Buspar 5mg, 10mg Buspirone Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Buspar et comment est-il utilisé ?
Buspar 5 mg est un médicament délivré sur ordonnance utilisé pour traiter les symptômes des troubles anxieux. Buspar 5 mg peut être utilisé seul ou avec d'autres médicaments.
Buspar appartient à une classe de médicaments appelés agents anxiolytiques, anxiolytiques, nonbenzodiazépines.
Quels sont les effets secondaires possibles de Buspar ?
Quels sont les effets secondaires possibles de Buspar 5mg ?
Buspar peut provoquer des effets secondaires graves, notamment :
- douleur thoracique,
- essoufflement, et
- étourdissement
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Buspar comprennent :
- mal de tête,
- vertiges,
- somnolence,
- problème de sommeil (insomnie),
- nausée,
- maux d'estomac, et
- se sentir nerveux ou excité
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Buspar. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
LA DESCRIPTION
Les comprimés d'hydrochlorure de Buspirone, USP sont un agent anti-anxiété qui n'est pas lié chimiquement ou pharmacologiquement aux benzodiazépines, aux barbituriques ou à d'autres médicaments sédatifs/anxiolytiques.
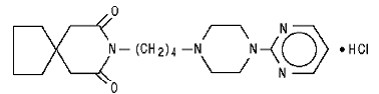
Le chlorhydrate de buspirone, USP est une poudre cristalline blanche. Il est très soluble dans l'eau ; librement soluble dans le méthanol et dans le chlorure de méthylène; peu soluble dans l'éthanol et dans l'acétonitrile; très légèrement soluble dans l'acétate d'éthyle et pratiquement insoluble dans les hexanes. Son poids moléculaire est de 422. Chimiquement, le chlorhydrate de buspirone est le monochlorhydrate de 8-[4-[4-(2-pyrimidinyl)-1-pipérazinyl]butyl]-8-azaspiro[4.5]décane-7,9-dione. La formule moléculaire C21H31N5O2•HCl est représentée par la formule structurale suivante :
Chaque comprimé d'hydrochlorure de buspirone destiné à l'administration orale contient 5 mg ou 10 mg ou 15 mg ou 30 mg d'hydrochlorure de buspirone (équivalent à 4,6 mg, 9,1 mg, 13,7 mg et 27,4 mg de base libre de buspirone, respectivement). De plus, chaque comprimé contient les ingrédients inactifs suivants : dioxyde de silice colloïdale, lactose monohydraté, stéarate de magnésium, cellulose microcristalline et glycolate d'amidon sodique. Les comprimés de 5 mg et 10 mg sont sécables pour pouvoir être coupés en deux. Ainsi, le comprimé de 5 mg peut également fournir une dose de 2,5 mg et le comprimé de 10 mg peut fournir une dose de 5 mg. Les comprimés de 15 mg et 30 mg sont sécables de façon à pouvoir être coupés en deux ou en trois. Ainsi, un seul comprimé de 15 mg peut apporter les doses suivantes : 15 mg (comprimé entier), 10 mg (deux tiers de comprimé), 7,5 mg (un demi-comprimé) ou 5 mg (un tiers de comprimé) . Un seul comprimé de 30 mg peut fournir les doses suivantes : 30 mg (comprimé entier), 20 mg (les deux tiers d'un comprimé), 15 mg (la moitié d'un comprimé) ou 10 mg (un tiers d'un comprimé).
LES INDICATIONS
Les comprimés de chlorhydrate de buspirone sont indiqués pour la gestion des troubles anxieux ou le soulagement à court terme des symptômes d'anxiété. L'anxiété ou la tension associée au stress de la vie quotidienne ne nécessite généralement pas de traitement avec un anxiolytique.
L'efficacité des comprimés d'hydrochlorure de buspirone a été démontrée dans des essais cliniques contrôlés de patients ambulatoires dont le diagnostic correspond à peu près au trouble d'anxiété généralisée (GAD). Beaucoup de patients inscrits à ces études avaient également des symptômes dépressifs coexistants et les comprimés d'hydrochlorure de buspirone ont soulagé l'anxiété en présence de ces symptômes dépressifs coexistants. Les patients évalués dans ces études avaient présenté des symptômes pendant des périodes de 1 mois à plus de 1 an avant l'étude, avec une durée moyenne des symptômes de 6 mois. Le trouble d'anxiété généralisée (300.02) est décrit dans le Manuel diagnostique et statistique de l'American Psychiatric Association, III1 comme suit :
Anxiété généralisée et persistante (d'une durée continue d'au moins 1 mois), se manifestant par des symptômes appartenant à trois des quatre catégories suivantes :
Tension du moteur
Tremblement, nervosité, nervosité, tremblement, tension, douleurs musculaires, fatigabilité, incapacité à se détendre, contraction des paupières, sourcils froncés, visage tendu, agitation, agitation, sursaut facile.
Hyperactivité autonome
Transpiration, battement ou accélération du cœur, mains froides et moites, bouche sèche, étourdissements, étourdissements, paresthésies (picotements dans les mains ou les pieds), maux d'estomac, périodes de chaleur ou de froid, mictions fréquentes, diarrhée, inconfort au creux de l'estomac, grosseur dans la gorge, bouffées vasomotrices, pâleur, pouls au repos et fréquence respiratoire élevés.
Attente appréhensive
Anxiété, inquiétude, peur, rumination et anticipation d'un malheur pour soi ou pour les autres.
Vigilance et balayage
Hyperattention entraînant distractibilité, difficulté à se concentrer, insomnie, sensation "sur les nerfs", irritabilité, impatience.
Les symptômes ci-dessus ne seraient pas dus à un autre trouble mental, comme un trouble dépressif ou la schizophrénie. Cependant, des symptômes dépressifs légers sont courants dans le TAG.
L'efficacité de comprimés d'hydrochlorure buspirone dans l'utilisation à long terme, c'est-à-dire depuis plus de 3 à 4 semaines, n'a pas été démontrée dans les procès contrôlés. Il n'existe aucun ensemble de preuves disponibles traitant systématiquement de la durée appropriée du traitement du TAG. Cependant, dans une étude d'utilisation à long terme, 264 patients ont été traités avec des comprimés d'hydrochlorure buspirone depuis 1 an sans mauvais effet. Par conséquent, le médecin qui choisit d'utiliser des comprimés d'hydrochlorure buspirone pendant les périodes prolongées devrait réévaluer périodiquement l'utilité du médicament pour le patient individuel.
DOSAGE ET ADMINISTRATION
La dose initiale recommandée est de 15 mg par jour (7,5 mg bid). Pour obtenir une réponse thérapeutique optimale, à des intervalles de 2 à 3 jours, la posologie peut être augmentée de 5 mg par jour, selon les besoins. La dose quotidienne maximale ne doit pas dépasser 60 mg par jour. Dans les essais cliniques permettant une titration de la dose, des doses fractionnées de 20 mg à 30 mg par jour étaient couramment utilisées.
La biodisponibilité de la buspirone est augmentée lorsqu'elle est administrée avec de la nourriture par rapport à l'état à jeun (voir PHARMACOLOGIE CLINIQUE ). Par conséquent, les patients doivent prendre la buspirone de manière cohérente en ce qui concerne le moment de l'administration ; toujours avec ou toujours sans nourriture.
Lorsque la buspirone doit être administrée avec un inhibiteur puissant du CYP3A4, les recommandations posologiques décrites dans le INTERACTIONS MÉDICAMENTEUSES section doit être suivie.
COMMENT FOURNIE
Les comprimés de chlorhydrate de buspirone USP, 5 mg sont des comprimés blancs à blanc cassé, en forme de capsule, à face plate, à bords biseautés gravés avec bisect sur un côté; un côté de la bissectrice est en creux avec 'ZE' et un autre est en creux avec '36' et l'autre côté est uni
Détails du fabricant : N/A. Révisé : Mai 2016
EFFETS SECONDAIRES
Aucune information fournie.
INTERACTIONS MÉDICAMENTEUSES
Agents psychotropes
Inhibiteurs MAO
Il est recommandé de ne pas utiliser les comprimés de chlorhydrate de buspirone en concomitance avec des inhibiteurs de la MAO (voir AVERTISSEMENTS ).
Amitriptyline
Après l'ajout de buspirone au schéma posologique de l'amitriptyline, aucune différence statistiquement significative dans les paramètres pharmacocinétiques à l'état d'équilibre (Cmax, ASC et Cmin) de l'amitriptyline ou de son métabolite nortriptyline n'a été observée.
Diazépam
Après l'ajout de buspirone au schéma posologique du diazépam, aucune différence statistiquement significative dans les paramètres pharmacocinétiques à l'état d'équilibre (Cmax, ASC et Cmin) n'a été observée pour le diazépam, mais des augmentations d'environ 15 % ont été observées pour le nordiazépam, et des effets cliniques indésirables mineurs (étourdissements, maux de tête et nausées) ont été observés.
Halopéridol
Dans une étude chez des volontaires sains, l'administration concomitante de buspirone et d'halopéridol a entraîné une augmentation des concentrations sériques d'halopéridol. La signification clinique de cette découverte n'est pas claire.
Néfazodone
[voir Inhibiteurs et inducteurs du cytochrome P450 3A4 (CYP3A4) ].
Trazodone
Un rapport suggère que l'utilisation concomitante de Desyrel®# (chlorhydrate de trazodone) et de buspirone peut avoir causé des élévations de 3 à 6 fois du SGPT (ALT) chez quelques patients. Dans une étude similaire tentant de reproduire cette découverte, aucun effet interactif sur les transaminases hépatiques n'a été identifié.
Triazolam/Flurazépam
L'administration concomitante de buspirone avec du triazolam ou du flurazépam n'a pas semblé prolonger ou intensifier les effets sédatifs de l'une ou l'autre des benzodiazépines.
Autres psychotropes
Étant donné que les effets de l'administration concomitante de buspirone avec la plupart des autres médicaments psychotropes n'ont pas été étudiés, l'utilisation concomitante de buspirone avec d'autres médicaments actifs sur le SNC doit être abordée avec prudence.
Inhibiteurs Et Inducteurs Du Cytochrome P450 3A4 (CYP3A4)
Il a été démontré in vitro que la buspirone est métabolisée par le CYP3A4. Cette découverte est cohérente avec les interactions in vivo observées entre la buspirone et les éléments suivants :
Diltiazem et vérapamil
Dans une étude portant sur neuf volontaires sains, la co-administration de buspirone (10 mg en dose unique) avec du vérapamil (80 mg tid) ou du diltiazem (60 mg tid) a augmenté les concentrations plasmatiques de buspirone (le vérapamil a augmenté l'ASC et la Cmax de la buspirone de 3,4 fois alors que le diltiazem augmentation de l'ASC et de la Cmax de 5,5 fois et de 4 fois, respectivement.) Les événements indésirables attribuables à la buspirone peuvent être plus probables lors de l'administration concomitante de diltiazem ou de vérapamil. Un ajustement ultérieur de la dose peut être nécessaire et doit être basé sur une évaluation clinique.
Érythromycine
Dans une étude chez des volontaires sains, la co-administration de buspirone (10 mg en dose unique) avec de l'érythromycine (1,5 g/jour pendant 4 jours) a augmenté les concentrations plasmatiques de buspirone (5 fois la Cmax et 6 fois l'ASC). Ces interactions pharmacocinétiques se sont accompagnées d'une incidence accrue d'effets secondaires attribuables à la buspirone. Si les deux médicaments doivent être utilisés en association, une faible dose de buspirone (par exemple, 2,5 mg bid) est recommandée. L'adaptation ultérieure de la dose de l'un ou l'autre des médicaments doit être basée sur une évaluation clinique.
Jus de pamplemousse
Dans une étude menée chez des volontaires sains, l'administration concomitante de buspirone (10 mg en dose unique) avec du jus de pamplemousse (200 mL deux fois par jour pendant 2 jours) a augmenté les concentrations plasmatiques de buspirone (augmentation de 4,3 fois de la Cmax ; augmentation de 9,2 fois de l'ASC ). Les patients recevant de la buspirone doivent être avertis d'éviter de boire de telles quantités de jus de pamplemousse.
Itraconazole
Dans une étude chez des volontaires sains, la co-administration de buspirone (10 mg en dose unique) avec l'itraconazole (200 mg/jour pendant 4 jours) a augmenté les concentrations plasmatiques de buspirone (augmentation de 13 fois de la Cmax et de 19 fois de l'ASC). Ces interactions pharmacocinétiques se sont accompagnées d'une incidence accrue d'effets secondaires attribuables à la buspirone. Si les deux médicaments doivent être utilisés en association, une faible dose de buspirone (par exemple, 2,5 mg qd) est recommandée. L'adaptation ultérieure de la dose de l'un ou l'autre des médicaments doit être basée sur une évaluation clinique.
Néfazodone
Dans une étude de pharmacocinétique à l'état d'équilibre chez des volontaires sains, la co-administration de buspirone (2,5 ou 5 mg bid) avec de la néfazodone (250 mg bid) a entraîné des augmentations marquées des concentrations plasmatiques de buspirone (augmentations jusqu'à 20 fois de la Cmax et jusqu'à 50 - fois l'ASC) et des diminutions statistiquement significatives (environ 50 %) des concentrations plasmatiques du métabolite de la buspirone 1-PP. Avec des doses bid de 5 mg de buspirone, de légères augmentations de l'ASC ont été observées pour la néfazodone (23 %) et ses métabolites, l'hydroxynéfazodone (HO-NEF) (17 %) et la méta-chlorophénylpipérazine (9 %). De légères augmentations de la Cmax ont été observées pour la néfazodone (8 %) et son métabolite HO-NEF (11 %).
Les sujets recevant de la buspirone 5 mg bid et de la néfazodone 250 mg bid ont présenté des étourdissements, de l'asthénie, des étourdissements et de la somnolence, des événements indésirables également observés avec l'un ou l'autre médicament seul. Si les deux médicaments doivent être utilisés en association, une faible dose de buspirone (par exemple, 2,5 mg qd) est recommandée. L'adaptation ultérieure de la dose de l'un ou l'autre des médicaments doit être basée sur une évaluation clinique.
Rifampine
Dans une étude chez des volontaires sains, la co-administration de buspirone (30 mg en dose unique) avec la rifampicine (600 mg/jour pendant 5 jours) a diminué les concentrations plasmatiques (diminution de 83,7 % de la Cmax ; diminution de 89,6 % de l'ASC) et les effets pharmacodynamiques de buspirone. Si les deux médicaments doivent être utilisés en association, la posologie de la buspirone peut nécessiter un ajustement pour maintenir l'effet anxiolytique.
Autres inhibiteurs et inducteurs du CYP3A4
Les substances qui inhibent le CYP3A4, telles que le kétoconazole ou le ritonavir, peuvent inhiber le métabolisme de la buspirone et augmenter les concentrations plasmatiques de la buspirone, tandis que les substances qui induisent le CYP3A4, telles que la dexaméthasone ou certains anticonvulsivants (phénytoïne, phénobarbital, carbamazépine), peuvent augmenter le taux de métabolisme de la buspirone. Si un patient a été titré à une dose stable de buspirone, un ajustement de la dose de buspirone peut être nécessaire pour éviter des événements indésirables attribuables à la buspirone ou à une diminution de l'activité anxiolytique. Par conséquent, lorsqu'il est administré avec un inhibiteur puissant du CYP3A4, une faible dose de buspirone utilisée avec prudence est recommandée. Lorsqu'il est utilisé en association avec un puissant inducteur du CYP3A4, la posologie de la buspirone peut nécessiter un ajustement pour maintenir l'effet anxiolytique.
Autres drogues
Cimétidine
L'administration concomitante de buspirone et de cimétidine a augmenté la Cmax (40 %) et le Tmax (2 fois), mais a eu des effets minimes sur l'ASC de la buspirone.
Liaison protéique
In vitro, la buspirone ne déplace pas les médicaments étroitement liés comme la phénytoïne, le propranolol et la warfarine des protéines sériques. Cependant, il y a eu un rapport de temps de prothrombine prolongé lorsque la buspirone a été ajoutée au régime d'un patient traité par la warfarine. Le patient recevait également de façon chronique de la phénytoïne, du phénobarbital, de la digoxine et du Synthroid®*. In vitro, la buspirone peut déplacer des médicaments moins fermement liés comme la digoxine. La signification clinique de cette propriété est inconnue.
Les doses thérapeutiques d'aspirine, de désipramine, de diazépam, de flurazépam, d'ibuprofène, de propranolol, de thioridazine et de tolbutamide n'ont eu qu'un effet limité sur le degré de liaison de la buspirone aux protéines plasmatiques (voir PHARMACOLOGIE CLINIQUE ).
Interactions médicament/test de laboratoire
Le chlorhydrate de buspirone peut interférer avec le dosage urinaire de métanéphrine/catécholamine. Il a été interprété par erreur comme de la métanéphrine lors des tests de routine pour le phéochromocytome, ce qui a entraîné un résultat de laboratoire faussement positif. L'hydrochlorure de Buspirone devrait donc être arrêté depuis au moins 48 heures avant de subir une collection d'urine pour les catecholamines.
Toxicomanie et dépendance
Classe de substances contrôlées
Le chlorhydrate de buspirone n'est pas une substance contrôlée.
Dépendance physique et psychologique
Dans les études humaines et animales, la buspirone n'a montré aucun potentiel d'abus ou de détournement et il n'y a aucune preuve qu'elle provoque une tolérance ou une dépendance physique ou psychologique. Des volontaires humains ayant des antécédents de consommation de drogues récréatives ou d'alcool ont été étudiés dans deux enquêtes cliniques en double aveugle. Aucun des sujets n'était capable de distinguer entre les comprimés d'hydrochlorure buspirone et le placebo. En revanche, les sujets ont montré une préférence statistiquement significative pour la méthaqualone et le diazépam. Des études sur des singes, des souris et des rats ont indiqué que la buspirone n'a pas de potentiel d'abus. Après administration chronique chez le rat, l'arrêt brutal de la buspirone n'a pas entraîné la perte de poids corporel couramment observée avec les substances entraînant une dépendance physique.
Bien qu'il n'y ait aucune preuve directe que les comprimés d'hydrochlorure de buspirone provoquent une dépendance physique ou un comportement de recherche de drogue, il est difficile de prédire à partir d'expériences dans quelle mesure un médicament actif sur le SNC sera mal utilisé, détourné et/ou abusé une fois commercialisé. Par conséquent, les médecins devraient soigneusement évaluer des patients pour une histoire d'abus de drogue et suivre de tels patients de près, en les observant pour les signes d'abus ou d'abus de comprimés d'hydrochlorure buspirone (par ex, le développement de tolérance, l'incrémentation de dose, le comportement de recherche de drogue).
Classe de substances contrôlées
Le chlorhydrate de buspirone n'est pas une substance contrôlée.
Dépendance physique et psychologique
Dans les études humaines et animales, la buspirone n'a montré aucun potentiel d'abus ou de détournement et il n'y a aucune preuve qu'elle provoque une tolérance ou une dépendance physique ou psychologique. Des volontaires humains ayant des antécédents de consommation de drogues récréatives ou d'alcool ont été étudiés dans deux enquêtes cliniques en double aveugle. Aucun des sujets n'était capable de distinguer entre les comprimés d'hydrochlorure buspirone et le placebo. En revanche, les sujets ont montré une préférence statistiquement significative pour la méthaqualone et le diazépam. Des études sur des singes, des souris et des rats ont indiqué que la buspirone n'a pas de potentiel d'abus. Après administration chronique chez le rat, l'arrêt brutal de la buspirone n'a pas entraîné la perte de poids corporel couramment observée avec les substances entraînant une dépendance physique.
Bien qu'il n'y ait aucune preuve directe que les comprimés d'hydrochlorure de buspirone provoquent une dépendance physique ou un comportement de recherche de drogue, il est difficile de prédire à partir d'expériences dans quelle mesure un médicament actif sur le SNC sera mal utilisé, détourné et/ou abusé une fois commercialisé. Par conséquent, les médecins devraient soigneusement évaluer des patients pour une histoire d'abus de drogue et suivre de tels patients de près, en les observant pour les signes d'abus ou d'abus de comprimés d'hydrochlorure buspirone (par ex, le développement de tolérance, l'incrémentation de dose, le comportement de recherche de drogue).
AVERTISSEMENTS
L'administration de comprimés d'hydrochlorure de buspirone à un patient prenant un inhibiteur de la monoamine oxydase (IMAO) peut présenter un danger. Il y a eu des rapports de l'occurrence de tension artérielle élevée quand les comprimés d'hydrochlorure buspirone ont été ajoutés à un régime en incluant un MAOI. Par conséquent, on recommande que les comprimés d'hydrochlorure buspirone ne soient pas utilisés concomitantly avec un MAOI.
Étant donné que les comprimés d'hydrochlorure de buspirone n'ont aucune activité antipsychotique établie, ils ne doivent pas être utilisés à la place d'un traitement antipsychotique approprié.
PRÉCAUTIONS
Général
Interférence avec les performances cognitives et motrices
Les études indiquent que les comprimés d'hydrochlorure de buspirone sont moins sédatifs que d'autres anxiolytiques et qu'ils ne produisent pas d'altération fonctionnelle significative. Cependant, ses effets sur le SNC chez un patient individuel peuvent ne pas être prévisibles. Par conséquent, les patients doivent être avertis de la conduite d'une automobile ou de l'utilisation de machines complexes jusqu'à ce qu'ils soient raisonnablement certains que le traitement par la buspirone ne les affecte pas négativement.
Tandis que les études formelles de l'action réciproque d'hydrochlorure buspirone avec l'alcool indiquent que buspirone n'augmente pas l'affaiblissement induit par l'alcool dans le moteur et la performance mentale, il est prudent d'éviter l'utilisation d'élément d'alcool et de buspirone.
Potentiel de réactions de sevrage chez les patients sédatifs/hypnotiques/anxiolytiques toxicomanes
Étant donné que les comprimés d'hydrochlorure de buspirone ne présentent pas de tolérance croisée avec les benzodiazépines et d'autres médicaments sédatifs/hypnotiques courants, ils ne bloqueront pas le syndrome de sevrage souvent observé lors de l'arrêt du traitement avec ces médicaments. Par conséquent, avant de commencer la thérapie avec les comprimés d'hydrochlorure buspirone, il est conseillé de retirer progressivement les patients, en particulier les patients qui ont utilisé un médicament dépresseur du SNC de façon chronique, de leur traitement antérieur. Les symptômes de rebond ou de sevrage peuvent survenir sur des périodes variables, en fonction en partie du type de médicament et de sa demi-vie d'élimination effective.
Le syndrome de sevrage des sédatifs/hypnotiques/anxiolytiques peut apparaître sous la forme de n'importe quelle combinaison d'irritabilité, d'anxiété, d'agitation, d'insomnie, de tremblements, de crampes abdominales, de crampes musculaires, de vomissements, de transpiration, de symptômes pseudo-grippaux sans fièvre et parfois même de convulsions. .
Préoccupations possibles liées à la liaison de la buspirone aux récepteurs de la dopamine
Étant donné que la buspirone peut se lier aux récepteurs centraux de la dopamine, une question a été soulevée quant à son potentiel de provoquer des modifications aiguës et chroniques de la fonction neurologique médiée par la dopamine (p. ex., dystonie, pseudoparkinsonisme, akathisie et dyskinésie tardive). L'expérience clinique dans les essais contrôlés n'a pas permis d'identifier une activité significative de type neuroleptique ; cependant, un syndrome d'agitation, apparaissant peu de temps après le début du traitement, a été rapporté chez une petite fraction de patients traités par la buspirone. Le syndrome peut s'expliquer de plusieurs manières. Par exemple, la buspirone peut augmenter l'activité noradrénergique centrale ; alternativement, l'effet peut être attribuable à des effets dopaminergiques (c'est-à-dire représenter une akathisie). Voir EFFETS INDÉSIRABLES : Expérience post-commercialisation .
Informations pour les patients
Pour assurer l'utilisation sûre et efficace de comprimés d'hydrochlorure buspirone, les renseignements suivants et les instructions devraient être donnés aux patients :
Informez votre médecin de n'importe quels médicaments, prescription ou non-prescription, alcool, ou drogues que vous prenez maintenant ou projetez de prendre pendant votre traitement avec les comprimés d'hydrochlorure buspirone.
Informez votre médecin si vous êtes enceinte, ou si vous projetez de devenir enceinte, ou si vous devenez enceinte pendant que vous prenez des comprimés d'hydrochlorure buspirone.
Informez votre médecin si vous allaitez un enfant.
Jusqu'à ce que vous sachiez comment ce médicament vous affecte, ne conduisez pas de voiture et n'utilisez pas de machines potentiellement dangereuses.
Vous devez prendre le chlorhydrate de buspirone régulièrement, toujours avec ou toujours sans nourriture.
Pendant votre traitement par les comprimés de chlorhydrate de buspirone, évitez de boire de grandes quantités de jus de pamplemousse.
Tests de laboratoire
Aucun test de laboratoire spécifique n'est recommandé.
Carcinogenèse, mutagenèse, altération de la fertilité
Aucune preuve de potentiel carcinogène n'a été observée chez les rats au cours d'une étude de 24 mois à environ 133 fois la dose orale maximale recommandée chez l'homme; ou chez la souris, au cours d'une étude de 18 mois à environ 167 fois la dose orale humaine maximale recommandée.
Avec ou sans activation métabolique, la buspirone n'a pas induit de mutations ponctuelles dans cinq souches de Salmonella typhimurium (test d'Ames) ou des cultures de cellules de lymphome de souris L5178YTK+, et aucun dommage à l'ADN n'a été observé avec la buspirone dans les cellules humaines Wi-38. Les aberrations ou anomalies chromosomiques ne se sont pas produites dans les cellules de la moelle osseuse des souris ayant reçu une ou cinq doses quotidiennes de buspirone.
Grossesse
Effets tératogènes
Catégorie de grossesse B
Aucune altération de la fertilité ou lésion fœtale n'a été observée dans les études de reproduction réalisées chez le rat et le lapin à des doses de buspirone d'environ 30 fois la dose maximale recommandée chez l'homme. Chez l'homme, cependant, des études adéquates et bien contrôlées pendant la grossesse n'ont pas été réalisées. Étant donné que les études sur la reproduction chez l'animal ne sont pas toujours prédictives de la réponse humaine, ce médicament ne doit être utilisé pendant la grossesse qu'en cas de nécessité absolue.
Travail et accouchement
L'effet d'hydrochlorure buspirone sur le travail et la livraison dans les femmes est inconnu. Aucun effet indésirable n'a été noté dans les études de reproduction chez le rat.
Mères allaitantes
L'étendue de l'excrétion dans le lait maternel de la buspirone ou de ses métabolites n'est pas connue. Chez le rat, cependant, la buspirone et ses métabolites sont excrétés dans le lait. L'administration de comprimés d'hydrochlorure de Buspirone aux femmes infirmières devrait être évitée si cliniquement possible.
Utilisation pédiatrique
L'innocuité et l'efficacité de la buspirone ont été évaluées dans deux essais contrôlés par placebo de 6 semaines impliquant un total de 559 patients pédiatriques (allant de 6 à 17 ans) atteints de TAG. Les doses étudiées étaient de 7,5 mg à 30 mg bid (15 à 60 mg/jour). Il n'y avait pas de différences significatives entre la buspirone et le placebo en ce qui concerne les symptômes du TAG après les doses recommandées pour le traitement du TAG chez l'adulte. Des études pharmacocinétiques ont montré qu'à doses identiques, l'exposition plasmatique à la buspirone et à son métabolite actif, le 1-PP, est égale ou supérieure chez les patients pédiatriques à celle des adultes. Aucun résultat d'innocuité inattendu n'a été associé à la buspirone dans ces essais. Il n'y a pas de données de sécurité ou d'efficacité à long terme dans cette population.
Utilisation gériatrique
Dans une étude portant sur 6632 patients ayant reçu de la buspirone pour le traitement de l'anxiété, 605 patients avaient ≥ 65 ans et 41 avaient ≥ 75 ans ; les profils de sécurité et d'efficacité pour ces 605 patients âgés (âge moyen = 70,8 ans) étaient similaires à ceux de la population plus jeune (âge moyen = 43,3 ans). L'examen des événements cliniques indésirables rapportés spontanément n'a pas identifié de différences entre les patients âgés et les patients plus jeunes, mais une plus grande sensibilité de certains patients plus âgés ne peut être exclue.
L'âge n'a pas eu d'effet sur la pharmacocinétique de la buspirone (voir PHARMACOLOGIE CLINIQUE , Populations particulières ).
Utilisation chez les patients présentant une fonction hépatique ou rénale altérée
La buspirone est métabolisée par le foie et excrétée par les reins. Une étude pharmacocinétique chez des patients présentant une insuffisance hépatique ou rénale a démontré une augmentation des taux plasmatiques et une demi-vie allongée de la buspirone. Par conséquent, l'administration de comprimés de chlorhydrate de buspirone aux patients présentant une insuffisance hépatique ou rénale sévère ne peut être recommandée (voir PHARMACOLOGIE CLINIQUE ).
SURDOSAGE
Aucune information fournie.
CONTRE-INDICATIONS
Les comprimés de chlorhydrate de buspirone sont contre-indiqués chez les patients hypersensibles au chlorhydrate de buspirone.
PHARMACOLOGIE CLINIQUE
Le mécanisme d'action de la buspirone est inconnu. La buspirone diffère des anxiolytiques typiques des benzodiazépines en ce qu'elle n'exerce pas d'effets anticonvulsivants ou relaxants musculaires. Il manque également l'effet sédatif important qui est associé à des anxiolytiques plus typiques. Des études précliniques in vitro ont montré que la buspirone a une forte affinité pour les récepteurs de la sérotonine (5-HT1A). La buspirone n'a pas d'affinité significative pour les récepteurs des benzodiazépines et n'affecte pas la liaison du GABA in vitro ou in vivo lorsqu'elle est testée dans des modèles précliniques.
La buspirone a une affinité modérée pour les récepteurs cérébraux D2-dopamine. Certaines études suggèrent que la buspirone peut avoir des effets indirects sur d'autres systèmes de neurotransmetteurs.
Le chlorhydrate de buspirone est rapidement absorbé chez l'homme et subit un important métabolisme de premier passage. Dans une étude radiomarquée, la buspirone inchangée dans le plasma ne représentait qu'environ 1 % de la radioactivité dans le plasma. Après administration orale, les concentrations plasmatiques de buspirone inchangée sont très faibles et variables d'un sujet à l'autre. Des concentrations plasmatiques maximales de 1 ng/mL à 6 ng/mL ont été observées 40 à 90 minutes après des doses orales uniques de 20 mg. La biodisponibilité d'une dose unique de buspirone inchangée lorsqu'elle est prise sous forme de comprimé est en moyenne d'environ 90 % d'une dose équivalente de solution, mais il existe une grande variabilité.
Les effets de nourriture sur le bioavailability de comprimés d'hydrochlorure buspirone ont été étudiés dans huit sujets. Ils ont reçu une dose de 20 mg avec et sans nourriture ; l'aire sous la courbe de la concentration plasmatique en fonction du temps (ASC) et la concentration plasmatique maximale (Cmax) de la buspirone inchangée ont augmenté respectivement de 84 % et de 116 %, mais la quantité totale de matériel immunoréactif de la buspirone n'a pas changé. Cela suggère que la nourriture peut diminuer l'étendue de la clairance présystémique de la buspirone (voir DOSAGE ET ADMINISTRATION ).
Une étude à doses multiples menée chez 15 sujets suggère que la buspirone a une pharmacocinétique non linéaire. Ainsi, les augmentations de dose et les doses répétées peuvent entraîner des taux sanguins légèrement plus élevés de buspirone inchangée que ce qui serait prédit à partir des résultats d'études à dose unique.
Une étude de liaison aux protéines in vitro a indiqué qu'environ 86 % de la buspirone est liée aux protéines plasmatiques. Il a également été observé que l'aspirine augmentait les taux plasmatiques de buspirone libre de 23 %, tandis que le flurazépam diminuait les taux plasmatiques de buspirone libre de 20 %. Cependant, on ne sait pas si ces médicaments provoquent des effets similaires sur les taux plasmatiques de buspirone libre in vivo, ou si de tels changements, s'ils se produisent, entraînent des différences cliniquement significatives dans les résultats du traitement. Une étude in vitro a indiqué que la buspirone n'a pas déplacé les médicaments fortement liés aux protéines tels que la phénytoïne, la warfarine et le propranolol des protéines plasmatiques, et que la buspirone peut déplacer la digoxine.
La buspirone est principalement métabolisée par oxydation, dont il a été démontré in vitro qu'elle est médiée par le cytochrome P450 3A4 (CYP3A4) (voir INTERACTIONS MÉDICAMENTEUSES ). Plusieurs dérivés hydroxylés et un métabolite pharmacologiquement actif, la 1-pyrimidinylpipérazine (1-PP), sont produits. Dans les modèles animaux prédictifs du potentiel anxiolytique, le 1-PP a environ un quart de l'activité de la buspirone, mais est présent en quantités jusqu'à 20 fois plus élevées. Cependant, cela n'est probablement pas important chez l'homme : les échantillons sanguins d'humains exposés de manière chronique au chlorhydrate de buspirone ne présentent pas de taux élevés de 1-PP ; les valeurs moyennes sont d'environ 3 ng/mL et le taux sanguin humain le plus élevé enregistré parmi 108 patients recevant une dose chronique était de 17 ng/mL, soit moins de 1/200e des taux de 1-PP trouvés chez les animaux ayant reçu de fortes doses de buspirone sans signes de toxicité.
Dans une étude à dose unique utilisant de la buspirone marquée au 14C, 29 % à 63 % de la dose ont été excrétés dans l'urine dans les 24 heures, principalement sous forme de métabolites ; l'excrétion fécale représentait 18 % à 38 % de la dose. La demi-vie d'élimination moyenne de la buspirone inchangée après des doses uniques de 10 mg à 40 mg est d'environ 2 à 3 heures.
Populations particulières
Effets de l'âge et du sexe
Après des doses uniques ou multiples chez l'adulte, aucune différence significative de la pharmacocinétique de la buspirone (ASC et Cmax) n'a été observée entre les sujets âgés et les sujets plus jeunes ou entre les hommes et les femmes.
Insuffisance hépatique
Après administration de doses multiples de buspirone à des patients insuffisants hépatiques, l'ASC à l'état d'équilibre de la buspirone a été multipliée par 13 par rapport aux sujets sains (voir PRÉCAUTIONS ).
Insuffisance rénale
Après l'administration de doses multiples de buspirone à des patients insuffisants rénaux (Clcr = 10 à 70 mL/min/1,73 m2), l'ASC à l'état d'équilibre de la buspirone a été multipliée par 4 par rapport aux sujets sains (Clcr ≥ 80 mL/min/1,73 m2) (voir PRÉCAUTIONS ).
Effets de course
Les effets de course sur le pharmacokinetics de buspirone n'ont pas été étudiés.
INFORMATIONS PATIENTS
Chlorhydrate de buspirone Comprimés, USP Pour les comprimés de 15 mg et 30 mg
COMMENT UTILISER
La réponse à la buspirone varie selon les individus. Votre médecin peut juger nécessaire d'ajuster votre posologie pour obtenir la réponse appropriée.
Chaque comprimé est sécable et peut être cassé avec précision.
Pour casser un comprimé avec précision et facilité, tenez le comprimé entre vos pouces et vos index près de la rainure appropriée du comprimé. Ensuite, avec le score de la tablette face à vous, appliquez une pression et séparez les segments de la tablette (les segments qui se cassent de manière incorrecte ne doivent pas être utilisés).
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
