Spiriva 9mcg Tiotropium Bromide Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Spiriva 9mcg HandiHaler et comment est-il utilisé ?
La poudre pour inhalation Spiriva HandiHaler (bromure de tiotropium) est un médicament anticholinergique utilisé pour prévenir le bronchospasme (rétrécissement des voies respiratoires dans les poumons) chez les personnes atteintes de bronchite, d'emphysème ou de MPOC (maladie pulmonaire obstructive chronique).
Quels sont les effets secondaires de Spiriva 9mcg HandiHaler ?
Les effets secondaires courants de Spiriva 9mcg HandiHaler incluent :
- bouche sèche,
- constipation,
- maux d'estomac,
- vomissement,
- symptômes du rhume (nez bouché, éternuements, mal de gorge),
- saignement de nez, ou
- douleur musculaire.
Informez votre médecin si vous avez des effets secondaires graves de Spiriva 9mcg HandiHaler, notamment :
- miction difficile ou douloureuse, ou
- rythme cardiaque rapide.
LA DESCRIPTION
SPIRIVA 9mcg HANDIHALER se compose de capsules SPIRIVA et d'un dispositif HANDIHALER. Chaque capsule de gélatine dure vert clair SPIRIVA 9 mcg contient une poudre sèche composée de 18 mcg de tiotropium (équivalent à 22,5 mcg de bromure de tiotropium monohydraté) mélangé avec du lactose monohydraté (qui peut contenir des protéines de lait).
Le contenu des gélules SPIRIVA est destiné à l'inhalation orale uniquement et est destiné à être administré uniquement avec le dispositif HANDIHALER.
Le composant actif de SPIRIVA HANDIHALER est le tiotropium. La substance médicamenteuse, le bromure de tiotropium monohydraté, est un anticholinergique avec une spécificité pour les récepteurs muscariniques. Il est chimiquement décrit comme (1α, 2β, 4β, 5α, 7β)-7-[(Hydroxydi-2-thiénylacétyl)oxy]-9,9-diméthyl-3-oxa-9-azoniatricyclo[3.3.1.02,4] bromure de nonane monohydraté. C'est un composé d'ammonium quaternaire synthétique, non chiral. Le bromure de tiotropium est une poudre blanche ou blanc jaunâtre. Il est peu soluble dans l'eau et soluble dans le méthanol.
La formule structurale est :
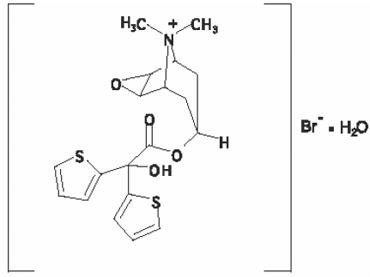
Le bromure de tiotropium (monohydraté) a une masse moléculaire de 490,4 et une formule moléculaire de C19H22NO4S2Br • H2O.
Le dispositif HANDIHALER est un dispositif d'inhalation permettant d'inhaler la poudre sèche contenue dans la gélule SPIRIVA 9mcg. La poudre sèche est délivrée par l'appareil HANDIHALER à des débits aussi bas que 20 L/min. Dans le cadre de tests in vitro standardisés, le dispositif HANDIHALER délivre une moyenne de 10,4 mcg de tiotropium lorsqu'il est testé à un débit de 39 L/min pendant 3,1 secondes (2 L au total). Dans une étude portant sur 26 patients adultes atteints de MPOC et dont la fonction pulmonaire est gravement altérée [VEMS moyen 1,02 L (intervalle de 0,45 à 2,24 L) ; 37,6 % de la valeur prédite (intervalle de 16 % à 65 %)], le débit inspiratoire de pointe (DIP) médian à travers le dispositif HANDIHALER était de 30,0 L/min (intervalle de 20,4 à 45,6 L/min). La quantité de médicament délivrée aux poumons variera en fonction des facteurs du patient tels que le débit inspiratoire et le débit inspiratoire de pointe à travers le dispositif HANDIHALER, qui peuvent varier d'un patient à l'autre et peuvent varier avec le temps d'exposition de la capsule SPIRIVA 9mcg à l'extérieur de la plaquette. paquet.
LES INDICATIONS
SPIRIVA HANDIHALER (poudre pour inhalation de bromure de tiotropium) est indiqué pour le traitement d'entretien à long terme, une fois par jour, du bronchospasme associé à la maladie pulmonaire obstructive chronique (MPOC), y compris la bronchite chronique et l'emphysème. SPIRIVA 9mcg HANDIHALER est indiqué pour réduire les exacerbations chez les patients atteints de MPOC.
DOSAGE ET ADMINISTRATION
Pour inhalation orale uniquement. Ne pas avaler les gélules de SPIRIVA 9mcg, car les effets escomptés sur les poumons ne seront pas obtenus. Le contenu des gélules SPIRIVA doit être utilisé uniquement avec l'appareil HANDIHALER [voir SURDOSAGE ].
La dose recommandée de SPIRIVA HANDIHALER est de deux inhalations du contenu en poudre d'une capsule SPIRIVA, une fois par jour, avec le dispositif HANDIHALER [voir INFORMATIONS PATIENTS ]. Ne prenez pas plus d'une dose en 24 heures.
Pour l'administration de SPIRIVA HANDIHALER, une capsule SPIRIVA de 9 mcg est placée dans la chambre centrale du dispositif HANDIHALER. La capsule SPIRIVA 9mcg est percée en appuyant et en relâchant le bouton de perçage vert sur le côté de l'appareil HANDIHALER. La formulation de tiotropium est dispersée dans le flux d'air lorsque le patient inhale par l'embout buccal [voir INFORMATIONS PATIENTS ].
Aucun ajustement posologique n'est nécessaire chez les patients gériatriques, insuffisants hépatiques ou insuffisants rénaux. Cependant, les patients présentant une insuffisance rénale modérée à sévère recevant SPIRIVA 9mcg HANDIHALER doivent être étroitement surveillés pour des effets anticholinergiques [voir AVERTISSEMENTS ET PRECAUTIONS , Utilisation dans des populations spécifiques , et PHARMACOLOGIE CLINIQUE ].
COMMENT FOURNIE
Formes posologiques et points forts
Poudre pour inhalation
SPIRIVA 9mcg HANDIHALER se compose de gélules SPIRIVA contenant de la poudre de tiotropium pour inhalation orale et d'un dispositif HANDIHALER. Les capsules SPIRIVA 9mcg contiennent 18 mcg de tiotropium dans une capsule de gélatine dure vert clair avec TI 01 imprimé sur un côté et le logo de la société Boehringer Ingelheim sur l'autre côté. L'appareil HANDIHALER est uniquement destiné à être utilisé avec les capsules SPIRIVA.
Stockage et manutention
SPIRIVA HANDIHALER se compose de capsules SPIRIVA 9mcg et du dispositif HANDIHALER. Les gélules SPIRIVA 9mcg contiennent 18 mcg de tiotropium et sont vert clair, avec le logo de la société Boehringer Ingelheim sur le capuchon de la gélule SPIRIVA et TI 01 sur le corps de la gélule SPIRIVA, ou vice versa.
L'appareil HANDIHALER est de couleur grise avec un bouton de perçage vert. Il est imprimé avec SPIRIVA HANDIHALER (poudre pour inhalation de bromure de tiotropium), le logo de la société Boehringer Ingelheim. Il est également imprimé pour indiquer que les capsules SPIRIVA ne doivent pas être conservées dans le dispositif HANDIHALER et que le dispositif HANDIHALER ne doit être utilisé qu'avec les capsules SPIRIVA 9mcg.
Les gélules de SPIRIVA 9mcg sont conditionnées dans une plaquette alvéolée en aluminium/aluminium et jointes le long d'une ligne de coupe perforée. Les gélules de SPIRIVA 9mcg doivent toujours être conservées dans la plaquette thermoformée et ne doivent être retirées qu'immédiatement avant utilisation. Le médicament doit être utilisé immédiatement après l'ouverture de l'emballage d'une capsule individuelle de SPIRIVA.
Les forfaits suivants sont disponibles :
- boîte contenant 5 gélules SPIRIVA 9mcg (1 plaquette thermoformée unitaire) et 1 dispositif d'inhalation HANDIHALER ( CDN 0597-0075-75) (dossier institutionnel)
- boîte contenant 30 gélules SPIRIVA 9mcg (3 plaquettes alvéolées unidoses) et 1 dispositif d'inhalation HANDIHALER ( CDN 0597-0075-41)
- boîte contenant 90 gélules SPIRIVA (9 plaquettes alvéolées unidoses) et 1 inhalateur HANDIHALER ( CDN 0597-0075-47)
Tenir hors de portée des enfants. Ne pas mettre de poudre dans les yeux.
Stockage
Conserver à 25 °C (77 °F); les excursions permises à 15° à 30°C (59° à 86°F) [voient USP la Température de Pièce Contrôlée].
Les gélules SPIRIVA ne doivent pas être exposées à des températures extrêmes ou à l'humidité. Ne pas conserver les gélules SPIRIVA 9mcg dans l'appareil HANDIHALER.
Distribué par : Boehringer Ingelheim Pharmaceuticals, Inc. Ridgefield, CT 06877 États-Unis. Révisé : février 2018
EFFETS SECONDAIRES
Les effets indésirables suivants sont décrits, ou décrits plus en détail, dans d'autres rubriques :
- Réactions d'hypersensibilité immédiates [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Bronchospasme paradoxal [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Aggravation du glaucome à angle fermé [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Aggravation de la rétention urinaire [voir AVERTISSEMENTS ET PRECAUTIONS ]
Expérience des essais cliniques
Étant donné que les essais cliniques sont menés dans des conditions très variables, l'incidence des effets indésirables observés dans les essais cliniques d'un médicament ne peut pas être directement comparée aux incidences dans les essais cliniques d'un autre médicament et peut ne pas refléter les incidences observées dans la pratique.
Essais de 6 mois à 1 an
Les données décrites ci-dessous reflètent l'exposition à SPIRIVA 9mcg HANDIHALER chez 2663 patients. SPIRIVA 9mcg HANDIHALER a été étudié dans le cadre de deux essais contrôlés par placebo d'une durée d'un an, deux essais contrôlés par comparateur actif d'une durée d'un an et deux essais contrôlés par placebo d'une durée de 6 mois chez des patients atteints de MPOC. Dans ces essais, 1308 patients ont été traités avec SPIRIVA HANDIHALER à la dose recommandée de 18 mcg une fois par jour. La population avait un âge allant de 39 à 87 ans avec 65 % à 85 % d'hommes, 95 % de race blanche, et avait une BPCO avec un volume expiratoire forcé moyen pré-bronchodilatateur en une seconde (VEMS) prévu de 39 % à 43 %. Les patients atteints de glaucome à angle fermé, d'hypertrophie prostatique symptomatique ou d'obstruction de l'évacuation de la vessie ont été exclus de ces essais. Un essai supplémentaire de 6 mois mené dans un établissement d'anciens combattants n'est pas inclus dans cette base de données sur l'innocuité, car seuls les événements indésirables graves ont été recueillis.
La sécheresse de la bouche était l'effet indésirable le plus fréquemment signalé. La sécheresse de la bouche était généralement légère et souvent résolue pendant la poursuite du traitement. D'autres réactions signalées chez des patients individuels et compatibles avec d'éventuels effets anticholinergiques comprenaient la constipation, la tachycardie, la vision floue, le glaucome (apparition ou aggravation), la dysurie et la rétention urinaire.
Quatre essais multicentriques, d'une durée d'un an, contrôlés contre placebo et contre comparateur actif ont évalué SPIRIVA HANDIHALER chez des patients atteints de MPOC. Le tableau 1 montre tous les effets indésirables survenus avec une fréquence ≥ 3 % dans le groupe SPIRIVA 9mcg HANDIHALER dans les essais contrôlés par placebo d'un an où les taux dans le groupe SPIRIVA HANDIHALER dépassaient le groupe placebo de ≥ 1 %. La fréquence des réactions correspondantes dans les essais contrôlés par l'ipratropium est incluse à titre de comparaison.
L'arthrite, la toux et les symptômes pseudo-grippaux sont survenus à un taux ≥ 3 % dans le groupe de traitement SPIRIVA 9mcg HANDIHALER, mais étaient
Les autres réactions survenues dans le groupe SPIRIVA HANDIHALER à une fréquence de 1 % à 3 % dans les essais contrôlés par placebo où les taux dépassaient ceux du groupe placebo comprennent :
Corps dans son ensemble : réaction allergique, douleur aux jambes;
Système nerveux central et périphérique : dysphonie, paresthésie;
Troubles du système gastro-intestinal : trouble gastro-intestinal non spécifié (NOS), reflux gastro-oesophagien, stomatite (y compris stomatite ulcéreuse) ;
Troubles métaboliques et nutritionnels : hypercholestérolémie, hyperglycémie;
Troubles du système musculo-squelettique : douleur squelettique;
Événements cardiaques : angine de poitrine (y compris angine de poitrine aggravée);
Trouble psychiatrique : la dépression; Infections : zona ;
Trouble du système respiratoire (supérieur) : laryngite;
Trouble de la vision : cataracte.
De plus, parmi les effets indésirables observés dans les essais cliniques avec une incidence
Dans les essais d'un an, l'incidence de la bouche sèche, de la constipation et des infections des voies urinaires augmentait avec l'âge [voir Utilisation dans des populations spécifiques ].
Deux études contrôlées multicentriques de 6 mois ont évalué SPIRIVA 9mcg HANDIHALER chez des patients atteints de BPCO. Les effets indésirables et les taux d'incidence étaient similaires à ceux observés dans les essais contrôlés d'un an.
Essai de 4 ans
Les données décrites ci-dessous reflètent l'exposition à SPIRIVA 9mcg HANDIHALER chez 5992 patients atteints de MPOC dans un essai contrôlé par placebo de 4 ans. Dans cet essai, 2986 patients ont été traités avec SPIRIVA 9mcg HANDIHALER à la dose recommandée de 18 mcg une fois par jour. La population était âgée de 40 à 88 ans, était composée à 75 % d'hommes, à 90 % de race blanche et souffrait de BPCO avec un pourcentage moyen de VEMS pré-bronchodilatateur prédit de 40 %. Les patients atteints de glaucome à angle fermé, d'hypertrophie prostatique symptomatique ou d'obstruction de l'évacuation de la vessie ont été exclus de ces essais. Lorsque les effets indésirables ont été analysés avec une fréquence ≥ 3 % dans le groupe SPIRIVA 9 mcg HANDIHALER où les taux dans le groupe SPIRIVA 9 mcg HANDIHALER dépassaient le placebo de ≥ 1 %, les effets indésirables inclus (SPIRIVA 9 mcg HANDIHALER, placebo) : pharyngite (12,5 % , 10,8 %), sinusite (6,5 %, 5,3 %), céphalées (5,7 %, 4,5 %), constipation (5,1 %, 3,7 %), bouche sèche (5,1 %, 2,7 %), dépression (4,4 %, 3,3 %) , insomnie (4,4 %, 3,0 %) et arthralgie (4,2 %, 3,1 %).
Effets indésirables supplémentaires
D'autres effets indésirables non répertoriés précédemment qui ont été signalés plus fréquemment chez les patients atteints de MPOC traités par SPIRIVA 9mcg HANDIHALER que le placebo comprennent : déshydratation, ulcère cutané, stomatite, gingivite, candidose oropharyngée, peau sèche, infection cutanée et gonflement des articulations.
Expérience post-commercialisation
Des effets indésirables ont été identifiés lors de l'utilisation post-approbation mondiale de SPIRIVA HANDIHALER. Étant donné que ces réactions sont signalées volontairement par une population de taille incertaine, il n'est pas toujours possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale avec l'exposition au médicament. Ces effets indésirables sont les suivants : irritation au site d'application (glossite, ulcération buccale et douleur pharyngolaryngée), étourdissements, dysphagie, enrouement, occlusion intestinale, y compris iléus paralytique, augmentation de la pression intraoculaire, candidose buccale, palpitations, prurit, tachycardie, irritation de la gorge et urticaire.
INTERACTIONS MÉDICAMENTEUSES
Sympathomimétiques, Méthylxanthines, Stéroïdes
SPIRIVA 9mcg HANDIHALER a été utilisé en concomitance avec des bronchodilatateurs sympathomimétiques (bêta-agonistes) à courte et à longue durée d'action, des méthylxanthines et des stéroïdes oraux et inhalés sans augmentation des effets indésirables.
Anticholinergiques
Il existe un potentiel d'interaction additive avec les médicaments anticholinergiques utilisés en concomitance. Par conséquent, évitez la co-administration de SPIRIVA 9mcg HANDIHALER avec d'autres médicaments contenant des anticholinergiques car cela peut entraîner une augmentation des effets indésirables anticholinergiques [voir AVERTISSEMENTS ET PRECAUTIONS et EFFETS INDÉSIRABLES ].
AVERTISSEMENTS
Inclus dans le cadre du "PRÉCAUTIONS" Section
PRÉCAUTIONS
Pas pour une utilisation aiguë
SPIRIVA 9mcg HANDIHALER est destiné au traitement d'entretien uniquotidien de la MPOC et ne doit pas être utilisé pour le soulagement des symptômes aigus, c'est-à-dire comme traitement de secours pour le traitement des épisodes aigus de bronchospasme.
Réactions d'hypersensibilité immédiates
Des réactions d'hypersensibilité immédiates, y compris de l'urticaire, un œdème de Quincke (y compris un gonflement des lèvres, de la langue ou de la gorge), une éruption cutanée, un bronchospasme, une anaphylaxie ou des démangeaisons, peuvent survenir après l'administration de SPIRIVA 9mcg HANDIHALER. Si une telle réaction se produit, le traitement par SPIRIVA 9mcg HANDIHALER doit être arrêté immédiatement et des traitements alternatifs doivent être envisagés. Étant donné la formule structurelle similaire de l'atropine au tiotropium, les patients ayant des antécédents de réactions d'hypersensibilité à l'atropine ou à ses dérivés doivent être étroitement surveillés pour des réactions d'hypersensibilité similaires à SPIRIVA HANDIHALER. De plus, SPIRIVA HANDIHALER doit être utilisé avec prudence chez les patients présentant une hypersensibilité sévère aux protéines du lait.
Bronchospasme paradoxal
Les médicaments inhalés, y compris SPIRIVA HANDIHALER, peuvent provoquer un bronchospasme paradoxal. Si cela se produit, il doit être traité immédiatement avec un bêta2-agoniste inhalé à courte durée d'action tel que l'albutérol. Le traitement par SPIRIVA HANDIHALER doit être arrêté et d'autres traitements doivent être envisagés.
Aggravation du glaucome à angle fermé
SPIRIVA 9mcg HANDIHALER doit être utilisé avec prudence chez les patients atteints de glaucome à angle fermé. Les prescripteurs et les patients doivent être attentifs aux signes et symptômes de glaucome aigu à angle fermé (p. ex., douleur ou gêne oculaire, vision floue, halos visuels ou images colorées associées à des yeux rouges dus à une congestion conjonctivale et à un œdème cornéen). Demandez aux patients de consulter immédiatement un médecin si l'un de ces signes ou symptômes se développe.
Aggravation de la rétention urinaire
SPIRIVA HANDIHALER doit être utilisé avec prudence chez les patients présentant une rétention urinaire. Les prescripteurs et les patients doivent être attentifs aux signes et symptômes de rétention urinaire (p. ex., difficulté à uriner, miction douloureuse), en particulier chez les patients présentant une hyperplasie prostatique ou une obstruction du col de la vessie. Demandez aux patients de consulter immédiatement un médecin si l'un de ces signes ou symptômes se développe.
Insuffisance rénale
En tant que médicament principalement excrété par les reins, les patients atteints d'insuffisance rénale modérée à sévère (clairance de la créatinine PHARMACOLOGIE CLINIQUE ].
Informations sur les conseils aux patients
Conseillez au patient de lire l'étiquetage patient approuvé par la FDA ( RENSEIGNEMENTS POUR LE PATIENT et mode d'emploi ).
Pas pour une utilisation aiguë
Informez les patients que SPIRIVA HANDIHALER est un bronchodilatateur d'entretien à prise unique quotidienne et qu'il ne doit pas être utilisé pour le soulagement immédiat des problèmes respiratoires (c'est-à-dire comme médicament de secours).
Réactions d'hypersensibilité immédiates
Informez les patients qu'une anaphylaxie, un œdème de Quincke (y compris un gonflement des lèvres, de la langue ou de la gorge), de l'urticaire, une éruption cutanée, un bronchospasme ou des démangeaisons peuvent survenir après l'administration de SPIRIVA 9mcg HANDIHALER. Conseillez au patient d'arrêter immédiatement le traitement et de consulter un médecin si l'un de ces signes ou symptômes se développe.
Bronchospasme paradoxal
Informez les patients que SPIRIVA HANDIHALER peut produire un bronchospasme paradoxal. Aviser les patients qu'en cas de bronchospasme paradoxal, ils doivent arrêter SPIRIVA HANDIHALER.
Aggravation du glaucome à angle fermé
Demandez aux patients d'être attentifs aux signes et symptômes de glaucome à angle fermé (p. ex., douleur ou gêne oculaire, vision floue, halos visuels ou images colorées associées à des yeux rouges dus à une congestion conjonctivale et à un œdème cornéen). Demandez aux patients de consulter immédiatement un médecin si l'un de ces signes et symptômes se développe.
Informez les patients que des précautions doivent être prises pour ne pas laisser la poudre pénétrer dans les yeux car cela peut provoquer une vision floue et une dilatation des pupilles.
Étant donné que des étourdissements et une vision floue peuvent survenir lors de l'utilisation de SPIRIVA HANDIHALER, avertir les patients de ne pas participer à des activités telles que la conduite d'un véhicule ou l'utilisation d'appareils ou de machines.
Aggravation de la rétention urinaire
Demandez aux patients d'être attentifs aux signes et symptômes de rétention urinaire (p. ex., difficulté à uriner, miction douloureuse). Demandez aux patients de consulter immédiatement un médecin si l'un de ces signes ou symptômes se développe.
Instructions pour l'administration de SPIRIVA HANDIHALER
Expliquer aux patients comment administrer correctement les gélules SPIRIVA 9mcg à l'aide du dispositif HANDIHALER [voir INFORMATIONS PATIENTS ]. Dites aux patients que les capsules SPIRIVA 9mcg doivent être administrées uniquement via le dispositif HANDIHALER et que le dispositif HANDIHALER ne doit pas être utilisé pour administrer d'autres médicaments. Rappeler aux patients que le contenu des gélules SPIRIVA 9mcg est destiné à l'inhalation orale uniquement et ne doit pas être avalé.
Demandez aux patients de toujours conserver les gélules de SPIRIVA 9mcg dans des plaquettes scellées et de ne retirer qu'une seule gélule de SPIRIVA immédiatement avant utilisation, sinon son efficacité pourrait être réduite. Demandez aux patients de jeter les capsules SPIRIVA supplémentaires inutilisées qui sont exposées à l'air (c'est-à-dire qui ne sont pas destinées à une utilisation immédiate).
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Aucun signe de tumorigénicité n'a été observé dans une étude d'inhalation de 104 semaines chez le rat à des doses de tiotropium allant jusqu'à 59 mcg/kg/jour, dans une étude d'inhalation de 83 semaines chez des souris femelles à des doses allant jusqu'à 145 mcg/kg/jour, et dans une étude d'inhalation de 101 semaines chez des souris mâles à des doses allant jusqu'à 2 mcg/kg/jour. Ces doses correspondent à environ 30, 40 et 0,5 fois la dose d'inhalation humaine quotidienne recommandée (MRHDID) sur une base mcg/m2, respectivement.
Le bromure de tiotropium n'a démontré aucun signe de mutagénicité ou de clastogénicité dans les tests suivants : le test de mutation génique bactérienne, le test de mutagenèse sur cellules de hamster chinois V79, les tests d'aberration chromosomique dans les lymphocytes humains in vitro et la formation de micronoyaux chez la souris in vivo, et la synthèse non programmée d'ADN dans test in vitro d'hépatocytes primaires de rat.
Chez les rats, des diminutions du nombre de corps jaunes et du pourcentage d'implants ont été notées à des doses de tiotropium par inhalation de 78 mcg/kg/jour ou plus (environ 40 fois le MRHDID sur une base mcg/m2). Aucun tel effet n'a été observé à 9 mcg/kg/day (environ 5 fois le MRHDID sur une base mcg/m2). L'index de fertilité, cependant, n'a pas été affecté aux doses d'inhalation jusqu'à 1689 mcg/kg/day (environ 910 fois le MRHDID sur une base mcg/m2).
Utilisation dans des populations spécifiques
Grossesse
Résumé des risques
Les données humaines limitées sur l'utilisation de SPIRIVA 9mcg HANDIHALER pendant la grossesse sont insuffisantes pour informer un risque associé au médicament d'effets indésirables liés à la grossesse. D'après les études de reproduction chez l'animal, aucune anomalie structurelle n'a été observée lorsque le tiotropium a été administré par inhalation à des rats et des lapins gravides pendant la période d'organogenèse à des doses 790 et 8 fois, respectivement, la dose maximale recommandée pour l'inhalation humaine quotidienne (MRHDID). Une perte post-implantation accrue a été observée chez des rats et des lapins ayant reçu du tiotropium à des doses maternellement toxiques 430 fois et 40 fois le MRHDID, respectivement [voir Données ].
Le risque de fond estimé de malformations congénitales majeures et de fausse couche pour la population indiquée est inconnu. Toutes les grossesses ont un risque de fond de malformation congénitale, de perte ou d'autres résultats indésirables. Dans la population générale des États-Unis, le risque de fond estimé de malformations congénitales majeures et de fausse couche dans les grossesses cliniquement reconnues est de 2 % à 4 % et de 15 % à 20 %, respectivement.
Données
Données animales
Dans 2 études distinctes sur le développement embryo-fœtal, des rats et des lapins gravides ont reçu du tiotropium pendant la période d'organogenèse à des doses allant jusqu'à environ 790 et 8 fois le MRHDID, respectivement (sur une base mcg/m2 à des doses d'inhalation de 1471 et 7 mcg/kg /jour chez le rat et le lapin, respectivement). Aucune preuve d'anomalies structurelles n'a été observée chez les rats ou les lapins. Cependant, chez le rat, le tiotropium a provoqué une résorption fœtale, une perte de portée, une diminution du nombre de ratons vivants à la naissance et du poids moyen des ratons, ainsi qu'un retard de la maturation sexuelle des ratons à des doses de tiotropium d'environ 40 fois la MRHDID (sur un mcg/m2 base à une dose d'inhalation maternelle de 78 mcg/kg/jour). Chez les lapins, le tiotropium a provoqué une augmentation de la perte post-implantation à une dose de tiotropium d'environ 430 fois la MRHDID (sur une base mcg/m2 à une dose d'inhalation maternelle de 400 mcg/kg/jour). De tels effets n'ont pas été observés à environ 5 et 95 fois le MRHDID, respectivement (sur une base mcg/m2 aux doses d'inhalation de 9 et 88 mcg/kg/day dans les rats et les lapins, respectivement).
Lactation
Résumé des risques
Il n'y a pas de données sur la présence de tiotropium dans le lait maternel, les effets sur le nourrisson allaité ou les effets sur la production de lait. Le tiotropium est présent dans le lait des rats en lactation ; cependant, en raison des différences spécifiques aux espèces dans la physiologie de la lactation, la pertinence clinique de ces données n'est pas claire [voir Données ]. Les avantages de l'allaitement pour le développement et la santé doivent être pris en compte, ainsi que le besoin clinique de SPIRIVA 9mcg HANDIHALER pour la mère et tout effet indésirable potentiel sur l'enfant allaité de SPIRIVA HANDIHALER ou de l'affection maternelle sous-jacente.
Données
La distribution du bromure de tiotropium dans le lait a été étudiée après une administration intraveineuse unique de 10 mg/kg à des rats en lactation. Le tiotropium et/ou ses métabolites sont présents dans le lait des rates allaitantes à des concentrations supérieures à celles du plasma.
Utilisation pédiatrique
SPIRIVA HANDIHALER n'est pas indiqué chez les enfants. L'innocuité et l'efficacité de SPIRIVA 9mcg HANDIHALER chez les patients pédiatriques n'ont pas été établies.
Utilisation gériatrique
D'après les données disponibles, aucun ajustement de la posologie de SPIRIVA HANDIHALER chez les patients gériatriques n'est justifié [voir PHARMACOLOGIE CLINIQUE ].
Sur le nombre total de patients qui ont reçu SPIRIVA 9mcg HANDIHALER dans les essais cliniques d'un an, 426 étaient âgés de moins de 65 ans, 375 étaient âgés de 65 à 74 ans et 105 étaient âgés de ≥ 75 ans. Au sein de chaque sous-groupe d'âge, il n'y avait aucune différence entre la proportion de patients présentant des événements indésirables dans le SPIRIVA 9mcg HANDIHALER et les groupes de comparaison pour la plupart des événements. La bouche sèche augmentait avec l'âge dans le groupe SPIRIVA 9mcg HANDIHALER (les différences par rapport au placebo étaient de 9,0 %, 17,1 % et 16,2 % dans les sous-groupes d'âge susmentionnés). Une fréquence plus élevée de constipation et d'infections des voies urinaires avec l'âge a été observée dans le groupe SPIRIVA HANDIHALER dans les études contrôlées versus placebo. Les différences par rapport au placebo pour la constipation étaient de 0 %, 1,8 % et 7,8 % pour chacun des groupes d'âge. Les différences par rapport au placebo pour les infections des voies urinaires étaient de -0,6 %, 4,6 % et 4,5 %. Aucune différence globale d'efficacité n'a été observée entre ces groupes.
Insuffisance rénale
Les patients atteints d'insuffisance rénale modérée à sévère (clairance de la créatinine DOSAGE ET ADMINISTRATION , AVERTISSEMENTS ET PRECAUTIONS , et PHARMACOLOGIE CLINIQUE ].
Insuffisance hépatique
Les effets de l'insuffisance hépatique sur la pharmacocinétique du tiotropium n'ont pas été étudiés.
SURDOSAGE
Des doses élevées de tiotropium peuvent entraîner des signes et des symptômes anticholinergiques. Cependant, il n'y a eu aucun effet indésirable anticholinergique systémique après une dose inhalée unique allant jusqu'à 282 mcg de tiotropium chez 6 volontaires sains. Dans une étude portant sur 12 volontaires sains, une conjonctivite bilatérale et une bouche sèche ont été observées après une inhalation répétée une fois par jour de 141 mcg de tiotropium.
Le traitement du surdosage consiste en l'arrêt de SPIRIVA HANDIHALER et en l'instauration d'un traitement symptomatique et/ou de soutien approprié.
Ingestion accidentelle
Une intoxication aiguë par ingestion orale accidentelle de capsules SPIRIVA est peu probable puisqu'elle n'est pas bien absorbée par voie systémique.
Un cas de surdosage a été rapporté depuis la commercialisation. Une patiente aurait inhalé 30 gélules sur une période de 2,5 jours et aurait développé un état mental altéré, des tremblements, des douleurs abdominales et une constipation sévère. Le patient a été hospitalisé, SPIRIVA HANDIHALER a été arrêté et la constipation a été traitée par un lavement. Le patient a récupéré et est sorti le même jour.
CONTRE-INDICATIONS
SPIRIVA 9mcg HANDIHALER est contre-indiqué chez les patients présentant une hypersensibilité au tiotropium, à l'ipratropium ou à l'un des composants de ce produit [voir AVERTISSEMENTS ET PRECAUTIONS ]. Dans les essais cliniques et l'expérience post-commercialisation avec SPIRIVA 9mcg HANDIHALER, des réactions d'hypersensibilité immédiates, y compris un œdème de Quincke (y compris un gonflement des lèvres, de la langue ou de la gorge), des démangeaisons ou une éruption cutanée ont été signalées [voir AVERTISSEMENTS ET PRECAUTIONS ].
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
Le tiotropium est un agent antimuscarinique à action prolongée, souvent appelé anticholinergique. Il a une affinité similaire pour les sous-types de récepteurs muscariniques, M1 à M5. Dans les voies respiratoires, il présente des effets pharmacologiques par inhibition des récepteurs M3 au niveau du muscle lisse, entraînant une bronchodilatation. Le caractère compétitif et réversible de l'antagonisme a été mis en évidence avec des récepteurs d'origine humaine et animale et des préparations d'organes isolés. Dans les études précliniques in vitro et in vivo, la prévention des effets de bronchoconstriction induits par la méthacholine était dose-dépendante et a duré plus de 24 heures. La bronchodilatation consécutive à l'inhalation de tiotropium est principalement un effet localisé.
Pharmacodynamie
Électrophysiologie cardiaque
Dans un essai multicentrique, randomisé, en double aveugle utilisant la poudre sèche de tiotropium pour inhalation qui a recruté 198 patients atteints de BPCO, le nombre de sujets présentant des changements par rapport à l'intervalle QT corrigé au départ de 30 à 60 msec était plus élevé dans le groupe SPIRIVA 9mcg HANDIHALER par rapport avec placebo. Cette différence était évidente en utilisant à la fois les corrections de Bazett (QTcB) [20 (20 %) patients contre 12 (12 %) patients] et Fredericia (QTcF) [16 (16 %) patients contre 1 (1 %) patient] de QT pour la fréquence cardiaque. Aucun patient dans l'un ou l'autre des groupes n'avait un QTcB ou un QTcF > 500 msec. D'autres études cliniques avec SPIRIVA HANDIHALER n'ont pas détecté d'effet du médicament sur les intervalles QTc.
L'effet de la poudre sèche de tiotropium pour inhalation sur l'intervalle QT a également été évalué dans une étude croisée randomisée, contrôlée contre placebo et positive chez 53 volontaires sains. Les sujets ont reçu de la poudre sèche de tiotropium pour inhalation 18 mcg, 54 mcg (3 fois la dose recommandée) ou un placebo pendant 12 jours. Des évaluations ECG ont été effectuées au départ et tout au long de l'intervalle de dosage suivant la première et la dernière dose du médicament à l'étude. Par rapport au placebo, la variation moyenne maximale par rapport au départ de l'intervalle QTc spécifique à l'étude était de 3,2 msec et 0,8 msec pour la poudre sèche de tiotropium pour inhalation 18 mcg et 54 mcg, respectivement. Aucun sujet n'a montré une nouvelle apparition de QTc> 500 msec ou des changements de QTc par rapport à la ligne de base de ≥ 60 msec.
Pharmacocinétique
Le tiotropium est administré par inhalation de poudre sèche. Certaines des données pharmacocinétiques décrites ci-dessous ont été obtenues avec des doses plus élevées que celles recommandées pour le traitement. Une étude pharmacocinétique dédiée chez des patients atteints de MPOC évaluant le tiotropium administré une fois par jour par l'inhalateur RESPIMAT (5 mcg) et sous forme de poudre pour inhalation (18 mcg) par le dispositif HANDIHALER a entraîné une exposition systémique similaire entre les deux produits.
Absorption
Suite à l'inhalation de poudre sèche par de jeunes volontaires sains, la biodisponibilité absolue de 19,5 % suggère que la fraction atteignant les poumons est hautement biodisponible. Les solutions orales de tiotropium ont une biodisponibilité absolue de 2 à 3 %. La nourriture ne devrait pas influencer l'absorption du tiotropium. Les concentrations plasmatiques maximales de tiotropium ont été observées 7 minutes après l'inhalation.
Distribution
Le tiotropium est lié à 72 % aux protéines plasmatiques et a un volume de distribution de 32 L/kg après administration intraveineuse à de jeunes volontaires sains. Les concentrations locales dans les poumons ne sont pas connues, mais le mode d'administration suggère des concentrations sensiblement plus élevées dans les poumons. Des études chez le rat ont montré que le tiotropium ne pénètre pas facilement la barrière hémato-encéphalique.
Élimination
La demi-vie terminale du tiotropium chez les patients atteints de BPCO après inhalation une fois par jour de 5 mcg de tiotropium était d'environ 25 heures. La clairance totale était de 880 mL/min après administration intraveineuse chez de jeunes volontaires sains. Après inhalation chronique de poudre sèche une fois par jour par des patients atteints de BPCO, l'état d'équilibre pharmacocinétique a été atteint au jour 7 sans accumulation par la suite.
Métabolisme
L'étendue du métabolisme est faible. Ceci est mis en évidence par une excrétion urinaire de 74% de substance inchangée après une dose intraveineuse chez de jeunes volontaires sains. Le tiotropium, un ester, est clivé de manière non enzymatique en l'alcool N-méthylscopine et l'acide dithiénylglycolique, dont aucun ne se lie aux récepteurs muscariniques.
Des expériences in vitro avec des microsomes hépatiques humains et des hépatocytes humains suggèrent qu'une fraction de la dose administrée (74 % d'une dose intraveineuse est excrétée sous forme inchangée dans l'urine, laissant 25 % pour le métabolisme) est métabolisée par oxydation dépendante du cytochrome P450 et conjugaison ultérieure au glutathion à une variété de métabolites de phase II. Cette voie enzymatique peut être inhibée par les inhibiteurs du CYP450 2D6 et 3A4, tels que la quinidine, le kétoconazole et le gestodène. Ainsi, les CYP450 2D6 et 3A4 sont impliqués dans la voie métabolique responsable de l'élimination d'une petite partie de la dose administrée. Des études in vitro utilisant des microsomes hépatiques humains ont montré que le tiotropium à des concentrations supra-thérapeutiques n'inhibait pas les CYP450 1A1, 1A2, 2B6, 2C9, 2C19, 2D6, 2E1 ou 3A4.
Excrétion
Le bromure de tiotropium administré par voie intraveineuse est principalement excrété sous forme inchangée dans l'urine (74 %). Après inhalation de poudre sèche chez des patients atteints de BPCO à l'état d'équilibre, l'excrétion urinaire était de 7 % (1,3 mcg) de la dose inchangée sur 24 heures. La clairance rénale du tiotropium dépasse la clairance de la créatinine, indiquant une sécrétion dans l'urine.
Populations spécifiques
Patients gériatriques
Comme attendu pour tous les médicaments principalement excrétés par les reins, l'âge avancé était associé à une diminution de la clairance rénale du tiotropium (365 ml/min chez les patients atteints de BPCO
Insuffisance rénale
Après 4 semaines d'administration de SPIRIVA 9mcg HANDIHALER ou SPIRIVA 9mcg RESPIMAT une fois par jour chez des patients atteints de BPCO, une insuffisance rénale légère (clairance de la créatinine 60-
Insuffisance hépatique
Les effets de l'insuffisance hépatique sur la pharmacocinétique du tiotropium n'ont pas été étudiés.
Interactions médicamenteuses
Une étude d'interaction avec le tiotropium (14,4 mcg en perfusion intraveineuse sur 15 minutes) et la cimétidine 400 mg trois fois par jour ou la ranitidine 300 mg une fois par jour a été menée. L'administration concomitante de cimétidine et de tiotropium a entraîné une augmentation de 20 % de l'ASC0-4h, une diminution de 28 % de la clairance rénale du tiotropium et aucun changement significatif de la Cmax et de la quantité excrétée dans les urines sur 96 heures. La co-administration de tiotropium avec la ranitidine n'a pas affecté la pharmacocinétique du tiotropium.
Les médicaments concomitants courants (agonistes bêta2-adrénergiques à longue durée d'action (BALA), corticostéroïdes inhalés (CSI)) utilisés par les patients atteints de BPCO n'ont pas modifié l'exposition au tiotropium.
Etudes cliniques
Le programme de développement clinique de SPIRIVA 9mcg HANDIHALER (bromure de tiotropium en poudre pour inhalation) comprenait six études de phase 3 chez 2 663 patients atteints de MPOC (1 308 recevant SPIRIVA 9mcg HANDIHALER) : deux études contrôlées par placebo d'une durée d'un an, deux études contrôlées par placebo d'une durée de 6 mois études et deux études d'un an contrôlées par l'ipratropium. Ces études ont inclus des patients qui avaient un diagnostic clinique de BPCO, étaient âgés de 40 ans ou plus, avaient des antécédents de tabagisme supérieurs à 10 paquets-années, avaient un volume expiratoire maximal en une seconde (FEV1) inférieur ou égal à 60 % ou 65 % de la valeur prévue, et un rapport VEMS/CVF inférieur ou égal à 0,7.
Dans ces études, SPIRIVA HANDIHALER, administré une fois par jour le matin, a entraîné une amélioration de la fonction pulmonaire (FEV1), avec un effet maximal survenant dans les 3 heures suivant la première dose.
Deux essais supplémentaires ont évalué les exacerbations : un essai clinique multicentrique, randomisé, en double aveugle, contrôlé par placebo, d'une durée de 6 mois portant sur 1 829 patients atteints de BPCO dans un établissement américain des anciens combattants et un essai clinique randomisé, en double aveugle, contrôlé par placebo, d'une durée de 4 ans, multicentrique, essai clinique de 5992 patients atteints de MPOC. Les effets à long terme sur la fonction pulmonaire et d'autres résultats ont également été évalués dans l'essai multicentrique de 4 ans.
Effets de 6 mois à 1 an sur la fonction pulmonaire
Dans les essais contrôlés par placebo d'une durée d'un an, l'amélioration moyenne du VEMS à 30 minutes était de 0,13 litre (13 %) avec une amélioration maximale de 0,24 litre (24 %) par rapport à la valeur initiale après la première dose (Jour 1). D'autres améliorations du VEMS et de la capacité vitale forcée (CVF) ont été observées avec l'état d'équilibre pharmacodynamique atteint au jour 8 avec un traitement une fois par jour. L'amélioration maximale moyenne du VEMS, par rapport à la ligne de base, était de 0,28 à 0,31 litre (28 % à 31 %), après 1 semaine (jour 8) de traitement une fois par jour. L'amélioration de la fonction pulmonaire s'est maintenue pendant 24 heures après une dose unique et s'est maintenue de manière constante sur la période de traitement d'un an sans signe de tolérance.
Dans les deux essais contrôlés par placebo d'une durée de 6 mois, des évaluations spirométriques en série ont été effectuées tout au long de la journée dans l'essai A (12 heures) et limitées à 3 heures dans l'essai B. Les valeurs en série du VEMS sur 12 heures (essai A) sont affichées dans Figure 1. Ces essais confirment davantage l'amélioration de la fonction pulmonaire (FEV1) avec SPIRIVA 9mcg HANDIHALER, qui a persisté pendant la période d'observation spirométrique. L'efficacité a été maintenue pendant 24 heures après l'administration sur la période de traitement de 6 mois.
Figure 1 : VEMS moyen au fil du temps (avant et après l'administration du médicament à l'étude) aux jours 1 et 169 pour l'essai A (une étude contrôlée par placebo de six mois)* 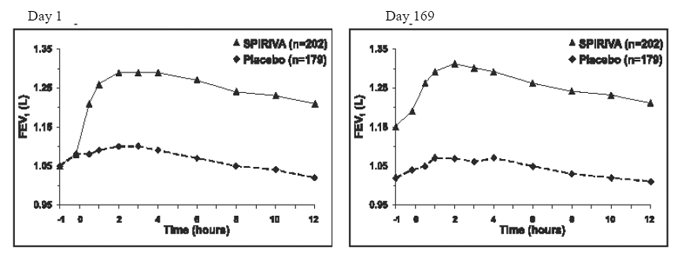
* Moyennes ajustées pour le centre, le traitement et l'effet de base. Au jour 169, un total de 183 et 149 patients des groupes SPIRIVA HANDIHALER et placebo, respectivement, ont terminé l'essai. Les données pour les patients restants ont été imputées en utilisant la dernière observation ou l'observation la moins favorable reportée.
Les résultats de chacun des essais contrôlés par ipratropium d'un an étaient similaires aux résultats des essais contrôlés par placebo d'un an. Les résultats de l'un de ces essais sont présentés à la figure 2.
Figure 2 : VEMS moyen dans le temps (0 à 6 heures après l'administration) aux jours 1 et 92, respectivement pour l'une des deux études contrôlées par l'ipratropium* 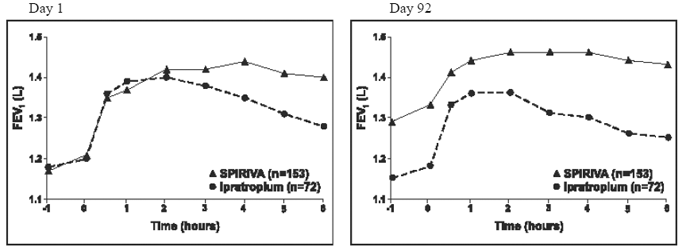
* Moyennes ajustées pour le centre, le traitement et l'effet de base. Au jour 92 (critère principal), un total de 151 et 69 patients des groupes SPIRIVA HANDIHALER et ipratropium, respectivement, ont terminé les 3 mois d'observation. Les données pour les patients restants ont été imputées en utilisant la dernière observation ou l'observation la moins favorable reportée.
Une étude clinique randomisée et contrôlée par placebo chez 105 patients atteints de BPCO a démontré que la bronchodilatation était maintenue tout au long de l'intervalle posologique de 24 heures par rapport au placebo, que SPIRIVA 9mcg HANDIHALER ait été administré le matin ou le soir.
Tout au long de chaque semaine de la période de traitement d'un an dans les deux essais contrôlés par placebo, les patients prenant SPIRIVA 9mcg HANDIHALER avaient moins besoin d'utiliser des bêta2-agonistes de secours à courte durée d'action. La réduction de l'utilisation de bêta2-agonistes de secours à courte durée d'action, par rapport au placebo, a été démontrée dans l'une des deux études de 6 mois.
Effets à 4 ans sur la fonction pulmonaire
Un essai clinique multicentrique, randomisé, en double aveugle, contrôlé par placebo, d'une durée de 4 ans, impliquant 5992 patients atteints de MPOC, a été mené pour évaluer les effets à long terme de SPIRIVA HANDIHALER sur la progression de la maladie (taux de déclin du VEMS). Les patients étaient autorisés à utiliser tous les médicaments respiratoires (y compris les bêta-agonistes à courte et longue durée d'action, les stéroïdes inhalés et systémiques et les théophyllines) autres que les anticholinergiques inhalés. Les patients étaient âgés de 40 à 88 ans, 75 % de sexe masculin et 90 % de race blanche avec un diagnostic de BPCO et un VEMS pré-bronchodilatateur moyen de 39 % prédit (intervalle = 9 % à 76 %) à l'entrée dans l'étude. Il n'y avait aucune différence entre les groupes dans l'un ou l'autre des critères d'efficacité co-primaires, le taux de déclin annuel du VEMS pré- et post-bronchodilatateur, comme le démontrent les pentes similaires de déclin du VEMS au fil du temps (Figure 3).
SPIRIVA HANDIHALER a maintenu l'amélioration du VEMS résiduel (pré-dose) (moyenne ajustée au fil du temps : 87 à 103 mL) tout au long des 4 années de l'étude (Figure 3).
Figure 3 : Valeurs moyennes minimales du VEMS (pré-dose) à chaque point dans le temps 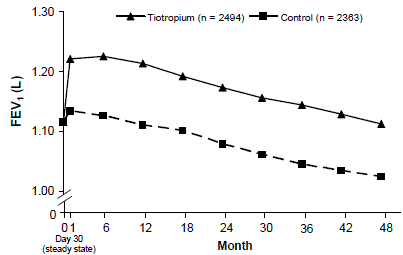
Une ANOVA à mesures répétées a été utilisée pour estimer les moyennes. Les moyennes sont ajustées pour les mesures de base. VEMS initial initial (moyenne observée) = 1,12. Les patients avec ≥3 tests de fonction pulmonaire acceptables après le jour 30 et une valeur de référence non manquante ont été inclus dans l'analyse.
Exacerbation
L'effet de SPIRIVA 9mcg HANDIHALER sur les exacerbations de MPOC a été évalué dans deux essais cliniques : un essai clinique de 4 ans décrit ci-dessus et un essai clinique de 6 mois sur 1 829 patients atteints de MPOC dans un établissement des Anciens Combattants. Dans l'essai de 6 mois, les exacerbations de la MPOC ont été définies comme un ensemble de symptômes respiratoires (augmentation ou nouvelle apparition) de plus d'un des éléments suivants : toux, crachats, respiration sifflante, dyspnée ou oppression thoracique d'une durée d'au moins 3 jours nécessitant un traitement avec des antibiotiques, des stéroïdes systémiques ou une hospitalisation. La population avait un âge allant de 40 à 90 ans avec 99 % d'hommes, 91 % de race blanche, et avait une BPCO avec un pourcentage moyen de VEMS prébronchodilatateur prédit de 36 % (intervalle = 8 % à 93 %). Les patients étaient autorisés à utiliser des médicaments respiratoires (y compris des bêta-agonistes à courte et longue durée d'action, des stéroïdes inhalés et systémiques et des théophyllines) autres que les anticholinergiques inhalés. Dans l'essai de 6 mois, les critères d'évaluation principaux étaient la proportion de patients présentant une exacerbation de la BPCO et la proportion de patients hospitalisés en raison d'une exacerbation de la BPCO. SPIRIVA 9mcg HANDIHALER a significativement réduit la proportion de patients atteints de BPCO ayant présenté des exacerbations par rapport au placebo (27,9 % contre 32,3 %, respectivement ; Odds ratio (OR) (tiotropium/placebo) = 0,81 ; IC à 95 % = 0,66, 0,99 ; p = 0,037 ). La proportion de patients hospitalisés en raison d'exacerbations de BPCO chez les patients qui ont utilisé SPIRIVA 9mcg HANDIHALER par rapport au placebo était de 7,0 % contre 9,5 %, respectivement ; OU = 0,72 ; IC à 95 % = 0,51, 1,01 ; p = 0,056.
Les exacerbations ont été évaluées comme résultat secondaire dans l'essai multicentrique de 4 ans. Dans cet essai, les exacerbations de la MPOC ont été définies comme une augmentation ou une nouvelle apparition de plus d'un des symptômes respiratoires suivants (toux, crachats, purulence des crachats, respiration sifflante, dyspnée) d'une durée de trois jours ou plus nécessitant un traitement avec des antibiotiques et/ou stéroïdes systémiques (oraux, intramusculaires ou intraveineux). SPIRIVA HANDIHALER a significativement réduit le risque d'exacerbation de 14 % (Hazard Ratio (HR) = 0,86 ; IC à 95 % = 0,81, 0,91 ; p
Mortalité toutes causes confondues
Dans l'essai de 4 ans sur la fonction pulmonaire contrôlé par placebo décrit ci-dessus, la mortalité toutes causes confondues par rapport au placebo a été évaluée. Il n'y avait aucune différence significative dans les taux de mortalité toutes causes confondues entre SPIRIVA 9mcg HANDIHALER et le placebo.
La mortalité toutes causes confondues de SPIRIVA HANDIHALER a également été comparée à celle du tiotropium en aérosol pour inhalation à 5 mcg (SPIRIVA RESPIMAT 5 mcg) dans une autre étude à long terme, randomisée, en double aveugle, à double insu et contrôlée par comparateur actif avec une période d'observation allant jusqu'à 3 ans. La mortalité toutes causes confondues était similaire entre SPIRIVA 9mcg HANDIHALER et SPIRIVA RESPIMAT.
INFORMATIONS PATIENTS
SPIRIVA 9mcgR® (speh REE vah) HANDIHALER® (bromure de tiotropium) Poudre pour inhalation, pour inhalation orale
NE PAS avaler les capsules SPIRIVA.
Une information important: Ne pas avaler les capsules SPIRIVA. Les gélules SPIRIVA 9mcg doivent être utilisées uniquement avec le dispositif HANDIHALER et inhalées par la bouche (inhalation orale).
Lisez les informations fournies avec votre SPIRIVA HANDIHALER avant de commencer à l'utiliser et chaque fois que vous renouvelez votre ordonnance. Il peut y avoir de nouvelles informations. Cette notice ne remplace pas une discussion avec votre médecin au sujet de votre état de santé ou de votre traitement.
Qu'est-ce que SPIRIVA HANDIHALER ?
- SPIRIVA HANDIHALER est un médicament délivré sur ordonnance utilisé quotidiennement (un médicament d'entretien) pour contrôler les symptômes de la maladie pulmonaire obstructive chronique (MPOC), y compris la bronchite chronique et l'emphysème.
- SPIRIVA HANDIHALER aide à améliorer le fonctionnement de vos poumons pendant 24 heures. SPIRIVA 9mcg HANDIHALER détend vos voies respiratoires et aide à les garder ouvertes. Vous pouvez commencer à avoir l'impression qu'il est plus facile de respirer le premier jour, mais il vous faudra peut-être plus de temps pour ressentir tous les effets du médicament. SPIRIVA HANDIHALER fonctionne mieux et peut aider à faciliter la respiration lorsque vous l'utilisez tous les jours.
- SPIRIVA 9mcg HANDIHALER réduit le risque de poussées et d'aggravation des symptômes de la MPOC (exacerbations de la MPOC). Une exacerbation de la MPOC est définie comme une augmentation ou une nouvelle apparition de plus d'un symptôme de la MPOC, comme la toux, le mucus, l'essoufflement et la respiration sifflante, qui nécessite des médicaments en plus de votre médicament de secours.
SPIRIVA 9mcg HANDIHALER n'est pas un médicament de secours et ne doit pas être utilisé pour traiter des problèmes respiratoires soudains. Votre médecin peut vous donner d'autres médicaments à utiliser pour des problèmes respiratoires soudains.
On ne sait pas si SPIRIVA 9mcg HANDIHALER est sûr et efficace chez les enfants.
Qui ne devrait pas prendre SPIRIVA 9mcg HANDIHALER ?
N'utilisez pas SPIRIVA 9mcg HANDIHALER si vous :
- êtes allergique au tiotropium, à l'ipratropium (Atrovent®) ou à l'un des ingrédients de SPIRIVA 9mcg HANDIHALER. Voir la fin de cette notice pour la liste complète des ingrédients de SPIRIVA 9mcg HANDIHALER.
Les symptômes d'une réaction allergique grave à SPIRIVA 9mcg HANDIHALER peuvent inclure :
- plaques rouges en relief sur la peau (urticaire)
- démangeaison
- éruption
- gonflement du visage, des lèvres, de la langue et de la gorge pouvant entraîner des difficultés à respirer ou à avaler
Si vous présentez ces symptômes de réaction allergique, arrêtez de prendre SPIRIVA HANDIHALER et appelez immédiatement votre médecin ou rendez-vous aux urgences de l'hôpital le plus proche.
Que dois-je dire à mon médecin avant d'utiliser SPIRIVA HANDIHALER ?
Avant de prendre SPIRIVA HANDIHALER, informez votre médecin de toutes vos conditions médicales, y compris si vous :
- avoir des problèmes rénaux.
- avoir un glaucome. SPIRIVA HANDIHALER peut aggraver votre glaucome.
- avez une hypertrophie de la prostate, des problèmes pour uriner ou un blocage de la vessie. SPIRIVA 9mcg HANDIHALER peut aggraver ces problèmes.
- êtes enceinte ou envisagez de devenir enceinte. On ne sait pas si SPIRIVA HANDIHALER pourrait nuire à votre bébé à naître.
- allaitez ou envisagez d'allaiter. On ne sait pas si SPIRIVA HANDIHALER passe dans le lait maternel. Vous et votre médecin déciderez si SPIRIVA 9mcg HANDIHALER vous convient pendant que vous allaitez.
- avez une allergie sévère aux protéines de lait. Demandez à votre médecin si vous n'êtes pas sûr.
Informez votre médecin de tous les médicaments que vous prenez, y compris les médicaments sur ordonnance et en vente libre et les gouttes pour les yeux, les vitamines et les suppléments à base de plantes. Certains de vos autres médicaments ou suppléments peuvent affecter le fonctionnement de SPIRIVA HANDIHALER. SPIRIVA 9mcg HANDIHALER est un médicament anticholinergique. Vous ne devez pas prendre d'autres médicaments anticholinergiques pendant l'utilisation de SPIRIVA 9mcg HANDIHALER, y compris l'ipratropium. Demandez à votre médecin ou à votre pharmacien si vous ne savez pas si l'un de vos médicaments est un anticholinergique.
Connaissez les médicaments que vous prenez. Conservez une liste de vos médicaments avec vous pour la montrer à votre médecin et à votre pharmacien lorsque vous recevez un nouveau médicament.
Comment dois-je prendre SPIRIVA 9mcg HANDIHALER ?
- Utilisez SPIRIVA 9mcg HANDIHALER exactement comme prescrit. Utilisez SPIRIVA HANDIHALER une fois par jour.
- Lisez les « Instructions d'utilisation » à la fin de cette notice avant d'utiliser SPIRIVA HANDIHALER. Discutez avec votre médecin si vous ne comprenez pas les instructions.
- Ne pas avaler les gélules de SPIRIVA 9mcg.
- Utilisez uniquement les gélules SPIRIVA 9mcg avec l'appareil HANDIHALER.
- N'utilisez pas l'appareil HANDIHALER pour prendre d'autres médicaments.
- SPIRIVA 9mcg HANDIHALER se présente sous forme de poudre dans une capsule SPIRIVA 9mcg qui s'adapte au dispositif HANDIHALER. Chaque capsule SPIRIVA, contenant seulement une petite quantité de poudre SPIRIVA, correspond à une dose complète de médicament.
- Séparez un blister de la plaquette alvéolée. Sortez ensuite l'une des gélules SPIRIVA 9mcg de la plaquette thermoformée juste avant de l'utiliser.
- Après perçage de la gélule, prendre une dose complète de SPIRIVA HANDIHALER en respirant deux fois la poudre par la bouche, à l'aide de l'appareil HANDIHALER (prendre 2 inhalations d'une gélule SPIRIVA). Voir le "Mode d'emploi" à la fin de cette notice.
- Jetez toute capsule SPIRIVA qui n'est pas utilisée immédiatement après l'avoir retirée de la plaquette alvéolée. Ne laissez pas les gélules SPIRIVA à l'air libre ; ils peuvent ne pas fonctionner aussi bien.
- Si vous oubliez une dose, prenez-la dès que vous vous en souvenez. Ne pas utiliser SPIRIVA HANDIHALER plus d'une fois toutes les 24 heures. ? Si vous utilisez plus que la dose prescrite de SPIRIVA HANDIHALER, appelez votre médecin ou un centre antipoison.
Que dois-je éviter lors de l'utilisation de SPIRIVA 9mcg HANDIHALER ?
- Ne laissez pas la poudre de la capsule SPIRIVA pénétrer dans vos yeux. Votre vision peut devenir floue et la pupille de votre œil peut s'agrandir (se dilater). Si cela se produit, appelez votre médecin.
- SPIRIVA 9mcg HANDIHALER peut causer des étourdissements et une vision floue. Si vous ressentez ces symptômes, vous devez faire preuve de prudence lorsque vous vous engagez dans des activités telles que la conduite d'une voiture ou l'utilisation d'appareils ou d'autres machines.
Quels sont les effets secondaires possibles de SPIRIVA HANDIHALER ?
SPIRIVA 9mcg HANDIHALER peut provoquer des effets secondaires graves, notamment : Réaction allergique. Les symptômes peuvent inclure :
- plaques rouges en relief sur la peau (urticaire)
- démangeaison
- éruption
- gonflement des lèvres, de la langue ou de la gorge pouvant entraîner des difficultés à respirer ou à avaler
Si vous présentez ces symptômes de réaction allergique, arrêtez de prendre SPIRIVA HANDIHALER et appelez immédiatement votre médecin ou rendez-vous aux urgences de l'hôpital le plus proche.
- Rétrécissement soudain et blocage des voies respiratoires dans les poumons (bronchospasme) . Votre respiration s'aggrave soudainement.
Si vous présentez ces symptômes de bronchospasme, arrêtez de prendre SPIRIVA 9mcg HANDIHALER et appelez immédiatement votre médecin ou rendez-vous aux urgences de l'hôpital le plus proche.
- Augmentation de la pression dans les yeux, nouvelle ou aggravée (glaucome aigu à angle fermé). Les symptômes du glaucome aigu à angle fermé peuvent inclure :
- douleur oculaire
- Vision floue
- voir des halos (halos visuels) ou des images colorées avec des yeux rouges
Utiliser uniquement des gouttes pour les yeux pour traiter ces symptômes peut ne pas fonctionner. Si vous présentez ces symptômes, arrêtez de prendre SPIRIVA HANDIHALER et appelez immédiatement votre médecin.
- Rétention urinaire nouvelle ou aggravée. Les symptômes d'obstruction de la vessie et/ou de l'hypertrophie de la prostate peuvent inclure : difficulté à uriner, miction douloureuse.
Si vous présentez ces symptômes de rétention urinaire, arrêtez de prendre SPIRIVA HANDIHALER et appelez immédiatement votre médecin.
Les autres effets secondaires de SPIRIVA 9mcg HANDIHALER incluent :
- infection des voies respiratoires supérieures
- bouche sèche
- Infection des sinus
- mal de gorge
- douleur thoracique non spécifique
- infection urinaire
- indigestion
- nez qui coule
- constipation
- rythme cardiaque augmenté
- Vision floue
Ce ne sont pas tous les effets secondaires possibles avec SPIRIVA HANDIHALER. Dites à votre médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
Comment conserver SPIRIVA HANDIHALER ?
- Ne conservez pas les gélules SPIRIVA dans l'appareil HANDIHALER.
- Conservez les gélules SPIRIVA dans la plaquette alvéolée scellée à température ambiante entre 68 °F et 77 °F (20 °C et 25 °C).
- Conserver les capsules SPIRIVA à l'abri de la chaleur et du froid (ne pas congeler).
- Conserver les gélules de SPIRIVA 9mcg dans un endroit sec. Jetez toutes les gélules inutilisées de SPIRIVA 9mcg qui ont été ouvertes à l'air.
Demandez à votre médecin ou à votre pharmacien si vous avez des questions sur la conservation de vos gélules SPIRIVA 9mcg.
Gardez SPIRIVA HANDIHALER, les gélules SPIRIVA 9mcg et tous les médicaments hors de la portée des enfants.
Informations générales sur SPIRIVA HANDIHALER
Les médicaments sont parfois prescrits à des fins autres que celles énumérées dans les notices d'information destinées aux patients. Ne pas utiliser SPIRIVA 9mcg HANDIHALER dans un but pour lequel il n'a pas été prescrit. Ne donnez pas SPIRIVA HANDIHALER à d'autres personnes même si elles présentent les mêmes symptômes que vous. Cela peut leur nuire.
Pour plus d'informations sur SPIRIVA HANDIHALER, parlez-en à votre médecin. Vous pouvez demander à votre médecin ou à votre pharmacien des informations sur SPIRIVA 9mcg HANDIHALER qui sont destinées aux professionnels de la santé.
Pour plus d'informations sur SPIRIVA 9mcg HANDIHALER, rendez-vous sur www.SPIRIVA.com, ou scannez le code ci-dessous, ou appelez Boehringer Ingelheim Pharmaceuticals, Inc. au 1-800-542-6257 ou (TTY) 1-800-459-9906.
Quels sont les ingrédients de SPIRIVA 9mcg HANDIHALER?
Ingrédient actif: tiotropium
Ingrédient inactif : lactose monohydraté
Qu'est-ce que la MPOC (maladie pulmonaire obstructive chronique) ?
La MPOC est une maladie pulmonaire grave qui comprend la bronchite chronique, l'emphysème ou les deux. La plupart des MPOC sont causées par le tabagisme. Lorsque vous souffrez de MPOC, vos voies respiratoires se rétrécissent. Ainsi, l'air sort plus lentement de vos poumons. Cela rend la respiration difficile.
Ces informations destinées aux patients ont été approuvées par la Food and Drug Administration des États-Unis.
MODE D'EMPLOISPIRIVA® (speh REE vah) HANDIHALER® (bromure de tiotropium) poudre pour inhalation, pour inhalation orale
Ne pas avaler les capsules SPIRIVA.
Informations importantes sur l'utilisation de votre SPIRIVA HANDIHALER
- Ne pas avaler les gélules de SPIRIVA 9mcg.
- Les capsules SPIRIVA doivent être utilisées uniquement avec l'appareil HANDIHALER et inhalées par la bouche (inhalation orale).
- N'utilisez pas votre appareil HANDIHALER pour prendre d'autres médicaments.
Lisez d'abord les informations destinées aux patients, puis lisez ces instructions d'utilisation avant de commencer à utiliser SPIRIVA HANDIHALER et chaque fois que vous renouvelez votre ordonnance. Il peut y avoir de nouvelles informations.
Se familiariser avec votre appareil HANDIHALER et les gélules SPIRIVA :
Votre SPIRIVA HANDIHALER est livré avec des capsules SPIRIVA 9mcg sous blister et un dispositif HANDIHALER. Utilisez le nouvel appareil HANDIHALER fourni avec votre médicament.
Les pièces de votre appareil HANDIHALER comprennent :
(Voir Figure A)
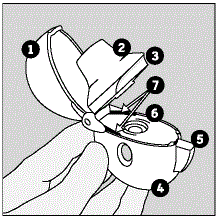
Figure A
Chaque gélule SPIRIVA 9mcg est conditionnée sous blister. (Voir Figure B)
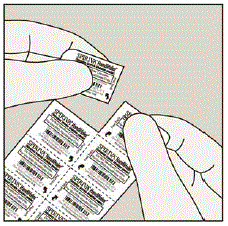
Figure B
- Chaque gélule SPIRIVA ne contient qu'une petite quantité de poudre. (Voir Figure C) Il s'agit d'une dose complète.
- Ne pas ouvrir la gélule SPIRIVA 9mcg ou cela peut ne pas fonctionner.

Figure C
Prendre votre dose quotidienne complète de médicament nécessite 4 étapes principales.
Étape 1. Ouverture de votre appareil HANDIHALER :
Après avoir retiré votre appareil HANDIHALER de la pochette :
- Ouvrez le capuchon anti-poussière (couvercle) en appuyant sur le bouton de perçage vert. (Voir Figure D)
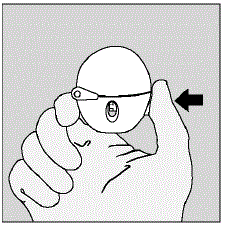
Figure D
- Tirez le capuchon anti-poussière (couvercle) vers le haut loin de la base pour exposer l'embout buccal. (Voir Figure E)
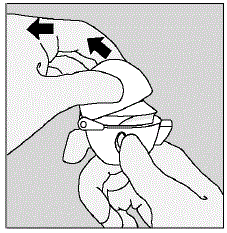
Figure E
- Ouvrez l'embout buccal en tirant la crête de l'embout buccal vers le haut et loin de la base afin que la chambre centrale soit visible. (Voir Figure F)

Figure F
Étape 2. Insertion de la gélule SPIRIVA 9mcg dans votre appareil HANDIHALER :
Chaque jour, ne séparez qu'une seule des alvéoles de la plaquette alvéolée en déchirant le long de la ligne perforée. (Voir Figure G)
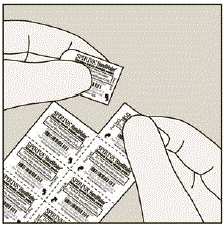
Chiffre G
Sortir la gélule SPIRIVA du blister :
- Ne pas couper la feuille ou utiliser des instruments pointus pour retirer la gélule SPIRIVA de la plaquette thermoformée.
- Pliez 1 des coins du blister avec une flèche et séparez les couches de papier d'aluminium.
- Décollez la feuille imprimée jusqu'à ce que vous voyiez la totalité de la capsule SPIRIVA. (Voir Figure H)
- Si vous avez ouvert plus d'une ampoule à l'air libre, la gélule supplémentaire SPIRIVA 9mcg ne doit pas être utilisée et doit être jetée.
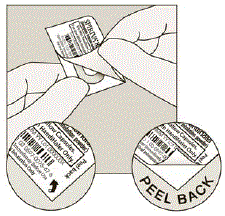
Chiffre H
Placez la capsule SPIRIVA 9mcg dans la chambre centrale de votre appareil HANDIHALER. (Voir figure 1)
Je figure
Fermez fermement l'embout buccal contre la base grise jusqu'à ce que vous entendiez un déclic. Laissez le capuchon anti-poussière (couvercle) ouvert. (Voir Figure J)
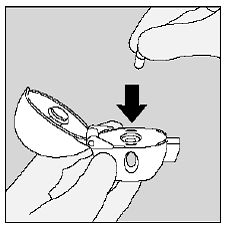
Figure J
Étape 3. Percer la gélule SPIRIVA 9mcg :
- Tenez votre appareil HANDIHALER avec l'embout buccal pointé vers le haut. (Voir Figure K)
- Appuyez une fois sur le bouton de perçage vert jusqu'à ce qu'il soit à plat (affleurant) contre la base, puis relâchez. C'est ainsi que vous percez des trous dans la gélule SPIRIVA afin que vous puissiez recevoir votre médicament lorsque vous inspirez.
- Ne pas appuyez plusieurs fois sur le bouton vert.
- Ne pas secouez votre appareil HANDIHALER.
- Le perçage de la gélule de SPIRIVA 9mcg peut produire de petites morceaux de gélatine. Certains de ces petits morceaux peuvent passer à travers l'écran de votre appareil HANDIHALER dans votre bouche ou votre gorge lorsque vous inspirez votre médicament. C'est normal. Les petits morceaux de gélatine ne doivent pas vous nuire.
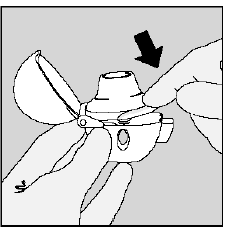
Figure K
Étape 4. Prendre votre dose quotidienne complète (2 inhalations de la même gélule SPIRIVA 9mcg) :
Expirez complètement en 1 respiration, vider vos poumons de tout air. (Voir Figure L)
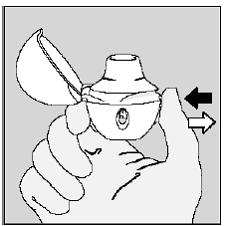
Chiffre L
Important : Ne pas respirez dans votre appareil HANDIHALER.
À votre prochaine respiration, prenez votre médicament :
- Maintenez votre tête en position verticale pendant que vous regardez droit devant vous. (Voir Figure M)
- Portez votre appareil HANDIHALER à votre bouche en position horizontale. Ne pas bloquer les bouches d'aération.
- Fermez bien vos lèvres autour de l'embout buccal.
- Inspirez profondément jusqu'à ce que vos poumons soient pleins. Tu devrais entendre ou sentir la capsule SPIRIVA vibrer (hochet). (Voir Figure M)
- Retenez votre souffle pendant quelques secondes et, en même temps, retirez votre appareil HANDIHALER de votre bouche.
- Respirez normalement à nouveau.
Figure M
Le hochet vous indique que vous avez bien inspiré. Si vous n'entendez pas ou ne sentez pas de râle, consultez la rubrique « Si vous n'entendez pas ou ne sentez pas le râle de la gélule SPIRIVA lorsque vous inspirez votre médicament.
Chiffre N
Pour obtenir votre dose quotidienne complète, vous devez à nouveau expirer complètement (Voir Figure N) et une deuxième fois, inspirer (Voir Figure O) à partir de la même capsule SPIRIVA.
Important : Ne pas appuyez à nouveau sur le bouton de perçage vert.
Chiffre O
Rappelles toi: Pour obtenir votre dose complète de médicament chaque jour, vous devez inspirer 2 fois la même capsule SPIRIVA 9mcg. Assurez-vous d'expirer complètement à chaque fois avant d'inspirer avec votre appareil HANDIHALER.
Entretien et stockage de votre SPIRIVA HANDIHALER :
Chiffre P
- Après avoir pris votre dose quotidienne, ouvrez l'embout buccal et versez la gélule SPIRIVA 9mcg usagée dans votre poubelle, sans la toucher.
- Retirez tout morceau de capsule SPIRIVA 9mcg ou toute accumulation de poudre SPIRIVA 9mcg en retournant votre appareil HANDIHALER et en le tapotant doucement mais fermement. (Voir Figure P) Ensuite, fermez l'embout buccal et le capuchon anti-poussière pour le stockage.
- Ne pas conservez votre appareil HANDIHALER et les gélules SPIRIVA 9mcg (blisters) dans un endroit humide. Conservez toujours les gélules de SPIRIVA dans les plaquettes scellées.
Si vous n'entendez pas ou ne sentez pas le cliquetis de la gélule SPIRIVA 9mcg lorsque vous inspirez votre médicament :
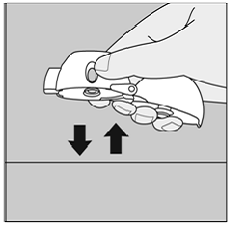
Chiffre Q
Ne pas appuyez à nouveau sur le bouton de perçage vert.
Tenez votre appareil HANDIHALER avec l'embout buccal pointé vers le haut et tapotez doucement votre appareil HANDIHALER sur une table. (Voir figure Q)
Vérifiez que l'embout buccal est complètement fermé. Expirez complètement avant d'inspirer à nouveau profondément avec l'embout buccal dans votre bouche. (Voir Figure O)
Si vous n'entendez ou ne sentez toujours pas le cliquetis de la gélule SPIRIVA après avoir répété les étapes ci-dessus :
- Jetez la capsule SPIRIVA.
- Ouvrez la base en soulevant le bouton de perçage vert et vérifiez la chambre centrale pour des morceaux de la capsule SPIRIVA 9mcg. Les morceaux de capsule SPIRIVA 9mcg dans la chambre centrale peuvent empêcher une capsule SPIRIVA 9mcg de vibrer.
- Retournez votre appareil HANDIHALER et tapotez doucement mais fermement pour retirer les morceaux de la capsule SPIRIVA. Appelez votre médecin pour obtenir des instructions.
Nettoyage de votre appareil HANDIHALER :
Nettoyez votre appareil HANDIHALER au besoin. (Voir Figure R)
- Il faut 24 heures pour sécher à l'air votre appareil HANDIHALER après l'avoir nettoyé.
- Ne pas utiliser des produits de nettoyage ou des détergents.
- Ne pas placez votre appareil HANDIHALER dans le lave-vaisselle pour le nettoyage.
Étapes de nettoyage :
- Ouvrez le capuchon anti-poussière et l'embout buccal.
- Ouvrez la base en soulevant le bouton de perçage vert.
- Regardez dans la chambre centrale pour les morceaux de capsule SPIRIVA 9mcg ou l'accumulation de poudre. Si vous le voyez, appuyez dessus.
- Rincez votre appareil HANDIHALER à l'eau tiède en appuyant plusieurs fois sur le bouton de perçage vert afin que la chambre centrale et l'aiguille de perçage soient sous l'eau courante. Vérifiez que toute accumulation de poudre ou tout morceau de capsule SPIRIVA a été retiré.
- Séchez bien votre appareil HANDIHALER en renversant l'excès d'eau sur une serviette en papier. Séchez ensuite à l'air libre, en laissant le capuchon anti-poussière, l'embout buccal et la base ouverts en l'étalant complètement pour qu'il sèche complètement.
- Ne pas utilisez un sèche-cheveux pour sécher votre appareil HANDIHALER.
- Ne pas utilisez votre appareil HANDIHALER lorsqu'il est mouillé. Si nécessaire, vous pouvez nettoyer l'extérieur de l'embout buccal avec un chiffon propre et humide.
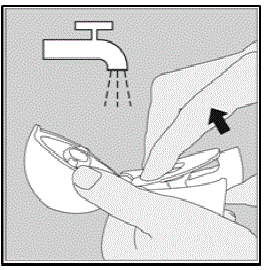
Figure R
Conseils utiles pour vous assurer que vous prenez correctement votre dose quotidienne complète de SPIRIVA 9mcg HANDIHALER :
- Presse le bouton perçant vert Une fois; Inspirez 2 fois; Expirez complètement avant chacune des 2 inhalations.
- Utilisez toujours le nouvel appareil HANDIHALER fourni avec votre médicament.
- Gardez votre appareil HANDIHALER avec l'embout buccal pointé vers le haut lorsque vous appuyez sur le bouton de perçage vert.
- Appuyez 1 fois sur le bouton de perçage vert pour percer la capsule SPIRIVA.
- N'expirez pas dans votre appareil HANDIHALER.
- Gardez votre appareil HANDIHALER en position horizontale et gardez la tête droite, regardant droit devant vous, lorsque vous inspirez.
- Vérifiez la chambre centrale de votre appareil HANDIHALER pour des morceaux de capsule SPIRIVA 9mcg ou une accumulation de poudre. Si des morceaux ou de la poudre sont visibles, tapotez avant utilisation.
- Nettoyez votre HANDIHALER au besoin et séchez-le soigneusement.
Pour plus d'informations, demandez à votre médecin ou à votre pharmacien, ou rendez-vous sur www.spiriva.com, ou scannez le code ci-dessous, ou appelez le 1-800-542-6257 ou (TTY) 1-800-459-9906.
Ce mode d'emploi a été approuvé par la Food and Drug Administration des États-Unis.
