Singulair 10mg, 4mg, 5mg Montelukast Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Singulair et comment est-il utilisé ?
Singulair 5 mg est un médicament délivré sur ordonnance utilisé pour traiter les symptômes de l'asthme, du bronchospasme induit par l'exercice et de la rhinite allergique ou perannuelle. Singulair peut être utilisé seul ou avec d'autres médicaments.
- Singulair appartient à une classe de médicaments appelés antagonistes des récepteurs des leucotriènes.
- On ne sait pas si Singulair est sûr et efficace chez les enfants de moins de 1 an.
Quels sont les effets secondaires possibles de Singulair ?
Singulair peut provoquer des effets secondaires graves, notamment :
- changements inhabituels d'humeur ou de comportement,
- démangeaison de la peau,
- ecchymoses,
- picotements intenses,
- engourdissement,
- la douleur,
- faiblesse musculaire,
- douleur à l'oreille,
- gonflement,
- chaleur,
- fièvre,
- mal de gorge,
- gonflement du visage ou de la langue,
- brûlant dans tes yeux, et
- douleur cutanée, suivie d'une éruption cutanée rouge ou violette qui s'étend au haut du corps et provoque des cloques et une desquamation
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Singulair incluent :
- Douleur d'estomac,
- diarrhée,
- fièvre,
- symptômes de la grippe,
- symptômes du rhume (nez bouché, douleurs sinusales, toux, mal de gorge),
- maux de tête, et
- pipi au lit ou perte de contrôle de la vessie chez les enfants
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Singulair. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
LA DESCRIPTION
Le montélukast sodique, principe actif de SINGULAIR 4 mg, est un antagoniste sélectif et actif par voie orale des récepteurs des leucotriènes qui inhibe le récepteur cystéinyl leucotriène CysLT1.
Le montélukast sodique est décrit chimiquement comme [R-(E)]-1-[[[1-[3-[2-(7-chloro-2-quinoléinyl)éthényl]phényl]-3-[2-(1-hydroxy Acide -1-méthyléthyl)phényl]propyl]thio]méthyl]cyclopropaneacétique, sel monosodique.
La formule empirique est C35H35ClNNaO3S et son poids moléculaire est de 608,18. La formule structurale est :
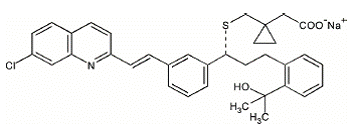
Le montélukast sodique est une poudre hygroscopique, optiquement active, blanche à blanc cassé. Le montélukast sodique est librement soluble dans l'éthanol, le méthanol et l'eau et pratiquement insoluble dans l'acétonitrile.
Chaque comprimé pelliculé SINGULAIR de 10 mg contient 10,4 mg de montelukast sodique, équivalent à 10 mg de montélukast, et les ingrédients inactifs suivants : cellulose microcristalline, lactose monohydraté, croscarmellose sodique, hydroxypropylcellulose et stéarate de magnésium. Le pelliculage est constitué d'hydroxypropylméthylcellulose, d'hydroxypropylcellulose, de dioxyde de titane, d'oxyde de fer rouge, d'oxyde de fer jaune et de cire de carnauba.
Chaque comprimé à croquer SINGULAIR de 4 mg et 5 mg contient respectivement 4,2 et 5,2 mg de montélukast sodique, équivalents à 4 et 5 mg de montélukast, respectivement. Les deux comprimés à croquer contiennent les ingrédients inactifs suivants : mannitol, cellulose microcristalline, hydroxypropylcellulose, oxyde de fer rouge, croscarmellose sodique, arôme de cerise, aspartame et stéarate de magnésium.
Chaque sachet de granulés oraux SINGULAIR 4 mg contient 4,2 mg de montelukast sodique, ce qui équivaut à 4 mg de montélukast. La formulation orale de granulés contient les ingrédients inactifs suivants : mannitol, hydroxypropylcellulose et stéarate de magnésium.
LES INDICATIONS
Asthme
SINGULAIR® est indiqué pour la prophylaxie et le traitement chronique de l'asthme chez les adultes et les enfants de 12 mois et plus.
Bronchoconstriction induite par l'exercice (EIB)
SINGULAIR est indiqué pour la prévention de la bronchoconstriction induite par l'exercice (BEI) chez les patients âgés de 6 ans et plus.
Rhinite allergique
SINGULAIR 10mg est indiqué pour le soulagement des symptômes de la rhinite allergique saisonnière chez les patients de 2 ans et plus et de la rhinite allergique perannuelle chez les patients de 6 mois et plus. Étant donné que les bénéfices de SINGULAIR 4 mg peuvent ne pas l'emporter sur le risque de symptômes neuropsychiatriques chez les patients atteints de rhinite allergique [voir AVERTISSEMENTS ET PRECAUTIONS ], réserver l'utilisation aux patients qui ont une réponse inadéquate ou une intolérance aux thérapies alternatives.
Limites d'utilisation
SINGULAIR n'est pas indiqué dans le traitement d'une crise d'asthme aiguë.
DOSAGE ET ADMINISTRATION
Asthme
Pour l'asthme, administrer SINGULAIR par voie orale une fois par jour le soir, avec ou sans nourriture. Il n'y a pas eu d'essais cliniques chez des patients asthmatiques pour évaluer l'efficacité relative de l'administration du matin par rapport à celle du soir.
Les doses suivantes sont recommandées :
Les patients qui oublient une dose doivent prendre la dose suivante à l'heure habituelle et ne doivent pas prendre 2 doses en même temps.
Bronchoconstriction induite par l'exercice (EIB)
Pour la prévention de l'EIB, administrer une dose unique de SINGULAIR 10 mg par voie orale au moins 2 heures, avant l'effort. Les doses suivantes sont recommandées :
Une dose supplémentaire de SINGULAIR ne doit pas être prise dans les 24 heures suivant une dose précédente. Les patients prenant déjà SINGULAIR quotidiennement pour une autre indication (y compris l'asthme chronique) ne doivent pas prendre de dose supplémentaire pour prévenir l'EIB. Tous les patients doivent avoir à leur disposition un bêta-agoniste à courte durée d'action.
L'administration quotidienne de SINGULAIR pour le traitement chronique de l'asthme n'a pas été établie pour prévenir les épisodes aigus d'EIB.
Rhinite allergique
Pour la rhinite allergique, administrer SINGULAIR 5 mg par voie orale une fois par jour sans tenir compte de l'heure d'ingestion des aliments. Le moment de l'administration chez les patients atteints de rhinite allergique peut être individualisé en fonction des besoins du patient.
Les doses suivantes pour le traitement des symptômes de la rhinite allergique saisonnière sont recommandées :
Tableau 3 : Posologie recommandée dans la rhinite allergique saisonnière
Les patients qui oublient une dose doivent prendre la dose suivante à l'heure habituelle et ne doivent pas prendre 2 doses en même temps.
Asthme et rhinite allergique
Pour les patients souffrant à la fois d'asthme et de rhinite allergique, administrer une seule dose de SINGULAIR par voie orale une fois par jour le soir.
Les patients qui oublient une dose doivent prendre la dose suivante à l'heure habituelle et ne doivent pas prendre 2 doses en même temps.
Instructions pour l'administration de granulés oraux
Les granulés oraux SINGULAIR 4 mg peuvent être administrés soit directement dans la bouche, dissous dans 1 cuillerée à café (5 ml) de lait maternisé ou de lait maternel froid ou à température ambiante, soit mélangés à une cuillerée d'aliments mous froids ou à température ambiante ; sur la base d'études de stabilité, seuls la compote de pommes, les carottes, le riz ou la crème glacée doivent être utilisés. Le paquet ne doit pas être ouvert avant d'être prêt à l'emploi. Après ouverture du paquet, la dose complète (avec ou sans mélange avec du lait maternisé, du lait maternel ou de la nourriture) doit être administrée dans les 15 minutes. En cas de mélange avec du lait maternisé, du lait maternel ou de la nourriture, les granulés oraux SINGULAIR 4 mg ne doivent pas être conservés pour une utilisation future. Jeter toute portion inutilisée. Les granulés oraux SINGULAIR ne sont pas destinés à être dissous dans un liquide autre que le lait maternisé ou le lait maternel pour administration. Cependant, des liquides peuvent être pris après l'administration. Les granules orales SINGULAIR peuvent être administrées indépendamment de l'heure des repas.
COMMENT FOURNIE
Formes posologiques et points forts
Comprimés
10 mg, comprimés pelliculés beiges, de forme carrée arrondie, portant le code MSD 117 sur une face et SINGULAIR 4 mg sur l'autre.
Tablette mastiquables
5 mg, rose, rond, de forme bi-convexe, avec le code MSD 275 d'un côté et SINGULAIR de l'autre.
Tablette mastiquables
4 mg, rose, ovale, de forme bi-convexe, avec le code MSD 711 d'un côté et SINGULAIR de l'autre.
Granulés oraux
4 mg, granulés blancs d'un poids net de 500 mg, emballés dans un emballage en aluminium avec sécurité enfant.
Stockage et manutention
SINGULAIR 4 mg Granulés Oraux : granulés blancs d'un poids net de 500 mg, emballés dans un emballage en aluminium avec sécurité enfant.
CDN 0006-3841-30 unité d'utilisation carton de 30 sachets.
SINGULAIR 4 mg Comprimés : comprimés à croquer roses, ovales, de forme bi-convexe, portant le code MSD 711 d'un côté et SINGULAIR 10mg de l'autre.
CDN 0006-1711-31 unité d'utilisation flacons en polyéthylène haute densité (HDPE) de 30 avec un bouchon de sécurité enfant en polypropylène, un joint d'induction en aluminium et un déshydratant de gel de silice.
SINGULAIR 5 mg Comprimés comprimés à croquer roses, ronds, de forme bi-convexe, portant le code MSD 275 d'un côté et SINGULAIR de l'autre.
CDN 0006-9275-31 unité d'utilisation flacons en polyéthylène haute densité (PEHD) de 30 avec un bouchon de sécurité enfant en polypropylène, un joint d'induction en aluminium et un déshydratant de gel de silice.
SINGULAIR 10 mg Comprimés : comprimés pelliculés beiges, de forme carrée arrondie, portant le code MSD 117 d'un côté et SINGULAIR 4 mg de l'autre.
CDN 0006-9117-31 unité d'utilisation flacons en polyéthylène haute densité (PEHD) de 30 avec un bouchon de sécurité enfant en polypropylène, un joint d'induction en aluminium et un déshydratant de gel de silice
CDN 0006-9117-54 Unité d'utilisation Flacons en polyéthylène haute densité (PEHD) de 90 avec un bouchon de sécurité enfant en polypropylène, un joint d'induction en aluminium et un déshydratant de gel de silice.
Stockage
Conserver SINGULAIR 4 mg granulés oraux, 4 mg comprimés à croquer, 5 mg comprimés à croquer et 10 mg comprimés pelliculés entre 20°C et 25°C (68°F à 77°F), excursions autorisées jusqu'à 15° C à 30°C (59°F à 86°F) [voir USP Température ambiante contrôlée]. Protégez de l'humidité et de la lumière. Conserver dans l'emballage d'origine.
Distribué par : Merck Sharp & Dohme Corp., une filiale de MERCK & CO., INC., Whitehouse Station, USA. Révisé : février 2021
EFFETS SECONDAIRES
Les effets indésirables cliniquement significatifs suivants sont décrits ailleurs dans l'étiquetage :
- Événements neuropsychiatriques [voir AVERTISSEMENTS ET PRECAUTIONS ]
Expérience des essais cliniques
Étant donné que les essais cliniques sont menés dans des conditions très variables, les taux d'effets indésirables observés dans les essais cliniques d'un médicament ne peuvent pas être directement comparés aux taux des essais cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique clinique. Dans la description suivante de l'expérience des essais cliniques, les effets indésirables sont répertoriés quelle que soit l'évaluation de la causalité.
Les effets indésirables les plus fréquents (incidence ≥ 5 % et supérieure au placebo ; répertoriés par ordre décroissant de fréquence) dans les essais cliniques contrôlés étaient : infection des voies respiratoires supérieures, fièvre, céphalée, pharyngite, toux, douleur abdominale, diarrhée, otite moyenne, grippe, rhinorrhée, sinusite, otite.
Adultes et adolescents de 15 ans et plus souffrant d'asthme
L'innocuité de SINGULAIR 10 mg a été évaluée chez environ 2 950 patients adultes et adolescents âgés de 15 ans et plus dans le cadre d'essais cliniques. Dans les essais cliniques contrôlés versus placebo, les effets indésirables suivants rapportés avec SINGULAIR 4 mg sont survenus chez au moins 1 % des patients et à une incidence supérieure à celle observée chez les patients traités par placebo :
La fréquence des effets indésirables moins fréquents était comparable entre SINGULAIR et le placebo.
Le profil de sécurité de SINGULAIR 10 mg, administré en dose unique pour la prévention de la BEI chez les patients adultes et adolescents de 15 ans et plus, était cohérent avec le profil de sécurité précédemment décrit pour SINGULAIR.
Au total, 569 patients ont été traités par SINGULAIR 10 mg pendant au moins 6 mois, 480 pendant un an et 49 pendant deux ans dans les essais cliniques. Avec un traitement prolongé, le profil des effets indésirables n'a pas changé de manière significative.
Patients pédiatriques de 6 à 14 ans souffrant d'asthme
L'innocuité de SINGULAIR 10 mg a été évaluée chez 476 patients pédiatriques âgés de 6 à 14 ans. Au total, 289 patients pédiatriques ont été traités par SINGULAIR 10 mg pendant au moins 6 mois et 241 pendant un an ou plus dans les essais cliniques. Le profil d'innocuité de SINGULAIR dans l'essai d'efficacité pédiatrique de 8 semaines en double aveugle était généralement similaire au profil d'innocuité chez l'adulte. Chez les patients pédiatriques âgés de 6 à 14 ans recevant SINGULAIR 5 mg, les réactions suivantes sont survenues avec une fréquence ≥ 2 % et plus fréquemment que chez les patients pédiatriques ayant reçu le placebo : pharyngite, grippe, fièvre, sinusite, nausées, diarrhée, dyspepsie, otite, infection virale et laryngite. La fréquence des effets indésirables moins fréquents était comparable entre SINGULAIR 4 mg et le placebo. Avec un traitement prolongé, le profil des effets indésirables n'a pas changé de manière significative.
Le profil de sécurité de SINGULAIR 4 mg, lorsqu'il est administré en dose unique pour la prévention de la BEI chez les patients pédiatriques âgés de 6 ans et plus, était cohérent avec le profil de sécurité précédemment décrit pour SINGULAIR.
Dans les études évaluant le taux de croissance, le profil de sécurité chez ces patients pédiatriques était cohérent avec le profil de sécurité précédemment décrit pour SINGULAIR. Dans une étude en double aveugle de 56 semaines évaluant le taux de croissance chez des patients pédiatriques âgés de 6 à 8 ans recevant SINGULAIR, les réactions suivantes non observées auparavant avec l'utilisation de SINGULAIR dans ce groupe d'âge sont survenues avec une fréquence ≥ 2 % et plus fréquemment que chez les patients pédiatriques ayant reçu le placebo : céphalées, rhinite (infectieuse), varicelle, gastro-entérite, dermatite atopique, bronchite aiguë, infection dentaire, infection cutanée et myopie.
Patients pédiatriques de 2 à 5 ans souffrant d'asthme
L'innocuité de SINGULAIR a été évaluée chez 573 patients pédiatriques âgés de 2 à 5 ans dans des études à dose unique et à doses multiples. Au total, 426 patients pédiatriques âgés de 2 à 5 ans ont été traités par SINGULAIR 10 mg pendant au moins 3 mois, 230 pendant 6 mois ou plus et 63 patients pendant un an ou plus dans les essais cliniques. Chez les patients pédiatriques âgés de 2 à 5 ans recevant SINGULAIR, les réactions suivantes sont survenues avec une fréquence ≥ 2 % et plus fréquemment que chez les patients pédiatriques ayant reçu le placebo : fièvre, toux, douleurs abdominales, diarrhée, céphalées, rhinorrhée, sinusite, otite, grippe, éruption cutanée, douleurs auriculaires, gastro-entérite, eczéma, urticaire, varicelle, pneumonie, dermatite et conjonctivite.
Patients pédiatriques âgés de 6 à 23 mois souffrant d'asthme
L'innocuité et l'efficacité chez les patients pédiatriques de moins de 12 mois souffrant d'asthme n'ont pas été établies.
L'innocuité de SINGULAIR 4 mg a été évaluée chez 175 patients pédiatriques âgés de 6 à 23 mois. Le profil de sécurité de SINGULAIR dans une étude clinique de 6 semaines, en double aveugle, contrôlée par placebo était généralement similaire au profil de sécurité chez les adultes et les patients pédiatriques âgés de 2 à 14 ans. Chez les patients pédiatriques âgés de 6 à 23 mois recevant SINGULAIR 5 mg, les réactions suivantes sont survenues avec une fréquence ≥ 2 % et plus fréquemment que chez les patients pédiatriques ayant reçu le placebo : infection des voies respiratoires supérieures, respiration sifflante ; otite moyenne; pharyngite, amygdalite, toux; et la rhinite. La fréquence des effets indésirables moins fréquents était comparable entre SINGULAIR et le placebo.
Adultes et adolescents de 15 ans et plus atteints de rhinite allergique saisonnière
L'innocuité de SINGULAIR a été évaluée chez 2199 patients adultes et adolescents âgés de 15 ans et plus dans des essais cliniques. SINGULAIR 10 mg administré une fois par jour le matin ou le soir a eu un profil de tolérance similaire à celui du placebo. Dans les essais cliniques contrôlés versus placebo, la réaction suivante a été rapportée avec SINGULAIR 5 mg avec une fréquence ≥ 1 % et à une incidence supérieure au placebo : infection des voies respiratoires supérieures, 1,9 % des patients recevant SINGULAIR 4 mg vs 1,5 % des patients recevant le placebo. Dans une étude clinique contrôlée par placebo de 4 semaines, le profil de sécurité était cohérent avec celui observé dans les études de 2 semaines. L'incidence de la somnolence était similaire à celle du placebo dans toutes les études.
Patients pédiatriques âgés de 2 à 14 ans atteints de rhinite allergique saisonnière
SINGULAIR 5 mg a été évalué chez 280 patients pédiatriques âgés de 2 à 14 ans dans une étude de sécurité de 2 semaines, multicentrique, en double aveugle, contrôlée par placebo, en groupes parallèles. SINGULAIR administré une fois par jour le soir a eu un profil de tolérance similaire à celui du placebo. Dans cette étude, les réactions suivantes sont survenues avec une fréquence ≥ 2 % et à une incidence supérieure au placebo : céphalées, otite moyenne, pharyngite et infection des voies respiratoires supérieures.
Adultes et adolescents de 15 ans et plus atteints de rhinite allergique perannuelle
L'innocuité de SINGULAIR a été évaluée chez 3357 patients adultes et adolescents âgés de 15 ans et plus atteints de rhinite allergique perannuelle, dont 1632 ont reçu SINGULAIR dans deux études cliniques de 6 semaines. SINGULAIR 10mg administré une fois par jour a eu un profil de tolérance cohérent avec celui observé chez les patients atteints de rhinite allergique saisonnière et similaire à celui du placebo. Dans ces deux études, les réactions suivantes ont été rapportées avec SINGULAIR avec une fréquence ≥ 1 % et à une incidence supérieure au placebo : sinusite, infection des voies respiratoires supérieures, céphalée sinusale, toux, épistaxis et augmentation des ALAT. L'incidence de la somnolence était similaire à celle du placebo.
Patients pédiatriques âgés de 6 mois à 14 ans atteints de rhinite allergique apériodique
L'innocuité chez les patients âgés de 2 à 14 ans atteints de rhinite allergique perannuelle est étayée par l'innocuité chez les patients âgés de 2 à 14 ans atteints de rhinite allergique saisonnière. La sécurité chez les patients âgés de 6 à 23 mois est étayée par des données provenant d'études pharmacocinétiques, de sécurité et d'efficacité dans l'asthme dans cette population pédiatrique et d'études pharmacocinétiques chez l'adulte.
Expérience post-commercialisation
Les effets indésirables suivants ont été identifiés lors de l'utilisation post-approbation de SINGULAIR. Étant donné que ces réactions sont signalées volontairement par une population de taille incertaine, il n'est pas toujours possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale avec l'exposition au médicament.
Troubles du système sanguin et lymphatique tendance hémorragique accrue, thrombocytopénie
Troubles du système immunitaire réactions d'hypersensibilité, y compris anaphylaxie, infiltration éosinophile hépatique
Troubles psychiatriques compris, mais sans s'y limiter, agitation, comportement agressif ou hostilité, anxiété, dépression, désorientation, troubles de l'attention, troubles du rêve, dysphémie (bégaiement), hallucinations, insomnie, irritabilité, troubles de la mémoire, symptômes obsessionnels compulsifs, agitation, somnambulisme, pensées et comportements suicidaires (y compris le suicide), tic et tremblement [voir AVERTISSEMENT ENCADRÉ , AVERTISSEMENTS ET PRECAUTIONS ]
Troubles du système nerveux somnolence, paresthésie/hypoesthésie, convulsions
Troubles cardiaques palpitations
Troubles respiratoires, thoraciques et médiastinaux épistaxis, éosinophilie pulmonaire
Problèmes gastro-intestinaux diarrhée, dyspepsie, nausées, pancréatite, vomissements
Affections hépatobiliaires Des cas d'hépatite cholestatique, d'atteinte hépatique hépatocellulaire et d'atteinte hépatique mixte ont été signalés chez des patients traités par SINGULAIR. La plupart d'entre eux sont survenus en association avec d'autres facteurs de confusion, tels que l'utilisation d'autres médicaments, ou lorsque SINGULAIR a été administré à des patients présentant un potentiel sous-jacent de maladie hépatique, telle que la consommation d'alcool ou d'autres formes d'hépatite.
Affections de la peau et du tissu sous-cutané œdème de Quincke, ecchymoses, érythème polymorphe, érythème noueux, prurit, syndrome de Stevens-Johnson/nécrolyse épidermique toxique, urticaire
Troubles musculo-squelettiques et du tissu conjonctif arthralgie, myalgie, y compris crampes musculaires
Troubles rénaux et urinaires énurésie chez les enfants
Troubles généraux et anomalies au site d'administration œdème
Les patients asthmatiques traités par SINGULAIR peuvent présenter une éosinophilie systémique, présentant parfois des caractéristiques cliniques de vascularite compatibles avec le syndrome de Churg-Strauss, une affection souvent traitée par une corticothérapie systémique. Ces réactions ont parfois été associées à la réduction de la corticothérapie orale. Les médecins doivent être attentifs à l'éosinophilie, à l'éruption vasculitique, à l'aggravation des symptômes pulmonaires, aux complications cardiaques et/ou à la neuropathie chez leurs patients [voir AVERTISSEMENTS ET PRECAUTIONS ].
INTERACTIONS MÉDICAMENTEUSES
Aucun ajustement posologique n'est nécessaire lorsque SINGULAIR 5 mg est co-administré avec la théophylline, la prednisone, la prednisolone, les contraceptifs oraux, la fexofénadine, la digoxine, la warfarine, le gemfibrozil, l'itraconazole, les hormones thyroïdiennes, les sédatifs hypnotiques, les anti-inflammatoires non stéroïdiens, les benzodiazépines, les décongestionnants, et inducteurs enzymatiques du cytochrome P450 (CYP) [voir PHARMACOLOGIE CLINIQUE ].
AVERTISSEMENTS
Inclus dans le cadre du "PRÉCAUTIONS" Section
PRÉCAUTIONS
Événements neuropsychiatriques
Des événements neuropsychiatriques (NP) graves ont été rapportés avec l'utilisation de SINGULAIR. Ces rapports post-commercialisation ont été très variables et comprenaient, mais sans s'y limiter, agitation, comportement agressif ou hostilité, anxiété, dépression, désorientation, troubles de l'attention, anomalies des rêves, dysphémie (bégaiement), hallucinations, insomnie, irritabilité, troubles de la mémoire, symptômes obsessionnels compulsifs, agitation, somnambulisme, pensées et comportements suicidaires (y compris le suicide), tic et tremblements. Des événements NP ont été signalés chez des patients adultes, adolescents et pédiatriques avec ou sans antécédents de troubles psychiatriques. Des événements NP ont été rapportés principalement pendant le traitement par SINGULAIR 10 mg, mais certains ont été rapportés après l'arrêt de SINGULAIR 5 mg. Des études animales ont montré que le montélukast se distribue dans le cerveau des rats [voir PHARMACOLOGIE CLINIQUE ] ; cependant, les mécanismes sous-jacents aux événements NP associés à SINGULAIR ne sont actuellement pas bien compris. Sur la base des données disponibles, il est difficile d'identifier les facteurs de risque ou de quantifier le risque d'événements NP avec l'utilisation de SINGULAIR 10 mg.
En raison du risque d'événements NP, les bénéfices de SINGULAIR peuvent ne pas l'emporter sur les risques chez certains patients, en particulier lorsque les symptômes de la maladie peuvent être légers et traités de manière adéquate avec des thérapies alternatives. Réserver l'utilisation de SINGULAIR 4mg aux patients atteints de rhinite allergique ayant une réponse inadéquate ou une intolérance aux thérapies alternatives [voir LES INDICATIONS ]. Chez les patients souffrant d'asthme ou de bronchoconstriction induite par l'effort, considérez les bénéfices et les risques avant de prescrire SINGULAIR.
Discutez des avantages et des risques de l'utilisation de SINGULAIR 10 mg avec les patients et les soignants lors de la prescription de SINGULAIR. Conseillez aux patients et/ou aux soignants d'être attentifs aux changements de comportement ou à l'apparition de nouveaux symptômes de NP lors de la prise de SINGULAIR. Si des changements de comportement sont observés, ou si de nouveaux symptômes de NP ou des pensées et/ou comportements suicidaires surviennent, conseiller aux patients d'arrêter SINGULAIR 10 mg et de contacter immédiatement un professionnel de la santé. Dans de nombreux cas, les symptômes ont disparu après l'arrêt du traitement par SINGULAIR ; cependant, dans certains cas, les symptômes ont persisté après l'arrêt de SINGULAIR. Par conséquent, continuez à surveiller et à fournir des soins de soutien jusqu'à ce que les symptômes disparaissent. Réévaluer les bénéfices et les risques de la reprise du traitement par SINGULAIR 10mg si de tels événements surviennent.
Asthme aigu
SINGULAIR n'est pas indiqué pour une utilisation dans l'inversion du bronchospasme dans les crises d'asthme aiguës, y compris l'état de mal asthmatique. Les patients doivent être informés qu'ils doivent disposer d'un médicament de secours approprié. Le traitement par SINGULAIR 4 mg peut être poursuivi pendant les exacerbations aiguës de l'asthme. Les patients qui ont des exacerbations de l'asthme après l'exercice doivent avoir à leur disposition un β-agoniste inhalé à courte durée d'action.
Utilisation concomitante de corticostéroïdes
Bien que la dose de corticoïde inhalé puisse être réduite progressivement sous surveillance médicale, SINGULAIR ne doit pas être substitué brutalement aux corticoïdes inhalés ou oraux.
Sensibilité à l'aspirine
Les patients présentant une sensibilité connue à l'aspirine doivent continuer à éviter l'aspirine ou les agents anti-inflammatoires non stéroïdiens pendant la prise de SINGULAIR. Bien que SINGULAIR soit efficace pour améliorer la fonction des voies respiratoires chez les asthmatiques présentant une sensibilité documentée à l'aspirine, il n'a pas été démontré qu'il tronquait la réponse bronchoconstrictrice à l'aspirine et aux autres anti-inflammatoires non stéroïdiens chez les patients asthmatiques sensibles à l'aspirine [voir Etudes cliniques ].
Conditions éosinophiles
Les patients asthmatiques traités par SINGULAIR peuvent présenter une éosinophilie systémique, présentant parfois des caractéristiques cliniques de vascularite compatibles avec le syndrome de Churg-Strauss, une affection souvent traitée par une corticothérapie systémique. Ces événements ont parfois été associés à la réduction de la corticothérapie orale. Les médecins doivent être attentifs à l'éosinophilie, à l'éruption vasculitique, à l'aggravation des symptômes pulmonaires, aux complications cardiaques et/ou à la neuropathie chez leurs patients. Une association causale entre SINGULAIR 10 mg et ces affections sous-jacentes n'a pas été établie [voir EFFETS INDÉSIRABLES ].
Risque chez les patients atteints de phénylcétonurie
SINGULAIR 4 mg contient de l'aspartam, source de phénylalanine. La phénylalanine peut être nocive pour les patients atteints de phénylcétonurie (PCU). Chaque comprimé à croquer de 4 mg et 5 mg contient respectivement 0,674 mg et 0,842 mg de phénylalanine. Avant de prescrire SINGULAIR à un patient atteint de PCU, tenez compte de la quantité quotidienne combinée de phénylalanine de toutes les sources, y compris SINGULAIR.
Informations sur les conseils aux patients
Pour les comprimés et les comprimés à croquer, conseillez au patient et/ou au soignant de lire l'étiquetage patient approuvé par la FDA ( Guide des médicaments ).
Pour les granulés oraux, conseillez au patient et/ou au soignant de lire l'étiquetage patient approuvé par la FDA ( Guide des médicaments et mode d'emploi ).
- Informer les patients du risque potentiel de symptômes neuropsychiatriques graves et de changements de comportement liés à l'utilisation de SINGULAIR [voir AVERTISSEMENTS ET PRECAUTIONS ].
- Discuter des bénéfices et des risques de SINGULAIR avec les patients lors de la prescription ou de la poursuite du traitement par SINGULAIR [voir AVERTISSEMENTS ET PRECAUTIONS ].
- Conseillez aux patients de surveiller les changements de comportement ou les symptômes neuropsychiatriques chez les patients prenant SINGULAIR [voir AVERTISSEMENTS ET PRECAUTIONS ].
- Demandez aux patients d'arrêter SINGULAIR et de contacter immédiatement un fournisseur de soins de santé si des changements de comportement ou de pensée qui ne sont pas typiques du patient se produisent, ou si le patient développe des idées suicidaires ou un comportement suicidaire [voir AVERTISSEMENTS ET PRECAUTIONS ].
- Conseillez aux patients de prendre SINGULAIR quotidiennement tel que prescrit, même lorsqu'ils sont asymptomatiques, ainsi qu'en période d'aggravation de l'asthme, et de contacter leur médecin si leur asthme n'est pas bien contrôlé.
- Aviser les patients que SINGULAIR oral n'est pas destiné au traitement des crises d'asthme aiguës. Ils doivent disposer de médicaments β-agonistes inhalés à courte durée d'action appropriés pour traiter les exacerbations de l'asthme. Les patients qui présentent des exacerbations d'asthme après un effort physique doivent être informés qu'ils doivent avoir à leur disposition un β-agoniste inhalé à courte durée d'action. L'administration quotidienne de SINGULAIR pour le traitement chronique de l'asthme n'a pas été établie pour prévenir les épisodes aigus d'EIB [voir AVERTISSEMENTS ET PRECAUTIONS ].
- Conseillez aux patients de consulter un médecin si des bronchodilatateurs inhalés à courte durée d'action sont nécessaires plus souvent que d'habitude, ou si plus que le nombre maximal d'inhalations de bronchodilatateurs à courte durée d'action prescrits pour une période de 24 heures sont nécessaires.
- Demandez aux patients de continuer à prendre les autres médicaments anti-asthmatiques prescrits, sauf indication contraire d'un médecin.
- Demandez aux patients présentant une sensibilité connue à l'aspirine de continuer à éviter l'aspirine ou les agents anti-inflammatoires non stéroïdiens pendant la prise de SINGULAIR [voir AVERTISSEMENTS ET PRECAUTIONS ].
- Informez les patients phénylcétonuriques que les comprimés à croquer de 4 mg et de 5 mg contiennent de la phénylalanine (une source d'aspartame) [voir AVERTISSEMENTS ET PRECAUTIONS ].
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Aucune preuve de tumorigénicité n'a été observée dans les études de cancérogénicité de 2 ans chez des rats Sprague-Dawley ou de 92 semaines chez des souris à des doses de gavage oral allant jusqu'à 200 mg/kg/jour ou 100 mg/kg/jour, respectivement. L'exposition estimée chez le rat était d'environ 120 et 75 fois l'ASC pour les adultes et les enfants, respectivement, à la dose orale quotidienne maximale recommandée. L'exposition estimée chez la souris était d'environ 45 et 25 fois l'ASC pour les adultes et les enfants, respectivement, à la dose orale quotidienne maximale recommandée.
Le montélukast n'a démontré aucune preuve d'activité mutagène ou clastogène dans les tests suivants : le test de mutagenèse microbienne, le test de mutagenèse sur cellules de mammifères V-79, le test d'élution alcaline dans les hépatocytes de rat, le test d'aberration chromosomique dans les cellules ovariennes de hamster chinois et dans le Essai d'aberration chromosomique de moelle osseuse de souris in vivo.
Dans des études de fertilité chez des rats femelles, le montélukast a entraîné des réductions des indices de fertilité et de fécondité à une dose orale de 200 mg/kg (l'exposition estimée était d'environ 70 fois l'ASC pour les adultes à la dose orale quotidienne maximale recommandée). Aucun effet sur la fertilité ou la fécondité des femelles n'a été observé à une dose orale de 100 mg/kg (l'exposition estimée était d'environ 20 fois l'ASC pour les adultes à la dose orale quotidienne maximale recommandée). Le montélukast n'a eu aucun effet sur la fertilité chez les rats mâles à des doses orales allant jusqu'à 800 mg/kg (l'exposition estimée était d'environ 160 fois l'ASC pour les adultes à la dose orale quotidienne maximale recommandée).
Utilisation dans des populations spécifiques
Grossesse
Résumé des risques
Les données disponibles issues d'études de cohorte prospectives et rétrospectives publiées sur des décennies d'utilisation de montélukast chez les femmes enceintes n'ont pas établi de risque associé au médicament d'anomalies congénitales majeures [voir Données ]. Dans les études de reproduction chez l'animal, aucun effet indésirable sur le développement n'a été observé lors de l'administration orale de montélukast à des rates et des lapines gestantes au cours de l'organogenèse à des doses d'environ 100 et 110 fois, respectivement, la dose orale quotidienne maximale recommandée chez l'homme (MRHDOD) basée sur les ASC [voir Données ].
Le risque de fond estimé de malformations congénitales majeures et de fausse couche pour la population indiquée est inconnu. Toutes les grossesses ont un risque de fond de malformation congénitale, de perte ou d'autres résultats indésirables. Dans le
Dans la population générale des États-Unis, le risque de fond estimé de malformations congénitales majeures et de fausse couche dans les grossesses cliniquement reconnues est de 2 à 4 % et de 15 à 20 %, respectivement.
Considérations cliniques
Risque maternel et/ou embryonnaire/fœtal associé à la maladie
Un asthme mal ou modérément contrôlé pendant la grossesse augmente le risque maternel d'effets indésirables périnatals tels que la prééclampsie et la prématurité du nourrisson, le faible poids à la naissance et la petite taille pour l'âge gestationnel.
Données
Données humaines
Les données publiées issues d'études de cohorte prospectives et rétrospectives n'ont pas identifié d'association avec l'utilisation de SINGULAIR pendant la grossesse et les malformations congénitales majeures. Les études disponibles présentent des limites méthodologiques, notamment une petite taille d'échantillon, dans certains cas une collecte de données rétrospective et des groupes de comparaison incohérents.
Données animales
Dans des études sur le développement embryo-fœtal, le montélukast administré à des rats et lapins gravides au cours de l'organogenèse (jours de gestation 6 à 17 chez le rat et 6 à 18 chez le lapin) n'a provoqué aucun effet indésirable sur le développement à des doses orales maternelles allant jusqu'à 400 et 300 mg/kg. /jour chez le rat et le lapin, respectivement (environ 100 et 110 fois l'ASC chez l'homme à la MRHDOD, respectivement).
Lactation
Résumé des risques
Une étude clinique publiée sur l'allaitement rapporte la présence de montélukast dans le lait maternel. Les données disponibles sur les effets du médicament sur les nourrissons, soit directement [voir Utilisation pédiatrique ou via le lait maternel, ne suggèrent pas de risque significatif d'effets indésirables liés à l'exposition à SINGULAIR. Les effets du médicament sur la production de lait sont inconnus. Les bénéfices de l'allaitement sur le développement et la santé doivent être pris en compte, ainsi que le besoin clinique de SINGULAIR 5 mg pour la mère et tout effet indésirable potentiel sur le nourrisson allaité à partir de SINGULAIR 10 mg ou de l'affection maternelle sous-jacente.
Utilisation pédiatrique
L'innocuité et l'efficacité de SINGULAIR pour l'asthme ont été établies chez les patients pédiatriques âgés de 6 à 14 ans. L'utilisation de SINGULAIR 4mg pour cette indication est étayée par des preuves issues d'études bien contrôlées. Les données d'innocuité et d'efficacité dans ce groupe d'âge sont similaires à celles observées chez les adultes [voir EFFETS INDÉSIRABLES , PHARMACOLOGIE CLINIQUE , Populations spécifiques , et Etudes cliniques ].
L'efficacité de SINGULAIR pour le traitement de la rhinite allergique saisonnière chez les patients pédiatriques de 2 à 14 ans et pour le traitement de la rhinite allergique perannuelle chez les patients pédiatriques de 6 mois à 14 ans a été établie et est étayée par extrapolation à partir de l'efficacité démontrée chez les patients de 15 ans et plus atteints de rhinite allergique ainsi que l'hypothèse selon laquelle l'évolution de la maladie, la physiopathologie et l'effet du médicament sont sensiblement similaires parmi ces populations.
La sécurité de SINGULAIR 4 mg comprimés à croquer chez les patients pédiatriques asthmatiques âgés de 2 à 5 ans a été démontrée par des données adéquates et bien contrôlées [voir EFFETS INDÉSIRABLES ]. L'efficacité de SINGULAIR 5 mg dans ce groupe d'âge est extrapolée à partir de l'efficacité démontrée chez les patients asthmatiques âgés de 6 ans et plus et est basée sur des données pharmacocinétiques similaires, ainsi que sur l'hypothèse que l'évolution de la maladie, la physiopathologie et l'effet du médicament sont sensiblement similaires. parmi ces populations. L'efficacité dans ce groupe d'âge est étayée par des évaluations d'efficacité exploratoires issues d'une vaste étude d'innocuité bien contrôlée menée chez des patients âgés de 2 à 5 ans.

La sécurité de SINGULAIR 4 mg granulés oraux chez les patients pédiatriques asthmatiques âgés de 12 à 23 mois a été démontrée dans une analyse portant sur 172 patients pédiatriques, dont 124 traités par SINGULAIR, dans le cadre d'une étude placebo de 6 semaines en double aveugle. -étude contrôlée [voir EFFETS INDÉSIRABLES ]. L'efficacité de SINGULAIR dans ce groupe d'âge est extrapolée à partir de l'efficacité démontrée chez les patients asthmatiques âgés de 6 ans et plus sur la base d'une exposition systémique moyenne (ASC) similaire, et du fait que l'évolution de la maladie, la physiopathologie et l'effet du médicament sont sensiblement similaires parmi ces populations , étayées par des données d'efficacité provenant d'un essai d'innocuité dans lequel l'efficacité était une évaluation exploratoire.
La sécurité de SINGULAIR 4 mg et 5 mg comprimés à croquer chez les patients pédiatriques âgés de 2 à 14 ans atteints de rhinite allergique est étayée par des données provenant d'études menées chez des patients pédiatriques âgés de 2 à 14 ans souffrant d'asthme. Une étude d'innocuité chez des patients pédiatriques âgés de 2 à 14 ans atteints de rhinite allergique saisonnière a démontré un profil d'innocuité similaire [voir EFFETS INDÉSIRABLES ]. La sécurité de SINGULAIR 4 mg granulés oraux chez les patients pédiatriques âgés de 6 mois à peine atteints de rhinite allergique perannuelle est étayée par une extrapolation à partir des données de sécurité obtenues à partir d'études menées chez des patients pédiatriques âgés de 6 mois à 23 mois souffrant d'asthme et de données pharmacocinétiques comparant les expositions systémiques chez les patients âgés de 6 mois à 23 mois aux expositions systémiques chez les adultes.
La sécurité et l'efficacité chez les patients pédiatriques âgés de moins de 12 mois souffrant d'asthme, de 6 mois avec une rhinite allergique perannuelle et de 6 ans avec une bronchoconstriction induite par l'exercice n'ont pas été établies.
Taux de croissance chez les patients pédiatriques
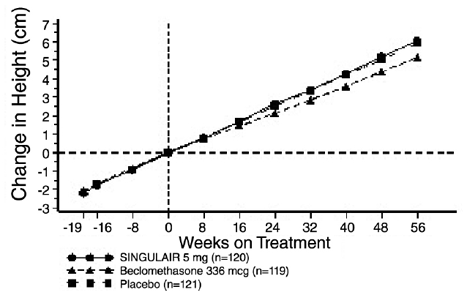
Une étude de 56 semaines, multicentrique, en double aveugle, randomisée, contrôlée contre comparateur actif et contre placebo a été menée pour évaluer l'effet de SINGULAIR 4 mg sur le taux de croissance chez 360 patients asthmatiques légers, âgés de 6 à 8 ans. Les groupes de traitement comprenaient SINGULAIR 5 mg une fois par jour, un placebo et le dipropionate de béclométhasone administré à raison de 168 mcg deux fois par jour avec un dispositif d'espacement. Pour chaque sujet, un taux de croissance a été défini comme la pente d'une ligne de régression linéaire ajustée aux mesures de taille sur 56 semaines. La principale comparaison était la différence des taux de croissance entre les groupes SINGULAIR et placebo. Les taux de croissance, exprimés en moyenne des moindres carrés (LS) (IC à 95 %) en cm/an, pour les groupes de traitement SINGULAIR, placebo et béclométhasone étaient de 5,67 (5,46, 5,88), 5,64 (5,42, 5,86) et 4,86 ( 4.64, 5.08), respectivement. Les différences de taux de croissance, exprimées en moyenne des moindres carrés (MC) (IC à 95 %) en cm/an, pour les groupes de traitement SINGULAIR 5 mg moins placebo, béclométhasone moins placebo et SINGULAIR 5 mg moins béclométhasone étaient de 0,03 (-0,26 ; 0,31). , -0,78 (-1,06, -0,49); et 0,81 (0,53, 1,09), respectivement. Le taux de croissance (exprimé en tant que changement moyen de taille au fil du temps) pour chaque groupe de traitement est illustré à la FIGURE 1.
Figure 1 : Changement de taille (cm) depuis la visite de randomisation par semaine programmée (moyenne du groupe de traitement ± erreur standard* de la moyenne)
Utilisation gériatrique
Sur le nombre total de sujets ayant participé aux études cliniques sur le montélukast, 3,5 % étaient âgés de 65 ans et plus et 0,4 % étaient âgés de 75 ans et plus. Aucune différence globale d'innocuité ou d'efficacité n'a été observée entre ces sujets et les sujets plus jeunes, et d'autres expériences cliniques rapportées n'ont pas identifié de différences dans les réponses entre les patients âgés et les patients plus jeunes, mais une plus grande sensibilité de certains individus plus âgés ne peut être exclue. Le profil pharmacocinétique et la biodisponibilité orale d'une dose orale unique de 10 mg de montélukast sont similaires chez les adultes âgés et jeunes. La demi-vie plasmatique du montélukast est légèrement plus longue chez les personnes âgées. Aucun ajustement posologique chez les personnes âgées n'est nécessaire.
Insuffisance hépatique
Aucun ajustement posologique n'est recommandé chez les patients présentant une insuffisance hépatique légère à modérée [voir PHARMACOLOGIE CLINIQUE ].
Insuffisance rénale
Aucun ajustement posologique n'est recommandé chez les insuffisants rénaux [voir PHARMACOLOGIE CLINIQUE ].
SURDOSAGE
Aucune information spécifique n'est disponible sur le traitement d'un surdosage avec SINGULAIR. En cas de surdosage, il est raisonnable d'employer les mesures de soutien habituelles ; par exemple, retirer le matériau non absorbé du tractus gastro-intestinal, effectuer une surveillance clinique et instituer une thérapie de soutien, si nécessaire. On ne sait pas si le montélukast est éliminé par dialyse péritonéale ou hémodialyse.
CONTRE-INDICATIONS
SINGULAIR est contre-indiqué chez les patients présentant une hypersensibilité à l'un de ses composants.
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
Les leucotriènes cystéiniques (LTC4, LTD4, LTE4) sont des produits du métabolisme de l'acide arachidonique et sont libérés par diverses cellules, notamment les mastocytes et les éosinophiles. Ces eicosanoïdes se lient aux récepteurs des cystéinyl leucotriènes (CysLT). Le récepteur CysLT de type 1 (CysLT1) se trouve dans les voies respiratoires humaines (y compris les cellules musculaires lisses des voies respiratoires et les macrophages des voies respiratoires) et sur d'autres cellules pro-inflammatoires (y compris les éosinophiles et certaines cellules souches myéloïdes). Les CysLT ont été corrélées avec la physiopathologie de l'asthme et de la rhinite allergique. Dans l'asthme, les effets médiés par les leucotriènes comprennent l'œdème des voies respiratoires, la contraction des muscles lisses et une activité cellulaire altérée associée au processus inflammatoire. Dans la rhinite allergique, les CysLT sont libérées de la muqueuse nasale après exposition à des allergènes au cours des réactions de phase précoce et tardive et sont associées aux symptômes de la rhinite allergique.
Le montélukast est un composé actif par voie orale qui se lie avec une affinité et une sélectivité élevées au récepteur CysLT1 (de préférence à d'autres récepteurs des voies respiratoires pharmacologiquement importants, tels que les récepteurs prostanoïdes, cholinergiques ou β-adrénergiques). Le montélukast inhibe les actions physiologiques de LTD4 au niveau du récepteur CysLT1 sans aucune activité agoniste.
Pharmacodynamie
Le montélukast provoque une inhibition des récepteurs des cystéinylleucotriènes des voies respiratoires, comme en témoigne sa capacité à inhiber la bronchoconstriction due au LTD4 inhalé chez les asthmatiques. Des doses aussi faibles que 5 mg provoquent un blocage substantiel de la bronchoconstriction induite par le LTD4. Dans une étude croisée contrôlée contre placebo (n = 12), SINGULAIR 4 mg a inhibé la bronchoconstriction de phase précoce et tardive due à une provocation antigénique de 75 % et 57 %, respectivement.
L'effet de SINGULAIR 5 mg sur les éosinophiles du sang périphérique a été examiné dans des essais cliniques. Chez les patients asthmatiques âgés de 2 ans et plus ayant reçu SINGULAIR 10 mg, une diminution du nombre moyen d'éosinophiles dans le sang périphérique allant de 9 % à 15 % a été notée, par rapport au placebo, au cours des périodes de traitement en double aveugle. Chez les patients atteints de rhinite allergique saisonnière âgés de 15 ans et plus ayant reçu SINGULAIR 4 mg, une augmentation moyenne de 0,2 % du nombre d'éosinophiles dans le sang périphérique a été notée, contre une augmentation moyenne de 12,5 % chez les patients traités par placebo, au cours du traitement en double aveugle. périodes; cela traduit un écart moyen de 12,3% en faveur de SINGULAIR. La relation entre ces observations et les bénéfices cliniques du montélukast notés dans les essais cliniques n'est pas connue [voir Etudes cliniques ].
Pharmacocinétique
Absorption
Le montélukast est rapidement absorbé après administration orale. Après administration du comprimé pelliculé de 10 mg à des adultes à jeun, le pic moyen de concentration plasmatique de montelukast (Cmax) est atteint en 3 à 4 heures (Tmax). La biodisponibilité orale moyenne est de 64 %. La biodisponibilité orale et la Cmax ne sont pas influencées par un repas standard le matin.
Pour le comprimé à croquer de 5 mg, la Cmax moyenne est atteinte en 2 à 2,5 heures après administration chez l'adulte à jeun. La biodisponibilité orale moyenne est de 73 % à jeun contre 63 % en cas d'administration avec un repas standard le matin.
Pour le comprimé à croquer de 4 mg, la Cmax moyenne est atteinte 2 heures après l'administration chez les patients pédiatriques âgés de 2 à 5 ans à jeun.
La formulation orale de granulés de 4 mg est bioéquivalente au comprimé à croquer de 4 mg lorsqu'elle est administrée à des adultes à jeun. La co-administration de la formulation orale de granulés avec de la compote de pommes n'a pas eu d'effet cliniquement significatif sur la pharmacocinétique du montélukast. Un repas riche en graisses le matin n'a pas affecté l'ASC des granules orales de montélukast ; cependant, le repas a diminué la Cmax de 35 % et prolongé le Tmax de 2,3 ± 1,0 heures à 6,4 ± 2,9 heures.
La sécurité et l'efficacité de SINGULAIR chez les patients asthmatiques ont été démontrées dans des essais cliniques au cours desquels les formulations de comprimés pelliculés à 10 mg et de comprimés à croquer à 5 mg ont été administrées le soir sans tenir compte de l'heure d'ingestion des aliments. La sécurité de SINGULAIR 4 mg chez les patients asthmatiques a également été démontrée dans des essais cliniques au cours desquels les formulations comprimé à croquer 4 mg et granulés oraux 4 mg ont été administrées le soir sans tenir compte de l'heure d'ingestion des aliments. La sécurité et l'efficacité de SINGULAIR chez les patients atteints de rhinite allergique saisonnière ont été démontrées dans des essais cliniques dans lesquels le comprimé pelliculé de 10 mg a été administré le matin ou le soir sans tenir compte de l'heure de la prise alimentaire.
La pharmacocinétique comparative du montélukast administré sous forme de deux comprimés à croquer de 5 mg versus un comprimé pelliculé de 10 mg n'a pas été évaluée.
Distribution
Le montélukast est lié à plus de 99 % aux protéines plasmatiques. Le volume de distribution à l'état d'équilibre du montélukast est en moyenne de 8 à 11 litres. Le montelukast administré par voie orale se distribue dans le cerveau des rats.
Élimination
La clairance plasmatique du montélukast est en moyenne de 45 ml/min chez l'adulte en bonne santé. Après administration orale d'une dose de montélukast radiomarqué, 86 % de la radioactivité a été récupérée dans les selles de 5 jours et moins de 0,2 % a été récupérée dans l'urine. Couplé aux estimations de la biodisponibilité orale du montélukast, cela indique que le montélukast et ses métabolites sont excrétés presque exclusivement par la bile.
Dans plusieurs études, la demi-vie plasmatique moyenne du montélukast variait de 2,7 à 5,5 heures chez de jeunes adultes en bonne santé. La pharmacocinétique du montélukast est presque linéaire pour des doses orales allant jusqu'à 50 mg. Lors d'une administration uniquotidienne de montélukast à 10 mg, il y a peu d'accumulation de la molécule mère dans le plasma (14 %).
Métabolisme
Le montélukast est largement métabolisé. Dans les études à doses thérapeutiques, les concentrations plasmatiques des métabolites du montélukast sont indétectables à l'état d'équilibre chez les adultes et les patients pédiatriques.
Des études in vitro utilisant des microsomes hépatiques humains indiquent que les CYP3A4, 2C8 et 2C9 sont impliqués dans le métabolisme du montélukast. Aux concentrations cliniquement pertinentes, le 2C8 semble jouer un rôle majeur dans le métabolisme du montélukast.
Populations spécifiques
Patients atteints d'insuffisance hépatique
Les patients présentant une insuffisance hépatique légère à modérée et des signes cliniques de cirrhose présentaient des signes de diminution du métabolisme du montélukast entraînant une augmentation de 41 % (IC à 90 % = 7 %, 85 %) de l'ASC moyenne du montelukast après une dose unique de 10 mg. L'élimination du montélukast a été légèrement prolongée par rapport à celle des sujets sains (demi-vie moyenne de 7,4 heures). Aucun ajustement posologique n'est nécessaire chez les patients présentant une insuffisance hépatique légère à modérée. La pharmacocinétique de SINGULAIR chez les patients présentant une insuffisance hépatique plus sévère ou une hépatite n'a pas été évaluée.
Patients atteints d'insuffisance rénale
Le montélukast et ses métabolites n'étant pas excrétés dans les urines, la pharmacocinétique du montélukast n'a pas été évaluée chez les insuffisants rénaux. Aucun ajustement posologique n'est recommandé chez ces patients.
Patients masculins et féminins
La pharmacocinétique du montélukast est similaire chez les hommes et les femmes.
Groupes raciaux
Les différences pharmacocinétiques dues à la race n'ont pas été étudiées.
Adolescents et patients pédiatriques
Les études pharmacocinétiques ont évalué l'exposition systémique de la formulation de granulés oraux à 4 mg chez les patients pédiatriques âgés de 6 à 23 mois, les comprimés à croquer à 4 mg chez les patients pédiatriques âgés de 2 à 5 ans, les comprimés à croquer à 5 mg chez les patients pédiatriques 6 à 14 ans, et les comprimés pelliculés de 10 mg chez les jeunes adultes et les adolescents ≥ 15 ans.
Le profil des concentrations plasmatiques du montélukast après administration du comprimé pelliculé de 10 mg est similaire chez les adolescents ≥ 15 ans et les jeunes adultes. Le comprimé pelliculé de 10 mg est recommandé chez les patients âgés de ≥ 15 ans.
L'exposition systémique moyenne du comprimé à croquer de 4 mg chez les patients pédiatriques de 2 à 5 ans et des comprimés à croquer de 5 mg chez les patients pédiatriques de 6 à 14 ans est similaire à l'exposition systémique moyenne du film de 10 mg. comprimé enrobé chez l'adulte. Le comprimé à croquer de 5 mg doit être utilisé chez les patients pédiatriques de 6 à 14 ans et le comprimé à croquer de 4 mg doit être utilisé chez les patients pédiatriques de 2 à 5 ans.
Chez les enfants de 6 à 11 mois, l'exposition systémique au montélukast et la variabilité des concentrations plasmatiques de montélukast ont été supérieures à celles observées chez l'adulte. D'après les analyses de population, l'ASC moyenne (4 296 ng•h/mL [intervalle de 1 200 à 7 153]) était supérieure de 60 % et la Cmax moyenne (667 ng/mL [intervalle de 201 à 1 058]) était supérieure de 89 % à celles observées chez adultes (ASC moyenne de 2 689 ng•h/mL [intervalle de 1 521 à 4 595]) et Cmax moyenne (353 ng/mL [intervalle de 180 à 548]). L'exposition systémique chez les enfants de 12 à 23 mois était moins variable, mais était tout de même supérieure à celle observée chez les adultes. L'ASC moyenne (3 574 ng•h/mL [intervalle de 2 229 à 5 408]) était supérieure de 33 % et la Cmax moyenne (562 ng/mL [intervalle de 296 à 814]) était supérieure de 60 % à celles observées chez les adultes. L'innocuité et la tolérabilité du montélukast dans une étude pharmacocinétique à dose unique chez 26 enfants âgés de 6 à 23 mois étaient similaires à celles des patients de deux ans et plus [voir EFFETS INDÉSIRABLES ]. La formulation de granulés oraux de 4 mg doit être utilisée chez les patients pédiatriques âgés de 12 à 23 mois pour le traitement de l'asthme ou chez les patients pédiatriques âgés de 6 à 23 mois pour le traitement de la rhinite allergique perannuelle. Étant donné que la formulation de granulés oraux de 4 mg est bioéquivalente au comprimé à croquer de 4 mg, elle peut également être utilisée comme formulation alternative au comprimé à croquer de 4 mg chez les patients pédiatriques âgés de 2 à 5 ans.
Études sur les interactions médicamenteuses
Théophylline, prednisone et prednisolone
SINGULAIR a été administré avec d'autres thérapies couramment utilisées dans la prophylaxie et le traitement chronique de l'asthme sans augmentation apparente des effets indésirables. Dans les études d'interactions médicamenteuses, la dose clinique recommandée de montélukast n'a pas eu d'effet cliniquement important sur la pharmacocinétique des médicaments suivants : théophylline, prednisone et prednisolone.
Le montélukast à une dose de 10 mg une fois par jour jusqu'à l'état d'équilibre pharmacocinétique n'a pas provoqué de modifications cliniquement significatives de la cinétique d'une dose intraveineuse unique de théophylline [principalement un substrat du cytochrome P450 (CYP) 1A2]. Le montélukast à des doses ≥ 100 mg par jour jusqu'à l'état d'équilibre pharmacocinétique n'a entraîné aucune modification cliniquement significative des profils plasmatiques de la prednisone ou de la prednisolone après l'administration de prednisone par voie orale ou de prednisolone par voie intraveineuse.
Contraceptifs oraux, fexofénadine, digoxine et warfarine
Dans les études sur les interactions médicamenteuses, la dose clinique recommandée de montélukast n'a pas eu d'effet cliniquement important sur la pharmacocinétique des médicaments suivants : contraceptifs oraux (noréthindrone 1 mg/éthinylestradiol 35 mcg), digoxine et warfarine. Le montélukast à des doses ≥ 100 mg par jour jusqu'à l'état d'équilibre pharmacocinétique n'a pas significativement modifié les concentrations plasmatiques de l'un ou l'autre des composants d'un contraceptif oral contenant 1 mg de noréthindrone/35 mcg d'éthinylestradiol. Le montélukast à la dose de 10 mg une fois par jour jusqu'à l'état d'équilibre pharmacocinétique n'a pas modifié le profil de concentration plasmatique de la fexofénadine, n'a pas modifié le profil pharmacocinétique ou l'excrétion urinaire de la digoxine immunoréactive ; n'a pas modifié le profil pharmacocinétique de la warfarine (principalement un substrat des CYP2C9, 3A4 et 1A2) ni influencé l'effet d'une dose orale unique de 30 mg de warfarine sur le temps de prothrombine ou le rapport international normalisé (INR).
Hormones thyroïdiennes, hypnotiques sédatifs, agents anti-inflammatoires non stéroïdiens, benzodiazépines et décongestionnants
Bien qu'aucune autre étude d'interaction spécifique n'ait été réalisée, SINGULAIR a été utilisé en concomitance avec un large éventail de médicaments couramment prescrits dans des études cliniques sans preuve d'interactions indésirables cliniques. Ces médicaments comprenaient des hormones thyroïdiennes, des hypnotiques sédatifs, des agents anti-inflammatoires non stéroïdiens, des benzodiazépines et des décongestionnants.
Inducteurs enzymatiques du cytochrome P450 (CYP)
Le phénobarbital, qui induit le métabolisme hépatique, a diminué l'aire sous la courbe de concentration plasmatique (ASC) du montélukast d'environ 40 % après une dose unique de 10 mg de montélukast. Aucun ajustement posologique de SINGULAIR n'est recommandé. Il est raisonnable d'employer une surveillance clinique appropriée lorsque des inducteurs enzymatiques puissants du CYP, tels que le phénobarbital ou la rifampicine, sont co-administrés avec SINGULAIR.
Effet du montélukast sur les enzymes du cytochrome P450 (CYP)
Le montélukast est un puissant inhibiteur du CYP2C8 in vitro. Cependant, les données d'une étude clinique sur les interactions médicamenteuses impliquant le montélukast et la rosiglitazone (un substrat de sonde représentatif des médicaments principalement métabolisés par le CYP2C8) chez 12 personnes en bonne santé ont démontré que la pharmacocinétique de la rosiglitazone n'est pas altérée lorsque les médicaments sont co-administrés, ce qui indique que le montélukast n'inhibe pas le CYP2C8 in vivo. Par conséquent, le montélukast ne devrait pas modifier le métabolisme des médicaments métabolisés par cette enzyme (p. ex., paclitaxel, rosiglitazone et répaglinide). D'après d'autres résultats in vitro sur des microsomes hépatiques humains, les concentrations plasmatiques thérapeutiques de montélukast n'inhibent pas les CYP 3A4, 2C9, 1A2, 2A6, 2C19 ou 2D6.
Inhibiteurs des enzymes du cytochrome P450 (CYP)
Des études in vitro ont montré que le montélukast est un substrat des CYP 2C8, 2C9 et 3A4. L'administration concomitante de montélukast et d'itraconazole, un puissant inhibiteur du CYP 3A4, n'a entraîné aucune augmentation significative de l'exposition systémique au montélukast. Les données d'une étude clinique sur les interactions médicamenteuses impliquant le montélukast et le gemfibrozil (un inhibiteur des CYP 2C8 et 2C9) ont démontré que le gemfibrozil, à une dose thérapeutique, augmentait de 4,4 fois l'exposition systémique au montélukast. L'administration concomitante d'itraconazole, de gemfibrozil et de montélukast n'a pas augmenté davantage l'exposition systémique au montélukast. D'après l'expérience clinique disponible, aucun ajustement posologique du montélukast n'est nécessaire en cas de co-administration avec le gemfibrozil [voir SURDOSAGE ].
Etudes cliniques
Asthme
Adultes et adolescents de 15 ans et plus souffrant d'asthme
Des essais cliniques menés chez des adultes et des adolescents de 15 ans et plus ont démontré qu'il n'y a aucun avantage clinique supplémentaire à des doses de montélukast supérieures à 10 mg une fois par jour.
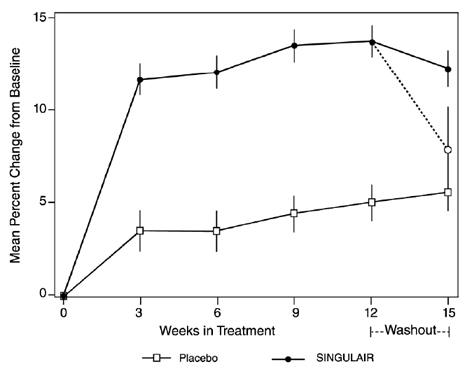
L'efficacité de SINGULAIR pour le traitement chronique de l'asthme chez les adultes et les adolescents de 15 ans et plus a été démontrée dans deux essais (américains et multinationaux) de conception similaire, randomisés, à double insu et contrôlés par placebo d'une durée de 12 semaines chez 1 576 patients ( 795 traités avec SINGULAIR, 530 traités avec un placebo et 251 traités avec un contrôle actif). L'âge médian était de 33 ans (intervalle de 15 à 85 ans) ; 56,8 % étaient des femmes et 43,2 % étaient des hommes. La répartition ethnique/raciale dans ces études était de 71,6 % de race blanche, 17,7 % d'hispanique, 7,2 % d'autres origines et 3,5 % de race noire. Les patients souffraient d'asthme léger ou modéré et étaient des non-fumeurs qui nécessitaient environ 5 bouffées de β-agoniste inhalé par jour sur une base « au besoin ». Les patients avaient un pourcentage de base moyen du volume expiratoire maximal prévu en 1 seconde (FEV1) de 66 % (intervalle approximatif, 40 à 90 %). Les co-critères d'évaluation principaux de ces essais étaient le VEMS et les symptômes d'asthme diurnes. Dans les deux études, après 12 semaines, un sous-groupe aléatoire de patients recevant SINGULAIR 5 mg a été remplacé par un placebo pendant 3 semaines supplémentaires de traitement en double aveugle afin d'évaluer d'éventuels effets de rebond.
Les résultats de l'essai américain sur le critère d'évaluation principal, le VEMS du matin, exprimés en pourcentage moyen de variation par rapport à la valeur initiale sur la période de traitement de 12 semaines, sont présentés dans la FIGURE 2. Par rapport au placebo, le traitement par un comprimé de SINGULAIR à 10 mg par jour dans la soirée a entraîné une augmentation statistiquement significative du pourcentage de variation du VEMS par rapport au départ (changement de 13,0 % dans le groupe traité par SINGULAIR 4 mg contre changement de 4,2 % dans le groupe placebo, p
Figure 2 : Variation moyenne en pourcentage du VEMS par rapport au départ (essai américain : SINGULAIR 5 mg N=406 ; placebo N=270) (modèle ANOVA)
L'effet de SINGULAIR 5 mg sur les autres critères de jugement principaux et secondaires, représentés par l'étude multinationale, est présenté dans le TABLEAU 6. Les résultats sur ces critères de jugement étaient similaires dans l'étude américaine.
Les deux études ont évalué l'effet de SINGULAIR 4 mg sur les critères de jugement secondaires, y compris la crise d'asthme (utilisation des ressources de soins de santé telles qu'une visite imprévue au cabinet d'un médecin, aux urgences ou à l'hôpital ; ou un traitement par voie orale, intraveineuse ou corticostéroïde intramusculaire) et l'utilisation de corticostéroïdes oraux pour le sauvetage de l'asthme. Dans l'étude multinationale, significativement moins de patients (15,6 % des patients) sous SINGULAIR ont présenté des crises d'asthme par rapport aux patients sous placebo (27,3 %, p
Début d'action et maintien des effets
Dans chaque essai contrôlé par placebo chez l'adulte, l'effet du traitement de SINGULAIR 4 mg, mesuré par les paramètres de la carte journalière quotidienne, y compris les scores de symptômes, l'utilisation de β-agonistes "au besoin" et les mesures du PEFR, a été obtenu après la première dose et s'est maintenu tout au long de l'intervalle de dosage (24 heures). Aucun changement significatif de l'effet du traitement n'a été observé lors de l'administration continue d'une prise par jour le soir dans les essais de prolongation non contrôlés par placebo jusqu'à un an. L'arrêt de SINGULAIR 4mg chez les patients asthmatiques après 12 semaines d'utilisation continue n'a pas entraîné d'aggravation rebond de l'asthme.
Patients pédiatriques de 6 à 14 ans souffrant d'asthme
L'efficacité de SINGULAIR 5 mg chez les patients pédiatriques âgés de 6 à 14 ans a été démontrée dans un essai de 8 semaines, en double aveugle, contrôlé par placebo chez 336 patients (201 traités par SINGULAIR et 135 traités par placebo) utilisant un β-agoniste inhalé. sur une base "au besoin". Les patients avaient un VEMS moyen prédit au départ de 72 % (intervalle approximatif, 45 à 90 %) et un besoin quotidien moyen en β-agonistes inhalés de 3,4 bouffées d'albutérol. Environ 36 % des patients étaient sous corticoïdes inhalés. L'âge médian était de 11 ans (intervalle de 6 à 15 ans) ; 35,4 % étaient des femmes et 64,6 % étaient des hommes. La répartition ethnique/raciale dans cette étude était de 80,1 % de race blanche, 12,8 % de race noire, 4,5 % d'origine hispanique et 2,7 % d'autres origines.
Par rapport au placebo, le traitement par un comprimé à croquer de 5 mg de SINGULAIR à 4 mg par jour a entraîné une amélioration significative de la variation moyenne en pourcentage du VEMS matinal par rapport à l'inclusion (8,7 % dans le groupe traité par SINGULAIR à 4 mg contre 4,2 % de variation par rapport à l'inclusion dans le groupe placebo, p
Comme dans les études chez l'adulte, aucun changement significatif de l'effet du traitement n'a été observé lors de l'administration continue une fois par jour dans un essai d'extension en ouvert sans groupe placebo simultané pendant une durée allant jusqu'à 6 mois.
Patients pédiatriques de 2 à 5 ans souffrant d'asthme
L'efficacité de SINGULAIR pour le traitement chronique de l'asthme chez les patients pédiatriques âgés de 2 à 5 ans a été explorée dans une étude de sécurité et de tolérance de 12 semaines, contrôlée contre placebo, chez 689 patients, dont 461 ont été traités par SINGULAIR. L'âge médian était de 4 ans (intervalle de 2 à 6 ans) ; 41,5 % étaient des femmes et 58,5 % étaient des hommes. La répartition ethnique/raciale dans cette étude était de 56,5 % de race blanche, 20,9 % d'origine hispanique, 14,4 % d'autres origines et 8,3 % de race noire.
Alors que l'objectif principal était de déterminer l'innocuité et la tolérabilité de SINGULAIR 10 mg dans ce groupe d'âge, l'étude comprenait des évaluations exploratoires de l'efficacité, y compris des scores de symptômes d'asthme diurnes et nocturnes, l'utilisation de β-agonistes, le sauvetage de corticostéroïdes oraux et l'évaluation globale du médecin. Les résultats de ces évaluations exploratoires d'efficacité, ainsi que la pharmacocinétique et l'extrapolation des données d'efficacité de patients âgés, étayent la conclusion générale selon laquelle SINGULAIR est efficace dans le traitement d'entretien de l'asthme chez les patients âgés de 2 à 5 ans.
Effets chez les patients prenant des corticostéroïdes inhalés concomitants
Des essais distincts menés chez l'adulte ont évalué la capacité de SINGULAIR 10 mg à renforcer l'effet clinique des corticoïdes inhalés et à permettre une diminution progressive des corticoïdes inhalés en cas d'utilisation concomitante.
Un essai randomisé, contrôlé par placebo et en groupes parallèles (n = 226) a recruté des adultes souffrant d'asthme stable avec un VEMS moyen d'environ 84 % de la valeur prédite qui étaient précédemment maintenus sous divers corticostéroïdes inhalés (administrés par aérosol-doseur ou inhalateurs à poudre sèche). ). L'âge médian était de 41,5 ans (intervalle de 16 à 70 ans) ; 52,2 % étaient des femmes et 47,8 % étaient des hommes. La répartition ethnique/raciale dans cette étude était de 92,0 % de race blanche, 3,5 % de race noire, 2,2 % d'hispanique et 2,2 % d'Asie. Les types de corticostéroïdes inhalés et leurs besoins initiaux moyens comprenaient le dipropionate de béclométhasone (dose moyenne, 1 203 mcg/jour), l'acétonide de triamcinolone (dose moyenne, 2 004 mcg/jour), le flunisolide (dose moyenne, 1 971 mcg/jour), le propionate de fluticasone (dose moyenne, dose, 1083 mcg/jour), ou budésonide (dose moyenne, 1192 mcg/jour). Certains de ces corticostéroïdes inhalés étaient des formulations non approuvées par les États-Unis et les doses exprimées peuvent ne pas être ex-actionneur. Les besoins en corticostéroïdes inhalés avant l'étude ont été réduits d'environ 37 % au cours d'une période de rodage avec placebo de 5 à 7 semaines conçue pour titrer les patients vers leur plus faible dose efficace de corticostéroïdes inhalés. Le traitement par SINGULAIR 4 mg a entraîné une réduction supplémentaire de 47 % de la dose moyenne de corticostéroïdes inhalés par rapport à une réduction moyenne de 30 % dans le groupe placebo sur la période de traitement actif de 12 semaines (p ≤ 0,05). On ne sait pas si les résultats de cette étude peuvent être généralisés aux patients asthmatiques nécessitant des doses plus élevées de corticoïdes inhalés ou de corticoïdes systémiques.
Dans un autre essai randomisé, contrôlé versus placebo, en groupes parallèles (n=642) dans une population similaire de patients adultes précédemment maintenus, mais insuffisamment contrôlés, sous corticoïdes inhalés (béclométhasone 336 mcg/j), l'ajout de SINGULAIR à la béclométhasone a entraîné d'améliorations statistiquement significatives du VEMS par rapport aux patients qui ont poursuivi la béclométhasone seule ou aux patients qui ont arrêté la béclométhasone et ont été traités par montelukast ou un placebo seul au cours des 10 dernières semaines de la période de traitement de 16 semaines en aveugle. Les patients randomisés dans les bras de traitement contenant de la béclométhasone présentaient un meilleur contrôle de l'asthme statistiquement significatif que les patients randomisés dans SINGULAIR seul ou le placebo seul, comme indiqué par le VEMS, les symptômes d'asthme diurnes, le PEFR, les réveils nocturnes dus à l'asthme et la β- « au besoin ». exigences agonistes.
Chez des patients adultes asthmatiques présentant une sensibilité documentée à l'aspirine et recevant de manière concomitante des corticoïdes inhalés et/ou oraux, un essai randomisé en groupes parallèles de 4 semaines (n=80) a démontré que SINGULAIR 10 mg, par rapport au placebo, entraînait dans une amélioration significative des paramètres de contrôle de l'asthme. L'ampleur de l'effet de SINGULAIR 4 mg chez les patients sensibles à l'aspirine était similaire à l'effet observé dans la population générale des patients asthmatiques étudiés. L'effet de SINGULAIR sur la réponse bronchoconstrictrice à l'aspirine ou à d'autres anti-inflammatoires non stéroïdiens chez les patients asthmatiques sensibles à l'aspirine n'a pas été évalué [voir AVERTISSEMENTS ET PRECAUTIONS ].
Bronchoconstriction induite par l'exercice (EIB)
Bronchoconstriction induite par l'exercice (adultes, adolescents et patients pédiatriques de 6 ans et plus)
L'efficacité de SINGULAIR 5mg, 10 mg, lorsqu'il est administré en une seule dose 2 heures avant l'exercice pour la prévention de la BEI a été étudiée dans trois études croisées (américaines et multinationales), randomisées, en double aveugle, contrôlées par placebo qui comprenaient un total de 160 patients adultes et adolescents de 15 ans et plus atteints d'EIB. Des tests de provocation à l'effort ont été effectués 2 heures, 8,5 ou 12 heures et 24 heures après l'administration d'une dose unique du médicament à l'étude (SINGULAIR 10 mg ou placebo). Le critère d'évaluation principal était la chute maximale moyenne en pourcentage du VEMS après le défi d'exercice post-dose de 2 heures dans les trois études (étude A, étude B et étude C). Dans l'étude A, une dose unique de SINGULAIR 10 mg a démontré un bénéfice protecteur statistiquement significatif contre l'EIB lorsqu'elle est prise 2 heures avant l'exercice. Certains patients ont été protégés de l'EIB à 8,5 et 24 heures après l'administration ; cependant, certains patients ne l'étaient pas. Les résultats pour le pourcentage maximal moyen de chute à chaque instant dans l'étude A sont présentés dans le TABLEAU 7 et sont représentatifs des résultats des deux autres études.
L'efficacité de SINGULAIR 5 mg comprimés à croquer, lorsqu'il est administré en une seule dose 2 heures avant l'exercice pour la prévention de la BEI, a été étudiée dans une étude croisée multinationale, randomisée, en double aveugle, contrôlée par placebo qui a inclus un total de 64 patients pédiatriques. patients âgés de 6 à 14 ans atteints d'EIB. Des tests de provocation à l'effort ont été effectués 2 heures et 24 heures après l'administration d'une dose unique du médicament à l'étude (SINGULAIR 5 mg ou placebo). Le critère d'évaluation principal était la chute maximale moyenne en pourcentage du VEMS après le défi d'exercice post-dose de 2 heures. Une dose unique de SINGULAIR 5 mg a démontré un bénéfice protecteur statistiquement significatif contre l'EIB lorsqu'elle est prise 2 heures avant l'effort (TABLEAU 8). Des résultats similaires ont été observés 24 heures après l'administration de la dose (critère d'évaluation secondaire). Certains patients ont été protégés de l'EIB 24 heures après l'administration ; cependant, certains patients ne l'étaient pas. Aucun point temporel n'a été évalué entre 2 et 24 heures après l'administration de la dose.
L'efficacité de SINGULAIR 5 mg dans la prévention de la BEI chez les patients de moins de 6 ans n'a pas été établie.
L'administration quotidienne de SINGULAIR 4 mg dans le traitement chronique de l'asthme n'a pas été établie pour prévenir les épisodes aigus d'EIB.
Dans une étude de 12 semaines, randomisée, en double aveugle et en groupes parallèles portant sur 110 asthmatiques adultes et adolescents âgés de 15 ans et plus, avec un VEMS initial moyen de 83 % et une exacerbation documentée de l'asthme induite par l'exercice, le traitement avec SINGULAIR, 10 mg, une fois par jour le soir, a entraîné une réduction statistiquement significative du pourcentage maximal moyen de chute du VEMS et du temps moyen de récupération à moins de 5 % du VEMS avant l'exercice. L'épreuve d'exercice a été effectuée à la fin de l'intervalle de dosage (c'est-à-dire 20 à 24 heures après la dose précédente). Cet effet s'est maintenu tout au long de la période de traitement de 12 semaines, ce qui indique qu'il n'y a pas eu de tolérance. SINGULAIR 4 mg n'a cependant pas empêché une détérioration cliniquement significative du pourcentage maximal de chute du VEMS après l'exercice (c'est-à-dire une diminution ≥ 20 % par rapport à la valeur initiale avant l'exercice) chez 52 % des patients étudiés. Dans une étude croisée distincte menée chez des adultes, un effet similaire a été observé après deux doses de 10 mg une fois par jour de SINGULAIR.
Chez les patients pédiatriques âgés de 6 à 14 ans, utilisant le comprimé à croquer de 5 mg, une étude croisée de 2 jours a démontré des effets similaires à ceux observés chez les adultes lorsque le défi à l'exercice a été effectué à la fin de l'intervalle posologique (c.-à-d. 20 à 24 heures après la dose précédente).
Rhinite allergique (saisonnière et pérenne)
Rhinite allergique saisonnière
L'efficacité des comprimés SINGULAIR pour le traitement de la rhinite allergique saisonnière a été étudiée dans 5 essais de conception similaire, randomisés, en double aveugle, en groupes parallèles, contrôlés par placebo et contre comparateur actif (loratadine) menés en Amérique du Nord. Les 5 essais ont inclus un total de 5029 patients, dont 1799 ont été traités avec les comprimés SINGULAIR. Les patients étaient âgés de 15 à 82 ans avec des antécédents de rhinite allergique saisonnière, un test cutané positif à au moins un allergène saisonnier pertinent et des symptômes actifs de rhinite allergique saisonnière à l'entrée dans l'étude.
La période de traitement randomisé était de 2 semaines dans 4 essais et de 4 semaines dans un essai. La principale variable de résultat était la variation moyenne par rapport au départ du score des symptômes nasaux diurnes (la moyenne des scores individuels de congestion nasale, de rhinorrhée, de démangeaisons nasales, d'éternuements) telle qu'évaluée par les patients sur une échelle catégorielle de 0 à 3.
Quatre des cinq essais ont montré une réduction significative des scores de symptômes nasaux diurnes avec les comprimés SINGULAIR 10 mg par rapport au placebo. Les résultats d'un essai sont présentés ci-dessous. L'âge médian dans cet essai était de 35,0 ans (intervalle de 15 à 81 ans) ; 65,4 % étaient des femmes et 34,6 % étaient des hommes. La répartition ethnique/raciale dans cette étude était de 83,1 % de race blanche, 6,4 % d'autres origines, 5,8 % de race noire et 4,8 % d'origine hispanique. Les variations moyennes par rapport à l'inclusion du score des symptômes nasaux diurnes dans les groupes de traitement ayant reçu des comprimés de SINGULAIR 4 mg, de la loratadine et un placebo sont présentées dans le TABLEAU 9. Les trois autres essais ayant démontré une efficacité ont donné des résultats similaires. L'efficacité a été démontrée dans la rhinite allergique saisonnière lorsque le montélukast était administré le matin ou le soir.
Rhinite allergique perannuelle
L'efficacité de SINGULAIR 5mg comprimés dans le traitement de la rhinite allergique perannuelle a été étudiée dans 2 études randomisées, en double aveugle, contrôlées versus placebo menées en Amérique du Nord et en Europe. Les deux études ont inclus un total de 3 357 patients, dont 1 632 ont reçu des comprimés de SINGULAIR à 10 mg. Patients âgés de 15 à 82 ans atteints de rhinite allergique perannuelle confirmée par des antécédents et un test cutané positif à au moins un allergène perannuel pertinent (acariens, squames animales et/ou spores de moisissures), qui présentaient des symptômes actifs au moment de l'étude entrée, ont été inscrits.
Dans l'étude où l'efficacité a été démontrée, l'âge médian était de 35 ans (intervalle de 15 à 81 ans) ; 64,1 % étaient des femmes et 35,9 % étaient des hommes. La répartition ethnique/raciale dans cette étude était de 83,2 % de race blanche, 8,1 % de race noire, 5,4 % d'origine hispanique, 2,3 % d'origine asiatique et 1,0 % d'autres origines. Il a été démontré que SINGULAIR 10 mg, comprimés une fois par jour, réduit significativement les symptômes de la rhinite allergique perannuelle sur une période de traitement de 6 semaines (TABLEAU 10) ; dans cette étude, la principale variable de résultat était la variation moyenne par rapport au départ du score des symptômes nasaux diurnes (la moyenne des scores individuels de congestion nasale, de rhinorrhée et d'éternuements).
L'autre étude de 6 semaines a évalué SINGULAIR 10 mg (n = 626), un placebo (n = 609) et un contrôle actif (cétirizine 10 mg ; n = 120). L'analyse principale a comparé la variation moyenne par rapport à l'inclusion du score des symptômes nasaux diurnes pour SINGULAIR par rapport au placebo au cours des 4 premières semaines de traitement ; l'étude n'a pas été conçue pour une comparaison statistique entre SINGULAIR et le contrôle actif. La principale variable de résultat comprenait les démangeaisons nasales en plus de la congestion nasale, de la rhinorrhée et des éternuements. La différence estimée entre SINGULAIR et le placebo était de -0,04 avec un IC à 95 % de (-0,09 ; 0,01). La différence estimée entre le contrôle actif et le placebo était de -0,10 avec un IC à 95 % de (-0,19, -0,01).
INFORMATIONS PATIENTS
SINGULAIR® (SING-u-lair)(montélukast sodique) comprimés à croquer
Quelles sont les informations les plus importantes que je devrais connaître sur SINGULAIR 4 mg ?Des problèmes de santé mentale graves sont survenus chez des personnes prenant SINGULAIR ou même après l'arrêt du traitement.
Cela peut se produire chez les personnes avec ou sans antécédents de problèmes de santé mentale. Arrêtez de prendre SINGULAIR et informez immédiatement votre professionnel de la santé si vous ou votre enfant présentez des changements inhabituels de comportement ou de pensée, y compris l'un de ces symptômes :
- agitation, y compris comportement agressif ou hostilité
- problèmes d'attention
- rêves mauvais ou vifs
- la dépression
- désorientation (confusion)
- se sentir anxieux
- irritabilité
- hallucinations (voir ou entendre des choses qui ne sont pas vraiment là)
- problèmes de mémoire
- symptômes obsessionnels compulsifs
- agitation
- somnambulisme
- bégaiement
- pensées et actions suicidaires (y compris le suicide)
- tremblement
- troubles du sommeil
- mouvements musculaires incontrôlés
Qu'est-ce que SINGULAIR 10 mg ?
SINGULAIR 4 mg est un médicament délivré sur ordonnance qui bloque les substances présentes dans l'organisme appelées leucotriènes. Cela peut aider à améliorer les symptômes de l'asthme et l'inflammation de la muqueuse du nez (rhinite allergique). SINGULAIR ne contient pas de stéroïde. SINGULAIR est utilisé pour :
- les allergies extérieures survenant une partie de l'année (rhinite allergique saisonnière) chez l'adulte et l'enfant à partir de 2 ans, et
- les allergies intérieures qui surviennent toute l'année (rhinite allergique perannuelle) chez les adultes et les enfants âgés de 6 mois et plus.
Ne pas prenez SINGULAIR si vous êtes allergique à l'un de ses composants. Voir la fin de ce Guide des médicaments pour une liste complète des ingrédients de SINGULAIR.
Avant de prendre SINGULAIR 4 mg, informez votre professionnel de la santé de toutes vos conditions médicales, y compris si vous :
- sont allergiques à l'aspirine.
- souffrez de phénylcétonurie. Les comprimés à croquer SINGULAIR contiennent de l'aspartam, une source de phénylalanine.
- avez ou avez eu des problèmes de santé mentale.
- êtes enceinte ou envisagez de devenir enceinte. Parlez-en à votre professionnel de la santé si vous êtes enceinte ou envisagez de le devenir, SINGULAIR 4 mg peut ne pas vous convenir.
- allaitez ou envisagez d'allaiter. On ne sait pas si SINGULAIR passe dans votre lait maternel. Discutez avec votre professionnel de la santé de la meilleure façon de nourrir votre bébé pendant que vous prenez SINGULAIR.
Informez votre fournisseur de soins de santé de tous les médicaments que vous prenez, y compris les médicaments sur ordonnance et en vente libre, les vitamines et les suppléments à base de plantes. Certains médicaments peuvent affecter l'action de SINGULAIR, ou SINGULAIR 4 mg peut affecter l'action de vos autres médicaments.
Comment dois-je prendre SINGULAIR 10 mg ?
Pour quelqu'un qui prend SINGULAIR :
- Lire le détail Mode d'emploi fourni avec les granules orales SINGULAIR.
- Prenez SINGULAIR 4 mg exactement comme prescrit par votre professionnel de la santé. Votre professionnel de la santé vous indiquera la quantité de SINGULAIR à prendre et quand le prendre.
- Arrêtez de prendre SINGULAIR 5 mg et informez immédiatement votre professionnel de la santé si vous ou votre enfant présentez des changements inhabituels dans le comportement ou la pensée.
- Vous pouvez prendre SINGULAIR 5 mg avec ou sans aliments. Voir la rubrique "Comment puis-je donner les granules orales SINGULAIR à mon enfant ?" dans le Mode d'emploi pour savoir quels aliments et liquides peuvent être pris avec SINGULAIR 10mg granulés oraux.
- Si vous ou votre enfant oubliez une dose de SINGULAIR, prenez simplement la dose suivante à l'heure habituelle. Ne prenez pas 2 doses en même temps.
- Si vous avez pris trop de SINGULAIR, appelez immédiatement votre professionnel de la santé.
Pour les adultes et les enfants de 12 mois et plus souffrant d'asthme :
- Prendre SINGULAIR 1 fois par jour, le soir. Continuez à prendre SINGULAIR 5 mg tous les jours aussi longtemps que votre médecin vous l'a prescrit, même si vous ne présentez aucun symptôme d'asthme.
- Informez immédiatement votre fournisseur de soins de santé si vos symptômes d'asthme s'aggravent ou si vous devez utiliser votre inhalateur de secours plus souvent pour les crises d'asthme.
- Ayez toujours votre inhalateur de secours avec vous pour les crises d'asthme.
- Continuez à prendre vos autres médicaments contre l'asthme comme prescrit, à moins que votre professionnel de la santé ne vous dise de modifier la façon dont vous prenez ces médicaments.
Pour les personnes de 6 ans et plus pour la prévention de l'asthme d'effort :
- Prenez SINGULAIR au moins 2 heures avant l'effort.
- Ayez toujours votre inhalateur de secours avec vous pour les crises d'asthme.
- Si vous prenez SINGULAIR 10mg tous les jours pour un asthme chronique ou une rhinite allergique, ne pas prendre une autre dose pour prévenir l'asthme d'effort. Discutez avec votre fournisseur de soins de santé de votre traitement contre l'asthme d'effort.
- Ne pas prendre 2 doses de SINGULAIR 5 mg dans les 24 heures (1 jour).
Pour toute personne de 2 ans et plus atteinte de rhinite allergique saisonnière, ou pour toute personne de 6 mois et plus atteinte de rhinite allergique perannuelle :
- Prenez SINGULAIR 1 fois par jour, à peu près à la même heure chaque jour.
Que dois-je éviter lors de la prise de SINGULAIR 10 mg ?
Si vous souffrez d'asthme et que l'aspirine aggrave vos symptômes d'asthme, continuez à éviter de prendre de l'aspirine ou d'autres médicaments appelés anti-inflammatoires non stéroïdiens (AINS) pendant que vous prenez SINGULAIR.
Quels sont les effets secondaires possibles de SINGULAIR ?
SINGULAIR peut provoquer des effets indésirables graves, notamment :
- Voir "Quelles sont les informations les plus importantes que je devrais connaître sur SINGULAIR 4mg ?"
- Augmentation de certains globules blancs (éosinophiles) et possible inflammation des vaisseaux sanguins dans tout le corps (vascularite systémique). Rarement, cela peut se produire chez les personnes asthmatiques qui prennent SINGULAIR. Cela se produit parfois chez les personnes qui prennent également un médicament stéroïdien par voie orale qui est arrêté ou dont la dose est réduite.
Informez immédiatement votre fournisseur de soins de santé si vous présentez un ou plusieurs de ces symptômes :
- une sensation d'épingles et d'aiguilles ou un engourdissement des bras ou des jambes
- une maladie pseudo-grippale
- éruption
- inflammation sévère (douleur et gonflement) des sinus (sinusite)
Les effets secondaires les plus courants de SINGULAIR incluent :
- infection respiratoire supérieure
- fièvre
- mal de tête
- mal de gorge
- toux
- Douleur d'estomac
- diarrhée
- mal d'oreille ou infection de l'oreille
- grippe
- nez qui coule
- Infection des sinus
Ce ne sont pas tous les effets secondaires possibles de SINGULAIR. Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
Comment dois-je conserver SINGULAIR ?
- Conservez SINGULAIR 10mg à température ambiante entre 68°F et 77°F (20°C et 25°C).
- Conservez SINGULAIR 4mg dans son emballage.
- Conservez SINGULAIR 4mg dans un endroit sec et à l'abri de la lumière.
- Gardez SINGULAIR et tous les médicaments hors de portée des enfants.
Informations générales sur l'utilisation sûre et efficace de SINGULAIR.
Les médicaments sont parfois prescrits à des fins autres que celles énumérées dans un guide des médicaments. Ne pas utiliser SINGULAIR pour une affection pour laquelle il n'a pas été prescrit. Ne donnez pas SINGULAIR à d'autres personnes même si elles présentent les mêmes symptômes que vous. Cela peut leur nuire.
Vous pouvez demander à votre pharmacien ou à votre professionnel de la santé des informations sur SINGULAIR 10 mg destinées aux professionnels de la santé.
Quels sont les ingrédients de SINGULAIR ?
Ingrédient actif: montélukast sodique
Ingrédients inactifs:
- Granulés oraux de 4 mg : mannitol, hydroxypropylcellulose et stéarate de magnésium.
- Comprimés à croquer de 4 mg et 5 mg : mannitol, cellulose microcristalline, hydroxypropylcellulose, oxyde de fer rouge, croscarmellose sodique, arôme de cerise, aspartame et stéarate de magnésium.
- Personnes atteintes de phénylcétonurie : SINGULAIR 4 mg comprimés à croquer contiennent 0,674 mg de phénylalanine et SINGULAIR 5 mg comprimés à croquer contiennent 0,842 mg de phénylalanine.
- Comprimé de 10 mg : cellulose microcristalline, lactose monohydraté, croscarmellose sodique, hydroxypropylcellulose et stéarate de magnésium. Le pelliculage contient : hydroxypropylméthylcellulose, hydroxypropylcellulose, dioxyde de titane, oxyde de fer rouge, oxyde de fer jaune et cire de carnauba.
Mode d'emploi
SINGULAIR® (SING-u-lair)(montélukast sodique) granulés oraux
Cette notice d'utilisation contient des informations sur l'utilisation de SINGULAIR 10mg granulés oraux.
Une information important:
- Avant d'administrer une dose de granulés oraux SINGULAIR, lisez attentivement ce mode d'emploi pour vous assurer de préparer et d'administrer correctement les granulés oraux.
- Donnez les granulés oraux SINGULAIR à votre enfant exactement comme indiqué par votre professionnel de la santé.
- Arrêtez de donner SINGULAIR 5 mg et informez immédiatement votre professionnel de la santé si votre enfant présente des changements inhabituels de comportement ou de pensée.
- Continuez à donner à votre enfant ses médicaments contre l'asthme comme prescrit, à moins que votre fournisseur de soins de santé ne vous dise de changer la façon dont vous donnez ces médicaments.
- Vous pouvez donner SINGULAIR 5 mg granulés oraux avec ou sans aliments.
Comment puis-je donner SINGULAIR 4mg granulés oraux à mon enfant ?
- Ne pas ouvrir le paquet jusqu'au moment de l'utiliser.
- Il existe différentes manières d'administrer SINGULAIR 4 mg granulés oraux. Vous devez choisir la meilleure méthode pour votre enfant :
- droit dans la bouche
- dissous dans 1 cuillerée à thé (5 ml) de lait maternisé froid ou à température ambiante ou de lait maternel
- mélangé avec 1 cuillerée d'un des aliments mous suivants à froid ou à température ambiante : compote de pommes, purée de carottes, riz ou crème glacée.
- Donnez à l'enfant tout le mélange dans les 15 minutes.
- Ne conservez aucun reste de mélange SINGULAIR (granulés oraux mélangés à de la nourriture, du lait maternisé ou du lait maternel) pour une utilisation ultérieure. Jetez toute portion inutilisée.
- Ne mélangez pas les granules orales SINGULAIR avec une boisson liquide autre que le lait maternisé ou le lait maternel. Votre enfant peut boire d'autres liquides après avoir avalé le mélange.
Comment conserver SINGULAIR 5mg ?
- Conservez SINGULAIR 4mg à température ambiante entre 68°F et 77°F (20°C et 25°C).
- Conservez SINGULAIR dans son emballage.
- Conservez SINGULAIR 5mg dans un endroit sec et à l'abri de la lumière.
- Conservez SINGULAIR et tous les médicaments hors de la portée des enfants.
Ce mode d'emploi a été approuvé par la Food and Drug Administration des États-Unis
