Symbicort 160/4.5mcg Budesonide Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Symbicort 4,5 mcg et comment est-il utilisé ?
Symbicort 4,5 mcg est un médicament d'ordonnance utilisé pour traiter les symptômes de l'asthme et de la maladie pulmonaire obstructive chronique. Symbicort peut être utilisé seul ou avec d'autres médicaments.
Symbicort appartient à une classe de médicaments appelés combos d'inhalants respiratoires.
On ne sait pas si Symbicort 4,5 mcg est sûr et efficace chez les enfants de moins de 6 ans.
Quels sont les effets secondaires possibles de Symbicort 4.5mcg ?
Symbicort peut provoquer des effets secondaires graves, notamment :
- aggravation des problèmes respiratoires,
- plaies ou plaques blanches dans la bouche ou la gorge,
- douleur à la déglutition,
- tremblements,
- nervosité,
- douleur thoracique,
- battements de cœur rapides ou battants,
- toux avec mucus,
- se sentir essoufflé,
- respiration sifflante,
- étouffement,
- autres problèmes respiratoires,
- Vision floue,
- vision tunnel,
- douleur ou rougeur oculaire,
- voir des halos autour des lumières,
- fièvre,
- des frissons,
- courbatures,
- fatigue inhabituelle,
- augmentation de la soif,
- augmentation de la miction,
- bouche sèche,
- odeur d'haleine fruitée,
- crampes dans les jambes,
- constipation,
- battements cardiaques irréguliers,
- flottant dans ta poitrine,
- engourdissement ou fourmillement,
- faiblesse musculaire,
- sensation de mollesse,
- fatigue,
- la faiblesse,
- étourdissement,
- des nausées et
- vomissement
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Symbicort incluent :
- douleur ou irritation de la gorge,
- taches blanches dans la bouche ou la gorge,
- maux d'estomac,
- vomissement,
- mal au dos,
- mal de tête,
- les symptômes de la grippe et
- symptômes du rhume (nez bouché ou qui coule, éternuements, douleur aux sinus ou mal de gorge)
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Symbicort. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
LA DESCRIPTION
SYMBICORT 80/4.5 et SYMBICORT 160/4.5 contiennent chacun du budésonide micronisé et du fumarate de formotérol dihydraté micronisé pour inhalation orale seulement.
Chaque cartouche SYMBICORT 80/4.5 et SYMBICORT 160/4.5 est formulée sous la forme d'un aérosol-doseur pressurisé propulsé par hydrofluoroalcane (HFA 227 ; 1,1,1,2,3,3,3-heptafluoropropane) contenant 60 ou 120 actionnements [voir Formes posologiques et points forts et COMMENT FOURNIE / Stockage et manutention ]. Après l'amorçage, chaque actionnement mesure 91/5,1 mcg ou 181/5,1 mcg de la vanne et délivre soit 80/4,5 mcg, soit 160/4,5 mcg (budésonide micronisé/fumarate de formotérol dihydraté micronisé) à partir de l'actionneur. La quantité réelle de médicament délivrée au poumon peut dépendre de facteurs liés au patient, tels que la coordination entre l'actionnement du dispositif et l'inspiration via le système de délivrance. SYMBICORT 160 mg contient également de la povidone K25 USP comme agent de suspension et du polyéthylène glycol 1000 NF comme lubrifiant.
SYMBICORT 160 mg doit être amorcé avant la première utilisation en libérant deux pulvérisations d'essai dans l'air loin du visage, en agitant bien pendant 5 secondes avant chaque pulvérisation. Dans les cas où l'inhalateur n'a pas été utilisé pendant plus de 7 jours ou lorsqu'il est tombé, amorcez à nouveau l'inhalateur en agitant bien pendant 5 secondes avant chaque pulvérisation et en libérant deux pulvérisations d'essai dans l'air loin du visage.
Un composant actif de SYMBICORT 4,5 mcg est le budésonide, un corticostéroïde désigné chimiquement par (RS)11β, 16α, 17,21-tétrahydroxypregna-1,4-diène-3,20-dione 16,17-acétal cyclique avec butyraldéhyde. Le budésonide est fourni sous la forme d'un mélange de deux épimères (22R et 22S). La formule empirique du budésonide est C25H34O6 et son poids moléculaire est de 430,5. Sa formule structurale est :
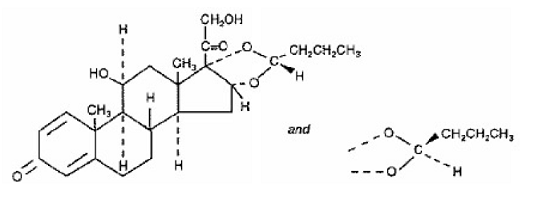
Le budésonide est une poudre blanche à blanc cassé, insipide et inodore, pratiquement insoluble dans l'eau et dans l'heptane, peu soluble dans l'éthanol et librement soluble dans le chloroforme. Son coefficient de partage entre l'octanol et l'eau à pH 7,4 est de 1,6 x 103.
L'autre composant actif de SYMBICORT 160 mg est le fumarate de formotérol dihydraté, un bêta2-agoniste sélectif désigné chimiquement par (R*,R*)-(±)-N-[2-hydroxy-5-[1-hydroxy-2-[[ 2-(4-méthoxyphényl)-1méthyléthyl]amino]éthyl]phényl]formamide, (E)-2-butendioate(2:1), dihydraté. La formule empirique du formotérol est C42H56N4O14 et son poids moléculaire est de 840,9. Sa formule structurale est :
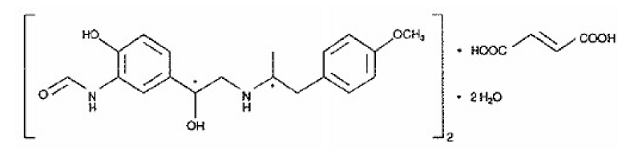
Le fumarate de formotérol dihydraté est une poudre légèrement soluble dans l'eau. Son coefficient de partage octanol-eau à pH 7,4 est de 2,6. Le pKa du fumarate de formotérol dihydraté à 25 °C est de 7,9 pour le groupe phénolique et de 9,2 pour le groupe amino.
LES INDICATIONS
Traitement de l'asthme
SYMBICORT 4,5 mcg est indiqué pour le traitement de l'asthme chez les patients de 6 ans et plus.
SYMBICORT doit être utilisé chez les patients dont le contrôle de l'asthme n'est pas suffisamment contrôlé par un médicament à long terme tel qu'un corticostéroïde inhalé (CSI) ou dont la maladie justifie l'instauration d'un traitement à la fois par un corticostéroïde inhalé et un agoniste bêta2-adrénergique à longue durée d'action (BALA).
Limites d'utilisation importantes
- SYMBICORT n'est PAS indiqué pour le soulagement du bronchospasme aigu.
Traitement d'entretien de la maladie pulmonaire obstructive chronique
SYMBICORT 160/4,5 est indiqué pour le traitement d'entretien de l'obstruction des voies respiratoires chez les patients atteints de maladie pulmonaire obstructive chronique (MPOC), y compris la bronchite chronique et/ou l'emphysème. SYMBICORT 160/4.5 est également indiqué pour réduire les exacerbations de la MPOC. SYMBICORT 160/4.5 est le seul dosage indiqué pour le traitement de la MPOC.
Limites d'utilisation importantes
- SYMBICORT 4,5 mcg n'est PAS indiqué pour le soulagement du bronchospasme aigu.
DOSAGE ET ADMINISTRATION
Informations administratives
SYMBICORT 160 mg doit être administré en 2 inhalations deux fois par jour (matin et soir, à environ 12 heures d'intervalle), tous les jours, par inhalation orale uniquement. Après inhalation, le patient doit se rincer la bouche avec de l'eau sans avaler.
Amorcer SYMBICORT 4,5 mcg avant la première utilisation en libérant deux pulvérisations d'essai dans l'air loin du visage, en agitant bien pendant 5 secondes avant chaque pulvérisation. Dans les cas où l'inhalateur n'a pas été utilisé pendant plus de 7 jours ou lorsqu'il est tombé, amorcez à nouveau l'inhalateur en agitant bien avant chaque pulvérisation et en libérant deux pulvérisations d'essai dans l'air loin du visage.
Une administration plus fréquente ou un plus grand nombre d'inhalations (plus de 2 inhalations deux fois par jour) de la concentration prescrite de SYMBICORT n'est pas recommandée, car certains patients sont plus susceptibles d'éprouver des effets indésirables avec des doses plus élevées de formotérol. Les patients utilisant SYMBICORT ne doivent pas utiliser de BALA supplémentaire pour quelque raison que ce soit [voir AVERTISSEMENTS ET PRECAUTIONS ].
Asthme
Si des symptômes d'asthme apparaissent entre les doses, un bêta2-agoniste inhalé à courte durée d'action doit être pris pour un soulagement immédiat.
Patients adultes et adolescents de 12 ans et plus
Pour les patients de 12 ans et plus, la posologie est de 2 inhalations de SYMBICORT 80/4,5 ou SYMBICORT 160/4,5 deux fois par jour.
Les posologies initiales recommandées pour SYMBICORT chez les patients âgés de 12 ans et plus sont basées sur la gravité de l'asthme du patient ou sur le niveau de contrôle des symptômes de l'asthme et sur le risque d'exacerbation avec les corticostéroïdes inhalés actuels.
La posologie maximale recommandée chez les patients adultes et adolescents de 12 ans et plus est de SYMBICORT 160/4,5, deux inhalations deux fois par jour.
Une amélioration du contrôle de l'asthme après l'administration de SYMBICORT par inhalation peut survenir dans les 15 minutes suivant le début du traitement, bien que le bénéfice maximum puisse ne pas être atteint avant 2 semaines ou plus après le début du traitement. Les patients individuels connaîtront un délai d'apparition et un degré de soulagement des symptômes variables.
Chez les patients qui ne répondent pas adéquatement à la dose initiale après 1 à 2 semaines de traitement par SYMBICORT 80/4,5, le remplacement par SYMBICORT 160/4,5 peut fournir un contrôle supplémentaire de l'asthme.
Si un schéma posologique auparavant efficace de SYMBICORT 4,5 mcg ne parvient pas à contrôler adéquatement l'asthme, le schéma thérapeutique doit être réévalué et des options thérapeutiques supplémentaires (p. ex., remplacer le dosage le plus faible de SYMBICORT 4,5 mcg par le dosage le plus élevé, corticostéroïde ou initiation de corticostéroïdes oraux) doit être envisagée.
Patients pédiatriques âgés de 6 à moins de 12 ans
Pour les patients âgés de 6 à moins de 12 ans, la posologie est de 2 inhalations de SYMBICORT 80/4,5 deux fois par jour.
Bronchopneumopathie chronique obstructive
Pour les patients atteints de MPOC, la dose recommandée est SYMBICORT 160/4,5, deux inhalations deux fois par jour.
Si un essoufflement survient entre les doses, un bêta2-agoniste inhalé à courte durée d'action doit être pris pour un soulagement immédiat.
COMMENT FOURNIE
Formes posologiques et points forts
SYMBICORT est disponible sous forme d'aérosol-doseur contenant une combinaison de budésonide (80 ou 160 mcg) et de formotérol (4,5 mcg) sous forme d'aérosol pour inhalation dans les deux dosages suivants : 80/4,5 et 160/4,5. Chaque dosage contient 60 ou 120 actionnements par cartouche. Chaque concentration de SYMBICORT 160 mg est fournie avec un actionneur en plastique rouge avec un capuchon anti-poussière gris.
Stockage et manutention
SYMBICORT est disponible en deux dosages et est fourni dans les conditionnements suivants :
Formes posologiques et points forts
Chaque force est fournie sous forme de cartouche en aluminium sous pression avec un dispositif de comptage attaché, un corps d'actionneur en plastique rouge avec un embout buccal blanc et un capuchon anti-poussière gris attaché. Chaque cartouche de 120 inhalations a un poids de remplissage net de 10,2 grammes et chaque cartouche de 60 inhalations a un poids de remplissage net de 6,9 grammes (SYMBICORT 80/4,5) ou 6 grammes (SYMBICORT 160/4,5). Chaque cartouche est emballée dans une pochette en aluminium avec un sachet déshydratant et placée dans un carton. Chaque boîte contient une cartouche et une notice d'information destinée au patient.
La cartouche SYMBICORT 4,5 mcg ne doit être utilisée qu'avec l'actionneur SYMBICORT 4,5 mcg, et l'actionneur SYMBICORT ne doit être utilisé avec aucun autre produit médicamenteux pour inhalation.
La quantité correcte de médicament dans chaque inhalation ne peut pas être garantie après que le nombre indiqué d'inhalations de la cartouche a été utilisé, même si l'inhalateur peut ne pas sembler complètement vide et peut continuer à fonctionner. L'inhalateur doit être jeté lorsque le nombre d'inhalations indiqué sur l'étiquette a été utilisé ou dans les 3 mois suivant son retrait du sachet en aluminium. N'immergez jamais la cartouche dans l'eau pour déterminer la quantité restante dans la cartouche ("test de flottaison").
Le magasin à la température de pièce contrôlée 20°C à 25°C (68°F à 77°F) [voit USP]. Rangez l'inhalateur avec l'embout buccal vers le bas.
Pour de meilleurs résultats, la cartouche doit être à température ambiante avant utilisation. Bien agiter pendant 5 secondes avant utilisation.
Garder hors de la portée des enfants. Éviter de vaporiser dans les yeux.
CONTENU SOUS PRESSION.
Ne pas percer ou incinérer. Ne pas entreposer près d'une source de chaleur ou d'une flamme nue. L'exposition à des températures supérieures à 120°F peut provoquer un éclatement. Ne jamais jeter le contenant au feu ou dans un incinérateur.
Fabriqué pour : AstraZeneca Pharmaceuticals LP, Wilmington, DE 19850 Par : AstraZeneca Dunkerque Production, Dunkerque, France. Révisé : décembre 2017
EFFETS SECONDAIRES
L'utilisation de BALA peut avoir les conséquences suivantes :
- Événements graves liés à l'asthme – hospitalisations, intubations, décès [voir AVERTISSEMENTS ET PRECAUTIONS ].
- Effets sur le système cardiovasculaire et le système nerveux central [voir AVERTISSEMENTS ET PRECAUTIONS ].
L'utilisation systémique et inhalée de corticostéroïdes peut entraîner les effets suivants :
- Infection à Candida albicans [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Pneumonie ou infections des voies respiratoires inférieures chez les patients atteints de BPCO [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Immunosuppression [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Hypercorticisme et suppression surrénalienne [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Effets sur la croissance chez les patients pédiatriques [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Glaucome et cataracte [voir AVERTISSEMENTS ET PRECAUTIONS ]
Étant donné que les essais cliniques sont menés dans des conditions très variables, les taux d'effets indésirables observés dans les essais cliniques d'un médicament ne peuvent pas être directement comparés aux taux des essais cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique.
Expérience des essais cliniques dans l'asthme
Patients adultes et adolescents de 12 ans et plus
Les données globales sur l'innocuité chez les adultes et les adolescents sont basées sur 10 essais cliniques contrôlés contre placebo et au cours desquels 3 393 patients âgés de 12 ans et plus (2 052 femmes et 1 341 hommes) souffrant d'asthme de gravité variable ont été traités avec SYMBICORT 80/4,5 ou 160 /4,5 en 2 inhalations 1 à 2 fois par jour pendant 12 à 52 semaines. Dans ces essais, les patients sous SYMBICORT avaient un âge moyen de 38 ans et étaient majoritairement de race blanche (82 %).
L'incidence des événements indésirables courants dans le tableau 2 ci-dessous est basée sur les données regroupées de trois études cliniques de 12 semaines, en double aveugle, contrôlées par placebo, au cours desquelles 401 patients adultes et adolescents (148 hommes et 253 femmes) âgés de 12 ans et plus ont été traité avec 2 inhalations de SYMBICORT 80/4,5 ou SYMBICORT 160/4,5 deux fois par jour. Le groupe SYMBICORT était composé principalement de patients de race blanche (84 %) avec un âge moyen de 38 ans et un pourcentage moyen de VEMS prédit au départ de 76 et 68 pour les groupes de traitement 80/4,5 mcg et 160/4,5 mcg, respectivement. Les bras témoins de comparaison comprenaient 2 inhalations de budésonide HFA en inhalateur-doseur (MDI) 80 ou 160 mcg, de formotérol en inhalateur de poudre sèche (DPI) 4,5 mcg ou de placebo (MDI et DPI) deux fois par jour. Le tableau 2 comprend tous les événements indésirables survenus à une incidence > 3 % dans l'un quelconque des groupes SYMBICORT et plus fréquemment que dans le groupe placebo avec une administration biquotidienne. Lors de l'examen de ces données, l'augmentation de la durée moyenne d'exposition des patients pour les patients SYMBICORT doit être prise en compte, car les incidences ne sont pas ajustées pour un déséquilibre de la durée du traitement.
Innocuité à long terme - Essais cliniques sur l'asthme chez des patients de 12 ans et plus
Des études de sécurité à long terme chez des patients adolescents et adultes âgés de 12 ans et plus, traités jusqu'à 1 an à des doses allant jusqu'à 1280/36 mcg/jour (640/18 mcg deux fois par jour), n'ont révélé aucun changement cliniquement important de l'incidence ni de nouveaux types d'événements indésirables apparaissant après de plus longues périodes de traitement. De même, aucun schéma significatif ou inattendu d'anomalies n'a été observé jusqu'à 1 an dans les mesures de sécurité, y compris la chimie, l'hématologie, l'ECG, le moniteur Holter et les évaluations de l'axe HPA.
Patients pédiatriques âgés de 6 à moins de 12 ans
Les données de sécurité pour les patients pédiatriques âgés de 6 à moins de 12 ans sont basées sur 1 essai d'une durée de traitement de 12 semaines. Les patients (79 femmes et 105 hommes) recevant un corticostéroïde inhalé à l'entrée dans l'essai ont été randomisés pour recevoir SYMBICORT 80/4,5 (n = 92) ou budésonide pMDI 80 mcg (n = 92), 2 inhalations deux fois par jour. Le profil d'innocuité global de ces patients était similaire à celui observé chez les patients de 12 ans et plus ayant reçu SYMBICORT 80/4,5 deux fois par jour dans des études de conception similaire. Les effets indésirables courants survenus chez les patients traités par SYMBICORT 80/4,5 avec une fréquence ≥ 3 % et plus fréquemment que les patients traités uniquement par le budésonide pMDI 80 mcg comprenaient une infection des voies respiratoires supérieures, une pharyngite, des maux de tête et une rhinite.
Expérience des essais cliniques dans la maladie pulmonaire obstructive chronique
Les données de sécurité décrites ci-dessous reflètent l'exposition à SYMBICORT 160/4,5 chez 1783 patients. SYMBICORT 160/4,5 a fait l'objet de deux études contrôlées par placebo sur la fonction pulmonaire (d'une durée de 6 et 12 mois) et de deux études d'exacerbation contrôlées contre comparateur actif (d'une durée de 6 et 12 mois) chez des patients atteints de MPOC.
L'incidence des événements indésirables courants dans le tableau 3 ci-dessous est basée sur les données regroupées de deux études cliniques sur la fonction pulmonaire à double insu et contrôlées par placebo (d'une durée de 6 et 12 mois) dans lesquelles 771 patients adultes atteints de MPOC (496 hommes et 275 femmes) 40 ans et plus ont été traités avec SYMBICORT 160/4,5, deux inhalations deux fois par jour. Parmi ces patients, 651 ont été traités pendant 6 mois et 366 ont été traités pendant 12 mois. Le groupe SYMBICORT était composé principalement de patients de race blanche (93 %) avec un âge moyen de 63 ans et un pourcentage moyen de VEMS prédit au départ de 33 %. Les bras témoins de comparaison comprenaient 2 inhalations de budésonide HFA (MDI) 160 mcg, de formotérol (DPI) 4,5 mcg ou de placebo (MDI et DPI) deux fois par jour. Le tableau 3 comprend tous les événements indésirables survenus à une incidence ≥ 3 % dans le groupe SYMBICORT et plus fréquemment que dans le groupe placebo. Lors de l'examen de ces données, l'augmentation de la durée moyenne d'exposition des patients à SYMBICORT 4,5 mcg doit être prise en compte, car les incidences ne sont pas ajustées en cas de déséquilibre de la durée du traitement.
Des infections pulmonaires autres que la pneumonie (principalement la bronchite) sont survenues chez un plus grand pourcentage de sujets traités par SYMBICORT 160/4,5 par rapport au placebo (7,9 % contre 5,1 %, respectivement). Il n'y a pas eu d'anomalies cliniquement importantes ou inattendues observées jusqu'à 1 an dans la chimie, l'hématologie, l'ECG, la surveillance ECG (Holter), l'axe HPA, la densité minérale osseuse et les évaluations ophtalmologiques.
Les résultats d'innocuité des deux études d'exacerbations à double insu et contrôlées par agent actif (d'une durée de 6 et 12 mois) dans lesquelles 1012 patients adultes atteints de MPOC (616 hommes et 396 femmes) âgés de 40 ans et plus ont été traités avec SYMBICORT 160/4.5, deux inhalations deux fois par jour étaient compatibles avec les études sur la fonction pulmonaire.
Expérience post-commercialisation
Les effets indésirables suivants ont été identifiés lors de l'utilisation post-approbation de SYMBICORT. Étant donné que ces réactions sont signalées volontairement par une population de taille incertaine, il n'est pas toujours possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale avec l'exposition au médicament. Certains de ces effets indésirables peuvent également avoir été observés dans des études cliniques avec SYMBICORT.
Troubles cardiaques : angine de poitrine, tachycardie, tachyarythmies auriculaires et ventriculaires, fibrillation auriculaire, extrasystoles, palpitations
Troubles endocriniens: hypercorticisme, réduction de la vitesse de croissance chez les patients pédiatriques
Troubles oculaires : cataracte, glaucome, augmentation de la pression intraoculaire
Problèmes gastro-intestinaux: candidose oropharyngée, nausées
Troubles du système immunitaire : réactions d'hypersensibilité immédiates et retardées, telles que réaction anaphylactique, œdème de Quincke, bronchospasme, urticaire, exanthème, dermatite, prurit
Troubles métaboliques et nutritionnels : hyperglycémie, hypokaliémie
Troubles musculo-squelettiques, du tissu conjonctif et osseux : crampes musculaires
Troubles du système nerveux : tremblements, étourdissements
Troubles psychiatriques: troubles du comportement, troubles du sommeil, nervosité, agitation, dépression, agitation
Troubles respiratoires, thoraciques et médiastinaux : dysphonie, toux, irritation de la gorge
Affections de la peau et du tissu sous-cutané : ecchymoses sur la peau
Affections vasculaires : hypotonie, hypertension
INTERACTIONS MÉDICAMENTEUSES
Dans les études cliniques, l'administration concomitante de SYMBICORT et d'autres médicaments, tels que les bêta2agonistes à courte durée d'action, les corticostéroïdes intranasaux et les antihistaminiques/décongestionnants, n'a pas entraîné d'augmentation de la fréquence des effets indésirables. Aucune étude formelle sur les interactions médicamenteuses n'a été réalisée avec SYMBICORT.
Inhibiteurs du cytochrome P4503A4
La principale voie de métabolisme des corticostéroïdes, y compris le budésonide, un composant de SYMBICORT, passe par l'isoenzyme 3A4 (CYP3A4) du cytochrome P450 (CYP). Après administration orale de kétoconazole, un puissant inhibiteur du CYP3A4, la concentration plasmatique moyenne du budésonide administré par voie orale a augmenté. L'administration concomitante de CYP3A4 peut inhiber le métabolisme du budésonide et augmenter l'exposition systémique à celui-ci. La prudence s'impose lorsqu'on envisage la co-administration de SYMBICORT 4,5 mcg avec du kétoconazole à long terme et d'autres inhibiteurs puissants connus du CYP3A4 (p. ex., ritonavir, atazanavir, clarithromycine, indinavir, itraconazole, néfazodone, nelfinavir, saquinavir, télithromycine) [voir AVERTISSEMENTS ET PRECAUTIONS ].
Inhibiteurs de la monoamine oxydase et antidépresseurs tricycliques
SYMBICORT doit être administré avec prudence aux patients traités par des inhibiteurs de la monoamine oxydase ou des antidépresseurs tricycliques, ou dans les 2 semaines suivant l'arrêt de ces agents, car l'action du formotérol, un composant de SYMBICORT 160 mg, sur le système vasculaire peut être potentialisée par ces agents. . Dans les essais cliniques avec SYMBICORT, un nombre limité de patients atteints de MPOC et d'asthme ont reçu des antidépresseurs tricycliques et, par conséquent, aucune conclusion cliniquement significative sur les événements indésirables ne peut être tirée.
Agents bloquants des récepteurs bêta-adrénergiques
Les bêta-bloquants (y compris les gouttes ophtalmiques) peuvent non seulement bloquer l'effet pulmonaire des bêta-agonistes, tels que le formotérol, un composant de SYMBICORT, mais peuvent également provoquer un bronchospasme sévère chez les patients asthmatiques. Par conséquent, les patients asthmatiques ne doivent normalement pas être traités par des bêta-bloquants. Cependant, dans certaines circonstances, il peut ne pas y avoir d'alternative acceptable à l'utilisation d'agents bêta-bloquants chez les patients asthmatiques. Dans ce contexte, les bêta-bloquants cardiosélectifs pourraient être envisagés, même s'ils doivent être administrés avec prudence.
Diurétiques
Les modifications de l'ECG et/ou l'hypokaliémie pouvant résulter de l'administration de diurétiques non épargneurs de potassium (tels que les diurétiques de l'anse ou thiazidiques) peuvent être fortement aggravées par les bêta-agonistes, en particulier lorsque la dose recommandée de bêta-agoniste est dépassée. Bien que la signification clinique de ces effets ne soit pas connue, la prudence est recommandée lors de la co-administration de SYMBICORT avec des diurétiques non épargneurs de potassium.
AVERTISSEMENTS
Inclus dans le cadre du PRÉCAUTIONS section.
PRÉCAUTIONS
Événements graves liés à l'asthme - hospitalisations, intubations et décès
L'utilisation de BALA en monothérapie (sans CSI) pour l'asthme est associée à un risque accru de décès lié à l'asthme [voir Essai de recherche multicentrique sur l'asthme sur le salmétérol (SMART)]. Les données disponibles provenant d'essais cliniques contrôlés suggèrent également que l'utilisation de BALA en monothérapie augmente le risque d'hospitalisation liée à l'asthme chez les patients pédiatriques et adolescents. Ces résultats sont considérés comme un effet de classe de LABA. Lorsque les BALA sont utilisés en association à dose fixe avec les CSI, les données issues d'essais cliniques de grande envergure ne montrent pas d'augmentation significative du risque d'événements graves liés à l'asthme (hospitalisations, intubations, décès) par rapport aux CSI seuls (voir Événements graves liés à l'asthme avec ICS/LABA).
Événements graves liés à l'asthme avec ICS/LABA
Quatre grands essais cliniques d'innocuité de 26 semaines, randomisés, en aveugle et contrôlés par traitement actif ont été menés pour évaluer le risque d'événements graves liés à l'asthme lorsque les BALA étaient utilisés en association à dose fixe avec les CSI par rapport aux CSI seuls chez les patients asthmatiques. Trois essais ont inclus des patients adultes et adolescents âgés de ≥ 12 ans : un essai a comparé l'association budésonide/formotérol (SYMBICORT) au budésonide [voir Etudes cliniques ] ; un essai comparait la poudre pour inhalation de propionate de fluticasone/salmétérol à la poudre pour inhalation de propionate de fluticasone ; et un essai comparait le furoate de mométasone/formotérol au furoate de mométasone. Le quatrième essai incluait des patients pédiatriques âgés de 4 à 11 ans et comparait la poudre pour inhalation de propionate de fluticasone/salmétérol à la poudre pour inhalation de propionate de fluticasone. Le principal critère d'évaluation de l'innocuité pour les quatre essais était les événements graves liés à l'asthme (hospitalisations, intubations et décès). Un comité de sélection en aveugle a déterminé si les événements étaient liés à l'asthme.
Les trois essais pour adultes et adolescents ont été conçus pour exclure une marge de risque de 2,0, et l'essai pédiatrique a été conçu pour exclure un risque de 2,7. Chaque essai individuel a atteint son objectif pré-spécifié et a démontré la non-infériorité de l'ICS/LABA par rapport à l'ICS seul. Une méta-analyse des trois essais adultes et adolescents n'a pas montré d'augmentation significative du risque d'événement grave lié à l'asthme avec l'association à dose fixe CSI/BALA par rapport aux CSI seuls (Tableau 1). Ces essais n'ont pas été conçus pour exclure tout risque d'événements graves liés à l'asthme avec les CSI/BALA par rapport aux CSI.
L'essai d'innocuité pédiatrique a inclus 6 208 patients pédiatriques âgés de 4 à 11 ans qui ont reçu un CSI/BALA (propionate de fluticasone/poudre pour inhalation de salmétérol) ou un CSI (poudre pour inhalation de propionate de fluticasone). Dans cet essai, 27/3107 (0,9%) patients randomisés pour CSI/BALA et 21/3101 (0,7%) patients randomisés pour CSI ont présenté un événement grave lié à l'asthme. Il n'y a pas eu de décès ou d'intubation liés à l'asthme. Les CSI/BALA n'ont pas montré de risque significativement accru d'événement lié à l'asthme grave par rapport aux CSI sur la base de la marge de risque prédéfinie (2,7), avec un risque relatif estimé du délai avant le premier événement de 1,29 (IC à 95 % : 0,73 , 2.27).
Essai de recherche multicentrique sur l'asthme au salmétérol (SMART)
Un essai américain contrôlé par placebo de 28 semaines comparant l'innocuité du salmétérol à un placebo, chacun ajouté au traitement habituel de l'asthme, a montré une augmentation des décès liés à l'asthme chez les patients recevant du salmétérol (13/13 176 chez les patients traités par le salmétérol contre 3 /13 179 chez les patients traités par placebo ; risque relatif : 4,37 [IC 95 % 1,25 ; 15,34]). L'utilisation d'ICS en arrière-plan n'était pas requise dans SMART. Le risque accru de décès lié à l'asthme est considéré comme un effet de classe de la monothérapie LABA.
Études sur le formotérol en monothérapie
Des études cliniques avec le formotérol utilisé en monothérapie ont suggéré une incidence plus élevée d'exacerbations graves de l'asthme chez les patients ayant reçu du formotérol que chez ceux ayant reçu un placebo. La taille de ces études n'était pas suffisante pour quantifier avec précision la différence dans les exacerbations graves de l'asthme entre les groupes de traitement.
Détérioration de la maladie et épisodes aigus
SYMBICORT 4,5 mcg ne doit pas être instauré chez les patients au cours d'épisodes d'asthme ou de MPOC se détériorant rapidement ou potentiellement mortels. SYMBICORT n'a pas été étudié chez les patients atteints d'asthme ou de MPOC se détériorant de manière aiguë. L'initiation de SYMBICORT 4,5 mcg dans ce contexte n'est pas appropriée.
L'utilisation croissante de bêta2-agonistes inhalés à courte durée d'action est un marqueur de l'aggravation de l'asthme. Dans cette situation, le patient nécessite une réévaluation immédiate avec réévaluation du schéma thérapeutique, en accordant une attention particulière à la nécessité éventuelle de remplacer le dosage actuel de SYMBICORT par un dosage plus élevé, d'ajouter un corticostéroïde inhalé supplémentaire ou d'initier des corticostéroïdes systémiques. Les patients ne doivent pas utiliser plus de 2 inhalations deux fois par jour (matin et soir) de SYMBICORT.
SYMBICORT 160 mg ne doit pas être utilisé pour le soulagement des symptômes aigus, c'est-à-dire comme traitement de secours pour le traitement des épisodes aigus de bronchospasme. Un bêta2-agoniste inhalé à courte durée d'action, et non SYMBICORT, doit être utilisé pour soulager les symptômes aigus tels que l'essoufflement.
Au début du traitement par SYMBICORT 4,5 mcg, les patients qui prenaient régulièrement (p. ex., 4 fois par jour) des bêta2-agonistes à courte durée d'action par voie orale ou inhalée (p. ex., 4 fois par jour) doivent être avisés d'arrêter l'utilisation régulière de ces médicaments.
Utilisation excessive de SYMBICORT 4,5 mcg et utilisation avec d'autres bêta2-agonistes à longue durée d'action
Comme avec d'autres médicaments inhalés contenant des agents bêta2-adrénergiques, SYMBICORT 4,5 mcg ne doit pas être utilisé plus souvent que recommandé, à des doses plus élevées que celles recommandées ou en association avec d'autres médicaments contenant des BALA, car un surdosage pourrait en résulter. Des effets cardiovasculaires cliniquement significatifs et des décès ont été rapportés en association avec une utilisation excessive de médicaments sympathomimétiques inhalés. Les patients utilisant SYMBICORT ne doivent pas utiliser un BALA supplémentaire (par exemple, le salmétérol, le fumarate de formotérol, le tartrate d'arformotérol) pour quelque raison que ce soit, y compris la prévention du bronchospasme induit par l'exercice (BEI) ou le traitement de l'asthme ou de la MPOC.
Effets locaux
Dans les études cliniques, le développement d'infections localisées de la bouche et du pharynx à Candida albicans est survenu chez des patients traités par SYMBICORT. Lorsqu'une telle infection se développe, elle doit être traitée avec un traitement local ou systémique approprié (c'est-à-dire un antifongique oral) pendant que le traitement par SYMBICORT 160 mg se poursuit, mais il peut parfois être nécessaire d'interrompre le traitement par SYMBICORT 4,5 mcg. Conseillez au patient de se rincer la bouche avec de l'eau sans avaler après l'inhalation pour aider à réduire le risque de candidose oropharyngée.
Pneumonie et autres infections des voies respiratoires inférieures
Les médecins doivent rester vigilants quant au développement possible d'une pneumonie chez les patients atteints de MPOC, car les caractéristiques cliniques de la pneumonie et des exacerbations se chevauchent fréquemment. Des infections des voies respiratoires inférieures, y compris des pneumonies, ont été signalées à la suite de l'administration inhalée de corticostéroïdes.
Dans une étude de 6 mois sur la fonction pulmonaire menée auprès de 1 704 patients atteints de MPOC, l'incidence d'infections pulmonaires autres que la pneumonie (p. ex., bronchite, infections virales des voies respiratoires inférieures, etc.) était plus élevée chez les patients recevant SYMBICORT 160/4,5 (7,6 %) que chez ceux recevant SYMBICORT 80/4,5 (3,2 %), formotérol 4,5 mcg (4,6 %) ou placebo (3,3 %). La pneumonie n'est pas survenue avec une incidence plus élevée dans le groupe SYMBICORT 160/4,5 (1,1 %) par rapport au groupe placebo (1,3 %). Dans une étude sur la fonction pulmonaire de 12 mois portant sur 1 964 patients atteints de MPOC, l'incidence d'infections pulmonaires autres que la pneumonie était également plus élevée chez les patients recevant SYMBICORT 160/4,5 (8,1 %) que chez ceux recevant SYMBICORT 80/4,5 (6,9 %). formotérol 4,5 mcg (7,1 %) ou placebo (6,2 %). Comme dans l'étude de 6 mois, la pneumonie n'est pas survenue avec une incidence plus élevée dans le groupe SYMBICORT 160/4,5 (4,0 %) par rapport au groupe placebo (5,0 %).
Immunosuppression
Les patients qui prennent des médicaments qui suppriment le système immunitaire sont plus sensibles aux infections que les individus en bonne santé. La varicelle et la rougeole, par exemple, peuvent avoir une évolution plus grave, voire mortelle, chez les enfants ou les adultes sensibles utilisant des corticostéroïdes. Chez ces enfants ou adultes qui n'ont pas eu ces maladies ou qui ont été correctement immunisés, des précautions particulières doivent être prises pour éviter toute exposition. On ne sait pas comment la dose, la voie et la durée de l'administration de corticostéroïdes affectent le risque de développer une infection disséminée. La contribution de la maladie sous-jacente et/ou de la corticothérapie antérieure au risque n'est pas non plus connue. En cas d'exposition, un traitement par des immunoglobulines varicelle-zona (VZIG) ou des immunoglobulines intraveineuses groupées (IgIV), selon le cas, peut être indiqué. En cas d'exposition à la rougeole, une prophylaxie avec un pool d'immunoglobulines intramusculaires (IG) peut être indiquée (voir les notices d'emballage respectives pour les informations de prescription complètes sur les VZIG et IG). Si la varicelle se développe, un traitement avec des agents antiviraux peut être envisagé. La réponse immunitaire au vaccin contre la varicelle a été évaluée chez des patients pédiatriques asthmatiques âgés de 12 mois à 8 ans avec une suspension pour inhalation de budésonide.
Une étude clinique ouverte et non randomisée a examiné la réponse immunitaire au vaccin contre la varicelle chez 243 patients asthmatiques âgés de 12 mois à 8 ans qui ont été traités avec une suspension pour inhalation de budésonide à raison de 0,25 mg à 1 mg par jour (n = 151) ou une thérapie non corticostéroïde contre l'asthme (n =92) (c.-à-d., bêta2-agonistes, antagonistes des récepteurs des leucotriènes, cromones). Le pourcentage de patients développant un titre d'anticorps séroprotecteurs > 5,0 (valeur gpELISA) en réponse à la vaccination était similaire chez les patients traités avec la suspension pour inhalation de budésonide (85 %), par rapport aux patients traités avec un traitement de l'asthme non corticoïde (90 %). Aucun patient traité par la suspension pour inhalation de budésonide n'a développé de varicelle suite à la vaccination.
Les corticostéroïdes inhalés doivent être utilisés avec prudence, voire pas du tout, chez les patients atteints d'infections tuberculeuses actives ou quiescentes des voies respiratoires ; infections fongiques, bactériennes, virales ou parasitaires systémiques non traitées ; ou l'herpès simplex oculaire.
Transfert de patients d'une corticothérapie systémique
Une attention particulière est nécessaire pour les patients qui ont été transférés de corticostéroïdes systémiquement actifs à des corticostéroïdes inhalés, car des décès dus à une insuffisance surrénalienne sont survenus chez des patients asthmatiques pendant et après le transfert de corticostéroïdes systémiques à des corticostéroïdes inhalés moins disponibles systémiquement. Après l'arrêt des corticostéroïdes systémiques, un certain nombre de mois sont nécessaires pour la récupération de la fonction hypothalamo-hypophyso-surrénalienne (HHS).
Les patients qui ont été précédemment maintenus à 20 mg ou plus par jour de prednisone (ou son équivalent) peuvent être les plus sensibles, en particulier lorsque leurs corticostéroïdes systémiques ont été presque complètement arrêtés. Au cours de cette période de suppression de l'HPA, les patients peuvent présenter des signes et des symptômes d'insuffisance surrénalienne lorsqu'ils sont exposés à un traumatisme, une intervention chirurgicale ou une infection (en particulier une gastro-entérite) ou d'autres affections associées à une grave perte d'électrolytes. Bien que SYMBICORT puisse contrôler les symptômes de l'asthme pendant ces épisodes, aux doses recommandées, il fournit des quantités physiologiques de glucocorticoïdes inférieures à la normale et ne fournit PAS l'activité minéralocorticoïde nécessaire pour faire face à ces urgences.
Pendant les périodes de stress, une crise d'asthme sévère ou une exacerbation sévère de la MPOC, les patients qui ont cessé de prendre des corticostéroïdes systémiques doivent être informés de reprendre immédiatement les corticostéroïdes oraux (à fortes doses) et de contacter leur médecin pour obtenir des instructions supplémentaires. Ces patients doivent également être informés qu'ils doivent porter une carte d'avertissement indiquant qu'ils peuvent avoir besoin de corticostéroïdes systémiques supplémentaires pendant les périodes de stress, une crise d'asthme sévère ou une exacerbation sévère de la BPCO.
Les patients nécessitant des corticostéroïdes oraux doivent être sevrés lentement de l'utilisation systémique de corticostéroïdes après le passage à SYMBICORT. La réduction de la prednisone peut être obtenue en réduisant la dose quotidienne de prednisone de 2,5 mg sur une base hebdomadaire pendant le traitement par SYMBICORT. La fonction pulmonaire (volume expiratoire maximal moyen en 1 seconde [FEV1] ou débit expiratoire de pointe du matin [PEF]), l'utilisation de bêta-agonistes et les symptômes d'asthme ou de BPCO doivent être étroitement surveillés pendant l'arrêt des corticostéroïdes oraux. De plus, les patients doivent être surveillés pour déceler les signes et symptômes d'insuffisance surrénalienne, tels que fatigue, lassitude, faiblesse, nausées et vomissements et hypotension.
Le transfert de patients d'une corticothérapie systémique à des corticostéroïdes inhalés ou à SYMBICORT peut révéler des affections précédemment supprimées par la corticothérapie systémique (p. ex., rhinite, conjonctivite, eczéma, arthrite, affections éosinophiles). Certains patients peuvent présenter des symptômes de sevrage des corticostéroïdes systémiquement actifs (p. ex., douleurs articulaires et/ou musculaires, lassitude, dépression) malgré le maintien, voire l'amélioration de la fonction respiratoire.
Hypercorticisme et suppression surrénalienne
Le budésonide, un composant de SYMBICORT, aidera souvent à contrôler les symptômes de l'asthme et de la MPOC avec moins de suppression de la fonction HPA que des doses orales thérapeutiquement équivalentes de prednisone. Étant donné que le budésonide est absorbé dans la circulation et peut être systémiquement actif à des doses plus élevées, les effets bénéfiques de SYMBICORT pour minimiser le dysfonctionnement de l'HHS ne peuvent être attendus que lorsque les doses recommandées ne sont pas dépassées et que les patients individuels sont titrés à la dose efficace la plus faible.
En raison de la possibilité d'absorption systémique des corticostéroïdes inhalés, les patients traités par SYMBICORT 160 mg doivent être surveillés attentivement afin de déceler tout signe d'effet corticostéroïde systémique. Des précautions particulières doivent être prises lors de l'observation des patients après l'opération ou pendant les périodes de stress afin de détecter une réponse surrénalienne inadéquate.
Il est possible que des effets corticostéroïdes systémiques tels que l'hypercorticisme et la suppression surrénalienne (y compris la crise surrénalienne) puissent apparaître chez un petit nombre de patients, en particulier lorsque le budésonide est administré à des doses supérieures aux doses recommandées sur des périodes prolongées. Si de tels effets se produisent, la posologie de SYMBICORT doit être réduite lentement, conformément aux procédures acceptées pour réduire les corticostéroïdes systémiques et pour la prise en charge des symptômes de l'asthme.
Interactions médicamenteuses avec de puissants inhibiteurs du cytochrome P450 3A4
La prudence s'impose lorsqu'on envisage l'administration concomitante de SYMBICORT 4,5 mcg avec du kétoconazole et d'autres inhibiteurs puissants connus du CYP3A4 (p. au budésonide peut survenir [voir INTERACTIONS MÉDICAMENTEUSES et PHARMACOLOGIE CLINIQUE ].
Bronchospasme paradoxal et symptômes des voies respiratoires supérieures
Comme avec d'autres médicaments inhalés, SYMBICORT 160 mg peut produire un bronchospasme paradoxal, qui peut mettre la vie en danger. Si un bronchospasme paradoxal survient après l'administration de SYMBICORT 160 mg, il doit être traité immédiatement avec un bronchodilatateur inhalé à courte durée d'action, SYMBICORT doit être arrêté immédiatement et un traitement alternatif doit être institué.
Réactions d'hypersensibilité immédiates
Des réactions d'hypersensibilité immédiates peuvent survenir après l'administration de SYMBICORT 160 mg, comme en témoignent des cas d'urticaire, d'œdème de Quincke, d'éruption cutanée et de bronchospasme.
Effets sur le système cardiovasculaire et le système nerveux central
Une stimulation bêta-adrénergique excessive a été associée à des convulsions, une angine de poitrine, une hypertension ou une hypotension, une tachycardie avec des fréquences allant jusqu'à 200 battements/min, des arythmies, de la nervosité, des maux de tête, des tremblements, des palpitations, des nausées, des étourdissements, de la fatigue, des malaises et de l'insomnie [voir SURDOSAGE ]. Par conséquent, SYMBICORT 160 mg, comme tous les produits contenant des amines sympathomimétiques, doit être utilisé avec prudence chez les patients souffrant de troubles cardiovasculaires, en particulier d'insuffisance coronarienne, d'arythmies cardiaques et d'hypertension.
Le formotérol, un composant de SYMBICORT, peut produire un effet cardiovasculaire cliniquement significatif chez certains patients, tel que mesuré par le pouls, la tension artérielle et/ou les symptômes. Bien que de tels effets soient peu fréquents après l'administration de formotérol aux doses recommandées, s'ils surviennent, il peut être nécessaire d'arrêter le médicament. De plus, il a été rapporté que les bêta-agonistes produisaient des modifications de l'ECG, telles qu'un aplatissement de l'onde T, un allongement de l'intervalle QTc et une dépression du segment ST. La signification clinique de ces résultats est inconnue. Des décès ont été signalés en association avec l'utilisation excessive de médicaments sympathomimétiques inhalés.
Réduction de la densité minérale osseuse
Des diminutions de la densité minérale osseuse (DMO) ont été observées avec l'administration à long terme de produits contenant des corticostéroïdes inhalés. La signification clinique de petites modifications de la DMO en ce qui concerne les conséquences à long terme telles que les fractures est inconnue. Patients présentant des facteurs de risque majeurs de diminution du contenu minéral osseux, tels qu'une immobilisation prolongée, des antécédents familiaux d'ostéoporose, un statut postménopausique, le tabagisme, un âge avancé, une mauvaise nutrition ou l'utilisation chronique de médicaments pouvant réduire la masse osseuse (p. ex., anticonvulsivants, corticostéroïdes oraux ) doivent être surveillés et traités conformément aux normes de soins établies. Étant donné que les patients atteints de MPOC présentent souvent de multiples facteurs de risque de réduction de la DMO, une évaluation de la DMO est recommandée avant de commencer SYMBICORT 160 mg et périodiquement par la suite. Si des réductions significatives de la DMO sont observées et que SYMBICORT est toujours considéré comme médicalement important pour le traitement de la MPOC de ce patient, l'utilisation de médicaments pour traiter ou prévenir l'ostéoporose doit être fortement envisagée.
Les effets du traitement par SYMBICORT 160/4,5, SYMBICORT 80/4,5, formotérol 4,5 mcg ou un placebo sur la DMO ont été évalués dans un sous-groupe de 326 patients (femmes et hommes âgés de 41 à 88 ans) atteints de MPOC au cours de la période de 12 mois de la fonction pulmonaire étude. Les évaluations de la DMO des régions de la hanche et du rachis lombaire ont été effectuées au départ et à 52 semaines à l'aide d'analyses d'absorptiométrie à rayons X à double énergie (DEXA). Les changements moyens de la DMO entre le début et la fin du traitement étaient faibles (les changements moyens variaient de -0,01 à 0,01 g/cm²). Les résultats de l'ANCOVA pour la DMO totale de la colonne vertébrale et de la hanche totale basés sur le moment de la fin du traitement ont montré que tous les rapports géométriques moyens LS pour les comparaisons de groupes de traitement par paires étaient proches de 1, indiquant que dans l'ensemble, la DMO pour les régions totales de la hanche et de la colonne vertébrale pour les 12 -mois étaient stables sur toute la période de traitement.
Effet sur la croissance
Les corticostéroïdes inhalés par voie orale peuvent entraîner une réduction de la vitesse de croissance lorsqu'ils sont administrés à des patients pédiatriques. Surveiller la croissance des patients pédiatriques recevant régulièrement SYMBICORT (p. ex., par stadiométrie). Pour minimiser les effets systémiques des corticostéroïdes inhalés par voie orale, y compris SYMBICORT, titrez la dose de chaque patient à la dose la plus faible qui contrôle efficacement ses symptômes [voir DOSAGE ET ADMINISTRATION et Utilisation dans des populations spécifiques ].
Glaucome et cataracte
Un glaucome, une augmentation de la pression intraoculaire et des cataractes ont été signalés chez des patients souffrant d'asthme et de MPOC après l'administration à long terme de corticostéroïdes inhalés, y compris le budésonide, un composant de SYMBICORT. Par conséquent, une surveillance étroite est justifiée chez les patients présentant une modification de la vision ou ayant des antécédents d'augmentation de la pression intraoculaire, de glaucome et/ou de cataracte.
Les effets du traitement par SYMBICORT 160/4,5, SYMBICORT 80/4,5, formotérol 4,5 mcg ou un placebo sur le développement de cataractes ou de glaucome ont été évalués dans un sous-groupe de 461 patients atteints de MPOC dans le cadre d'une étude de 12 mois sur la fonction pulmonaire. Des examens ophtalmiques ont été effectués au départ, à 24 semaines et à 52 semaines. Il y avait 26 sujets (6 %) avec une augmentation du score sous-capsulaire postérieur de la valeur initiale à la valeur maximale (> 0,7) au cours de la période de traitement randomisée. Des changements dans les scores sous-capsulaires postérieurs > 0,7 entre le départ et le maximum du traitement sont survenus chez 11 patients (9,0 %) dans le groupe SYMBICORT 160/4,5, 4 patients (3,8 %) dans le groupe SYMBICORT 80/4,5, 5 patients (4,2 %) dans le groupe SYMBICORT 160/4,5. le groupe formotérol et 6 patients (5,2 %) dans le groupe placebo.
Conditions éosinophiles et syndrome de Churg-Strauss
Dans de rares cas, les patients sous corticostéroïdes inhalés peuvent présenter des affections éosinophiles systémiques. Certains de ces patients présentent des caractéristiques cliniques de vascularite compatibles avec le syndrome de Churg-Strauss, une affection souvent traitée par une corticothérapie systémique. Ces événements ont généralement, mais pas toujours, été associés à la réduction et/ou à l'arrêt de la corticothérapie orale après l'introduction des corticoïdes inhalés. Les médecins doivent être attentifs à l'éosinophilie, à l'éruption vasculitique, à l'aggravation des symptômes pulmonaires, aux complications cardiaques et/ou à la neuropathie chez leurs patients. Une relation causale entre le budésonide et ces affections sous-jacentes n'a pas été établie.
Conditions coexistantes
SYMBICORT 4,5 mcg, comme tous les médicaments contenant des amines sympathomimétiques, doit être utilisé avec prudence chez les patients souffrant de troubles convulsifs ou de thyrotoxicose et chez ceux qui réagissent de façon inhabituelle aux amines sympathomimétiques. Des doses d'albutérol, agoniste des récepteurs bêta2-adrénergiques apparentés, lorsqu'elles sont administrées par voie intraveineuse, ont été signalées comme aggravant le diabète sucré et l'acidocétose préexistants.
Hypokaliémie et hyperglycémie
Les médicaments agonistes bêta-adrénergiques peuvent produire une hypokaliémie importante chez certains patients, éventuellement par shunt intracellulaire, ce qui a le potentiel de produire des effets cardiovasculaires indésirables [voir PHARMACOLOGIE CLINIQUE ]. La diminution du potassium sérique est généralement transitoire et ne nécessite pas de supplémentation. Des modifications cliniquement significatives de la glycémie et/ou de la kaliémie ont été rarement observées au cours des études cliniques avec SYMBICORT aux doses recommandées.
Informations sur les conseils aux patients
Conseillez au patient de lire l'étiquetage patient approuvé par la FDA ( RENSEIGNEMENTS POUR LE PATIENT et mode d'emploi ).
Événements graves liés à l'asthme
Informez les patients asthmatiques que le LABA, lorsqu'il est utilisé seul, augmente le risque d'hospitalisation ou de décès lié à l'asthme. Les données disponibles montrent que lorsque les CSI et les LABA sont utilisés ensemble, comme avec SYMBICORT, il n'y a pas d'augmentation significative du risque de ces événements.
Pas pour les symptômes aigus
Informez les patients que SYMBICORT 160 mg n'est pas destiné à soulager les symptômes aigus de l'asthme ou de la MPOC et que des doses supplémentaires ne doivent pas être utilisées à cette fin. Conseillez aux patients de traiter les symptômes aigus avec un bêta2-agoniste inhalé à courte durée d'action tel que l'albutérol. Fournissez aux patients un tel médicament et expliquez-lui comment il doit être utilisé.
Demandez aux patients de consulter immédiatement un médecin s'ils ressentent l'un des éléments suivants :
- Diminution de l'efficacité des bêta2-agonistes inhalés à courte durée d'action
- Besoin de plus d'inhalations que d'habitude de bêta2-agonistes inhalés à courte durée d'action
- Diminution significative de la fonction pulmonaire comme indiqué par le médecin
Dites aux patients qu'ils ne doivent pas arrêter le traitement par SYMBICORT sans l'avis du médecin/prestataire car les symptômes peuvent réapparaître après l'arrêt.
Ne pas utiliser de bêta2-agonistes supplémentaires à longue durée d'action
Demandez aux patients de ne pas utiliser d'autres LABA pour l'asthme et la MPOC.
Effets locaux
Informez les patients que des infections localisées à Candida albicans se sont produites dans la bouche et le pharynx chez certains patients. Si une candidose oropharyngée se développe, elle doit être traitée avec un traitement antifongique local ou systémique (c.-à-d. oral) approprié tout en poursuivant le traitement par SYMBICORT 4,5 mcg, mais il peut parfois être nécessaire d'interrompre temporairement le traitement par SYMBICORT sous surveillance médicale étroite. Il est conseillé de rincer la bouche avec de l'eau sans avaler après inhalation pour réduire le risque de muguet.
Pneumonie
Les patients atteints de MPOC ont un risque plus élevé de pneumonie; demandez-leur de contacter leur fournisseur de soins de santé s'ils développent des symptômes de pneumonie.
Immunosuppression
Avertir les patients sous doses immunosuppressives de corticostéroïdes d'éviter l'exposition à la varicelle ou à la rougeole et, en cas d'exposition, de consulter leur médecin sans délai. Informer les patients de l'aggravation potentielle de la tuberculose existante, des infections fongiques, bactériennes, virales ou parasitaires, ou de l'herpès simplex oculaire.
Hypercorticisme et suppression surrénalienne
Aviser les patients que SYMBICORT peut provoquer des effets corticostéroïdes systémiques d'hypercorticisme et de suppression surrénalienne. En outre, informez les patients que des décès dus à une insuffisance surrénalienne sont survenus pendant et après le transfert de corticostéroïdes systémiques. Les patients doivent cesser lentement de prendre des corticostéroïdes systémiques s'ils passent à SYMBICORT.
Réduction de la densité minérale osseuse
Informez les patients qui présentent un risque accru de diminution de la DMO que l'utilisation de corticostéroïdes peut présenter un risque supplémentaire.
Vitesse de croissance réduite
Informez les patients que les corticostéroïdes inhalés par voie orale, un composant de SYMBICORT, peuvent entraîner une réduction de la vitesse de croissance lorsqu'ils sont administrés à des patients pédiatriques. Les médecins doivent suivre de près la croissance des enfants et des adolescents prenant des corticostéroïdes par n'importe quelle voie.
Effets oculaires
L'utilisation à long terme de corticostéroïdes inhalés peut augmenter le risque de certains problèmes oculaires (cataracte ou glaucome); envisager des examens de la vue réguliers.
Risques associés à la thérapie bêta-agoniste
Informer les patients des effets indésirables associés aux bêta2agonistes, tels que des palpitations, des douleurs thoraciques, une accélération du rythme cardiaque, des tremblements ou de la nervosité.
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Budésonide
Des études à long terme ont été menées chez des rats et des souris en utilisant l'administration orale pour évaluer le potentiel carcinogène du budésonide.
Dans une étude de 2 ans chez des rats Sprague-Dawley, le budésonide a provoqué une augmentation statistiquement significative de l'incidence des gliomes chez les rats mâles à une dose orale de 50 mcg/kg (environ équivalente à la MRHDID chez les adultes et les enfants sous mcg/m² base). Aucune tumorigénicité n'a été observée chez les rats mâles et femelles à des doses orales respectives allant jusqu'à 25 et 50 mcg/kg (environ l'équivalent du MRHDID chez les adultes et les enfants sur une base mcg/m²). Dans deux études supplémentaires de 2 ans chez des rats mâles Fischer et Sprague-Dawley, le budésonide n'a causé aucun gliome à une dose orale de 50 mcg/kg (environ l'équivalent du MRHDID chez les adultes et les enfants sur une base de mcg/m²). Cependant, chez les rats mâles Sprague-Dawley, le budésonide a provoqué une augmentation statistiquement significative de l'incidence des tumeurs hépatocellulaires à une dose orale de 50 mcg/kg (environ équivalente à la MRHDID chez les adultes et les enfants sur une base mcg/m²). Les corticostéroïdes de référence simultanés (prednisolone et acétonide de triamcinolone) dans ces deux études ont montré des résultats similaires.
Dans une étude de 91 semaines chez la souris, le budésonide n'a provoqué aucune cancérogénicité liée au traitement à des doses orales allant jusqu'à 200 mcg/kg (environ 2 fois la MRHDID chez les adultes et les enfants sur une base de mcg/m²).
Le budésonide ne s'est pas révélé mutagène ou clastogène dans six systèmes de test différents : test d'Ames Salmonella/microsome sur plaque, test du micronoyau de la souris, test du lymphome de la souris, test d'aberration chromosomique dans les lymphocytes humains, test létal récessif lié au sexe chez Drosophila melanogaster et analyse de la réparation de l'ADN chez le rat culture d'hépatocytes.
La fertilité et la performance reproductive n'ont pas été affectées chez les rats à des doses sous-cutanées allant jusqu'à 80 mcg/kg (environ égales au MRHDID sur une base mcg/m²). Cependant, il a provoqué une diminution de la viabilité prénatale et de la viabilité des petits à la naissance et pendant la lactation, ainsi qu'une diminution du gain de poids corporel maternel, à des doses sous-cutanées de 20 mcg/kg et plus (moins que le MRHDID sur une base mcg/m² ). Aucun tel effet n'a été noté à 5 mcg/kg (moins que le MRHDID sur une base de mcg/m²).
Formotérol
Des études à long terme ont été menées sur des souris par voie orale et sur des rats par inhalation pour évaluer le potentiel carcinogène du fumarate de formotérol.
Dans une étude de cancérogénicité de 24 mois chez des souris CD-1, le formotérol à des doses orales de 100 mcg/kg et plus (environ 30 et 15 fois le MRHDID chez les adultes et les enfants, respectivement, sur une base mcg/m²) a provoqué une dose- augmentation connexe de l'incidence des léiomyomes utérins.
Dans une étude de cancérogénicité de 24 mois chez des rats Sprague-Dawley, une incidence accrue de léiomyome mésovarien et de léiomyosarcome utérin a été observée à la dose inhalée de 130 mcg/kg (environ 70 et 35 fois la MRHDID chez les adultes et les enfants, respectivement, sur un base mcg/m²). Aucune tumeur n'a été vue à 22 mcg/kg (environ 12 et 6 fois le MRHDID dans les adultes et les enfants, respectivement, sur une base de mcg/m²).
D'autres médicaments bêta-agonistes ont également démontré une augmentation des léiomyomes du tractus génital chez les rongeurs femelles. La pertinence de ces résultats pour l'utilisation humaine est inconnue.
Le formotérol n'a pas été mutagène ni clastogène dans le test d'Ames Salmonella/microsome sur plaque, le test de lymphome de souris, le test d'aberration chromosomique dans les lymphocytes humains et le test du micronoyau de rat.
Une réduction de la fertilité et/ou de la performance reproductive a été identifiée chez les rats mâles traités avec le formotérol à une dose orale de 15 000 mcg/kg (environ 2 200 fois le MRHDID sur une base AUC). Aucun tel effet n'a été vu à 3000 mcg/kg (environ 1600 fois le MRHDID sur une base de mcg/m²). Dans une étude séparée avec des rats mâles traités avec une dose orale de 15 000 mcg/kg (environ 8 000 fois le MRHDID sur une base de mcg/m²), il y a eu des découvertes d'atrophie tubulaire testiculaire et de débris spermatiques dans les testicules et d'oligospermie dans les épididymes. Aucun effet sur la fertilité n'a été détecté dans les rats femelles aux doses jusqu'à 15 000 mcg/kg (environ 1100 fois le MRHDID sur une base AUC).
Utilisation dans des populations spécifiques
Grossesse
Résumé des risques
Il n'y a pas d'études adéquates et bien contrôlées de SYMBICORT 160 mg ou de l'un de ses composants individuels, le fumarate de formotérol, chez les femmes enceintes ; cependant, des études sont disponibles pour l'autre composant, le budésonide. Dans les études de reproduction chez l'animal, SYMBICORT 4,5 mcg, administré par inhalation, s'est avéré tératogène, embryocide et a réduit le poids des fœtus chez le rat à une dose inférieure à la dose maximale recommandée pour l'inhalation humaine quotidienne (MRHDID) sur une base de mcg/m². Le budésonide seul, administré par voie sous-cutanée, était tératogène, embryocide et réduisait le poids des fœtus chez les rats et les lapins à des doses inférieures à la MRHDID, mais ces effets n'ont pas été observés chez les rats ayant reçu des doses inhalées jusqu'à 4 fois la MRHDID. Les études sur les femmes enceintes n'ont pas montré que le budésonide inhalé seul augmente le risque d'anomalies lorsqu'il est administré pendant la grossesse. L'expérience avec les corticostéroïdes oraux suggère que les rongeurs sont plus sujets aux effets tératogènes de l'exposition aux corticostéroïdes que les humains. Le fumarate de formotérol seul, administré par voie orale, s'est avéré tératogène chez le rat et le lapin à 1600 et 65 000 fois la MRHDID, respectivement. Le fumarate de formotérol était également embryocide, augmentait la perte de petits à la naissance et pendant la lactation et diminuait le poids des petits chez les rats à 110 fois le MRHDID. Ces effets indésirables se produisaient généralement à des multiples élevés du MRHDID lorsque le fumarate de formotérol était administré par voie orale pour obtenir des expositions systémiques élevées. Aucun effet tératogène, embryocide ou sur le développement n'a été observé chez les rats ayant reçu des doses par inhalation allant jusqu'à 375 fois la MRHDID.
Le risque de fond estimé de malformations congénitales majeures et de fausse couche des populations indiquées est inconnu. Dans la population générale des États-Unis, le risque de fond estimé de malformations congénitales majeures et de fausse couche dans les grossesses cliniquement reconnues est de 2 % à 4 % et de 15 % à 20 %, respectivement.
Considérations cliniques
Risque maternel et/ou embryonnaire/fœtal associé à la maladie
Chez les femmes dont l'asthme est mal ou modérément contrôlé, il existe un risque accru de plusieurs issues indésirables périnatales telles que la prééclampsie chez la mère et la prématurité, le faible poids à la naissance et la petite taille pour l'âge gestationnel chez le nouveau-né. Les femmes enceintes souffrant d'asthme doivent être étroitement surveillées et les médicaments ajustés si nécessaire pour maintenir un contrôle optimal de l'asthme.
Travail ou accouchement
Il n'y a pas d'études humaines bien contrôlées qui ont étudié les effets de SYMBICORT 4,5 mcg pendant le travail et l'accouchement. En raison du potentiel d'interférence des bêta-agonistes avec la contractilité utérine, l'utilisation de SYMBICORT 4,5 mcg pendant le travail doit être limitée aux patientes pour lesquelles les avantages l'emportent clairement sur les risques.
Données
Données humaines
Les études sur les femmes enceintes n'ont pas montré que le budésonide inhalé augmente le risque d'anomalies lorsqu'il est administré pendant la grossesse. Les résultats d'une vaste étude épidémiologique de cohorte prospective basée sur la population examinant les données de trois registres suédois couvrant environ 99 % des grossesses de 1995 à 1997 (c. pour les malformations congénitales résultant de l'utilisation de budésonide inhalé en début de grossesse. Les malformations congénitales ont été étudiées en 2014 chez des nourrissons nés de mères déclarant avoir utilisé du budésonide inhalé pour l'asthme en début de grossesse (généralement 10 à 12 semaines après la dernière période menstruelle), période au cours de laquelle la plupart des malformations d'organes majeures se produisent. Le taux de malformations congénitales enregistrées était similaire à celui de la population générale (3,8 % contre 3,5 %, respectivement). De plus, après exposition au budésonide inhalé, le nombre de nourrissons nés avec des fentes orofaciales était similaire au nombre attendu dans la population normale (4 enfants contre 3,3, respectivement).
Ces mêmes données ont été utilisées dans une seconde étude portant le total à 2534 nourrissons dont les mères ont été exposées au budésonide inhalé. Dans cette étude, le taux de malformations congénitales chez les nourrissons dont les mères ont été exposées au budésonide inhalé en début de grossesse n'était pas différent du taux de tous les nouveau-nés au cours de la même période (3,6 %).
Données animales
SYMBICORT
Dans une étude sur le développement embryo-fœtal chez des rates gravides ayant reçu une dose pendant la période d'organogenèse des jours de gestation 6 à 16, SYMBICORT 160 mg a produit une hernie ombilicale chez les fœtus à des doses inférieures à la MRHDID (sur une base de mcg/m² à des doses maternelles inhalées de 12/ 0,66 mcg/kg/jour et plus). Les poids fœtaux ont été réduits à environ 5 et 3 fois le MRHDID, respectivement (sur la base de l'ASC à une dose maternelle inhalée de 80/4,4 mcg/kg (budésonide/formotérol)). Aucun effet tératogène ou embryocide n'a été détecté à des doses inférieures au MRHDID (sur une base de mcg/m² à une dose maternelle inhalée de 2,5/0,14 mcg/kg/jour).
Budésonide
Dans une étude de fertilité et de reproduction, des rats mâles ont reçu une dose sous-cutanée pendant 9 semaines et des rats femelles pendant 2 semaines avant l'accouplement et tout au long de la période d'accouplement. Les femelles ont été dosées jusqu'au sevrage de leur progéniture. Le budésonide a provoqué une diminution de la viabilité prénatale et de la viabilité des ratons à la naissance et pendant la lactation, ainsi qu'une diminution du gain de poids corporel maternel, à des doses inférieures au MRHDID (sur une base mcg/m² à des doses sous-cutanées maternelles de 20 mcg/ kg/jour et plus). Aucun de ces effets n'a été noté à une dose inférieure au MRHDID (sur une base de mcg/m² à une dose maternelle sous-cutanée de 5 mcg/kg/jour).
Dans une étude sur le développement embryo-fœtal chez des lapines gravides ayant reçu une dose pendant la période d'organogenèse des jours de gestation 6 à 18, le budésonide a produit une perte fœtale, une diminution du poids fœtal et des anomalies squelettiques à des doses inférieures à la MRHDID (sur une base de mcg/m² à une dose maternelle sous-cutanée de 25 mcg/kg/jour). Dans une étude sur le développement embryo-fœtal chez des rates gravides ayant reçu une dose pendant la période d'organogenèse des jours de gestation 6 à 15, le budésonide a produit des effets indésirables similaires sur le fœtus à des doses d'environ 8 fois la MRHDID (sur une base de mcg/m² à une dose sous-cutanée maternelle de 500 µg/kg/jour). Dans une autre étude sur le développement embryo-fœtal chez des rats gravides, aucun effet tératogène ou embryocide n'a été observé à des doses allant jusqu'à 4 fois le MRHDID (sur une base de mcg/m² à des doses d'inhalation maternelles allant jusqu'à 250 mcg/kg/jour).
Dans une étude sur le développement périnatal et postnatal, chez des rats ayant reçu du 15e jour de gestation au 21e jour postpartum, le budésonide n'a eu aucun effet sur l'accouchement, mais a eu un effet sur la croissance et le développement de la progéniture. La survie de la progéniture était réduite et la progéniture survivante présentait une diminution du poids corporel moyen à la naissance et pendant l'allaitement à des doses inférieures à la MRHDID et supérieures (sur une base en mcg/m² à des doses sous-cutanées maternelles de 20 mcg/kg/jour et supérieures). Ces découvertes se sont produites en présence de toxicité maternelle.
Formotérol
Dans une étude de fertilité et de reproduction, des rats mâles ont reçu une dose orale pendant 9 semaines et des rats femelles pendant 2 semaines avant l'accouplement et tout au long de la période d'accouplement. Les femelles ont reçu des doses jusqu'au jour de gestation 19 ou jusqu'au sevrage de leur progéniture. Les mâles ont reçu des doses jusqu'à 25 semaines. Une hernie ombilicale a été observée chez les fœtus de rat à des doses orales 1600 fois supérieures au MRHDID (sur une base de mcg/m² à des doses orales maternelles de 3000 mcg/kg/jour et plus). Brachygnathia a été observé dans les foetus de rat à une dose 8000 fois le MRHDID (sur une base de mcg/m² à une dose maternelle orale de 15 000 mcg/kg/jour). La grossesse a été prolongée à une dose 8000 fois le MRHDID (sur une base de mcg/m² à une dose orale maternelle de 15 000 mcg/kg/jour). Des décès de fœtus et de petits sont survenus à des doses d'environ 1 600 fois la MRHDID et plus (sur une base de mcg/m² à des doses orales de 3 000 mcg/kg/jour et plus) pendant la gestation.
Dans une étude sur le développement embryo-fœtal chez des rats gravides ayant reçu une dose pendant la période d'organogenèse des jours de gestation 6 à 15, aucun effet tératogène, embryocide ou sur le développement n'a été observé à des doses allant jusqu'à 375 fois le MRHDID (sur une base de mcg/m² avec inhalation maternelle doses allant jusqu'à 690 mcg/kg/jour).
Dans une étude sur le développement embryo-fœtal chez des lapines gravides recevant une dose pendant la période d'organogenèse des jours de gestation 6 à 18, des kystes sous-capsulaires sur le foie ont été observés chez les fœtus à une dose 65 000 fois la MRHDID (sur une base de mcg/m² avec une dose orale de 60 000 mcg/kg/jour). Aucun effet tératogène n'a été observé à des doses allant jusqu'à 3800 fois le MRHDID (sur une base mcg/m² à des doses maternelles orales allant jusqu'à 3500 mcg/kg/jour).
Dans une étude sur le développement prénatal et postnatal, des rates gravides ont reçu du formotérol à des doses orales de 0, 210, 840 et 3400 mcg/kg/jour du 6e jour de gestation jusqu'à la période de lactation. La survie des petits a diminué de la naissance au 26e jour post-partum à des doses 110 fois supérieures à la MRHDID (sur une base en mcg/m² à des doses orales maternelles de 210 mcg/kg/jour et plus), bien qu'il n'y ait eu aucune preuve d'une relation dose-réponse relation. Il n'y a eu aucun effet lié au traitement sur le développement physique, fonctionnel et comportemental des ratons.
Lactation
Résumé des risques
Il n'y a pas de données disponibles sur les effets de SYMBICORT 4,5 mcg, du budésonide ou du fumarate de formotérol sur l'enfant allaité ou sur la production de lait. Le budésonide, comme les autres corticostéroïdes inhalés, est présent dans le lait maternel [voir Données ]. Il n'y a pas de données disponibles sur la présence de fumarate de formotérol dans le lait maternel. Le fumarate de formotérol est présent dans le lait de rat [voir Données ]. Les avantages de l'allaitement pour le développement et la santé doivent être pris en compte, ainsi que le besoin clinique de la mère pour SYMBICORT 4,5 mcg et tout effet indésirable potentiel sur le nourrisson allaité à partir de SYMBICORT 160 mg ou de l'affection maternelle sous-jacente.
Données
Les données humaines sur le budésonide administré par inhalateur de poudre sèche indiquent que la dose orale quotidienne totale de budésonide disponible dans le lait maternel pour le nourrisson est d'environ 0,3 % à 1 % de la dose inhalée par la mère [voir PHARMACOLOGIE CLINIQUE ]. Pour SYMBICORT 4,5 mcg, la dose de budésonide disponible pour le nourrisson dans le lait maternel, en pourcentage de la dose maternelle, devrait être similaire.
Dans l'étude de fertilité et de reproduction chez le rat, les taux plasmatiques de formotérol ont été mesurés chez les ratons au jour 15 après la naissance [voir Utilisation dans des populations spécifiques ]. Il a été estimé que la concentration plasmatique maximale que les petits ont reçue de l'animal maternel, à la dose la plus élevée de 15 mg/kg, après l'allaitement était de 4,4 % (0,24 nmol/L pour une portée contre 5,5 nmol/L pour la mère) .
Utilisation pédiatrique
L'innocuité et l'efficacité de SYMBICORT chez les patients asthmatiques âgés de 12 ans et plus ont été établies dans des études allant jusqu'à 12 mois. Dans les deux études pivots américaines contrôlées par placebo, à double insu, d'une durée de 12 semaines, 25 patients âgés de 12 à 17 ans ont été traités par SYMBICORT deux fois par jour [voir Etudes cliniques ]. Les résultats d'efficacité dans ce groupe d'âge étaient similaires à ceux observés chez les patients de 18 ans et plus. Il n'y avait pas de différences évidentes dans le type ou la fréquence des événements indésirables signalés dans ce groupe d'âge par rapport aux patients de 18 ans et plus.
L'innocuité et l'efficacité de SYMBICORT 80/4.5 chez les patients asthmatiques âgés de 6 à moins de 12 ans ont été établies dans des études d'une durée allant jusqu'à 12 semaines [voir Etudes cliniques ]. Le profil d'innocuité chez ces patients correspondait à celui observé chez les patients âgés de 12 ans et plus ayant également reçu SYMBICORT [voir EFFETS INDÉSIRABLES ].
L'innocuité et l'efficacité de SYMBICORT 160 mg chez les patients asthmatiques de moins de 6 ans n'ont pas été établies.
Des études cliniques contrôlées ont montré que les corticostéroïdes inhalés par voie orale, y compris le budésonide, un composant de SYMBICORT, peuvent entraîner une réduction de la vitesse de croissance chez les patients pédiatriques. Cet effet a été observé en l'absence de preuves de laboratoire de suppression de l'axe HPA, suggérant que la vitesse de croissance est un indicateur plus sensible de l'exposition systémique aux corticostéroïdes chez les patients pédiatriques que certains tests couramment utilisés de la fonction de l'axe HPA. L'effet à long terme de cette réduction de la vitesse de croissance associée aux corticostéroïdes inhalés par voie orale, y compris l'impact sur la taille finale, est inconnu. Le potentiel de croissance « de rattrapage » après l'arrêt du traitement par des corticostéroïdes inhalés par voie orale n'a pas été suffisamment étudié.
Dans une étude portant sur des enfants asthmatiques âgés de 5 à 12 ans, ceux traités par budésonide DPI 200 mcg deux fois par jour (n = 311) ont présenté une réduction de croissance de 1,1 centimètre par rapport à ceux recevant un placebo (n = 418) au bout d'un an ; la différence entre ces deux groupes de traitement n'a pas augmenté davantage au cours des trois années de traitement supplémentaire. Au bout de 4 ans, les enfants traités par budésonide DPI et les enfants traités par placebo avaient des vitesses de croissance similaires. Les conclusions tirées de cette étude peuvent être faussées par l'utilisation inégale des corticostéroïdes dans les groupes de traitement et l'inclusion de données provenant de patients atteignant la puberté au cours de l'étude.
La croissance des patients pédiatriques recevant des corticostéroïdes inhalés par voie orale, y compris SYMBICORT, doit être surveillée. Si un enfant ou un adolescent sous corticostéroïde semble présenter un retard de croissance, la possibilité qu'il soit particulièrement sensible à cet effet doit être envisagée. Les effets potentiels sur la croissance d'un traitement prolongé doivent être mis en balance avec les bénéfices cliniques obtenus. Pour minimiser les effets systémiques des corticostéroïdes inhalés par voie orale, y compris SYMBICORT, chaque patient doit être titré au dosage le plus faible qui contrôle efficacement son asthme [voir DOSAGE ET ADMINISTRATION ].
Utilisation gériatrique
Sur le nombre total de patients asthmatiques traités par SYMBICORT à 160 mg deux fois par jour dans deux études de 12 semaines et une étude postcommercialisation de 26 semaines, 791 étaient âgés de 65 ans ou plus, dont 141 avaient 75 ans ou plus.
Dans les études sur la MPOC d'une durée de 6 à 12 mois, 810 patients traités par SYMBICORT 160/4,5, deux inhalations deux fois par jour étaient âgés de 65 ans et plus et parmi ceux-ci, 177 patients étaient âgés de 75 ans et plus. Aucune différence globale dans la sécurité ou l'efficacité n'a été observée entre ces patients et les patients plus jeunes, et d'autres expériences cliniques rapportées n'ont pas identifié de différences dans les réponses entre les patients âgés et les patients plus jeunes.
Comme avec d'autres produits contenant des bêta2-agonistes, une prudence particulière doit être observée lors de l'utilisation de SYMBICORT chez les patients gériatriques qui ont une maladie cardiovasculaire concomitante qui pourrait être affectée négativement par les bêta2-agonistes.
Sur la base des données disponibles pour SYMBICORT ou ses composants actifs, aucun ajustement de la posologie de SYMBICORT 4,5 mcg chez les patients gériatriques n'est justifié.
Insuffisance hépatique
Aucune étude pharmacocinétique formelle utilisant SYMBICORT n'a été menée chez des patients atteints d'insuffisance hépatique. Cependant, étant donné que le budésonide et le fumarate de formotérol sont principalement éliminés par métabolisme hépatique, une altération de la fonction hépatique peut entraîner une accumulation de budésonide et de fumarate de formotérol dans le plasma. Par conséquent, les patients atteints de maladie hépatique doivent être étroitement surveillés.
Insuffisance rénale
Aucune étude pharmacocinétique formelle utilisant SYMBICORT n'a été menée chez des patients atteints d'insuffisance rénale.
SURDOSAGE
SYMBICORT
SYMBICORT contient à la fois du budésonide et du formotérol; par conséquent, les risques associés à un surdosage pour les composants individuels décrits ci-dessous s'appliquent à SYMBICORT. Dans les études pharmacocinétiques, des doses uniques de 960/54 mcg (12 actionnements de SYMBICORT 80/4,5) et de 1280/36 mcg (8 actionnements de 160/4,5) ont été administrées à des patients atteints de MPOC. Un total de 1 920/54 mcg (12 actionnements de SYMBICORT 160/4,5) a été administré en une seule dose à la fois à des sujets sains et à des patients asthmatiques. Dans une étude d'innocuité à long terme avec contrôle actif chez des patients asthmatiques adolescents et adultes âgés de 12 ans et plus, SYMBICORT 160/4,5 a été administré pendant une période allant jusqu'à 12 mois à des doses allant jusqu'à deux fois la dose quotidienne recommandée la plus élevée. Aucun effet indésirable cliniquement significatif n'a été observé dans aucune de ces études.
Budésonide
Le potentiel d'effets toxiques aigus suite à un surdosage de budésonide est faible. En cas d'utilisation à des doses excessives pendant des périodes prolongées, des effets corticostéroïdes systémiques tels qu'un hypercorticisme peuvent survenir [voir AVERTISSEMENTS ET PRECAUTIONS ]. Le budésonide à cinq fois la dose maximale recommandée (3200 mcg par jour) administré à l'homme pendant 6 semaines a entraîné une réduction significative (27 %) de la réponse plasmatique du cortisol à une perfusion d'ACTH de 6 heures par rapport au placebo (+1 %). L'effet correspondant de 10 mg de prednisone par jour était une réduction de 35 % de la réponse du cortisol plasmatique à l'ACTH.
Formotérol
Un surdosage de formotérol entraînerait probablement une exagération des effets typiques des bêta2agonistes : convulsions, angine de poitrine, hypertension, hypotension, tachycardie, tachyarythmies auriculaires et ventriculaires, nervosité, maux de tête, tremblements, palpitations, crampes musculaires, nausées, étourdissements, troubles du sommeil. , acidose métabolique, hyperglycémie, hypokaliémie. Comme avec tous les médicaments sympathomimétiques, un arrêt cardiaque et même la mort peuvent être associés à l'abus de formotérol. Aucun effet indésirable cliniquement significatif n'a été observé lorsque le formotérol a été administré à des patients adultes souffrant de bronchoconstriction aiguë à une dose de 90 mcg/jour pendant 3 heures ou à des asthmatiques stables 3 fois par jour à une dose totale de 54 mcg/jour pendant 3 jours.
Le traitement d'un surdosage de formotérol consiste en l'arrêt du médicament et en l'instauration d'un traitement symptomatique et/ou de soutien approprié. L'utilisation judicieuse d'un bêta-bloquant cardiosélectif peut être envisagée, sachant qu'une telle médication peut provoquer un bronchospasme. Les preuves sont insuffisantes pour déterminer si la dialyse est bénéfique en cas de surdosage de formotérol. Une surveillance cardiaque est recommandée en cas de surdosage.
CONTRE-INDICATIONS
L'utilisation de SYMBICORT est contre-indiquée dans les conditions suivantes :
- Traitement primaire de l'état de mal asthmatique ou d'autres épisodes aigus d'asthme ou de MPOC nécessitant des mesures intensives.
- Hypersensibilité à l'un des ingrédients de SYMBICORT.
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
SYMBICORT
SYMBICORT contient à la fois du budésonide et du formotérol; par conséquent, les mécanismes d'action décrits ci-dessous pour les composants individuels s'appliquent à SYMBICORT. Ces médicaments représentent deux classes de médicaments (un corticostéroïde synthétique et un agoniste sélectif des récepteurs bêta2-adrénergiques à longue durée d'action) qui ont des effets différents sur les indices cliniques, physiologiques et inflammatoires de la MPOC et de l'asthme.
Budésonide
Le budésonide est un corticostéroïde anti-inflammatoire qui présente une puissante activité glucocorticoïde et une faible activité minéralocorticoïde. Dans les modèles in vitro et animaux standard, le budésonide a une affinité environ 200 fois plus élevée pour le récepteur des glucocorticoïdes et une puissance anti-inflammatoire topique 1000 fois plus élevée que le cortisol (dosage de l'œdème de l'oreille à l'huile de croton de rat). En tant que mesure de l'activité systémique, le budésonide est 40 fois plus puissant que le cortisol lorsqu'il est administré par voie sous-cutanée et 25 fois plus puissant lorsqu'il est administré par voie orale dans le test d'involution du thymus chez le rat.
Dans les études d'affinité pour les récepteurs des glucocorticoïdes, la forme 22R du budésonide était deux fois plus active que l'épimère 22S. Des études in vitro ont indiqué que les deux formes de budésonide ne s'interconvertissent pas.
L'inflammation est un élément important dans la pathogenèse de la MPOC et de l'asthme. Les corticostéroïdes ont un large éventail d'activités inhibitrices contre plusieurs types de cellules (p. ex. mastocytes, éosinophiles, neutrophiles, macrophages et lymphocytes) et médiateurs (p. ex. histamine, eicosanoïdes, leucotriènes et cytokines) impliqués dans les réactions allergiques et non allergiques. inflammation. Ces actions anti-inflammatoires des corticostéroïdes peuvent contribuer à leur efficacité dans la BPCO et l'asthme.
Des études chez des patients asthmatiques ont montré un rapport favorable entre l'activité anti-inflammatoire topique et les effets corticostéroïdes systémiques sur une large gamme de doses de budésonide. Cela s'explique par la combinaison d'un effet anti-inflammatoire local relativement élevé, d'une importante dégradation hépatique de premier passage du médicament absorbé par voie orale (85 % à 95 %) et de la faible puissance des métabolites formés.
Formotérol
Le fumarate de formotérol est un agoniste bêta2-adrénergique sélectif à longue durée d'action (bêta2-agoniste) avec un début d'action rapide. Le fumarate de formotérol inhalé agit localement dans les poumons comme un bronchodilatateur. Des études in vitro ont montré que le formotérol a une activité agoniste plus de 200 fois supérieure sur les récepteurs bêta2 que sur les récepteurs bêta1. La sélectivité de liaison in vitro aux récepteurs bêta2 sur bêta1-adrénergiques est plus élevée pour le formotérol que pour l'albutérol (5 fois), tandis que le salmétérol a un rapport de sélectivité bêta2 plus élevé (3 fois) que le formotérol.
Bien que les récepteurs bêta2 soient les récepteurs adrénergiques prédominants dans le muscle lisse bronchique et que les récepteurs bêta1 soient les récepteurs prédominants dans le cœur, il existe également des récepteurs bêta2 dans le cœur humain représentant 10 % à 50 % du total des récepteurs bêta-adrénergiques. La fonction précise de ces récepteurs n'a pas été établie, mais ils soulèvent la possibilité que même des bêta2-agonistes hautement sélectifs puissent avoir des effets cardiaques.
Les effets pharmacologiques des agonistes des récepteurs bêta2-adrénergiques, y compris le formotérol, sont au moins en partie attribuables à la stimulation de l'adénylcyclase intracellulaire, l'enzyme qui catalyse la conversion de l'adénosine triphosphate (ATP) en adénosine monophosphate 3', 5' cyclique ( AMP cyclique). Des niveaux accrus d'AMP cyclique provoquent une relaxation du muscle lisse bronchique et une inhibition de la libération de médiateurs d'hypersensibilité immédiate par les cellules, en particulier par les mastocytes.
Des tests in vitro montrent que le formotérol est un inhibiteur de la libération de médiateurs mastocytaires, tels que l'histamine et les leucotriènes, par le poumon humain. Le formotérol inhibe également l'extravasation de l'albumine plasmatique induite par l'histamine chez les cobayes anesthésiés et inhibe l'afflux d'éosinophiles induit par les allergènes chez les chiens présentant une hyperréactivité des voies respiratoires. La pertinence de ces découvertes in vitro et animales pour les humains est inconnue.
Pharmacodynamie
Asthme
Effets cardiovasculaires
Dans une étude croisée à dose unique portant sur 201 patients souffrant d'asthme persistant, des traitements à dose unique de 4,5, 9 et 18 mcg de formotérol en association avec 320 mcg de budésonide administrés via SYMBICORT ont été comparés au budésonide 320 mcg seul. Des améliorations dose-ordonnées du VEMS ont été démontrées par rapport au budésonide. Des ECG et des échantillons de sang pour le glucose et le potassium ont été obtenus après l'administration de la dose. Pour SYMBICORT 4,5 mcg, de petites augmentations moyennes de la glycémie et des diminutions de la kaliémie (+0,44 mmol/L et -0,18 mmol/L à la dose la plus élevée, respectivement) ont été observées avec des doses croissantes de formotérol, par rapport au budésonide. Dans les ECG, SYMBICORT a produit de petites augmentations moyennes liées à la dose de la fréquence cardiaque (environ 3 bpm à la dose la plus élevée) et des intervalles QTc (3 à 6 msec) par rapport au budésonide seul. Aucun sujet n'avait une valeur QT ou QTc ≥ 500 msec.
Aux États-Unis, cinq études de 12 semaines contrôlées contre comparateur actif et contre placebo et une étude contrôlée contre comparateur actif de 6 mois ont évalué 2 976 patients asthmatiques âgés de 6 ans et plus. Les effets pharmacodynamiques systémiques du formotérol (fréquence cardiaque/pouls, tension artérielle, intervalle QTc, potassium et glucose) étaient similaires chez les patients traités par SYMBICORT, par rapport aux patients traités par la poudre sèche de formotérol pour inhalation 4,5 mcg, 2 inhalations deux fois par jour. Aucun patient n'a eu de valeur QT ou QTc ≥ 500 msec pendant le traitement.
Dans trois études contrôlées par placebo chez des adolescents et des adultes asthmatiques âgés de 12 ans et plus, un total de 1232 patients (553 patients dans le groupe SYMBICORT 160 mg) ont bénéficié d'une surveillance électrocardiographique continue évaluable sur 24 heures. Dans l'ensemble, il n'y avait aucune différence importante dans la survenue d'ectopies ventriculaires ou supraventriculaires et aucune preuve d'un risque accru de dysrythmie cliniquement significative dans le groupe SYMBICORT 160 mg par rapport au groupe placebo.
Effets de l'axe HPA
Dans l'ensemble, aucun effet cliniquement important sur l'axe HPA, tel que mesuré par le cortisol urinaire sur 24 heures, n'a été observé chez les patients adultes ou adolescents traités par SYMBICORT à des doses allant jusqu'à 640/18 mcg/jour par rapport au budésonide.
Bronchopneumopathie chronique obstructive
Effets cardiovasculaires
Dans deux études sur la fonction pulmonaire dans la MPOC, d'une durée de 6 mois et de 12 mois incluant 3 668 patients atteints de MPOC, aucune différence cliniquement importante n'a été observée dans le pouls, la tension artérielle, le potassium et le glucose entre SYMBICORT, les composants individuels de SYMBICORT à 160 mg et le placebo [voir Etudes cliniques ].
Les ECG enregistrés lors de multiples visites à la clinique pendant le traitement dans les deux études n'ont montré aucune différence cliniquement importante pour la fréquence cardiaque, l'intervalle PR, la durée du QRS, la fréquence cardiaque, les signes d'ischémie cardiaque ou d'arythmie entre SYMBICORT 160/4,5 les monoproduits et le placebo, tous administrés en 2 inhalations deux fois par jour. D'après les ECG, 6 patients traités par SYMBICORT 160/4,5, 6 patients traités par formotérol 4,5 mcg et 6 patients du groupe placebo ont présenté une fibrillation ou un flutter auriculaire qui n'était pas présent au départ. Il n'y a eu aucun cas de tachycardie ventriculaire non soutenue dans les groupes SYMBICORT 160/4,5, formotérol 4,5 mcg ou placebo.
Dans l'étude de 12 mois, 520 patients ont bénéficié d'une surveillance ECG continue évaluable (Holter) sur 24 heures avant la première dose et après environ 1 et 4 mois de traitement. Aucune différence cliniquement importante dans les arythmies ventriculaires ou supraventriculaires, les battements ectopiques ventriculaires ou supraventriculaires ou la fréquence cardiaque n'a été observée parmi les groupes traités par SYMBICORT 160/4,5, le formotérol ou le placebo pris en 2 inhalations deux fois par jour. D'après la surveillance ECG (Holter), un patient sous SYMBICORT 160/4,5, aucun patient sous formotérol 4,5 mcg et trois patients du groupe placebo ont présenté une fibrillation auriculaire ou un flutter qui n'était pas présent au départ.
Effets de l'axe HPA
Des mesures de cortisol urinaire sur vingt-quatre heures ont été recueillies dans un sous-ensemble groupé (n = 616) de patients issus de deux études sur la fonction pulmonaire de la MPOC. Les données ont indiqué des valeurs moyennes de cortisol libre urinaire sur 24 heures inférieures d'environ 30 % après l'administration chronique (> 6 mois) de SYMBICORT par rapport au placebo. SYMBICORT 4,5 mcg a semblé présenter une suppression du cortisol comparable au budésonide 160 mcg seul ou à la co-administration de budésonide 160 mcg et de formotérol 4,5 mcg. Pour les patients traités avec SYMBICORT 160 mg ou un placebo pendant une période allant jusqu'à 12 mois, le pourcentage de patients qui est passé de normal à faible pour cette mesure était généralement comparable.
Autres produits de budésonide
Pour confirmer que l'absorption systémique n'est pas un facteur significatif dans l'efficacité clinique du budésonide inhalé, une étude clinique chez des patients asthmatiques a été réalisée comparant 400 mcg de budésonide administré via un inhalateur-doseur sous pression avec un tube d'espacement à 1 400 mcg de budésonide oral et un placebo. . L'étude a démontré l'efficacité du budésonide inhalé mais pas du budésonide ingéré par voie orale, malgré des niveaux systémiques comparables. Ainsi, l'effet thérapeutique des doses conventionnelles de budésonide inhalé par voie orale s'explique en grande partie par son action directe sur les voies respiratoires.
Il a été démontré que le budésonide inhalé diminue la réactivité des voies respiratoires à divers modèles de provocation, notamment l'histamine, la méthacholine, le métabisulfite de sodium et l'adénosine monophosphate chez les patients présentant des voies respiratoires hyperréactives. La pertinence clinique de ces modèles n'est pas certaine.
Un prétraitement avec du budésonide inhalé, 1600 mcg par jour (800 mcg deux fois par jour) pendant 2 semaines a réduit la diminution aiguë (réaction de phase précoce) et retardée (réaction de phase tardive) du VEMS suite à une provocation par allergène inhalé.
Les effets systémiques des corticostéroïdes inhalés sont liés à l'exposition systémique à ces médicaments. Des études pharmacocinétiques ont démontré que chez les adultes et les enfants asthmatiques, l'exposition systémique au budésonide est plus faible avec SYMBICORT 160 mg par rapport au budésonide inhalé administré à la même dose administrée via un inhalateur de poudre sèche [voir PHARMACOLOGIE CLINIQUE ]. Par conséquent, les effets systémiques (axe HPA et croissance) du budésonide délivré par SYMBICORT ne devraient pas être supérieurs à ceux rapportés pour le budésonide inhalé lorsqu'il est administré à des doses comparables via l'inhalateur de poudre sèche [voir Utilisation dans des populations spécifiques ].
Effets de l'axe HPA
Les effets du budésonide inhalé administré via un inhalateur de poudre sèche sur l'axe HPA ont été étudiés chez 905 adultes et 404 patients pédiatriques souffrant d'asthme. Pour la plupart des patients, la capacité à augmenter la production de cortisol en réponse au stress, telle qu'évaluée par le test de stimulation à la cosyntropine (ACTH), est restée intacte avec le traitement au budésonide aux doses recommandées. Chez les patients adultes traités avec 100, 200, 400 ou 800 mcg deux fois par jour pendant 12 semaines, 4 %, 2 %, 6 % et 13 %, respectivement, ont présenté une réponse anormale du cortisol stimulé (pic de cortisol
Autres produits de formotérol
Bien que l'effet pharmacodynamique se fasse via la stimulation des récepteurs bêta-adrénergiques, une activation excessive de ces récepteurs entraîne généralement des tremblements et des crampes des muscles squelettiques, de l'insomnie, de la tachycardie, une diminution du potassium plasmatique et une augmentation du glucose plasmatique. Le formotérol inhalé, comme d'autres médicaments agonistes bêta2-adrénergiques, peut produire des effets cardiovasculaires liés à la dose et des effets sur la glycémie et/ou la kaliémie [voir AVERTISSEMENTS ET PRECAUTIONS ]. Pour SYMBICORT 160 mg, ces effets sont détaillés dans la section Pharmacologie clinique, Pharmacodynamie, SYMBICORT (12.2).
L'utilisation de médicaments LABA peut entraîner une tolérance aux effets bronchoprotecteurs et bronchodilatateurs.
Une hyperréactivité bronchique de rebond après l'arrêt d'un traitement bêta-agoniste chronique à longue durée d'action n'a pas été observée.
Pharmacocinétique
SYMBICORT
Absorption
Budésonide
Sujets sains
Le budésonide inhalé par voie orale est rapidement absorbé dans les poumons et la concentration maximale est généralement atteinte en 20 minutes. Après administration orale de budésonide, la concentration plasmatique maximale a été atteinte en environ 1 à 2 heures et la disponibilité systémique absolue était de 6 % à 13 % en raison d'un important métabolisme de premier passage. En revanche, la majeure partie du budésonide délivré aux poumons a été absorbée par voie systémique. Chez les sujets sains, 34 % de la dose mesurée se sont déposés dans les poumons (tel qu'évalué par la méthode de la concentration plasmatique et à l'aide d'un inhalateur de poudre sèche contenant du budésonide) avec une disponibilité systémique absolue de 39 % de la dose mesurée.
Après l'administration de SYMBICORT 160/4,5, deux ou quatre inhalations deux fois par jour pendant 5 jours chez des sujets sains, la concentration plasmatique de budésonide a généralement augmenté proportionnellement à la dose. L'indice d'accumulation pour le groupe ayant reçu 2 inhalations deux fois par jour était de 1,32 pour le budésonide.
Patients asthmatiques
Dans une étude à dose unique, des doses de SYMBICORT supérieures à celles recommandées (12 inhalations de SYMBICORT 160/4,5) ont été administrées à des patients souffrant d'asthme modéré. La concentration plasmatique maximale de budésonide de 4,5 nmol/L s'est produite 20 minutes après l'administration. Cette étude a démontré que l'exposition systémique totale au budésonide de SYMBICORT 4,5 mcg était inférieure d'environ 30 % à celle du budésonide inhalé via un inhalateur de poudre sèche (DPI) à la même dose administrée. Après l'administration de SYMBICORT, la demi-vie du composant budésonide était de 4,7 heures.
Dans une étude à doses répétées, la dose la plus élevée recommandée de SYMBICORT (160/4,5, deux inhalations deux fois par jour) a été administrée à des patients souffrant d'asthme modéré et à des sujets sains pendant 1 semaine. La concentration plasmatique maximale de budésonide de 1,2 nmol/L s'est produite à 21 minutes chez des patients asthmatiques. La concentration plasmatique maximale de budésonide était inférieure de 27 % chez les patients asthmatiques par rapport à celle des sujets sains. Cependant, l'exposition systémique totale au budésonide était comparable à celle des patients asthmatiques.
Les concentrations plasmatiques maximales à l'état d'équilibre du budésonide administré par DPI chez les adultes asthmatiques étaient en moyenne de 0,6 et 1,6 nmol/L à des doses de 180 mcg et 360 mcg deux fois par jour, respectivement. Chez les patients asthmatiques, le budésonide a montré une augmentation linéaire de l'ASC et de la Cmax avec l'augmentation de la dose après administration unique et répétée de budésonide inhalé.
Patients atteints de MPOC
Dans une étude à dose unique, 12 inhalations de SYMBICORT 80/4,5 (dose totale de 960/54 mcg) ont été administrées à des patients atteints de MPOC. La concentration plasmatique maximale moyenne de budésonide de 3,3 nmol/L s'est produite 30 minutes après l'administration. L'exposition systémique au budésonide était comparable entre SYMBICORT pMDI et la co-administration de budésonide via un aérosol-doseur et de formotérol via un inhalateur à poudre sèche (budésonide 960 mcg et formotérol 54 mcg). Dans la même étude, un groupe ouvert de patients asthmatiques modérés a également reçu la même dose plus élevée de SYMBICORT. Pour le budésonide, les patients atteints de MPOC présentaient une ASC supérieure de 12 % et une Cmax inférieure de 10 % par rapport aux patients asthmatiques.
Dans l'étude clinique pivot de 6 mois sur la fonction pulmonaire, des données pharmacocinétiques à l'état d'équilibre du budésonide ont été obtenues dans un sous-groupe de patients atteints de MPOC avec des bras de traitement de SYMBICORT 4,5 mcg pMDI 160/4,5, SYMBICORT 160 mg pMDI 80/4,5, budésonide 160 mcg, budésonide 160 mcg et formotérol 4,5 mcg administrés ensemble, tous administrés en 2 inhalations deux fois par jour. L'exposition systémique au budésonide (ASC et Cmax) a augmenté proportionnellement avec des doses de 80 mcg à 160 mcg et était généralement similaire entre les 3 groupes de traitement recevant la même dose de budésonide (SYMBICORT 4,5 mcg pMDI 160/4,5, budésonide 160 mcg, budésonide 160 mcg et formotérol 4,5 mcg administrés ensemble).
Formotérol
Le formotérol inhalé est rapidement absorbé; les concentrations plasmatiques maximales sont généralement atteintes au premier prélèvement de plasma, dans les 5 à 10 minutes suivant l'administration. Comme pour de nombreux médicaments pour inhalation orale, il est probable que la majorité du formotérol inhalé administré soit avalé puis absorbé par le tractus gastro-intestinal.
Sujets sains
Après administration de SYMBICORT (160/4,5, deux ou quatre inhalations deux fois par jour) pendant 5 jours chez des sujets sains, la concentration plasmatique de formotérol a généralement augmenté proportionnellement à la dose. L'indice d'accumulation pour le groupe ayant reçu 2 inhalations deux fois par jour était de 1,77 pour le formotérol.
Patients asthmatiques
Dans une étude à dose unique, des doses de SYMBICORT supérieures à celles recommandées (12 inhalations de SYMBICORT 160/4,5) ont été administrées à des patients souffrant d'asthme modéré. La concentration plasmatique maximale de formotérol de 136 pmol s'est produite 10 minutes après l'administration. Environ 8 % de la dose de formotérol délivrée ont été récupérés dans les urines sous forme inchangée.
Dans une étude à doses répétées, la dose la plus élevée recommandée de SYMBICORT (160/4,5, deux inhalations deux fois par jour) a été administrée à des patients souffrant d'asthme modéré et à des sujets sains pendant 1 semaine. La concentration plasmatique maximale de formotérol de 28 pmol/L s'est produite à 10 minutes chez les patients asthmatiques. La concentration plasmatique maximale de formotérol était inférieure d'environ 42 % chez les patients asthmatiques par rapport à celle des sujets sains. Cependant, l'exposition systémique totale au formotérol était comparable à celle des patients asthmatiques.
Patients atteints de MPOC
Après l'administration d'une dose unique de 12 inhalations de SYMBICORT 80/4,5, la concentration plasmatique maximale moyenne de formotérol de 167 pmol/L a été rapidement atteinte 15 minutes après l'administration. L'exposition au formotérol était légèrement supérieure (~16-18 %) avec SYMBICORT 160 mg pMDI par rapport à la co-administration de budésonide via un aérosol-doseur et de formotérol via un inhalateur à poudre sèche (dose totale de budésonide 960 mcg et de formotérol 54 mcg). Dans la même étude, un groupe ouvert de patients asthmatiques modérés a reçu la même dose de SYMBICORT. Les patients atteints de MPOC présentaient une ASC et une Cmax de 12 à 15 % supérieures pour le formotérol par rapport aux patients asthmatiques.
Dans l'étude clinique pivot de 6 mois sur la fonction pulmonaire, des données pharmacocinétiques à l'état d'équilibre du formotérol ont été obtenues dans un sous-groupe de patients atteints de MPOC avec des bras de traitement de SYMBICORT 160 mg pMDI 160/4,5, SYMBICORT 160 mg pMDI 80/4,5, formotérol 4,5 mcg, budésonide 160 mcg et formotérol 4,5 mcg administrés ensemble, tous administrés en 2 inhalations deux fois par jour. L'exposition systémique au formotérol, comme en témoigne l'ASC, était environ 30 % et 16 % plus élevée avec SYMBICORT pMDI par rapport au bras de traitement au formotérol seul et à la co-administration de composants individuels du bras de traitement au budésonide et au formotérol, respectivement.
Distribution
Budésonide
Le volume de distribution du budésonide était d'environ 3 L/kg. Il était lié à 85 % à 90 % aux protéines plasmatiques. La liaison aux protéines était constante sur la plage de concentration (1-100 nmol/L) obtenue avec et dépassant les doses inhalées recommandées. Le budésonide a montré peu ou pas de liaison à la globuline liant les corticostéroïdes. Le budésonide s'est rapidement équilibré avec les globules rouges d'une manière indépendante de la concentration avec un rapport plasma sanguin d'environ 0,8.
Formotérol
Sur la plage de concentrations de 10 à 500 nmol/L, la liaison aux protéines plasmatiques des énantiomères RR et SS du formotérol était de 46 % et 58 %, respectivement. Les concentrations de formotérol utilisées pour évaluer la liaison aux protéines plasmatiques étaient supérieures à celles obtenues dans le plasma après inhalation d'une dose unique de 54 mcg.
Métabolisme
Budésonide
Des études in vitro avec des homogénats de foie humain ont montré que le budésonide était rapidement et largement métabolisé. Deux métabolites majeurs formés via la biotransformation catalysée par l'isoenzyme 3A4 (CYP3A4) du cytochrome P450 (CYP) ont été isolés et identifiés comme étant la 16α-hydroxyprednisolone et la 6ß-hydroxybudésonide. L'activité corticostéroïde de chacun de ces deux métabolites était inférieure à 1 % de celle du composé parent. Aucune différence qualitative entre les schémas métaboliques in vitro et in vivo n'a été détectée. Une inactivation métabolique négligeable a été observée dans les préparations de poumon et de sérum humains.
Formotérol
Le métabolisme primaire du formotérol se fait par glucuronidation directe et par O-déméthylation suivie d'une conjugaison à des métabolites inactifs. Les voies métaboliques secondaires comprennent la déformylation et la conjugaison des sulfates. Le CYP2D6 et le CYP2C ont été identifiés comme étant principalement responsables de l'odéméthylation.
Élimination
Budésonide
Le budésonide a été excrété dans l'urine et les fèces sous forme de métabolites. Environ 60 % d'une dose intraveineuse radiomarquée ont été récupérés dans l'urine.
Aucun budésonide inchangé n'a été détecté dans les urines. La forme 22R du budésonide était préférentiellement éliminée par le foie avec une clairance systémique de 1,4 L/min contre 1,0 L/min pour la forme 22S. La demi-vie terminale, de 2 à 3 heures, était la même pour les deux épimères et était indépendante de la dose.
Formotérol
L'excrétion du formotérol a été étudiée chez quatre sujets sains après administration simultanée de formotérol radiomarqué par voies orale et IV. Dans cette étude, 62 % du formotérol radiomarqué a été excrété dans l'urine tandis que 24 % a été éliminé dans les fèces.
Populations particulières
Gériatrique
La pharmacocinétique de SYMBICORT 4,5 mcg chez les patients gériatriques n'a pas été spécifiquement étudiée.
Pédiatrique
Les concentrations plasmatiques de budésonide ont été mesurées après l'administration de quatre inhalations de SYMBICORT 160/4,5 dans une étude à dose unique chez des patients pédiatriques asthmatiques âgés de 6 à moins de 12 ans. Des concentrations maximales de budésonide de 1,4 nmol/L ont été observées 20 minutes après l'administration de la dose. Cette étude a également démontré que l'exposition systémique totale au budésonide de SYMBICORT 4,5 mcg était inférieure d'environ 30 % à celle du budésonide inhalé via un inhalateur de poudre sèche qui a également été évalué à la même dose délivrée. La Cmax et l'ASC0-inf normalisées en fonction de la dose du budésonide après inhalation d'une dose unique chez les enfants âgés de 6 à moins de 12 ans étaient numériquement inférieures à celles observées chez les adultes.
Après 2 inhalations de SYMBICORT 160/4,5 deux fois par jour, la Cmax et l'ASC0-6 du formotérol à l'état d'équilibre chez les enfants de 6 à moins de 12 ans étaient comparables à celles observées chez les adultes.
Sexe/Race
Aucune étude spécifique n'a été menée pour examiner les effets du sexe et de la race sur la pharmacocinétique de SYMBICORT. L'analyse PK de population des données de SYMBICORT 4,5 mcg indique que le sexe n'affecte pas la pharmacocinétique du budésonide et du formotérol. Aucune conclusion ne peut être tirée sur l'effet de la race en raison du faible nombre de non-caucasiens évalués pour PK.
Mères allaitantes
La disposition du budésonide lorsqu'il est administré par inhalation à partir d'un inhalateur de poudre sèche à des doses de 200 ou 400 mcg deux fois par jour pendant au moins 3 mois a été étudiée chez huit femmes allaitantes souffrant d'asthme de 1 à 6 mois après l'accouchement. L'exposition systémique au budésonide chez ces femmes semble être comparable à celle observée chez les femmes non allaitantes souffrant d'asthme dans d'autres études. Le lait maternel obtenu plus de huit heures après l'administration a révélé que la concentration maximale de budésonide pour les doses quotidiennes totales de 400 et 800 mcg était de 0,39 et 0,78 nmol/L, respectivement, et s'est produite dans les 45 minutes suivant l'administration. La dose orale quotidienne estimée de budésonide du lait maternel au nourrisson est d'environ 0,007 et 0,014 mcg/kg/jour pour les deux schémas posologiques utilisés dans cette étude, ce qui représente environ 0,3 % à 1 % de la dose inhalée par la mère. Les taux de budésonide dans les échantillons de plasma prélevés sur cinq nourrissons environ 90 minutes après l'allaitement (et environ 140 minutes après l'administration du médicament à la mère) étaient inférieurs aux niveaux quantifiables ( Utilisation dans des populations spécifiques ].
Insuffisance rénale ou hépatique
Il n'y a pas de données concernant l'utilisation spécifique de SYMBICORT chez les patients atteints d'insuffisance hépatique ou rénale. Une fonction hépatique réduite peut affecter l'élimination des corticostéroïdes. La pharmacocinétique du budésonide a été affectée par une altération de la fonction hépatique, comme en témoigne une disponibilité systémique doublée après ingestion orale. La pharmacocinétique du budésonide intraveineux était cependant similaire chez les patients cirrhotiques et chez les sujets sains. Des données spécifiques avec le formotérol ne sont pas disponibles, mais comme le formotérol est principalement éliminé par métabolisme hépatique, une exposition accrue peut être attendue chez les patients présentant une insuffisance hépatique sévère.
Interactions médicament-médicament
Une étude croisée à dose unique a été menée pour comparer la pharmacocinétique de huit inhalations des substances suivantes : budésonide, formotérol et budésonide plus formotérol administrés simultanément. Les résultats de l'étude ont indiqué qu'il n'y avait aucune preuve d'une interaction pharmacocinétique entre les deux composants de SYMBICORT.
Inhibiteurs des enzymes du cytochrome P450
Kétoconazole
Le kétoconazole, un puissant inhibiteur de l'isoenzyme 3A4 (CYP3A4) du cytochrome P450 (CYP), la principale enzyme métabolique des corticostéroïdes, a augmenté les taux plasmatiques de budésonide ingéré par voie orale.
Cimétidine
Aux doses recommandées, la cimétidine, un inhibiteur non spécifique des enzymes CYP, a eu un effet léger mais cliniquement non significatif sur la pharmacocinétique du budésonide oral.
Aucune étude spécifique sur les interactions médicamenteuses avec le formotérol n'a été réalisée.
Toxicologie animale et/ou pharmacologie
Préclinique
Des études chez des animaux de laboratoire (porcs miniatures, rongeurs et chiens) ont démontré la survenue d'arythmies cardiaques et de mort subite (avec des signes histologiques de nécrose myocardique) lorsque des bêta-agonistes et des méthylxanthines sont administrés simultanément. La signification clinique de ces résultats est inconnue.
Etudes cliniques
Asthme
Patients asthmatiques de 12 ans et plus
Dans deux études cliniques comparant SYMBICORT 4,5 mcg avec les composants individuels, les améliorations de la plupart des paramètres d'efficacité étaient plus importantes avec SYMBICORT qu'avec l'utilisation du budésonide ou du formotérol seul. De plus, une étude clinique a montré des résultats similaires entre SYMBICORT et l'utilisation simultanée de budésonide et de formotérol à des doses correspondantes provenant d'inhalateurs séparés.
L'innocuité et l'efficacité de SYMBICORT à 160 mg ont été démontrées dans deux études cliniques américaines randomisées, à double insu et contrôlées par placebo portant sur 1 076 patients âgés de 12 ans et plus. Des doses fixes de SYMBICORT de 160/9 mcg et 320/9 mcg deux fois par jour (chaque dose administrée en 2 inhalations des dosages 80/4,5 et 160/4,5 mcg, respectivement) ont été comparées aux monocomposants (budésonide et formotérol) et au placebo pour fournir des informations sur le dosage approprié pour couvrir une gamme de sévérité de l'asthme.
Étude 1 : Étude clinique avec SYMBICORT 160/4,5
Cette étude de 12 semaines a évalué 596 patients âgés de 12 ans et plus en comparant SYMBICORT 160/4,5, l'association gratuite de budésonide 160 mcg plus formotérol 4,5 mcg dans des inhalateurs séparés, budésonide 160 mcg, formotérol 4,5 mcg et placebo ; chacun administré en 2 inhalations deux fois par jour. L'étude comprenait une période de rodage de 2 semaines avec du budésonide 80 mcg, 2 inhalations deux fois par jour. La plupart des patients souffraient d'asthme modéré à sévère et utilisaient des doses modérées à élevées de corticostéroïdes inhalés avant leur entrée dans l'étude. La randomisation a été stratifiée selon le traitement antérieur par corticoïdes inhalés (71,6 % sous corticoïdes modérés et 28,4 % sous corticoïdes inhalés à forte dose). Le pourcentage moyen du VEMS prédit au départ était de 68,1 % et était similaire dans tous les groupes de traitement. Les co-critères principaux d'évaluation de l'efficacité étaient le VEMS post-dose moyen sur 12 heures à la semaine 2 et le VEMS pré-dose moyen au cours de l'étude. L'étude exigeait également que les patients qui satisfaisaient à un critère prédéfini d'aggravation de l'asthme soient retirés. Les critères prédéfinis d'aggravation de l'asthme étaient une diminution cliniquement importante du VEMS ou du DEP, une augmentation de l'utilisation d'albutérol de secours, un réveil nocturne dû à l'asthme, une intervention d'urgence ou une hospitalisation due à l'asthme, ou la nécessité d'un médicament contre l'asthme non autorisé par le protocole. Pour le critère de réveil nocturne dû à l'asthme, les patients étaient autorisés à rester dans l'étude à la discrétion de l'investigateur si aucun des autres critères d'aggravation de l'asthme n'était rempli. Le pourcentage de patients se retirant en raison ou répondant à des critères prédéfinis d'aggravation de l'asthme est indiqué dans le tableau 4.
La variation moyenne en pourcentage par rapport à la ligne de base du VEMS mesuré immédiatement avant l'administration (pré-dose) sur 12 semaines est illustrée à la figure 1. Étant donné que cette étude a utilisé des critères de retrait prédéfinis pour l'aggravation de l'asthme, ce qui a entraîné un taux de retrait différentiel dans les groupes de traitement, Les résultats de la dose FEV1 lors de la dernière visite d'étude disponible (fin de traitement, EOT) sont également fournis. Les patients recevant SYMBICORT 160/4,5 présentaient des améliorations moyennes significativement plus importantes par rapport au départ du VEMS pré-dose à la fin du traitement (0,19 L, 9,4 %), par rapport au budésonide 160 mcg (0,10 L, 4,9 %), le formotérol 4,5 mcg (-0,12 L, -4,8 %) et placebo (-0,17 L, -6,9 %).
Figure 1 : Changement moyen en pourcentage par rapport au départ du VEMS pré-dose sur 12 semaines (étude 1)
INFORMATIONS PATIENTS
SYMBICORT (SIM-bi-kort) (budésonide 80 mcg et fumarate de formotérol dihydraté 4,5 mcg) Aérosol pour inhalation
SYMBICORT (SIM-bi-kort) (budésonide 160 mcg et fumarate de formotérol dihydraté 4,5 mcg) Aérosol pour inhalation
Qu'est-ce que SYMBICORT?
SYMBICORT associe un médicament corticostéroïde inhalé (CSI), le budésonide, et un médicament bêta2-agoniste à longue durée d'action (BALA), le formotérol.
- Les corticostéroïdes inhalés aident à diminuer l'inflammation dans les poumons. L'inflammation des poumons peut entraîner des problèmes respiratoires.
- Les médicaments LABA sont utilisés chez les personnes atteintes de maladie pulmonaire obstructive chronique (MPOC) et d'asthme. Les médicaments LABA aident les muscles entourant les voies respiratoires de vos poumons à rester détendus pour prévenir les symptômes tels que la respiration sifflante, la toux, l'oppression thoracique et l'essoufflement. Ces symptômes peuvent survenir lorsque les muscles autour des voies respiratoires se resserrent. Cela rend la respiration difficile. Dans les cas graves, une respiration sifflante peut arrêter votre respiration et peut entraîner la mort si elle n'est pas traitée immédiatement.
SYMBICORT 4,5 mcg n'est pas utilisé pour soulager les problèmes respiratoires soudains et ne remplacera pas un inhalateur de secours. SYMBICORT est utilisé pour l'asthme et la MPOC comme suit :
- Asthme: SYMBICORT est utilisé pour contrôler les symptômes de l'asthme et prévenir les symptômes tels que la respiration sifflante chez les adultes et les enfants âgés de 6 ans et plus. SYMBICORT 4,5 mcg contient du formotérol. Les médicaments BALA tels que le formotérol, lorsqu'ils sont utilisés seuls, augmentent le risque de décès et d'hospitalisations dus à des problèmes d'asthme. SYMBICORT contient un CSI et un BALA. Lorsqu'un CSI et un LABA sont utilisés ensemble, il n'y a pas de risque accru significatif d'hospitalisations et de décès dus à des problèmes d'asthme. SYMBICORT 160 mg n'est pas destiné aux adultes et aux enfants asthmatiques qui sont bien contrôlés par un médicament contre l'asthme, comme une dose faible à moyenne d'un CSI. SYMBICORT 160 mg est destiné aux adultes et aux enfants asthmatiques qui ont besoin à la fois d'un médicament CSI et d'un BALA. On ne sait pas si SYMBICORT est sûr et efficace chez les enfants asthmatiques de moins de 6 ans.
- MPOC : La MPOC est une maladie pulmonaire à long terme (chronique) qui comprend la bronchite chronique, l'emphysème ou les deux. SYMBICORT 160/4,5 mcg est utilisé à long terme, en 2 inhalations 2 fois par jour, pour améliorer les symptômes de la MPOC pour une meilleure respiration et pour réduire le nombre de poussées (l'aggravation de vos symptômes de MPOC pendant plusieurs jours).
N'utilisez jamais SYMBICORT :
- pour traiter les symptômes graves soudains de l'asthme ou de la MPOC.
- si vous êtes allergique à l'un des ingrédients de SYMBICORT. Voir la fin de cette notice pour la liste des ingrédients de SYMBICORT.
Avant d'utiliser SYMBICORT, informez votre fournisseur de soins de santé de toutes vos conditions médicales, y compris si vous :
- avoir des problèmes cardiaques.
- avoir une pression artérielle élevée.
- avoir des convulsions.
- avoir des problèmes de thyroïde.
- avoir le diabète.
- avoir des problèmes de foie.
- souffrez d'ostéoporose.
- avoir un problème de système immunitaire.
- avez des problèmes oculaires tels qu'une augmentation de la pression dans l'œil, un glaucome ou une cataracte.
- êtes allergique à certains médicaments.
- avez tout type d'infection virale, bactérienne, fongique ou parasitaire.
- sont exposés à la varicelle ou à la rougeole.
- êtes enceinte ou envisagez de devenir enceinte. On ne sait pas si SYMBICORT 4,5 mcg peut nuire à votre bébé à naître.
- allaitent. Le budésonide, l'un des ingrédients actifs de SYMBICORT, passe dans le lait maternel. Vous et votre fournisseur de soins de santé devez décider si vous prendrez SYMBICORT 160 mg pendant l'allaitement.
Informez votre fournisseur de soins de santé de tous les médicaments que vous prenez, y compris les médicaments sur ordonnance et en vente libre, les vitamines et les suppléments à base de plantes. SYMBICORT et certains autres médicaments peuvent interagir les uns avec les autres. Cela peut provoquer des effets secondaires graves. Informez tout particulièrement votre professionnel de la santé si vous prenez des médicaments antifongiques ou anti-VIH.
Connaissez tous les médicaments que vous prenez. Gardez une liste et montrez-la à votre fournisseur de soins de santé et à votre pharmacien chaque fois que vous recevez un nouveau médicament.
Comment dois-je utiliser SYMBICORT ?
Voir les instructions étape par étape pour l'utilisation de SYMBICORT à la fin de cette notice d'information destinée aux patients. N'utilisez pas SYMBICORT 4,5 mcg à moins que votre fournisseur de soins de santé ne vous l'ait enseigné et que vous ne compreniez tout. Demandez à votre professionnel de la santé ou à votre pharmacien si vous avez des questions.
- Utilisez SYMBICORT exactement comme prescrit. N'utilisez pas SYMBICORT 160 mg plus souvent que prescrit. SYMBICORT est disponible en 2 concentrations. Votre fournisseur de soins de santé vous a prescrit la concentration qui vous convient le mieux. Notez les différences entre SYMBICORT et vos autres médicaments inhalés, y compris les différences dans l'utilisation prescrite et l'apparence physique.
- Les enfants doivent utiliser SYMBICORT avec l'aide d'un adulte, selon les instructions du fournisseur de soins de santé de l'enfant.
- SYMBICORT 160 mg doit être pris chaque jour en 2 bouffées le matin et 2 bouffées le soir à environ 12 heures d'intervalle.
- Si vous oubliez une dose de SYMBICORT 160 mg, vous devez prendre votre dose suivante à l'heure habituelle.
- Rincez-vous la bouche avec de l'eau et recrachez l'eau après chaque dose (2 bouffées) de SYMBICORT. Ne pas avaler l'eau. Cela aidera à réduire le risque de contracter une infection fongique (muguet) dans la bouche et la gorge.
- Si vous avez pris trop de SYMBICORT, appelez votre fournisseur de soins de santé ou rendez-vous immédiatement à l'urgence de l'hôpital le plus proche si vous présentez des symptômes inhabituels, tels qu'une aggravation de l'essoufflement, des douleurs thoraciques, une accélération du rythme cardiaque ou des tremblements.
- Ne vaporisez pas SYMBICORT 4,5 mcg dans vos yeux. Si vous recevez accidentellement SYMBICORT 160mg dans vos yeux, rincez-vous les yeux avec de l'eau, et si la rougeur ou l'irritation persiste, consultez votre fournisseur de soins de santé.
- Ne changez pas ou n'arrêtez pas les médicaments utilisés pour contrôler ou traiter vos problèmes respiratoires. Votre fournisseur de soins de santé modifiera vos médicaments au besoin.
- Pendant que vous utilisez SYMBICORT 2 fois par jour, n'utilisez pas d'autres médicaments contenant un LABA pour quelque raison que ce soit. Demandez à votre fournisseur de soins de santé ou à votre pharmacien si l'un de vos autres médicaments est un LABA.
- SYMBICORT 4,5 mcg ne soulage pas les symptômes soudains. Ayez toujours avec vous un inhalateur de secours pour traiter les symptômes soudains. Si vous n'avez pas d'inhalateur de secours, appelez votre fournisseur de soins de santé pour qu'il vous en prescrive un.
- Appelez votre fournisseur de soins de santé ou obtenez des soins médicaux immédiatement si :
- vos problèmes respiratoires s'aggravent avec SYMBICORT.
- vous devez utiliser votre inhalateur de secours plus souvent que d'habitude.
- votre médicament inhalateur de secours ne fonctionne pas aussi bien pour soulager les symptômes.
- les résultats de votre débitmètre de pointe diminuent. Votre fournisseur de soins de santé vous indiquera les numéros qui vous conviennent.
- vos symptômes ne s'améliorent pas après l'utilisation régulière de SYMBICORT 160 mg pendant 1 semaine.
Quels sont les effets secondaires possibles de SYMBICORT ?
SYMBICORT 4,5 mcg peut provoquer des effets secondaires graves, notamment :
- L'utilisation d'une trop grande quantité d'un médicament BALA peut provoquer :
- douleur thoracique
- augmentation de la pression artérielle
- un rythme cardiaque rapide et irrégulier
- mal de tête
- tremblement
- nervosité
- Infection fongique dans la bouche ou la gorge (muguet). Rincez-vous la bouche avec de l'eau sans avaler après avoir utilisé SYMBICORT 4,5 mcg pour aider à réduire votre risque de contracter le muguet.
- Pneumonie et autres infections des voies respiratoires inférieures. Les personnes atteintes de MPOC ont un risque plus élevé de contracter une pneumonie et d'autres infections pulmonaires. Les corticostéroïdes inhalés peuvent augmenter le risque de contracter une pneumonie. Appelez votre fournisseur de soins de santé si vous remarquez l'un de ces symptômes :
- augmentation de la production de mucus (crachats)
- changement de couleur du mucus
- fièvre
- des frissons
- augmentation de la toux
- augmentation des problèmes respiratoires
- Effets sur le système immunitaire et risque accru d'infections. Informez votre fournisseur de soins de santé de tout signe d’infection tel que :
- fièvre
- la douleur
- courbatures
- des frissons
- se sentir fatigué
- nausée
- vomissement
- Insuffisance surrénalienne. L'insuffisance surrénale est une condition dans laquelle les glandes surrénales ne produisent pas suffisamment d'hormones stéroïdes. Cela peut se produire lorsque vous arrêtez de prendre des corticostéroïdes oraux et que vous commencez à prendre des corticostéroïdes inhalés.
- Augmentation de la respiration sifflante juste après la prise de SYMBICORT. Ayez toujours un inhalateur de secours avec vous pour traiter une respiration sifflante soudaine.
- Réactions allergiques graves, y compris éruption cutanée, urticaire, gonflement du visage, de la bouche et de la langue et problèmes respiratoires. Appelez votre fournisseur de soins de santé ou obtenez des soins médicaux d'urgence si vous présentez des symptômes d'une réaction allergique grave.
- Diminution de la densité minérale osseuse. Cela peut se produire chez les personnes qui ont un risque élevé de faible densité minérale osseuse (ostéoporose). Votre fournisseur de soins de santé devrait vous vérifier pendant le traitement par SYMBICORT.
- Croissance ralentie chez les enfants. La croissance d'un enfant doit être contrôlée régulièrement pendant l'utilisation de SYMBICORT.
- Problèmes oculaires, y compris le glaucome et la cataracte. Vous devriez subir des examens de la vue réguliers pendant que vous utilisez SYMBICORT.
- Gonflement de vos vaisseaux sanguins. Cela peut arriver chez les personnes asthmatiques. Informez immédiatement votre fournisseur de soins de santé si vous avez :
- une sensation d'épingles et d'aiguilles ou
- symptômes pseudo-grippaux engourdissement des bras ou des jambes
- douleur et gonflement des sinus
- éruption
- Diminution des taux sanguins de potassium (hypokaliémie).
- Augmentation du taux de sucre dans le sang (hyperglycémie).
Les effets secondaires les plus courants de SYMBICORT comprennent :
Les asthmatiques :
- irritation de la gorge
- mal de tête
- infection des voies respiratoires supérieures
- mal de gorge
- inflammation des muqueuses des sinus
- grippe (sinusite)
- congestion nasale
- mal au dos
- vomissement
- maux d'estomac
- muguet dans la bouche et la gorge. Rincez-vous la bouche avec de l'eau sans avaler après utilisation pour aider à prévenir le muguet
Personnes atteintes de MPOC :
- irritation de la gorge.
- muguet dans la bouche et la gorge. Rincez-vous la bouche avec de l'eau sans avaler après utilisation pour aider à prévenir le muguet.
- infection et inflammation des muqueuses des bronches (bronchite).
- inflammation des muqueuses des sinus (sinusite).
- infection des voies respiratoires supérieures.
Informez votre fournisseur de soins de santé de tout effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de SYMBICORT.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
Vous pouvez également signaler les effets secondaires à AstraZeneca au 1-800-236-9933.
Comment dois-je conserver SYMBICORT ?
- Conservez SYMBICORT à température ambiante entre 68 °F et 77 °F (20 °C et 25 °C).
- Conservez SYMBICORT avec l'embout buccal vers le bas.
- Le contenu de votre cartouche de SYMBICORT est sous pression. Ne percez pas et ne jetez pas la cartouche dans un feu ou un incinérateur. Ne l'utilisez pas et ne l'entreposez pas près d'une source de chaleur ou d'une flamme nue. Le stockage au-dessus de 120°F peut faire éclater la cartouche.
- Jetez SYMBICORT 160 mg lorsque le compteur atteint zéro (« 0 ») ou 3 mois après avoir retiré SYMBICORT de son sachet en aluminium, selon la première éventualité.
- Gardez SYMBICORT 4,5 mcg et tous les médicaments hors de la portée des enfants.
Informations générales sur l'utilisation sûre et efficace de SYMBICORT.
Les médicaments sont parfois prescrits à des fins autres que celles énumérées dans une notice d'information destinée aux patients. N'utilisez pas SYMBICORT 4,5 mcg pour une affection pour laquelle il n'a pas été prescrit. Ne donnez pas SYMBICORT à d'autres personnes, même si elles présentent les mêmes symptômes que vous. Cela peut leur nuire.
Vous pouvez demander à votre professionnel de la santé ou à votre pharmacien des informations sur SYMBICORT 4,5 mcg qui sont destinées aux professionnels de la santé.
Quels sont les ingrédients de SYMBICORT 4,5 mcg ?
Principes actifs : budésonide micronisé et fumarate de formotérol dihydraté micronisé
Ingrédients inactifs : hydrofluoroalcane (HFA 227), povidone K25 USP et polyéthylène glycol 1000 NF
Mode d'emploi
SYMBICORT (SIM-bi-kort)(budésonide 80 mcg et fumarate de formotérol dihydraté 4,5 mcg) Aérosol pour inhalation
SYMBICORT (SIM-bi-kort) (budésonide 160 mcg et fumarate de formotérol dihydraté 4,5 mcg) Aérosol pour inhalation
Figure 1  Position verticale
Position verticale
Comment utiliser SYMBICORT
Suivez les instructions ci-dessous pour utiliser SYMBICORT. Vous allez inspirer (inhaler) le médicament. Si vous avez des questions, interrogez votre médecin ou votre pharmacien.
Préparation de votre inhalateur SYMBICORT pour utilisation
Figure 2 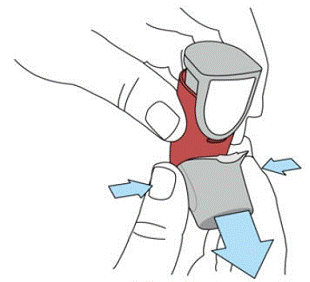
5. Amorçage de votre inhalateur SYMBICORT
Avant d'utiliser SYMBICORT pour la première fois, vous devrez l'amorcer. Pour amorcer SYMBICORT 160 mg, tenez-le en position verticale. Voir la figure 1. Bien agiter l'inhalateur SYMBICORT 4,5 mcg pendant 5 secondes. Tenez votre inhalateur SYMBICORT 160 mg face à vous et appuyez fermement et complètement sur le dessus du comptoir de l'inhalateur SYMBICORT 160 mg pour libérer une pulvérisation d'essai. Ensuite, secouez-le à nouveau pendant 5 secondes et relâchez un deuxième spray d'essai. Votre inhalateur SYMBICORT 160 mg est maintenant amorcé et prêt à l'emploi. Après avoir amorcé l'inhalateur SYMBICORT pour la première fois, le compteur indiquera 120 ou 60, selon la taille qui vous a été fournie.
Si vous n'utilisez pas votre inhalateur SYMBICORT pendant plus de 7 jours ou si vous le laissez tomber, vous devrez le réamorcer.
Manières de tenir l'inhalateur SYMBICORT 160 mg pour l'utiliser
figure 3 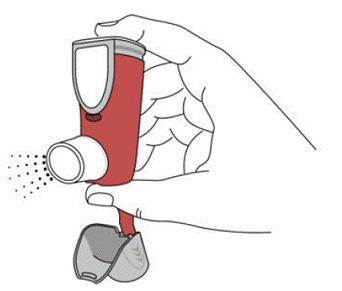
OU
Figure 4 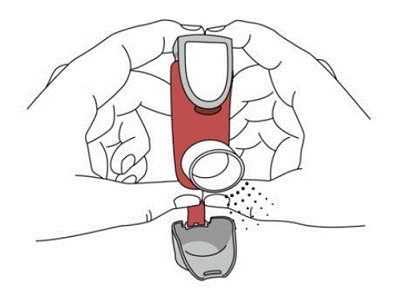
Utilisation de votre inhalateur SYMBICORT
6. Bien agiter votre inhalateur SYMBICORT 160 mg pendant 5 secondes. Retirez le couvercle de l'embout buccal. Vérifiez l'embout buccal pour les corps étrangers.
7. Expirez complètement (expirez). Tenez l'inhalateur SYMBICORT contre votre bouche. Placez l'embout buccal blanc entièrement dans votre bouche et refermez vos lèvres autour de celui-ci. Assurez-vous que l'inhalateur SYMBICORT 4,5 mcg est en position verticale et que l'ouverture de l'embout buccal pointe vers le fond de votre gorge (voir Figure 5).
Figure 5 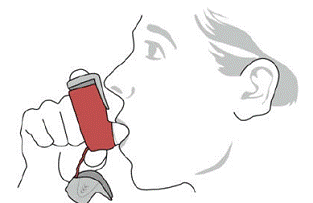
8. Inspirez (inspirez) profondément et lentement par la bouche. Appuyez fermement et complètement sur le dessus du comptoir de l'inhalateur SYMBICORT pour libérer le médicament (voir les figures 3 et 4).
9. Continuez à inspirer (inspirez) et retenez votre souffle pendant environ 10 secondes, ou aussi longtemps que cela est confortable. Avant d'expirer (expirez), relâchez votre doigt du haut du compteur. Gardez l'inhalateur SYMBICORT droit et retirez-le de votre bouche.
10. Agitez à nouveau l'inhalateur SYMBICORT pendant 5 secondes et répétez les étapes 7 à 9.
Après avoir utilisé votre inhalateur SYMBICORT
11. Après utilisation, fermez le couvercle de l'embout buccal en poussant jusqu'à ce qu'il s'enclenche.
12. Après avoir fini de prendre SYMBICORT (2 bouffées), rincez-vous la bouche avec de l'eau. Recrachez l'eau. Ne l'avalez pas.
Lire le compteur
- La flèche sur le compteur en haut de l'inhalateur SYMBICORT indique le nombre d'inhalations (bouffées) restant dans votre inhalateur.
COMPTEUR 
- Le compteur décomptera chaque fois que vous libérerez une bouffée de médicament (soit lors de l'amorçage de votre inhalateur SYMBICORT, soit lors de la prise du médicament).
- Lorsque la flèche sur le compteur s'approche de 20, vous remarquerez le début d'une zone jaune vous indiquant qu'il est temps d'appeler votre fournisseur de soins de santé pour une recharge.
COMPTEUR 
- Il est important que vous fassiez attention au nombre d'inhalations (bouffées) restant dans votre inhalateur SYMBICORT 160 mg en lisant le compteur. Jetez SYMBICORT lorsque le compteur indique zéro (« 0 ») ou 3 mois après avoir sorti votre inhalateur SYMBICORT 160 mg de son sachet en aluminium, selon la première éventualité. Votre inhalateur SYMBICORT peut ne pas sembler vide et il peut continuer à fonctionner, mais vous n'obtiendrez pas la bonne quantité de médicament si vous continuez à l'utiliser. Utilisez un nouvel inhalateur SYMBICORT et suivez les instructions d'amorçage (voir l'instruction 5 ci-dessus).
Comment nettoyer votre inhalateur SYMBICORT
Nettoyez l'embout buccal blanc de votre inhalateur SYMBICORT 4,5 mcg tous les 7 jours. Pour nettoyer l'embout buccal :
- Retirez le couvercle gris de l'embout buccal
- Essuyez l'intérieur et l'extérieur de l'ouverture de l'embout buccal blanc avec un chiffon propre et sec
- Remplacer le couvercle de l'embout buccal
- Ne mettez pas l'inhalateur SYMBICORT dans l'eau
- N'essayez pas de démonter votre SYMBICORT inhalateur
Ces informations pour les patients et instructions d'utilisation ont été approuvées par la Food and Drug Administration des États-Unis.
