Proair Inhaler 100mcg Salbutamol Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que ProAir et comment est-il utilisé ?
ProAir est un médicament délivré sur ordonnance utilisé pour traiter les symptômes de l'asthme aigu, sévère ou induit par l'exercice (bronchospasme). ProAir peut être utilisé seul ou avec d'autres médicaments.
ProAir appartient à une classe de médicaments appelés PAH, PDE-5 Inhibitors, Phosphodiesterase-5 Enzyme Inhibitors.
On ne sait pas si ProAir est sûr et efficace chez les enfants de moins de 4 ans.
Quels sont les effets secondaires possibles de ProAir ?
ProAir peut provoquer des effets secondaires graves, notamment :
- respiration sifflante,
- étouffement,
- autres problèmes respiratoires,
- douleur thoracique,
- rythme cardiaque rapide,
- battre des battements de cœur ou flotter dans votre poitrine,
- Maux de tête sévères,
- battant dans votre cou ou vos oreilles,
- douleur ou brûlure lorsque vous urinez,
- augmentation de la soif,
- augmentation de la miction,
- bouche sèche,
- odeur d'haleine fruitée,
- crampes dans les jambes,
- constipation,
- battements cardiaques irréguliers,
- augmentation de la soif ou de la miction,
- engourdissements ou picotements, et
- faiblesse musculaire ou sensation de boiterie
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de ProAir comprennent :
- douleur thoracique,
- battements de cœur rapides ou battants,
- vertiges,
- se sentir tremblant ou nerveux,
- mal de tête,
- mal au dos,
- courbatures,
- maux d'estomac,
- mal de gorge,
- douleur aux sinus et
- nez qui coule ou bouché
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de ProAir. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
LA DESCRIPTION
L'ingrédient actif de l'aérosol pour inhalation ProAir HFA (sulfate d'albutérol) est le sulfate d'albutérol, un sel racémique d'albutérol. Le sulfate d'albutérol porte le nom chimique α -[(tert-butylamino) méthyl]-4- hydroxy-m-xylène-α,α'-diol sulfate (2:1) (sel) et a la structure chimique suivante :
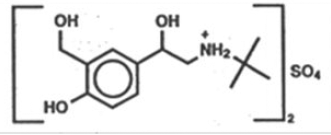
Le poids moléculaire du sulfate d'albutérol est de 576,7 et la formule empirique est (C13H21NO3)2 •H2SO4. Le sulfate d'albutérol est une poudre cristalline blanche à blanc cassé. Il est soluble dans l'eau et légèrement soluble dans l'éthanol. Le sulfate d'albutérol est le nom générique officiel aux États-Unis et le sulfate de salbutamol est le nom générique recommandé par l'Organisation mondiale de la santé. L'aérosol pour inhalation ProAir HFA est un aérosol à dose mesurée sous pression avec un compteur de dose. ProAir HFA est destiné à l'inhalation orale uniquement. Il contient une suspension microcristalline de sulfate d'albutérol dans du propulseur HFA-134a (1, 1, 1, 2-tétrafluoroéthane) et de l'éthanol.
Amorcer l'inhalateur avant la première utilisation et dans les cas où l'inhalateur n'a pas été utilisé pendant plus de 2 semaines en libérant trois pulvérisations dans l'air, loin du visage. Après l'amorçage, chaque actionnement délivre 108 mcg de sulfate d'albutérol, à partir de l'embout buccal de l'actionneur (équivalent à 90 mcg de base d'albutérol). Chaque cartouche fournit 200 actionnements (inhalations).
Ce produit ne contient pas de chlorofluorocarbures (CFC) comme propulseur.
LES INDICATIONS
Bronchospasme
L'aérosol pour inhalation PROAIR HFA est indiqué pour le traitement ou la prévention du bronchospasme chez les patients de 4 ans et plus atteints d'une maladie obstructive réversible des voies respiratoires.
Bronchospasme induit par l'exercice
L'aérosol pour inhalation PROAIR HFA est indiqué pour la prévention du bronchospasme induit par l'exercice chez les patients de 4 ans et plus.
DOSAGE ET ADMINISTRATION
Bronchospasme
Pour le traitement des épisodes aigus de bronchospasme ou la prévention des symptômes associés au bronchospasme, la posologie habituelle pour les adultes et les enfants de 4 ans et plus est de deux inhalations répétées toutes les 4 à 6 heures. Une administration plus fréquente ou un plus grand nombre d'inhalations n'est pas recommandée. Chez certains patients, une inhalation toutes les 4 heures peut suffire.
Bronchospasme induit par l'exercice
La posologie habituelle pour les adultes et les enfants de 4 ans ou plus est de deux inhalations 15 à 30 minutes avant l'exercice.
Informations administratives
Administrer PROAIR HFA par inhalation orale uniquement. Bien agiter avant chaque pulvérisation. Pour maintenir une utilisation appropriée de ce produit et pour éviter l'accumulation et le blocage des médicaments, il est important de suivre attentivement les instructions de nettoyage.
Amorçage
Amorcer l'inhalateur avant la première utilisation et dans les cas où l'inhalateur n'a pas été utilisé pendant plus de 2 semaines en libérant trois pulvérisations dans l'air, loin du visage.
Nettoyage
Comme avec tous les inhalateurs d'albutérol contenant du HFA, pour maintenir une utilisation correcte de ce produit et pour éviter l'accumulation et le blocage des médicaments, il est important de nettoyer régulièrement l'embout buccal en plastique. L'inhalateur peut cesser d'administrer le médicament si l'embout buccal en plastique de l'actionneur n'est pas correctement nettoyé et séché. Pour nettoyer : Lavez l'embout buccal en plastique à l'eau courante tiède pendant 30 secondes, secouez l'excès d'eau et séchez-le soigneusement à l'air libre au moins une fois par semaine. Si le patient a plus d'un inhalateur PROAIR HFA, le patient doit laver chacun séparément pour éviter de fixer la mauvaise cartouche sur le mauvais actionneur en plastique. De cette façon, le patient peut être sûr de toujours connaître le nombre correct de doses restantes. Ne fixez jamais une cartouche de médicament d'un autre inhalateur à l'actionneur PROAIR HFA et ne fixez jamais la cartouche PROAIR HFA à un actionneur d'un autre inhalateur. Si l'embout buccal se bouche, laver l'embout buccal éliminera le blocage. S'il est nécessaire d'utiliser l'inhalateur avant qu'il ne soit complètement sec, secouez l'excès d'eau, remplacez la cartouche, vaporisez deux fois dans l'air loin du visage et prenez la dose prescrite. Après une telle utilisation, l'embout buccal doit être lavé à nouveau et laissé sécher complètement à l'air. [voir Étiquetage des patients approuvé par la FDA ].
Compteur de doses
PROAIR HFA a un compteur de dose fixé à l'actionneur. Lorsque le patient reçoit l'inhalateur, un point noir apparaît dans la fenêtre de visualisation jusqu'à ce qu'il ait été amorcé 3 fois, auquel cas le nombre 200 s'affiche. Le compteur de dose comptera à rebours chaque fois qu'un spray est libéré. Lorsque le compteur de doses atteint 20, la couleur des chiffres passe au rouge pour rappeler au patient de contacter son pharmacien pour un renouvellement de médicament ou de consulter son médecin pour un renouvellement d'ordonnance.
Lorsque le compteur de doses atteint 0, l'arrière-plan passe au rouge uni. L'inhalateur PROAIR HFA doit être jeté lorsque le compteur de dose affiche 0 ou après la date de péremption sur le produit, selon la première éventualité.
COMMENT FOURNIE
Formes posologiques et dosages
PROAIR HFA est un aérosol pour inhalation. PROAIR HFA est fourni sous forme de cartouche en aluminium sous pression de 8,5 g/200 actionnements avec un actionneur en plastique rouge avec un compteur de dose et un capuchon anti-poussière blanc chacun dans des boîtes d'un. Chaque actionnement délivre 120 mcg de sulfate d'albutérol à partir de la valve de la cartouche et 108 mcg de sulfate d'albutérol à partir de l'embout buccal de l'actionneur (équivalent à 90 mcg de base d'albutérol).
Stockage et manutention
PROAIR HFA (sulfate d'albutérol) Aérosol pour inhalation est fourni sous forme de cartouche en aluminium sous pression avec un actionneur en plastique rouge avec un compteur de dose et un capuchon anti-poussière blanc chacun dans des boîtes d'un. Chaque bidon contient 8,5 g de la formulation et fournit 200 actionnements ( CDN 59310-579-22). Chaque actionnement délivre 120 mcg de sulfate d'albutérol à partir de la valve de la cartouche et 108 mcg de sulfate d'albutérol à partir de l'embout buccal de l'actionneur (équivalent à 90 mcg de base d'albutérol).
BIEN AGITER AVANT DE SERVIR. Conserver entre 15° et 25°C (59° et 77°F). Contenu sous pression. Ne pas percer ou incinérer. Protéger du gel et de l'exposition prolongée à la lumière directe du soleil. L'exposition à des températures supérieures à 120°F peut provoquer un éclatement. Pour de meilleurs résultats, la cartouche doit être à température ambiante avant utilisation. Éviter de vaporiser dans les yeux. Tenir hors de portée des enfants.
Voir Étiquetage des patients approuvé par la FDA pour les instructions d'amorçage et de nettoyage.
L'actionneur rouge fourni avec l'aérosol pour inhalation PROAIR HFA ne doit pas être utilisé avec la cartouche d'un autre produit aérosol pour inhalation. La cartouche d'aérosol pour inhalation PROAIR HFA ne doit pas être utilisée avec l'actionneur d'un autre produit aérosol pour inhalation.
L'inhalateur PROAIR HFA a un compteur de dose attaché à l'actionneur. Les patients ne doivent jamais essayer de modifier les chiffres du compteur de dose ou d'altérer le mécanisme à goupille à l'intérieur de l'actionneur. Jetez l'inhalateur PROAIR HFA lorsque le compteur affiche 0 ou après la date de péremption sur le produit, selon la première éventualité. La quantité étiquetée de médicament à chaque actionnement ne peut pas être garantie après que le compteur affiche 0, même si la cartouche n'est pas complètement vide et continuera à fonctionner. N'immergez jamais la cartouche dans l'eau pour déterminer le niveau de remplissage de la cartouche ("test de flottaison").
L'aérosol pour inhalation PROAIR HFA ne contient pas de chlorofluorocarbures (CFC) comme propulseur.
Fabriqué par : Teva Respiratory, LLC, Frazer, PA 19355. Fabriqué par : IVAX Pharmaceuticals Ireland Waterford, Irlande. Révisé : février 2019
EFFETS SECONDAIRES
L'utilisation de PROAIR HFA peut être associée aux éléments suivants :
- Bronchospasme paradoxal [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Effets cardiovasculaires [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Réactions d'hypersensibilité immédiates [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Hypokaliémie [voir AVERTISSEMENTS ET PRECAUTIONS ]
Expérience des essais cliniques
Au total, 1090 sujets ont été traités avec l'aérosol pour inhalation PROAIR HFA, ou avec la même formulation d'albutérol que dans l'aérosol pour inhalation PROAIR HFA, au cours du programme de développement clinique mondial.
Étant donné que les essais cliniques sont menés dans des conditions très variables, les taux d'effets indésirables observés dans les essais cliniques d'un médicament ne peuvent pas être directement comparés aux taux des essais cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique.
Adultes et adolescents de 12 ans et plus
Les informations sur les effets indésirables présentées dans le tableau ci-dessous concernant l'aérosol pour inhalation PROAIR HFA sont tirées d'une étude en aveugle de 6 semaines qui a comparé l'aérosol pour inhalation PROAIR HFA (180 mcg quatre fois par jour) avec un aérosol pour inhalation HFA placebo apparié en double aveugle et un inhalateur d'albutérol HFA-134a commercialisé en aveugle par l'évaluateur chez 172 patients asthmatiques âgés de 12 à 76 ans. Le tableau répertorie l'incidence de tous les événements indésirables (qu'ils soient considérés par l'investigateur comme liés ou non au médicament) de cette étude qui se sont produits à un taux de 3 % ou plus dans le groupe de traitement par aérosol pour inhalation PROAIR HFA et plus fréquemment dans le groupe PROAIR HFA groupe de traitement par aérosol pour inhalation que dans le groupe placebo apparié. Dans l'ensemble, l'incidence et la nature des événements indésirables signalés pour l'aérosol pour inhalation PROAIR HFA et l'inhalateur d'albutérol HFA-134a comparateur actif commercialisé étaient comparables.
Incidences des effets indésirables (% de patients) dans un essai clinique de six semaines*
Les événements indésirables signalés par moins de 3 % des patients recevant PROAIR HFA en aérosol pour inhalation, mais par une plus grande proportion de patients PROAIR HFA en aérosol pour inhalation que les patients placebo appariés, qui ont le potentiel d'être liés à PROAIR HFA en aérosol pour inhalation, comprenaient des douleurs thoraciques, infection, diarrhée, glossite, blessure accidentelle (système nerveux), anxiété, dyspnée, trouble de l'oreille, douleur à l'oreille et infection des voies urinaires.
Dans les études à petites doses cumulatives, les tremblements, la nervosité et les maux de tête étaient les événements indésirables les plus fréquents.
Patients pédiatriques âgés de 4 à 11 ans
Les événements indésirables rapportés dans un essai clinique pédiatrique de 3 semaines comparant la même formulation d'albutérol que dans PROAIR HFA en aérosol pour inhalation (180 mcg d'albutérol quatre fois par jour) à un placebo correspondant en aérosol pour inhalation HFA se sont produits à un faible taux d'incidence (pas plus de 2 % dans le groupe de traitement actif) et étaient similaires à ceux observés dans les essais chez l'adulte et l'adolescent.
Expérience post-commercialisation
Les effets indésirables suivants ont été identifiés lors de l'utilisation post-approbation de PROAIR HFA. Étant donné que ces réactions sont signalées volontairement par une population de taille incertaine, il n'est pas toujours possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale avec l'exposition au médicament. Les rapports ont inclus de rares cas de bronchospasme aggravé, un manque d'efficacité, une exacerbation de l'asthme (déclarée mortelle dans un cas), des crampes musculaires et divers effets secondaires oropharyngés tels qu'une irritation de la gorge, une altération du goût, une glossite, une ulcération de la langue et un haut-le-cœur.
Les événements indésirables suivants ont été observés lors de l'utilisation post-approbation de l'albutérol inhalé : urticaire, œdème de Quincke, éruption cutanée, bronchospasme, enrouement, œdème oropharyngé et arythmies (y compris fibrillation auriculaire, tachycardie supraventriculaire, extrasystoles). De plus, l'albutérol, comme les autres agents sympathomimétiques, peut provoquer des effets indésirables tels que : angine de poitrine, hypertension ou hypotension, palpitations, stimulation du système nerveux central, insomnie, céphalées, nervosité, tremblements, crampes musculaires, assèchement ou irritation de l'oropharynx, hypokaliémie, hyperglycémie et acidose métabolique.
INTERACTIONS MÉDICAMENTEUSES
Les autres bronchodilatateurs en aérosol sympathomimétiques à courte durée d'action ne doivent pas être utilisés en concomitance avec l'aérosol pour inhalation PROAIR HFA. Si des médicaments adrénergiques supplémentaires doivent être administrés par n'importe quelle voie, ils doivent être utilisés avec prudence pour éviter des effets cardiovasculaires délétères.
Bêta-bloquants
Les agents bloquants des récepteurs bêta-adrénergiques non seulement bloquent l'effet pulmonaire des bêta-agonistes, tels que PROAIR HFA en aérosol pour inhalation, mais peuvent également produire un bronchospasme sévère chez les patients asthmatiques. Par conséquent, les patients asthmatiques ne doivent normalement pas être traités par des bêta-bloquants. Cependant, dans certaines circonstances, par exemple en tant que prophylaxie après un infarctus du myocarde, il peut ne pas y avoir d'alternative acceptable à l'utilisation d'agents bêta-bloquants chez les patients asthmatiques. Dans ce contexte, envisagez les bêta-bloquants cardiosélectifs, même s'ils doivent être administrés avec prudence.
Diurétiques
Les modifications de l'ECG et/ou l'hypokaliémie qui peuvent résulter de l'administration de diurétiques non épargneurs de potassium (tels que les diurétiques de l'anse ou thiazidiques) peuvent être fortement aggravées par les bêta-agonistes, en particulier lorsque la dose recommandée de bêta-agoniste est dépassée. Bien que la signification clinique de ces effets ne soit pas connue, la prudence est recommandée lors de l'administration concomitante de bêta-agonistes avec des diurétiques non épargneurs de potassium. Envisagez de surveiller les niveaux de potassium.
Digoxine
Des diminutions moyennes de 16 % et 22 % des taux sériques de digoxine ont été démontrées après l'administration intraveineuse et orale d'une dose unique d'albutérol, respectivement, à des volontaires sains qui avaient reçu de la digoxine pendant 10 jours. La signification clinique de ces résultats pour les patients atteints d'une maladie obstructive des voies respiratoires qui reçoivent de l'albutérol et de la digoxine de manière chronique n'est pas claire. Néanmoins, il serait prudent d'évaluer soigneusement les taux sériques de digoxine chez les patients qui reçoivent actuellement de la digoxine et de l'aérosol pour inhalation PROAIR HFA.
Inhibiteurs de la monoamine oxydase ou antidépresseurs tricycliques
L'aérosol pour inhalation PROAIR HFA doit être administré avec une extrême prudence aux patients traités par des inhibiteurs de la monoamine oxydase ou des antidépresseurs tricycliques, ou dans les 2 semaines suivant l'arrêt de ces agents, car l'action de l'albutérol sur le système cardiovasculaire peut être potentialisée. Envisager un traitement alternatif chez les patients prenant des inhibiteurs de la MAO ou des antidépresseurs tricycliques.
AVERTISSEMENTS
Inclus dans le cadre du PRÉCAUTIONS section.
PRÉCAUTIONS
Bronchospasme paradoxal
L'aérosol pour inhalation PROAIR HFA peut produire un bronchospasme paradoxal pouvant mettre la vie en danger. En cas de bronchospasme paradoxal, l'aérosol pour inhalation PROAIR HFA doit être arrêté immédiatement et un traitement alternatif doit être institué. Il convient de reconnaître que le bronchospasme paradoxal, lorsqu'il est associé à des formulations inhalées, survient fréquemment lors de la première utilisation d'une nouvelle cartouche.
Détérioration de l'asthme
L'asthme peut s'aggraver de manière aiguë sur une période de quelques heures ou de façon chronique sur plusieurs jours ou plus. Si le patient a besoin de plus de doses de PROAIR HFA en aérosol pour inhalation que d'habitude, cela peut être un marqueur de déstabilisation de l'asthme et nécessite une réévaluation du patient et du schéma thérapeutique, en accordant une attention particulière à la nécessité éventuelle d'un traitement anti-inflammatoire, par exemple, corticostéroïdes.
Utilisation d'agents anti-inflammatoires
L'utilisation de bronchodilatateurs bêta-adrénergiques seuls peut ne pas être suffisante pour contrôler l'asthme chez de nombreux patients. Il convient d'envisager rapidement l'ajout d'agents anti-inflammatoires, par exemple des corticostéroïdes, au schéma thérapeutique.
Effets cardiovasculaires
L'aérosol pour inhalation PROAIR HFA, comme d'autres agonistes bêta-adrénergiques, peut produire des effets cardiovasculaires cliniquement significatifs chez certains patients, tels que mesurés par le pouls, la pression artérielle et/ou les symptômes. Bien que de tels effets soient peu fréquents après l'administration de PROAIR HFA en aérosol pour inhalation aux doses recommandées, s'ils se produisent, il peut être nécessaire d'arrêter le médicament. De plus, il a été rapporté que les bêta-agonistes produisaient des modifications de l'ECG, telles qu'un aplatissement de l'onde T, un allongement de l'intervalle QTc et une dépression du segment ST. La signification clinique de ces résultats est inconnue. Par conséquent, PROAIR HFA en aérosol pour inhalation, comme toutes les amines sympathomimétiques, doit être utilisé avec prudence chez les patients souffrant de troubles cardiovasculaires, en particulier d'insuffisance coronarienne, d'arythmies cardiaques et d'hypertension.
Ne pas dépasser la dose recommandée
Des décès ont été signalés en association avec une utilisation excessive de médicaments sympathomimétiques inhalés chez des patients asthmatiques. La cause exacte du décès est inconnue, mais un arrêt cardiaque suite au développement inattendu d'une crise d'asthme aiguë sévère et d'une hypoxie subséquente est suspecté.
Réactions d'hypersensibilité immédiates
Des réactions d'hypersensibilité immédiates peuvent survenir après l'administration de sulfate d'albutérol, comme en témoignent de rares cas d'urticaire, d'œdème de Quincke, d'éruption cutanée, de bronchospasme, d'anaphylaxie et d'œdème oropharyngé. Le potentiel d'hypersensibilité doit être pris en compte dans l'évaluation clinique des patients qui présentent des réactions d'hypersensibilité immédiates lors de l'administration de PROAIR HFA en aérosol pour inhalation.
Conditions coexistantes
L'aérosol pour inhalation PROAIR HFA, comme toutes les amines sympathomimétiques, doit être utilisé avec prudence chez les patients souffrant de troubles cardiovasculaires, en particulier d'insuffisance coronarienne, d'arythmies cardiaques et d'hypertension ; chez les patients souffrant de troubles convulsifs, d'hyperthyroïdie ou de diabète sucré ; et chez les patients qui sont exceptionnellement sensibles aux amines sympathomimétiques. Des modifications cliniquement significatives de la pression artérielle systolique et diastolique ont été observées chez certains patients et pourraient survenir chez certains patients après l'utilisation de tout bronchodilatateur bêta-adrénergique. De fortes doses d'albutérol par voie intraveineuse ont été rapportées pour aggraver le diabète sucré préexistant et l'acidocétose.
Hypokaliémie
Comme avec d'autres bêta-agonistes, PROAIR HFA en aérosol pour inhalation peut produire une hypokaliémie importante chez certains patients, peut-être par shunt intracellulaire, ce qui a le potentiel de produire des effets cardiovasculaires indésirables. La diminution est généralement transitoire, ne nécessitant pas de supplémentation.
Informations sur les conseils aux patients
Voir Étiquetage des patients approuvé par la FDA
Les patients doivent recevoir les informations suivantes :
Fréquence d'utilisation
L'action de PROAIR HFA Aérosol pour Inhalation doit durer de 4 à 6 heures. N'utilisez pas l'aérosol pour inhalation PROAIR HFA plus fréquemment que recommandé. Demandez aux patients de ne pas augmenter la dose ou la fréquence des doses de PROAIR HFA en aérosol pour inhalation sans consulter le médecin. Si les patients constatent que le traitement par PROAIR HFA en aérosol pour inhalation devient moins efficace pour le soulagement des symptômes, que les symptômes s'aggravent et/ou qu'ils doivent utiliser le produit plus fréquemment que d'habitude, ils doivent consulter immédiatement un médecin.
Amorçage et nettoyage
Amorçage
L'amorçage est essentiel pour garantir une teneur appropriée en albutérol à chaque actionnement. Demandez aux patients d'amorcer l'inhalateur avant de l'utiliser pour la première fois et dans les cas où l'inhalateur n'a pas été utilisé pendant plus de 2 semaines en libérant trois pulvérisations dans l'air, loin du visage.
Nettoyage
Pour garantir un dosage correct et éviter le blocage de l'orifice de l'actionneur, demandez aux patients de laver l'embout buccal de l'actionneur en plastique rouge et de le sécher soigneusement au moins une fois par semaine. Informez les patients que s'ils ont plus d'un inhalateur PROAIR HFA, ils doivent laver chacun à des moments différents pour éviter de fixer la mauvaise cartouche au mauvais actionneur en plastique. De cette façon, ils peuvent être sûrs de toujours connaître le nombre exact de doses restantes. Les patients doivent être informés de ne jamais attacher une cartouche de médicament d'un autre inhalateur à l'actionneur PROAIR HFA et de ne jamais attacher la cartouche PROAIR HFA à un actionneur d'un autre inhalateur. Les patients ne doivent pas retirer la cartouche de l'actionneur, sauf pendant le nettoyage, car la remise en place peut libérer une dose dans l'air et le compteur de dose comptera à rebours chaque fois qu'un spray est libéré. Des instructions de nettoyage détaillées sont incluses dans la notice illustrée Informations pour le patient.
Compteur de doses
Les patients doivent être informés que le PROAIR HFA est équipé d'un compteur de dose fixé à l'actionneur. Lorsque le patient reçoit l'inhalateur, un point noir apparaît dans la fenêtre de visualisation jusqu'à ce qu'il ait été amorcé 3 fois, auquel cas le nombre 200 s'affiche. Le compteur de dose comptera à rebours chaque fois qu'un spray est libéré. La fenêtre du compteur de doses affiche le nombre de pulvérisations restant dans l'inhalateur par unités de deux (par exemple, 200, 198, 196, etc.). Lorsque le compteur affiche 20, la couleur des chiffres passe au rouge pour rappeler au patient de contacter son pharmacien pour un renouvellement de médicament ou de consulter son médecin pour un renouvellement d'ordonnance. Lorsque le compteur de doses atteint 0, l'arrière-plan passe au rouge uni. Les patients doivent être informés qu'ils doivent jeter l'inhalateur PROAIR HFA lorsque le compteur de dose affiche 0 ou après la date de péremption sur le produit, selon la première éventualité.
Bronchospasme paradoxal
Informez les patients que l'aérosol pour inhalation PROAIR HFA peut produire un bronchospasme paradoxal. Demandez aux patients d'arrêter l'aérosol pour inhalation PROAIR HFA en cas de bronchospasme paradoxal.
Consommation concomitante de drogues
Pendant que les patients prennent PROAIR HFA en aérosol pour inhalation, les autres médicaments inhalés et les médicaments contre l'asthme doivent être pris uniquement selon les directives d'un médecin.
Événements indésirables courants
Les effets indésirables courants du traitement par l'albutérol inhalé comprennent des palpitations, des douleurs thoraciques, une fréquence cardiaque rapide, des tremblements ou de la nervosité.
Grossesse
Les patientes enceintes ou qui allaitent doivent contacter leur médecin au sujet de l'utilisation de l'aérosol pour inhalation PROAIR HFA.
Il existe un registre d'exposition pendant la grossesse qui surveille l'issue de la grossesse chez les femmes exposées à des médicaments contre l'asthme pendant la grossesse [voir Utilisation dans des populations spécifiques ].
Informations générales sur l'utilisation
L'utilisation efficace et sûre de l'aérosol pour inhalation PROAIR HFA comprend une compréhension de la manière dont il doit être administré.
Bien agiter avant chaque pulvérisation.
Utiliser l'aérosol pour inhalation PROAIR HFA uniquement avec l'actionneur fourni avec le produit. Jeter l'inhalateur PROAIR HFA lorsque le compteur de dose affiche 0 ou après la date de péremption sur le produit, selon la première éventualité. N'immergez jamais le bidon dans l'eau pour déterminer le niveau de remplissage du bidon ("test de flottaison").
En général, la technique d'administration de l'aérosol pour inhalation PROAIR HFA aux enfants est similaire à celle des adultes. Les enfants doivent utiliser l'aérosol pour inhalation PROAIR HFA sous la surveillance d'un adulte, selon les instructions du médecin du patient.
Étiquetage des patients approuvé par la FDA
Voir le déchirement illustré Informations pour le patient brochure.
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Dans une étude de 2 ans chez des rats Sprague-Dawley, le sulfate d'albutérol a provoqué une augmentation liée à la dose de l'incidence des léiomyomes bénins du mésovarium à des doses alimentaires de 2 mg/kg et plus (environ 15 fois et 6 fois la dose maximale recommandée chez l'humain). dose quotidienne par inhalation (MRHDID) pour les adultes et les enfants, respectivement, sur une base en mg/m²). Dans une autre étude, cet effet a été bloqué par la co-administration de propranolol, un antagoniste bêta-adrénergique non sélectif. Dans une étude de 18 mois chez des souris CD-1, le sulfate d'albutérol n'a montré aucun signe de tumorigénicité à des doses alimentaires allant jusqu'à 500 mg/kg (environ 1 900 fois et 740 fois le MRHDID pour les adultes et les enfants, respectivement, sur un mg/m² base). Dans une étude de 22 mois sur des hamsters dorés, le sulfate d'albutérol n'a montré aucun signe de tumorigénicité à des doses alimentaires allant jusqu'à 50 mg/kg (environ 250 fois et 100 fois la MRHDID pour les adultes et les enfants, respectivement, sur une base mg/m²) .
Le sulfate d'albutérol n'était pas mutagène dans le test d'Ames ou dans un test de mutation chez la levure. Le sulfate d'albutérol n'était pas clastogène dans un test de lymphocytes périphériques humains ou dans un test de micronoyau de souris de souche AH1.
Les études de reproduction dans les rats n'ont démontré aucune évidence de fertilité diminuée aux doses orales jusqu'à 50 mgs/kg (approximativement 380 fois le MRHDID pour les adultes sur une base mg/m²).
Utilisation dans des populations spécifiques
Grossesse
Registre d'exposition pendant la grossesse
Il existe un registre d'exposition pendant la grossesse qui surveille les résultats de la grossesse chez les femmes exposées à des médicaments contre l'asthme pendant la grossesse. Pour plus d'informations, contactez les études Mothers To Baby Pregnancy menées par l'Organisation des spécialistes de l'information en tératologie au 1-877-311-8972 ou visitez http://mothertobaby.org/pregnancystudies/.
Résumé des risques
Il n'y a pas d'études cliniques randomisées sur l'utilisation de l'albutérol pendant la grossesse. Les données disponibles provenant d'études épidémiologiques publiées et de rapports de cas post-commercialisation sur les issues de grossesse suite à l'utilisation d'albutérol inhalé ne démontrent pas systématiquement un risque de malformations congénitales majeures ou de fausse couche. Il existe des considérations cliniques concernant l'utilisation de l'albutérol chez la femme enceinte [voir Considérations cliniques ]. Dans les études de reproduction chez l'animal, lorsque le sulfate d'albutérol a été administré par voie sous-cutanée à des souris gravides, il y avait des signes de fente palatine à des doses inférieures et jusqu'à 9 fois la dose maximale recommandée pour l'inhalation humaine quotidienne (MRHDID) [voir Données ].
Le risque de fond estimé de malformations congénitales majeures et de fausse couche pour la ou les populations indiquées est inconnu. Dans la population générale des États-Unis, le risque estimé de malformations congénitales majeures et de fausse couche dans les grossesses cliniquement reconnues est de 2 à 4 % et de 15 à 20 %, respectivement.
Considérations cliniques
Risque maternel et/ou embryonnaire/fœtal associé à la maladie
Chez les femmes dont l'asthme est mal ou modérément contrôlé, il existe un risque accru de prééclampsie chez la mère et de prématurité, de faible poids à la naissance et de petite taille pour l'âge gestationnel chez le nouveau-né. Les femmes enceintes doivent être étroitement surveillées et les médicaments ajustés si nécessaire pour maintenir un contrôle optimal.
Travail ou accouchement
En raison du potentiel d'interférence des bêta-agonistes avec la contractilité utérine, l'utilisation de PROAIR HFA en aérosol pour inhalation pour le soulagement du bronchospasme pendant le travail doit être limitée aux patientes pour lesquelles les avantages l'emportent clairement sur les risques. L'aérosol pour inhalation PROAIR HFA n'a pas été approuvé pour la prise en charge du travail prématuré. Des effets indésirables graves, y compris un œdème pulmonaire, ont été signalés pendant ou après le traitement d'un accouchement prématuré avec des bêta2-agonistes, y compris l'albutérol.
Données
Données animales
Dans une étude de reproduction chez la souris, le sulfate d'albutérol administré par voie sous-cutanée a produit la formation d'une fente palatine chez 5 des 111 fœtus (4,5 %) à une exposition aux neuf dixièmes de la MRHDID pour les adultes (sur une base en mg/m² à une dose maternelle de 0,25 mg/kg ) et chez 10 fœtus sur 108 (9,3 %) à environ 9 fois la MRHDID (sur une base en mg/m² à une dose maternelle de 2,5 mg/kg). Des effets similaires n'ont pas été observés à environ un onzième de la MRHDID pour les adultes (sur une base en mg/m² à une dose maternelle de 0,025 mg/kg). Une fente palatine est également survenue chez 22 des 72 fœtus (30,5 %) de femelles traitées par voie sous-cutanée avec de l'isoprotérénol (témoin positif).
Dans une étude de reproduction chez le lapin, le sulfate d'albutérol administré par voie orale a induit un cranioschisis chez 7 des 19 fœtus (37 %) à environ 750 fois le MRHDID (sur une base en mg/m² à une dose maternelle de 50 mg/kg).
Dans une étude de reproduction chez le rat, une formulation de sulfate d'albutérol/HFA-134a administrée par inhalation n'a produit aucun effet tératogène à des expositions d'environ 80 fois la MRHDID (sur une base en mg/m² à une dose maternelle de 10,5 mg/kg).
Une étude dans laquelle des rats enceintes ont reçu une dose de sulfate d'albutérol radiomarqué a démontré que le matériel lié au médicament est transféré de la circulation maternelle au fœtus.
Lactation
Résumé des risques
Il n'y a pas de données disponibles sur la présence d'albutérol dans le lait maternel, les effets sur l'enfant allaité ou les effets sur la production de lait. Cependant, les taux plasmatiques d'albutérol après des doses thérapeutiques inhalées sont faibles chez l'homme, et s'il est présent dans le lait maternel, l'albutérol a une faible biodisponibilité orale [voir PHARMACOLOGIE CLINIQUE ].
Les avantages de l'allaitement pour le développement et la santé doivent être pris en compte, ainsi que le besoin clinique de la mère en albutérol et tout effet indésirable potentiel sur l'enfant allaité de l'albutérol ou de l'affection maternelle sous-jacente.
Utilisation pédiatrique
L'innocuité et l'efficacité de PROAIR HFA en aérosol pour inhalation pour le traitement ou la prévention du bronchospasme chez les enfants de 12 ans et plus atteints d'une maladie obstructive réversible des voies respiratoires sont basées sur un essai clinique de 6 semaines chez 116 patients de 12 ans et plus souffrant d'asthme comparant des doses de 180 mcg quatre fois par jour avec un placebo, et une étude croisée à dose unique comparant des doses de 90, 180 et 270 mcg avec un placebo chez 58 patients [voir Etudes cliniques ]. L'innocuité et l'efficacité de PROAIR HFA en aérosol pour inhalation pour le traitement du bronchospasme induit par l'exercice chez les enfants de 12 ans et plus sont basées sur une étude croisée à dose unique chez 24 adultes et adolescents atteints de bronchospasme induit par l'exercice comparant des doses de 180 mcg à un placebo [voir Etudes cliniques ].
L'innocuité de l'aérosol pour inhalation PROAIR HFA chez les enfants de 4 à 11 ans est basée sur un essai clinique de 3 semaines chez 50 patients asthmatiques âgés de 4 à 11 ans utilisant la même formulation d'albutérol que celle de l'aérosol pour inhalation PROAIR HFA comparant des doses de 180 mcg quatre fois par jour avec un placebo. L'efficacité de PROAIR HFA en aérosol pour inhalation chez les enfants de 4 à 11 ans est extrapolée à partir d'essais cliniques chez des patients de 12 ans et plus souffrant d'asthme et de bronchospasme induit par l'exercice, sur la base des données d'une étude à dose unique comparant l'effet bronchodilatateur de PROAIR HFA 90 mcg et 180 mcg avec placebo chez 55 patients asthmatiques et un essai clinique de 3 semaines utilisant la même formulation d'albutérol que dans PROAIR HFA en aérosol pour inhalation chez 95 enfants asthmatiques âgés de 4 à 11 ans comparant une dose de 180 mcg d'albutérol quatre fois par jour avec un placebo [voir Etudes cliniques ].
L'innocuité et l'efficacité de PROAIR HFA en aérosol pour inhalation chez les patients pédiatriques de moins de 4 ans n'ont pas été établies.
Utilisation gériatrique
Les études cliniques sur l'aérosol pour inhalation PROAIR HFA n'ont pas inclus un nombre suffisant de patients âgés de 65 ans et plus pour déterminer s'ils réagissent différemment des patients plus jeunes. D'autres expériences cliniques rapportées n'ont pas identifié de différences dans les réponses entre les patients âgés et les patients plus jeunes. En général, la sélection de la dose pour un patient âgé doit être prudente, en commençant généralement à l'extrémité inférieure de la plage posologique, reflétant la fréquence plus élevée de diminution de la fonction hépatique, rénale ou cardiaque et de maladie concomitante ou d'un autre traitement médicamenteux [voir AVERTISSEMENTS ET PRECAUTIONS ].
Tous les agonistes bêta2-adrénergiques, y compris l'albutérol, sont connus pour être excrétés en grande partie par les reins, et le risque de réactions toxiques peut être plus élevé chez les patients dont la fonction rénale est altérée. Étant donné que les patients âgés sont plus susceptibles d'avoir une fonction rénale diminuée, des précautions doivent être prises lors du choix de la dose et il peut être utile de surveiller la fonction rénale.
SURDOSAGE
Les symptômes attendus en cas de surdosage sont ceux d'une stimulation bêta-adrénergique excessive et/ou de l'apparition ou de l'exagération de l'un des symptômes répertoriés dans la rubrique EFFETS INDÉSIRABLES, par exemple, convulsions, angine de poitrine, hypertension ou hypotension, tachycardie avec des fréquences allant jusqu'à 200 battements par minute, arythmies, nervosité. , maux de tête, tremblements, bouche sèche, palpitations, nausées, étourdissements, fatigue, malaise et insomnie.
Une hypokaliémie peut également survenir. Comme avec tous les médicaments sympathomimétiques, un arrêt cardiaque et même la mort peuvent être associés à l'abus de l'aérosol pour inhalation PROAIR HFA.
Le traitement consiste en l'arrêt de PROAIR HFA en aérosol pour inhalation ainsi qu'un traitement symptomatique approprié. L'utilisation judicieuse d'un bêta-bloquant cardiosélectif peut être envisagée, sachant qu'une telle médication peut provoquer un bronchospasme. Il n'y a pas suffisamment de preuves pour déterminer si la dialyse est bénéfique en cas de surdosage de PROAIR HFA en aérosol pour inhalation.
La dose létale médiane orale de sulfate d'albutérol chez la souris est supérieure à 2 000 mg/kg (environ 6 800 fois la dose quotidienne maximale recommandée par inhalation chez l'adulte en mg/m² et environ 3 200 fois la dose quotidienne maximale recommandée par inhalation chez l'enfant sous mg/m²). /m² base). Chez les rats matures, la dose létale médiane sous-cutanée de sulfate d'albutérol est d'environ 450 mg/kg (environ 3 000 fois la dose quotidienne maximale recommandée par inhalation pour les adultes sur une base en mg/m² et environ 1 400 fois la dose quotidienne maximale recommandée par inhalation pour les enfants sous mg/m²). Chez les jeunes rats, la dose létale médiane sous-cutanée est d'environ 2 000 mg/kg (environ 14 000 fois la dose quotidienne maximale recommandée par inhalation pour les adultes en mg/m² et environ 6 400 fois la dose quotidienne maximale recommandée par inhalation pour les enfants en mg/m² base). La dose létale médiane par inhalation n'a pas été déterminée chez l'animal.
CONTRE-INDICATIONS
L'aérosol pour inhalation PROAIR HFA est contre-indiqué chez les patients ayant des antécédents d'hypersensibilité à l'albutérol et à tout autre composant de l'aérosol pour inhalation PROAIR HFA. De rares cas de réactions d'hypersensibilité, y compris l'urticaire, l'œdème de Quincke et les éruptions cutanées ont été signalés après l'utilisation de sulfate d'albutérol [voir AVERTISSEMENTS ET PRECAUTIONS ].
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
Le sulfate d'albutérol est un agoniste bêta 2-adrénergique. Les effets pharmacologiques du sulfate d'albutérol sont attribuables à l'activation des récepteurs bêta 2-adrénergiques sur le muscle lisse des voies respiratoires. L'activation des récepteurs bêta2-adrénergiques conduit à l'activation de l'adénylcyclase et à une augmentation de la concentration intracellulaire de l'adénosine monophosphate cyclique-3',5' (AMP cyclique). Cette augmentation de l'AMP cyclique est associée à l'activation de la protéine kinase A, qui à son tour inhibe la phosphorylation de la myosine et abaisse les concentrations de calcium ionique intracellulaire, entraînant une relaxation musculaire. L'albutérol détend le muscle lisse de toutes les voies respiratoires, de la trachée aux bronchioles terminales. L'albutérol agit comme un antagoniste fonctionnel pour détendre les voies respiratoires quel que soit le spasmogène impliqué, protégeant ainsi contre tous les défis bronchoconstricteurs. Des concentrations accrues d'AMP cyclique sont également associées à l'inhibition de la libération de médiateurs par les mastocytes dans les voies respiratoires. Bien qu'il soit reconnu que les récepteurs bêta2-adrénergiques sont les récepteurs prédominants sur le muscle lisse bronchique, les données indiquent qu'il existe des récepteurs bêta dans le cœur humain, dont 10 % à 50 % sont des récepteurs cardiaques bêta2-adrénergiques. La fonction précise de ces récepteurs n'a pas été établie [voir AVERTISSEMENTS ET PRECAUTIONS ].
Il a été démontré dans la plupart des essais cliniques contrôlés que l'albutérol a plus d'effet sur les voies respiratoires, sous la forme d'une relaxation des muscles lisses bronchiques, que l'isoprotérénol à des doses comparables tout en produisant moins d'effets cardiovasculaires. Cependant, l'albutérol inhalé, comme d'autres médicaments agonistes bêta-adrénergiques, peut produire un effet cardiovasculaire significatif chez certains patients, tel que mesuré par le pouls, la pression artérielle, les symptômes et/ou les modifications électrocardiographiques [voir AVERTISSEMENTS ET PRECAUTIONS ].
Pharmacocinétique
Les taux systémiques d'albutérol sont faibles après inhalation des doses recommandées. Dans une étude croisée menée chez des volontaires sains de sexe masculin et féminin, des doses cumulatives élevées de PROAIR HFA en aérosol pour inhalation (1 080 mcg d'albutérol base administré pendant une heure) ont produit des concentrations plasmatiques maximales moyennes (Cmax) et une exposition systémique (ASCinf) d'environ 4 100 pg/ mL et 28 426 pg/mL*h, respectivement contre environ 3 900 pg/mL et 28 395 pg/mL*h, respectivement après la même dose d'un comparateur d'inhalateur d'albutérol HFA-134a actif. La demi-vie plasmatique terminale de l'albutérol délivré par l'aérosol pour inhalation PROAIR HFA était d'environ 6 heures. La comparaison des paramètres pharmacocinétiques n'a mis en évidence aucune différence entre les produits.
Le profil pharmacocinétique de PROAIR HFA en aérosol pour inhalation a été évalué dans une étude croisée à deux voies chez 11 volontaires pédiatriques en bonne santé, âgés de 4 à 11 ans. L'administration d'une dose unique de PROAIR HFA en aérosol pour inhalation (180 mcg d'albutérol base) a donné une moyenne des moindres carrés (SE) Cmax et AUC0-∞ de 1 100 (1,18) pg/mL et 5 120 (1,15) pg/mL*h, respectivement. La demi-vie plasmatique terminale moyenne des moindres carrés (SE) de l'albutérol administré par l'aérosol pour inhalation PROAIR HFA était de 166 (7,8) minutes.
Métabolisme et élimination
Les informations disponibles dans la littérature publiée suggèrent que la principale enzyme responsable du métabolisme de l'albutérol chez l'homme est SULTIA3 (sulfotransférase). Lorsque l'albutérol racémique a été administré par voie intraveineuse ou par inhalation après l'administration orale de charbon de bois, il y avait une différence de 3 à 4 fois dans l'aire sous les courbes concentration-temps entre les énantiomères (R) et (S)albutérol, avec (S )-les concentrations d'albutérol étant constamment plus élevées. Cependant, sans prétraitement au charbon, après administration orale ou par inhalation, les différences étaient de 8 à 24 fois, ce qui suggère que le (R)-albutérol est préférentiellement métabolisé dans le tractus gastro-intestinal, vraisemblablement par SULTIA3.
La principale voie d'élimination de l'albutérol est l'excrétion rénale (80 % à 100 %) du composé d'origine ou du métabolite principal. Moins de 20% du médicament est détecté dans les matières fécales. Suite à l'administration intraveineuse d'albutérol racémique, entre 25 % et 46 % de la fraction (R)-albutérol de la dose a été excrétée sous forme inchangée (R)-albutérol dans l'urine.
Gériatrie, pédiatrie, insuffisance hépatique/rénale
Aucune étude pharmacocinétique sur PROAIR HFA en aérosol pour inhalation n'a été menée chez des nouveau-nés ou des sujets âgés.
L'effet de l'insuffisance hépatique sur la pharmacocinétique de PROAIR HFA en aérosol pour inhalation n'a pas été évalué.
L'effet de l'insuffisance rénale sur la pharmacocinétique de l'albutérol a été évalué chez 5 sujets avec une clairance de la créatinine de 7 à 53 ml/min, et les résultats ont été comparés à ceux de volontaires sains. La maladie rénale n'a eu aucun effet sur la demi-vie, mais il y a eu une diminution de 67 % de la clairance de l'albutérol. La prudence s'impose lors de l'administration de fortes doses de PROAIR HFA en aérosol pour inhalation à des patients atteints d'insuffisance rénale [voir Utilisation dans des populations spécifiques ].
Toxicologie animale et/ou pharmacologie
Préclinique
Des études intraveineuses chez des rats avec du sulfate d'albutérol ont démontré que l'albutérol traverse la barrière hémato-encéphalique et atteint des concentrations cérébrales s'élevant à environ 5 % des concentrations plasmatiques. Dans les structures en dehors de la barrière hémato-encéphalique (glandes pinéale et pituitaire), les concentrations d'albutérol se sont avérées 100 fois supérieures à celles du cerveau entier.
Des études chez des animaux de laboratoire (porcs miniatures, rongeurs et chiens) ont démontré la survenue d'arythmies cardiaques et de mort subite (avec des signes histologiques de nécrose myocardique) lorsque des β-agonistes et des méthylxanthines étaient administrés simultanément. La signification clinique de ces résultats est inconnue.
Le propulseur HFA-134a est dépourvu d'activité pharmacologique sauf à des doses très élevées chez les animaux (380 à 1300 fois l'exposition humaine maximale basée sur des comparaisons des valeurs d'AUC), produisant principalement de l'ataxie, des tremblements, de la dyspnée ou de la salivation. Ceux-ci sont similaires aux effets produits par les chlorofluorocarbures (CFC) structurellement apparentés, qui ont été largement utilisés dans les inhalateurs-doseurs.
Chez les animaux et les humains, le propulseur HFA-134a s'est avéré être rapidement absorbé et rapidement éliminé, avec une demi-vie d'élimination de 3 à 27 minutes chez les animaux et de 5 à 7 minutes chez les humains. Le temps jusqu'à la concentration plasmatique maximale (Tmax) et le temps de séjour moyen sont tous deux extrêmement courts, ce qui entraîne une apparition transitoire de HFA-134a dans le sang sans signe d'accumulation.
Etudes cliniques
Bronchospasme associé à l'asthme
Patients adultes et adolescents de 12 ans et plus
Dans un essai randomisé, à double insu et contrôlé par placebo d'une durée de 6 semaines, l'aérosol pour inhalation PROAIR HFA (58 patients) a été comparé à un aérosol pour inhalation HFA placebo apparié (58 patients) chez des patients asthmatiques âgés de 12 à 76 ans à une dose de 180 mcg d'albutérol quatre fois par jour. Un bras d'inhalateur d'albutérol HFA-134a commercialisé en aveugle par l'évaluateur (56 patients) a été inclus.
Les mesures en série du VEMS, présentées ci-dessous sous forme de variation en pourcentage par rapport à la valeur initiale du jour du test au jour 1 et au jour 43, ont démontré que deux inhalations de PROAIR HFA en aérosol pour inhalation produisaient une amélioration significativement plus importante du VEMS par rapport à la valeur de prétraitement que le placebo apparié, ainsi qu'une effet bronchodilatateur comparable à l'inhalateur d'albutérol HFA-134a comparateur actif commercialisé.
VEMS en tant que variation moyenne en pourcentage par rapport à la pré-dose du jour du test dans un essai clinique de 6 semaines Jour 1
INFORMATIONS PATIENTS
PROAIR® HFA (pro' ar) (sulfate d'albutérol) Inhalation Aérosol
Lisez ces informations patient avant de commencer à utiliser PROAIR HFA et chaque fois que vous recevez une recharge. Il peut y avoir de nouvelles informations. Ces informations ne remplacent pas une discussion avec votre médecin au sujet de votre état de santé ou de votre traitement.
Qu'est-ce que le PROAIR HFA ?
PROAIR HFA est un médicament sur ordonnance utilisé chez les personnes de 4 ans et plus pour :
- traiter ou prévenir le bronchospasme chez les personnes atteintes d'une maladie obstructive réversible des voies respiratoires
- prévenir le bronchospasme induit par l'exercice
On ne sait pas si PROAIR HFA est sûr et efficace chez les enfants de moins de 4 ans.
Qui ne devrait pas utiliser PROAIR HFA ?
N'utilisez pas PROAIR HFA si vous êtes allergique au sulfate d'albutérol ou à l'un des ingrédients de PROAIR HFA. Voir la fin de cette notice pour une liste complète des ingrédients de PROAIR HFA.
Que dois-je dire à mon médecin avant d'utiliser PROAIR HFA ?
Avant d'utiliser PROAIR HFA, informez votre médecin si vous :
- avoir des problèmes cardiaques
- avoir une pression artérielle élevée (hypertension)
- avoir des convulsions (crises)
- avoir des problèmes de thyroïde
- avoir le diabète
- avez un faible taux de potassium dans le sang
- êtes enceinte ou envisagez de devenir enceinte. On ne sait pas si PROAIR HFA nuira à votre bébé à naître. Parlez à votre médecin si vous êtes enceinte ou envisagez de devenir enceinte.
- allaitez ou envisagez d'allaiter. On ne sait pas si PROAIR HFA passe dans votre lait maternel. Discutez avec votre médecin de la meilleure façon de nourrir votre bébé si vous utilisez PROAIR HFA.
Informez votre médecin de tous les médicaments que vous prenez, compris les médicaments sur ordonnance et en vente libre, les vitamines et les suppléments à base de plantes.
PROAIR HFA et d'autres médicaments peuvent s'influencer mutuellement et causer des effets secondaires. PROAIR HFA peut affecter le mode d'action d'autres médicaments, et d'autres médicaments peuvent affecter le mode d'action de PROAIR HFA.
Prévenez surtout votre médecin si vous prenez :
- autres médicaments inhalés ou médicaments contre l'asthme
- médicaments bêta-bloquants
- diurétiques
- digoxine
- inhibiteurs de la monoamine oxydase
- antidépresseurs tricycliques
Demandez à votre médecin ou à votre pharmacien une liste de ces médicaments en cas de doute.
Connaissez les médicaments que vous prenez. Conservez-en une liste pour la montrer à votre médecin et à votre pharmacien lorsque vous recevez un nouveau médicament.
Comment dois-je utiliser PROAIR HFA ?
- Pour des instructions détaillées, voir "Mode d'emploi" à la fin de ces informations patient.
- Utilisez PROAIR HFA exactement comme votre médecin vous l'a indiqué.
- Si votre enfant doit utiliser PROAIR HFA, surveillez-le attentivement pour vous assurer qu'il utilise correctement l'inhalateur. Votre médecin vous montrera comment votre enfant doit utiliser PROAIR HFA.
- Chaque dose de PROAIR HFA devrait durer jusqu'à 4 heures à 6 heures.
- Ne pas augmentez votre dose ou prenez des doses supplémentaires de PROAIR HFA sans en parler d'abord à votre médecin.
- Obtenez immédiatement une aide médicale si PROAIR HFA ne soulage plus vos symptômes.
- Consultez immédiatement un médecin si vos symptômes s'aggravent ou si vous devez utiliser votre inhalateur plus souvent.
- Pendant que vous utilisez PROAIR HFA, n'utilisez pas d'autres médicaments de secours inhalés et des médicaments contre l'asthme à moins que votre médecin ne vous le dise.
- Appelez votre médecin si vos symptômes d'asthme comme une respiration sifflante et des difficultés respiratoires s'aggravent en quelques heures ou quelques jours. Votre médecin devra peut-être vous prescrire un autre médicament (par exemple, des corticostéroïdes) pour traiter vos symptômes.
Quels sont les effets secondaires possibles de PROAIR HFA ?
PROAIR HFA peut provoquer des effets secondaires graves, notamment :
- aggravation des difficultés respiratoires, toux et respiration sifflante (bronchospasme paradoxal). Si cela se produit, arrêtez d'utiliser PROAIR HFA et appelez votre médecin ou obtenez immédiatement une aide d'urgence. Le bronchospasme paradoxal est plus susceptible de se produire lors de votre première utilisation d'une nouvelle cartouche de médicament.
- problèmes cardiaques, y compris une fréquence cardiaque plus rapide et une pression artérielle élevée
- décès possible chez les personnes asthmatiques qui utilisent trop de PROAIR HFA
- réactions allergiques. Appelez immédiatement votre médecin si vous présentez les symptômes suivants d'une réaction allergique :
- la peau qui gratte
- gonflement sous la peau ou dans la gorge
- éruption
- aggravation des difficultés respiratoires
- faible taux de potassium dans votre sang
- aggravation d'autres problèmes médicaux chez les personnes qui utilisent également PROAIR HFA, y compris une augmentation de la glycémie
Les effets secondaires les plus courants de PROAIR HFA comprennent :
- votre cœur a l'impression de battre ou de s'emballer (palpitations)
- douleur thoracique
- rythme cardiaque rapide
- tremblement
- nervosité
- mal de tête
- vertiges
- mal de gorge
- nez qui coule
Dites à votre médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de PROAIR HFA. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
Comment dois-je conserver PROAIR HFA ?
- Conservez PROAIR HFA à température ambiante entre 59° F et 77° F (15° C et 25° C).
- Évitez l'exposition à la chaleur et au froid extrêmes.
- Bien agiter le bidon PROAIR HFA avant utilisation.
- Ne pas percer la cartouche PROAIR HFA.
- Ne pas stocker la cartouche PROAIR HFA près d'une source de chaleur ou d'une flamme. Des températures supérieures à 120 °F peuvent faire éclater la cartouche.
- Ne pas jeter le bidon PROAIR HFA dans un feu ou un incinérateur.
- Évitez de vaporiser PROAIR HFA dans vos yeux.
Gardez PROAIR HFA et tous les médicaments hors de la portée des enfants.
Informations générales sur l'utilisation sûre et efficace de PROAIR HFA
Les médicaments sont parfois prescrits à des fins autres que celles énumérées dans un guide des médicaments. Ne pas utiliser PROAIR HFA pour une condition pour laquelle il n'a pas été prescrit. Ne donnez pas PROAIR HFA à d'autres personnes, même si elles présentent les mêmes symptômes que vous. Cela peut leur nuire.
Ces informations destinées aux patients résument les informations les plus importantes sur PROAIR HFA. Si vous souhaitez plus d'informations, parlez-en à votre médecin. Vous pouvez demander à votre pharmacien ou à votre médecin des informations sur PROAIR HFA destinées aux professionnels de la santé.
Pour plus d'informations, rendez-vous sur www.ProAirHFA.com ou appelez le 1-888-482-9522.
Quels sont les ingrédients de PROAIR HFA ?
Ingrédient actif : sulfate d'albutérol
Ingrédients inactifs : propulseur HFA-134a et éthanol.
Mode d'emploi
PROAIR® HFA (pro' ar) (sulfate d'albutérol) Inhalation Aérosol
Lisez ce mode d'emploi avant de commencer à utiliser PROAIR HFA et chaque fois que vous recevez une recharge. Il peut y avoir de nouvelles informations. Ces informations ne remplacent pas une discussion avec votre médecin au sujet de votre état de santé ou de votre traitement.
Les parties de votre inhalateur PROAIR HFA :
Il y a 2 parties principales de votre inhalateur PROAIR HFA, y compris :
- actionneur en plastique rouge qui pulvérise le médicament de la cartouche. Voir la figure A.
- capuchon protecteur anti-poussière qui recouvre l'embout buccal de l'actionneur. Voir la figure A.
Il y a aussi une boîte en métal qui contient le médicament. Voir la figure A.
Il y a aussi un compteur de dose fixé à l'arrière de l'actionneur avec une fenêtre de visualisation qui vous montre combien de pulvérisations de médicament il vous reste. Voir la figure B.
Vous verrez un point noir dans la fenêtre de visualisation sur l'actionneur jusqu'à ce que l'appareil ait été amorcé 3 fois. Voir Figure B et « Amorçage de votre appareil PROAIR HFA » ci-dessous.
Figure A et Figure B 
- Ne pas utiliser l'actionneur PROAIR HFA avec une cartouche de médicament de tout autre inhalateur.
- Ne pas utiliser une cartouche PROAIR HFA avec un actionneur de tout autre inhalateur, y compris un autre inhalateur PROAIR HFA.
Amorçage de votre appareil PROAIR HFA :
Votre appareil PROAIR doit être amorcé avant que vous ne l'utilisiez pour la première fois ou si votre appareil n'a pas été utilisé pendant plus de 14 jours consécutifs. Ne pas amorcez votre appareil PROAIR HFA tous les jours.
- Retirez votre appareil PROAIR HFA de son emballage.
- Retirez le capuchon protecteur anti-poussière de l'embout buccal.
- Bien agiter l'inhalateur et le vaporiser dans l'air loin de votre visage. Voir la figure C.
Figure C 
- Secouez et vaporisez l'inhalateur comme ceci 2 fois de plus pour finir de l'amorcer. Le compteur de doses sur l'actionneur doit afficher le nombre 200 après avoir amorcé l'actionneur pour la première fois. Voir la figure D.
Figure D 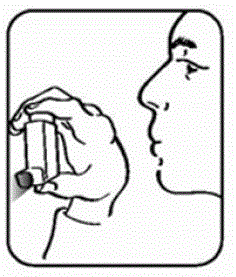
Chaque fois que vous utilisez votre appareil PROAIR HFA :
- Assurez-vous que la cartouche s'insère fermement dans l'actionneur en plastique.
- Regardez dans l'embout buccal pour vous assurer qu'il n'y a pas de corps étrangers, surtout si le capuchon n'a pas été utilisé pour couvrir l'embout buccal.
Lecture du compteur de doses sur votre actionneur PROAIR HFA
- Le compteur de dose comptera à rebours chaque fois qu'un spray est libéré. La fenêtre du compteur de doses indique le nombre de pulvérisations restantes dans votre inhalateur par unités de 2 pulvérisations. Par exemple, il reste 190 pulvérisations si la flèche est exactement en face du chiffre 190, ou 189 pulvérisations si la flèche pointe entre 190 et 188. Voir la figure D.
- Lorsque le compteur de doses atteint 0, il continue d'afficher 0 et vous devez remplacer votre appareil PROAIR HFA.
- Le compteur de doses ne peut pas être réinitialisé et est fixé en permanence à l'actionneur. Ne modifiez jamais les chiffres du compteur de dose ou ne touchez jamais la goupille à l'intérieur de l'actionneur.
- Ne pas retirez la cartouche de l'actionneur en plastique, sauf pendant le nettoyage. Le rattachement de la cartouche à l'actionneur peut libérer accidentellement une dose de PROAIR HFA dans l'air. Le compteur de dose comptera à rebours chaque fois qu'un spray est libéré.
Utilisation de votre appareil PROAIR HFA :
Étape 1. Bien agiter l'inhalateur avant chaque pulvérisation. Retirez le capuchon de l'embout buccal de l'actionneur.
Étape 2. Tenez l'inhalateur avec l'embout buccal vers le bas. Voir la figure E.
Figure E 
Étape 3. Expirez par la bouche et expulsez autant d'air de vos poumons que vous le pouvez. Mettez l'embout buccal dans votre bouche et refermez vos lèvres autour. Voir la figure F.
Étape 4. Poussez le haut de la cartouche vers le bas pendant que vous inspirez profondément et lentement par la bouche. Voir la figure F.
Figure F 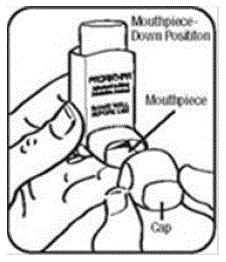
Étape 5. Juste après la sortie du spray, retirez votre doigt de la cartouche. Après avoir inspiré à fond, retirez l'inhalateur de votre bouche et fermez la bouche.
Étape 6. Retenez votre souffle aussi longtemps que vous le pouvez, jusqu'à 10 secondes, puis respirez normalement.
Si votre médecin vous a dit d'utiliser plus de sprays, attendez 1 minute et secouez à nouveau l'inhalateur. Répétez les étapes 2 à 6.
Étape 7. Remettez le capuchon sur l'embout buccal après chaque utilisation de l'inhalateur. Assurez-vous que le capuchon s'enclenche fermement en place.
Nettoyage de votre appareil PROAIR HFA :
Il est très important de garder l'actionneur en plastique propre afin que le médicament ne s'accumule pas et ne bloque pas la pulvérisation. Voir Figure G et Figure H.
Figure G et Figure H 
- N'essayez pas de nettoyer la cartouche métallique ou de la laisser se mouiller. L'inhalateur peut cesser de pulvériser s'il n'est pas nettoyé correctement.
- Si vous avez plus d'un inhalateur PROAIR HFA, lavez chaque appareil à des moments différents pour éviter de mettre la mauvaise cartouche avec le mauvais actionneur en plastique. De cette façon, vous pouvez être sûr de toujours connaître le nombre exact de doses restantes de PROAIR HFA.
- Laver l'actionneur au moins 1 fois par semaine comme suit :
- Retirez la cartouche de l'actionneur et retirez le capuchon de l'embout buccal.
- Tenez l'actionneur sous le robinet et faites-y couler de l'eau chaude pendant environ 30 secondes. Voir Figure I.
Je figure 
- Retournez l'actionneur et faites couler de l'eau chaude dans l'embout buccal pendant environ 30 secondes. Voir figure J.
Figure J 
- Secouez autant d'eau que possible de l'actionneur. Regardez dans l'embout buccal pour vous assurer que toute accumulation de médicament a été complètement éliminée. S'il y a une accumulation, répétez les instructions de lavage.
- Laissez l'actionneur sécher complètement à l'air, par exemple pendant la nuit. Voir la figure K.
Figure K 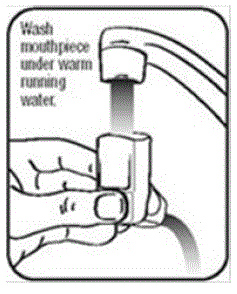
- Lorsque l'actionneur est sec, placez la cartouche dans l'actionneur et assurez-vous qu'elle est bien ajustée. Bien agiter l'inhalateur et vaporiser deux fois dans l'air loin de votre visage. Remettez le capuchon sur l'embout buccal.
Si vous devez utiliser votre inhalateur avant que l'actionneur ne soit complètement sec :
- Secouez autant d'eau que possible sur l'actionneur.
- Placez la cartouche dans l'actionneur et assurez-vous qu'elle est bien ajustée.
- Bien agiter l'inhalateur et vaporiser deux fois dans l'air loin de votre visage.
- Prenez votre dose de PROAIR HFA comme prescrit.
- Suivez les instructions de nettoyage ci-dessus.
Remplacement de votre appareil PROAIR HFA
- Lorsque le compteur de doses sur l'actionneur indique le chiffre 20, la couleur des chiffres passera au rouge. Les chiffres rouges vous rappellent de renouveler votre ordonnance ou de demander à votre médecin une autre ordonnance de PROAIR HFA. Lorsque le compteur de doses atteint 0, la couleur de fond passe au rouge uni.
- Jeter l'inhalateur PROAIR HFA dès que le compteur de dose indique 0 ou après la date de péremption sur l'emballage du PROAIR HFA, selon la première éventualité. Vous ne devez pas continuer à utiliser l'inhalateur après 200 pulvérisations, même si la cartouche n'est pas complètement vide. Vous ne pouvez pas être sûr de recevoir un médicament après avoir utilisé 200 pulvérisations.
- Ne pas utiliser l'inhalateur après la date de péremption indiquée sur l'emballage du PROAIR HFA.
Ces informations pour les patients et instructions d'utilisation ont été approuvées par la Food and Drug Administration des États-Unis.
