Pulmicort 100mcg, 200mcg Budesonide Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Pulmicort 100mcg Turbuhaler et comment est-il utilisé ?
Pulmicort 100mcg Turbuhaler est un médicament d'ordonnance utilisé pour traiter les symptômes de l'asthme. Pulmicort 100mcg Turbuhaler peut être utilisé seul ou avec d'autres médicaments.
Pulmicort Turbuhaler appartient à une classe de médicaments appelés corticostéroïdes, inhalants.
On ne sait pas si Pulmicort Turbuhaler est sûr et efficace chez les enfants de moins de 1 an.
Quels sont les effets secondaires possibles de Pulmicort 200mcg Turbuhaler ?
Pulmicort 100mcg Turbuhaler peut provoquer des effets secondaires graves, notamment :
- urticaire,
- difficulté à respirer,
- gonflement du visage, des lèvres, de la langue ou de la gorge,
- fatigue inhabituelle,
- problèmes de vue,
- ecchymoses ou saignements faciles,
- visage bouffi,
- croissance inhabituelle des cheveux,
- des changements d'humeur,
- la dépression,
- sautes d'humeur,
- agitation,
- faiblesse ou douleur musculaire,
- amincissement de la peau,
- cicatrisation lente des plaies et
- augmentation de la soif ou de la miction
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Pulmicort 100mcg Turbuhaler incluent :
- gorge sèche, irritée ou irritée,
- enrouement,
- changements de voix,
- mauvais goût dans la bouche,
- nez qui coule ou bouché, et
- saignements de nez
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Pulmicort Turbuhaler. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
Pour inhalation orale uniquement.
LA DESCRIPTION
Le budésonide, le composant actif de PULMICORT TURBUHALER (budésonide) 200 mcg, est un corticostéroïde désigné chimiquement par (RS)-11β, 16α, 17,21-Tetrahydroxypregna-1,4-diene-3,20-dione cyclique 16,17- acétal avec du butyraldéhyde. Le budésonide est fourni sous la forme d'un mélange de deux épimères (22R et 22S). La formule empirique du budésonide est C25H34O6 et son poids moléculaire est de 430,5. Sa formule structurale est :
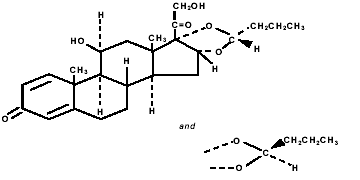
Le budésonide est une poudre blanche à blanc cassé, insipide et inodore, pratiquement insoluble dans l'eau et dans l'heptane, peu soluble dans l'éthanol et librement soluble dans le chloroforme. Son coefficient de partage entre l'octanol et l'eau à pH 7,4 est de 1,6 x 103.
PULMICORT 100 mcg TURBUHALER (budésonide) est un inhalateur de poudre sèche multidose à inhalation qui ne contient que du budésonide micronisé. Chaque actionnement de PULMICORT 100 mcg TURBUHALER fournit 200 mcg de budésonide par dose mesurée, ce qui délivre environ 160 mcg de budésonide à partir de l'embout buccal (basé sur des tests in vitro à 60 L/min pendant 2 secondes).
Des tests in vitro ont montré que l'administration de la dose de PULMICORT 100 mcg TURBUHALER (budésonide) dépend essentiellement du débit d'air à travers le dispositif. Des facteurs liés au patient tels que les débits inspiratoires affecteront également la dose délivrée aux poumons des patients en cours d'utilisation (voir Instructions d'utilisation pour le patient ). Chez les patients adultes asthmatiques (VEMS moyen 2,9 L [0,8 - 5,1 L]), le débit inspiratoire de pointe (PIF) moyen dans PULMICORT TURBUHALER (budésonide) était de 78 (40-111) L/min. Des résultats similaires (PIF moyen 82 [43-125] L/min) ont été obtenus chez des enfants asthmatiques (6 à 15 ans, VEMS moyen 2,1 L [0,9 - 5,4 L]). Les patients doivent être soigneusement informés de l'utilisation de ce médicament afin d'assurer une administration optimale de la dose.
LES INDICATIONS
PULMICORT TURBUHALER (budésonide) est indiqué pour le traitement d'entretien de l'asthme comme traitement prophylactique chez les patients adultes et pédiatriques âgés de six ans ou plus. Il est également indiqué chez les patients nécessitant une corticothérapie orale pour l'asthme. Beaucoup de ces patients peuvent être en mesure de réduire ou d'éliminer leurs besoins en corticostéroïdes oraux au fil du temps.
PULMICORT 100mcg TURBUHALER (budésonide) n'est PAS indiqué pour le soulagement du bronchospasme aigu.
DOSAGE ET ADMINISTRATION
PULMICORT 200 mcg TURBUHALER (budésonide) doit être administré par inhalation orale chez les patients asthmatiques âgés de 6 ans et plus. Les patients individuels connaîtront un début et un degré variables de soulagement des symptômes. Généralement, PULMICORT TURBUHALER (budésonide) a un début d'action relativement rapide pour un corticostéroïde inhalé. Une amélioration du contrôle de l'asthme après l'administration par inhalation de PULMICORT 200 mcg TURBUHALER (budésonide) peut survenir dans les 24 heures suivant le début du traitement, bien que le bénéfice maximum puisse ne pas être atteint avant 1 à 2 semaines ou plus. L'innocuité et l'efficacité de PULMICORT TURBUHALER (budésonide) lorsqu'il est administré au-delà des doses recommandées n'ont pas été établies.
La dose initiale recommandée et la dose maximale recommandée de PULMICORT TURBUHALER (budésonide), selon un traitement antérieur contre l'asthme, sont indiquées dans le tableau suivant.
Chez les patients asthmatiques légers à modérés bien contrôlés par les corticostéroïdes inhalés, l'administration de PULMICORT 100 mcg TURBUHALER (budésonide) 200 mcg ou 400 mcg une fois par jour peut être envisagée. PULMICORT 200mcg TURBUHALER (budésonide) peut être administré une fois par jour soit le matin soit le soir.
Si le traitement uniquotidien par PULMICORT 200 mcg TURBUHALER (budésonide) ne permet pas un contrôle adéquat des symptômes de l'asthme, la dose quotidienne totale doit être augmentée et/ou administrée en dose fractionnée.
Patients maintenus sous corticostéroïdes oraux chroniques
Initialement, PULMICORT TURBUHALER (budésonide) doit être utilisé en même temps que la dose d'entretien habituelle de corticostéroïde systémique du patient. Après environ une semaine, l'arrêt progressif du corticostéroïde systémique est commencé en réduisant la dose quotidienne ou alternée. La réduction suivante est effectuée après un intervalle d'une ou deux semaines, selon la réponse du patient. Généralement, ces décrémentations ne doivent pas dépasser 2,5 mg de prednisone ou son équivalent. Un rythme de retrait lent est fortement recommandé. Pendant la réduction des corticostéroïdes oraux, les patients doivent être étroitement surveillés pour détecter une instabilité de l'asthme, y compris des mesures objectives de la fonction des voies respiratoires et une insuffisance surrénalienne (voir AVERTISSEMENTS ). Pendant le sevrage, certains patients peuvent présenter des symptômes de sevrage systémique des corticostéroïdes, par exemple des douleurs articulaires et/ou musculaires, de la lassitude et une dépression, malgré le maintien ou même l'amélioration de la fonction pulmonaire. Ces patients doivent être encouragés à poursuivre le traitement par PULMICORT TURBUHALER (budésonide), mais doivent être surveillés pour déceler des signes objectifs d'insuffisance surrénalienne. En cas de signes d'insuffisance surrénalienne, les doses systémiques de corticostéroïdes doivent être temporairement augmentées, puis le sevrage doit se poursuivre plus lentement. Pendant les périodes de stress ou de crise d'asthme sévère, les patients transférés peuvent nécessiter un traitement complémentaire avec des corticostéroïdes systémiques.
REMARQUE: Chez tous les patients, il est souhaitable de titrer à la dose efficace la plus faible une fois que la stabilité de l'asthme est atteinte.
Mode d'emploi
Instructions illustrées pour le patient à utiliser accompagnent chaque emballage de PULMICORT 200mcg TURBUHALER (budésonide) .
Les patients doivent être informés de l'amorçage de PULMICORT TURBUHALER (budésonide) avant son utilisation initiale, et doivent être invités à inhaler profondément et avec force chaque fois que l'appareil est utilisé. Il est également recommandé de se rincer la bouche après inhalation.
COMMENT FOURNIE
PULMICORT TURBUHALER (budésonide) se compose d'un certain nombre de pièces en plastique assemblées, les pièces principales étant le mécanisme de dosage, l'unité de stockage de la substance médicamenteuse et l'embout buccal. L'inhalateur est protégé par un couvercle tubulaire extérieur blanc vissé sur l'inhalateur. Le corps de l'inhalateur est blanc et la poignée tournante est brune. Le libellé suivant est imprimé sur la poignée en lettres en relief, « Pulmicort™ 200 mcg ». L'inhalateur TURBUHALER ne peut pas être rempli et doit être jeté lorsqu'il est vide.
PULMICORT TURBUHALER (budésonide) est disponible en 200 mcg/dose, 200 doses (NDC 0186-0915-42) et a un poids de remplissage cible de 104 mg.
Lorsqu'il reste 20 doses de PULMICORT 200 mcg TURBUHALER (budésonide), une marque rouge apparaît dans la fenêtre indicatrice. Si l'appareil est utilisé au-delà du point auquel la marque rouge apparaît au bas de la fenêtre, la quantité correcte de médicament peut ne pas être obtenue. L'unité doit être jetée.
Le magasin avec la couverture serrée dans un endroit sec à la température de pièce contrôlée 20-25°C (68-77°F) [voit USP]. Garder hors de la portée des enfants.
Toutes les marques déposées sont la propriété du groupe de sociétés AstraZeneca. ©AstraZeneca 2001, 2006. Fabriqué pour : AstraZeneca LP, Wilmington, DE 19850 Par : AstraZeneca AB, Sodertalje, Suède 33020-00. Rév. 10/06. Date de révision FDA : 20/08/2007
EFFETS SECONDAIRES
Les effets indésirables suivants ont été signalés chez des patients traités par PULMICORT 100 mcg TURBUHALER (budésonide) .
L'incidence des événements indésirables courants est basée sur des essais cliniques américains à double insu et contrôlés par placebo au cours desquels 1116 patients adultes et pédiatriques âgés de 6 à 70 ans (472 femmes et 644 hommes) ont été traités avec PULMICORT TURBUHALER (budésonide) (200 à 800 mcg deux fois par jour pendant 12 à 20 semaines) ou un placebo.
Le tableau suivant montre l'incidence des effets indésirables chez les patients ayant précédemment reçu des bronchodilatateurs et/ou des corticostéroïdes inhalés lors d'essais cliniques contrôlés aux États-Unis. Cette population comprenait 232 hommes et 62 femmes patients pédiatriques (âgés de 6 à 17 ans) et 332 hommes et 331 femmes adultes (âgés de 18 ans et plus).
Événements indésirables avec une incidence ≥ 3 % signalés par des patients sous PULMICORT 100 mcg TURBUHALER (budésonide)
Le tableau ci-dessus comprend tous les événements (qu'ils soient considérés comme liés ou non au médicament par les investigateurs) qui se sont produits à un taux ≥ 3 % dans l'un quelconque des groupes PULMICORT TURBUHALER (budésonide) et qui étaient plus fréquents que dans le groupe placebo. Lors de l'examen de ces données, la durée moyenne d'exposition accrue des patients atteints de PULMICORT 200 mcg TURBUHALER (budésonide) doit être prise en compte.
Les autres événements indésirables suivants sont survenus dans ces essais cliniques avec PULMICORT 100 mcg TURBUHALER (budésonide) avec une incidence de 1 à 3 % et étaient plus fréquents avec PULMICORT 200 mcg TURBUHALER (budésonide) qu'avec le placebo.
Corps dans son ensemble : la douleur du cou
Cardiovasculaire: syncope
Digestif: douleurs abdominales, bouche sèche, vomissements
Métabolique et Nutritionnel : gain de poids
Musculo-squelettique : fracture, myalgie
Nerveux: hypertonie, migraine
Plaquettes, saignements et coagulation : ecchymose
Psychiatrique: insomnie
Mécanismes de résistance : infection
Sens spéciaux : perversion du goût
Dans un essai de 20 semaines mené auprès d'adultes asthmatiques qui nécessitaient auparavant des corticostéroïdes oraux, les effets de PULMICORT TURBUHALER (budésonide) 400 mcg deux fois par jour (N = 53) et 800 mcg deux fois par jour (N = 53) ont été comparés à ceux d'un placebo (N = 53 ) sur la fréquence des événements indésirables rapportés. Les événements indésirables, qu'ils soient considérés comme liés ou non au médicament par les investigateurs, signalés chez plus de cinq patients du groupe PULMICORT 200mcg TURBUHALER (budésonide) et qui sont survenus plus fréquemment avec PULMICORT TURBUHALER (budésonide) qu'avec le placebo sont présentés ci-dessous ( % PULMICORT TURBUHALER (budésonide) et % placebo). Lors de l'examen de ces données, il convient de tenir compte de l'augmentation de la durée moyenne d'exposition des patients recevant PULMICORT 200 mcg TURBUHALER (budésonide) (78 jours pour PULMICORT TURBUHALER (budésonide) contre 41 jours pour le placebo).
Patients recevant PULMICORT TURBUHALER (budésonide) une fois par jour
Le profil des effets indésirables de l'administration uniquotidienne de PULMICORT 100 mcg TURBUHALER (budésonide) 200 mcg et 400 mcg, et d'un placebo, a été évalué chez 309 patients adultes asthmatiques dans une étude de 18 semaines. La population de l'étude comprenait à la fois des patients précédemment traités par des corticoïdes inhalés et des patients n'ayant pas reçu de corticothérapie auparavant. Il n'y avait aucune différence cliniquement pertinente dans le schéma des effets indésirables après l'administration uniquotidienne de PULMICORT 200mcg TURBUHALER (budésonide) par rapport à l'administration biquotidienne.
Études pédiatriques : Dans un essai contrôlé par placebo de 12 semaines mené auprès de 404 patients pédiatriques âgés de 6 à 18 ans précédemment traités par des corticostéroïdes inhalés, la fréquence des événements indésirables pour chaque catégorie d'âge (6 à 12 ans, 13 à 18 ans) était comparable pour PULMICORT TURBUHALER (budésonide) (à 100, 200 et 400 mcg deux fois par jour) et un placebo. Il n'y avait pas de différences cliniquement pertinentes dans le schéma ou la gravité des événements indésirables chez les enfants par rapport à ceux rapportés chez les adultes.
Rapports d'événements indésirables provenant d'autres sources : Les événements indésirables rares rapportés dans la littérature publiée ou issus de l'expérience de commercialisation mondiale avec toute formulation de budésonide inhalé comprennent : réactions d'hypersensibilité immédiates et retardées, y compris éruption cutanée, dermatite de contact, urticaire, œdème de Quincke et bronchospasme ; symptômes d'hypocorticisme et d'hypercorticisme; glaucome, cataractes; symptômes psychiatriques, y compris la dépression, les réactions agressives, l'irritabilité, l'anxiété et la psychose.
INTERACTIONS MÉDICAMENTEUSES
Dans les études cliniques, l'administration concomitante de budésonide et d'autres médicaments couramment utilisés dans le traitement de l'asthme n'a pas entraîné d'augmentation de la fréquence des événements indésirables. La principale voie de métabolisme du budésonide, ainsi que d'autres corticostéroïdes, est via l'isoenzyme 3A4 (CYP3A4) du cytochrome P450 (CYP). Après administration orale de kétoconazole, un puissant inhibiteur du CYP3A4, la concentration plasmatique moyenne du budésonide administré par voie orale a augmenté. L'administration concomitante d'autres inhibiteurs connus du CYP3A4 (par exemple, l'itraconazole, la clarithromycine, l'érythromycine, etc.) peut inhiber le métabolisme et augmenter l'exposition systémique au budésonide. La prudence s'impose lorsque le budésonide est co-administré avec du kétoconazole à long terme et d'autres inhibiteurs connus du CYP3A4.
AVERTISSEMENTS
Une attention particulière est nécessaire pour les patients qui sont transférés de corticostéroïdes systémiques actifs à PULMICORT 200 mcg TURBUHALER (budésonide) car des décès dus à une insuffisance surrénalienne sont survenus chez des patients asthmatiques pendant et après le transfert de corticostéroïdes systémiques à des corticostéroïdes inhalés moins systémiquement disponibles. Après l'arrêt des corticostéroïdes systémiques, un certain nombre de mois sont nécessaires pour la récupération de la fonction hypothalamo-hypophyso-surrénalienne (HHS).
Les patients qui ont été précédemment maintenus à 20 mg ou plus par jour de prednisone (ou son équivalent) peuvent être les plus sensibles, en particulier lorsque leurs corticostéroïdes systémiques ont été presque complètement arrêtés. Au cours de cette période de suppression de l'HPA, les patients peuvent présenter des signes et des symptômes d'insuffisance surrénalienne lorsqu'ils sont exposés à un traumatisme, une intervention chirurgicale ou une infection (en particulier une gastro-entérite) ou d'autres affections associées à une grave perte d'électrolytes. Bien que PULMICORT TURBUHALER (budésonide) puisse contrôler les symptômes de l'asthme pendant ces épisodes, aux doses recommandées, il fournit des quantités physiologiques de glucocorticoïdes inférieures à la normale et ne fournit PAS l'activité minéralocorticoïde nécessaire pour faire face à ces urgences.
Pendant les périodes de stress ou de crise d'asthme sévère, les patients qui ont cessé de prendre des corticostéroïdes systémiques doivent être informés de reprendre immédiatement les corticostéroïdes oraux (à fortes doses) et de contacter leur médecin pour obtenir des instructions supplémentaires. Ces patients doivent également être informés qu'ils doivent être munis d'une carte d'identité médicale indiquant qu'ils peuvent avoir besoin de corticostéroïdes systémiques supplémentaires pendant les périodes de stress ou de crise d'asthme sévère.
Les patients nécessitant des corticostéroïdes oraux doivent être sevrés lentement de l'utilisation systémique de corticostéroïdes après le passage à PULMICORT 100 mcg TURBUHALER (budésonide) . La fonction pulmonaire (FEV1 ou AM DEP), l'utilisation de bêta-agonistes et les symptômes de l'asthme doivent être étroitement surveillés pendant l'arrêt des corticostéroïdes oraux. En plus de surveiller les signes et symptômes de l'asthme, les patients doivent être surveillés pour détecter les signes et symptômes d'insuffisance surrénalienne tels que fatigue, lassitude, faiblesse, nausées et vomissements et hypotension.
Le transfert de patients d'une corticothérapie systémique à PULMICORT 200 mcg TURBUHALER (budésonide) peut révéler des affections allergiques précédemment supprimées par la corticothérapie systémique, par exemple, rhinite, conjonctivite, arthrite, affections éosinophiles et eczéma (voir DOSAGE ET ADMINISTRATION ).
Les patients qui prennent des médicaments qui suppriment le système immunitaire sont plus sensibles aux infections que les individus en bonne santé. La varicelle et la rougeole, par exemple, peuvent avoir une évolution plus grave, voire mortelle, chez les patients pédiatriques sensibles ou les adultes recevant des doses immunosuppressives de corticostéroïdes. Chez les patients pédiatriques ou adultes qui n'ont pas eu ces maladies, des précautions particulières doivent être prises pour éviter l'exposition. On ne sait pas comment la dose, la voie et la durée de l'administration de corticostéroïdes affectent le risque de développer une infection disséminée. La contribution de la maladie sous-jacente et/ou de la corticothérapie antérieure au risque n'est pas non plus connue. En cas d'exposition, un traitement par des immunoglobulines varicelle-zona (VZIG) ou des immunoglobulines intraveineuses groupées (IgIV), selon le cas, peut être indiqué. En cas d'exposition à la rougeole, une prophylaxie avec un pool d'immunoglobulines intramusculaires (IG) peut être indiquée. (Voir les notices d'emballage respectives pour des informations complètes sur la prescription de VZIG et IG.) Si la varicelle se développe, un traitement avec des agents antiviraux peut être envisagé.
PULMICORT 200 mcg TURBUHALER (budésonide) n'est pas un bronchodilatateur et n'est pas indiqué pour le soulagement rapide du bronchospasme ou d'autres épisodes aigus d'asthme.
Comme avec d'autres médicaments contre l'asthme inhalés, un bronchospasme, avec une augmentation immédiate de la respiration sifflante, peut survenir après l'administration. Si un bronchospasme survient après l'administration de PULMICORT TURBUHALER (budésonide), il doit être traité immédiatement avec un bronchodilatateur inhalé à action rapide. Le traitement par PULMICORT TURBUHALER (budésonide) doit être interrompu et un autre traitement doit être institué.
Les patients doivent être informés qu'ils doivent contacter leur médecin immédiatement lorsque des épisodes d'asthme ne répondant pas à leurs doses habituelles de bronchodilatateurs surviennent pendant le traitement par PULMICORT TURBUHALER (budésonide) . Au cours de tels épisodes, les patients peuvent nécessiter un traitement par corticostéroïdes oraux.
PRÉCAUTIONS
Général
Au cours du sevrage des corticoïdes oraux, certains patients peuvent présenter des symptômes de sevrage des corticoïdes systémiquement actifs, par exemple des douleurs articulaires et/ou musculaires, de la lassitude et une dépression, malgré le maintien ou même l'amélioration de la fonction respiratoire (voir DOSAGE ET ADMINISTRATION ).
Chez les patients répondeurs, PULMICORT TURBUHALER (budésonide) peut permettre de contrôler les symptômes de l'asthme avec moins de suppression de la fonction de l'axe HPA que des doses orales thérapeutiquement équivalentes de prednisone. Étant donné que le budésonide est absorbé dans la circulation et peut être actif de manière systémique, les effets bénéfiques de PULMICORT 100 mcg TURBUHALER (budésonide) pour minimiser le dysfonctionnement de l'HHS ne peuvent être attendus que lorsque les doses recommandées ne sont pas dépassées et que les patients individuels sont titrés à la dose efficace la plus faible. Étant donné qu'il existe une sensibilité individuelle aux effets sur la production de cortisol, les médecins doivent tenir compte de cette information lorsqu'ils prescrivent PULMICORT 100 mcg TURBUHALER (budésonide) .
En raison de la possibilité d'absorption systémique des corticostéroïdes inhalés, les patients traités par PULMICORT 200 mcg TURBUHALER (budésonide) doivent être surveillés attentivement pour tout signe d'effets corticostéroïdes systémiques. Des précautions particulières doivent être prises lors de l'observation des patients après l'opération ou pendant les périodes de stress afin de détecter une réponse surrénalienne inadéquate.
Il est possible que des effets corticostéroïdes systémiques tels qu'un hypercorticisme, une réduction de la densité minérale osseuse et une suppression surrénalienne puissent apparaître chez un petit nombre de patients, en particulier à des doses plus élevées. Si de tels changements se produisent, PULMICORT 100 mcg TURBUHALER (budésonide) doit être réduit lentement, conformément aux procédures acceptées pour la prise en charge des symptômes de l'asthme et pour la diminution progressive des stéroïdes systémiques.
Les corticostéroïdes inhalés par voie orale, y compris le budésonide, peuvent entraîner une réduction de la vitesse de croissance lorsqu'ils sont administrés à des patients pédiatriques. Une réduction de la vitesse de croissance peut survenir à la suite d'un contrôle inadéquat de l'asthme ou de l'utilisation de corticostéroïdes pour le traitement. Les effets potentiels d'un traitement prolongé sur la vitesse de croissance doivent être mis en balance avec les bénéfices cliniques obtenus et les risques associés aux thérapies alternatives. Pour minimiser les effets systémiques des corticostéroïdes inhalés par voie orale, y compris PULMICORT 200 mcg TURBUHALER (budésonide), chaque patient doit être titré à sa dose efficace la plus faible (voir PRÉCAUTIONS, Usage pédiatrique ).
Bien que les patients des essais cliniques aient reçu PULMICORT TURBUHALER (budésonide) de façon continue pendant des périodes de 1 à 2 ans, les effets locaux et systémiques à long terme de PULMICORT 200 mcg TURBUHALER (budésonide) chez les sujets humains ne sont pas entièrement connus. En particulier, les effets résultant de l'utilisation chronique de PULMICORT TURBUHALER (budésonide) sur les processus de développement ou immunologiques dans la bouche, le pharynx, la trachée et les poumons sont inconnus.
Dans les essais cliniques avec PULMICORT TURBUHALER (budésonide), des infections localisées à Candida albicans sont survenues dans la bouche et le pharynx chez certains patients. Ces infections peuvent nécessiter un traitement par un traitement antifongique approprié et/ou l'arrêt du traitement par PULMICORT TURBUHALER (budésonide) .
Les corticostéroïdes inhalés doivent être utilisés avec prudence, voire pas du tout, chez les patients atteints d'une infection tuberculeuse active ou quiescente des voies respiratoires, d'infections fongiques, bactériennes, virales ou parasitaires systémiques non traitées ou d'herpès simplex oculaire.
De rares cas de glaucome, d'augmentation de la pression intraoculaire et de cataractes ont été signalés à la suite de l'administration inhalée de corticostéroïdes.
Informations pour les patients
Les patients traités par PULMICORT TURBUHALER (budésonide) doivent recevoir les informations et instructions suivantes. Ces informations sont destinées à aider le patient à utiliser le médicament de manière sûre et efficace. Il ne s'agit pas d'une divulgation de tous les effets indésirables ou intentionnels possibles. Pour une utilisation appropriée de PULMICORT 200 mcg TURBUHALER (budésonide) et pour obtenir une amélioration maximale, le patient doit lire et suivre les instructions ci-jointes. Instructions pour le patient à utiliser avec précaution.
- Les patients doivent utiliser PULMICORT 200 mcg TURBUHALER (budésonide) à intervalles réguliers selon les directives puisque son efficacité dépend d'une utilisation régulière. Le patient ne doit pas modifier la posologie prescrite, sauf avis contraire du médecin.
- Les patients doivent être informés que PULMICORT 100 mcg TURBUHALER (budésonide) n'est pas un bronchodilatateur et n'est pas destiné à traiter les épisodes d'asthme aigus ou potentiellement mortels.
- Les patients doivent être informés que l'efficacité de PULMICORT 100 mcg TURBUHALER (budésonide) dépend de l'utilisation appropriée de l'appareil et de la technique d'administration par inhalation :
- 1. PULMICORT TURBUHALER (budésonide) doit être en position verticale (embout buccal sur le dessus) pendant le chargement afin de fournir la bonne dose.
- 2. PULMICORT 100mcg TURBUHALER (budésonide) doit être amorcé lorsque l'appareil est utilisé pour la toute première fois. Pour amorcer l'appareil, il doit être tenu en position verticale et la poignée marron tournée complètement vers la droite, puis complètement tournée vers la gauche jusqu'au déclic. Répéter.
- 3. Pour charger la première dose, la poignée doit être complètement tournée vers la droite et complètement vers la gauche jusqu'au déclic.
- 4. Après la première dose, il n'est pas nécessaire d'amorcer l'appareil. Cependant, il doit être chargé en position verticale immédiatement avant utilisation comme décrit ci-dessus.
- 5. Les patients doivent être avertis de ne pas secouer l'inhalateur.
- Les patients doivent placer l'embout buccal entre les lèvres et inspirer fortement et profondément. La poudre est ensuite délivrée aux poumons.
- Les patients ne doivent pas expirer dans PULMICORT TURBUHALER (budésonide) .
- En raison du faible volume de poudre, le patient peut ne pas goûter ou sentir la présence de tout médicament pénétrant dans les poumons lors de l'inhalation de l'inhalateur TURBUHALER. Cette absence de sensation n'indique pas que le patient ne tire pas profit de PULMICORT TURBUHALER (budésonide) .
- Les patients doivent être informés que le fait de se rincer la bouche avec de l'eau sans avaler après chaque administration peut réduire le risque de développement d'une candidose buccale.
- Les patients doivent être informés qu'ils recevront une nouvelle unité de PULMICORT TURBUHALER (budésonide) chaque fois qu'ils renouvelleront leur ordonnance. Les patients doivent être avisés de jeter tout le dispositif une fois que le nombre d'inhalations indiqué sur l'étiquette a été utilisé. Lorsqu'il reste 20 doses de PULMICORT TURBUHALER (budésonide), une marque rouge apparaît dans la fenêtre indicatrice.
- PULMICORT TURBUHALER (budésonide) ne doit pas être utilisé avec une chambre d'inhalation.
- L'embout buccal ne doit pas être mordu ou mâché.
- Le couvercle doit être remis en place en toute sécurité après chaque ouverture.
- Les patients doivent garder PULMICORT TURBUHALER (budésonide) propre et sec en tout temps.
- Les patients doivent être informés que l'amélioration de la maîtrise de l'asthme après l'inhalation de PULMICORT TURBUHALER (budésonide) peut se produire dans les 24 heures suivant le début du traitement, bien que le bénéfice maximum puisse ne pas être atteint avant 1 à 2 semaines, voire plus. Si les symptômes ne s'améliorent pas dans ce laps de temps, ou si l'état s'aggrave, le patient doit être informé de ne pas augmenter la dose, mais de contacter le médecin.
- Les patients dont les corticostéroïdes systémiques ont été réduits ou arrêtés doivent être informés qu'ils doivent porter une carte d'avertissement indiquant qu'ils peuvent avoir besoin de corticostéroïdes systémiques supplémentaires pendant les périodes de stress ou une crise d'asthme qui ne répond pas aux bronchodilatateurs.
- Les patients doivent être avisés de ne pas interrompre brusquement l'utilisation de PULMICORT TURBUHALER (budésonide).
- Les patients doivent être avertis d'éviter toute exposition à la varicelle ou à la rougeole et, s'ils y sont exposés, de consulter leur médecin sans délai.
- L'utilisation à long terme de corticostéroïdes inhalés, y compris le budésonide, peut augmenter le risque de certains problèmes oculaires (cataracte ou glaucome). Des examens réguliers de la vue doivent être envisagés.
- Les femmes qui envisagent d'utiliser PULMICORT TURBUHALER (budésonide) doivent consulter leur médecin si elles sont enceintes ou ont l'intention de le devenir, ou si elles allaitent un bébé.
- Les patients qui envisagent d'utiliser PULMICORT TURBUHALER (budésonide) doivent consulter leur médecin s'ils sont allergiques au budésonide ou à tout autre corticostéroïde inhalé par voie orale.
- Les patients doivent informer leur médecin des autres médicaments qu'ils prennent, car PULMICORT 100 mcg TURBUHALER (budésonide) peut ne pas convenir dans certaines circonstances et le médecin peut souhaiter utiliser un médicament différent.
Carcinogenèse, mutagenèse, altération de la fertilité
Des études à long terme ont été menées chez des rats et des souris en utilisant l'administration orale pour évaluer le potentiel carcinogène du budésonide.
Dans une étude orale de 104 semaines chez des rats Sprague-Dawley, une augmentation statistiquement significative de l'incidence des gliomes a été observée chez des rats mâles recevant une dose orale de 50 mcg/kg/jour (moins que la dose quotidienne maximale recommandée par inhalation chez les adultes et enfants sur une base de mcg/m2). Aucune tumorigénicité n'a été observée chez les rats mâles et femelles à des doses orales respectives allant jusqu'à 25 et 50 mcg/kg (moins que la dose quotidienne maximale recommandée par inhalation chez les adultes et les enfants sur une base mcg/m2). Dans deux études supplémentaires de deux ans chez des rats mâles Fischer et Sprague-Dawley, le budésonide n'a causé aucun gliome à une dose orale de 50 mcg/kg (moins que la dose quotidienne maximale recommandée par inhalation chez les adultes et les enfants sur une base de mcg/m2). Cependant, chez les rats Sprague-Dawley mâles, le budésonide a provoqué une augmentation statistiquement significative de l'incidence des tumeurs hépatocellulaires à une dose orale de 50 mcg/kg (moins que la dose quotidienne maximale recommandée par inhalation chez les adultes et les enfants sur une base de mcg/m2 ). Les corticostéroïdes de référence simultanés (prednisone et acétonide de triamcinolone) dans ces deux études ont montré des résultats similaires.
Il n'y avait aucune preuve d'effet cancérigène lorsque le budésonide a été administré par voie orale pendant 91 semaines à des souris à des doses allant jusqu'à 200 mcg/kg/jour (moins que la dose quotidienne maximale recommandée par inhalation chez les adultes et les enfants sur une base de mcg/m2).
Le budésonide ne s'est pas révélé mutagène ou clastogène dans six systèmes de test différents : test d'Ames Salmonella/microsome sur plaque, test du micronoyau de la souris, test du lymphome de la souris, test d'aberration chromosomique dans les lymphocytes humains, test létal récessif lié au sexe chez Drosophila melanogaster et analyse de la réparation de l'ADN chez le rat culture d'hépatocytes.
Chez le rat, le budésonide n'a eu aucun effet sur la fertilité à des doses sous-cutanées allant jusqu'à 80 mcg/kg (inférieures à la dose d'inhalation quotidienne maximale recommandée chez l'humain sur une base de mcg/m2).
À 20 mcg/kg/jour (moins que la dose d'inhalation quotidienne maximale recommandée chez l'homme sur une base de mcg/m2), des diminutions du gain de poids maternel, de la viabilité prénatale et de la viabilité des jeunes à la naissance et pendant l'allaitement ont été observées. Aucun de ces effets n'a été noté à 5 mcg/kg (moins que la dose d'inhalation quotidienne humaine recommandée maximale chez les adultes sur une base mcg/m2).
Grossesse : effets tératogènes
Catégorie de grossesse B : Comme avec d'autres glucocorticoïdes, le budésonide a entraîné une perte fœtale, une diminution du poids des ratons et des anomalies squelettiques à des doses sous-cutanées de 25 mcg/kg/jour chez le lapin (moins que la dose d'inhalation quotidienne maximale recommandée chez l'humain sur une base de mcg/m2) et 500 mcg/kg/jour chez le rat (environ 3 fois la dose d'inhalation quotidienne maximale recommandée chez l'humain sur une base de mcg/m2).
Aucun effet tératogène ou embryocide n'a été observé chez le rat lorsque le budésonide a été administré par inhalation à des doses allant jusqu'à 250 mcg/kg/jour (équivalent à la dose quotidienne maximale recommandée par inhalation chez l'homme sur une base de mcg/m2).
L'expérience avec les corticostéroïdes oraux depuis leur introduction à des doses pharmacologiques plutôt que physiologiques suggère que les rongeurs sont plus sujets aux effets tératogènes des corticostéroïdes que les humains.
Cependant, les études sur les femmes enceintes n'ont pas montré que PULMICORT TURBUHALER (budésonide) augmente le risque d'anomalies lorsqu'il est administré pendant la grossesse. Les résultats d'une vaste étude épidémiologique de cohorte prospective basée sur la population examinant les données de trois registres suédois couvrant environ 99 % des grossesses de 1995 à 1997 (c. pour les malformations congénitales résultant de l'utilisation de budésonide inhalé en début de grossesse. Les malformations congénitales ont été étudiées chez 2 014 nourrissons nés de mères déclarant avoir utilisé du budésonide inhalé pour l'asthme en début de grossesse (généralement 10 à 12 semaines après la dernière période menstruelle), période au cours de laquelle la plupart des malformations d'organes majeures se produisent. Le taux de malformations congénitales enregistrées était similaire par rapport au taux de la population générale (3,8 % contre 3,5 %, respectivement). De plus, après exposition au budésonide inhalé, le nombre de nourrissons nés avec des fentes orofaciales était similaire au nombre attendu dans la population normale (4 enfants contre 3,3, respectivement).
Ces mêmes données ont été utilisées dans une deuxième étude portant le total à 2 534 nourrissons dont les mères ont été exposées au budésonide inhalé. Dans cette étude, le taux de malformations congénitales chez les nourrissons dont les mères ont été exposées au budésonide inhalé en début de grossesse n'était pas différent du taux de tous les nouveau-nés au cours de la même période (3,6 %).
Malgré les découvertes sur les animaux, il semblerait que la possibilité de dommages au fœtus soit faible si le médicament est utilisé pendant la grossesse. Néanmoins, étant donné que les études chez l'humain ne peuvent exclure la possibilité d'effets nocifs, PULMICORT TURBUHALER (budésonide) ne doit être utilisé pendant la grossesse qu'en cas de nécessité absolue.

Effets non tératogènes
L'hypoadrénalisme peut survenir chez les nourrissons nés de mères recevant des corticostéroïdes pendant la grossesse. Ces nourrissons doivent être surveillés attentivement.
Mères allaitantes
Les corticostéroïdes sont sécrétés dans le lait maternel. En raison du risque d'effets indésirables chez les nourrissons allaités de tout corticostéroïde, une décision doit être prise d'interrompre l'allaitement ou d'arrêter le médicament, en tenant compte de l'importance du médicament pour la mère. Les données réelles sur le budésonide font défaut.
Utilisation pédiatrique
L'innocuité et l'efficacité de PULMICORT 100 mcg TURBUHALER (budésonide) chez les patients pédiatriques de moins de 6 ans n'ont pas été établies.
Chez les enfants asthmatiques, la fréquence des événements indésirables observés avec PULMICORT 100 mcg TURBUHALER (budésonide) était similaire entre le groupe d'âge de 6 à 12 ans (N = 172) et le groupe d'âge de 13 à 17 ans (N = 124) .
Des études cliniques contrôlées ont montré que les corticostéroïdes inhalés par voie orale peuvent entraîner une réduction de la vitesse de croissance chez les patients pédiatriques. Cet effet a été observé en l'absence de preuves de laboratoire de suppression de l'axe hypothalamo-hypophyso-surrénalien (HHS), ce qui suggère que la vitesse de croissance est un indicateur plus sensible de l'exposition systémique aux corticostéroïdes chez les patients pédiatriques que certains tests couramment utilisés de la fonction de l'axe HHS. Les effets à long terme de cette réduction de la vitesse de croissance associée aux corticostéroïdes inhalés par voie orale, y compris l'impact sur la taille adulte finale, sont inconnus. Le potentiel de « rattrapage » de la croissance après l'arrêt du traitement par des corticostéroïdes inhalés par voie orale n'a pas été suffisamment étudié.
Dans une étude portant sur des enfants asthmatiques âgés de 5 à 12 ans, ceux traités par PULMICORT 200 mcg TURBUHALER (budésonide) 200 mcg deux fois par jour (n = 311) ont présenté une réduction de croissance de 1,1 centimètre par rapport à ceux recevant un placebo (n = 418) à la fin d'un an; la différence entre ces deux groupes de traitement n'a pas augmenté davantage au cours des trois années de traitement supplémentaire. Au bout de quatre ans, les enfants traités par PULMICORT TURBUHALER (budésonide) et les enfants traités par placebo présentaient des vitesses de croissance similaires. Les conclusions tirées de cette étude peuvent être faussées par l'utilisation inégale des corticostéroïdes dans les groupes de traitement et l'inclusion de données provenant de patients atteignant la puberté au cours de l'étude.
La croissance des patients pédiatriques recevant des corticostéroïdes inhalés par voie orale, y compris PULMICORT TURBUHALER (budésonide), doit être surveillée régulièrement (p. ex., par stadiométrie). Les effets potentiels sur la croissance d'un traitement prolongé doivent être mis en balance avec les bénéfices cliniques obtenus et les risques et bénéfices associés aux thérapies alternatives. Pour minimiser les effets systémiques des corticostéroïdes inhalés, y compris PULMICORT 100 mcg TURBUHALER (budésonide), chaque patient doit être titré à sa dose efficace la plus faible.
Utilisation gériatrique
Cent patients âgés de 65 ans ou plus ont été inclus dans les essais cliniques contrôlés américains et non américains sur PULMICORT 100 mcg TURBUHALER (budésonide) . Il n'y avait aucune différence dans l'innocuité et l'efficacité du médicament par rapport à celles observées chez les patients plus jeunes.
En général, la sélection de la dose pour un patient âgé doit être prudente, en commençant généralement à l'extrémité inférieure de la plage posologique, reflétant la plus grande fréquence de diminution de la fonction hépatique, rénale ou cardiaque et de maladie concomitante ou d'un autre traitement médicamenteux.
SURDOSAGE
Le potentiel d'effets toxiques aigus suite à un surdosage de PULMICORT 100mcg TURBUHALER (budésonide) est faible. En cas d'utilisation à des doses excessives pendant des périodes prolongées, des effets corticostéroïdes systémiques tels qu'un hypercorticisme peuvent survenir (voir PRÉCAUTIONS ). PULMICORT TURBUHALER à deux fois la dose maximale recommandée (3200 mcg par jour) administré pendant 6 semaines a entraîné une réduction significative (27 %) de la réponse plasmatique du cortisol à une perfusion d'ACTH de 6 heures par rapport au placebo (+1 %). L'effet correspondant de 10 mg de prednisone par jour était une réduction de 35 % de la réponse du cortisol plasmatique à l'ACTH.
La dose létale par inhalation minimale chez la souris était de 100 mg/kg (environ 320 fois la dose quotidienne maximale recommandée par inhalation chez les adultes et environ 380 fois la dose quotidienne maximale recommandée par inhalation chez les enfants sur une base mcg/m2). Il n'y a eu aucun décès suite à l'administration d'une dose par inhalation de 68 mg/kg chez le rat (environ 430 fois la dose quotidienne maximale recommandée par inhalation chez les adultes et environ 510 fois la dose quotidienne maximale recommandée par inhalation chez les enfants sur une base mcg/m2). La dose létale orale minimale était de 200 mg/kg chez la souris (environ 630 fois la dose quotidienne maximale recommandée par inhalation chez l'adulte et environ 750 fois la dose quotidienne maximale recommandée par inhalation chez l'enfant sur une base de mcg/m2) et inférieure à 100 mg/kg chez le rat (environ 630 fois la dose quotidienne maximale recommandée par inhalation chez l'adulte et environ 750 fois la dose quotidienne maximale recommandée par inhalation chez l'enfant, sur la base d'un mcg/m2).
L'expérience post-commercialisation a montré que les patients subissant un surdosage aigu de budésonide inhalé restaient généralement asymptomatiques. L'utilisation de doses excessives (jusqu'à 6400 mcg par jour) pendant des périodes prolongées a montré des effets corticostéroïdes systémiques tels que l'hypercorticisme.
CONTRE-INDICATIONS
PULMICORT TURBUHALER (budésonide) est contre-indiqué dans le traitement primaire de l'état de mal asthmatique ou d'autres épisodes aigus d'asthme nécessitant des mesures intensives.
L'hypersensibilité au budésonide contre-indique l'utilisation de PULMICORT TURBUHALER (budésonide) .
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
Le budésonide est un corticostéroïde anti-inflammatoire qui présente une puissante activité glucocorticoïde et une faible activité minéralocorticoïde. Dans les modèles in vitro et animaux standard, le budésonide a une affinité environ 200 fois plus élevée pour le récepteur des glucocorticoïdes et une puissance anti-inflammatoire topique 1000 fois plus élevée que le cortisol (dosage de l'œdème de l'oreille à l'huile de croton de rat). En tant que mesure de l'activité systémique, le budésonide est 40 fois plus puissant que le cortisol lorsqu'il est administré par voie sous-cutanée et 25 fois plus puissant lorsqu'il est administré par voie orale dans le test d'involution du thymus chez le rat.
L'activité de PULMICORT 100 mcg TURBUHALER est due au médicament parent, le budésonide. Dans les études d'affinité pour les récepteurs des glucocorticoïdes, la forme 22R était deux fois plus active que l'épimère 22S. Des études in vitro ont indiqué que les deux formes de budésonide ne s'interconvertissent pas.
Le mécanisme précis des actions des corticostéroïdes sur l'inflammation dans l'asthme n'est pas connu. L'inflammation est un élément important dans la pathogenèse de l'asthme. Il a été démontré que les corticostéroïdes ont un large éventail d'activités inhibitrices contre plusieurs types de cellules (p. ex. mastocytes, éosinophiles, neutrophiles, macrophages et lymphocytes) et médiateurs (p. ex. histamine, eicosanoïdes, leucotriènes et cytokines) impliqués dans les réactions allergiques et non - inflammation à médiation allergique. Ces actions anti-inflammatoires des corticostéroïdes peuvent contribuer à leur efficacité dans l'asthme.
Des études chez des patients asthmatiques ont montré un rapport favorable entre l'activité anti-inflammatoire topique et les effets systémiques des corticostéroïdes sur une large gamme de doses de PULMICORT 200mcg TURBUHALER (budésonide) . Cela s'explique par une combinaison d'un effet anti-inflammatoire local relativement élevé, d'une importante dégradation hépatique de premier passage du médicament absorbé par voie orale (85-95 %) et de la faible puissance des métabolites formés (voir ci-dessous).
Pharmacocinétique
Absorption:
Après administration orale de budésonide, la concentration plasmatique maximale a été atteinte en environ 1 à 2 heures et la disponibilité systémique absolue était de 6 à 13 %. En revanche, la majeure partie du budésonide délivré aux poumons est absorbée par voie systémique. Chez les sujets sains, 34 % de la dose mesurée se sont déposés dans les poumons (tel qu'évalué par la méthode de la concentration plasmatique) avec une disponibilité systémique absolue de 39 % de la dose mesurée. La pharmacocinétique du budésonide ne diffère pas significativement chez les volontaires sains et les patients asthmatiques. Les concentrations plasmatiques maximales de budésonide ont été atteintes dans les 30 minutes suivant l'inhalation de PULMICORT 200 mcg TURBUHALER.Chez les patients asthmatiques, le budésonide a montré une augmentation linéaire de l'ASC et de la Cmax avec l'augmentation de la dose après une dose unique et des doses répétées de PULMICORT 200 mcg TURBUHALER (budésonide) .
Distribution:
Le volume de distribution du budésonide était d'environ 3 L/kg. Il était lié à 85 à 90 % aux protéines plasmatiques. La liaison aux protéines était constante sur la plage de concentration (1-100 nmol/L) obtenue avec les doses recommandées de PULMICORT TURBUHALER et les dépassant. Le budésonide a montré peu ou pas de liaison à la globuline liant les corticostéroïdes. Le budésonide s'est rapidement équilibré avec les globules rouges d'une manière indépendante de la concentration avec un rapport sang/plasma d'environ 0,8.Métabolisme:
Des études in vitro avec des homogénats de foie humain ont montré que le budésonide est rapidement et largement métabolisé. Deux métabolites majeurs formés via la biotransformation catalysée par l'isoenzyme 3A4 (CYP3A4) du cytochrome P450 (CYP) ont été isolés et identifiés comme étant la 16α-hydroxyprednisolone et le 6β-hydroxybudésonide. L'activité corticostéroïde de chacun de ces deux métabolites est inférieure à 1 % de celle de la molécule mère. Aucune différence qualitative entre les schémas métaboliques in vitro et in vivo n'a été détectée. Une inactivation métabolique négligeable a été observée dans les préparations de poumon et de sérum humains.Excrétion/Élimination :
La forme 22R du budésonide était préférentiellement éliminée par le foie avec une clairance systémique de 1,4 L/min contre 1,0 L/min pour la forme 22S. La demi-vie terminale, de 2 à 3 heures, était la même pour les deux épimères et était indépendante de la dose. Le budésonide a été excrété dans l'urine et les fèces sous forme de métabolites. Environ 60 % d'une dose intraveineuse radiomarquée a été récupérée dans l'urine. Aucun budésonide inchangé n'a été détecté dans les urines.Publics particuliers :
Aucune différence pharmacocinétique n'a été identifiée en raison de la race, du sexe ou de l'âge avancé.Pédiatrique:
Après administration intraveineuse chez des patients pédiatriques âgés de 10 à 14 ans, la demi-vie plasmatique était plus courte que chez les adultes (1,5 heure contre 2,0 heures chez l'adulte). Dans la même population après inhalation de budésonide via un aérosol-doseur sous pression, la disponibilité systémique absolue était similaire à celle observée chez les adultes.Insuffisance hépatique :
Une fonction hépatique réduite peut affecter l'élimination des corticostéroïdes. La pharmacocinétique du budésonide a été affectée par une altération de la fonction hépatique, comme en témoigne une disponibilité systémique doublée après ingestion orale. La pharmacocinétique intraveineuse du budésonide était cependant similaire chez les patients cirrhotiques et chez les sujets sains.Interactions médicament-médicament :
Le kétoconazole, un puissant inhibiteur de l'isoenzyme 3A4 (CYP3A4) du cytochrome P450 (CYP), la principale enzyme métabolique des corticostéroïdes, a augmenté les taux plasmatiques de budésonide ingéré par voie orale. Aux doses recommandées, la cimétidine a eu un effet léger mais cliniquement non significatif sur la pharmacocinétique du budésonide oral.Pharmacodynamie
Pour confirmer que l'absorption systémique n'est pas un facteur significatif dans l'efficacité clinique du budésonide inhalé, une étude clinique chez des patients asthmatiques a été réalisée comparant 400 mcg de budésonide administré via un aérosol-doseur pressurisé avec un tube d'espacement à 1400 mcg de budésonide oral et placebo. L'étude a démontré l'efficacité du budésonide inhalé mais pas du budésonide ingéré par voie orale malgré des niveaux systémiques comparables. Ainsi, l'effet thérapeutique des doses conventionnelles de budésonide inhalé par voie orale s'explique en grande partie par son action directe sur les voies respiratoires.
Généralement, PULMICORT TURBUHALER (budésonide) a un début d'action relativement rapide pour un corticostéroïde inhalé. L'amélioration du contrôle de l'asthme après l'inhalation de PULMICORT TURBUHALER (budésonide) peut survenir dans les 24 heures suivant le début du traitement, bien que le bénéfice maximum puisse ne pas être atteint avant 1 à 2 semaines ou plus.
Il a été démontré que PULMICORT TURBUHALER (budésonide) diminue la réactivité des voies respiratoires dans divers modèles de provocation, y compris l'histamine, la méthacholine, le métabisulfite de sodium et l'adénosine monophosphate chez les patients présentant des voies respiratoires hyperréactives. La pertinence clinique de ces modèles n'est pas certaine.
Un prétraitement avec PULMICORT 200 mcg TURBUHALER (budésonide) 1600 mcg par jour (800 mcg deux fois par jour) pendant 2 semaines a réduit la diminution aiguë (réaction de phase précoce) et retardée (réaction de phase tardive) du VEMS suite à une provocation par allergène inhalé.
Les effets de PULMICORT 200 mcg TURBUHALER (budésonide) sur l'axe hypothalamo-hypophyso-surrénalien (HHS) ont été étudiés chez 905 adultes et 404 patients pédiatriques souffrant d'asthme. Pour la plupart des patients, la capacité d'augmenter la production de cortisol en réponse au stress, telle qu'évaluée par le test de stimulation à la cosyntropine (ACTH), est restée intacte avec le traitement par PULMICORT TURBUHALER (budésonide) aux doses recommandées. Chez les patients adultes traités avec 100, 200, 400 ou 800 mcg deux fois par jour pendant 12 semaines, 4 %, 2 %, 6 % et 13 %, respectivement, ont présenté une réponse anormale du cortisol stimulé (pic de cortisol
L'administration de budésonide via PULMICORT 200 mcg TURBUHALER (budésonide) à des doses allant jusqu'à 800 mcg/jour (dose quotidienne moyenne de 445 mcg/jour) ou via un aérosol-doseur sous pression à des doses allant jusqu'à 1 200 mcg/jour (dose quotidienne moyenne de 620 mcg /jour) chez 216 patients pédiatriques (âgés de 3 à 11 ans) pendant 2 à 6 ans n'a eu aucun effet significatif sur la croissance staturale par rapport à un traitement non corticostéroïde chez 62 patients témoins appariés. Cependant, l'effet à long terme de PULMICORT TURBUHALER (budésonide) sur la croissance n'est pas entièrement connu.
Sentiers cliniques
L'efficacité thérapeutique de PULMICORT 100 mcg TURBUHALER (budésonide) a été évaluée dans des essais cliniques contrôlés impliquant plus de 1 300 patients (6 ans et plus) souffrant d'asthme dont la durée de la maladie ( 20 ans) et sa gravité varient.
Des essais cliniques à double insu, parallèles et contrôlés par placebo d'une durée de 12 semaines et plus ont montré que, par rapport au placebo, PULMICORT TURBUHALER (budésonide) améliorait significativement la fonction pulmonaire (mesurée par le DEP et le VEMS), diminuait significativement les symptômes d'asthme du matin et du soir , et réduit significativement le besoin d'utiliser au besoin des β2-agonistes inhalés à des doses de 400 mcg à 1600 mcg par jour (200 mcg à 800 mcg deux fois par jour) chez les adultes et de 400 mcg à 800 mcg par jour (200 mcg à 400 mcg deux fois par jour) chez les patients pédiatriques de 6 ans et plus.
Une amélioration de la fonction pulmonaire (DEP du matin) a été observée dans les 24 heures suivant le début du traitement chez les patients adultes et pédiatriques âgés de 6 ans et plus, bien que le bénéfice maximum n'ait pas été atteint pendant 1 à 2 semaines ou plus après le début du traitement. L'amélioration de la fonction pulmonaire a été maintenue tout au long des 12 semaines de la partie en double aveugle des essais.
Patients ne recevant pas de corticothérapie
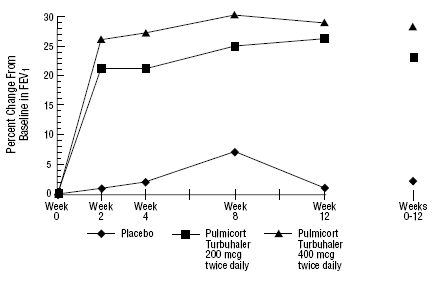
Dans un essai clinique de 12 semaines chez 273 patients souffrant d'asthme léger à modéré (VEMS moyen initial 2,27 L) qui n'étaient pas bien contrôlés par les bronchodilatateurs seuls, PULMICORT 200 mcg TURBUHALER (budésonide) a été évalué à des doses de 200 mcg deux fois par jour et de 400 mcg deux fois par jour. quotidiennement versus placebo. Les résultats FEV1 de cet essai sont présentés dans la figure ci-dessous. La fonction pulmonaire s'est améliorée de manière significative avec les deux doses de PULMICORT 100 mcg TURBUHALER (budésonide) par rapport au placebo.
Un essai de 12 semaines chez des patients ne prenant pas de corticothérapie avant l'entrée dans l'étude
Dans un essai contrôlé de 12 mois mené auprès de 75 patients n'ayant jamais reçu de corticostéroïdes, PULMICORT TURBUHALER (budésonide) à 200 mcg deux fois par jour a entraîné une amélioration de la fonction pulmonaire (mesurée par le DEP) et une réduction de l'hyperréactivité bronchique par rapport au placebo.
Patients précédemment maintenus sous corticostéroïdes inhalés
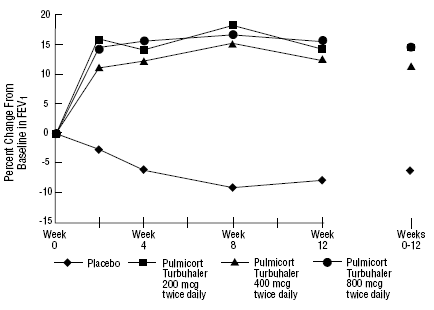
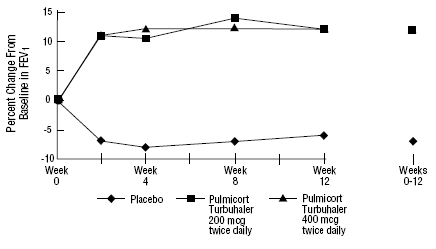
L'innocuité et l'efficacité de PULMICORT 200 mcg TURBUHALER (budésonide) ont également été évaluées chez des patients adultes et pédiatriques (âgés de 6 à 18 ans) précédemment maintenus sous corticostéroïdes inhalés (adultes : N = 473, VEMS moyen initial 2,04 L, doses initiales de dipropionate de béclométhasone 126 -1 008 mcg/jour ; pédiatrie : N = 404, VEMS initial moyen de 2,09 L, doses initiales de dipropionate de béclométhasone de 126 à 672 mcg/jour ou d'acétonide de triamcinolone de 300 à 1 800 mcg/jour). Les résultats du VEMS de ces deux essais, tous deux d'une durée de 12 semaines, sont présentés dans les figures suivantes. La fonction pulmonaire s'est améliorée de manière significative avec toutes les doses de PULMICORT TURBUHALER (budésonide) par rapport au placebo dans les deux essais.
Patients adultes précédemment maintenus sous corticostéroïdes inhalés
Patients pédiatriques âgés de 6 à 18 ans précédemment maintenus sous corticostéroïdes inhalés
Patients recevant PULMICORT TURBUHALER (budésonide) une fois par jour
L'efficacité et l'innocuité de l'administration uniquotidienne de PULMICORT 100 mcg TURBUHALER (budésonide) 200 mcg et 400 mcg et d'un placebo ont également été évaluées chez 309 patients adultes asthmatiques (VEMS moyen initial 2,7 L) dans une étude de 18 semaines. Par rapport au placebo, les patients recevant Pulmicort 200 ou 400 mcg une fois par jour ont montré une stabilité de l'asthme significativement meilleure, évaluée par le DEP et le VEMS sur une période de traitement initiale de 6 semaines, qui a été maintenue avec une dose quotidienne de 200 mcg au cours des 12 semaines suivantes. Bien que la population de l'étude comprenne à la fois des patients précédemment traités par des corticostéroïdes inhalés, ainsi que des patients n'ayant pas reçu de corticothérapie antérieure, les résultats ont montré que l'administration une fois par jour était plus clairement efficace chez les patients précédemment maintenus sous corticostéroïdes inhalés par voie orale (voir DOSAGE ET ADMINISTRATION ).
Patients précédemment maintenus sous corticostéroïdes oraux
Dans un essai clinique mené auprès de 159 patients asthmatiques sévères nécessitant un traitement oral chronique à la prednisone (dose initiale moyenne de prednisone de 19,3 mg/jour), PULMICORT TURBUHALER (budésonide) à des doses de 400 mcg deux fois par jour et de 800 mcg deux fois par jour a été comparé à un placebo sur une période de 20 semaines période. Environ les deux tiers (68 % sous 400 mcg deux fois par jour et 64 % sous 800 mcg deux fois par jour) des patients traités par PULMICORT TURBUHALER (budésonide) ont pu obtenir un arrêt soutenu (au moins 2 semaines) des corticostéroïdes oraux (comparativement à 8 % des patients traités par placebo) et un meilleur contrôle de l'asthme. La dose moyenne de corticostéroïdes oraux a été réduite de 83 % avec 400 mcg deux fois par jour et de 79 % avec 800 mcg deux fois par jour pour les patients traités par PULMICORT TURBUHALER (budésonide) contre 27 % pour le placebo. De plus, 58 des 64 patients (91 %) qui ont complètement éliminé les corticostéroïdes oraux pendant la phase à double insu de l'essai sont restés sans corticostéroïdes oraux pendant 12 mois supplémentaires tout en recevant PULMICORT 200 mcg TURBUHALER (budésonide) .
INFORMATIONS PATIENTS
Instructions d'utilisation pour le patient
Veuillez lire attentivement cette notice avant de commencer à prendre votre médicament. Il fournit un résumé des informations sur votre médicament. Le respect de ces instructions permet de s'assurer que vous inhalez correctement le médicament.
POUR PLUS D'INFORMATIONS, DEMANDEZ A VOTRE MEDECIN OU A VOTRE PHARMACIEN.
CE QUE VOUS DEVEZ SAVOIR SUR PULMICORT TURBUHALER (budésonide)
Votre médecin vous a prescrit PULMICORT TURBUHALER 200 mcg. Il contient un médicament appelé budésonide, qui est un corticostéroïde synthétique. Les corticostéroïdes sont des substances naturelles présentes dans le corps qui aident à combattre l'inflammation. Ils sont utilisés pour traiter l'asthme car ils réduisent le gonflement et l'irritation des parois des petits passages d'air dans les poumons et soulagent les problèmes respiratoires. Lorsqu'ils sont inhalés régulièrement, les corticostéroïdes aident également à prévenir les crises d'asthme.
PULMICORT TURBUHALER (budésonide) traite l'inflammation, la « partie calme » de l'asthme que vous ne pouvez ni entendre, ni voir, ni ressentir. Lorsque l'inflammation n'est pas traitée, vos symptômes d'asthme et vos crises peuvent augmenter. PULMICORT 200mcg TURBUHALER (budésonide) agit pour prévenir et réduire vos symptômes et crises d'asthme.
POINTS IMPORTANTS À RETENIR SUR PULMICORT TURBUHALER (budésonide)
ASSUREZ-VOUS que ce médicament vous convient (voir « AVANT D'UTILISER VOTRE PULMICORT TURBUHALER (budésonide) »).
Il est important que vous inhaliez chaque dose comme votre médecin vous l'a conseillé.
Utilisez votre Turbuhaler selon les directives de votre médecin. N'ARRÊTEZ PAS LE TRAITEMENT OU NE RÉDUISEZ PAS VOTRE DOSE MÊME SI VOUS VOUS SENTEZ MIEUX, sauf indication contraire de votre médecin.
NE PAS inhalez plus de doses ou utilisez votre Turbuhaler plus souvent que prescrit par votre médecin.
Ce médicament est NE PAS destiné à soulager rapidement vos difficultés respiratoires lors d'une crise d'asthme. Il doit être pris à intervalles réguliers selon les recommandations de votre médecin, et non comme mesure d'urgence.
Votre médecin peut vous prescrire des médicaments supplémentaires (tels que des bronchodilatateurs) pour les secours d'urgence en cas de crise aiguë.
Si vous utilisez également un autre médicament par inhalation, vous devriez consulter votre médecin pour savoir quand l'utiliser par rapport à l'utilisation de votre PULMICORT 100mcg TURBUHALER (budésonide) .
AVANT D'UTILISER VOTRE PULMICORT TURBUHALER (budésonide)
INFORMEZ VOTRE MEDECIN AVANT DE COMMENCER A PRENDRE CE MEDICAMENT SI VOUS :
- êtes enceinte (ou avez l'intention de le devenir),
- allaitez un bébé,
- êtes allergique au budésonide ou à tout autre corticostéroïde inhalé par voie orale,
- avez des infections,
- avez ou avez eu la tuberculose,
- souffrez d'ostéoporose,
- avez récemment côtoyé une personne atteinte de varicelle ou de rougeole,
- envisagent de subir une intervention chirurgicale,
- avez pris un médicament corticostéroïde oral comme la prednisone. Vous devrez peut-être suivre des instructions spécifiques pour éviter les risques pour la santé associés à l'arrêt de l'utilisation de ces types de médicaments.
Dans certaines circonstances, ce médicament peut ne pas convenir et votre médecin peut souhaiter vous prescrire un autre médicament. Assurez-vous que votre médecin sait quels autres médicaments vous prenez, y compris les médicaments sur ordonnance et en vente libre, ainsi que les vitamines ou les compléments alimentaires et à base de plantes.
QUELS SONT LES EFFETS SECONDAIRES POSSIBLES DE PULMICORT TURBUHALER (budésonide) ?
Comme avec tous les corticostéroïdes inhalés, vous devez être conscient des effets secondaires suivants :
- Augmentation de la respiration sifflante juste après la prise de PULMICORT 100 mcg TURBUHALER (budésonide) . Ayez toujours avec vous un médicament bronchodilatateur à action brève pour traiter la respiration sifflante soudaine. Les médicaments bronchodilatateurs à courte durée d'action aident à détendre les muscles autour des voies respiratoires dans vos poumons. La respiration sifflante se produit lorsque les muscles autour des voies respiratoires se resserrent. Cela rend la respiration difficile. Dans les cas graves, une respiration sifflante peut arrêter votre respiration et entraîner la mort si elle n'est pas traitée immédiatement.
- Effets sur le système immunitaire et risque accru d'infections.
- Problèmes oculaires, y compris le glaucome et la cataracte. Des examens de la vue doivent être envisagés lors de l'utilisation de PULMICORT TURBUHALER (budésonide) .
- La croissance d'un enfant doit être contrôlée régulièrement pendant le traitement par PULMICOR TURBUHALER en raison du risque de ralentissement de la croissance.
Selon les essais cliniques, les effets secondaires les plus fréquemment signalés par les patients utilisant PULMICORT 100 mcg TURBUHALER (budésonide) sont :
- infection respiratoire
- mal de tête
- symptômes de la grippe
- mal de gorge
- sinusite
Ce ne sont pas tous les effets secondaires possibles de PULMICORT TURBUHALER (budésonide) . Pour plus d'informations, demandez à votre médecin, professionnel de la santé ou pharmacien.
UTILISATION DE VOTRE PULMICORT TURBUHALER (budésonide)
- Suivez les instructions indiquées dans la section "COMMENT UTILISER VOTRE PULMICORT 200mcg TURBUHALER". Si vous avez des problèmes, informez-en votre médecin ou votre pharmacien.
- Il est important que vous inhaliez chaque dose selon les directives de votre médecin. L'étiquette de la pharmacie vous indiquera généralement quelle dose prendre et à quelle fréquence. Si ce n'est pas le cas, ou si vous n'êtes pas sûr, demandez à votre médecin ou à votre pharmacien.
DOSAGE
- Utilisez selon les directives de votre médecin.
- Il est TRÈS IMPORTANT que vous suiviez les instructions de votre médecin quant au nombre d'inhalations à prendre et à la fréquence d'utilisation de votre PULMICORT TURBUHALER (budésonide) .
- NE PAS inhalez plus de doses ou utilisez votre PULMICORT TURBUHALER (budésonide) plus souvent que votre médecin ne vous l'a conseillé.
- Cela peut prendre 1 à 2 semaines ou plus avant que vous ne ressentiez une amélioration maximale, alors IL EST TRÈS IMPORTANT QUE VOUS UTILISIEZ RÉGULIÈREMENT PULMICORT 100mcg TURBUHALER (budésonide). N'ARRÊTEZ PAS LE TRAITEMENT OU NE RÉDUISEZ PAS VOTRE DOSE MÊME SI VOUS VOUS SENTEZ MIEUX, sauf indication contraire de votre médecin.
- Si vous oubliez une dose, prenez simplement la prochaine dose prévue à l'heure prévue. NE DOUBLEZ PAS la dose.
COMMENT UTILISER VOTRE PULMICORT TURBUHALER (budésonide)
Lisez attentivement les instructions complètes et utilisez uniquement comme indiqué.
INSTRUCTIONS D'AMORÇAGE :
Avant d'utiliser un nouveau PULMICORT 200 mcg TURBUHALER (budésonide) pour la première fois, vous devez l'amorcer. Pour ce faire, tournez le couvercle et soulevez-le. Tenez PULMICORT TURBUHALER (budésonide) en position verticale (avec l'embout buccal vers le haut), puis tournez la poignée marron complètement vers la droite et de nouveau vers la gauche. Répéter. Vous êtes maintenant prêt à prendre votre première dose (voir les instructions pour « PRENDRE UNE DOSE »). Vous n'avez pas besoin de l'amorcer à un autre moment après cela, même si vous le mettez de côté pendant une période prolongée.
PRENDRE UNE DOSE :
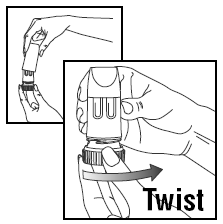
CHARGER UNE DOSE
- Tournez le couvercle et soulevez-le.
- Afin de fournir la bonne dose, PULMICORT TURBUHALER (budésonide) doit être tenu en position verticale (embout buccal vers le haut) chaque fois qu'une dose de médicament est chargée.
- Tournez la poignée marron complètement vers la droite aussi loin que possible. Tournez-le à nouveau complètement vers la gauche.
- Vous entendrez un clic.
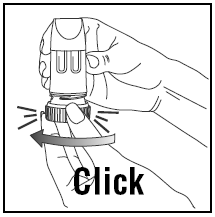
INHALER LA DOSE
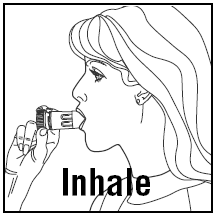
- Lorsque vous inhalez, PULMICORT 200 mcg TURBUHALER (budésonide) doit être tenu en position verticale (embout buccal vers le haut) ou horizontale.
- Détournez la tête de l'inhalateur et expirez. Ne secouez pas l'inhalateur après l'avoir chargé.
- Placez l'embout buccal entre vos lèvres et inspirez profondément et avec force. Vous ne pouvez pas goûter ou sentir le médicament.
- Ne pas mâcher ou mordre l'embout buccal.
- Retirez l'inhalateur de votre bouche et expirez. Ne soufflez pas et n'expirez pas dans l'embout buccal.
- Si plus d'une dose est nécessaire, répétez simplement les étapes ci-dessus.
- Lorsque vous avez terminé, remettez le couvercle sur l'inhalateur et fermez-le. Rincez-vous la bouche avec de l'eau. Ne pas avaler.
- Gardez votre PULMICORT TURBUHALER (budésonide) propre et sec en tout temps.
- N'utilisez pas PULMICORT TURBUHALER (budésonide) s'il a été endommagé ou si l'embout buccal s'est détaché.
COMMENT CONSERVER VOTRE PULMICORT TURBUHALER (budésonide)
- Après chaque utilisation, remettez le couvercle blanc en place et tournez-le fermement en place.
- Conservez PULMICORT TURBUHALER (budésonide) dans un endroit sec à température ambiante contrôlée, entre 68 et 77 °F (20 et 25 °C).
- Conservez votre PULMICORT TURBUHALER (budésonide) dans un endroit sûr hors de portée des jeunes enfants.
- NE PAS utiliser après la date indiquée sur le corps de votre Turbuhaler.
COMMENT SAVOIR QUAND VOTRE PULMICORT TURBUHALER (budésonide) EST VIDE
L'étiquette sur la boîte ou le couvercle vous indiquera le nombre de doses contenues dans votre PULMICORT TURBUHALER. Votre PULMICORT TURBUHALER (budésonide) a une fenêtre d'indication de dose pratique juste en dessous de l'embout buccal.
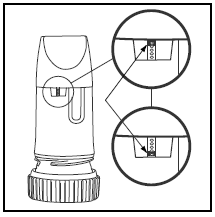
- Lorsqu'une marque rouge apparaît en haut de la fenêtre, il reste 20 doses de médicament. Il est maintenant temps de vous procurer votre prochain PULMICORT 100 mcg TURBUHALER (budésonide) .
- Lorsque la marque rouge atteint le bas de la fenêtre, votre inhalateur doit être jeté car il risque de ne plus délivrer la bonne quantité de médicament. (Vous pouvez toujours entendre un son si vous le secouez - ce son n'est pas le médicament. Ce son est produit par l'agent de séchage à l'intérieur du Turbuhaler.)
- N'oubliez pas que vous recevrez un nouvel inhalateur chaque fois que vous renouvelerez votre ordonnance.
- Ne le plongez pas dans l'eau pour savoir s'il est vide. Vérifiez simplement votre fenêtre d'indicateur de dose.
INFORMATIONS COMPLÉMENTAIRES SUR PULMICORT TURBUHALER (budésonide)
- PULMICORT 200mcg TURBUHALER (budésonide) délivre votre médicament sous forme de poudre très fine. Pour cette raison, vous ne pouvez pas goûter, sentir ou sentir tout médicament pénétrant dans vos poumons lors de l'inhalation de PULMICORT TURBUHALER (budésonide) Cela ne signifie pas que vous ne recevez pas votre médicament.
- PULMICORT 100mcg TURBUHALER (budésonide) ne doit pas être utilisé avec un espaceur.
- PULMICORT 100mcg TURBUHALER contient uniquement du budésonide et ne contient aucun ingrédient inactif.
- PULMICORT TURBUHALER (budésonide) est spécialement conçu pour délivrer une seule dose à la fois, peu importe la fréquence à laquelle vous appuyez sur la poignée brune. Si vous soufflez accidentellement dans votre inhalateur après avoir chargé une dose, suivez simplement les instructions pour charger une nouvelle dose.
Cette notice ne contient pas les informations complètes sur votre médicament. Si vous avez des questions ou n'êtes pas sûr de quelque chose, vous devriez demander à votre médecin ou à votre pharmacien.
Vous voudrez peut-être relire cette notice. Veuillez NE PAS LE JETER tant que vous n'avez pas fini de prendre votre médicament.
N'OUBLIEZ PAS : Ce médicament vous a été prescrit par votre médecin. NE PAS donner ce médicament à quelqu'un d'autre.
UTILISEZ CE PRODUIT COMME INDIQUÉ, SAUF INSTRUCTION CONTRAIRE DE VOTRE MÉDECIN.
Si vous avez d'autres questions sur l'utilisation de PULMICORT 100mcg TURBUHALER (budésonide), appelez le : 1-800-236-9933.
