Prilosec 40mg, 10mg, 20mg Omeprazole Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Prilosec 40 mg et comment est-il utilisé ?
Prilosec 40 mg est un médicament sur ordonnance et en vente libre utilisé pour traiter les symptômes du reflux gastro-œsophagien (RGO), des ulcères gastriques et d'autres affections causées par un excès d'acide gastrique. Prilosec 10 mg peut être utilisé seul ou avec d'autres médicaments.
Prilosec appartient à une classe de médicaments appelés inhibiteurs de la pompe à protons.
On ne sait pas si Prilosec 40 mg est sûr et efficace chez les enfants de moins de 1 mois.
Quels sont les effets secondaires possibles de Prilosec 10mg ?
Prilosec peut provoquer des effets secondaires graves, notamment :
- fortes douleurs à l'estomac,
- diarrhée aqueuse ou sanglante,
- douleur nouvelle ou inhabituelle au poignet, à la cuisse, à la hanche ou au dos,
- saisie (convulsions),
- peu ou pas de miction,
- du sang dans vos urines,
- gonflement,
- prise de poids rapide,
- vertiges,
- battements cardiaques irréguliers,
- se sentir nerveux,
- crampes musculaires,
- spasmes musculaires,
- toux,
- sensation d'étouffement,
- douleurs articulaires et
- éruption cutanée sur les joues ou les bras qui s'aggrave avec la lumière du soleil
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Prilosec incluent :
- Douleur d'estomac,
- gaz,
- nausée,
- vomissement,
- diarrhée, et
- mal de tête
LA DESCRIPTION
L'ingrédient actif des gélules à libération retardée PRILOSEC (oméprazole) est un benzimidazole substitué, le 5-méthoxy-2-[[(4-méthoxy-3, 5-diméthyl-2-pyridinyl) méthyl] sulfinyl]-1H-benzimidazole, un composé qui inhibe la sécrétion d'acide gastrique. Sa formule empirique est C17H19N3O3S, avec un poids moléculaire de 345,42. La formule structurale est :
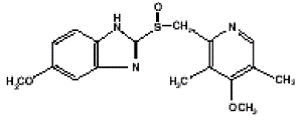
L'oméprazole est une poudre cristalline blanche à blanc cassé qui fond avec décomposition à environ 155°C. C'est une base faible, librement soluble dans l'éthanol et le méthanol, et légèrement soluble dans l'acétone et l'isopropanol et très légèrement soluble dans l'eau. La stabilité de l'oméprazole est fonction du pH ; il se dégrade rapidement en milieu acide, mais présente une stabilité acceptable en milieu alcalin.
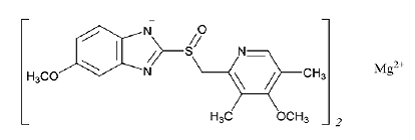
L'ingrédient actif de PRILOSEC (oméprazole magnésien) pour suspension orale à libération retardée est le 5-méthoxy-2-[[(4-méthoxy-3,5-diméthyl-2-pyridinyl)méthyl]sulfinyl]-1H-benzimidazole, magnésium sel (2:1)
L'oméprazole magnésien est une poudre blanche à blanc cassé avec un point de fusion avec dégradation à 200°C. Le sel est légèrement soluble (0,25 mg/mL) dans l'eau à 25°C, et il est soluble dans le méthanol. La demi-vie dépend fortement du pH.
La formule empirique de l'oméprazole magnésien est (C17H18N3O3S)2 Mg, le poids moléculaire est de 713,12 et la formule structurelle est :
PRILOSEC est fourni sous forme de gélules à libération retardée pour administration orale. Chaque gélule à libération retardée contient soit 10 mg, 20 mg ou 40 mg d'oméprazole sous forme de granulés à enrobage entérique avec les ingrédients inactifs suivants : cellulose, hydrogénophosphate disodique, hydroxypropylcellulose, hypromellose, lactose, mannitol, laurylsulfate de sodium et autres ingrédients. Les enveloppes des gélules contiennent les ingrédients inactifs suivants : gélatine-NF, FD&C bleu n°1, FD&C rouge n°40, D&C rouge n°28, dioxyde de titane, oxyde de fer noir synthétique, isopropanol, alcool butylique, FD&C bleu n°2, D&C rouge n°7 Calcium Lake et, en plus, les enveloppes des gélules de 10 mg et 40 mg contiennent également D&C Yellow #10.
Chaque sachet de PRILOSEC pour suspension orale à libération retardée contient 2,8 mg ou 11,2 mg d'oméprazole magnésien (équivalent à 2,5 mg ou 10 mg d'oméprazole), sous forme de granulés à enrobage entérique avec les ingrédients inactifs suivants : monostéarate de glycéryle, hydroxypropyl cellulose, hypromellose, stéarate de magnésium, copolymère d'acide méthacrylique C, polysorbate, sphères de sucre, talc et citrate de triéthyle, ainsi que des granulés inactifs. Les granulés inactifs sont composés des ingrédients suivants : acide citrique, crospovidone, dextrose, hydroxypropylcellulose, oxyde de fer et gomme de xanthane. Les granules d'oméprazole et les granules inactifs sont constitués d'eau pour former une suspension et sont administrés par voie orale, nasogastrique ou gastrique directe.
LES INDICATIONS
Traitement de l'ulcère duodénal actif
PRILOSEC 20 mg est indiqué dans le traitement de courte durée de l'ulcère duodénal actif chez l'adulte. La plupart des patients guérissent en quatre semaines. Certains patients peuvent nécessiter quatre semaines supplémentaires de traitement.
Éradication d'Helicobacter pylori pour réduire le risque de récidive de l'ulcère duodénal
Il a été démontré que l'éradication de H. pylori réduit le risque de récidive de l'ulcère duodénal.
Triple thérapie
PRILOSEC 40 mg en association avec la clarithromycine et l'amoxicilline, est indiqué pour le traitement des patients atteints d'infection à H. pylori et d'ulcère duodénal (actif ou ayant jusqu'à 1 an d'antécédents) pour éradiquer H. pylori chez l'adulte.
Bithérapie
PRILOSEC en association avec la clarithromycine est indiqué pour le traitement des patients atteints d'une infection à H. pylori et d'un ulcère duodénal pour éradiquer H. pylori chez l'adulte.
Parmi les patients en échec thérapeutique, PRILOSEC associé à la clarithromycine est plus susceptible d'être associé au développement d'une résistance à la clarithromycine par rapport à la trithérapie. Chez les patients qui échouent au traitement, des tests de sensibilité doivent être effectués. Si une résistance à la clarithromycine est démontrée ou si les tests de sensibilité ne sont pas possibles, un traitement antimicrobien alternatif doit être institué [voir PHARMACOLOGIE CLINIQUE et les renseignements thérapeutiques sur la clarithromycine, section Microbiologie].
Traitement de l'ulcère gastrique bénin actif
PRILOSEC est indiqué dans le traitement de courte durée (4 à 8 semaines) de l'ulcère gastrique bénin évolutif chez l'adulte.
Traitement du reflux gastro-oesophagien symptomatique (RGO)
PRILOSEC est indiqué pour le traitement des brûlures d'estomac et d'autres symptômes associés au RGO jusqu'à 4 semaines chez les patients âgés d'un an et plus.
Traitement de l'œsophagite érosive (EE) due au RGO à médiation acide
Patients pédiatriques âgés de 1 an à adultes
PRILOSEC 20 mg est indiqué pour le traitement à court terme (4 à 8 semaines) de l'EE due au RGO à médiation acide qui a été diagnostiqué par endoscopie chez les patients âgés de 1 an et plus.
L'efficacité de PRILOSEC 10 mg utilisé pendant plus de 8 semaines chez les patients atteints d'EE n'a pas été établie. Si un patient ne répond pas à 8 semaines de traitement, 4 semaines supplémentaires de traitement peuvent être administrées. S'il y a récurrence des symptômes de l'EE ou du RGO (p. ex. brûlures d'estomac), des cures supplémentaires de 4 à 8 semaines de PRILOSEC peuvent être envisagées.
Patients pédiatriques âgés de 1 mois à moins de 1 an
PRILOSEC est indiqué pour le traitement à court terme (jusqu'à 6 semaines) de l'EE due au RGO à médiation acide chez les patients pédiatriques âgés de 1 mois à moins de 1 an.
Maintien de la guérison de l'EE due au RGO à médiation acide
PRILOSEC 40 mg est indiqué pour la guérison d'entretien de l'EE due au RGO à médiation acide chez les patients âgés d'un an et plus.
Les études contrôlées ne s'étendent pas au-delà de 12 mois.
Conditions hypersécrétoires pathologiques
PRILOSEC 40 mg est indiqué dans le traitement à long terme des états pathologiques d'hypersécrétion (par exemple, syndrome de Zollinger-Ellison, adénomes endocriniens multiples et mastocytose systémique) chez l'adulte.
DOSAGE ET ADMINISTRATION
Schéma posologique recommandé pour adultes par indication
Le tableau 1 présente la posologie recommandée de PRILOSEC 40 mg chez les patients adultes par indication.
Schéma posologique pédiatrique recommandé par indication
La table 2 montre le dosage recommandé de PRILOSEC dans les patients de pédiatrie par l'indication.
Consignes administratives
- PRILOSEC 40 mg est destiné à être préparé dans de l'eau et administré par voie orale ou via une sonde nasogastrique (NG) ou gastrique.
- Prenez PRILOSEC 40mg avant les repas.
- Les antiacides peuvent être utilisés en concomitance avec PRILOSEC.
- Doses oubliées : si une dose est oubliée, administrez-la dès que possible. Cependant, si la prochaine dose prévue est due, ne prenez pas la dose oubliée et prenez la dose suivante à temps. Ne prenez pas deux doses à la fois pour compenser une dose oubliée.
Administration orale dans l'eau
Administration avec de l'eau via une sonde NG ou gastrique (taille 6 ou plus)
COMMENT FOURNIE
Formes posologiques et points forts
PRILOSEC pour suspension orale à libération retardée : 2,5 mg et 10 mg d'oméprazole en sachets à dose unitaire contenant une fine poudre jaune, constituée de granules de magnésium d'oméprazole blanc à brunâtre et de granules inactifs jaune pâle.
Stockage et manutention
PRILOSEC (oméprazole magnésien) pour suspension buvable à libération retardée, 2,5 mg ou 10 mg d'oméprazole, est fourni sous forme de dose unitaire contenant une fine poudre jaune, composée de granules d'oméprazole magnésium blanc à brunâtre et de granules inactifs jaune pâle. Les sachets à dose unitaire PRILOSEC sont fournis comme suit :
CDN 70515-625–01 conditionnements unitaires de 30 : 2,5 mg sachets CDN 70515-610–01 doses unitaires de 30 : sachets de 10 mg
Stockage
Conservez PRILOSEC pour suspension orale à libération retardée à 25°C (77°F); excursions autorisées jusqu'à 15 - 30°C (59 - 86°F). [Voir Température ambiante contrôlée USP .]
Fabriqué pour : Covis Pharma, Zoug, 6300 Suisse. Révisé : mars 2022
EFFETS SECONDAIRES
Les effets indésirables graves suivants sont décrits ci-dessous et ailleurs dans l'étiquetage :
- Néphrite tubulo-interstitielle aiguë [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Diarrhée associée à Clostridium difficile [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Fracture osseuse [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Effets indésirables cutanés graves [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Lupus érythémateux cutané et disséminé [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Carence en cyanocobalamine (vitamine B-12) [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Hypomagnésémie et métabolisme minéral [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Polypes de la glande fundique [voir AVERTISSEMENTS ET PRECAUTIONS ]
Expérience des essais cliniques avec PRILOSEC
Monothérapie
Étant donné que les essais cliniques sont menés dans des conditions très variables, les taux d'effets indésirables observés dans les essais cliniques d'un médicament ne peuvent pas être directement comparés aux taux des essais cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique.
Les données de sécurité décrites ci-dessous reflètent l'exposition aux gélules à libération retardée d'oméprazole magnésien chez 3096 patients issus d'essais cliniques mondiaux (465 patients issus d'études américaines et 2631 patients issus d'études internationales). Les indications cliniquement étudiées dans les essais américains comprenaient l'ulcère duodénal, l'ulcère résistant et le syndrome de Zollinger-Ellison. Les essais cliniques internationaux étaient en double aveugle et de conception ouverte. Les effets indésirables les plus fréquemment rapportés (c'est-à-dire avec un taux d'incidence ≥ 2 %) chez les patients traités par PRILOSEC inclus dans ces études comprenaient des maux de tête (7 %), des douleurs abdominales (5 %), des nausées (4 %), des diarrhées (4 % ), vomissements (3 %) et flatulences (3 %).
Les autres effets indésirables signalés avec une incidence ≥ 1 % comprenaient la régurgitation acide (2 %), l'infection des voies respiratoires supérieures (2 %), la constipation (2 %), les étourdissements (2 %), les éruptions cutanées (2 %), l'asthénie (1 % ), maux de dos (1 %) et toux (1 %).
Le profil d'innocuité des essais cliniques chez les patients de plus de 65 ans était similaire à celui des patients de 65 ans ou moins.
Le profil d'innocuité des essais cliniques chez les patients pédiatriques ayant reçu des gélules à libération retardée d'oméprazole magnésien était similaire à celui des patients adultes. Unique à la population pédiatrique, cependant, les effets indésirables du système respiratoire ont été fréquemment signalés dans le groupe d'âge de 1 mois à Utilisation dans des populations spécifiques ].
Expérience des essais cliniques avec PRILOSEC 20mg en thérapie combinée pour l'éradication de H. pylori
Dans les essais cliniques utilisant soit une bithérapie avec des gélules à libération retardée d'oméprazole magnésien et de la clarithromycine, soit une trithérapie avec des gélules à libération retardée d'oméprazole magnésien, de la clarithromycine et de l'amoxicilline, aucun effet indésirable propre à ces associations médicamenteuses n'a été observé. Les effets indésirables observés se limitaient à ceux précédemment rapportés avec l'oméprazole, la clarithromycine ou l'amoxicilline seuls.
Bithérapie (gélules à libération retardée d'oméprazole magnésien/clarithromycine)
Les effets indésirables observés dans les essais cliniques contrôlés utilisant un traitement combiné avec des gélules à libération retardée d'oméprazole magnésien et de la clarithromycine (n = 346) qui différaient de ceux précédemment décrits pour les gélules à libération retardée d'oméprazole magnésien seul étaient une altération du goût (15 %), une décoloration de la langue (2 %), rhinite (2%), pharyngite (1%) et syndrome grippal (1%). (Pour plus d'informations sur la clarithromycine, reportez-vous aux informations de prescription de la clarithromycine, section Effets indésirables.)
Triple thérapie (gélules à libération retardée d'oméprazole magnésien/clarithromycine/amoxicilline)
Les effets indésirables les plus fréquents observés dans les essais cliniques utilisant un traitement combiné avec des gélules à libération retardée d'oméprazole magnésien, de la clarithromycine et de l'amoxicilline (n = 274) étaient la diarrhée (14 %), l'altération du goût (10 %) et les maux de tête (7 %). Aucun de ceux-ci ne s'est produit à une fréquence plus élevée que celle rapportée par les patients prenant des agents antimicrobiens seuls. (Pour plus d'informations sur la clarithromycine ou l'amoxicilline, reportez-vous aux informations de prescription respectives, sections Effets indésirables.)
Expérience post-commercialisation
Les effets indésirables suivants ont été identifiés lors de l'utilisation post-approbation de l'oméprazole. Étant donné que ces réactions sont signalées volontairement par une population de taille incertaine, il n'est pas toujours possible d'estimer de manière fiable leur fréquence réelle ou d'établir une relation causale avec l'exposition au médicament.
Corps dans son ensemble : Réactions d'hypersensibilité incluant anaphylaxie, choc anaphylactique, œdème de Quincke, bronchospasme, néphrite interstitielle, urticaire (voir également Peau ci-dessous) ; fièvre; la douleur; fatigue; malaise; le lupus érythémateux disséminé
Cardiovasculaire: Douleur thoracique ou angine de poitrine, tachycardie, bradycardie, palpitations, tension artérielle élevée, œdème périphérique
Endocrine: Gynécomastie
Gastro-intestinal : Pancréatite (certaines mortelles), anorexie, côlon irritable, décoloration fécale, candidose œsophagienne, atrophie muqueuse de la langue, stomatite, gonflement abdominal, bouche sèche, colite microscopique, polypes des glandes fundiques.
Des carcinoïdes gastroduodénaux ont été rapportés chez des patients atteints du syndrome ZE sous traitement à long terme par l'oméprazole. On pense que cette découverte est une manifestation de la condition sous-jacente, qui est connue pour être associée à de telles tumeurs.
Hépatique: Maladie hépatique, y compris insuffisance hépatique (certaines mortelles), nécrose hépatique (certaines mortelles), encéphalopathie hépatique, maladie hépatocellulaire, maladie cholestatique, hépatite mixte, ictère et élévation des tests de la fonction hépatique [ALT, AST, GGT, phosphatase alcaline et bilirubine]
Infections et infestations : Diarrhée associée à Clostridium difficile
Troubles métaboliques et nutritionnels : Hypomagnésémie, hypocalcémie, hypokaliémie [Mises en garde et précautions 5.9], hyponatrémie, hypoglycémie, prise de poids
Musculo-squelettique : Faiblesse musculaire, myalgie, crampes musculaires, douleurs articulaires, douleurs aux jambes, fracture osseuse
Système nerveux/psychiatrique : Troubles psychiatriques et troubles du sommeil, y compris dépression, agitation, agressivité, hallucinations, confusion, insomnie, nervosité, apathie, somnolence, anxiété et troubles des rêves ; tremblements, paresthésie; vertige
Respiratoire: Épistaxis, douleurs pharyngées
Peau: Réactions cutanées généralisées sévères, y compris SJS/TEN toxique (certaines mortelles), DRESS, AGEP, lupus érythémateux cutané et érythème polymorphe ; photosensibilité; urticaire; éruption; inflammation cutanée; prurit; pétéchies; purpura; alopécie; peau sèche; hyperhidrose
Sens spéciaux : Acouphènes, altération du goût
Oculaire: Atrophie optique, neuropathie optique ischémique antérieure, névrite optique, syndrome de l'œil sec, irritation oculaire, vision floue, vision double
Urogénital: Néphrite interstitielle, hématurie, protéinurie, créatinine sérique élevée, pyurie microscopique, infection des voies urinaires, glycosurie, pollakiurie, douleur testiculaire
Hématologique : Agranulocytose (certaines mortelles), anémie hémolytique, pancytopénie, neutropénie, anémie, thrombocytopénie, leucopénie, leucocytose
INTERACTIONS MÉDICAMENTEUSES
Les tableaux 3 et 4 incluent des médicaments avec des interactions médicamenteuses cliniquement importantes et des interactions avec des diagnostics lorsqu'ils sont administrés en concomitance avec l'oméprazole et des instructions pour les prévenir ou les gérer.
Consultez l'étiquetage des médicaments utilisés en concomitance pour obtenir de plus amples informations sur les interactions avec les IPP.
AVERTISSEMENTS
Inclus dans le cadre du PRÉCAUTIONS section.
PRÉCAUTIONS
Présence de malignité gastrique
Dans les adultes, la réponse symptomatique à la thérapie avec PRILOSEC n'exclut pas la présence de malignité gastrique. Envisager un suivi et des tests diagnostiques supplémentaires chez les patients adultes qui ont une réponse sous-optimale ou une rechute symptomatique précoce après avoir terminé le traitement avec un IPP. Chez les patients plus âgés, envisagez également une endoscopie.
Néphrite tubulo-interstitielle aiguë
Une néphrite tubulo-interstitielle (TIN) aiguë a été observée chez des patients prenant des IPP et peut survenir à tout moment au cours du traitement par IPP. Les patients peuvent présenter divers signes et symptômes allant de réactions d'hypersensibilité symptomatiques à des symptômes non spécifiques de diminution de la fonction rénale (p. ex., malaise, nausées, anorexie). Dans les séries de cas rapportés, certains patients ont été diagnostiqués sur biopsie et en l'absence de manifestations extra-rénales (p. ex., fièvre, éruption cutanée ou arthralgie). Arrêtez PRILOSEC 40 mg et évaluez les patients chez qui on soupçonne une TIN aiguë [voir CONTRE-INDICATIONS ].
Diarrhée associée à Clostridium difficile
Des études observationnelles publiées suggèrent que le traitement par IPP comme PRILOSEC peut être associé à un risque accru de diarrhée associée à Clostridium difficile, en particulier chez les patients hospitalisés. Ce diagnostic doit être évoqué en cas de diarrhée qui ne s'améliore pas [voir EFFETS INDÉSIRABLES ].
Les patients doivent utiliser la dose la plus faible et la durée la plus courte de traitement par IPP appropriées à l'affection traitée.
Une diarrhée associée à Clostridium difficile (DACD) a été signalée avec l'utilisation de presque tous les agents antibactériens. Pour plus d'informations spécifiques aux agents antibactériens (clarithromycine et amoxicilline) indiqués pour une utilisation en association avec PRILOSEC, reportez-vous aux sections Mises en garde et Précautions des informations de prescription correspondantes.
Fracture de l'os
Plusieurs études observationnelles publiées suggèrent que le traitement par inhibiteur de la pompe à protons (IPP) peut être associé à un risque accru de fractures de la hanche, du poignet ou de la colonne vertébrale liées à l'ostéoporose. Le risque de fracture était accru chez les patients ayant reçu une dose élevée, définie comme de multiples doses quotidiennes, et un traitement par IPP à long terme (un an ou plus). Les patients doivent utiliser la dose la plus faible et la durée la plus courte de traitement par IPP appropriées à l'affection traitée. Les patients à risque de fractures liées à l'ostéoporose doivent être pris en charge conformément aux directives de traitement établies [voir DOSAGE ET ADMINISTRATION , EFFETS INDÉSIRABLES ].
Effets indésirables cutanés graves
Des effets indésirables cutanés graves, y compris le syndrome de Stevens-Johnson (SJS) et la nécrolyse épidermique toxique (NET), la réaction médicamenteuse avec éosinophilie et symptômes systémiques (DRESS) et la pustulose exanthématique aiguë généralisée (PEAG) ont été signalés en association avec l'utilisation d'IPP [voir EFFETS INDÉSIRABLES ]. Arrêtez PRILOSEC aux premiers signes ou symptômes de réactions indésirables cutanées sévères ou d'autres signes d'hypersensibilité et envisagez une évaluation plus approfondie.
Lupus érythémateux cutané et disséminé
Des cas de lupus érythémateux cutané (CLE) et de lupus érythémateux disséminé (LES) ont été signalés chez des patients prenant des IPP, y compris l'oméprazole. Ces événements se sont produits à la fois comme une nouvelle apparition et comme une exacerbation d'une maladie auto-immune existante. La majorité des cas de lupus érythémateux induits par les IPP étaient des CLE.
La forme la plus courante de CLE signalée chez les patients traités par des IPP était la CLE subaiguë (SCLE) et s'est produite dans les semaines ou les années suivant un traitement médicamenteux continu chez des patients allant des nourrissons aux personnes âgées. Généralement, les résultats histologiques ont été observés sans atteinte des organes.
Le lupus érythémateux disséminé (LES) est moins fréquemment rapporté que le CLE chez les patients recevant des IPP. Le LED associé aux IPP est généralement plus léger que le LED non médicamenteux. L'apparition du LES s'est généralement produite quelques jours à quelques années après le début du traitement, principalement chez des patients allant des jeunes adultes aux personnes âgées. La majorité des patients présentaient une éruption cutanée ; cependant, des arthralgies et des cytopénies ont également été signalées.
Évitez l'administration d'IPP plus longtemps que médicalement indiqué. Si des signes ou des symptômes compatibles avec le CLE ou le SLE sont notés chez les patients recevant PRILOSEC 10 mg, arrêtez le médicament et référez le patient au spécialiste approprié pour évaluation. La plupart des patients s'améliorent avec l'arrêt de l'IPP seul en 4 à 12 semaines. Les tests sérologiques (par exemple, ANA) peuvent être positifs et les résultats des tests sérologiques élevés peuvent prendre plus de temps à se résoudre que les manifestations cliniques.
Interaction avec le clopidogrel
Eviter l'utilisation concomitante de PRILOSEC 10mg avec le clopidogrel. Le clopidogrel est un promédicament. L'inhibition de l'agrégation plaquettaire par le clopidogrel est entièrement due à un métabolite actif. Le métabolisme du clopidogrel en son métabolite actif peut être altéré par l'utilisation concomitante de médicaments, tels que l'oméprazole, qui inhibent l'activité du CYP2C19. L'utilisation concomitante de clopidogrel avec 80 mg d'oméprazole réduit l'activité pharmacologique du clopidogrel, même lorsqu'il est administré à 12 heures d'intervalle.
Lors de l'utilisation de PRILOSEC, envisager un traitement antiplaquettaire alternatif [voir INTERACTIONS MÉDICAMENTEUSES et PHARMACOLOGIE CLINIQUE ].
Carence en cyanocobalamine (vitamine B-12)
Un traitement quotidien avec des médicaments antiacides sur une longue période (p. ex., plus de 3 ans) peut entraîner une malabsorption de la cyanocobalamine (vitamine B-12) causée par une hypo ou une achlorhydrie. De rares cas de carence en cyanocobalamine survenant avec un traitement anti-acide ont été rapportés dans la littérature. Ce diagnostic doit être envisagé si des symptômes cliniques compatibles avec un déficit en cyanocobalamine sont observés chez des patients traités par PRILOSEC.
Hypomagnésémie et métabolisme minéral
De rares cas d'hypomagnésémie, symptomatique et asymptomatique, ont été rapportés chez des patients traités par des IPP pendant au moins trois mois, dans la plupart des cas après un an de traitement. Les événements indésirables graves comprennent la tétanie, les arythmies et les convulsions. L'hypomagnésémie peut entraîner une hypocalcémie et/ou une hypokaliémie et peut exacerber l'hypocalcémie sous-jacente chez les patients à risque. Chez la plupart des patients, le traitement de l'hypomagnésémie a nécessité un remplacement du magnésium et l'arrêt de l'IPP.
Pour les patients qui devraient suivre un traitement prolongé ou qui prennent des IPP avec des médicaments tels que la digoxine ou des médicaments susceptibles de provoquer une hypomagnésémie (p. EFFETS INDÉSIRABLES ].
Envisagez de surveiller les niveaux de magnésium et de calcium avant l'initiation de PRILOSEC et périodiquement pendant le traitement chez les patients présentant un risque préexistant d'hypocalcémie (par exemple, hypoparathyroïdie). Compléter avec du magnésium et/ou du calcium, si nécessaire. Si l'hypocalcémie est réfractaire au traitement, envisager d'arrêter l'IPP.
Interaction avec le millepertuis ou la rifampicine
Les médicaments qui induisent le CYP2C19 ou le CYP3A4 (tels que le millepertuis ou la rifampicine) peuvent diminuer considérablement les concentrations d'oméprazole [voir INTERACTIONS MÉDICAMENTEUSES ]. Éviter l'utilisation concomitante de PRILOSEC avec le millepertuis ou la rifampicine.
Interactions avec les investigations diagnostiques pour les tumeurs neuroendocrines
Les taux sériques de chromogranine A (CgA) augmentent en raison de la diminution de l'acidité gastrique induite par les médicaments. L'augmentation du taux de CgA peut entraîner des résultats faussement positifs dans les investigations diagnostiques des tumeurs neuroendocrines. Les professionnels de la santé doivent temporairement arrêter le traitement par PRILOSEC 20 mg au moins 14 jours avant d'évaluer les taux de CgA et envisager de répéter le test si les taux initiaux de CgA sont élevés. Si des tests en série sont effectués (par exemple, pour la surveillance), le même laboratoire commercial doit être utilisé pour les tests, car les plages de référence entre les tests peuvent varier [voir INTERACTIONS MÉDICAMENTEUSES ].
Interaction avec le méthotrexate
La littérature suggère que l'utilisation concomitante d'IPP avec le méthotrexate (principalement à forte dose) peut élever et prolonger les taux sériques de méthotrexate et/ou de son métabolite, pouvant entraîner des toxicités du méthotrexate. En cas d'administration de méthotrexate à forte dose, un arrêt temporaire de l'IPP peut être envisagé chez certains patients [voir INTERACTIONS MÉDICAMENTEUSES ].
Polypes de la glande fundique
L'utilisation d'IPP est associée à un risque accru de polypes des glandes fundiques qui augmente avec une utilisation à long terme, en particulier au-delà d'un an. La plupart des utilisateurs d'IPP qui ont développé des polypes de la glande fundique étaient asymptomatiques et les polypes de la glande fundique ont été identifiés accidentellement à l'endoscopie. Utilisez la durée la plus courte de traitement par IPP appropriée à la condition traitée.
Informations sur les conseils aux patients
Conseillez au patient de lire l'étiquetage patient approuvé par la FDA ( Guide des médicaments et mode d'emploi ).
Néphrite tubulo-interstitielle aiguë
Conseillez au patient ou au soignant d'appeler immédiatement le fournisseur de soins de santé du patient s'il présente des signes et/ou des symptômes associés à une néphrite tubulo-interstitielle aiguë [voir AVERTISSEMENTS ET PRECAUTIONS ].
Diarrhée associée à Clostridium difficile
Conseillez au patient ou au soignant d'appeler immédiatement le fournisseur de soins de santé du patient s'il souffre d'une diarrhée qui ne s'améliore pas [voir AVERTISSEMENTS ET PRECAUTIONS ].
Fracture de l'os
Conseillez au patient ou au soignant de signaler toute fracture, en particulier de la hanche, du poignet ou de la colonne vertébrale, au fournisseur de soins de santé du patient [voir AVERTISSEMENTS ET PRECAUTIONS ].
Effets indésirables cutanés graves
Conseillez au patient ou au soignant d'arrêter PRILOSEC 40 mg et de le signaler à son professionnel de la santé dès la première apparition d'un effet indésirable cutané sévère ou de tout autre signe d'hypersensibilité [voir AVERTISSEMENTS ET PRECAUTIONS ].
Lupus érythémateux cutané et disséminé
Conseillez au patient ou au soignant d'appeler immédiatement le fournisseur de soins de santé du patient en cas d'apparition ou d'aggravation de symptômes associés au lupus érythémateux cutané ou disséminé [voir AVERTISSEMENTS ET PRECAUTIONS ]
Carence en cyanocobalamine (vitamine B-12)
Conseillez au patient ou au soignant de signaler tout symptôme clinique pouvant être associé à une carence en cyanocobalamine au professionnel de santé du patient s'il reçoit PRILOSEC depuis plus de 3 ans [voir AVERTISSEMENTS ET PRECAUTIONS ].
Hypomagnésémie et métabolisme minéral
Conseillez au patient ou au soignant de signaler tout symptôme clinique pouvant être associé à une hypomagnésémie, une hypocalcémie et/ou une hypokaliémie au professionnel de santé du patient s'il reçoit PRILOSEC depuis au moins 3 mois [voir AVERTISSEMENTS ET PRECAUTIONS ].
Interactions médicamenteuses
Conseillez aux patients de signaler à leur fournisseur de soins de santé s'ils commencent un traitement avec des produits contenant de la rilpivirine, du clopidogrel, du millepertuis ou de la rifampicine ; ou, s'ils prennent du méthotrexate à forte dose [voir CONTRE-INDICATIONS , AVERTISSEMENTS ET PRECAUTIONS ].
Administration
- PRILOSEC est destiné à être préparé dans de l'eau et administré par voie orale ou via une sonde nasogastrique (NG) ou gastrique, comme décrit dans le Guide des médicaments.
- Prenez PRILOSEC avant les repas.
- Les antiacides peuvent être utilisés en concomitance avec PRILOSEC.
- Doses oubliées : si une dose est oubliée, administrez-la dès que possible. Cependant, si la prochaine dose prévue est due, ne prenez pas la dose oubliée et prenez la dose suivante à temps. Ne prenez pas deux doses à la fois pour compenser une dose oubliée.
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Dans deux études de cancérogénicité de 24 mois chez le rat, l'oméprazole à des doses quotidiennes de 1,7, 3,4, 13,8, 44,0 et 140,8 mg/kg/jour (environ 0,4 à 34 fois une dose humaine de 40 mg/jour, telle qu'exprimée sur une surface corporelle surface) a produit des carcinoïdes à cellules ECL gastriques d'une manière liée à la dose chez les rats mâles et femelles ; l'incidence de cet effet était nettement plus élevée chez les rats femelles, qui présentaient des taux sanguins d'oméprazole plus élevés. Les carcinoïdes gastriques surviennent rarement chez le rat non traité. De plus, une hyperplasie des cellules ECL était présente dans tous les groupes traités des deux sexes. Dans l'une de ces études, des rats femelles ont été traités avec 13,8 mg d'oméprazole/kg/jour (environ 3,4 fois une dose humaine de 40 mg/jour, basée sur la surface corporelle) pendant un an, puis suivis pendant une année supplémentaire sans médicament. Aucun carcinoïde n'a été observé chez ces rats. Une incidence accrue d'hyperplasie des cellules ECL liée au traitement a été observée au bout d'un an (94 % des patients traités contre 10 % des témoins). À la deuxième année, la différence entre les rats traités et les rats témoins était beaucoup plus petite (46 % contre 26 %), mais présentait toujours plus d'hyperplasie dans le groupe traité. Un adénocarcinome gastrique a été observé chez un rat (2 %). Aucune tumeur similaire n'a été observée chez les rats mâles ou femelles traités pendant deux ans. Pour cette souche de rat, aucune tumeur similaire n'a été notée historiquement, mais une découverte impliquant une seule tumeur est difficile à interpréter. Dans une étude de toxicité de 52 semaines chez des rats Sprague-Dawley, des astrocytomes cérébraux ont été trouvés chez un petit nombre de mâles ayant reçu de l'oméprazole à des doses de 0,4, 2 et 16 mg/kg/jour (environ 0,1 à 3,9 fois la dose humaine de 40 mg/jour, en fonction de la surface corporelle). Aucun astrocytome n'a été observé chez les rats femelles dans cette étude. Dans une étude de cancérogénicité de 2 ans chez des rats Sprague-Dawley, aucun astrocytome n'a été trouvé chez les mâles ou les femelles à la dose élevée de 140,8 mg/kg/jour (environ 34 fois la dose humaine de 40 mg/jour sur la base de la surface corporelle) . Une étude de 78 semaines sur la cancérogénicité de l'oméprazole chez la souris n'a pas montré d'augmentation de la fréquence des tumeurs, mais l'étude n'a pas été concluante. Une étude de cancérogénicité de 26 semaines sur des souris transgéniques p53 (+/-) n'a pas été positive.
L'oméprazole s'est avéré positif pour les effets clastogènes dans un test in vitro d'aberration chromosomique sur des lymphocytes humains, dans l'un des deux tests in vivo sur le micronoyau chez la souris et dans un test in vivo d'aberration chromosomique sur des cellules de moelle osseuse. L'oméprazole s'est révélé négatif dans le test d'Ames in vitro, un test in vitro de mutation directe de cellules de lymphome de souris et un test in vivo de dommages à l'ADN du foie de rat.
L'oméprazole à des doses orales allant jusqu'à 138 mg/kg/jour chez le rat (environ 34 fois une dose humaine orale de 40 mg sur la base de la surface corporelle) s'est avéré n'avoir aucun effet sur la fertilité et les performances de reproduction.
Dans des études de cancérogénicité de 24 mois chez le rat, une augmentation significative liée à la dose des tumeurs carcinoïdes gastriques et de l'hyperplasie des cellules ECL a été observée chez les animaux mâles et femelles [voir AVERTISSEMENTS ET PRECAUTIONS ]. Des tumeurs carcinoïdes ont également été observées chez des rats soumis à une fundectomie ou à un traitement à long terme avec d'autres inhibiteurs de la pompe à protons ou des doses élevées d'antagonistes des récepteurs H2.
Utilisation dans des populations spécifiques
Grossesse
Résumé des risques
Il n'y a pas d'études adéquates et bien contrôlées avec l'oméprazole chez les femmes enceintes. Les données épidémiologiques disponibles ne parviennent pas à démontrer un risque accru de malformations congénitales majeures ou d'autres résultats indésirables de la grossesse avec l'utilisation d'oméprazole au premier trimestre. Des études de reproduction chez des rats et des lapins ont entraîné une létalité embryonnaire dose-dépendante à des doses d'oméprazole qui étaient environ 3,4 à 34 fois une dose humaine orale de 40 mg (sur la base d'une surface corporelle pour une personne de 60 kg).
Aucune tératogénicité n'a été observée dans les études de reproduction chez l'animal avec l'administration orale d'ésoméprazole (un énantiomère de l'oméprazole) de magnésium chez les rats et les lapins au cours de l'organogenèse avec des doses d'environ 68 fois et 42 fois, respectivement, une dose humaine orale de 40 mg d'ésoméprazole ou de 40 mg d'oméprazole ( en fonction de la surface corporelle pour une personne de 60 kg).
Des modifications de la morphologie osseuse ont été observées chez la progéniture de rats ayant reçu pendant la majeure partie de la grossesse et de l'allaitement des doses égales ou supérieures à environ 34 fois une dose humaine orale de 40 mg d'ésoméprazole ou de 40 mg d'oméprazole. Lorsque l'administration maternelle était confinée à la gestation uniquement, il n'y avait aucun effet sur la morphologie de la physe osseuse chez la progéniture à tout âge [voir Données ].
Les risques de fond estimés de malformations congénitales majeures et de fausses couches pour la population indiquée sont inconnus. Toutes les grossesses ont un risque de fond de malformation congénitale, de perte ou d'autres résultats indésirables. Dans la population générale des États-Unis, le risque de fond estimé de malformations congénitales majeures et de fausse couche dans les grossesses cliniquement reconnues est de 2 % à 4 % et de 15 % à 20 %, respectivement.
Données
Données humaines
Quatre études épidémiologiques publiées ont comparé la fréquence des anomalies congénitales chez les nourrissons nés de femmes ayant utilisé l'oméprazole pendant la grossesse avec la fréquence des anomalies chez les nourrissons de femmes exposées à des antagonistes des récepteurs H2 ou à d'autres témoins.
Une étude épidémiologique de cohorte rétrospective basée sur la population du registre médical suédois des naissances, couvrant environ 99 % des grossesses, de 1995 à 99, a fait état de 955 nourrissons (824 exposés au cours du premier trimestre, dont 39 exposés au-delà du premier trimestre et 131 exposés après le premier trimestre) dont les mères ont utilisé l'oméprazole pendant la grossesse. Le nombre de nourrissons exposés in utero à l'oméprazole qui présentaient une malformation, un faible poids à la naissance, un faible score d'Apgar ou une hospitalisation était similaire au nombre observé dans cette population. Le nombre de nourrissons nés avec des malformations septales ventriculaires et le nombre de nourrissons mort-nés étaient légèrement plus élevés chez les nourrissons exposés à l'oméprazole que le nombre attendu dans cette population.
Une étude de cohorte rétrospective basée sur la population couvrant toutes les naissances vivantes au Danemark de 1996 à 2009, a fait état de 1 800 naissances vivantes dont les mères ont utilisé de l'oméprazole au cours du premier trimestre de la grossesse et de 837 317 naissances vivantes dont les mères n'ont utilisé aucun inhibiteur de la pompe à protons. Le taux global de malformations congénitales chez les nourrissons nés de mères ayant été exposées à l'oméprazole au cours du premier trimestre était de 2,9 % et de 2,6 % chez les nourrissons nés de mères non exposées à un inhibiteur de la pompe à protons au cours du premier trimestre.
Une étude de cohorte rétrospective a rapporté 689 femmes enceintes exposées soit aux anti-H2 soit à l'oméprazole au cours du premier trimestre (134 exposées à l'oméprazole) et 1 572 femmes enceintes non exposées à l'un ou l'autre au cours du premier trimestre. Le taux global de malformation chez les descendants nés de mères ayant été exposées au premier trimestre à l'oméprazole, un anti-H2, ou n'ayant pas été exposées était de 3,6 %, 5,5 % et 4,1 %, respectivement.
Une petite étude de cohorte observationnelle prospective a suivi 113 femmes exposées à l'oméprazole pendant la grossesse (89 % avec des expositions au cours du premier trimestre). Le taux rapporté de malformations congénitales majeures était de 4 % dans le groupe oméprazole, de 2 % chez les témoins exposés à des agents non tératogènes et de 2,8 % chez les témoins appariés par maladie. Les taux d'avortements spontanés et électifs, d'accouchements prématurés, d'âge gestationnel à l'accouchement et de poids moyen à la naissance étaient similaires entre les groupes.
Plusieurs études n'ont rapporté aucun effet indésirable apparent à court terme sur le nourrisson lorsqu'une dose unique d'oméprazole par voie orale ou intraveineuse a été administrée à plus de 200 femmes enceintes comme prémédication pour une césarienne sous anesthésie générale.
Données animales
Oméprazole
Études de reproduction menées avec l'oméprazole chez le rat à des doses orales allant jusqu'à 138 mg/kg/jour (environ 34 fois une dose humaine orale de 40 mg sur la base de la surface corporelle) et chez le lapin à des doses allant jusqu'à 69,1 mg/kg/jour ( environ 34 fois une dose humaine orale de 40 mg sur la base de la surface corporelle) au cours de l'organogenèse n'a révélé aucune preuve d'un potentiel tératogène de l'oméprazole. Chez le lapin, l'oméprazole à une dose comprise entre 6,9 et 69,1 mg/kg/jour (environ 3,4 à 34 fois une dose humaine orale de 40 mg sur la base de la surface corporelle) administrée pendant l'organogenèse a produit des augmentations liées à la dose de la létalité embryonnaire, résorptions fœtales et interruptions de grossesse. Chez le rat, une toxicité embryo/fœtale liée à la dose et une toxicité sur le développement postnatal ont été observées chez la progéniture issue de parents traités par l'oméprazole à raison de 13,8 à 138,0 mg/kg/jour (environ 3,4 à 34 fois une dose humaine orale de 40 mg sur une surface corporelle). superficie), administré avant l'accouplement pendant toute la période de lactation.
Ésoméprazole
Les données décrites ci-dessous ont été générées à partir d'études utilisant l'ésoméprazole, un énantiomère de l'oméprazole. Les multiples de dose entre l'animal et l'homme sont basés sur l'hypothèse d'une exposition systémique égale à l'ésoméprazole chez l'homme après l'administration orale de 40 mg d'ésoméprazole ou de 40 mg d'oméprazole.
Aucun effet sur le développement embryo-fœtal n'a été observé dans les études de reproduction avec l'ésoméprazole magnésien chez le rat à des doses orales allant jusqu'à 280 mg/kg/jour (environ 68 fois une dose humaine orale de 40 mg sur la base de la surface corporelle) ou chez le lapin à doses orales allant jusqu'à 86 mg/kg/jour (environ 42 fois une dose humaine orale de 40 mg d'ésoméprazole ou de 40 mg d'oméprazole sur la base de la surface corporelle) administrées pendant l'organogenèse.
Une étude de toxicité sur le développement pré et postnatal chez le rat avec des critères d'évaluation supplémentaires pour évaluer le développement osseux a été réalisée avec l'ésoméprazole magnésien à des doses orales de 14 à 280 mg/kg/jour (environ 3,4 à 68 fois une dose humaine orale de 40 mg d'ésoméprazole ou 40 mg d'oméprazole sur la base de la surface corporelle). La survie néonatale/postnatale précoce (de la naissance au sevrage) a diminué à des doses égales ou supérieures à 138 mg/kg/jour (environ 34 fois une dose humaine orale de 40 mg d'ésoméprazole ou de 40 mg d'oméprazole sur la base de la surface corporelle). Le poids corporel et le gain de poids corporel ont été réduits et des retards neurocomportementaux ou de développement général dans la période suivant immédiatement le sevrage étaient évidents à des doses égales ou supérieures à 69 mg/kg/jour (environ 17 fois une dose humaine orale de 40 mg d'ésoméprazole ou de 40 mg d'oméprazole sur la base de la surface corporelle). De plus, une diminution de la longueur du fémur, de la largeur et de l'épaisseur de l'os cortical, une diminution de l'épaisseur de la plaque de croissance tibiale et une hypocellularité minime à légère de la moelle osseuse ont été observées à des doses égales ou supérieures à 14 mg/kg/jour (environ 3,4 fois une administration orale humaine dose de 40 mg d'ésoméprazole ou de 40 mg d'oméprazole sur la base de la surface corporelle). Une dysplasie physaire du fémur a été observée chez la progéniture de rats traités par des doses orales d'ésoméprazole magnésien à des doses égales ou supérieures à 138 mg/kg/jour (environ 34 fois une dose humaine orale de 40 mg d'ésoméprazole ou de 40 mg d'oméprazole sur un corps). sur la base de la surface).
Des effets sur les os maternels ont été observés chez des rates gravides et allaitantes dans l'étude de toxicité prénatale et postnatale lorsque l'ésoméprazole magnésien a été administré à des doses orales de 14 à 280 mg/kg/jour (environ 3,4 à 68 fois une dose humaine orale de 40 mg d'ésoméprazole ou 40 mg d'oméprazole sur la base de la surface corporelle). Lorsque les rats ont reçu une dose du 7e jour de gestation jusqu'au sevrage au 21e jour postnatal, une diminution statistiquement significative du poids du fémur maternel allant jusqu'à 14 % (par rapport au traitement par placebo) a été observée à des doses égales ou supérieures à 138 mg/kg/jour. (environ 34 fois une dose humaine orale de 40 mg d'ésoméprazole ou de 40 mg d'oméprazole sur la base de la surface corporelle).
Une étude sur le développement prénatal et postnatal chez des rats avec de l'ésoméprazole strontium (utilisant des doses équimolaires par rapport à l'étude sur l'ésoméprazole magnésien) a produit des résultats similaires chez les mères et les petits comme décrit ci-dessus.
Une étude de suivi de la toxicité pour le développement chez le rat avec d'autres points temporels pour évaluer le développement de l'os du chiot du jour 2 postnatal à l'âge adulte a été réalisée avec l'ésoméprazole magnésien à des doses orales de 280 mg/kg/jour (environ 68 fois une dose humaine orale de 40 mg sur sur la base de la surface corporelle) où l'administration d'ésoméprazole s'est déroulée du 7e jour de gestation ou du 16e jour de gestation jusqu'à la parturition. Lorsque l'administration maternelle était confinée à la gestation uniquement, il n'y avait aucun effet sur la morphologie de la physe osseuse chez la progéniture à tout âge.
Lactation
Résumé des risques
Des données limitées suggèrent que l'oméprazole peut être présent dans le lait maternel. Il n'y a pas de données cliniques sur les effets de l'oméprazole sur le nourrisson allaité ou sur la production de lait. Les avantages de l'allaitement pour le développement et la santé doivent être pris en compte, ainsi que le besoin clinique de la mère pour PRILOSEC 40 mg et tout effet indésirable potentiel sur le nourrisson allaité à partir de PRILOSEC 20 mg ou de l'affection maternelle sous-jacente.
Utilisation pédiatrique
L'innocuité et l'efficacité de PRILOSEC 40 mg ont été établies chez les patients pédiatriques âgés de 1 à 16 ans pour le traitement du RGO symptomatique, le traitement de l'EE due à un RGO d'origine acide et le maintien de la guérison de l'EE due à un RGO d'origine acide. L'utilisation de PRILOSEC 10 mg dans ce groupe d'âge est étayée par des études adéquates et bien contrôlées chez l'adulte et des études non contrôlées d'innocuité, d'efficacité et de pharmacocinétique réalisées chez des patients pédiatriques et adolescents [voir PHARMACOLOGIE CLINIQUE , Etudes cliniques ].
La sécurité et l'efficacité de PRILOSEC 10 mg ont été établies chez les patients pédiatriques âgés de 1 mois à moins de 1 an pour le traitement de l'EE due au RGO à médiation acide et sont étayées par des études adéquates et bien contrôlées chez l'adulte et la sécurité, la pharmacocinétique, et des études pharmacodynamiques réalisées chez des patients pédiatriques [voir PHARMACOLOGIE CLINIQUE ].
Dans la population pédiatrique, des effets indésirables de l'appareil respiratoire ont été fréquemment rapportés dans l'ensemble de la tranche d'âge (1 mois à 16 ans). Des otites moyennes ont été fréquemment signalées dans le groupe d'âge de 1 mois à EFFETS INDÉSIRABLES ].
L'innocuité et l'efficacité de PRILOSEC n'ont pas été établies dans :
- patients de moins de 1 an pour :
- Traitement du RGO symptomatique
- Maintien de la guérison de l'EE due au RGO à médiation acide
- patients pédiatriques pour :
- Traitement de l'ulcère duodénal actif
- Éradication de H. pylori pour réduire le risque de récidive de l'ulcère duodénal
- Traitement de l'ulcère gastrique bénin actif
- Conditions hypersécrétoires pathologiques
- patients de moins de 1 mois quelle que soit l'indication.
Données sur les animaux juvéniles
L'ésoméprazole, un énantiomère de l'oméprazole, s'est avéré diminuer le poids corporel, le gain de poids corporel, le poids du fémur, la longueur du fémur et la croissance globale à des doses orales d'environ 34 à 68 fois une dose humaine quotidienne de 40 mg d'ésoméprazole ou de 40 mg d'oméprazole basée sur le corps. surface dans une étude de toxicité chez le rat juvénile. Les multiples de dose entre l'animal et l'homme sont basés sur l'hypothèse d'une exposition systémique égale à l'ésoméprazole chez l'homme après l'administration orale de 40 mg d'ésoméprazole ou de 40 mg d'oméprazole.
Une étude de toxicité de 28 jours avec une phase de récupération de 14 jours a été menée chez des rats juvéniles avec de l'ésoméprazole magnésien à des doses de 70 à 280 mg/kg/jour (environ 17 à 68 fois une dose humaine orale quotidienne de 40 mg d'ésoméprazole ou de 40 mg oméprazole sur la base de la surface corporelle). Une augmentation du nombre de décès à la dose élevée de 280 mg/kg/jour a été observée lorsque des rats juvéniles ont reçu de l'ésoméprazole magnésien du jour postnatal 7 au jour postnatal 35. De plus, des doses égales ou supérieures à 140 mg/kg/jour jour (environ 34 fois une dose humaine orale quotidienne de 40 mg d'ésoméprazole ou de 40 mg d'oméprazole sur la base de la surface corporelle), a produit des diminutions du poids corporel (environ 14 %) et du gain de poids corporel liées au traitement, des diminutions du poids du fémur et du fémur longueur et affectait la croissance globale. Des résultats comparables décrits ci-dessus ont également été observés dans cette étude avec un autre sel d'ésoméprazole, l'ésoméprazole strontium, à des doses équimolaires d'ésoméprazole.
Utilisation gériatrique
L'oméprazole a été administré à plus de 2 000 personnes âgées (≥ 65 ans) dans le cadre d'essais cliniques aux États-Unis et en Europe. Il n'y avait aucune différence dans la sécurité et l'efficacité entre les sujets âgés et les sujets plus jeunes. D'autres expériences cliniques rapportées n'ont pas identifié de différences de réponse entre les sujets âgés et les sujets plus jeunes, mais une plus grande sensibilité de certains individus plus âgés ne peut être exclue.
Des études pharmacocinétiques ont montré que le taux d'élimination était quelque peu diminué chez les personnes âgées et que la biodisponibilité était augmentée. La clairance plasmatique de l'oméprazole était de 250 ml/min (environ la moitié de celle des jeunes volontaires) et sa demi-vie plasmatique était en moyenne d'une heure, soit environ le double de celle des jeunes volontaires sains. Cependant, aucun ajustement posologique n'est nécessaire chez la personne âgée [voir PHARMACOLOGIE CLINIQUE ].
Insuffisance hépatique
Chez les patients atteints d'insuffisance hépatique (Child-Pugh Classe A, B ou C), l'exposition à l'oméprazole a considérablement augmenté par rapport aux sujets sains. La réduction de la posologie de PRILOSEC 10 mg à 10 mg une fois par jour est recommandée chez les patients atteints d'insuffisance hépatique pour le maintien de la cicatrisation de l'EE [voir DOSAGE ET ADMINISTRATION , PHARMACOLOGIE CLINIQUE ].
Population asiatique
Dans les études sur des sujets sains, les Asiatiques avaient une exposition environ quatre fois plus élevée que les Caucasiens. La réduction de la posologie de PRILOSEC 20 mg à 10 mg une fois par jour est recommandée chez les patients asiatiques pour le maintien de la cicatrisation de l'EE [voir DOSAGE ET ADMINISTRATION , PHARMACOLOGIE CLINIQUE ].
SURDOSAGE
Des cas de surdosage d'oméprazole chez l'homme ont été signalés. Les doses allaient jusqu'à 2400 mg (120 fois la dose clinique habituelle recommandée). Les manifestations étaient variables, mais incluaient confusion, somnolence, vision floue, tachycardie, nausées, vomissements, diaphorèse, bouffées vasomotrices, maux de tête, bouche sèche et autres effets indésirables similaires à ceux observés dans l'expérience clinique normale [voir EFFETS INDÉSIRABLES ]. Les symptômes ont été transitoires et aucun résultat clinique grave n'a été signalé lorsque PRILOSEC 20 mg a été pris seul. Aucun antidote spécifique pour le surdosage d'oméprazole n'est connu.
L'oméprazole est fortement lié aux protéines et n'est donc pas facilement dialysable. En cas de surdosage, le traitement doit être symptomatique et de soutien.
En cas de surexposition, appelez votre centre antipoison au 1-800-222-1222 pour obtenir des informations à jour sur la gestion d'un empoisonnement ou d'un surdosage.
CONTRE-INDICATIONS
- PRILOSEC est contre-indiqué chez les patients présentant une hypersensibilité connue aux benzimidazoles substitués ou à tout composant de la formulation. Les réactions d'hypersensibilité peuvent inclure l'anaphylaxie, le choc anaphylactique, l'œdème de Quincke, le bronchospasme, la néphrite tubulo-interstitielle aiguë et l'urticaire [voir AVERTISSEMENTS ET PRECAUTIONS , EFFETS INDÉSIRABLES ].
- Les inhibiteurs de la pompe à protons (IPP), y compris PRILOSEC 10 mg, sont contre-indiqués chez les patients recevant des produits contenant de la rilpivirine [voir INTERACTIONS MÉDICAMENTEUSES ].
- Pour plus d'informations sur les contre-indications des agents antibactériens (clarithromycine et amoxicilline) indiqués en association avec PRILOSEC 40mg, se référer à la rubrique CONTRE-INDICATIONS de leurs notices.
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
L'oméprazole appartient à une classe de composés antisécrétoires, les benzimidazoles substitués, qui suppriment la sécrétion d'acide gastrique par inhibition spécifique du système enzymatique H+/K+ ATPase à la surface sécrétoire de la cellule pariétale gastrique. Étant donné que ce système enzymatique est considéré comme la pompe à acide (proton) dans la muqueuse gastrique, l'oméprazole a été caractérisé comme un inhibiteur de la pompe à acide gastrique, en ce qu'il bloque l'étape finale de la production d'acide. Cet effet est lié à la dose et conduit à l'inhibition de la sécrétion d'acide basale et stimulée, quel que soit le stimulus.
Pharmacodynamie
Activité antisécrétoire
Après administration orale, le début de l'effet antisécrétoire de l'oméprazole se produit dans l'heure, l'effet maximal se produisant dans les deux heures. L'inhibition de la sécrétion est d'environ 50% du maximum à 24 heures et la durée de l'inhibition dure jusqu'à 72 heures. L'effet antisécrétoire dure donc beaucoup plus longtemps que ce à quoi on pourrait s'attendre avec la très courte demi-vie plasmatique (moins d'une heure), apparemment en raison d'une liaison prolongée à l'enzyme pariétale H+/K+ ATPase. Lorsque le médicament est arrêté, l'activité sécrétoire revient progressivement, sur 3 à 5 jours. L'effet inhibiteur de la sécrétion d'acide oméprazole augmente avec une administration répétée une fois par jour, atteignant un plateau après quatre jours.
Les résultats de nombreuses études sur l'effet antisécrétoire de doses multiples de 20 mg et 40 mg d'oméprazole chez des sujets sains et des patients sont présentés ci-dessous. La valeur « max » représente les déterminations à un moment d'effet maximal (2 à 6 heures après l'administration), tandis que les valeurs « min » sont celles 24 heures après la dernière dose d'oméprazole.
Des doses orales quotidiennes uniques d'oméprazole allant d'une dose de 10 mg à 40 mg ont produit une inhibition de 100 % de l'acidité intragastrique sur 24 heures chez certains patients.
Effets de la gastrine sérique
Dans des études portant sur plus de 200 patients, les taux sériques de gastrine ont augmenté au cours des 1 à 2 premières semaines d'administration uniquotidienne de doses thérapeutiques d'oméprazole parallèlement à l'inhibition de la sécrétion acide. Aucune autre augmentation de la gastrine sérique ne s'est produite avec la poursuite du traitement. En comparaison avec les antagonistes des récepteurs H2 de l'histamine, les augmentations médianes produites par des doses de 20 mg d'oméprazole étaient plus élevées (augmentation de 1,3 à 3,6 fois contre 1,1 à 1,8 fois). Les valeurs de gastrine sont revenues aux niveaux de prétraitement, généralement dans les 1 à 2 semaines suivant l'arrêt du traitement.
L'augmentation de la gastrine provoque une hyperplasie des cellules de type entérochromaffine et une augmentation des taux sériques de chromogranine A (CgA). L'augmentation des taux de CgA peut entraîner des résultats faussement positifs dans les examens diagnostiques des tumeurs neuroendocrines [voir AVERTISSEMENTS ET PRECAUTIONS ].
Effets sur les cellules de type entérochromaffine (ECL)
Des échantillons de biopsie gastrique humaine ont été obtenus de plus de 3000 patients (enfants et adultes) traités par l'oméprazole dans des essais cliniques à long terme. L'incidence de l'hyperplasie des cellules ECL dans ces études a augmenté avec le temps ; cependant, aucun cas de carcinoïdes à cellules ECL, de dysplasie ou de néoplasie n'a été trouvé chez ces patients. Cependant, ces études sont d'une durée et d'une taille insuffisantes pour exclure l'influence possible de l'administration à long terme d'oméprazole sur le développement de toute affection précancéreuse ou maligne.
Autres effets
Les effets systémiques de l'oméprazole sur le SNC, les systèmes cardiovasculaire et respiratoire n'ont pas été trouvés à ce jour. L'oméprazole, administré à des doses orales de 30 ou 40 mg pendant 2 à 4 semaines, n'a eu aucun effet sur la fonction thyroïdienne, le métabolisme des glucides ou les taux circulants d'hormone parathyroïdienne, de cortisol, d'estradiol, de testostérone, de prolactine, de cholécystokinine ou de sécrétine.
Aucun effet sur la vidange gastrique des composants solides et liquides d'un repas test n'a été démontré après une dose unique d'oméprazole 90 mg. Chez des sujets sains, une dose intraveineuse unique d'oméprazole (0,35 mg/kg) n'a eu aucun effet sur la sécrétion de facteur intrinsèque. Aucun effet dose-dépendant systématique n'a été observé sur la production de pepsine basale ou stimulée chez l'homme.
Cependant, lorsque le pH intragastrique est maintenu à 4,0 ou plus, la production basale de pepsine est faible et l'activité de la pepsine est diminuée.
Comme le font d'autres agents qui élèvent le pH intragastrique, l'oméprazole administré pendant 14 jours chez des sujets sains a produit une augmentation significative des concentrations intragastriques de bactéries viables. Le modèle des espèces bactériennes était inchangé par rapport à celui que l'on trouve couramment dans la salive. Tous les changements ont disparu dans les trois jours suivant l'arrêt du traitement.
L'évolution de l'œsophage de Barrett chez 106 patients a été évaluée dans une étude américaine contrôlée en double aveugle portant sur PRILOSEC 40 mg deux fois par jour pendant 12 mois suivi de 20 mg deux fois par jour pendant 12 mois ou de ranitidine 300 mg deux fois par jour pendant 24 mois. Aucun impact cliniquement significatif sur la muqueuse de Barrett par un traitement antisécrétoire n'a été observé. Bien qu'un épithélium néosquameux se soit développé pendant le traitement antisécrétoire, l'élimination complète de la muqueuse de Barrett n'a pas été obtenue. Aucune différence significative n'a été observée entre les groupes de traitement dans le développement de la dysplasie de la muqueuse de Barrett et aucun patient n'a développé de carcinome de l'œsophage pendant le traitement. Aucune différence significative entre les groupes de traitement n'a été observée dans le développement d'une hyperplasie des cellules ECL, d'une gastrite atrophique du corps, d'une métaplasie intestinale du corps ou de polypes du côlon dépassant 3 mm de diamètre.
Pharmacocinétique
Absorption
PRILOSEC 20 mg pour suspension buvable à libération retardée contient des granules d'oméprazole magnésien et des granules inactifs à administrer dans l'eau. L'absorption de l'oméprazole ne commence qu'après que les granules gastro-résistants quittent l'estomac. La pharmacocinétique de l'oméprazole dépend du temps, avec des concentrations plasmatiques plus élevées à l'état d'équilibre qu'après une dose unique. L'exposition systémique (ASC et Cmax) à l'oméprazole après l'administration une fois par jour de 20 mg de suspension buvable à libération retardée pendant 5 jours est respectivement supérieure de 51 % et 58 % à celle obtenue après la première dose. Les concentrations plasmatiques maximales d'oméprazole après des doses répétées de suspension buvable à libération retardée surviennent en 1,5 à 2 heures. Chez le sujet sain, la demi-vie plasmatique est de 0,5 à 1 heure.
Distribution
La liaison aux protéines est d'environ 95 %.
Élimination
Métabolisme
L'oméprazole est largement métabolisé par le système enzymatique du cytochrome P450 (CYP). La majeure partie de son métabolisme dépend du CYP2C19 exprimé de manière polymorphe, responsable de la formation d'hydroxyoméprazole, le principal métabolite dans le plasma. La partie restante dépend d'une autre isoforme spécifique, le CYP3A4, responsable de la formation de l'oméprazole sulfone.
Excrétion
Suite à l'administration orale d'une dose unique d'une solution tamponnée d'oméprazole, peu ou pas de médicament inchangé a été excrété dans l'urine. La majorité de la dose (environ 77 %) a été éliminée dans l'urine sous la forme d'au moins six métabolites. Deux ont été identifiés comme étant l'hydroxyoméprazole et l'acide carboxylique correspondant. Le reste de la dose était récupérable dans les fèces. Cela implique une excrétion biliaire importante des métabolites de l'oméprazole. Trois métabolites ont été identifiés dans le plasma, les dérivés sulfurés et sulfonés de l'oméprazole et l'hydroxyoméprazole. Ces métabolites ont très peu ou pas d'activité antisécrétoire.
Thérapie combinée avec des antimicrobiens
L'oméprazole 40 mg par jour a été administré en association avec la clarithromycine 500 mg toutes les 8 heures à des sujets masculins adultes en bonne santé. Les concentrations plasmatiques à l'état d'équilibre de l'oméprazole ont été augmentées (Cmax, ASC0-24 et augmentations de la T½ de 30 %, 89 % et 34 % respectivement) par l'administration concomitante de clarithromycine. Les augmentations observées de la concentration plasmatique d'oméprazole ont été associées aux effets pharmacologiques suivants. La valeur moyenne du pH gastrique sur 24 heures était lorsque l'oméprazole était administré seul et de 5,7 lorsqu'il était co-administré avec la clarithromycine.
Les concentrations plasmatiques de clarithromycine et de 14-hydroxy-clarithromycine ont été augmentées par l'administration concomitante d'oméprazole. Pour la clarithromycine, la Cmax moyenne était supérieure de 10 %, la Cmin moyenne était supérieure de 27 % et l'ASC0-8 moyenne était supérieure de 15 % lorsque la clarithromycine était administrée avec l'oméprazole que lorsque la clarithromycine était administrée seule. Des résultats similaires ont été observés pour la 14-hydroxy-clarithromycine, la Cmax moyenne était supérieure de 45 %, la Cmin moyenne était supérieure de 57 % et l'ASC0-8 moyenne était supérieure de 45 %. Les concentrations de clarithromycine dans le tissu gastrique et le mucus ont également été augmentées par l'administration concomitante d'oméprazole.
Populations spécifiques
Patients gériatriques
Le taux d'élimination de l'oméprazole était quelque peu diminué chez les personnes âgées et la biodisponibilité était augmentée. L'oméprazole était biodisponible à 76 % lorsqu'une dose orale unique de 40 mg d'oméprazole (solution tamponnée) était administrée à des volontaires âgés en bonne santé, contre 58 % chez les jeunes volontaires ayant reçu la même dose. Près de 70 % de la dose a été récupérée dans l'urine sous forme de métabolites de l'oméprazole et aucun médicament inchangé n'a été détecté. La clairance plasmatique de l'oméprazole était de 250 ml/min (environ la moitié de celle des jeunes volontaires) et sa demi-vie plasmatique était en moyenne d'une heure, soit environ le double de celle des jeunes volontaires sains.
Patients pédiatriques
2 à 16 ans
La pharmacocinétique de l'oméprazole a été étudiée chez des patients pédiatriques âgés de 2 à 16 ans :
Après des doses comparables en mg/kg d'oméprazole, les enfants plus jeunes (2 à 5 ans) ont des ASC inférieures à celles des enfants de 6 à 16 ans ou des adultes ; Les ASC des deux derniers groupes ne différaient pas [voir DOSAGE ET ADMINISTRATION ].
1 à 11 mois d'âge
Un modèle de pharmacocinétique de population a été utilisé pour déterminer les doses appropriées de PRILOSEC 40 mg chez les patients pédiatriques
1 mois à moins de 1 an pour le traitement (jusqu'à 6 semaines) de l'œsophagite érosive due au RGO à médiation acide. Le modèle était basé sur les données de 64 enfants âgés de 0,5 mois à 16 ans. Seules des données limitées étaient disponibles chez les enfants de moins de 1 an. L'oméprazole a été administré aux patients pédiatriques dans ces études sous forme de suspension orale préparée à partir des gélules à libération retardée. Des doses pédiatriques ont été simulées dans le groupe d'âge de 1 à 11 mois, pour obtenir des expositions à l'oméprazole comparables avec des adultes après un traitement avec 20 mg une fois par jour [voir DOSAGE ET ADMINISTRATION ].
Groupes raciaux ou ethniques
[Voir PHARMACOLOGIE CLINIQUE ].
Patients atteints d'insuffisance rénale
Chez les patients atteints d'insuffisance rénale chronique (clairance de la créatinine entre 10 et 62 mL/min/1,73 m²), la disposition de l'oméprazole était très similaire à celle des sujets sains, bien qu'il y ait eu une légère augmentation de la biodisponibilité. Étant donné que l'excrétion urinaire est la principale voie d'excrétion des métabolites de l'oméprazole, leur élimination a ralenti proportionnellement à la diminution de la clairance de la créatinine. Cette augmentation de la biodisponibilité n'est pas considérée comme cliniquement significative.
Patients atteints d'insuffisance hépatique
Chez les patients atteints d'une maladie hépatique chronique classée dans la classe Child-Pugh A (n = 3), B (n = 4) et C (n = 1), la biodisponibilité a augmenté d'environ 100 % par rapport aux sujets sains, reflétant une diminution du premier passage. effet, et la demi-vie plasmatique du médicament a augmenté à près de 3 heures par rapport à la demi-vie chez les sujets sains de 0,5 à 1 heure. La clairance plasmatique était en moyenne de 70 ml/min, contre une valeur de 500 à 600 ml/min chez les sujets sains [voir DOSAGE ET ADMINISTRATION , Utilisation dans des populations spécifiques ].
Études sur les interactions médicamenteuses
Effet de l'oméprazole sur d'autres médicaments
L'oméprazole est un inhibiteur temps-dépendant du CYP2C19 et peut augmenter l'exposition systémique des médicaments co-administrés qui sont des substrats du CYP2C19. De plus, l'administration d'oméprazole augmente le pH intragastrique et peut modifier l'exposition systémique de certains médicaments qui présentent une solubilité dépendante du pH.
Antirétroviraux
Pour certains médicaments antirétroviraux, tels que la rilpivirine, l'atazanavir et le nelfinavir, une diminution des concentrations sériques a été rapportée lorsqu'ils sont administrés avec l'oméprazole [voir INTERACTIONS MÉDICAMENTEUSES ].
Rilpivirine : Après plusieurs doses de rilpivirine (150 mg, par jour) et d'oméprazole (20 mg, par jour), l'ASC a diminué de 40 %, la Cmax de 40 % et la Cmin de 33 % pour la rilpivirine.
Nelfinavir : Après plusieurs doses de nelfinavir (1250 mg, deux fois par jour) et d'oméprazole (40 mg par jour), l'ASC a diminué de 36 % et 92 %, la Cmax de 37 % et 89 % et la Cmin de 39 % et 75 % respectivement pour le nelfinavir et le M8. .
Atazanavir : Après plusieurs doses d'atazanavir (400 mg, par jour) et d'oméprazole (40 mg, par jour, 2 heures avant l'atazanavir), l'ASC a diminué de 94 %, la Cmax de 96 % et la Cmin de 95 %.
Saquinavir : Suite à des doses multiples de saquinavir/ritonavir (1000/100 mg) deux fois par jour pendant 15 jours avec de l'oméprazole 40 mg par jour co-administré les jours 11 à 15.
L'ASC a été augmentée de 82 %, la Cmax de 75 % et la Cmin de 106 %. Le mécanisme derrière cette interaction n'est pas entièrement élucidé.
Clopidogrel
Dans une étude clinique croisée, 72 sujets sains ont reçu du clopidogrel (dose de charge de 300 mg suivie de 75 mg par jour) seul et avec de l'oméprazole (80 mg en même temps que le clopidogrel) pendant 5 jours. L'exposition au métabolite actif du clopidogrel a diminué de 46 % (Jour 1) et de 42 % (Jour 5) lorsque le clopidogrel et l'oméprazole ont été administrés ensemble.
Les résultats d'une autre étude croisée chez des sujets sains ont montré une interaction pharmacocinétique similaire entre le clopidogrel (dose de charge de 300 mg/dose d'entretien quotidienne de 75 mg) et l'oméprazole 80 mg par jour lorsqu'il est co-administré pendant 30 jours. L'exposition au métabolite actif du clopidogrel a été réduite de 41 % à 46 % au cours de cette période.
Dans une autre étude, 72 sujets sains ont reçu les mêmes doses de clopidogrel et 80 mg d'oméprazole, mais les médicaments ont été administrés à 12 heures d'intervalle ; les résultats étaient similaires, indiquant que l'administration de clopidogrel et d'oméprazole à des moments différents n'empêche pas leur interaction [voir AVERTISSEMENTS ET PRECAUTIONS , INTERACTIONS MÉDICAMENTEUSES ].
Mycophénolate mofétil
L'administration d'oméprazole 20 mg deux fois par jour pendant 4 jours et d'une dose unique de 1000 mg de MMF environ une heure après la dernière dose d'oméprazole à 12 sujets sains dans une étude croisée a entraîné une réduction de 52 % de la Cmax et une réduction de 23 % dans l'AUC de MPA [voir INTERACTIONS MÉDICAMENTEUSES ].
Cilostazol
L'oméprazole agit comme un inhibiteur du CYP2C19. L'oméprazole, administré à raison de 40 mg par jour pendant une semaine à 20 sujets sains dans une étude croisée, a augmenté la Cmax et l'ASC du cilostazol de 18 % et 26 % respectivement. La Cmax et l'ASC de l'un des métabolites actifs, le 3,4-dihydro-cilostazol, qui a 4 à 7 fois l'activité du cilostazol, ont été augmentées de 29 % et 69 %, respectivement. La co-administration de cilostazol avec l'oméprazole devrait augmenter les concentrations de cilostazol et du métabolite actif mentionné ci-dessus [voir INTERACTIONS MÉDICAMENTEUSES ].
Diazépam
L'administration concomitante d'oméprazole 20 mg une fois par jour et de diazépam 0,1 mg/kg par voie intraveineuse a entraîné une diminution de 27 % de la clairance et une augmentation de 36 % de la demi-vie du diazépam [voir INTERACTIONS MÉDICAMENTEUSES ].
Digoxine
L'administration concomitante d'oméprazole 20 mg une fois par jour et de digoxine chez des sujets sains a augmenté la biodisponibilité de la digoxine de 10 % (30 % chez deux sujets) [voir INTERACTIONS MÉDICAMENTEUSES ].
Effet d'autres médicaments sur l'oméprazole
Voriconazole
L'administration concomitante d'oméprazole et de voriconazole (un inhibiteur combiné du CYP2C19 et du CYP3A4) a plus que doublé l'exposition à l'oméprazole. Lorsque le voriconazole (400 mg toutes les 12 heures pendant un jour, suivi de 200 mg une fois par jour pendant 6 jours) a été administré avec de l'oméprazole (40 mg une fois par jour pendant 7 jours) à des sujets sains, la Cmax à l'état d'équilibre et l'ASC0-24 de l'oméprazole significativement augmenté : en moyenne 2 fois (IC à 90 % : 1,8, 2,6) et 4 fois (IC à 90 % : 3,3, 4,4), respectivement, par rapport à l'administration d'oméprazole sans voriconazole [voir INTERACTIONS MÉDICAMENTEUSES ].
Microbiologie
La bithérapie oméprazole et clarithromycine et la trithérapie oméprazole, clarithromycine et amoxicilline se sont révélées actives contre la plupart des souches d'Helicobacter pylori in vitro et dans les infections cliniques [voir INDICATIONS ET USAGE , Etudes cliniques ].
Helicobacter pylori
Des tests de sensibilité des isolats de H. pylori ont été effectués pour l'amoxicilline et la clarithromycine en utilisant la méthodologie de dilution sur gélose1, et les concentrations minimales inhibitrices (CMI) ont été déterminées.
Les procédures de test de sensibilité standardisées nécessitent l'utilisation de micro-organismes de contrôle de laboratoire pour contrôler les aspects techniques des procédures de laboratoire.
Résistance au prétraitement
Les taux de résistance avant traitement par la clarithromycine étaient de 3,5 % (4/113) dans les études de bithérapie oméprazole/clarithromycine (4 et 5) et de 9,3 % (41/439) dans les études de trithérapie oméprazole/clarithromycine/amoxicilline (1, 2 et 3).
Des isolats sensibles au prétraitement à l'amoxicilline (≤ 0,25 μg/mL) ont été trouvés chez 99,3 % (436/439) des patients dans les études de trithérapie oméprazole/clarithromycine/amoxicilline (1, 2 et 3). Des concentrations minimales inhibitrices (CMI) avant le traitement à l'amoxicilline > 0,25 μg/mL ont été observées chez 0,7 % (3/439) des patients, qui appartenaient tous au groupe d'étude clarithromycine et amoxicilline. Un patient avait une concentration minimale inhibitrice (CMI) d'amoxicilline avant traitement non confirmée de > 256 μg/mL par Etest®.
Les patients non éradiqués de H. pylori après une trithérapie oméprazole/clarithromycine/amoxicilline ou une bithérapie oméprazole/clarithromycine auront probablement des isolats de H. pylori résistants à la clarithromycine. Par conséquent, des tests de sensibilité à la clarithromycine doivent être effectués, si possible. Les patients atteints d'H. pylori résistant à la clarithromycine ne doivent pas être traités par l'un des traitements suivants : la bithérapie oméprazole/clarithromycine, la trithérapie oméprazole/clarithromycine/amoxicilline ou d'autres régimes qui incluent la clarithromycine comme seul agent antimicrobien.
Résultats des tests de sensibilité à l'amoxicilline et résultats cliniques/bactériologiques
Dans les essais cliniques de trithérapie, 84,9 % (157/185) des patients du groupe de traitement oméprazole/clarithromycine/amoxicilline qui avaient des CMI sensibles à l'amoxicilline avant le traitement (≤ 0,25 μg/mL) ont été éradiqués de H. pylori et 15,1 % (28 /185) échec thérapeutique. Sur les 28 patients qui ont échoué à la trithérapie, 11 n'ont eu aucun résultat de test de sensibilité post-traitement et 17 avaient des isolats de H. pylori post-traitement avec des CMI sensibles à l'amoxicilline. Onze des patients qui n'ont pas répondu à la trithérapie présentaient également des isolats de H. pylori post-traitement avec des CMI résistantes à la clarithromycine.
Test de sensibilité pour Helicobacter pylori
Pour obtenir des informations sur les tests de sensibilité à Helicobacter pylori, voir la section Microbiologie dans les informations de prescription pour la clarithromycine et l'amoxicilline.
Effets sur l'écologie microbienne gastro-intestinale
La diminution de l'acidité gastrique due à tout moyen, y compris les inhibiteurs de la pompe à protons, augmente le nombre gastrique de bactéries normalement présentes dans le tractus gastro-intestinal. Le traitement avec des inhibiteurs de la pompe à protons peut entraîner une légère augmentation du risque d'infections gastro-intestinales telles que Salmonella et Campylobacter et, chez les patients hospitalisés, éventuellement aussi Clostridium difficile.
Pharmacogénomique
Le CYP2C19, une enzyme polymorphe, est impliqué dans le métabolisme de l'oméprazole. L'allèle CYP2C19*1 est entièrement fonctionnel tandis que les allèles CYP2C19*2 et *3 ne sont pas fonctionnels. Il existe d'autres allèles associés à une fonction enzymatique nulle ou réduite. Les patients porteurs de deux allèles entièrement fonctionnels sont des métaboliseurs rapides et ceux porteurs de deux allèles de perte de fonction sont des métaboliseurs lents. Chez les métaboliseurs rapides, l'oméprazole est principalement métabolisé par le CYP2C19.
L'exposition systémique à l'oméprazole varie en fonction du statut métabolique du patient : métaboliseurs lents > métaboliseurs intermédiaires > métaboliseurs rapides. Environ 3 % des Caucasiens et 15 à 20 % des Asiatiques sont des métaboliseurs lents du CYP2C19.
Dans une étude pharmacocinétique d'une dose unique de 20 mg d'oméprazole, l'ASC de l'oméprazole chez les sujets asiatiques était environ quatre fois supérieure à celle des Caucasiens [voir DOSAGE ET ADMINISTRATION , Utilisation dans des populations spécifiques ].
Etudes cliniques
Ulcère duodénal actif
Dans une étude multicentrique, en double aveugle, contrôlée par placebo portant sur 147 patients atteints d'ulcère duodénal documenté par endoscopie, le pourcentage de patients guéris (selon le protocole) à 2 et 4 semaines était significativement plus élevé avec les gélules à libération retardée d'oméprazole magnésien 20 mg une fois par jour qu'avec avec placebo (p ≤ 0,01).
Traitement de l'ulcère duodénal actif % de patients guéris
Le soulagement complet de la douleur diurne et nocturne s'est produit significativement plus rapidement (p ≤ 0,01) chez les patients traités par les gélules à libération retardée d'oméprazole magnésien 20 mg que chez les patients traités par placebo. À la fin de l'étude, un nombre significativement plus élevé de patients ayant reçu des gélules à libération retardée d'oméprazole magnésien présentaient un soulagement complet de la douleur diurne (p ≤ 0,05) et de la douleur nocturne (p ≤ 0,01).
Dans une étude multicentrique en double aveugle portant sur 293 patients atteints d'ulcère duodénal documenté par endoscopie, le pourcentage de patients guéris (selon le protocole) à 4 semaines était significativement plus élevé avec les gélules à libération retardée d'oméprazole magnésien 20 mg une fois par jour qu'avec la ranitidine 150 mg bid ( p
Traitement de l'ulcère duodénal actif % de patients guéris
La guérison s'est produite significativement plus rapidement chez les patients traités avec des gélules à libération retardée d'oméprazole magnésien que chez ceux traités avec la ranitidine 150 mg bid (p
Dans une étude multinationale étrangère randomisée en double aveugle portant sur 105 patients atteints d'ulcère duodénal documenté par endoscopie, 20 mg et 40 mg de gélules à libération retardée d'oméprazole magnésien ont été comparés à 150 mg bid de ranitidine à 2, 4 et 8 semaines. À 2 et 4 semaines, les deux doses de PRILOSEC 10 mg étaient statistiquement supérieures (selon le protocole) à la ranitidine, mais 40 mg n'étaient pas supérieurs à 20 mg de gélules à libération retardée d'oméprazole magnésien, et à 8 semaines, il n'y avait aucune différence significative entre les deux doses. médicaments actifs.
Traitement de l'ulcère duodénal actif % de patients guéris
Éradication de H. pylori chez les patients atteints d'ulcère duodénal
Triple thérapie (gélules à libération retardée d'oméprazole magnésien/clarithromycine/amoxicilline)
Trois études cliniques américaines, randomisées, en double aveugle chez des patients atteints d'une infection à H. pylori et d'un ulcère duodénal (n = 558) ont comparé les gélules à libération retardée d'oméprazole magnésien plus clarithromycine plus amoxicilline à la clarithromycine plus amoxicilline. Deux études (1 et 2) ont été menées chez des patients présentant un ulcère duodénal actif, et l'autre étude (3) a été menée chez des patients ayant des antécédents d'ulcère duodénal au cours des 5 dernières années mais sans ulcère présent au moment de l'inscription. . Le schéma posologique dans les études consistait en capsules à libération retardée d'oméprazole magnésien 20 mg deux fois par jour plus clarithromycine 500 mg deux fois par jour plus amoxicilline 1 g deux fois par jour pendant 10 jours ; ou clarithromycine 500 mg deux fois par jour plus amoxicilline 1 g deux fois par jour pendant 10 jours. Dans les études 1 et 2, les patients qui ont pris le régime d'oméprazole ont également reçu 18 jours supplémentaires de capsules à libération retardée d'oméprazole magnésium 20 mg une fois par jour. Les paramètres étudiés étaient l'éradication de H. pylori et la cicatrisation de l'ulcère duodénal (études 1 et 2 uniquement). Le statut H. pylori a été déterminé par CLOtest®, histologie et culture dans les trois études. Pour un patient donné, H. pylori était considéré comme éradiqué si au moins deux de ces tests étaient négatifs et qu'aucun n'était positif.
L'association oméprazole plus clarithromycine plus amoxicilline a été efficace pour éradiquer H. pylori.
Bithérapie (gélules à libération retardée d'oméprazole magnésien/clarithromycine)
Quatre études randomisées, en double aveugle et multicentriques (4, 5, 6 et 7) ont évalué les gélules à libération retardée d'oméprazole magnésien 40 mg une fois par jour plus clarithromycine 500 mg trois fois par jour pendant 14 jours, suivies de capsules à libération retardée d'oméprazole magnésien gélules 20 mg une fois par jour (études 4, 5 et 7) ou par des gélules à libération retardée d'oméprazole magnésium 40 mg une fois par jour (étude 6) pendant 14 jours supplémentaires chez les patients présentant un ulcère duodénal actif associé à H. pylori. Les études 4 et 5 ont été menées aux États-Unis et au Canada et ont recruté 242 et 256 patients, respectivement. L'infection à H. pylori et l'ulcère duodénal ont été confirmés chez 219 patients dans l'étude 4 et 228 patients dans l'étude 5. Ces études ont comparé le régime combiné aux gélules à libération retardée d'oméprazole magnésien et aux monothérapies à la clarithromycine. Les études 6 et 7 ont été menées en Europe et ont recruté respectivement 154 et 215 patients. L'infection à H. pylori et l'ulcère duodénal ont été confirmés chez 148 patients dans l'étude 6 et 208 patients dans l'étude 7. Ces études ont comparé le régime combiné à la monothérapie par l'oméprazole. Les résultats des analyses d'efficacité de ces études sont décrits ci-dessous. L'éradication de H. pylori était définie par l'absence de test positif (culture ou histologie) à 4 semaines après la fin du traitement, et deux tests négatifs étaient nécessaires pour être considéré comme éradiqué de H. pylori. Dans l'analyse per-protocole, les patients suivants ont été exclus : les abandons, les patients avec des tests H. pylori manquants après le traitement et les patients qui n'ont pas été évalués pour l'éradication de H. pylori parce qu'ils présentaient un ulcère à la fin du traitement. .
L'association d'oméprazole et de clarithromycine a été efficace pour éradiquer H. pylori.
La guérison de l'ulcère n'était pas significativement différente lorsque la clarithromycine était ajoutée au traitement par l'oméprazole par rapport au traitement par l'oméprazole seul.
L'association d'oméprazole et de clarithromycine a été efficace pour éradiquer H. pylori et réduire la récidive de l'ulcère duodénal.
Ulcère gastrique bénin actif
Dans une étude multicentrique américaine en double aveugle sur l'oméprazole 40 mg une fois par jour, 20 mg une fois par jour et un placebo chez 520 patients atteints d'ulcère gastrique diagnostiqué par endoscopie, les résultats suivants ont été obtenus.
Traitement de l'ulcère gastrique % de patients guéris (tous les patients traités)
Pour les groupes stratifiés de patients avec une taille d'ulcère inférieure ou égale à 1 cm, aucune différence dans les taux de guérison entre 40 mg et 20 mg n'a été détectée à 4 ou 8 semaines. Pour les patients dont la taille de l'ulcère était supérieure à 1 cm, 40 mg étaient significativement plus efficaces que 20 mg à 8 semaines.
Dans une étude étrangère, multinationale, en double aveugle de 602 patients atteints d'ulcère gastrique diagnostiqué par endoscopie, l'oméprazole 40 mg une fois par jour, 20 mg une fois par jour et la ranitidine 150 mg deux fois par jour ont été évalués.
Traitement de l'ulcère gastrique % de patients guéris (tous les patients traités)
RGO symptomatique
Une étude contrôlée par placebo a été menée en Scandinavie pour comparer l'efficacité de l'oméprazole 20 mg ou 10 mg une fois par jour pendant jusqu'à 4 semaines dans le traitement des brûlures d'estomac et d'autres symptômes chez les patients atteints de RGO sans EE. Les résultats sont présentés ci-dessous.
% de résultats symptomatiques réussis1
EE due au RGO à médiation acide
Dans une étude américaine multicentrique en double aveugle contrôlée par placebo portant sur 20 mg ou 40 mg de gélules à libération retardée d'oméprazole magnésien chez des patients présentant des symptômes de RGO et une EE diagnostiquée par endoscopie de grade 2 ou plus, les taux de guérison en pourcentage (par protocole) étaient les suivants : :
Dans cette étude, la dose de 40 mg n'était pas supérieure à la dose de 20 mg de gélules à libération retardée d'oméprazole magnésien en termes de pourcentage de guérison. D'autres essais cliniques contrôlés ont également montré que les gélules à libération retardée d'oméprazole magnésien sont efficaces dans le RGO sévère. En comparaison avec les antagonistes des récepteurs H2 de l'histamine chez les patients atteints d'EE de grade 2 ou supérieur, les gélules à libération retardée d'oméprazole magnésien à une dose de 20 mg ont été significativement plus efficaces que les témoins actifs. Le soulagement complet des brûlures d'estomac diurnes et nocturnes s'est produit significativement plus rapidement (p
Dans cette étude et cinq autres études contrôlées sur le RGO, significativement plus de patients prenant 20 mg d'oméprazole (84 %) ont signalé un soulagement complet des symptômes du RGO que les patients recevant un placebo (12 %).
Maintien de la guérison de l'EE due au RGO à médiation acide
Dans une étude américaine à double insu, randomisée, multicentrique et contrôlée par placebo, deux schémas posologiques de gélules à libération retardée d'oméprazole magnésien ont été étudiés chez des patients présentant une œsophagite cicatrisée confirmée par endoscopie. Les résultats pour déterminer le maintien de la cicatrisation de l'EE sont présentés ci-dessous.
Analyse de la table de mortalité
Dans une étude internationale multicentrique en double aveugle, les gélules à libération retardée d'oméprazole magnésien 20 mg par jour et 10 mg par jour ont été comparées à la ranitidine 150 mg deux fois par jour chez des patients présentant une œsophagite cicatrisée confirmée par endoscopie. Le tableau ci-dessous présente les résultats de cette étude pour le maintien de la cicatrisation de l'EE.
Analyse de la table de mortalité
Chez les patients qui avaient initialement une œsophagite érosive de grade 3 ou 4, pour l'entretien après la guérison, 20 mg par jour de gélules à libération retardée d'oméprazole magnésien ont été efficaces, tandis que 10 mg n'ont pas démontré d'efficacité.
Conditions hypersécrétoires pathologiques
Dans des études ouvertes portant sur 136 patients atteints d'hypersécrétions pathologiques, telles que le syndrome de Zollinger-Ellison (ZE) avec ou sans adénomes endocriniens multiples, les gélules à libération retardée d'oméprazole magnésien ont inhibé de manière significative la sécrétion d'acide gastrique et contrôlé les symptômes associés de diarrhée, d'anorexie et de douleur. Des doses allant de 20 mg tous les deux jours à 360 mg par jour ont maintenu la sécrétion basale d'acide en dessous de 10 mEq/h chez les patients sans chirurgie gastrique antérieure et en dessous de 5 mEq/h chez les patients ayant déjà subi une chirurgie gastrique.
Les doses initiales ont été adaptées aux besoins individuels du patient et des ajustements ont été nécessaires avec le temps chez certains patients [voir DOSAGE ET ADMINISTRATION ]. Les gélules à libération retardée d'oméprazole magnésien ont été bien tolérées à ces doses élevées pendant des périodes prolongées (> 5 ans chez certains patients). Chez la plupart des patients ZE, les taux sériques de gastrine n'ont pas été modifiés par les gélules à libération retardée d'oméprazole magnésien. Cependant, chez certains patients, la gastrine sérique a augmenté à des niveaux supérieurs à ceux présents avant le début du traitement par l'oméprazole. Au moins 11 patients atteints du syndrome ZE sous traitement à long terme avec des gélules à libération retardée d'oméprazole magnésien ont développé des carcinoïdes gastriques. On pense que ces résultats sont une manifestation de l'affection sous-jacente, qui est connue pour être associée à de telles tumeurs, plutôt que le résultat de l'administration de gélules à libération retardée d'oméprazole magnésien [voir EFFETS INDÉSIRABLES ].
Études pédiatriques pour le traitement du RGO symptomatique, le traitement de l'EE due au RGO à médiation acide et le maintien de la guérison de l'EE due au RGO à médiation acide
Traitement du RGO symptomatique
L'efficacité des gélules à libération retardée d'oméprazole magnésien pour le traitement du RGO symptomatique chez les patients pédiatriques âgés de 1 à 16 ans est basée en partie sur des données obtenues auprès de 125 patients pédiatriques dans deux études cliniques non contrôlées.
La première étude a recruté 12 patients pédiatriques âgés de 1 à 2 ans ayant des antécédents de RGO cliniquement diagnostiqué. Les patients ont reçu une dose unique d'oméprazole (0,5 mg/kg, 1 mg/kg ou 1,5 mg/kg) pendant 8 semaines sous forme de capsule ouverte dans une solution de bicarbonate de sodium à 8,4 %. Soixante-quinze pour cent (9/12) des patients ont eu des épisodes de vomissements/régurgitations diminués d'au moins 50 %.
La deuxième étude a recruté 113 patients pédiatriques âgés de 2 à 16 ans ayant des antécédents de symptômes évoquant un RGO symptomatique. Les patients ont reçu une dose unique d'oméprazole (10 mg ou 20 mg, en fonction du poids corporel) pendant 4 semaines soit sous forme de capsule intacte, soit sous forme de capsule ouverte dans de la compote de pommes. Une réponse réussie a été définie comme l'absence d'épisodes modérés ou sévères de symptômes liés à la douleur ou de vomissements/régurgitations au cours des 4 derniers jours de traitement. Les résultats ont montré des taux de réussite de 60 % (9/15 ; 10 mg d'oméprazole) et de 59 % (58/98 ; 20 mg d'oméprazole), respectivement.
Traitement de l'EE due au RGO à médiation acide
Dans une étude de titration de dose ouverte et non contrôlée, pour le traitement de l'EE chez des patients pédiatriques âgés de 1 à 16 ans, des doses requises variaient de 0,7 à 3,5 mg/kg/jour (80 mg/jour). Les doses ont été initiées à 0,7 mg/kg/jour. Les doses ont été augmentées par paliers de 0,7 mg/kg/jour (si le pH intra-œsophagien affichait un pH
Maintien de la guérison de l'EE due au RGO à médiation acide
Dans une étude ouverte non contrôlée sur le maintien de la cicatrisation de l'EE chez 46 patients pédiatriques âgés de 1 à 16 ans, 54 % des patients ont eu besoin de la moitié de la dose de cicatrisation. Les patients restants ont augmenté la dose de guérison (0,7 à un maximum de 2,8 mg/kg/jour) soit pendant toute la période d'entretien, soit sont revenus à la moitié de la dose avant la fin. Sur les 46 patients qui sont entrés dans la phase d'entretien, 19 (41 %) n'ont eu aucune rechute au cours du suivi (intervalle de 4 à 25 mois). De plus, le traitement d'entretien chez les patients atteints d'EE a entraîné l'absence de symptômes généraux chez 63 % des patients.
RÉFÉRENCES
1. Institut des normes cliniques et de laboratoire (CLSI). Méthodes de dilution des tests de sensibilité aux antimicrobiens pour les bactéries à croissance aérobie ; Norme approuvée - Dixième édition. Document CLSI M07-A10, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvanie, 19087, États-Unis 2015.
INFORMATIONS PATIENTS
PRILOSEC® (pry-lo-sec) (oméprazole magnésien) pour suspension buvable à libération retardée
Quelles sont les informations les plus importantes que je devrais connaître sur PRILOSEC ?
PRILOSEC 10 mg peut soulager vos symptômes liés à l'acidité, mais vous pourriez tout de même avoir de graves problèmes d'estomac. Discutez avec votre médecin.
PRILOSEC peut provoquer des effets secondaires graves, notamment :
- Un type de problème rénal (néphrite tubulo-interstitielle aiguë). Certaines personnes qui prennent des inhibiteurs de la pompe à protons (IPP), y compris PRILOSEC, peuvent développer un problème rénal appelé néphrite tubulo-interstitielle aiguë qui peut survenir à tout moment pendant le traitement par PRILOSEC. Appelez immédiatement votre médecin si vous avez une diminution de la quantité que vous urinez ou si vous avez du sang dans vos urines.
- Diarrhée causée par une infection (Clostridium difficile) dans vos intestins. Appelez immédiatement votre médecin si vous avez des selles liquides ou des douleurs à l'estomac qui ne disparaissent pas. Vous pouvez ou non avoir de la fièvre.
- Fractures osseuses (hanche, poignet ou colonne vertébrale). Des fractures osseuses de la hanche, du poignet ou de la colonne vertébrale peuvent survenir chez les personnes qui prennent plusieurs doses quotidiennes d'IPP et pendant une longue période (un an ou plus). Informez votre médecin si vous avez une fracture osseuse, en particulier au niveau de la hanche, du poignet ou de la colonne vertébrale.
- Certains types de lupus érythémateux. Le lupus érythémateux est une maladie auto-immune (les cellules immunitaires du corps attaquent d'autres cellules ou organes du corps). Certaines personnes qui prennent des médicaments IPP, y compris PRILOSEC 10 mg, peuvent développer certains types de lupus érythémateux ou présenter une aggravation du lupus qu'ils ont déjà. Appelez immédiatement votre médecin si vous avez des douleurs articulaires nouvelles ou qui s'aggravent ou une éruption cutanée sur les joues ou les bras qui s'aggrave au soleil.
Parlez à votre médecin de votre risque de ces effets secondaires graves. PRILOSEC 10 mg peut avoir d'autres effets indésirables graves. Voir « Quels sont les effets secondaires possibles de PRILOSEC 20 mg ? »
Qu'est-ce que PRILOSEC 20 mg ?
Un médicament sur ordonnance appelé inhibiteur de la pompe à protons (IPP) utilisé pour réduire la quantité d'acide dans votre estomac.
Chez l'adulte, PRILOSEC 20mg est utilisé pour :
- jusqu'à 8 semaines pour la cicatrisation des ulcères duodénaux.
- 10 à 14 jours avec certains antibiotiques pour traiter une infection causée par une bactérie appelée H. pylori. Si nécessaire, votre médecin peut vous prescrire 14 à 18 jours supplémentaires de PRILOSEC après le traitement aux antibiotiques.
- jusqu'à 8 semaines pour la guérison des ulcères d'estomac.
- jusqu'à 4 semaines pour traiter les brûlures d'estomac et d'autres symptômes qui surviennent avec le reflux gastro-œsophagien (RGO).
- jusqu'à 8 semaines pour la guérison et le soulagement des symptômes des lésions de la muqueuse de l'œsophage liées à l'acide (appelées œsophagite érosive ou EE). Votre médecin peut prescrire 4 semaines supplémentaires de PRILOSEC 20 mg chez les patients dont l'EE ne guérit pas.
- maintenir la guérison de l'EE et aider à prévenir le retour des symptômes de brûlures d'estomac causés par le RGO. On ne sait pas si PRILOSEC est sûr et efficace lorsqu'il est utilisé pendant plus de 12 mois à cette fin.
- le traitement à long terme des conditions où votre estomac produit trop d'acide. Cela inclut une maladie rare appelée syndrome de Zollinger-Ellison.
Chez les enfants de 1 à 16 ans, PRILOSEC 20mg est utilisé pour :
- jusqu'à 4 semaines pour traiter les brûlures d'estomac et d'autres symptômes qui surviennent avec le RGO.
- jusqu'à 8 semaines pour traiter le RGO avec EE.
- maintenir la guérison de l'EE et aider à prévenir le retour des symptômes de brûlures d'estomac causés par le RGO. On ne sait pas si PRILOSEC est sûr et efficace lorsqu'il est utilisé plus de 12 mois à cette fin.
Chez les enfants de 1 mois à moins de 12 mois, PRILOSEC 10 mg est utilisé pour :
- jusqu'à 6 semaines pour traiter le RGO avec EE. On ne sait pas si PRILOSEC est sûr et efficace pour d'autres utilisations chez les enfants de 1 mois à moins de 12 mois ou chez les enfants de moins de 1 mois.
Ne prenez pas PRILOSEC si vous êtes :
- allergique à l'oméprazole, à tout autre médicament IPP ou à l'un des ingrédients de PRILOSEC. Voir la fin de ce Guide de Médication pour une liste complète d'ingrédients.
- prendre un médicament contenant de la rilpivirine (EDURANT, COMPLERA, ODEFSEY) utilisé pour traiter le VIH-1 (virus de l'immunodéficience humaine).
Avant de prendre PRILOSEC 20 mg, informez votre médecin de toutes vos conditions médicales, y compris si vous :
- avez un faible taux de magnésium, un faible taux de calcium et un faible taux de potassium dans votre sang.
- êtes enceinte ou envisagez de devenir enceinte. On ne sait pas si PRILOSEC 10 mg nuira à votre bébé à naître.
- allaitez ou envisagez d'allaiter. PRILOSEC 40 mg peut passer dans votre lait maternel. Discutez avec votre médecin de la meilleure façon de nourrir votre bébé si vous prenez PRILOSEC.
- Informez votre médecin de tous les médicaments que vous prenez, y compris les médicaments sur ordonnance et en vente libre, les vitamines et les suppléments à base de plantes. Informez surtout votre médecin si vous prenez un médicament contenant de la clarithromycine ou de l'amoxicilline, du clopidogrel (Plavix), du méthotrexate (Otrxup, Rasuvo, Trexall, XATMEP), de la digoxine (LANOXIN), un diurétique (diurétique), du millepertuis (Hypericum perforatum) ou de la rifampicine (Rimactane, Rifater, Rifamate).
Comment dois-je prendre PRILOSEC 20 mg ?
- Prenez PRILOSEC 20 mg exactement comme prescrit par votre médecin.
- Ne modifiez pas votre dose et n'arrêtez pas PRILOSEC 40 mg sans en parler avec votre médecin.
- PRILOSEC est généralement pris 1 fois par jour.
- Prenez PRILOSEC 20mg avant un repas.
- Des antiacides peuvent être pris avec PRILOSEC.
- PRILOSEC est mélangé avec de l'eau et peut être pris par la bouche ou administré par sonde nasogastrique (NG) ou gastrique.
- Voir le "Mode d'emploi" à la fin de ce Guide de Médication pour les instructions sur comment mélanger et prendre PRILOSEC 10 mgs par voie orale dans l'eau ou comment mélanger et donner PRILOSEC par un tube NG ou un tube gastrique mélangé dans l'eau.
- Si vous oubliez une dose de PRILOSEC, prenez-la dès que vous vous en souvenez. S'il est presque l'heure de votre prochaine dose, ne prenez pas la dose oubliée. Prenez la dose suivante à l'heure habituelle. Ne prenez pas 2 doses en même temps.
- Si vous avez pris trop de PRILOSEC, appelez immédiatement votre médecin ou votre centre antipoison au 1-800-222-1222 ou rendez-vous à la salle d'urgence la plus proche.
Quels sont les effets secondaires possibles de PRILOSEC 40mg ?
PRILOSEC peut provoquer des effets secondaires graves, notamment :
- Voir « Quelle est l'information la plus importante que je devrais connaître sur PRILOSEC 40 mg ? »
- Faibles niveaux de vitamine B-12 dans votre corps peut survenir chez les personnes qui ont pris PRILOSEC 40 mg pendant une longue période (plus de 3 ans). Informez votre médecin si vous présentez des symptômes de faible taux de vitamine B-12, notamment un essoufflement, des étourdissements, un rythme cardiaque irrégulier, une faiblesse musculaire, une peau pâle, une sensation de fatigue, des changements d'humeur et des picotements ou un engourdissement dans les bras et les jambes.
- Faibles niveaux de magnésium et métabolisme minéral dans votre corps peut survenir chez les personnes qui ont pris PRILOSEC pendant au moins 3 mois. Informez votre médecin si vous présentez des symptômes de faibles niveaux de magnésium, notamment des convulsions, des étourdissements, un rythme cardiaque irrégulier, de la nervosité, des douleurs musculaires ou une faiblesse et des spasmes des mains, des pieds ou de la voix.
- Excroissances de l'estomac (polypes de la glande fundique). Les personnes qui prennent des IPP pendant une longue période ont un risque accru de développer un certain type d'excroissances gastriques appelées polypes des glandes fundiques, en particulier après avoir pris des IPP pendant plus d'un an.
- Réactions cutanées sévères. PRILOSEC peut provoquer des réactions cutanées rares mais graves qui peuvent affecter n'importe quelle partie de votre corps. Ces réactions cutanées graves peuvent nécessiter un traitement à l'hôpital et peuvent mettre la vie en danger :
- Éruption cutanée pouvant présenter des cloques, une desquamation ou des saignements sur n'importe quelle partie de la peau (y compris les lèvres, les yeux, la bouche, le nez, les organes génitaux, les mains ou les pieds).
- Vous pouvez également avoir de la fièvre, des frissons, des courbatures, un essoufflement ou des ganglions lymphatiques hypertrophiés.
Arrêtez de prendre PRILOSEC 20 mg et appelez immédiatement votre médecin. Ces symptômes peuvent être le premier signe d'une réaction cutanée sévère.
Les effets indésirables les plus courants de PRILOSEC 40 mg chez l'adulte incluent : maux de tête, douleurs dans la région de l'estomac (abdominales), nausées, diarrhée, vomissements et gaz.
Les effets secondaires les plus fréquents de PRILOSEC chez les enfants de 1 à 16 ans comprennent : infection des voies respiratoires supérieures, fièvre, maux de tête, douleurs dans la région de l'estomac (abdominales), nausées, diarrhée, vomissements et gaz. Ce ne sont pas tous les effets secondaires possibles de PRILOSEC. Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
Comment dois-je conserver PRILOSEC 40 mg ?
Conservez PRILOSEC à la température de pièce entre 68°F à 77°F (20°C à 25°C).
Gardez PRILOSEC 20 mg et tous les médicaments hors de la portée des enfants.
Informations générales sur l'utilisation sûre et efficace de PRILOSEC.
Les médicaments sont parfois prescrits à des fins autres que celles énumérées dans un guide des médicaments. N'utilisez pas PRILOSEC pour une affection pour laquelle il n'a pas été prescrit. Ne donnez pas PRILOSEC 40 mg à d'autres personnes, même si elles présentent les mêmes symptômes que vous. Cela peut leur nuire. Vous pouvez demander à votre médecin ou à votre pharmacien des informations sur PRILOSEC 20 mg destinées aux professionnels de la santé.
Quels sont les ingrédients de PRILOSEC ?
Ingrédient actif: oméprazole magnésium
Ingrédients inactifs: le monostéarate de glycéryle, l'hydroxypropylcellulose, l'hypromellose, le stéarate de magnésium, le copolymère d'acide méthacrylique C, le polysorbate, les sphères de sucre, le talc et le citrate de triéthyle, ainsi que des granulés inactifs. Les granulés inactifs sont composés d'acide citrique, de crospovidone, de dextrose, d'hydroxypropylcellulose, d'oxyde de fer et de gomme xanthane.
MODE D'EMPLOI
PRILOSEC® (pry-lo-sec) (oméprazole magnésien) pour suspension buvable à libération retardée
Prise de PRILOSEC 40mg dans l'eau :
Administration de PRILOSEC avec de l'eau par sonde nasogastrique (NG) ou gastrique :
Pour les personnes qui ont un tube NG ou un tube gastrique de taille 6 ou plus, PRILOSEC peut être administré comme suit :
Ce guide des médicaments a été approuvé par la Food and Drug Administration des États-Unis
