Pentasa 400mg Mesalamine Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Pentasa et comment est-il utilisé ?
Pentasa est un médicament d'ordonnance utilisé pour traiter les symptômes de la colite ulcéreuse. Pentasa 400 mg peut être utilisé seul ou avec d'autres médicaments.
Pentasa appartient à une classe de médicaments appelés dérivés de l'acide 5-aminosalicylique.
On ne sait pas si Pentasa est sûr et efficace chez les enfants de plus de 5 ans.
Quels sont les effets secondaires possibles de Pentasa ?
Pentasa peut provoquer des effets secondaires graves, notamment :
- fortes douleurs à l'estomac,
- crampes d'estomac,
- diarrhée sanglante,
- fièvre,
- mal de tête,
- démangeaison de la peau,
- selles sanglantes ou goudronneuses,
- tousser du sang,
- vomi qui ressemble à du marc de café,
- peu ou pas de miction,
- miction douloureuse ou difficile,
- gonflement des pieds ou des chevilles,
- sensation de fatigue ou d'essoufflement,
- perte d'appétit,
- douleur dans le haut du ventre,
- fatigue,
- ecchymoses ou saignements faciles,
- urine foncée,
- selles de couleur argile, et
- jaunissement de la peau ou des yeux
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Pentasa 400 mg incluent :
- nausée,
- vomissement,
- Douleur d'estomac,
- diarrhée,
- indigestion,
- gaz,
- mal de tête,
- éruption cutanée, et
- tests de la fonction hépatique anormaux
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Pentasa. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
LA DESCRIPTION
PENTASA (mésalamine) pour administration orale est une formulation à libération contrôlée de mésalamine, un agent anti-inflammatoire aminosalicylate à usage gastro-intestinal.
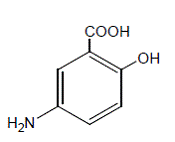
Chimiquement, la mésalamine est l'acide 5-amino-2-hydroxybenzoïque. Il a un poids moléculaire de 153,14.
La formule structurale est :
Chaque capsule de 250 mg contient 250 mg de mésalamine. Il contient également les ingrédients inactifs suivants : monoglycéride acétylé, huile de ricin, dioxyde de silicium colloïdal, éthylcellulose, hydroxypropylméthylcellulose, amidon, acide stéarique, sucre, talc et cire blanche. L'enveloppe de la gélule contient du jaune D&C #10, du bleu FD&C #1, du vert FD&C #3, de la gélatine, du dioxyde de titane et d'autres ingrédients.
Chaque gélule de 500 mg contient 500 mg de mésalamine. Il contient également les ingrédients inactifs suivants : monoglycéride acétylé, huile de ricin, dioxyde de silicium colloïdal, éthylcellulose, hydroxypropylméthylcellulose, amidon, acide stéarique, sucre, talc et cire blanche. L'enveloppe de la gélule contient du FD&C Blue #1, de la gélatine, du dioxyde de titane et d'autres ingrédients.
LES INDICATIONS
PENTASA 400 mg est indiqué pour l'induction de la rémission et pour le traitement des patients adultes atteints de colite ulcéreuse légèrement à modérément active.
DOSAGE ET ADMINISTRATION
La posologie recommandée pour l'induction de la rémission et le traitement symptomatique de la rectocolite hémorragique active légère à modérée chez l'adulte est de 1 g (4 gélules PENTASA 250 mg ou 2 gélules PENTASA 500 mg) 4 fois par jour pour une posologie quotidienne totale de 4 g. La durée du traitement dans les essais contrôlés allait jusqu'à 8 semaines.
Les gélules de PENTASA peuvent être avalées entières, ou alternativement, la gélule peut être ouverte et tout le contenu saupoudré sur de la compote de pommes ou du yogourt. Tout le contenu doit être consommé immédiatement. Les gélules et le contenu des gélules ne doivent pas être écrasés ni mâchés.
Buvez une quantité suffisante de liquides.
L'innocuité et l'efficacité de PENTASA 400 mg chez les patients pédiatriques n'ont pas été établies.
COMMENT FOURNIE
PENTASA à libération prolongée 250 mg les gélules sont fournies en flacons de 240 gélules ( CDN 54092-189-81). Chaque capsule verte et bleue contient 250 mg de mésalamine dans des billes à libération prolongée. Les gélules à libération prolongée PENTASA sont identifiées par un logo étoile pentagonal et le numéro 2010 sur la partie verte et S429 250 mg sur la partie bleue des gélules.
PENTASA à libération prolongée 500 mg les gélules sont fournies en flacons de 120 gélules ( CDN 54092-191-12). Chaque capsule bleue contient 500 mg de mésalamine dans des billes à libération prolongée. Les gélules à libération prolongée PENTASA 400 mg sont identifiées par un logo étoile pentagonal et S429 500 mg sur les gélules.
Conserver à 25 °C (77 °F); les excursions permises à 15°C à 30°C (59°F à 86°F) [voient USP la Température de Pièce Contrôlée].
Pour signaler des RÉACTIONS INDÉSIRABLES SUSPECTÉES, contactez Takeda Pharmaceuticals au 1800-828-2088 ou la FDA au 1-800-FDA-1088 ou www.fda.gov/medwatch.
Distribué par : Takeda Pharmaceuticals America, Inc. Lexington, MA 02421, États-Unis. Révisé : novembre 2021
EFFETS SECONDAIRES
Dans des essais cliniques combinés nationaux et étrangers, plus de 2100 patients atteints de colite ulcéreuse ou de la maladie de Crohn ont reçu un traitement PENTASA. En général, le traitement par PENTASA a été bien toléré. Les événements les plus fréquents (c'est-à-dire supérieurs ou égaux à 1 %) étaient la diarrhée (3,4 %), les maux de tête (2,0 %), les nausées (1,8 %), les douleurs abdominales (1,7 %), la dyspepsie (1,6 %), les vomissements (1,5 %). %) et éruption cutanée (1,0 %).
Dans deux essais nationaux contrôlés par placebo portant sur plus de 600 patients atteints de rectocolite hémorragique, les événements indésirables étaient moins nombreux chez les patients traités par PENTASA (mésalamine) que dans le groupe placebo (PENTASA 14 % contre placebo 18 %) et n'étaient pas liés à la dose. Les événements survenant dans plus de 1 % des cas sont indiqués dans le tableau ci-dessous. Parmi ceux-ci, seuls les nausées et les vomissements étaient plus fréquents dans le groupe PENTASA. L'arrêt du traitement en raison d'événements indésirables était plus fréquent sous placebo que sous PENTASA (7 % contre 4 %).
Les mesures de laboratoire clinique n'ont montré aucune tendance anormale significative pour aucun test, y compris la mesure de la fonction hématologique, hépatique et rénale.
Les événements indésirables suivants, présentés par système corporel, ont été rapportés peu fréquemment (c'est-à-dire moins de 1 %) au cours des essais sur la colite ulcéreuse domestique et la maladie de Crohn. Dans de nombreux cas, la relation avec PENTASA n'a pas été établie.
Gastro-intestinal : distension abdominale, anorexie, constipation, ulcère duodénal, dysphagie, éructation, ulcère œsophagien, incontinence fécale, augmentation de la GGTP, saignement gastro-intestinal, augmentation de la phosphatase alcaline, augmentation de la LDH, ulcère buccal, candidose buccale, pancréatite, saignement rectal, augmentation de la SGOT, augmentation de la SGPT, anomalies des selles (changement de couleur ou de texture), soif
Dermatologique : acné, alopécie, peau sèche, eczéma, érythème noueux, trouble des ongles, photosensibilité, prurit, sudation, urticaire
Système nerveux: dépression, étourdissements, insomnie, somnolence, paresthésie
Cardiovasculaire: palpitations, péricardite, vasodilatation
Autre: albuminurie, aménorrhée, augmentation de l'amylase, arthralgie, asthénie, douleur mammaire, conjonctivite, ecchymose, œdème, fièvre, hématurie, hypoménorrhée, syndrome de type Kawasaki, crampes dans les jambes, lichen plan, augmentation de la lipase, malaise, ménorragie, métrorragie, myalgie, infiltrats pulmonaires , thrombocytémie, thrombocytopénie, pollakiurie
Une semaine après la fin d'une étude de 8 semaines sur la colite ulcéreuse, un homme de 72 ans, sans antécédents de problèmes pulmonaires, a développé une dyspnée. Le patient a ensuite été diagnostiqué d'une fibrose pulmonaire interstitielle sans éosinophilie par un médecin et d'une bronchiolite oblitérante avec pneumopathie organisée par un deuxième médecin. Une relation causale entre cet événement et le traitement par la mésalamine n'a pas été établie.
Des rapports de cas publiés et/ou une surveillance post-commercialisation spontanée ont décrit des cas peu fréquents de péricardite, de myocardite mortelle, de douleurs thoraciques et d'anomalies de l'onde T, de pneumopathie d'hypersensibilité, de pancréatite, de syndrome néphrotique, de néphrite interstitielle, d'hépatite, d'anémie aplasique, de pancytopénie, de leucopénie, d'agranulocytose ou anémie pendant le traitement par la mésalamine. L'anémie peut faire partie de la présentation clinique de la maladie inflammatoire de l'intestin. Des réactions allergiques, pouvant impliquer une éosinophilie, peuvent être observées en relation avec le traitement par PENTASA 400 mg.
Rapports post-commercialisation
Les événements suivants ont été identifiés lors de l'utilisation post-approbation de la marque PENTASA de mésalamine dans la pratique clinique. Parce qu'ils sont signalés volontairement à partir d'une population de taille inconnue, les estimations de fréquence ne peuvent pas être faites. Ces événements ont été choisis pour inclusion en raison d'une combinaison de gravité, de fréquence de signalement ou de lien de causalité potentiel avec la mésalamine :
Gastro-intestinal : Rapports d'hépatotoxicité, notamment d'enzymes hépatiques élevées (SGOT/AST, SGPT/ALT, GGT, LDH, phosphatase alcaline, bilirubine), d'hépatite, d'ictère, d'ictère cholestatique, de cirrhose et d'éventuelles lésions hépatocellulaires, notamment une nécrose hépatique et une insuffisance hépatique. Certains de ces cas ont été mortels. Un cas de syndrome de type Kawasaki qui incluait des modifications de la fonction hépatique a également été signalé.
Autre: réaction anaphylactique, SJS/TEN, DRESS, AGEP, pleurésie/pleurite, pneumonite, granulocytopénie, lupus érythémateux disséminé, syndrome lupique, insuffisance rénale aiguë, maladie pulmonaire interstitielle, pneumopathie d'hypersensibilité (y compris pneumopathie interstitielle, alvéolite allergique, pneumonie à éosinophiles), insuffisance rénale chronique, diabète insipide néphrogénique, néphrolithiase, hypertension intracrânienne, œdème de Quincke et oligospermie (réversible).
INTERACTIONS MÉDICAMENTEUSES
Aucune enquête sur les interactions entre PENTASA 400 mg et d'autres médicaments n'a été réalisée ; cependant, les interactions médicamenteuses suivantes ont été signalées pour les produits contenant de la mésalamine :
Agents néphrotoxiques, y compris les anti-inflammatoires non stéroïdiens
L'utilisation concomitante de mésalamine avec des agents néphrotoxiques connus, y compris des anti-inflammatoires non stéroïdiens (AINS), peut augmenter le risque de néphrotoxicité. Surveiller les patients prenant des médicaments néphrotoxiques pour détecter des modifications de la fonction rénale et des effets indésirables liés à la mésalamine.

Azathioprine Ou 6-Mercaptopurine
L'utilisation concomitante de mésalamine avec l'azathioprine ou la 6-mercaptopurine et/ou tout autre médicament connu pour provoquer une myélotoxicité peut augmenter le risque de troubles sanguins, d'insuffisance médullaire et de complications associées. Si l'utilisation concomitante de PENTASA et d'azathioprine ou de 6-mercaptopurine ne peut être évitée, surveiller les analyses de sang, y compris la numération globulaire complète et la numération plaquettaire.
AVERTISSEMENTS
Aucune information fournie
PRÉCAUTIONS
Insuffisance rénale
Une insuffisance rénale, y compris une maladie à modifications minimes, une néphrite interstitielle aiguë et chronique et une insuffisance rénale, ont été signalées chez des patients recevant PENTASA ou d'autres produits contenant de la mésalamine ou convertis en mésalamine.
La mésalamine est connue pour être en grande partie excrétée par les reins et le risque d'effets indésirables peut être plus élevé chez les patients dont la fonction rénale est altérée. Évaluer la fonction rénale chez tous les patients avant l'initiation et périodiquement pendant le traitement par PENTASA. Évaluer les risques et les avantages de l'utilisation de PENTASA chez les patients présentant une insuffisance rénale connue ou des antécédents de maladie rénale ou prenant des médicaments néphrotoxiques en concomitance.
Syndrome d'intolérance aiguë induite par la mésalamine
La mésalamine a été associée à un syndrome d'intolérance aiguë qui peut être difficile à distinguer d'une poussée de maladie inflammatoire de l'intestin. Les symptômes comprennent des crampes, des douleurs abdominales aiguës, une diarrhée sanglante et parfois de la fièvre, des maux de tête et des éruptions cutanées. Surveiller les patients pour une aggravation de ces symptômes pendant le traitement. Si un syndrome d'intolérance aiguë est suspecté, interrompre rapidement le traitement par PENTASA.
Réactions d'hypersensibilité
Des réactions d'hypersensibilité ont été rapportées chez des patients prenant de la sulfasalazine. Certains patients peuvent avoir une réaction similaire à PENTASA ou à d'autres composés qui contiennent ou sont convertis en mésalamine.
Comme avec la sulfasalazine, les réactions d'hypersensibilité induites par la mésalamine peuvent se manifester par une atteinte des organes internes, notamment une myocardite, une péricardite, une néphrite, une hépatite, une pneumonite et des anomalies hématologiques. Évaluer immédiatement les patients si des signes ou des symptômes d'une réaction d'hypersensibilité sont présents. Interrompre PENTASA si une autre étiologie des signes et symptômes ne peut être établie.
Défaillance hépatique
Des cas d'insuffisance hépatique ont été signalés chez des patients atteints d'une maladie hépatique préexistante qui ont reçu d'autres produits contenant de la mésalamine. Évaluer les risques et les avantages de l'utilisation de PENTASA 400 mg chez les patients présentant une insuffisance hépatique connue.
Effets indésirables cutanés graves
Des effets indésirables cutanés sévères, tels que le syndrome de Stevens-Johnson (SJS) et la nécrolyse épidermique toxique (NET), la réaction médicamenteuse avec éosinophilie et symptômes systémiques (DRESS) et la pustulose exanthématique aiguë généralisée (PEAG) ont été rapportés avec l'utilisation de la mésalamine (voir EFFETS INDÉSIRABLES ). Arrêtez PENTASA dès les premiers signes ou symptômes d'effets indésirables cutanés graves ou d'autres signes d'hypersensibilité et envisagez une évaluation plus approfondie.
Photosensibilité
Les patients souffrant d'affections cutanées préexistantes telles que la dermatite atopique et l'eczéma atopique ont signalé des réactions de photosensibilité plus graves. Conseillez aux patients d'éviter l'exposition au soleil, de porter des vêtements de protection et d'utiliser un écran solaire à large spectre lorsqu'ils sont à l'extérieur.
Néphrolithiase
Des cas de néphrolithiase ont été signalés avec l'utilisation de mésalamine, y compris des calculs contenant 100 % de mésalamine. Les calculs contenant de la mésalamine sont radiotransparents et indétectables par radiographie standard ou tomodensitométrie (TDM). Veiller à une hydratation adéquate pendant le traitement.
Interférence avec les tests de laboratoire
L'utilisation de mésalamine peut conduire à des résultats de test anormalement élevés lors de la mesure de la normétanéphrine urinaire par chromatographie liquide avec détection électrochimique en raison de la similitude des chromatogrammes de la normétanéphrine et du principal métabolite de la mésalamine, l'acide N-acétyl-5-aminosalicylique (N-Ac-5-ASA ). Envisagez un autre test sélectif pour la normétanéphrine.
Carcinogenèse, mutagenèse, altération de la fertilité
Dans une étude de cancérogénicité alimentaire de 104 semaines sur la mésalamine, des souris CD-1 ont été traitées avec des doses allant jusqu'à 2 500 mg/kg/jour et celle-ci n'était pas tumorigène. Pour une personne de taille moyenne de 50 kg (1,46 m2 de surface corporelle), cela représente 2,5 fois la dose humaine recommandée sur la base de la surface corporelle (2960 mg/m2/jour). Dans une étude de carcinogénicité alimentaire de 104 semaines chez des rats Wistar, la mésalamine jusqu'à une dose de 800 mg/kg/jour n'a pas été tumorigène. Cette dose représente 1,5 fois la dose humaine recommandée sur la base de la surface corporelle.
Aucun signe de mutagénicité n'a été observé dans un test d'Ames in vitro et dans un test du micronoyau de souris in vivo.
Aucun effet sur la fertilité ou la performance reproductive n'a été observé chez les rats mâles ou femelles à des doses orales de mésalamine allant jusqu'à 400 mg/kg/jour (0,8 fois la dose humaine recommandée basée sur la surface corporelle).
Les anomalies du sperme et l'infertilité chez les hommes, qui ont été signalées en association avec la sulfasalazine, n'ont pas été observées avec les gélules de PENTASA à 400 mg au cours des essais cliniques contrôlés.
Grossesse
Effets tératogènes
Les données publiées provenant de méta-analyses, d'études de cohorte et de séries de cas sur l'utilisation de la mésalamine pendant la grossesse n'ont pas établi de manière fiable une association avec la mésalamine et des malformations congénitales majeures, une fausse couche ou des issues maternelles ou fœtales indésirables. Il n'y a aucune preuve claire que l'exposition à la mésalamine en début de grossesse est associée à un risque accru de malformations congénitales majeures, y compris les malformations cardiaques. Les études épidémiologiques publiées présentent d'importantes limitations méthodologiques qui entravent l'interprétation des données, notamment l'incapacité de contrôler les facteurs de confusion, tels que les maladies maternelles sous-jacentes, l'utilisation maternelle de médicaments concomitants et l'absence d'informations sur la dose et la durée d'utilisation des produits à base de mésalamine. PENTASA ne doit être utilisé pendant la grossesse que si les avantages l'emportent sur les risques.
Dans les études de reproduction chez l'animal, l'administration orale de mésalamine pendant l'organogenèse à des rates gravides à des doses allant jusqu'à 1000 mg/kg/jour (5900 mg/m²) et à des lapines à des doses de 800 mg/kg/jour (6856 mg/m²) n'a révélé aucun signe. d'effets tératogènes ou de dommages au fœtus dus à la mésalamine.
Le risque de fond estimé de malformations congénitales majeures et de fausse couche pour les populations indiquées est inconnu. Toutes les grossesses ont un risque de fond de malformation congénitale, de perte ou d'autres résultats indésirables. Dans la population générale des États-Unis, le risque de fond estimé de malformations congénitales majeures et de fausses couches dans les grossesses cliniquement reconnues est de 2 % à 4 % et de 15 % à 20 %, respectivement.
Effets non tératogènes
Les données publiées suggèrent qu'une activité accrue de la maladie est associée au risque de développer des issues de grossesse défavorables chez les femmes atteintes de colite ulcéreuse. Les résultats défavorables de la grossesse comprennent l'accouchement prématuré (avant 37 semaines de gestation), les nourrissons de faible poids à la naissance (moins de 2 500 g) et la petite taille pour l'âge gestationnel à la naissance.
Mères allaitantes
Les données de la littérature publiée rapportent la présence de mésalamine et de son métabolite, l'acide N-acétyl-5-aminosalicylique dans le lait maternel en petites quantités avec des doses relatives infantiles (RID) de 0,1 % ou moins pour la mésalamine. La signification clinique de cela n'a pas été déterminée et l'expérience des femmes qui allaitent utilisant la mésalamine est limitée.
Des cas de diarrhée ont été signalés chez des nourrissons allaités exposés à la mésalamine. L'effet de PENTASA 400 mg sur la production de lait est inconnu. Soyez prudent si PENTASA 400 mg est administré à une femme qui allaite et surveillez les nourrissons allaités pour la diarrhée.
Dans des études publiées sur l'allaitement, les doses maternelles de mésalamine provenant de diverses formulations et produits oraux et rectaux variaient de 500 mg à 4,8 g par jour. La concentration moyenne de mésalamine dans le lait variait de non détectable à 0,5 mg/L. La concentration moyenne d'acide N-acétyl-5-aminosalicylique dans le lait variait de 0,2 à 9,3 mg/L. Sur la base de ces concentrations, les doses quotidiennes estimées pour un nourrisson exclusivement allaité sont de 0 à 0,075 mg/kg/jour de mésalamine (RID 0 % à 0,1 %) et de 0,03 à 1,4 mg/kg/jour de N-acétyl-5-aminosalicylique. acide.
Utilisation pédiatrique
L'innocuité et l'efficacité de PENTASA chez les patients pédiatriques n'ont pas été établies.
Utilisation gériatrique
Les essais cliniques de PENTASA 400 mg n'ont pas inclus un nombre suffisant de patients âgés de 65 ans et plus pour déterminer s'ils répondent différemment des patients plus jeunes. Les rapports d'études cliniques non contrôlées et les systèmes de notification post-commercialisation ont suggéré une incidence plus élevée de dyscrasies sanguines (c.-à-d. agranulocytose, neutropénie et pancytopénie) chez les patients âgés de 65 ans ou plus recevant des produits contenant de la mésalamine tels que PENTASA 400 mg par rapport aux patients plus jeunes. Surveiller la numération globulaire complète et la numération plaquettaire chez les patients âgés pendant le traitement par PENTASA.
En général, il faut tenir compte de la plus grande fréquence de diminution de la fonction hépatique, rénale ou cardiaque et de maladies concomitantes ou d'autres traitements médicamenteux chez les patients âgés lors de la prescription de PENTASA.
SURDOSAGE
PENTASA 400 mg est un aminosalicylate et des symptômes de toxicité au salicylate peuvent être possibles, tels que : nausées, vomissements, douleurs abdominales, tachypnée, hyperpnée, acouphènes et symptômes neurologiques (maux de tête, étourdissements, confusion, convulsions). Une intoxication grave aux salicylates peut entraîner un déséquilibre des électrolytes et du pH sanguin et potentiellement des lésions d'autres organes (par exemple, les reins et le foie).
Traitement du surdosage
Il n'existe pas d'antidote spécifique en cas de surdosage en mésalamine ; cependant, le traitement conventionnel de la toxicité du salicylate peut être bénéfique en cas de surdosage aigu et peut inclure une décontamination du tractus gastro-intestinal pour empêcher une absorption supplémentaire. Corriger le déséquilibre hydrique et électrolytique par l'administration d'un traitement intraveineux approprié et maintenir une fonction rénale adéquate.
CONTRE-INDICATIONS
PENTASA est contre-indiqué chez les patients présentant une hypersensibilité connue ou soupçonnée aux salicylates, aux aminosalicylates ou à l'un des composants de ce médicament.
PHARMACOLOGIE CLINIQUE
La sulfasalazine est divisée par action bactérienne dans le côlon en sulfapyridine (SP) et mésalamine (5-ASA). La dose orale habituelle de sulfasalazine pour la rectocolite hémorragique active chez l'adulte est de 2 à 4 g par jour en doses fractionnées. Quatre grammes de sulfasalazine fournissent 1,6 g de mésalamine libre au côlon.
Le mécanisme d'action de la mésalamine (et de la sulfasalazine) n'est pas entièrement compris, mais il semble qu'il s'agisse d'un effet anti-inflammatoire topique sur les cellules épithéliales du côlon. La production muqueuse de métabolites de l'acide arachidonique (AA), à la fois par les voies de la cyclooxygénase (c'est-à-dire les prostanoïdes) et par les voies de la lipoxygénase (c'est-à-dire les leucotriènes (LT) et les acides hydroxyeicosatétraénoïques (HETE), est augmentée chez les patients atteints de colite ulcéreuse, et il est possible que la mésalamine diminue l'inflammation en bloquant la cyclooxygénase et en inhibant la production de prostaglandine (PG) dans le côlon.
Pharmacocinétique humaine et métabolisme
Absorption
PENTASA est une formulation de mésalamine à libération prolongée enrobée d'éthylcellulose conçue pour libérer des quantités thérapeutiques de mésalamine dans tout le tractus gastro-intestinal. D'après les données sur l'excrétion urinaire, 20 à 30 % de la mésalamine contenue dans PENTASA est absorbée. En revanche, lorsque la mésalamine est administrée par voie orale sous forme de suspension aqueuse non formulée de 1 g, la mésalamine est absorbée à environ 80 %.
La concentration plasmatique de mésalamine a culminé à environ 1 mcg/mL 3 heures après une dose de 1 g de PENTASA et a diminué de manière biphasique. La littérature décrit une demi-vie terminale moyenne de 42 minutes pour la mésalamine après administration intraveineuse. En raison de la libération et de l'absorption continues de la mésalamine de PENTASA dans tout le tractus gastro-intestinal, la véritable demi-vie d'élimination ne peut être déterminée après administration orale. L'acide N-acétyl-5-aminosalicylique, le principal métabolite de la mésalamine (acide 5-aminosalicylique), a culminé à environ 3 heures à 1,8 mcg/mL, et sa concentration a suivi une baisse biphasique. Les activités pharmacologiques de l'acide N-acétyl-5-aminosalicylique sont inconnues et d'autres métabolites n'ont pas été identifiés.
La pharmacocinétique de la mésalamine orale n'était pas linéaire lorsque les gélules de PENTASA étaient dosées de 250 mg à 1 g quatre fois par jour, les concentrations plasmatiques de mésalamine à l'état d'équilibre augmentant environ neuf fois, passant de 0,14 mcg/mL à 1,21 mcg/mL, suggérant un métabolisme de premier passage saturable. La pharmacocinétique de l'acide N-acétyl-5-aminosalicylique était linéaire.
Élimination
Environ 130 mg de mésalamine libre ont été récupérés dans les matières fécales après une dose unique de 1 g de PENTASA à 400 mg, ce qui était comparable aux 140 mg de mésalamine récupérés à partir de la dose molaire équivalente de comprimés de sulfasalazine de 2,5 g. L'élimination de la mésalamine libre et des salicylates dans les fèces a augmenté proportionnellement à la dose de PENTASA. L'acide N-acétyl-5-aminosalicylique était le principal composé excrété dans l'urine (19 % à 30 %) après l'administration de 400 mg de PENTASA.
Essais cliniques
Dans deux essais dose-réponse randomisés, en double aveugle, contrôlés par placebo (UC-1 et UC-2) portant sur 625 patients atteints de colite ulcéreuse active légère à modérée, PENTASA 400 mg, à une dose orale de 4 g/jour ayant reçu 1 g quatre fois par jour, a produit une amélioration constante des principaux paramètres d'efficacité identifiés prospectivement, PGA, Tx F et SI, comme indiqué dans le tableau ci-dessous.
La dose de 4 g de PENTASA a également entraîné une amélioration constante des paramètres d'efficacité secondaires, à savoir la fréquence des allers-retours aux toilettes, la consistance des selles, les saignements rectaux, les douleurs abdominales/rectales et l'urgence. La dose de 4 g de PENTASA a induit une rémission évaluée par des paramètres endoscopiques et symptomatiques.
Chez certains patients, il a été observé que la dose de 2 g de PENTASA 400 mg améliorait les paramètres d'efficacité mesurés. Cependant, la dose de 2 g a donné des résultats incohérents dans les principaux paramètres d'efficacité dans les deux essais adéquats et bien contrôlés.
INFORMATIONS PATIENTS
Aucune information fournie. Veuillez vous référer au PRÉCAUTIONS section.
