Pepcid 20mg, 40mg Famotidine Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Pepcid et comment est-il utilisé ?
Pepcid (famotidine) est utilisé pour traiter les brûlures d'estomac, le RGO et le syndrome de Zollinger-Ellison. Il est disponible en vente libre. Pepcid 20mg est disponible sous forme de générique.
Quels sont les effets secondaires possibles de l'utilisation de Pepcid ?
Les effets secondaires sont rares, mais peuvent inclure :
- fatigue,
- vomissement,
- nausée,
- douleur abdominale,
- anorexie,
- bouche sèche,
- éruption cutanée, et
- crampes musculaires
LA DESCRIPTION
L'ingrédient actif de PEPCID® (famotidine) est un antagoniste des récepteurs H2 de l'histamine. La famotidine est le N'(aminosulfonyl)-3-[[[2-[(diaminométhylène)amino]-4-thiazolyl]méthyl]thio]propanimidamide. La formule empirique de la famotidine est C8H15N7O2S3 et son poids moléculaire est de 337,43. Sa formule structurale est :
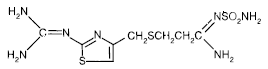
La famotidine est un composé cristallin blanc à jaune pâle qui est librement soluble dans l'acide acétique glacial, légèrement soluble dans le méthanol, très légèrement soluble dans l'eau et pratiquement insoluble dans l'éthanol.
Chaque comprimé pour administration orale contient 20 mg ou 40 mg de famotidine et les ingrédients inactifs suivants : hydroxypropylcellulose, hypromellose, oxydes de fer, stéarate de magnésium, cellulose microcristalline, amidon de maïs, talc, dioxyde de titane et cire de carnauba.
LES INDICATIONS
PEPCID 40mg est indiqué dans :
DOSAGE ET ADMINISTRATION
L'ulcère duodénal
Thérapie aiguë : La posologie orale recommandée chez l'adulte pour l'ulcère duodénal actif est de 40 mg une fois par jour au coucher. La plupart des patients guérissent en 4 semaines; il y a rarement des raisons d'utiliser PEPCID à pleine dose pendant plus de 6 à 8 semaines. Un régime de 20 mg bid est également efficace.
Thérapie d'entretien : La dose orale recommandée pour un adulte est de 20 mg une fois par jour au coucher.
Ulcère gastrique bénin
Thérapie aiguë : La posologie orale recommandée chez l'adulte pour l'ulcère gastrique bénin actif est de 40 mg une fois par jour au coucher.
Reflux gastro-oesophagien (RGO)
La posologie orale recommandée pour le traitement des patients adultes présentant des symptômes de RGO est de 20 mg bid pendant 6 semaines maximum. La posologie orale recommandée pour le traitement des patients adultes atteints d'œsophagite, y compris les érosions et les ulcérations et les symptômes associés dus au RGO, est de 20 ou 40 mg bid pendant jusqu'à 12 semaines (voir PHARMACOLOGIE CLINIQUE chez l'adulte , Etudes cliniques ).
Posologie pour les patients pédiatriques
Voir PRÉCAUTIONS , Patients pédiatriques
Les études décrites dans PRÉCAUTIONS, Patients pédiatriques
Posologie pour les patients pédiatriques âgés de 1 à 16 ans
Voir PRÉCAUTIONS , Patients pédiatriques âgés de 1 à 16 ans.
Les études décrites dans PRÉCAUTIONS, Patients pédiatriques de 1 à 16 ans suggèrent les doses initiales suivantes chez les patients pédiatriques de 1 à 16 ans :
Ulcère peptique - 0,5 mg/kg/jour po au coucher ou bid divisé jusqu'à 40 mg/jour.
Reflux gastro-œsophagien avec ou sans œsophagite, y compris érosions et ulcérations - 1,0 mg/kg/jour po bid divisé jusqu'à 40 mg bid
Bien que des études non contrôlées publiées suggèrent l'efficacité de la famotidine dans le traitement du reflux gastro-œsophagien et de l'ulcère peptique, les données chez les patients pédiatriques sont insuffisantes pour établir le pourcentage de réponse avec la dose et la durée du traitement. Par conséquent, la durée du traitement (initialement basée sur les recommandations de durée pour adultes) et la dose doivent être individualisées en fonction de la réponse clinique et/ou de la détermination du pH (gastrique ou œsophagien) et de l'endoscopie. Des études cliniques non contrôlées publiées chez des patients pédiatriques âgés de 1 à 16 ans ont utilisé des doses allant jusqu'à 1 mg/kg/jour pour l'ulcère peptique et 2 mg/kg/jour pour le RGO avec ou sans œsophagite, y compris les érosions et les ulcérations.
Conditions hypersécrétoires pathologiques (p. ex., syndrome de Zollinger-Ellison, adénomes endocriniens multiples)
La posologie de PEPCID chez les patients présentant des états pathologiques d'hypersécrétion varie d'un patient à l'autre. La dose initiale orale recommandée chez l'adulte pour les états pathologiques d'hypersécrétion est de 20 mg q 6 h. Chez certains patients, une dose initiale plus élevée peut être nécessaire. Les doses doivent être ajustées aux besoins individuels du patient et doivent être poursuivies aussi longtemps que cliniquement indiqué. Des doses allant jusqu'à 160 mg q 6 h ont été administrées à certains patients adultes atteints du syndrome de Zollinger-Ellison sévère.
Utilisation concomitante d'antiacides
Des antiacides peuvent être administrés simultanément si nécessaire.
Ajustement posologique pour les patients présentant une insuffisance rénale modérée ou sévère
Chez les patients adultes présentant une insuffisance rénale modérée (clairance de la créatinine
Sur la base de la comparaison des paramètres pharmacocinétiques de PEPCID chez les adultes et les patients pédiatriques, un ajustement posologique chez les patients pédiatriques présentant une insuffisance rénale modérée ou sévère doit être envisagé.
COMMENT FOURNIE
PEPCID 40mg Comprimés 20 mg, sont des comprimés pelliculés de couleur beige, de forme carrée arrondie, codés MSD sur une face et lisses sur l'autre. Ils sont fournis comme suit :
CDN 42998-639-09 unité d'utilisation flacons de 30 CDN 42998-639-98 unité d'utilisation flacons de 100.
Les comprimés PEPCID 40 mg, 40 mg, sont des comprimés pelliculés de couleur beige, de forme carrée arrondie, portant le code MSD d'un côté et unis de l'autre. Ils sont fournis comme suit :
CDN 42998-649-09 unité d'utilisation flacons de 30 CDN 42998-649-98 unité d'utilisation flacons de 100. Stockage
Conserver à température ambiante contrôlée.
Les comprimés PEPCID® (famotidine) à 20 mg et à 40 mg sont fabriqués pour : Marathon Pharmaceuticals, LLC, Northbrook, IL 60062, États-Unis. Émis en février 2014.
EFFETS SECONDAIRES
Les effets indésirables énumérés ci-dessous ont été signalés au cours d'essais cliniques nationaux et internationaux chez environ 2 500 patients. Dans les essais cliniques contrôlés dans lesquels les comprimés PEPCID 40 mg ont été comparés à un placebo, l'incidence des effets indésirables dans le groupe ayant reçu les comprimés PEPCID 40 mg au coucher était similaire à celle du groupe placebo.
Les effets indésirables suivants ont été signalés chez plus de 1 % des patients sous traitement par PEPCID dans des essais cliniques contrôlés et peuvent être liés au médicament : maux de tête (4,7 %), étourdissements (1,3 %), constipation (1,2 % ) et la diarrhée (1,7 %).
Les autres effets indésirables suivants ont été rapportés peu fréquemment dans les essais cliniques ou depuis la commercialisation du médicament. La relation avec le traitement par PEPCID 20 mg n'a pas été claire dans de nombreux cas. Dans chaque catégorie, les effets indésirables sont répertoriés par ordre décroissant de gravité :
Corps dans son ensemble : fièvre, asthénie, fatigue
Cardiovasculaire: arythmie, bloc AV, palpitations. L'allongement de l'intervalle QT, chez les patients présentant une insuffisance rénale, a été rapporté très rarement.
Gastro-intestinal : ictère cholestatique, hépatite, anomalies des enzymes hépatiques, vomissements, nausées, gêne abdominale, anorexie, bouche sèche
Hématologique : rares cas d'agranulocytose, pancytopénie, leucopénie, thrombocytopénie
Hypersensibilité : anaphylaxie, œdème de Quincke, œdème orbitaire ou facial, urticaire, éruption cutanée, injection conjonctivale
Musculo-squelettique : rhabdomyolyse, douleurs musculo-squelettiques, y compris crampes musculaires, arthralgie
Système nerveux/psychiatrique : crise de grand mal ; troubles psychiques, réversibles dans les cas pour lesquels un suivi a été obtenu, notamment hallucinations, confusion, agitation, dépression, anxiété, diminution de la libido ; paresthésie; insomnie; somnolence. Des convulsions, chez des patients présentant une insuffisance rénale, ont été rapportées très rarement.
Respiratoire: bronchospasme, pneumonie interstitielle
Peau: nécrolyse épidermique toxique/syndrome de Stevens-Johnson (très rare), alopécie, acné, prurit, peau sèche, bouffées vasomotrices
Sens spéciaux : acouphènes, trouble du goût
Autre: de rares cas d'impuissance et de rares cas de gynécomastie ont été rapportés ; cependant, dans les essais cliniques contrôlés, les incidences n'étaient pas supérieures à celles observées avec le placebo.
Les effets indésirables signalés pour les comprimés PEPCID peuvent également survenir avec PEPCID 20 mg pour suspension buvable.
Patients pédiatriques
Dans une étude clinique chez 35 patients pédiatriques âgés de
INTERACTIONS MÉDICAMENTEUSES
Aucune interaction médicamenteuse n'a été identifiée. Des études avec la famotidine chez l'homme, dans des modèles animaux et in vitro n'ont montré aucune interférence significative avec la disposition des composés métabolisés par les enzymes microsomales hépatiques, par exemple le système du cytochrome P450. Les composés testés chez l'homme comprennent la warfarine, la théophylline, la phénytoïne, le diazépam, l'aminopyrine et l'antipyrine. Le vert d'indocyanine en tant qu'indice d'extraction hépatique de médicaments a été testé et aucun effet significatif n'a été trouvé.
AVERTISSEMENTS
Aucune information fournie
PRÉCAUTIONS
Général
La réponse symptomatique au traitement par PEPCID n'exclut pas la présence d'une tumeur maligne gastrique.
Patients présentant une insuffisance rénale modérée ou sévère
Étant donné que des effets indésirables sur le SNC ont été rapportés chez des patients présentant une insuffisance rénale modérée et sévère, des intervalles plus longs entre les doses ou des doses plus faibles peuvent devoir être utilisés chez les patients présentant une insuffisance rénale modérée (clairance de la créatinine PHARMACOLOGIE CLINIQUE chez l'adulte et DOSAGE ET ADMINISTRATION ). Un allongement de l'intervalle QT a été très rarement signalé chez des patients présentant une insuffisance rénale dont la dose/l'intervalle posologique de famotidine n'a peut-être pas été ajusté de manière appropriée.
Carcinogenèse, mutagenèse, altération de la fertilité
Dans une étude de 106 semaines chez le rat et une étude de 92 semaines chez la souris ayant reçu des doses orales allant jusqu'à 2 000 mg/kg/jour (environ 2 500 fois la dose humaine recommandée pour l'ulcère duodénal actif), il n'y a eu aucune preuve de potentiel carcinogène pour PEPCIDE.
La famotidine était négative dans le test de mutagène microbien (test d'Ames) utilisant Salmonella typhimurium et Escherichia coli avec ou sans activation des enzymes hépatiques de rat à des concentrations allant jusqu'à 10 000 mcg/plaque. Dans des études in vivo chez la souris, avec un test du micronoyau et un test d'aberration chromosomique, aucun signe d'effet mutagène n'a été observé.
Dans des études sur des rats ayant reçu des doses orales allant jusqu'à 2 000 mg/kg/jour ou des doses intraveineuses allant jusqu'à 200 mg/kg/jour, la fertilité et les performances de reproduction n'ont pas été affectées.

Grossesse
Catégorie de grossesse B
Des études de reproduction ont été réalisées chez des rats et des lapins à des doses orales allant jusqu'à 2 000 et 500 mg/kg/jour, respectivement, et chez les deux espèces à des doses IV allant jusqu'à 200 mg/kg/jour, et n'ont révélé aucune preuve significative de altération de la fertilité ou atteinte au fœtus due au PEPCID. Bien qu'aucun effet fœtotoxique direct n'ait été observé, des avortements sporadiques survenant uniquement chez les mères présentant une diminution marquée de l'apport alimentaire ont été observés chez certains lapins à des doses orales de 200 mg/kg/jour (250 fois la dose humaine habituelle) ou plus. Cependant, il n'y a pas d'études adéquates ou bien contrôlées chez les femmes enceintes. Étant donné que les études sur la reproduction chez l'animal ne sont pas toujours prédictives de la réponse humaine, ce médicament ne doit être utilisé pendant la grossesse qu'en cas de nécessité absolue.
Mères allaitantes
Des études réalisées chez des rats en lactation ont montré que la famotidine est sécrétée dans le lait maternel. Un ralentissement transitoire de la croissance a été observé chez de jeunes rats allaitant de mères traitées avec des doses maternotoxiques d'au moins 600 fois la dose habituelle chez l'homme. La famotidine est détectable dans le lait maternel. En raison du risque d'effets indésirables graves chez les nourrissons allaités par PEPCID, une décision doit être prise d'interrompre l'allaitement ou d'arrêter le médicament, en tenant compte de l'importance du médicament pour la mère.
Patients pédiatriques
L'utilisation de PEPCID 20 mg chez les patients pédiatriques de
Deux études pharmacocinétiques chez des patients pédiatriques de 3 mois à 1 an est similaire à celle observée chez les patients pédiatriques plus âgés (1-15 ans) et les adultes . En revanche, les patients pédiatriques âgés de 0 à 3 mois avaient des valeurs de clairance de la famotidine qui étaient de 2 à 4 fois inférieures à celles des patients pédiatriques plus âgés et des adultes. Ces études montrent également que la biodisponibilité moyenne chez les patients pédiatriques de PHARMACOLOGIE CLINIQUE Chez les patients pédiatriques , Pharmacocinétique et pharmacodynamique .)
Dans une étude randomisée en double aveugle sur l'arrêt du traitement, 35 patients pédiatriques âgés de EFFETS INDÉSIRABLES , Patients pédiatriques ).
Ces études suggèrent qu'une dose initiale de 0,5 mg/kg/dose de suspension buvable de famotidine peut être bénéfique pour le traitement du RGO jusqu'à 4 semaines une fois par jour chez les patients âgés de
Patients pédiatriques âgés de 1 à 16 ans
L'utilisation de PEPCID 40 mg chez les patients pédiatriques âgés de 1 à 16 ans est étayée par des preuves issues d'études adéquates et bien contrôlées de PEPCID chez les adultes, et par les études suivantes chez les patients pédiatriques : Dans des études publiées sur un petit nombre de patients pédiatriques 1-15 ans, la clairance de la famotidine était similaire à celle observée chez les adultes. Chez les patients pédiatriques âgés de 11 à 15 ans, des doses orales de 0,5 mg/kg ont été associées à une aire sous la courbe moyenne (ASC) similaire à celle observée chez les adultes traités par voie orale avec 40 mg. De même, chez les patients pédiatriques âgés de 1 à 15 ans, des doses intraveineuses de 0,5 mg/kg ont été associées à une ASC moyenne similaire à celle observée chez les adultes traités par voie intraveineuse avec 40 mg. Des études publiées limitées suggèrent également que la relation entre la concentration sérique et la suppression de l'acide est similaire chez les patients pédiatriques âgés de 1 à 15 ans par rapport aux adultes. Ces études suggèrent une dose initiale pour les patients pédiatriques âgés de 1 à 16 ans comme suit :
Ulcère gastro-duodénal - 0,5 mg/kg/jour po Au coucher ou bid divisé jusqu'à 40 mg/jour.
Reflux gastro-œsophagien avec ou sans œsophagite, y compris érosions et ulcérations - 1,0 mg/kg/jour po bid divisé jusqu'à 40 mg bid
Bien que des études non contrôlées publiées suggèrent l'efficacité de la famotidine dans le traitement du reflux gastro-œsophagien et de l'ulcère peptique, les données chez les patients pédiatriques sont insuffisantes pour établir le pourcentage de réponse avec la dose et la durée du traitement. Par conséquent, la durée du traitement (initialement basée sur les recommandations de durée pour adultes) et la dose doivent être individualisées en fonction de la réponse clinique et/ou de la détermination du pH (gastrique ou œsophagien) et de l'endoscopie. Des études cliniques non contrôlées publiées chez des patients pédiatriques ont utilisé des doses allant jusqu'à 1 mg/kg/jour pour l'ulcère peptique et 2 mg/kg/jour pour le RGO avec ou sans œsophagite, y compris les érosions et les ulcérations.
Utilisation gériatrique
Sur les 4 966 sujets des études cliniques qui ont été traités par la famotidine, 488 sujets (9,8 %) étaient âgés de 65 ans et plus et 88 sujets (1,7 %) étaient âgés de plus de 75 ans. Aucune différence globale d'innocuité ou d'efficacité n'a été observée entre ces sujets et les sujets plus jeunes. Cependant, une plus grande sensibilité de certaines personnes âgées ne peut être exclue.
Aucun ajustement posologique n'est nécessaire en fonction de l'âge (voir PHARMACOLOGIE CLINIQUE chez l'adulte , Pharmacocinétique ). Ce médicament est connu pour être en grande partie excrété par les reins et le risque de réactions toxiques à ce médicament peut être plus élevé chez les patients présentant une insuffisance rénale. Étant donné que les patients âgés sont plus susceptibles d'avoir une fonction rénale diminuée, des précautions doivent être prises lors du choix de la dose et il peut être utile de surveiller la fonction rénale. Un ajustement posologique en cas d'insuffisance rénale modérée ou sévère est nécessaire (voir PRÉCAUTIONS , Patients présentant une insuffisance rénale modérée ou sévère et DOSAGE ET ADMINISTRATION , Ajustement posologique chez les patients présentant une insuffisance rénale modérée ou sévère ).
SURDOSAGE
Les effets indésirables dans les cas de surdosage sont similaires aux effets indésirables rencontrés dans l'expérience clinique normale (voir EFFETS INDÉSIRABLES ). Des doses orales allant jusqu'à 640 mg/jour ont été administrées à des patients adultes présentant des états pathologiques d'hypersécrétion sans effets indésirables graves. En cas de surdosage, le traitement doit être symptomatique et de soutien. Le matériel non absorbé doit être retiré du tractus gastro-intestinal, le patient doit être surveillé et un traitement de soutien doit être utilisé.
La DL50 orale de la famotidine chez les rats et les souris mâles et femelles était supérieure à 3 000 mg/kg et la dose orale aiguë létale minimale chez le chien dépassait 2 000 mg/kg. La famotidine n'a pas produit d'effets manifestes à des doses orales élevées chez la souris, le rat, le chat et le chien, mais a induit une anorexie et un retard de croissance significatifs chez le lapin à partir de 200 mg/kg/jour par voie orale. La DL50 intraveineuse de la famotidine pour les souris et les rats variait de 254 à 563 mg/kg et la dose intraveineuse unique létale minimale chez le chien était d'environ 300 mg/kg. Les signes d'intoxication aiguë chez les chiens traités par IV étaient des vomissements, de l'agitation, une pâleur des muqueuses ou une rougeur de la bouche et des oreilles, une hypotension, une tachycardie et un collapsus.
CONTRE-INDICATIONS
Hypersensibilité à l'un des composants de ces produits. Une sensibilité croisée dans cette classe de composés a été observée. Par conséquent, PEPCID 40 mg ne doit pas être administré aux patients ayant des antécédents d'hypersensibilité à d'autres antagonistes des récepteurs H2.
PHARMACOLOGIE CLINIQUE
Pharmacologie clinique chez l'adulte
Effets GI
PEPCID est un inhibiteur compétitif des récepteurs H2 de l'histamine. La principale activité pharmacologique cliniquement importante de PEPCID 40 mg est l'inhibition de la sécrétion gastrique. La concentration d'acide et le volume de la sécrétion gastrique sont tous deux supprimés par PEPCID, tandis que les modifications de la sécrétion de pepsine sont proportionnelles au volume de sortie.
Chez les volontaires normaux et hypersécréteurs, PEPCID 20mg a inhibé la sécrétion gastrique basale et nocturne, ainsi que la sécrétion stimulée par les aliments et la pentagastrine. Après administration orale, le début de l'effet antisécrétoire s'est produit dans l'heure qui suit; l'effet maximal était dose-dépendant, survenant en une à trois heures. La durée d'inhibition de la sécrétion par des doses de 20 et 40 mg était de 10 à 12 heures.
Des doses orales uniques en soirée de 20 et 40 mg ont inhibé la sécrétion acide basale et nocturne chez tous les sujets; la sécrétion nocturne moyenne d'acide gastrique a été inhibée de 86 % et 94 %, respectivement, pendant une période d'au moins 10 heures. Les mêmes doses administrées le matin ont supprimé la sécrétion d'acide stimulée par les aliments chez tous les sujets. La suppression moyenne était de 76 % et 84 %, respectivement, 3 à 5 heures après l'administration, et de 25 % et 30 %, respectivement, 8 à 10 heures après l'administration. Chez certains sujets qui ont reçu la dose de 20 mg, cependant, l'effet antisécrétoire s'est dissipé en 6 à 8 heures. Il n'y a pas eu d'effet cumulatif avec des doses répétées. Le pH intragastrique nocturne a été augmenté par des doses du soir de 20 et 40 mg de PEPCID à des valeurs moyennes de 5,0 et 6,4, respectivement. Lorsque PEPCID 40 mg a été administré après le petit-déjeuner, le pH interdigestif basal diurne à 3 et 8 heures après 20 ou 40 mg de PEPCID 40 mg a été augmenté à environ 5.
PEPCID 40 mg a eu peu ou pas d'effet sur les taux de gastrine sérique à jeun ou postprandiaux. La vidange gastrique et la fonction pancréatique exocrine n'ont pas été affectées par PEPCID.
Autres effets
Les effets systémiques de PEPCID sur le SNC, les systèmes cardiovasculaire, respiratoire ou endocrinien n'ont pas été notés dans les études de pharmacologie clinique. De plus, aucun effet anti-androgène n'a été noté. (Voir EFFETS INDÉSIRABLES .) Les niveaux d'hormones sériques, y compris la prolactine, le cortisol, la thyroxine (T4) et la testostérone, n'ont pas été modifiés après le traitement avec PEPCID.
Pharmacocinétique
PEPCID 20 mg n'est pas complètement absorbé. La biodisponibilité des doses orales est de 40 à 45 %. La biodisponibilité peut être légèrement augmentée par les aliments ou légèrement diminuée par les antiacides; cependant, ces effets sont sans conséquence clinique. Le PEPCID subit un métabolisme de premier passage minimal. Après des doses orales, les concentrations plasmatiques maximales se produisent en 1 à 3 heures. Les niveaux plasmatiques après des doses multiples sont similaires à ceux après des doses uniques. Quinze à 20 % du PEPCID 20 mg dans le plasma est lié aux protéines. PEPCID a une demi-vie d'élimination de 2,5 à 3,5 heures. Le PEPCID est éliminé par voie rénale (65-70%) et métabolique (30-35%). La clairance rénale est de 250 à 450 mL/min, indiquant une certaine excrétion tubulaire. Vingt-cinq à 30 % d'une dose orale et 65 à 70 % d'une dose intraveineuse sont récupérés dans l'urine sous forme inchangée. Le seul métabolite identifié chez l'homme est le S-oxyde.
Il existe une relation étroite entre les valeurs de clairance de la créatinine et la demi-vie d'élimination du PEPCID. Chez les patients présentant une insuffisance rénale sévère, c'est-à-dire une clairance de la créatinine inférieure à 10 ml/min, la demi-vie d'élimination de PEPCID peut dépasser 20 heures et un ajustement de la dose ou des intervalles de dosage en cas d'insuffisance rénale modérée et sévère peut être nécessaire (voir PRÉCAUTIONS , DOSAGE ET ADMINISTRATION ).
Chez les patients âgés, il n'y a pas de changements cliniquement significatifs liés à l'âge dans la pharmacocinétique de PEPCID. Cependant, chez les patients âgés dont la fonction rénale est diminuée, la clairance du médicament peut être diminuée (voir PRÉCAUTIONS , Utilisation gériatrique ).
Etudes cliniques
L'ulcère duodénal
Dans une étude américaine multicentrique en double aveugle chez des patients ambulatoires atteints d'un ulcère duodénal confirmé par endoscopie, le PEPCID administré par voie orale a été comparé à un placebo. Comme le montre le tableau 1, 70 % des patients traités par PEPCID 40 mg hs étaient guéris à la semaine 4.
Les patients non guéris à la semaine 4 ont été poursuivis dans l'étude. À la semaine 8, 83 % des patients traités par PEPCID avaient guéri contre 45 % des patients traités par placebo. L'incidence de la cicatrisation des ulcères avec PEPCID était significativement plus élevée qu'avec le placebo à chaque instant sur la base de la proportion d'ulcères cicatrisés confirmés par endoscopie.
Dans cette étude, le délai de soulagement des douleurs diurnes et nocturnes était significativement plus court pour les patients recevant PEPCID que pour les patients recevant le placebo ; les patients recevant PEPCID ont également pris moins d'antiacides que les patients recevant le placebo.
Traitement d'entretien à long terme des ulcères duodénaux
PEPCID 40 mg, 20 mg pohs, a été comparé à un placebo hs comme traitement d'entretien dans deux études multicentriques en double aveugle portant sur des patients atteints d'ulcères duodénaux cicatrisés confirmés par endoscopie. Dans l'étude américaine, l'incidence d'ulcère observée dans les 12 mois chez les patients traités par placebo était 2,4 fois supérieure à celle observée chez les patients traités par PEPCID. Les 89 patients traités avec PEPCID avaient une incidence cumulée d'ulcères observés de 23,4 % par rapport à une incidence d'ulcères observée de 56,6 % chez les 89 patients recevant le placebo (p
Ulcère gastrique
Dans une étude multicentrique américaine et internationale en double aveugle chez des patients atteints d'ulcère gastrique bénin actif confirmé par endoscopie, PEPCID administré par voie orale 20 mg, 40 mg hs, a été comparé à un placebo hs Les antiacides étaient autorisés pendant les études, mais la consommation n'était pas significativement différente entre les groupes PEPCID et placebo. Comme le montre le tableau 2, l'incidence de la cicatrisation des ulcères (abandons comptés comme non cicatrisés) avec PEPCID 20 mg était statistiquement significativement meilleure que le placebo aux semaines 6 et 8 dans l'étude américaine, et aux semaines 4, 6 et 8 dans l'étude internationale, sur la base sur le nombre d'ulcères cicatrisés, confirmés par endoscopie.
Le temps nécessaire au soulagement complet de la douleur diurne et nocturne était statistiquement significativement plus court pour les patients recevant PEPCID 20 mg que pour les patients recevant le placebo ; cependant, dans aucune des deux études, il n'y avait de différence statistiquement significative dans la proportion de patients dont la douleur était soulagée à la fin de l'étude (semaine 8).
Reflux gastro-oesophagien (RGO)
PEPCID administré par voie orale a été comparé à un placebo dans une étude américaine qui a recruté des patients présentant des symptômes de RGO et sans preuve endoscopique d'érosion ou d'ulcération de l'œsophage. Le PEPCID 20 mg bid était statistiquement significativement supérieur à 40 mg hs et au placebo pour fournir un résultat symptomatique positif, défini comme une amélioration modérée ou excellente des symptômes (Tableau 3).
Après deux semaines de traitement, un succès symptomatique a été observé chez un plus grand pourcentage de patients prenant PEPCID 20 mg bid par rapport au placebo (p ≤ 0,01).
L'amélioration symptomatique et la cicatrisation de l'érosion et de l'ulcération vérifiées par endoscopie ont été étudiées dans deux essais supplémentaires. La guérison a été définie comme la résolution complète de toutes les érosions ou ulcérations visibles à l'endoscopie. L'étude américaine comparant PEPCID 40 mg pobid à un placebo et PEPCID 20 mg pobid a montré un pourcentage significativement plus élevé de guérison pour PEPCID 40 mg bid aux semaines 6 et 12 (Tableau 4).
Par rapport au placebo, les patients qui ont reçu PEPCID ont eu un soulagement plus rapide des brûlures d'estomac diurnes et nocturnes et un plus grand pourcentage de patients ont connu un soulagement complet des brûlures d'estomac nocturnes. Ces différences étaient statistiquement significatives.
Dans l'étude internationale, lorsque PEPCID 40 mg pobid a été comparé à la ranitidine 150 mg pobid, un pourcentage de guérison statistiquement significativement plus élevé a été observé avec PEPCID 40 mg bid à la semaine 12 (Tableau 5). Il n'y avait, cependant, aucune différence significative entre les traitements dans le soulagement des symptômes.
Conditions hypersécrétoires pathologiques (p. ex., syndrome de Zollinger-Ellison, adénomes endocriniens multiples)
Dans des études portant sur des patients atteints d'hypersécrétions pathologiques telles que le syndrome de Zollinger-Ellison avec ou sans adénomes endocriniens multiples, le PEPCID a significativement inhibé la sécrétion d'acide gastrique et contrôlé les symptômes associés. Des doses administrées par voie orale de 20 à 160 mg q 6 h ont maintenu la sécrétion acide basale en dessous de 10 mEq/h ; les doses initiales ont été adaptées aux besoins individuels du patient et des ajustements ultérieurs ont été nécessaires avec le temps chez certains patients. PEPCID 40 mg a été bien toléré à ces doses élevées pendant des périodes prolongées (supérieures à 12 mois) chez huit patients, et aucun cas de gynécomastie, d'augmentation des taux de prolactine ou d'impuissance considérés comme dus au médicament n'a été signalé.
Pharmacologie clinique chez les patients pédiatriques
Pharmacocinétique
Le tableau 6 présente les données pharmacocinétiques d'essais cliniques et d'une étude publiée chez des patients pédiatriques (
La clairance plasmatique est réduite et la demi-vie d'élimination est prolongée chez les patients pédiatriques âgés de 0 à 3 mois par rapport aux patients pédiatriques plus âgés. Les paramètres pharmacocinétiques pour les patients pédiatriques, âgés de > 3 mois à 15 ans, sont comparables à ceux obtenus pour les adultes.
Les études de biodisponibilité de 8 patients pédiatriques (âgés de 11 à 15 ans) ont montré une biodisponibilité orale moyenne de 0,5 par rapport aux valeurs adultes de 0,42 à 0,49. Des doses orales de 0,5 mg/kg ont atteint des ASC de 645 ± 249 ng-h/mL et 580 ± 60 ng-h/mL chez les patients pédiatriques de
Pharmacodynamie
La pharmacodynamie de la famotidine a été évaluée chez 5 patients pédiatriques âgés de 2 à 13 ans à l'aide du modèle sigmoïde Emax. Ces données suggèrent que la relation entre la concentration sérique de famotidine et la suppression de l'acide gastrique est similaire à celle observée dans une étude chez l'adulte (tableau 7).
Cinq études publiées (tableau 8) ont examiné l'effet de la famotidine sur le pH gastrique et la durée de la suppression de l'acide chez les patients pédiatriques. Bien que chaque étude ait une conception différente, les données sur la suppression de l'acide au fil du temps sont résumées comme suit :
Une étude a montré que la durée de l'effet de la famotidine IV 0,5 mg/kg sur le pH gastrique et la suppression de l'acidité était plus longue chez les patients pédiatriques âgés de
INFORMATIONS PATIENTS
Aucune information fournie. Veuillez vous référer au PRÉCAUTIONS section.
