Imodium 2mg Loperamide Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce qu'Imodium 2 mg et comment est-il utilisé ?
Imodium 2 mg est un médicament sur ordonnance utilisé pour traiter les symptômes de la diarrhée aiguë, de la diarrhée chronique et de la diarrhée du voyageur. Imodium peut être utilisé seul ou avec d'autres médicaments.
Imodium appartient à une classe de médicaments appelés antidiarrhéiques.
Quels sont les effets secondaires possibles d'Imodium ?
Imodium peut provoquer des effets secondaires graves, notamment :
- diarrhée aqueuse ou sanglante,
- douleurs à l'estomac ou ballonnements,
- diarrhée persistante ou qui s'aggrave,
- battements de cœur rapides ou battants,
- flottant dans ta poitrine,
- essoufflement, et
- étourdissement
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants d'Imodium comprennent:
- constipation,
- vertiges,
- somnolence,
- des nausées et
- des crampes d'estomac
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles d'Imodium. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
LA DESCRIPTION
IMODIUM® (chlorhydrate de lopéramide), 4-(p-chlorophényl)-4-hydroxy-N,N-diméthyl- a, a-diphényl-1-pipéridinebutyramide monochlorhydrate, est un antidiarrhéique synthétique à usage oral.
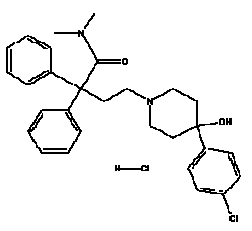
IMODIUM® (chlorhydrate de lopéramide) est disponible en gélules de 2 mg.
Les ingrédients inactifs sont : Lactose, amidon de maïs, talc et stéarate de magnésium. Les gélules IMODIUM® (chlorhydrate de lopéramide) contiennent FD&C jaune n° 6.
LES INDICATIONS
IMODIUM® (chlorhydrate de lopéramide) est indiqué pour le contrôle et le soulagement symptomatique de la diarrhée aiguë non spécifique et de la diarrhée chronique associée aux maladies inflammatoires de l'intestin. IMODIUM® (chlorhydrate de lopéramide) est également indiqué pour réduire le volume d'écoulement des iléostomies.
DOSAGE ET ADMINISTRATION
(1 gélule = 2 mg)
Les patients doivent recevoir un remplacement hydrique et électrolytique approprié au besoin.
Diarrhée aiguë
Adultes: La dose initiale recommandée est de 4 mg (deux gélules) suivie de 2 mg (une gélule) après chaque selle non formée. La dose quotidienne ne doit pas dépasser 16 mg (huit gélules). L'amélioration clinique est généralement observée dans les 48 heures.
Enfants: Chez les enfants de 2 à 5 ans (20 kg ou moins), la formulation liquide sans ordonnance (IMODIUM® (chlorhydrate de lopéramide) AD 1 mg/5 ml) doit être utilisée ; pour les enfants de 6 à 12 ans, les capsules IMODIUM® (chlorhydrate de lopéramide) ou le liquide AD IMODIUM® (chlorhydrate de lopéramide) peuvent être utilisés. Pour les enfants de 2 à 12 ans, le calendrier suivant pour les gélules ou le liquide répondra généralement aux exigences de dosage initiales :
Schéma posologique recommandé pour le premier jour
Deux à cinq ans : 1 mg tid (dose quotidienne de 3 mg) (13 à 20 kg) Six à huit ans : 2 mg bid (dose quotidienne de 4 mg) (20 à 30 kg) Huit à douze ans : 2 mg tid (dose quotidienne de 6 mg) (plus de 30 kg )
Dose quotidienne ultérieure recommandée
Après le premier jour de traitement, il est recommandé que les doses ultérieures d'IMODIUM® (chlorhydrate de lopéramide) (1 mg/10 kg de poids corporel) ne soient administrées qu'après des selles molles. La dose quotidienne totale ne doit pas dépasser les doses recommandées pour le premier jour.
Diarrhée chronique
Enfants: Bien qu'IMODIUM® (chlorhydrate de lopéramide) ait été étudié chez un nombre limité d'enfants souffrant de diarrhée chronique ; la dose thérapeutique pour le traitement de la diarrhée chronique dans une population pédiatrique n'a pas été établie.
Adultes: La dose initiale recommandée est de 4 mg (deux gélules) suivie de 2 mg (une gélule) après chaque selle non formée jusqu'à ce que la diarrhée soit maîtrisée, après quoi la posologie d'IMODIUM® (chlorhydrate de lopéramide) doit être réduite pour répondre aux besoins individuels. Lorsque la posologie quotidienne optimale a été établie, cette quantité peut alors être administrée en une dose unique ou en doses fractionnées.
La dose d'entretien quotidienne moyenne dans les essais cliniques était de 4 à 8 mg (deux à quatre gélules). Une posologie de 16 mg (huit gélules) était rarement dépassée. Si aucune amélioration clinique n'est observée après un traitement par 16 mg par jour pendant au moins 10 jours, il est peu probable que les symptômes soient contrôlés par une administration supplémentaire. L'administration d'IMODIUM® (chlorhydrate de lopéramide) peut être poursuivie si la diarrhée ne peut pas être contrôlée de manière adéquate par un régime alimentaire ou un traitement spécifique.
Enfants de moins de 2 ans
L'utilisation d'IMODIUM (chlorhydrate de lopéramide) chez les enfants de moins de 2 ans est déconseillée. De rares cas d'iléus paralytique associés à une distension abdominale ont été rapportés. La plupart de ces rapports sont survenus dans le cadre d'une dysenterie aiguë, d'une surdose et de très jeunes enfants de moins de deux ans.
Âgé
Aucune étude pharmacocinétique formelle n'a été menée chez des sujets âgés. Cependant, aucune différence majeure n'a été signalée dans l'élimination des médicaments chez les patients âgés souffrant de diarrhée par rapport aux patients jeunes. Aucun ajustement posologique n'est nécessaire chez les personnes âgées.
Insuffisance rénale
Aucune donnée pharmacocinétique n'est disponible chez les patients insuffisants rénaux. Étant donné que les métabolites et le médicament inchangé sont principalement excrétés dans les selles, aucun ajustement posologique n'est nécessaire chez les patients insuffisants rénaux (voir Rubrique PRÉCAUTIONS ).
Insuffisance hépatique
Bien qu'aucune donnée pharmacocinétique ne soit disponible chez les patients atteints d'insuffisance hépatique, IMODIUM (chlorhydrate de lopéramide) doit être utilisé avec prudence chez ces patients en raison d'un métabolisme de premier passage réduit. (voir PRÉCAUTIONS ).
COMMENT FOURNIE
Gélules - chaque gélule contient 2 mg de chlorhydrate de lopéramide. Les gélules ont un corps vert clair et un capuchon vert foncé portant l'inscription « JANSSEN » sur un segment et « IMODIUM » sur l'autre segment. Les gélules d'IMODIUM® (chlorhydrate de lopéramide) sont fournies en flacons de 100.
NDC 50458-400-10.........(100 CAPSULES)
Conserver à 15°-25°C (59°-77°F).
Janssen Pharmaceutica Inc. Révisé en septembre 1996, juillet 1998. Date de révision FDA : 21/10/2005
EFFETS SECONDAIRES
Données d'essais cliniques
Les effets indésirables rapportés lors des investigations cliniques d'IMODIUM® (chlorhydrate de lopéramide) sont difficiles à distinguer des symptômes associés au syndrome diarrhéique. Les effets indésirables enregistrés au cours des études cliniques avec IMODIUM® (chlorhydrate de lopéramide) étaient généralement de nature mineure et spontanément résolutive. Ils ont été plus fréquemment observés lors du traitement d'une diarrhée chronique.
Les événements indésirables signalés sont résumés indépendamment de l'évaluation de la causalité par les investigateurs.
1) Evénements indésirables issus de 4 études contrôlées versus placebo chez des patients atteints de diarrhée aiguë Les événements indésirables avec une incidence de 1,0 % ou plus, qui ont été rapportés au moins aussi souvent chez les patients sous chlorhydrate de lopéramide que sous placebo, sont présentés dans le tableau ci-dessous.
Les événements indésirables avec une incidence de 1,0 % ou plus, qui ont été plus fréquemment rapportés chez les patients sous placebo que sous chlorhydrate de lopéramide, ont été : bouche sèche, flatulences, crampes abdominales et coliques.
2) Événements indésirables de 20 études contrôlées par placebo chez des patients souffrant de diarrhée chronique
Les événements indésirables avec une incidence de 1,0 % ou plus, qui ont été signalés au moins aussi souvent chez les patients sous chlorhydrate de lopéramide que sous placebo, sont présentés ci-dessous dans le tableau ci-dessous.
Les événements indésirables avec une incidence de 1,0 % ou plus, qui ont été plus fréquemment rapportés chez les patients sous placebo que sous chlorhydrate de lopéramide ont été : nausées, vomissements, céphalées, météorisme, douleurs abdominales, crampes abdominales et coliques.
3) Événements indésirables de soixante-seize études contrôlées et non contrôlées chez des patients souffrant de diarrhée aiguë ou chronique
Les événements indésirables avec une incidence de 1,0 % ou plus chez les patients de toutes les études sont présentés dans le tableau ci-dessous.
Expérience post-commercialisation
Les événements indésirables suivants ont été signalés :
Affections de la peau et du tissu sous-cutané
Des éruptions cutanées, du prurit, de l'urticaire, un œdème de Quincke et des cas extrêmement rares d'éruption bulleuse, y compris l'érythème polymorphe, le syndrome de Stevens-Johnson et la nécrolyse épidermique toxique, ont été signalés avec l'utilisation d'IMODIUM (chlorhydrate de lopéramide).
Troubles du système immunitaire
Des cas isolés de réactions allergiques et, dans certains cas, de graves réactions d'hypersensibilité, notamment un choc anaphylactique et des réactions anaphylactoïdes, ont été signalés avec l'utilisation d'IMODIUM (chlorhydrate de lopéramide).

Problèmes gastro-intestinaux
Bouche sèche, douleurs abdominales, distension ou inconfort, nausées, vomissements, flatulences, dyspepsie, constipation, iléus paralytique, mégacôlon, y compris mégacôlon toxique (voir CONTRE-INDICATIONS et MISES EN GARDE ).
Troubles rénaux et urinaires
Rétention urinaire
Troubles du système nerveux
Somnolence, vertiges
Troubles généraux et conditions du site administratif
Fatigue
Un certain nombre d'effets indésirables rapportés au cours des investigations cliniques et de l'expérience post-commercialisation du lopéramide sont des symptômes fréquents du syndrome diarrhéique sous-jacent (douleur/gêne abdominale, nausées, vomissements, bouche sèche, fatigue, somnolence, étourdissements, constipation et flatulences). . Ces symptômes sont souvent difficiles à distinguer des effets indésirables des médicaments.
Toxicomanie et dépendance
Abuser de
Une étude clinique spécifique conçue pour évaluer le potentiel d'abus du lopéramide à fortes doses a abouti à la découverte d'un potentiel d'abus extrêmement faible.
Dépendance
Des études chez des singes dépendants de la morphine ont démontré que le chlorhydrate de lopéramide à des doses supérieures à celles recommandées pour l'homme prévenait les signes de sevrage de la morphine. Cependant, chez l'homme, le test pupillaire de provocation à la naloxone, qui lorsqu'il est positif indique des effets de type opiacé, effectué après une seule dose élevée, ou après plus de deux ans d'utilisation thérapeutique d'IMODIUM® (chlorhydrate de lopéramide), s'est avéré négatif. IMODIUM® (chlorhydrate de lopéramide) administré par voie orale (lopéramide formulé avec du stéarate de magnésium) est à la fois hautement insoluble et pénètre mal dans le SNC.
INTERACTIONS MÉDICAMENTEUSES
Des données non cliniques ont montré que le lopéramide est un substrat de la glycoprotéine P. L'administration concomitante de lopéramide (dose unique de 16 mg) avec une dose unique de 600 mg de quinidine ou de ritonavir, qui sont tous deux des inhibiteurs de la glycoprotéine P, a entraîné une augmentation de 2 à 3 fois des taux plasmatiques de lopéramide. En raison du potentiel d'augmentation des effets centraux lorsque le lopéramide est co-administré avec la quinidine et le ritonavir, la prudence s'impose lorsque le lopéramide est administré aux doses recommandées (2 mg, jusqu'à 16 mg de dose quotidienne maximale) avec des inhibiteurs de la glycoprotéine P.
Lorsqu'une dose unique de 16 mg de lopéramide est co-administrée avec une dose unique de 600 mg de saquinavir, le lopéramide a diminué l'exposition au saquinavir de 54 %, ce qui peut avoir une pertinence clinique en raison de la réduction de l'efficacité thérapeutique du saquinavir. L'effet du saquinavir sur le lopéramide est moins significatif sur le plan clinique. Par conséquent, lorsque le lopéramide est administré avec du saquinavir, l'efficacité thérapeutique du saquinavir doit être étroitement surveillée.
AVERTISSEMENTS
Une déplétion hydrique et électrolytique survient souvent chez les patients souffrant de diarrhée. Dans de tels cas, l'administration de liquide et d'électrolytes appropriés est très importante. L'utilisation d'IMODIUM® (chlorhydrate de lopéramide) n'exclut pas la nécessité d'une thérapie liquidienne et électrolytique appropriée.
En général, IMODIUM (chlorhydrate de lopéramide) ne doit pas être utilisé lorsque l'inhibition du péristaltisme doit être évitée en raison du risque possible de séquelles importantes, notamment d'iléus, de mégacôlon et de mégacôlon toxique. IMODIUM (chlorhydrate de lopéramide) doit être interrompu rapidement en cas de constipation, de distension abdominale ou d'iléus.
Le traitement de la diarrhée par IMODIUM (chlorhydrate de lopéramide) est uniquement symptomatique. Chaque fois qu'une étiologie sous-jacente peut être déterminée, un traitement spécifique doit être administré le cas échéant (ou lorsqu'il est indiqué).
Les patients atteints du SIDA traités par IMODIUM (chlorhydrate de lopéramide) pour la diarrhée doivent arrêter le traitement dès les premiers signes de distension abdominale. Il y a eu des cas isolés de mégacôlon toxique chez des patients atteints du SIDA atteints de colite infectieuse due à la fois à des agents pathogènes viraux et bactériens traités avec du chlorhydrate de lopéramide. {réf EDMS-PSDB-2564186, page 12}
IMODIUM® (chlorhydrate de lopéramide) doit être utilisé avec une prudence particulière chez les jeunes enfants en raison de la plus grande variabilité de la réponse dans ce groupe d'âge. La déshydratation, en particulier chez les jeunes enfants, peut influencer davantage la variabilité de la réponse à IMODIUM® (chlorhydrate de lopéramide).
PRÉCAUTIONS
Général
Des réactions allergiques extrêmement rares, y compris l'anaphylaxie et le choc anaphylactique, ont été signalées. En cas de diarrhée aiguë, si aucune amélioration clinique n'est observée dans les 48 heures, l'administration d'IMODIUM® (chlorhydrate de lopéramide) doit être interrompue et les patients doivent être invités à consulter leur médecin. Bien qu'aucune donnée pharmacocinétique ne soit disponible chez les patients atteints d'insuffisance hépatique, IMODIUM (chlorhydrate de lopéramide) doit être utilisé avec prudence chez ces patients en raison d'un métabolisme de premier passage réduit. Les patients présentant un dysfonctionnement hépatique doivent être étroitement surveillés afin de détecter tout signe de toxicité sur le SNC. Aucune donnée pharmacocinétique n'est disponible chez les patients insuffisants rénaux. Puisqu'il a été rapporté que la majorité du médicament est métabolisée et que les métabolites ou le médicament inchangé sont excrétés principalement dans les fèces, des ajustements posologiques chez les patients atteints d'insuffisance rénale ne sont pas nécessaires. Aucune étude formelle n'a été menée pour évaluer la pharmacocinétique du lopéramide chez les sujets âgés. Cependant, dans deux études portant sur des patients âgés, il n'y avait pas de différences majeures dans la disposition des médicaments chez les patients âgés souffrant de diarrhée par rapport aux patients jeunes.
Carcinogenèse, mutagenèse, altération de la fertilité
Dans une étude de 18 mois chez le rat avec des doses orales allant jusqu'à 40 mg/kg/jour (21 fois la dose humaine maximale de 16 mg/jour, basée sur une comparaison de la surface corporelle), il n'y a eu aucun signe de carcinogenèse.
Le lopéramide n'était pas génotoxique dans le test d'Ames, le chromotest SOS dans E. coli, le test de létalité dominante chez les souris femelles ou le test de transformation des cellules embryonnaires de souris.
La fertilité et la performance reproductive ont été évaluées chez des rats à l'aide de doses orales de 2,5, 10 et 40 mg/kg/jour dans une étude, et de 1, 5, 10, 20 et 40 mg/kg/jour (femelles uniquement) dans une seconde étude. L'administration orale de 20 mg/kg/jour (environ 11 fois la dose humaine sur la base d'une comparaison de la surface corporelle) et plus a produit une forte altération de la fertilité féminine. Le traitement de rats femelles avec jusqu'à 10 mg/kg/jour po (environ 5 fois la dose humaine basée sur une comparaison de la surface corporelle) n'a eu aucun effet sur la fertilité. Le traitement de rats mâles avec 40 mg/kg/jour po (environ 21 fois la dose humaine sur la base d'une comparaison de la surface corporelle) a produit une altération de la fertilité mâle, alors que l'administration de jusqu'à 10 mg/kg/jour (environ 5 fois la dose humaine dose basée sur une comparaison de la surface corporelle) n'a eu aucun effet.
Grossesse
Effets tératogènes Catégorie de grossesse C
Des études de tératologie ont été réalisées chez des rats à des doses orales de 2,5, 10 et 40 mg/kg/jour et chez des lapins à des doses orales de 5, 20 et 40 mg/kg/jour. Ces études n'ont révélé aucun signe d'altération de la fertilité ou d'effet nocif sur le fœtus à des doses allant jusqu'à 10 mg/kg/jour chez le rat (5 fois la dose humaine sur la base d'une comparaison de la surface corporelle) et 40 mg/kg/jour chez le lapin (43 fois la dose humaine basée sur la comparaison de la surface corporelle). Le traitement de rats avec 40 mg/kg/jour po (21 fois la dose humaine sur la base d'une comparaison de la surface corporelle) a produit une altération marquée de la fertilité. Les études n'ont produit aucune preuve d'activité tératogène. Il n'y a pas d'études adéquates et bien contrôlées chez les femmes enceintes. Le lopéramide ne doit être utilisé pendant la grossesse que si le bénéfice potentiel justifie le risque potentiel pour le fœtus.
Effets non tératogènes
Dans une étude de reproduction périnatale et postnatale chez le rat, l'administration orale de 40 mg/kg/jour a entraîné une altération de la croissance et de la survie de la progéniture.
Mères allaitantes
De petites quantités de lopéramide peuvent apparaître dans le lait maternel humain. Par conséquent, IMODIUM (chlorhydrate de lopéramide) est déconseillé pendant l'allaitement.
Utilisation pédiatrique
Voir le " AVERTISSEMENTS " Section d'information sur la plus grande variabilité de la réponse dans ce groupe d'âge.
En cas de surdosage accidentel d'IMODIUM® par des enfants, voir " SURDOSAGE " Section pour le traitement suggéré.
SURDOSAGE
En cas de surdosage (y compris un surdosage relatif dû à un dysfonctionnement hépatique), une rétention urinaire, un iléus paralytique et une dépression du SNC peuvent survenir. Les enfants peuvent être plus sensibles aux effets sur le SNC que les adultes. Des essais cliniques ont démontré qu'une bouillie de charbon actif administrée rapidement après l'ingestion de chlorhydrate de lopéramide peut réduire jusqu'à neuf fois la quantité de médicament absorbée dans la circulation systémique. Si des vomissements surviennent spontanément lors de l'ingestion, une bouillie de 100 g de charbon actif doit être administrée par voie orale dès que les liquides peuvent être retenus.
S'il n'y a pas eu de vomissements, un lavage gastrique doit être effectué suivi de l'administration de 100 g de suspension de charbon actif par le tube gastrique. En cas de surdosage, les patients doivent être surveillés pour déceler des signes de dépression du SNC pendant au moins 24 heures.
Si des symptômes de surdosage apparaissent, la naloxone peut être administrée comme antidote. En cas de réponse à la naloxone, les signes vitaux doivent être surveillés attentivement pour la récurrence des symptômes de surdosage pendant au moins 24 heures après la dernière dose de naloxone.
Compte tenu de l'action prolongée du lopéramide et de la courte durée (une à trois heures) de la naloxone, le patient doit être étroitement surveillé et traité à plusieurs reprises par la naloxone selon les indications. Puisque relativement peu de médicament est excrété dans l'urine, la diurèse forcée ne devrait pas être efficace en cas de surdosage avec IMODIUM® (chlorhydrate de lopéramide).
Dans les essais cliniques, un adulte qui a pris trois doses de 20 mg sur une période de 24 heures a eu des nausées après la deuxième dose et a vomi après la troisième dose. Dans les études conçues pour examiner le potentiel d'effets secondaires, l'ingestion intentionnelle de jusqu'à 60 mg de chlorhydrate de lopéramide en une seule dose chez des sujets sains n'a entraîné aucun effet indésirable significatif.
CONTRE-INDICATIONS
IMODIUM (chlorhydrate de lopéramide) est contre-indiqué chez les patients présentant une hypersensibilité connue au chlorhydrate de lopéramide ou à l'un des excipients.
IMODIUM (chlorhydrate de lopéramide) est contre-indiqué chez les patients souffrant de douleurs abdominales en l'absence de diarrhée.
IMODIUM (chlorhydrate de lopéramide) n'est pas recommandé chez les nourrissons de moins de 24 mois.
IMODIUM (chlorhydrate de lopéramide) ne doit pas être utilisé comme traitement principal :
- chez les patients atteints de dysenterie aiguë, qui se caractérise par du sang dans les selles et une forte fièvre,
- chez les patients atteints de rectocolite hémorragique aiguë,
chez les patients atteints d'entérocolite bactérienne causée par des organismes invasifs tels que Salmonella, Shigella et Campylobacter,
- chez les patients atteints de colite pseudomembraneuse associée à l'utilisation d'antibiotiques à large spectre.
PHARMACOLOGIE CLINIQUE
Des études in vitro et animales montrent qu'IMODIUM® (chlorhydrate de lopéramide) agit en ralentissant la motilité intestinale et en affectant le mouvement de l'eau et des électrolytes dans l'intestin. Le lopéramide se lie au récepteur opiacé dans la paroi intestinale. Par conséquent, il inhibe la libération d'acétylcholine et de prostaglandines, réduisant ainsi le péristaltisme et augmentant le temps de transit intestinal. Le lopéramide augmente le tonus du sphincter anal, réduisant ainsi l'incontinence et l'urgence.
Chez l'homme, IMODIUM® (chlorhydrate de lopéramide) prolonge le temps de transit du contenu intestinal. Il réduit le volume fécal quotidien, augmente la viscosité et la densité apparente et diminue la perte de liquide et d'électrolytes. Aucune tolérance à l'effet antidiarrhéique n'a été observée. Des études cliniques ont indiqué que la demi-vie d'élimination apparente du lopéramide chez l'homme est de 10,8 heures avec une fourchette de 9,1 à 14,4 heures. Les taux plasmatiques de médicament inchangé restent inférieurs à 2 nanogrammes par mL après la prise d'une gélule de 2 mg d'IMODIUM® (chlorhydrate de lopéramide). Les taux plasmatiques sont les plus élevés environ cinq heures après l'administration de la capsule et 2,5 heures après l'administration du liquide. Les concentrations plasmatiques maximales de lopéramide étaient similaires pour les deux formulations. L'élimination du lopéramide se produit principalement par N-déméthylation oxydative. On pense que les isozymes du cytochrome P450 (CYP450), CYP2C8 et CYP3A4, jouent un rôle important dans le processus de N-déméthylation du lopéramide puisque la quercétine (inhibiteur du CYP2C8) et le kétoconazole (inhibiteur du CYP3A4) inhibent de manière significative le processus de N-déméthylation in vitro de 40% et 90 %, respectivement. De plus, le CYP2B6 et le CYP2D6 semblent jouer un rôle mineur dans la N-déméthylation du lopéramide. L'excrétion du lopéramide inchangé et de ses métabolites se produit principalement par les fèces. Chez les patients dont les paramètres biochimiques et hématologiques ont été surveillés au cours des essais cliniques, aucune tendance vers une anomalie pendant le traitement par IMODIUM® (chlorhydrate de lopéramide) n'a été notée. De même, les analyses d'urine, l'électrocardiogramme et les examens ophtalmologiques cliniques n'ont pas montré de tendance à l'anomalie.
INFORMATIONS PATIENTS
Les patients doivent être avisés de consulter leur médecin si leur diarrhée ne s'améliore pas dans les 48 heures ou s'ils remarquent du sang dans leurs selles, développent de la fièvre ou développent une distension abdominale.
De la fatigue, des étourdissements ou de la somnolence peuvent survenir dans le cadre de syndromes diarrhéiques traités par IMODIUM (chlorhydrate de lopéramide). Par conséquent, il est conseillé de faire preuve de prudence lors de la conduite d'une voiture ou de l'utilisation de machines. (voir EFFETS INDÉSIRABLES ).
