Aciphex 10mg, 20mg Rabeprazole Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce qu'Aciphex 10 mg et comment est-il utilisé ?
Aciphex 10 mg est un médicament délivré sur ordonnance utilisé pour traiter les symptômes du reflux gastro-oesophagien (RGO), Helicobacter Pylori et les ulcères intestinaux. Aciphex 10 mg peut être utilisé seul ou avec d'autres médicaments.
Aciphex est un inhibiteur de la pompe à protons.
On ne sait pas si Aciphex 20 mg comprimé à libération retardée est sûr et efficace chez les enfants de moins de 12 ans. On ne sait pas si Aciphex 10 mg, comprimé à libération retardée (sprinkles) est sûr et efficace chez les enfants de moins de 1 an.
Quels sont les effets secondaires possibles d'Aciphex 10mg ?
Aciphex peut provoquer des effets secondaires graves, notamment :
- fortes douleurs à l'estomac,
- diarrhée sanglante,
- douleur soudaine ou difficulté à bouger la hanche, le poignet ou le dos,
- saisie (convulsions),
- uriner moins que d'habitude,
- du sang dans vos urines,
- gonflement,
- prise de poids rapide,
- douleur articulaire,
- éruption cutanée sur les joues ou les bras aggravée par la lumière du soleil,
- vertiges,
- rythme cardiaque rapide ou irrégulier,
- mouvements musculaires secouant ou saccadés (tremblements),
- se sentir nerveux,
- crampes ou spasmes musculaires dans les mains ou les pieds,
- toux,
- difficulté à avaler ou à s'étouffer,
- mal de tête,
- la faiblesse,
- ecchymoses,
- saignements inhabituels (saignements de nez, gencives),
- urine rouge ou rose,
- flux menstruel abondant,
- selles sanglantes ou goudronneuses,
- crachats de sang ou de vomi ressemblant à du marc de café,
- saignement difficile à contrôler,
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants d'Aciphex comprennent :
- mal de tête,
- nausée,
- vomissement,
- diarrhée,
- constipation,
- Douleur d'estomac,
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles d'Aciphex. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
LA DESCRIPTION
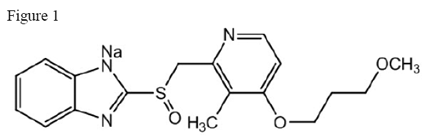
Le principe actif des comprimés à libération retardée ACIPHEX 20 mg est le rabéprazole sodique, qui est un inhibiteur de la pompe à protons. Il s'agit d'un benzimidazole substitué connu chimiquement sous le nom de sel de sodium de 2-[[[4-(3méthoxypropoxy)-3-méthyl-2-pyridinyl]-méthyl]sulfinyl]-1H–benzimidazole. Il a une formule empirique de C18H20N3NaO3S et un poids moléculaire de 381,42. Le rabéprazole sodique est un solide blanc à blanc légèrement jaunâtre. Il est très soluble dans l'eau et le méthanol, librement soluble dans l'éthanol, le chloroforme et l'acétate d'éthyle et insoluble dans l'éther et le n-hexane. La stabilité du rabéprazole sodique est fonction du pH ; il se dégrade rapidement en milieu acide et est plus stable en milieu alcalin. La figure structurelle est:
ACIPHEX est disponible pour administration orale sous forme de comprimés entérosolubles à libération retardée contenant 20 mg de rabéprazole sodique.
Les ingrédients inactifs du comprimé de 20 mg sont la cire de carnauba, la crospovidone, les monoglycérides diacétylés, l'éthylcellulose, l'hydroxypropylcellulose, le phtalate d'hypromellose, le stéarate de magnésium, le mannitol, le propylèneglycol, l'hydroxyde de sodium, le stéarylfumarate de sodium, le talc et le dioxyde de titane. L'oxyde de fer jaune est le colorant de l'enrobage du comprimé. L'oxyde de fer rouge est le pigment de l'encre.
LES INDICATIONS
Guérison du RGO érosif ou ulcératif chez les adultes
ACIPHEX 20 mg comprimés à libération retardée est indiqué en traitement de courte durée (4 à 8 semaines) dans la cicatrisation et le soulagement symptomatique du reflux gastro-oesophagien (RGO) érosif ou ulcératif. Pour les patients qui n'ont pas guéri après 8 semaines de traitement, une cure supplémentaire de 8 semaines d'ACIPHEX peut être envisagée.
Entretien de la guérison du RGO érosif ou ulcératif chez les adultes
Les comprimés à libération retardée ACIPHEX sont indiqués pour le maintien de la cicatrisation et la réduction des taux de rechute des symptômes de brûlures d'estomac chez les patients atteints de reflux gastro-œsophagien érosif ou ulcératif (entretien du RGO). Les études contrôlées ne s'étendent pas au-delà de 12 mois.
Traitement du RGO symptomatique chez les adultes
ACIPHEX 20 mg comprimés à libération retardée est indiqué pour le traitement des brûlures d'estomac diurnes et nocturnes et d'autres symptômes associés au RGO chez l'adulte jusqu'à 4 semaines.
Guérison des ulcères duodénaux chez les adultes
Les comprimés à libération retardée ACIPHEX 20 mg sont indiqués pour le traitement à court terme (jusqu'à quatre semaines) dans la cicatrisation et le soulagement symptomatique des ulcères duodénaux. La plupart des patients guérissent en quatre semaines.
Éradication d'Helicobacter Pylori pour réduire le risque de récidive de l'ulcère duodénal chez l'adulte
Les comprimés à libération retardée ACIPHEX 10 mg, en association avec l'amoxicilline et la clarithromycine en tant que schéma thérapeutique à trois médicaments, sont indiqués pour le traitement des patients atteints d'une infection à H. pylori et d'un ulcère duodénal (actif ou ayant des antécédents au cours des 5 dernières années) pour éradiquer H. pylori . Il a été démontré que l'éradication de H. pylori réduit le risque de récidive de l'ulcère duodénal.
Chez les patients qui échouent au traitement, des tests de sensibilité doivent être effectués. Si une résistance à la clarithromycine est démontrée ou si les tests de sensibilité ne sont pas possibles, un traitement antimicrobien alternatif doit être institué [voir PHARMACOLOGIE CLINIQUE et les renseignements thérapeutiques complets pour la clarithromycine].
Traitement des états pathologiques d'hypersécrétion, y compris le syndrome de Zollinger-Ellison chez l'adulte
Les comprimés à libération retardée d'ACIPHEX sont indiqués pour le traitement à long terme des états pathologiques d'hypersécrétion, y compris le syndrome de Zollinger-Ellison.
Traitement du RGO symptomatique chez les patients adolescents de 12 ans et plus
Les comprimés à libération retardée ACIPHEX 20 mg sont indiqués pour le traitement du RGO symptomatique chez les adolescents de 12 ans et plus pendant une durée allant jusqu'à 8 semaines.
DOSAGE ET ADMINISTRATION
Le tableau 1 indique la posologie recommandée des comprimés à libération retardée ACIPHEX chez les adultes et les adolescents de 12 ans et plus. L'utilisation des comprimés à libération retardée d'ACIPHEX n'est pas recommandée chez les patients pédiatriques âgés de 1 an à moins de 12 ans, car le dosage le plus faible des comprimés disponibles (20 mg) dépasse la dose recommandée pour ces patients. Utiliser une autre formulation de rabéprazole pour les patients pédiatriques âgés de 1 an à moins de 12 ans.
Consignes administratives
- Avalez ACIPHEX 20 mg comprimés à libération retardée entiers. Ne pas mâcher, écraser ou diviser les comprimés.
- Pour le traitement des ulcères duodénaux, prendre les comprimés à libération retardée ACIPHEX après un repas.
- Pour l'éradication d'Helicobacter pylori, prendre les comprimés à libération retardée d'ACIPHEX 20 mg avec de la nourriture.
- Pour toutes les autres indications, ACIPHEX comprimés à libération retardée peut être pris avec ou sans aliments.
- Prenez une dose oubliée dès que possible. S'il est presque l'heure de la dose suivante, sautez la dose oubliée et reprenez l'horaire normal. Ne prenez pas deux doses en même temps.
COMMENT FOURNIE
Formes posologiques et points forts
Les comprimés à libération retardée ACIPHEX 10 mg sont fournis en un seul dosage, 20 mg. Les comprimés sont ronds, jaune clair, à enrobage entérique et biconvexes. « ACIPHEX 20 » est imprimé en rouge sur une face du comprimé.
Stockage et manutention
ACIPHEX 20 mg est fourni sous forme de comprimés entérosolubles jaune clair à libération retardée. Le nom et la concentration, en mg, (ACIPHEX 20) sont imprimés sur un côté.
Bouteilles de 30 ( CDN 69784-243-30)
Conserver à 25 °C (77 °F); excursions autorisées jusqu'à 15-30°C (59-86°F) [voir Température ambiante contrôlée USP ]. Protéger de l'humidité.
Distribué par Eisai Inc., Woodcliff Lake, NJ 07677. Révisé : mars 2022
EFFETS SECONDAIRES
Les effets indésirables graves suivants sont décrits ci-dessous et ailleurs dans l'étiquetage :
- Néphrite tubulo-interstitielle aiguë [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Diarrhée associée à Clostridium difficile [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Fracture osseuse [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Effets indésirables cutanés graves [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Lupus érythémateux cutané et disséminé [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Carence en cyanocobalamine (vitamine B-12) [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Hypomagnésémie et métabolisme minéral [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Polypes de la glande fundique [voir AVERTISSEMENTS ET PRECAUTIONS ]
Expérience des études cliniques
Étant donné que les essais cliniques sont menés dans des conditions variables, les taux d'effets indésirables observés dans les essais cliniques d'un médicament ne peuvent pas être directement comparés aux taux des essais cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique.
Adultes
Les données décrites ci-dessous reflètent l'exposition aux comprimés à libération retardée d'ACIPHEX chez 1064 patients adultes exposés jusqu'à 8 semaines. Les études étaient principalement des essais contrôlés contre placebo et contre comparateur actif chez des patients adultes atteints de reflux gastro-œsophagien érosif ou ulcéreux (RGO), d'ulcères duodénaux et d'ulcères gastriques. La population avait un âge moyen de 53 ans (fourchette de 18 à 89 ans) et avait un ratio d'environ 60 % d'hommes : 40 % de femmes. La répartition raciale était de 86 % de race blanche, 8 % d'afro-américains, 2 % d'asiatiques et 5 % d'autres. La plupart des patients ont reçu 10 mg, 20 mg ou 40 mg par jour d'ACIPHEX 20 mg comprimés à libération retardée.
Une analyse des effets indésirables apparaissant chez ≥ 2 % des patients traités par ACIPHEX 10 mg comprimés à libération retardée (n = 1064) et avec une fréquence supérieure à celle du placebo (n = 89) dans des essais contrôlés nord-américains et européens sur le traitement aigu, a révélé ce qui suit effets indésirables : douleur (3 % contre 1 %), pharyngite (3 % contre 2 %), flatulence (3 % contre 1 %), infection (2 % contre 1 %) et constipation (2 % contre 1%).
Trois études d'entretien à long terme ont porté sur un total de 740 patients adultes ; au moins 54 % des patients adultes ont été exposés à ACIPHEX 20 mg comprimés à libération retardée pendant 6 mois et au moins 33 % ont été exposés pendant 12 mois. Sur les 740 patients adultes, 247 (33 %) et 241 (33 %) patients ont reçu respectivement 10 mg et 20 mg d'ACIPHEX 20 mg, comprimés à libération retardée, tandis que 169 (23 %) patients ont reçu un placebo et 83 (11 %) ont reçu oméprazole.
Le profil de sécurité du rabéprazole dans les études d'entretien chez l'adulte était cohérent avec ce qui a été observé dans les études aiguës.
Les effets indésirables moins fréquents observés dans les essais cliniques contrôlés (
Traitement combiné avec l'amoxicilline et la clarithromycine
Dans les essais cliniques utilisant une association thérapeutique avec le rabéprazole plus l'amoxicilline et la clarithromycine (RAC), aucun effet indésirable propre à cette association médicamenteuse n'a été observé. Dans l'étude multicentrique américaine, les effets indésirables liés au médicament les plus fréquemment signalés chez les patients ayant reçu un traitement par RAC pendant 7 ou 10 jours étaient la diarrhée (8 % et 7 %) et l'altération du goût (6 % et 10 %), respectivement.
Aucune anomalie de laboratoire cliniquement significative particulière aux combinaisons de médicaments n'a été observée.
Pour plus d'informations sur les effets indésirables ou les changements de laboratoire avec l'amoxicilline ou la clarithromycine, reportez-vous à leurs informations de prescription respectives, section Effets indésirables.
Pédiatrie
Dans une étude multicentrique en ouvert portant sur des patients adolescents âgés de 12 à 16 ans présentant un diagnostic clinique de RGO symptomatique ou de RGO confirmé par endoscopie, le profil des effets indésirables était similaire à celui des adultes. Les effets indésirables signalés sans égard à la relation avec ACIPHEX 20 mg comprimés à libération retardée qui sont survenus chez ≥ 2 % des 111 patients étaient les maux de tête (9,9 %), la diarrhée (4,5 %), les nausées (4,5 %), les vomissements (3,6 %) et douleurs abdominales (3,6%). Les effets indésirables apparentés signalés chez ≥ 2 % des patients étaient les maux de tête (5,4 %) et les nausées (1,8 %). Aucun effet indésirable n'a été signalé dans cette étude qui n'ait été observé auparavant chez l'adulte.
Expérience post-commercialisation
Les effets indésirables suivants ont été identifiés lors de l'utilisation post-approbation du rabéprazole. Étant donné que ces réactions sont signalées volontairement à partir d'une population de taille incertaine, il n'est pas toujours possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale avec l'exposition au médicament :
Troubles du système sanguin et lymphatique : agranulocytose, anémie hémolytique, leucopénie, pancytopénie, thrombocytopénie
Troubles de l'oreille et du labyrinthe : vertige
Troubles oculaires : Vision floue
Problèmes gastro-intestinaux: polypes des glandes fundiques
Troubles généraux et conditions au site d'administration : mort subite
Troubles hépatobiliaires : jaunisse
Troubles du système immunitaire : anaphylaxie, œdème de Quincke, lupus érythémateux disséminé, syndrome de Stevens-Johnson, nécrolyse épidermique toxique (certaines mortelles), DRESS, AGEP
Infections et infestations : Diarrhée associée à Clostridium difficile
Enquêtes : Augmentations du temps de prothrombine/INR (chez les patients traités avec de la warfarine concomitante), élévations de la TSH
Troubles du métabolisme et de la nutrition : hyperammoniémie, hypomagnésémie, hypocalcémie, hypokaliémie [Mises en garde et précautions 5.8], hyponatrémie
Troubles du système musculo-squelettique : fracture osseuse, rhabdomyolyse
Troubles du système nerveux : coma
Troubles psychiatriques: délire, désorientation
Troubles rénaux et urinaires : néphrite interstitielle
Troubles respiratoires, thoraciques et médiastinaux : pneumonie interstitielle
Troubles de la peau et du tissu sous-cutané : réactions dermatologiques sévères, y compris éruptions bulleuses et autres éruptions médicamenteuses de la peau, lupus érythémateux cutané, érythème polymorphe
INTERACTIONS MÉDICAMENTEUSES
Le tableau 2 comprend les médicaments ayant des interactions médicamenteuses cliniquement importantes et des interactions avec les diagnostics lorsqu'ils sont administrés en même temps que les comprimés à libération retardée d'ACIPHEX 10 mg et des instructions pour les prévenir ou les gérer.
Consultez l'étiquetage des médicaments utilisés en concomitance pour obtenir de plus amples informations sur les interactions avec les IPP.
AVERTISSEMENTS
Inclus dans le cadre du PRÉCAUTIONS section.
PRÉCAUTIONS
Présence de malignité gastrique
Chez l'adulte, la réponse symptomatique au traitement par ACIPHEX 10 mg n'exclut pas la présence d'une tumeur gastrique maligne. Envisager un suivi et des tests diagnostiques supplémentaires chez les patients adultes qui ont une réponse sous-optimale ou une rechute symptomatique précoce après avoir terminé le traitement avec un IPP.
Interaction avec la warfarine
Les interactions à l'état d'équilibre du rabéprazole et de la warfarine n'ont pas été suffisamment évaluées chez les patients. Des cas d'augmentation de l'INR et du temps de prothrombine ont été rapportés chez des patients recevant simultanément un inhibiteur de la pompe à protons et de la warfarine. L'augmentation de l'INR et du temps de prothrombine peut entraîner des saignements anormaux et même la mort. Les patients traités par ACIPHEX 10 mg comprimés à libération retardée et la warfarine en concomitance peuvent nécessiter une surveillance des augmentations de l'INR et du temps de prothrombine [voir INTERACTIONS MÉDICAMENTEUSES ].
Néphrite tubulo-interstitielle aiguë
Une néphrite tubulo-interstitielle (TIN) aiguë a été observée chez des patients prenant des IPP et peut survenir à tout moment au cours du traitement par IPP. Les patients peuvent présenter divers signes et symptômes allant de réactions d'hypersensibilité symptomatiques à des symptômes non spécifiques de diminution de la fonction rénale (p. ex. malaise, nausées, anorexie). Dans les séries de cas rapportés, certains patients ont été diagnostiqués sur biopsie et en l'absence de manifestations extra-rénales (p. ex., fièvre, éruption cutanée ou arthralgie).
Interrompre ACIPHEX et évaluer les patients chez qui l'on soupçonne une TIN aiguë [voir CONTRE-INDICATION ].
Diarrhée associée à Clostridium difficile
Des études observationnelles publiées suggèrent que le traitement par IPP comme ACIPHEX peut être associé à un risque accru de diarrhée associée à Clostridium difficile, en particulier chez les patients hospitalisés. Ce diagnostic doit être évoqué en cas de diarrhée qui ne s'améliore pas [voir EFFETS INDÉSIRABLES ].
Les patients doivent utiliser la dose la plus faible et la durée la plus courte de traitement par IPP appropriées à l'affection traitée.
Une diarrhée associée à Clostridium difficile (DACD) a été signalée avec l'utilisation de presque tous les agents antibactériens. Pour plus d'informations spécifiques aux agents antibactériens (clarithromycine et amoxicilline) indiqués pour une utilisation en association avec ACIPHEX, reportez-vous aux sections Mises en garde et Précautions des informations de prescription correspondantes.
Fracture de l'os
Plusieurs études observationnelles publiées chez l'adulte suggèrent que le traitement par IPP peut être associé à un risque accru de fractures de la hanche, du poignet ou de la colonne vertébrale liées à l'ostéoporose. Le risque de fracture était accru chez les patients ayant reçu une dose élevée, définie comme de multiples doses quotidiennes, et un traitement par IPP à long terme (un an ou plus). Les patients doivent utiliser la dose la plus faible et la durée la plus courte de traitement par IPP appropriées à l'affection traitée. Les patients à risque de fractures liées à l'ostéoporose doivent être pris en charge conformément aux directives de traitement établies [voir DOSAGE ET ADMINISTRATION , EFFETS INDÉSIRABLES ].
Effets indésirables cutanés graves
Des effets indésirables cutanés graves, y compris le syndrome de Stevens-Johnson (SJS) et la nécrolyse épidermique toxique (NET), la réaction médicamenteuse avec éosinophilie et symptômes systémiques (DRESS) et la pustulose exanthématique aiguë généralisée (PEAG) ont été signalés en association avec l'utilisation d'IPP [voir EFFETS INDÉSIRABLES ]. Arrêtez ACIPHEX dès les premiers signes ou symptômes d'effets indésirables cutanés graves ou d'autres signes d'hypersensibilité et envisagez une évaluation plus approfondie.
Lupus érythémateux cutané et disséminé
Des cas de lupus érythémateux cutané (CLE) et de lupus érythémateux disséminé (LES) ont été rapportés chez des patients prenant des IPP, y compris le rabéprazole. Ces événements se sont produits à la fois comme une nouvelle apparition et comme une exacerbation d'une maladie auto-immune existante. La majorité des cas de lupus érythémateux induits par les IPP étaient des CLE.
La forme la plus courante de CLE signalée chez les patients traités par des IPP était la CLE subaiguë (SCLE) et s'est produite dans les semaines ou les années suivant un traitement médicamenteux continu chez des patients allant des nourrissons aux personnes âgées. Généralement, les résultats histologiques ont été observés sans atteinte des organes.
Le lupus érythémateux disséminé (LES) est moins fréquemment rapporté que le CLE chez les patients recevant des IPP. Le LED associé aux IPP est généralement plus léger que le LED non médicamenteux. L'apparition du LES s'est généralement produite quelques jours à quelques années après le début du traitement, principalement chez des patients allant des jeunes adultes aux personnes âgées. La majorité des patients présentaient une éruption cutanée ; cependant, des arthralgies et des cytopénies ont également été signalées.
Évitez l'administration d'IPP plus longtemps que médicalement indiqué. Si des signes ou des symptômes compatibles avec le CLE ou le SLE sont notés chez les patients recevant ACIPHEX, arrêtez le médicament et référez le patient au spécialiste approprié pour évaluation. La plupart des patients s'améliorent avec l'arrêt de l'IPP seul en 4 à 12 semaines. Les tests sérologiques (par exemple ANA) peuvent être positifs et les résultats des tests sérologiques élevés peuvent prendre plus de temps à se résoudre que les manifestations cliniques.
Carence en cyanocobalamine (vitamine B-12)
Un traitement quotidien avec des médicaments antiacides sur une longue période (p. ex., plus de 3 ans) peut entraîner une malabsorption de la cyanocobalamine (vitamine B-12) causée par une hypo ou une achlorhydrie. De rares cas de carence en cyanocobalamine survenant avec un traitement anti-acide ont été rapportés dans la littérature. Ce diagnostic doit être envisagé si des symptômes cliniques compatibles avec un déficit en cyanocobalamine sont observés chez des patients traités par ACIPHEX.
Hypomagnésémie et métabolisme minéral
De rares cas d'hypomagnésémie, symptomatique et asymptomatique, ont été rapportés chez des patients traités par des IPP pendant au moins trois mois, dans la plupart des cas après un an de traitement. Les événements indésirables graves comprennent la tétanie, les arythmies et les convulsions. L'hypomagnésémie peut entraîner une hypocalcémie et/ou une hypokaliémie et peut exacerber l'hypocalcémie sous-jacente chez les patients à risque. Chez la plupart des patients, le traitement de l'hypomagnésémie a nécessité un remplacement du magnésium et l'arrêt de l'IPP.
Pour les patients qui devraient suivre un traitement prolongé ou qui prennent des IPP avec des médicaments tels que la digoxine ou des médicaments susceptibles de provoquer une hypomagnésémie (p. EFFETS INDÉSIRABLES ].
Envisager de surveiller les taux de magnésium et de calcium avant le début d'ACIPHEX et périodiquement pendant le traitement chez les patients présentant un risque préexistant d'hypocalcémie (par exemple, hypoparathyroïdie). Compléter avec du magnésium et/ou du calcium si nécessaire. Si l'hypocalcémie est réfractaire au traitement, envisager d'arrêter l'IPP.
Interaction avec le méthotrexate
La littérature suggère que l'utilisation concomitante d'IPP avec le méthotrexate (principalement à dose élevée ; voir les informations de prescription du méthotrexate) peut augmenter et prolonger les concentrations sériques de méthotrexate et/ou de son métabolite, pouvant entraîner des toxicités du méthotrexate. En cas d'administration de méthotrexate à forte dose, un arrêt temporaire de l'IPP peut être envisagé chez certains patients [voir INTERACTIONS MÉDICAMENTEUSES ].
Polypes de la glande fundique
L'utilisation d'IPP est associée à un risque accru de polypes des glandes fundiques qui augmente avec une utilisation à long terme, en particulier au-delà d'un an. La plupart des utilisateurs d'IPP qui ont développé des polypes de la glande fundique étaient asymptomatiques et les polypes de la glande fundique ont été identifiés accidentellement à l'endoscopie. Utilisez la durée la plus courte de traitement par IPP appropriée à la condition traitée.
Informations sur les conseils aux patients
Conseillez au patient de lire l'étiquetage patient approuvé par la FDA ( Guide des médicaments ).
Néphrite tubulo-interstitielle aiguë
Conseillez au patient ou au soignant d'appeler immédiatement le fournisseur de soins de santé du patient s'il présente des signes et/ou des symptômes associés à une néphrite tubulo-interstitielle aiguë [voir AVERTISSEMENTS ET PRECAUTIONS ].
Diarrhée associée à Clostridium difficile
Conseillez au patient ou au soignant d'appeler immédiatement le fournisseur de soins de santé du patient s'il souffre d'une diarrhée qui ne s'améliore pas [voir AVERTISSEMENTS ET PRECAUTIONS ].
Fracture de l'os
Conseillez au patient ou au soignant de signaler toute fracture, en particulier de la hanche, du poignet ou de la colonne vertébrale, au fournisseur de soins de santé du patient [voir AVERTISSEMENTS ET PRECAUTIONS ].
Effets indésirables cutanés graves
Conseillez au patient ou au soignant d'arrêter ACIPHEX 20 mg et de signaler tout signe et symptôme d'effet indésirable cutané sévère ou tout autre signe d'hypersensibilité au professionnel de santé [voir AVERTISSEMENTS ET PRECAUTIONS ].
Lupus érythémateux cutané et disséminé
Conseillez au patient ou au soignant d'appeler immédiatement le fournisseur de soins de santé du patient en cas d'apparition ou d'aggravation de symptômes associés au lupus érythémateux cutané ou disséminé [voir AVERTISSEMENTS ET PRECAUTIONS ].
Carence en cyanocobalamine (vitamine B-12)
Conseillez au patient ou au soignant de signaler tout symptôme clinique pouvant être associé à une carence en cyanocobalamine au professionnel de santé du patient s'il reçoit ACIPHEX 20 mg depuis plus de 3 ans [voir AVERTISSEMENTS ET PRECAUTIONS ].
Hypomagnésémie et métabolisme minéral
Conseillez au patient ou au soignant de signaler tout symptôme clinique pouvant être associé à une hypomagnésémie, une hypocalcémie, une hypokaliémie et une hyponatrémie au professionnel de santé du patient, s'il reçoit ACIPHEX depuis au moins 3 mois [voir AVERTISSEMENTS ET PRECAUTIONS ].
Interactions médicamenteuses
Conseillez aux patients de signaler à leur professionnel de santé s'ils prennent des produits contenant de la rilpivirine [voir CONTRE-INDICATIONS ], warfarine, digoxine ou méthotrexate à forte dose [voir AVERTISSEMENTS ET PRECAUTIONS ].
Administration
- Avalez ACIPHEX 10 mg comprimés à libération retardée entiers. Ne pas mâcher, écraser ou diviser les comprimés.
- Pour le traitement des ulcères duodénaux, prendre les comprimés à libération retardée ACIPHEX après un repas.
- Pour l'éradication d'Helicobacter pylori, prendre les comprimés à libération retardée d'ACIPHEX 20 mg avec de la nourriture.
- Pour toutes les autres indications, ACIPHEX 10 mg comprimés à libération retardée peut être pris avec ou sans aliments.
- Prenez une dose oubliée dès que possible. S'il est presque l'heure de la dose suivante, sautez la dose oubliée et reprenez l'horaire normal. Ne prenez pas deux doses en même temps.
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Dans une étude de cancérogénicité de 88/104 semaines chez des souris CD-1, le rabéprazole à des doses orales allant jusqu'à 100 mg/kg/jour n'a pas entraîné d'augmentation de la survenue de tumeurs. La dose testée la plus élevée a produit une exposition systémique au rabéprazole (ASC) de 1,40 μg•h/mL, soit 1,6 fois l'exposition humaine (ASC0-∞ plasmatique = 0,88 μg•h/mL) à la dose recommandée pour le RGO (20 mg/ journée). Dans une étude de cancérogénicité de 28 semaines chez des souris transgéniques p53+/-, le rabéprazole à des doses orales de 20, 60 et 200 mg/kg/jour n'a pas provoqué d'augmentation des taux d'incidence des tumeurs mais a produit une hyperplasie de la muqueuse gastrique à toutes les doses. L'exposition systémique au rabéprazole à 200 mg/kg/jour est d'environ 17 à 24 fois l'exposition humaine à la dose recommandée pour le RGO. Dans une étude de cancérogénicité de 104 semaines chez des rats Sprague-Dawley, les mâles ont été traités avec des doses orales de 5, 15, 30 et 60 mg/kg/jour et les femelles avec 5, 15, 30, 60 et 120 mg/kg/jour . Le rabéprazole a produit une hyperplasie gastrique des cellules de type entérochromaffine (ECL) chez les rats mâles et femelles et des tumeurs carcinoïdes des cellules ECL chez les rats femelles à toutes les doses, y compris la plus faible dose testée. La dose la plus faible (5 mg/kg/jour) a produit une exposition systémique au rabéprazole (ASC) d'environ 0,1 μg•h/mL, soit environ 0,1 fois l'exposition humaine à la dose recommandée pour le RGO. Chez les rats mâles, aucune tumeur liée au traitement n'a été observée à des doses allant jusqu'à 60 mg/kg/jour produisant une exposition plasmatique au rabéprazole (ASC) d'environ 0,2 μg•h/mL (0,2 fois l'exposition humaine à la dose recommandée pour le RGO).
Le rabéprazole était positif dans le test d'Ames, le test de mutation génique directe sur les cellules ovariennes de hamster chinois (CHO/HGPRT) et le test de mutation génique directe sur les cellules de lymphome de souris (L5178Y/TK+/–). Son métabolite déméthylé était également positif dans le test d'Ames. Le rabéprazole a donné des résultats négatifs au test d'aberration chromosomique in vitro sur les cellules pulmonaires du hamster chinois, au test in vivo du micronoyau chez la souris et aux tests in vivo et ex vivo de synthèse d'ADN non programmée (UDS) d'hépatocytes de rat.
Le rabéprazole à des doses intraveineuses allant jusqu'à 30 mg/kg/jour (ASC plasmatique de 8,8 μg•h/mL, soit environ 10 fois l'exposition humaine à la dose recommandée pour le RGO) s'est avéré n'avoir aucun effet sur la fertilité et les performances de reproduction des mâles et des femelles. rats femelles.
Utilisation dans des populations spécifiques
Grossesse
Résumé des risques
Il n'y a pas de données humaines disponibles sur l'utilisation d'ACIPHEX 10 mg chez les femmes enceintes pour informer le risque associé au médicament. Le risque de fond de malformations congénitales majeures et de fausse couche pour les populations indiquées est inconnu. Cependant, le risque de fond dans la population générale américaine de malformations congénitales majeures est de 2 à 4% et de fausse couche est de 15 à 20% des grossesses cliniquement reconnues. Aucune preuve d'effets indésirables sur le développement n'a été observée dans les études de reproduction chez l'animal avec le rabéprazole administré pendant l'organogenèse à 13 et 8 fois l'aire humaine sous la courbe concentration plasmatique-temps (ASC) à la dose recommandée pour le RGO, chez le rat et le lapin, respectivement [voir Données ].
Des modifications de la morphologie osseuse ont été observées chez les descendants de rats traités avec des doses orales d'un IPP différent pendant la majeure partie de la grossesse et de l'allaitement. Lorsque l'administration maternelle était confinée à la gestation uniquement, il n'y avait aucun effet sur la morphologie de la physe osseuse chez la progéniture à tout âge [voir Données ].
Données
Données animales
Des études sur le développement embryo-fœtal ont été réalisées chez le rat au cours de l'organogenèse à des doses intraveineuses de rabéprazole allant jusqu'à 50 mg/kg/jour (ASC plasmatique de 11,8 μg•h/mL, soit environ 13 fois l'exposition humaine à la dose orale recommandée pour le RGO) et des lapins à des doses intraveineuses allant jusqu'à 30 mg/kg/jour (ASC plasmatique de 7,3 μg•h/mL, soit environ 8 fois l'exposition humaine à la dose orale recommandée pour le RGO) et n'ont révélé aucun signe d'effet nocif pour le fœtus dû à rabéprazole.
L'administration de rabéprazole à des rats en fin de gestation et pendant l'allaitement à une dose orale de 400 mg/kg/jour (environ 195 fois la dose orale humaine basée sur mg/m²) a entraîné une diminution du gain de poids corporel des ratons.
Une étude de toxicité sur le développement prénatal et postnatal chez le rat avec des paramètres supplémentaires pour évaluer le développement osseux a été réalisée avec un IPP différent à environ 3,4 à 57 fois une dose humaine orale sur la base de la surface corporelle. Une diminution de la longueur du fémur, de la largeur et de l'épaisseur de l'os cortical, une diminution de l'épaisseur de la plaque de croissance tibiale et une hypocellularité minime à légère de la moelle osseuse ont été notées à des doses de cet IPP égales ou supérieures à 3,4 fois une dose humaine orale sur la base de la surface corporelle . Une dysplasie physaire du fémur a également été observée chez la progéniture après une exposition in utero et pendant l'allaitement à l'IPP à des doses égales ou supérieures à 33,6 fois une dose humaine orale sur la base de la surface corporelle. Des effets sur l'os maternel ont été observés chez des rats gravides et allaitants dans une étude de toxicité prénatale et postnatale lorsque l'IPP a été administré à des doses orales de 3,4 à 57 fois une dose humaine orale sur la base de la surface corporelle. Lorsque les rats ont reçu une dose du 7e jour de gestation jusqu'au sevrage au 21e jour postnatal, une diminution statistiquement significative du poids du fémur maternel allant jusqu'à 14 % (par rapport au traitement par placebo) a été observée à des doses égales ou supérieures à 33,6 fois une dose humaine orale. sur la base de la surface corporelle.
Une étude de suivi de la toxicité pour le développement chez le rat avec d'autres points temporels pour évaluer le développement de l'os du chiot du jour 2 postnatal à l'âge adulte a été réalisée avec un IPP différent à des doses orales de 280 mg/kg/jour (environ 68 fois une dose humaine orale sur un sur la base de la surface corporelle) où l'administration du médicament s'est déroulée du 7e jour de gestation ou du 16e jour de gestation jusqu'à la parturition. Lorsque l'administration maternelle était confinée à la gestation uniquement, il n'y avait aucun effet sur la morphologie de la physe osseuse chez la progéniture à tout âge.
Lactation
Résumé des risques
Aucune étude sur l'allaitement n'a été menée pour évaluer la présence de rabéprazole dans le lait maternel, les effets du rabéprazole sur le nourrisson allaité ou les effets du rabéprazole sur la production de lait. Le rabéprazole est présent dans le lait de rat. Les avantages de l'allaitement pour le développement et la santé doivent être pris en compte, ainsi que le besoin clinique d'ACIPHEX de la mère et tout effet indésirable potentiel sur le nourrisson allaité d'ACIPHEX ou de l'affection maternelle sous-jacente.
Utilisation pédiatrique
La sécurité et l'efficacité d'ACIPHEX 20 mg comprimés à libération retardée ont été établies chez les patients pédiatriques pour les patients adolescents de 12 ans et plus pour le traitement du RGO symptomatique. L'utilisation d'ACIPHEX 20 mg comprimés à libération retardée dans ce groupe d'âge est étayée par des études adéquates et bien contrôlées chez l'adulte et une étude multicentrique, randomisée, ouverte, en groupes parallèles chez 111 patients adolescents âgés de 12 à 16 ans. Les patients avaient un diagnostic clinique de RGO symptomatique ou de RGO suspecté ou confirmé par endoscopie et ont été randomisés pour recevoir 10 mg ou 20 mg une fois par jour pendant 8 semaines maximum pour l'évaluation de l'innocuité et de l'efficacité. Le profil des effets indésirables chez les patients adolescents était similaire à celui des adultes. Les effets indésirables rapportés qui sont survenus chez ≥ 2 % des patients étaient des maux de tête (5 %) et des nausées (2 %). Aucun effet indésirable n'a été signalé dans ces études qui n'avait pas été observé auparavant chez l'adulte.
La sécurité et l'efficacité d'ACIPHEX 10 mg comprimés à libération retardée n'ont pas été établies chez les patients pédiatriques pour :
- Guérison du RGO érosif ou ulcératif
- Maintien de la guérison du RGO érosif ou ulcératif
- Traitement du RGO symptomatique
- Guérison des ulcères duodénaux
- Éradication d'Helicobacter pylori pour réduire le risque de récidive de l'ulcère duodénal
- Traitement des états pathologiques d'hypersécrétion, y compris le syndrome de Zollinger-Ellison
Les comprimés ACIPHEX à libération retardée de 20 mg ne sont pas recommandés chez les patients pédiatriques de moins de 12 ans car le dosage des comprimés dépasse la dose recommandée pour ces patients [voir DOSAGE ET ADMINISTRATION ]. Pour les patients pédiatriques âgés de 1 an à moins de 12 ans, envisager une autre formulation de rabéprazole. L'innocuité et l'efficacité d'une forme posologique et d'un dosage différents du rabéprazole ont été établies chez les patients pédiatriques âgés de 1 à 11 ans pour le traitement du RGO.
Données sur les animaux juvéniles
Des études sur des rats et des chiens juvéniles et jeunes adultes ont été réalisées. Dans des études sur des animaux juvéniles, le rabéprazole sodique a été administré par voie orale à des rats pendant jusqu'à 5 semaines et à des chiens pendant jusqu'à 13 semaines, chacune commençant le jour 7 post-partum et suivie d'une période de récupération de 13 semaines. Les rats ont reçu des doses de 5, 25 ou 150 mg/kg/jour et les chiens ont reçu des doses de 3, 10 ou 30 mg/kg/jour. Les données de ces études étaient comparables à celles rapportées pour les jeunes animaux adultes. Des modifications d'origine pharmacologique, notamment une augmentation des taux sériques de gastrine et des modifications de l'estomac, ont été observées à toutes les doses chez le rat et le chien. Ces observations étaient réversibles au cours des périodes de récupération de 13 semaines. Bien que le poids corporel et/ou la longueur de la calotte et de la croupe aient été légèrement diminués pendant l'administration, aucun effet sur les paramètres de développement n'a été noté chez les rats ou les chiens juvéniles.
Lorsque des animaux juvéniles ont été traités pendant 28 jours avec un IPP différent à des doses égales ou supérieures à 34 fois la dose humaine orale quotidienne sur la base de la surface corporelle, la croissance globale a été affectée et une diminution du poids corporel liée au traitement (environ 14 %) et un gain de poids corporel, ainsi qu'une diminution du poids et de la longueur du fémur ont été observés.
Utilisation gériatrique
Sur le nombre total de sujets (n = 2009) dans les études cliniques d'ACIPHEX 20 mg, comprimés à libération retardée, 19 % étaient âgés de 65 ans et plus, tandis que 4 % étaient âgés de 75 ans et plus. Aucune différence globale d'innocuité ou d'efficacité n'a été observée entre ces sujets et les sujets plus jeunes, et d'autres expériences cliniques rapportées n'ont pas identifié de différences dans les réponses entre les patients âgés et les patients plus jeunes, mais une plus grande sensibilité de certains individus plus âgés ne peut être exclue.
Insuffisance hépatique
L'administration de comprimés à libération retardée d'ACIPHEX à des patients atteints d'insuffisance hépatique légère à modérée (classes Child-Pugh A et B, respectivement) a entraîné une augmentation de l'exposition et une diminution de l'élimination [voir PHARMACOLOGIE CLINIQUE ]. Aucun ajustement posologique n'est nécessaire chez les patients présentant une insuffisance hépatique légère à modérée. Il n'y a pas d'information chez les patients atteints d'insuffisance hépatique sévère (Child-Pugh classe C). Éviter l'utilisation des comprimés à libération retardée d'ACIPHEX chez les patients présentant une insuffisance hépatique sévère ; cependant, si un traitement est nécessaire, surveiller les effets indésirables chez les patients [voir AVERTISSEMENTS ET PRECAUTIONS , EFFETS INDÉSIRABLES ].
SURDOSAGE
Sept cas de surdosage accidentel de rabéprazole ont été signalés. Le surdosage maximal signalé était de 80 mg. Aucun signe ou symptôme clinique n'a été associé à un surdosage signalé. Les patients atteints du syndrome de Zollinger-Ellison ont été traités avec jusqu'à 120 mg de rabéprazole une fois par jour. Aucun antidote spécifique du rabéprazole n'est connu. Le rabéprazole est fortement lié aux protéines et n'est pas facilement dialysable.
En cas de surdosage, le traitement doit être symptomatique et de soutien.
En cas de surexposition, appelez votre centre antipoison au 1-800-222-1222 pour obtenir des informations à jour sur la gestion d'un empoisonnement ou d'un surdosage.
CONTRE-INDICATIONS
- ACIPHEX 10 mg est contre-indiqué chez les patients présentant une hypersensibilité connue au rabéprazole, aux benzimidazoles substitués ou à tout composant de la formulation. Les réactions d'hypersensibilité peuvent inclure l'anaphylaxie, le choc anaphylactique, l'œdème de Quincke, le bronchospasme, la néphrite tubulo-interstitielle aiguë et l'urticaire [voir AVERTISSEMENTS ET PRECAUTIONS , EFFETS INDÉSIRABLES ].
- Les IPP, y compris ACIPHEX, sont contre-indiqués avec les produits contenant de la rilpivirine [voir INTERACTIONS MÉDICAMENTEUSES ].
- Pour connaître les contre-indications des agents antibactériens (clarithromycine et amoxicilline) indiqués en association avec ACIPHEX 20mg comprimés retard, se référer à la rubrique Contre-indications de leurs notices.
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
Le rabéprazole appartient à une classe de composés antisécrétoires (inhibiteurs de la pompe à protons benzimidazoles substitués) qui ne présentent pas de propriétés anticholinergiques ou antagonistes des récepteurs H2 de l'histamine, mais suppriment la sécrétion d'acide gastrique en inhibant la H+, K+ATPase gastrique à la surface sécrétoire de l'estomac. Cellule pariétale. Parce que cette enzyme est considérée comme la pompe acide (proton) dans la cellule pariétale, le rabéprazole a été caractérisé comme un inhibiteur gastrique de la pompe à protons. Le rabéprazole bloque la dernière étape de la sécrétion d'acide gastrique.
Dans les cellules pariétales gastriques, le rabéprazole est protoné, s'accumule et se transforme en un sulfénamide actif. Lorsqu'il est étudié in vitro, le rabéprazole est activé chimiquement à pH 1,2 avec une demi-vie de 78 secondes. Il inhibe le transport acide dans les vésicules gastriques porcines avec une demi-vie de 90 secondes.
Pharmacodynamie
Activité antisécrétoire
L'effet antisécrétoire débute dans l'heure qui suit l'administration orale de 20 mg d'ACIPHEX 20 mg comprimés à libération retardée. L'effet inhibiteur médian du rabéprazole sur l'acidité gastrique sur 24 heures est de 88 % de l'effet maximal après la première dose. Une dose de 20 mg de comprimés à libération retardée ACIPHEX inhibe la sécrétion d'acide basale et stimulée par le repas de peptone par rapport au placebo de 86 % et 95 %, respectivement, et augmente le pourcentage d'une période de 24 heures où le pH gastrique> 3 passe de 10 % à 65 % (voir tableau ci-dessous). Cette action pharmacodynamique relativement prolongée par rapport à la courte demi-vie pharmacocinétique (1 à 2 heures) reflète l'inactivation prolongée de la H+, K+ATPase.
Par rapport au placebo, 10 mg, 20 mg et 40 mg de comprimés à libération retardée d'ACIPHEX, administrés une fois par jour pendant 7 jours, ont significativement réduit l'acidité intragastrique avec toutes les doses pour chacun des quatre intervalles liés aux repas et la période de 24 heures dans l'ensemble. Dans cette étude, il n'y avait pas de différences statistiquement significatives entre les doses; cependant, il y avait une diminution significative liée à la dose de l'acidité intragastrique. La capacité du rabéprazole à provoquer une diminution liée à la dose de l'acidité intragastrique moyenne est illustrée ci-dessous.

Après l'administration de 20 mg d'ACIPHEX 20 mg comprimés à libération retardée une fois par jour pendant huit jours, le pourcentage moyen de temps pendant lequel le pH gastrique était supérieur à 3 ou le pH gastrique supérieur à 4 après une dose unique (Jour 1) et des doses multiples (Jour 8) était significativement plus élevé que le placebo (voir tableau ci-dessous). La diminution de l'acidité gastrique et l'augmentation du pH gastrique observées avec 20 mg d'ACIPHEX comprimés à libération retardée de 10 mg administrés une fois par jour pendant huit jours ont été comparées aux mêmes paramètres pour le placebo, comme illustré ci-dessous :
Effets sur l'exposition à l'acide oesophagien
Chez les patients atteints de RGO et exposés à l'acide œsophagien modéré à sévère, une dose de 20 mg et 40 mg par jour d'ACIPHEX 20 mg comprimés à libération retardée a diminué l'exposition à l'acide œsophagien sur 24 heures. Après sept jours de traitement, le pourcentage de temps pendant lequel le pH œsophagien était inférieur à 4 a diminué par rapport aux valeurs initiales de 24,7 % pour 20 mg et 23,7 % pour 40 mg, à 5,1 % et 2,0 %, respectivement. La normalisation de l'exposition intra-œsophagienne à l'acide sur 24 heures était corrélée à un pH gastrique supérieur à 4 pendant au moins 35 % de la période de 24 heures ; ce niveau a été atteint chez 90 % des sujets recevant ACIPHEX 20 mg et chez 100 % des sujets recevant ACIPHEX 40 mg. Avec ACIPHEX 20 mg et 40 mg par jour, des effets significatifs sur le pH gastrique et oesophagien ont été notés après un jour de traitement, et plus prononcés après sept jours de traitement.
Effets sur la gastrine sérique
Le taux médian de gastrine à jeun a augmenté de manière dose-dépendante chez les patients traités une fois par jour avec ACIPHEX 10 mg, comprimés à libération retardée jusqu'à huit semaines pour une œsophagite ulcéreuse ou érosive et chez les patients traités jusqu'à 52 semaines pour prévenir la récurrence de la maladie. Les valeurs médianes du groupe sont restées dans la fourchette normale.
Dans un groupe de sujets traités avec des comprimés à libération retardée d'ACIPHEX à 20 mg pendant 4 semaines, un doublement des concentrations sériques moyennes de gastrine a été observé. Environ 35 % de ces sujets traités ont développé des concentrations sériques de gastrine supérieures à la limite supérieure de la normale.
Effets sur les cellules de type entérochromaffine (ECL)
L'augmentation de la gastrine sérique secondaire aux agents antisécrétoires stimule la prolifération des cellules ECL gastriques qui, avec le temps, peut entraîner une hyperplasie des cellules ECL chez les rats et les souris et des carcinoïdes gastriques chez les rats, en particulier chez les femelles [voir Toxicologie non clinique ].
Chez plus de 400 patients traités par ACIPHEX comprimés à libération retardée (10 ou 20 mg) une fois par jour pendant un an au maximum, l'incidence de l'hyperplasie des cellules ECL a augmenté avec le temps et la dose, ce qui est cohérent avec l'action pharmacologique de l'inhibiteur de la pompe à protons. Aucun patient n'a développé de modifications adénomatoïdes, dysplasiques ou néoplasiques des cellules ECL dans la muqueuse gastrique. Aucun patient n'a développé les tumeurs carcinoïdes observées chez le rat.
Effets endocriniens
Des études chez l'homme jusqu'à un an n'ont pas révélé d'effets cliniquement significatifs sur le système endocrinien. Chez des sujets sains de sexe masculin traités par les comprimés à libération retardée d'ACIPHEX pendant 13 jours, aucune modification cliniquement pertinente n'a été détectée dans les paramètres endocriniens suivants examinés : 17 β-estradiol, hormone stimulant la thyroïde, tri-iodothyronine, thyroxine, protéine de liaison à la thyroxine, parathyroïde hormone, insuline, glucagon, rénine, aldostérone, hormone folliculo-stimulante, hormone lutéotrophique, prolactine, hormone somatotrophique, déhydroépiandrostérone, globuline liant le cortisol et 6β-hydroxycortisol urinaire, testostérone sérique et profil circadien de cortisol.
Autres effets
Chez l'homme traité par ACIPHEX 10 mg comprimés à libération retardée pendant un an au maximum, aucun effet systémique n'a été observé sur les systèmes nerveux central, lymphoïde, hématopoïétique, rénal, hépatique, cardiovasculaire ou respiratoire. Aucune donnée n'est disponible sur le traitement au long cours par ACIPHEX 10mg comprimés retard et les effets oculaires.
Pharmacocinétique
Après administration orale de 20 mg d'ACIPHEX 10 mg comprimés à libération retardée, les concentrations plasmatiques maximales (Cmax) de rabéprazole se produisent sur une plage de 2 à 5 heures (Tmax). La Cmax et l'ASC du rabéprazole sont linéaires sur une plage de doses orales de 10 mg à 40 mg. Il n'y a pas d'accumulation appréciable lorsque des doses de 10 mg à 40 mg sont administrées toutes les 24 heures ; la pharmacocinétique du rabéprazole n'est pas modifiée par des doses multiples.
Absorption
La biodisponibilité absolue pour un comprimé oral de 20 mg de rabéprazole (par rapport à l'administration intraveineuse) est d'environ 52 %. Lorsque ACIPHEX 10 mg comprimés à libération retardée est administré avec un repas riche en graisses, le Tmax est variable ; lequel apport alimentaire concomitant peut retarder l'absorption jusqu'à 4 heures ou plus. Cependant, la Cmax et le degré d'absorption du rabéprazole (ASC) ne sont pas significativement modifiés. Ainsi, les comprimés à libération retardée d'ACIPHEX peuvent être pris sans tenir compte de l'heure des repas.
Distribution
Le rabéprazole est lié à 96,3 % aux protéines plasmatiques humaines.
Élimination
Métabolisme
Le rabéprazole est largement métabolisé. Une partie importante du rabéprazole est métabolisée par réduction systémique non enzymatique en un composé thioéther. Le rabéprazole est également métabolisé en composés sulfones et déméthylés via le cytochrome P450 dans le foie. Le thioéther et la sulfone sont les principaux métabolites mesurés dans le plasma humain. On n'a pas observé que ces métabolites avaient une activité antisécrétoire significative. Des études in vitro ont démontré que le rabéprazole est métabolisé dans le foie principalement par les cytochromes P450 3A (CYP3A) en un métabolite sulfone et le cytochrome P450 2C19 (CYP2C19) en desméthyl rabéprazole. Le CYP2C19 présente un polymorphisme génétique connu en raison de son déficit dans certaines sous-populations (par exemple, 3 à 5 % des Caucasiens et 17 à 20 % des Asiatiques). Le métabolisme du rabéprazole est lent dans ces sous-populations, par conséquent, ils sont qualifiés de métaboliseurs lents du médicament.
Excrétion
Après une dose orale unique de 20 mg de rabéprazole marqué au 14C, environ 90 % du médicament a été éliminé dans l'urine, principalement sous forme d'acide thioéther carboxylique ; ses métabolites glucuronide et acide mercapturique. Le reste de la dose a été récupéré dans les fèces. La récupération totale de la radioactivité était de 99,8 %. Aucun rabéprazole inchangé n'a été retrouvé dans l'urine ou les fèces.
Populations spécifiques
Patients gériatriques
Chez 20 sujets âgés en bonne santé ayant reçu 20 mg de comprimés à libération retardée d'ACIPHEX une fois par jour pendant sept jours, les valeurs de l'ASC ont approximativement doublé et la Cmax a augmenté de 60 % par rapport aux valeurs d'un groupe témoin parallèle plus jeune. Il n'y avait aucun signe d'accumulation de médicament après l'administration une fois par jour [voir Utilisation dans une population spécifique ].
Patients pédiatriques
La pharmacocinétique du rabéprazole a été étudiée chez 12 patients adolescents atteints de RGO âgés de 12 à 16 ans, dans une étude multicentrique. Les patients ont reçu 20 mg d'ACIPHEX comprimés à libération retardée une fois par jour pendant cinq ou sept jours. Une augmentation d'environ 40 % de l'exposition au rabéprazole a été notée après 5 à 7 jours d'administration par rapport à l'exposition après 1 jour d'administration. Les paramètres pharmacocinétiques chez les patients adolescents atteints de RGO âgés de 12 à 16 ans se situaient dans la fourchette observée chez les sujets adultes en bonne santé.
Patients masculins et féminins et groupes raciaux ou ethniques
Dans les analyses ajustées en fonction de la masse corporelle et de la taille, la pharmacocinétique du rabéprazole n'a montré aucune différence cliniquement significative entre les sujets masculins et féminins. Dans les études qui ont utilisé différentes formulations de rabéprazole, les valeurs d'ASC0-∞ pour les hommes japonais en bonne santé étaient environ 50 à 60 % supérieures aux valeurs dérivées des données regroupées d'hommes en bonne santé aux États-Unis.
Patients atteints d'insuffisance rénale
Chez 10 patients atteints d'insuffisance rénale terminale stable nécessitant une hémodialyse d'entretien (clairance de la créatinine ≤ 5 ml/min/1,73 m²), aucune différence cliniquement significative n'a été observée dans la pharmacocinétique du rabéprazole après une dose unique de 20 mg d'ACIPHEX 20 mg comprimés à libération retardée par rapport à 10 sujets sains.
Patients atteints d'insuffisance hépatique
Dans une étude à dose unique portant sur 10 patients atteints d'insuffisance hépatique légère à modérée (Child-Pugh Classe A et B, respectivement) auxquels ont été administrés une dose unique de 20 mg d'ACIPHEX 10 mg, comprimés à libération retardée, l'ASC0-24 a été approximativement doublée, l'élimination la demi-vie était 2 à 3 fois plus élevée et la clairance corporelle totale était réduite de moins de moitié par rapport aux valeurs observées chez les hommes en bonne santé.
Dans une étude à doses multiples chez 12 patients atteints d'insuffisance hépatique légère à modérée ayant reçu 20 mg d'ACIPHEX 10 mg de comprimés à libération retardée une fois par jour pendant huit jours, les valeurs de l'ASC0-∞ et de la Cmax ont augmenté d'environ 20 % par rapport aux valeurs chez des patients en bonne santé appariés selon l'âge et le sexe. sujets. Ces augmentations n'étaient pas statistiquement significatives.
Aucune information n'existe sur le sort du rabéprazole chez les patients atteints d'insuffisance hépatique sévère (Child-Pugh Classe C) [voir Utilisation dans des populations spécifiques ].
Études sur les interactions médicamenteuses
Administration combinée avec des antimicrobiens
Seize sujets sains génotypés comme métaboliseurs rapides par rapport au CYP2C19 ont reçu 20 mg de comprimés à libération retardée ACIPHEX, 1000 mg d'amoxicilline, 500 mg de clarithromycine ou les 3 médicaments dans une étude croisée à quatre voies. Chacun des quatre régimes a été administré deux fois par jour pendant 6 jours. L'ASC et la Cmax de la clarithromycine et de l'amoxicilline n'étaient pas différentes après une administration combinée par rapport aux valeurs après une administration unique. Cependant, l'ASC et la Cmax du rabéprazole ont augmenté de 11 % et 34 %, respectivement, après administration combinée. L'ASC et la Cmax de la 14-hydroxyclarithromycine (métabolite actif de la clarithromycine) ont également augmenté de 42 % et 46 %, respectivement. Cette augmentation de l'exposition au rabéprazole et à la 14-hydroxyclarithromycine ne devrait pas entraîner de problèmes de sécurité.
Effets d'autres médicaments sur le rabéprazole
Antiacides
La co-administration d'ACIPHEX 20 mg comprimés à libération retardée et d'antiacides n'a produit aucune modification cliniquement pertinente des concentrations plasmatiques de rabéprazole.
Effets du rabéprazole sur d'autres médicaments
Des études chez des sujets sains ont montré que le rabéprazole n'a pas d'interactions cliniquement significatives avec d'autres médicaments métabolisés par le système CYP450, tels que la théophylline (CYP1A2) administrée en doses orales uniques, le diazépam (CYP2C9 et CYP3A4) en dose intraveineuse unique et la phénytoïne ( CYP2C9 et CYP2C19) administrés en une seule dose intraveineuse (avec administration orale supplémentaire). Les interactions à l'état d'équilibre du rabéprazole et d'autres médicaments métabolisés par ce système enzymatique n'ont pas été étudiées chez les patients.
Clopidogrel
Le clopidogrel est métabolisé en son métabolite actif en partie par le CYP2C19. Une étude chez des sujets sains incluant des métaboliseurs rapides et intermédiaires du CYP2C19 recevant une administration une fois par jour de clopidogrel 75 mg en même temps qu'un placebo ou avec 20 mg d'ACIPHEX 20 mg comprimés à libération retardée (n = 36), pendant 7 jours a été menée. L'ASC moyenne du métabolite actif du clopidogrel a été réduite d'environ 12 % (le rapport moyen de l'ASC était de 88 %, avec un IC à 90 % de 81,7 à 95,5 %) lorsque les comprimés à libération retardée d'ACIPHEX ont été co-administrés par rapport à l'administration de clopidogrel avec un placebo [voir INTERACTIONS MÉDICAMENTEUSES ].
Digoxine
Chez des sujets adultes sains (n = 16), la co-administration de comprimés à libération retardée de 20 mg de rabéprazole sodique avec 2,5 mg de digoxine une fois par jour à l'état d'équilibre a entraîné une augmentation d'environ 29 % et 19 % de la Cmax moyenne et de l'ASC(0- 24) de digoxine [voir INTERACTIONS MÉDICAMENTEUSES ].
Kétoconazole
Chez des sujets adultes sains (n = 19), la co-administration de comprimés à libération retardée de 20 mg de rabéprazole sodique à l'état d'équilibre avec une dose orale unique de 400 mg de kétoconazole a entraîné une réduction moyenne d'environ 31 % de la Cmax et de l'ASC(0- inf) de kétoconazole [voir INTERACTIONS MÉDICAMENTEUSES ].
Ciclosporine
Des incubations in vitro utilisant des microsomes hépatiques humains ont indiqué que le rabéprazole inhibait le métabolisme de la cyclosporine avec une CI50 de 62 micromolaires, une concentration plus de 50 fois supérieure à la Cmax chez des volontaires sains après 14 jours d'administration de 20 mg de comprimés à libération retardée ACIPHEX 10 mg. Ce degré d'inhibition est similaire à celui de l'oméprazole à des concentrations équivalentes.
Microbiologie
Les données in vitro suivantes sont disponibles mais la signification clinique est inconnue.
Le rabéprazole sodique, l'amoxicilline et la clarithromycine en tant que traitement à trois médicaments se sont avérés actifs contre la plupart des souches d'Helicobacter pylori in vitro et dans les infections cliniques [voir INDICATIONS ET USAGE , Etudes cliniques ].
Helicobacter pylori
Des tests de sensibilité des isolats de H. pylori ont été effectués pour l'amoxicilline et la clarithromycine en utilisant la méthodologie de dilution sur gélose1, et les concentrations minimales inhibitrices (CMI) ont été déterminées.
Les procédures de test de sensibilité standardisées nécessitent l'utilisation de micro-organismes de contrôle de laboratoire pour contrôler les aspects techniques des procédures de laboratoire.
Incidence des organismes résistants aux antibiotiques parmi les isolats cliniques
Résistance au prétraitement
Le taux de résistance à H. pylori avant le traitement (CMI ≥ 1 mcg/mL) à la clarithromycine était de 9 % (51/560) au départ dans tous les groupes de traitement combinés. Plus de 99 % (558/560) des patients présentaient des isolats de H. pylori considérés comme sensibles (CMI ≤ 0,25 mcg/mL) à l'amoxicilline au départ. Deux patients avaient des isolats de H. pylori de base avec une CMI d'amoxicilline de 0,5 mcg/mL.
Pour obtenir des informations sur les tests de sensibilité à Helicobacter pylori, voir la section Microbiologie dans les informations de prescription pour la clarithromycine et l'amoxicilline.
Les patients présentant une infection persistante à H. pylori après un traitement par le rabéprazole, l'amoxicilline et la clarithromycine auront probablement des isolats cliniques résistants à la clarithromycine. Par conséquent, des tests de sensibilité à la clarithromycine doivent être effectués lorsque cela est possible. Si une résistance à la clarithromycine est démontrée ou si les tests de sensibilité ne sont pas possibles, un traitement antimicrobien alternatif doit être institué.
Résultats des tests de sensibilité à l'amoxicilline et résultats cliniques/bactériologiques
Dans l'étude multicentrique américaine, plus de 99 % (558/560) des patients présentaient des isolats de H. pylori considérés comme sensibles (CMI ≤ 0,25 mcg/mL) à l'amoxicilline au départ. Les 2 autres patients avaient des isolats de H. pylori à l'inclusion avec une CMI d'amoxicilline de 0,5 mcg/mL, et les deux isolats étaient résistants à la clarithromycine à l'inclusion ; dans un cas, H. pylori a été éradiqué. Dans les groupes de traitement de 7 et 10 jours, 75 % (107/145) et 79 % (112/142), respectivement, des patients qui avaient des CMI sensibles à l'amoxicilline avant le traitement (≤ 0,25 mcg/mL) ont été éradiqués de H. pylori . Aucun patient n'a développé de H. pylori résistant à l'amoxicilline pendant le traitement.
Pharmacogénomique
Dans une étude clinique évaluant les comprimés à libération retardée d'ACIPHEX chez des patients adultes japonais classés par génotype CYP2C19 (n = 6 par catégorie de génotype), la suppression de l'acide gastrique était plus élevée chez les métaboliseurs lents que chez les métaboliseurs rapides. Cela pourrait être dû à des taux plasmatiques de rabéprazole plus élevés chez les métaboliseurs lents. La pertinence clinique de ceci n'est pas connue. La question de savoir si les interactions du rabéprazole sodique avec d'autres médicaments métabolisés par le CYP2C19 seraient différentes entre les métaboliseurs rapides et les métaboliseurs lents n'a pas été étudiée.
Etudes cliniques
Guérison du RGO érosif ou ulcératif chez les adultes
Dans une étude américaine, multicentrique, randomisée, en double aveugle, contrôlée par placebo, 103 patients ont été traités pendant jusqu'à huit semaines avec un placebo, 10 mg, 20 mg ou 40 mg de comprimés à libération retardée ACIPHEX une fois par jour. Pour cette étude et toutes les études sur la guérison du RGO, seuls les patients présentant des symptômes de RGO et une œsophagite de grade 2 au moins (échelle de notation Hetzel-Dent modifiée) étaient éligibles. La cicatrisation endoscopique a été définie comme un grade 0 ou 1. Chaque dose de rabéprazole était significativement supérieure au placebo pour produire une cicatrisation endoscopique après quatre et huit semaines de traitement. Le pourcentage de patients démontrant une cicatrisation endoscopique était le suivant :
De plus, il y avait une différence statistiquement significative en faveur des doses d'ACIPHEX 10 mg, 20 mg et 40 mg par rapport au placebo aux semaines 4 et 8 concernant la résolution complète de la fréquence des brûlures d'estomac du RGO (p≤0,026). Tous les groupes ACIPHEX ont rapporté des taux significativement plus élevés de résolution complète de la sévérité des brûlures d'estomac pendant le RGO par rapport au placebo aux semaines 4 et 8 (p ≤ 0,036). Les réductions moyennes par rapport au départ de la dose quotidienne d'antiacide étaient statistiquement significatives pour tous les groupes ACIPHEX par rapport au placebo aux semaines 4 et 8 (p ≤ 0,007).
Dans une étude nord-américaine multicentrique, randomisée, en double aveugle et contrôlée par comparateur actif portant sur 336 patients, le pourcentage de patients guéris à l'endoscopie après quatre et huit semaines de traitement était statistiquement supérieur chez les patients traités par ACIPHEX comprimés à libération retardée par rapport à la ranitidine :
Une dose de 20 mg une fois par jour d'ACIPHEX comprimés à libération retardée a été significativement plus efficace que la ranitidine 150 mg quatre fois par jour sur le pourcentage de patients présentant une résolution complète des brûlures d'estomac aux semaines 4 et 8 (p
La posologie recommandée d'ACIPHEX 10 mg comprimés à libération retardée est de 20 mg une fois par jour pendant 4 à 8 semaines.
Maintien à long terme de la guérison du RGO érosif ou ulcératif chez les adultes
Le maintien à long terme de la cicatrisation chez les patients atteints de RGO érosif ou ulcératif précédemment guéris par un traitement antisécrétoire gastrique a été évalué dans deux études américaines, multicentriques, randomisées, en double aveugle, contrôlées par placebo, de conception identique d'une durée de 52 semaines. Les deux études ont randomisé 209 et 285 patients, respectivement, pour recevoir 10 mg ou 20 mg de comprimés à libération retardée ACIPHEX une fois par jour ou un placebo. Comme démontré dans les tableaux 10 et 11 ci-dessous, les patients traités par les comprimés à libération retardée d'ACIPHEX étaient significativement supérieurs au placebo dans les deux études en ce qui concerne le maintien de la cicatrisation du RGO et les proportions de patients restant sans symptômes de brûlures d'estomac à 52 semaines. La posologie recommandée d'ACIPHEX 20 mg comprimés à libération retardée est de 20 mg une fois par jour.
Traitement du RGO symptomatique chez les adultes
Deux études américaines, multicentriques, à double insu et contrôlées par placebo ont été menées chez 316 patients adultes souffrant de brûlures d'estomac diurnes et nocturnes. Les patients ont signalé 5 périodes ou plus de brûlures d'estomac modérées à très graves pendant la phase de traitement par placebo la semaine précédant la randomisation. Les patients ont été confirmés par endoscopie comme n'ayant pas d'érosions oesophagiennes.
Le pourcentage de périodes diurnes et/ou nocturnes sans brûlures d'estomac était supérieur avec 20 mg d'ACIPHEX 20 mg comprimés à libération retardée par rapport au placebo au cours des 4 semaines d'étude dans l'étude RABUSA-2 (47 % contre 23 %) et l'étude RAB-USA- 3 (52 % contre 28 %). Les diminutions moyennes par rapport au départ des scores moyens de brûlures d'estomac diurnes et nocturnes étaient significativement plus importantes pour ACIPHEX 20 mg par rapport au placebo à la semaine 4. Des affichages graphiques illustrant les scores moyens quotidiens diurnes et nocturnes sont fournis dans les figures 2 à 5.
Figure 2 : Scores moyens de brûlures d'estomac diurnes RAB-USA-2
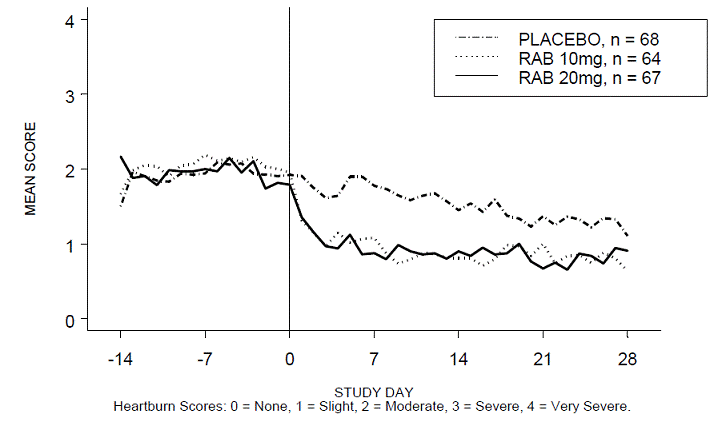
Figure 3 : Scores moyens de brûlures d'estomac nocturnes RAB-USA-2
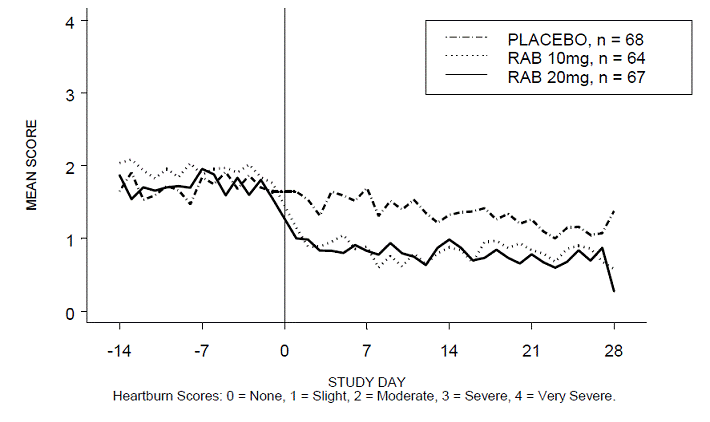
Figure 4 : Scores moyens de brûlures d'estomac diurnes RAB-USA-3 Figure 3 : Scores moyens de brûlures d'estomac diurnes RAB - USA –3
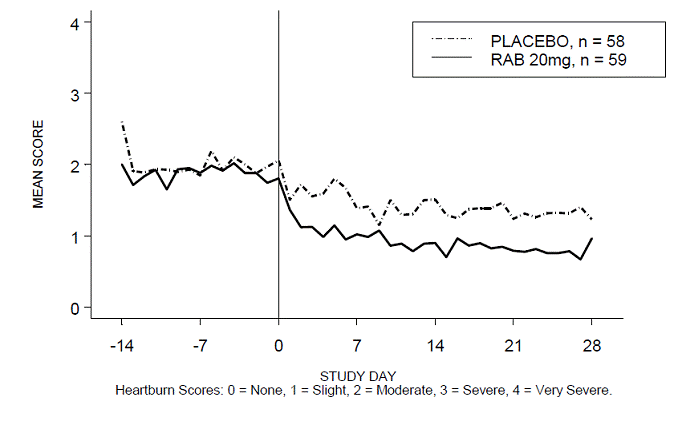
Figure 5 : Scores moyens de brûlures d'estomac nocturnes RAB-USA-3
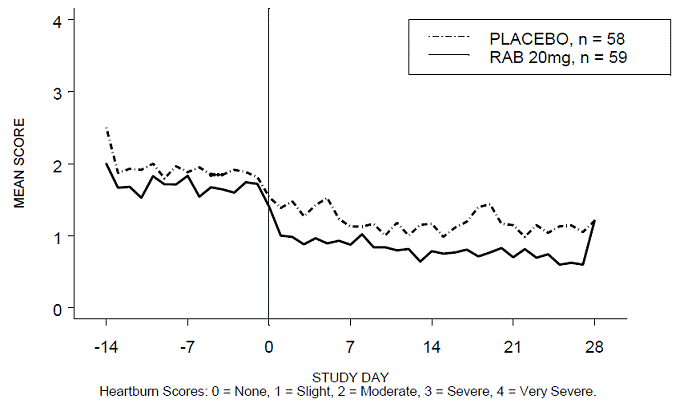
De plus, l'analyse combinée de ces deux études a montré que 20 mg de comprimés à libération retardée ACIPHEX 10 mg amélioraient de manière significative d'autres symptômes associés au RGO (régurgitations, éructations et satiété précoce) à la semaine 4 par rapport au placebo (toutes les valeurs de p
Une dose de 20 mg d'ACIPHEX 20 mg comprimés à libération retardée a également réduit de manière significative la consommation quotidienne d'antiacide par rapport au placebo sur 4 semaines (p
La posologie recommandée d'ACIPHEX comprimés à libération retardée est de 20 mg une fois par jour pendant 4 semaines.
Guérison des ulcères duodénaux chez les adultes
Dans une étude américaine, randomisée, en double aveugle et multicentrique évaluant l'efficacité de 20 mg et 40 mg d'ACIPHEX 10 mg comprimés à libération retardée une fois par jour par rapport à un placebo pour la cicatrisation des ulcères duodénaux définis par endoscopie, 100 patients ont été traités jusqu'à quatre semaines. ACIPHEX s'est avéré significativement supérieur au placebo pour la cicatrisation des ulcères duodénaux. Les pourcentages de patients avec cicatrisation endoscopique sont présentés ci-dessous :
Aux semaines 2 et 4, significativement plus de patients des groupes ACIPHEX 20 et 40 mg ont signalé une résolution complète de la fréquence de la douleur ulcéreuse (p ≤ 0,018), de l'intensité de la douleur diurne (p ≤ 0,023) et de l'intensité de la douleur nocturne (p ≤ 0,035) par rapport aux patients placebos. La seule exception était le groupe 40 mg versus placebo à la semaine 2 pour la fréquence de la douleur de l'ulcère duodénal (p = 0,094). Des différences significatives dans la résolution de la douleur diurne et nocturne ont été notées dans les deux groupes ACIPHEX par rapport au placebo à la fin de la première semaine de l'étude. Des réductions significatives de l'utilisation quotidienne d'antiacides ont également été notées dans les deux groupes ACIPHEX par rapport au placebo aux semaines 2 et 4 (p
Un essai international randomisé, en double aveugle et contrôlé par comparateur actif a été mené chez 205 patients comparant 20 mg d'ACIPHEX comprimés à libération retardée une fois par jour avec 20 mg d'oméprazole une fois par jour. L'étude a été conçue pour fournir au moins 80 % de puissance pour exclure une différence d'au moins 10 % entre ACIPHEX 10 mg et l'oméprazole, en supposant des taux de réponse de guérison sur quatre semaines de 93 % pour les deux groupes. Chez les patients atteints d'ulcères duodénaux définis par endoscopie et traités jusqu'à quatre semaines, ACIPHEX a été comparable à l'oméprazole en ce qui concerne la cicatrisation des ulcères duodénaux. Les pourcentages de patients avec cicatrisation endoscopique à deux et quatre semaines sont présentés ci-dessous :
ACIPHEX 20 mg et l'oméprazole étaient comparables en ce qui concerne la résolution complète des symptômes.
La posologie recommandée d'ACIPHEX 20 mg comprimés à libération retardée est de 20 mg une fois par jour pendant 4 semaines.
Éradication d'Helicobacter pylori chez les patients atteints d'un ulcère peptique ou d'une maladie non ulcéreuse symptomatique chez l'adulte
L'étude multicentrique américaine était une comparaison en double aveugle et en groupes parallèles des comprimés à libération retardée ACIPHEX, de l'amoxicilline et de la clarithromycine pendant 3, 7 ou 10 jours par rapport à l'oméprazole, l'amoxicilline et la clarithromycine pendant 10 jours. Le traitement consistait en rabéprazole 20 mg deux fois par jour, amoxicilline 1000 mg deux fois par jour et clarithromycine 500 mg deux fois par jour (RAC) ou oméprazole 20 mg deux fois par jour, amoxicilline 1000 mg deux fois par jour et clarithromycine 500 mg deux fois par jour (OAC). Les patients infectés par H. pylori ont été stratifiés selon un rapport 1: 1 pour ceux atteints d'ulcère peptique (actif ou ayant des antécédents d'ulcère au cours des cinq dernières années) [PUD] et ceux qui étaient symptomatiques mais sans ulcère peptique [NPUD], tel que déterminé par endoscopie digestive haute. Les taux globaux d'éradication de H. pylori, définis comme un 13C-UBT négatif pour H. pylori ≥ 6 semaines à compter de la fin du traitement, sont présentés dans le tableau suivant. Les taux d'éradication dans les régimes RAC de 7 et 10 jours se sont avérés similaires à ceux du régime OAC de 10 jours en utilisant soit les populations en intention de traiter (ITT) ou selon le protocole (PP). Les taux d'éradication dans le régime RAC de 3 jours étaient inférieurs à ceux des autres régimes.
La posologie recommandée d'ACIPHEX 20 mg comprimés à libération retardée est de 20 mg deux fois par jour avec de l'amoxicilline et de la clarithromycine pendant 7 jours.
Conditions hypersécrétoires pathologiques, y compris le syndrome de Zollinger-Ellison chez l'adulte
Douze patients atteints d'hypersécrétion gastrique idiopathique ou de syndrome de Zollinger-Ellison ont été traités avec succès par ACIPHEX 10 mg comprimés à libération retardée à des doses allant de 20 à 120 mg pendant jusqu'à 12 mois. ACIPHEX 10 mg a produit une inhibition satisfaisante de la sécrétion d'acide gastrique chez tous les patients et une résolution complète des signes et symptômes de la maladie acido-peptique lorsqu'elle était présente. ACIPHEX 20 mg a également prévenu la récidive de l'hypersécrétion gastrique et les manifestations de la maladie acido-peptique chez tous les patients. Les doses élevées d'ACIPHEX utilisées pour traiter cette petite cohorte de patients présentant une hypersécrétion gastrique ont été bien tolérées.
La posologie initiale recommandée des comprimés à libération retardée ACIPHEX est de 60 mg une fois par jour.
RÉFÉRENCES
1. Institut des normes cliniques et de laboratoire (CLSI). Méthodes de dilution des tests de sensibilité aux antimicrobiens pour les bactéries à croissance aérobie ; Norme approuvée - Dixième édition. Document CLSI M07-A10, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvanie, 19087, États-Unis 2015.
INFORMATIONS PATIENTS
ACIPHEX® (a-se-feks) (rabéprazole sodique) comprimés à libération retardée
Quelle est l'information la plus importante que je devrais connaître sur ACIPHEX 10mg ?
Vous devez prendre ACIPHEX 20 mg exactement comme prescrit, à la dose la plus faible possible et pendant la durée la plus courte nécessaire.
ACIPHEX 20 mg peut soulager vos symptômes liés à l'acidité, mais vous pouvez toujours avoir de graves problèmes d'estomac. Discutez avec votre médecin.
ACIPHEX 20 mg peut provoquer des effets indésirables graves, notamment :
- Un type de problème rénal (néphrite tubulo-interstitielle aiguë). Certaines personnes qui prennent des inhibiteurs de la pompe à protons (IPP), y compris ACIPHEX, peuvent développer un problème rénal appelé néphrite tubulo-interstitielle aiguë qui peut survenir à tout moment pendant le traitement par ACIPHEX. Appelez immédiatement votre médecin si vous avez une diminution de la quantité que vous urinez ou si vous avez du sang dans vos urines.
- Diarrhée causée par une infection (Clostridium difficile) dans vos intestins. Appelez immédiatement votre médecin si vous avez des selles liquides ou des douleurs à l'estomac qui ne disparaissent pas. Vous pouvez ou non avoir de la fièvre.
- Fractures osseuses (hanche, poignet ou colonne vertébrale). Des fractures osseuses de la hanche, du poignet ou de la colonne vertébrale peuvent survenir chez les personnes qui prennent plusieurs doses quotidiennes d'IPP et pendant une longue période (un an ou plus). Informez votre médecin si vous avez une fracture osseuse, en particulier à la hanche, au poignet ou à la colonne vertébrale.
- Certains types de lupus érythémateux. Le lupus érythémateux est une maladie auto-immune (les cellules immunitaires du corps attaquent d'autres cellules ou organes du corps). Certaines personnes qui prennent des médicaments IPP, y compris ACIPHEX, peuvent développer certains types de lupus érythémateux ou avoir une aggravation du lupus qu'ils ont déjà. Appelez immédiatement votre médecin si vous avez des douleurs articulaires nouvelles ou qui s'aggravent ou une éruption cutanée sur les joues ou les bras qui s'aggrave au soleil.
Parlez à votre médecin de votre risque de ces effets secondaires graves.
ACIPHEX 10mg peut avoir d'autres effets secondaires graves. Voir « Quels sont les effets secondaires possibles d'ACIPHEX 10 mg ? »
Qu'est-ce qu'ACIPHEX 20mg ?
ACIPHEX 10 mg est un médicament délivré sur ordonnance appelé inhibiteur de la pompe à protons (IPP).
ACIPHEX 20 mg réduit la quantité d'acide dans votre estomac.
Chez l'adulte, ACIPHEX est utilisé pour :
- 8 semaines à 16 semaines pour guérir les lésions de la muqueuse de l'œsophage liées à l'acide (appelées œsophagite érosive ou EE) et pour soulager les symptômes, tels que les brûlures d'estomac.
- maintien de la cicatrisation de l'œsophage et soulagement des symptômes liés à l'EE. On ne sait pas si ACIPHEX 20 mg est sûr et efficace s'il est utilisé plus de 12 mois (1 an).
- jusqu'à 4 semaines pour traiter les brûlures d'estomac diurnes et nocturnes et d'autres symptômes qui surviennent avec le reflux gastro-œsophagien (RGO).
- jusqu'à 4 semaines pour la cicatrisation et le soulagement des symptômes des ulcères duodénaux.
- 7 jours avec certains médicaments antibiotiques pour traiter une infection et des ulcères de l'estomac (duodénaux) causés par une bactérie appelée H. pylori.
- le traitement à long terme des conditions où votre estomac produit trop d'acide. Cela inclut une maladie rare appelée syndrome de Zollinger-Ellison.
Chez les adolescents de 12 ans et plus, ACIPHEX 10 mg est utilisé jusqu'à 8 semaines pour traiter les symptômes du RGO.
On ne sait pas si ACIPHEX est sûr et efficace chez les enfants de moins de 12 ans pour d'autres utilisations.
Les comprimés à libération retardée ACIPHEX ne doivent pas être utilisés chez les enfants de moins de 12 ans.
Ne prenez jamais ACIPHEX 10 mg si vous êtes :
- allergique au rabéprazole, à tout autre médicament IPP ou à l'un des ingrédients d'ACIPHEX. Voir la fin de ce Guide de Médication pour une liste complète d'ingrédients.
- prendre un médicament contenant de la rilpivirine (EDURANT, COMPLERA, ODEFSEY) utilisé pour traiter le VIH-1 (virus de l'immunodéficience humaine).
Avant de prendre ACIPHEX, informez votre médecin de toutes vos conditions médicales, y compris si vous :
- avez un faible taux de magnésium, un faible taux de calcium et un faible taux de potassium dans votre sang.
- avoir des problèmes de foie.
- êtes enceinte ou envisagez de devenir enceinte. On ne sait pas si ACIPHEX 20 mg peut nuire à votre bébé à naître.
- allaitez ou envisagez d'allaiter. On ne sait pas si ACIPHEX 10 mg passe dans votre lait maternel. Discutez avec votre médecin de la meilleure façon de nourrir votre bébé si vous prenez ACIPHEX.
Informez votre médecin de tous les médicaments que vous prenez, y compris les médicaments sur ordonnance et en vente libre, les vitamines et les suppléments à base de plantes. Dites surtout à votre médecin si vous prenez un antibiotique contenant de la clarithromycine ou de l'amoxicilline ou si vous prenez de la warfarine (COUMADIN, JANTOVEN), du méthotrexate (OTREXUP, RASUVO, TREXALL, XATMEP), de la digoxine (LANOXIN) ou un diurétique (diurétique).
Comment dois-je prendre ACIPHEX ?
- Prenez ACIPHEX exactement comme prescrit.
- ACIPHEX est généralement pris 1 fois par jour. Votre médecin vous indiquera l'heure à laquelle vous devez prendre ACIPHEX, en fonction de votre état de santé.
- ACIPHEX 10 mg peut être pris avec ou sans nourriture. Votre médecin vous dira si vous devez prendre ce médicament avec ou sans nourriture en fonction de votre état de santé.
- Avalez chaque comprimé ACIPHEX 20mg entier. Ne pas mâcher, écraser ou diviser les comprimés ACIPHEX 10 mg. Informez votre médecin si vous ne pouvez pas avaler les comprimés entiers.
- Si vous manquez une dose d'ACIPHEX 10 mg, prenez-la dès que possible. S'il est presque l'heure de votre prochaine dose, vous ne devez pas prendre la dose oubliée. Vous devez prendre votre prochaine dose à l'heure habituelle. Ne prenez pas 2 doses en même temps.
- Si vous avez pris trop d'ACIPHEX 20 mg, appelez immédiatement votre médecin ou votre centre antipoison au 1-800-222-1222, ou rendez-vous à la salle d'urgence la plus proche.
- Si votre médecin vous prescrit des antibiotiques avec ACIPHEX, lisez les informations destinées aux patients fournies avec les antibiotiques avant de les prendre.
Quels sont les effets secondaires possibles d'ACIPHEX 20mg ?
ACIPHEX 10 mg peut provoquer des effets indésirables graves, notamment :
- Voir « Quelles sont les informations les plus importantes que je devrais connaître sur ACIPHEX 20 mg ? »
- Interaction avec la warfarine. La prise de warfarine avec un IPP peut entraîner un risque accru de saignement et de décès. Si vous prenez de la warfarine, votre médecin peut vérifier votre sang pour voir si vous avez un risque accru de saignement. Si vous prenez de la warfarine pendant le traitement par ACIPHEX 20 mg, informez immédiatement votre médecin si vous présentez des signes ou symptômes de saignement, notamment :
- douleur, enflure ou inconfort
- maux de tête, étourdissements ou faiblesse
- ecchymoses inhabituelles (ecchymoses qui surviennent sans cause connue ou qui grossissent)
- saignements de nez
- saignement des gencives
- les saignements de coupures mettent longtemps à s'arrêter
- saignements menstruels plus abondants que la normale
- urine rose ou brune
- selles rouges ou noires
- tousser du sang
- vomir du sang ou du vomi qui ressemble à du marc de café
- Faibles niveaux de vitamine B-12 dans le corps peut survenir chez les personnes qui ont pris ACIPHEX 10 mg pendant une longue période (plus de 3 ans). Informez votre médecin si vous présentez des symptômes de faible taux de vitamine B-12, notamment un essoufflement, des étourdissements, un rythme cardiaque irrégulier, une faiblesse musculaire, une peau pâle, une sensation de fatigue, des changements d'humeur et des picotements ou un engourdissement dans les bras et les jambes.
- Faibles niveaux de magnésium dans le corps peut survenir chez les personnes qui ont pris ACIPHEX 20 mg pendant au moins 3 mois. Informez votre médecin si vous présentez des symptômes de faibles niveaux de magnésium, notamment des convulsions, des étourdissements, un rythme cardiaque irrégulier, de la nervosité, des douleurs musculaires ou une faiblesse et des spasmes des mains, des pieds ou de la voix.
- Excroissances de l'estomac (polypes de la glande fundique). Les personnes qui prennent des médicaments IPP pendant une longue période ont un risque accru de développer un certain type d'excroissances gastriques appelées polypes de la glande fundique, en particulier après avoir pris des médicaments IPP pendant plus d'un an.
- Réactions cutanées sévères. ACIPHEX peut provoquer des réactions cutanées rares mais graves pouvant affecter n'importe quelle partie de votre corps. Ces réactions cutanées graves peuvent nécessiter un traitement à l'hôpital et peuvent mettre la vie en danger :
- Éruption cutanée pouvant présenter des cloques, une desquamation ou des saignements sur n'importe quelle partie de la peau (y compris les lèvres, les yeux, la bouche, le nez, les organes génitaux, les mains ou les pieds).
- Vous pouvez également avoir de la fièvre, des frissons, des courbatures, un essoufflement ou des ganglions lymphatiques hypertrophiés.
Arrêtez de prendre ACIPHEX 20 mg et appelez immédiatement votre médecin. Ces symptômes peuvent être le premier signe d'une réaction cutanée sévère.
Les effets indésirables les plus courants d'ACIPHEX 20 mg chez l'adulte incluent : douleur, mal de gorge, gaz, infection et constipation.
Les effets secondaires les plus courants d'ACIPHEX chez les adolescents de 12 ans et plus comprennent : maux de tête, diarrhée, nausées, vomissements et douleurs dans la région de l'estomac (abdomen).
Ce ne sont pas tous les effets secondaires possibles d'ACIPHEX. Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
Comment dois-je conserver ACIPHEX ?
Conservez les comprimés ACIPHEX dans un endroit sec à température ambiante entre 68 ° F et 77 ° F (20 ° C et 25 ° C).
Conservez ACIPHEX 20 mg et tous les médicaments hors de la portée des enfants.
Informations générales sur l'utilisation sûre et efficace d'ACIPHEX.
Les médicaments sont parfois prescrits à des fins autres que celles énumérées dans un guide des médicaments. Ne pas utiliser ACIPHEX pour une condition pour laquelle il n'a pas été prescrit. Ne donnez pas ACIPHEX à d'autres personnes, même si elles présentent les mêmes symptômes que vous. Cela peut leur nuire.
Vous pouvez demander à votre médecin ou à votre pharmacien des informations sur ACIPHEX destinées aux professionnels de la santé.
Quels sont les ingrédients d'ACIPHEX 10mg ?
Ingrédient actif: rabéprazole sodique
Ingrédients inactifs: cire de carnauba, crospovidone, monoglycérides diacétylés, éthylcellulose, hydroxypropylcellulose, phtalate d'hypromellose, stéarate de magnésium, mannitol, hydroxyde de sodium, stéarylfumarate de sodium, talc et dioxyde de titane. L'oxyde de fer jaune est le colorant de l'enrobage du comprimé. L'oxyde de fer rouge est le pigment de l'encre.
Ce guide de médication a été approuvé par la Food and Drug Administration des États-Unis. Révisé : 03/2022
