Prevacid 15mg, 30mg Lansoprazole Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Prevacid et comment est-il utilisé ?
Prevacid 15 mg est un médicament délivré sur ordonnance utilisé pour traiter les symptômes des ulcères gastriques et intestinaux et pour diminuer la quantité d'acide produite dans l'estomac. Prevacid 15 mg peut être utilisé seul ou avec d'autres médicaments.
- Prevacid 15 mg est un inhibiteur de la pompe à protons.
Quels sont les effets secondaires possibles de Prevacid 30mg ?
Prevacid 30 mg peut provoquer des effets secondaires graves, notamment :
- fortes douleurs à l'estomac,
- diarrhée contenant du sang,
- saisie (convulsions,
- difficulté à uriner,
- du sang dans vos urines,
- gonflement,
- prise de poids rapide,
- vertiges,
- rythme cardiaque rapide ou irrégulier,
- tremblement,
- mouvements musculaires saccadés,
- se sentir nerveux,
- crampes ou spasmes musculaires dans les mains ou les pieds,
- tousser,
- sensation d'étouffement,
- douleurs articulaires et
- éruption cutanée sur les joues ou les bras qui s'aggrave au soleil
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Prevacid 15 mg incluent :
- nausée,
- Douleur d'estomac,
- diarrhée,
- la constipation et
- mal de tête
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Prevacid. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
PREVACID (lansoprazole) comprimés à désagrégation orale à libération retardée
LA DESCRIPTION
L'ingrédient actif des gélules à libération retardée PREVACID 30 mg et des comprimés à désintégration orale à libération retardée PREVACID 15 mg SoluTab est le lansoprazole, un benzimidazole substitué, le 2-[[[3-méthyl-4-(2,2,2trifluoroéthoxy)-2-pyridyl] méthyl] sulfinyl] benzimidazole, un composé qui inhibe la sécrétion d'acide gastrique. Sa formule empirique est C16H14F3N3O2S avec un poids moléculaire de 369,37. Le lansoprazole a la structure suivante :
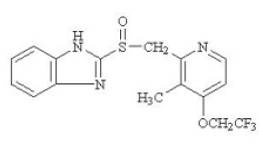
Le lansoprazole est une poudre cristalline inodore blanche à blanc brunâtre qui fond avec décomposition à environ 166 °C. Le lansoprazole est librement soluble dans le diméthylformamide; soluble dans le méthanol; peu soluble dans l'éthanol; légèrement soluble dans l'acétate d'éthyle, le dichlorométhane et l'acétonitrile; très légèrement soluble dans l'éther et pratiquement insoluble dans l'hexane et l'eau.
Le lansoprazole est stable lorsqu'il est exposé à la lumière jusqu'à deux mois. La vitesse de dégradation du composé dans une solution aqueuse augmente avec la diminution du pH. La demi-vie de dégradation de la substance médicamenteuse dans une solution aqueuse à 25 °C est d'environ 0,5 heure à pH 5,0 et d'environ 18 heures à pH 7,0.
PREVACID est fourni en gélules à libération retardée et PREVACID 15 mg SoluTab est fourni en comprimés à désintégration orale à libération retardée (SoluTab) pour administration orale.
PREVACID est disponible en deux dosages : 15 et 30 mg de lansoprazole par capsule. Chaque gélule à libération retardée contient des granules à enrobage entérique constitués de 15 ou 30 mg de lansoprazole (ingrédient actif) et des ingrédients inactifs suivants : sphère de sucre, saccharose, copolymère d'acide méthacrylique, hydroxypropylcellulose faiblement substituée, amidon, carbonate de magnésium, talc, polyéthylène glycol, dioxyde de titane, polysorbate 80, hydroxypropylcellulose, dioxyde de silicium colloïdal, D&C Red No. 28, FD&C Blue No. 1, FD&C Green No. 31 et FD&C Red No. 40.
PREVACID 30mg SoluTab est disponible en deux dosages : 15 et 30 mg de lansoprazole par comprimé. Chaque comprimé à désintégration orale à libération retardée contient des microgranules à enrobage entérique constitués de 15 ou 30 mg de lansoprazole (ingrédient actif) et des ingrédients inactifs suivants : mannitol, acide méthacrylique, hydroxypropylcellulose, lactose monohydraté-sphère de cellulose microcristalline, citrate de triéthyle, crospovidone, polyacrylate, carbonate de magnésium, aspartame2, monostéarate de glycéryle, hypromellose, stéarate de magnésium, acide citrique, dioxyde de titane, talc, arôme artificiel de fraise, polyéthylène glycol, polysorbate 80 et oxyde ferrique.
1Gélules PREVACID 15 mg uniquement. 2Phénylcétonuriques : PREVACID SoluTab contient de la phénylalanine 2,5 mg par comprimé de 15 mg et 5,1 mg par comprimé de 30 mg.
LES INDICATIONS
Traitement de l'ulcère duodénal actif
PREVACID et PREVACID SoluTab sont indiqués chez l'adulte pour un traitement à court terme (pendant quatre semaines) pour la cicatrisation et le soulagement des symptômes de l'ulcère duodénal actif [voir Etudes cliniques ].
Éradication de H. pylori pour réduire le risque de récidive de l'ulcère duodénal
Trithérapie : PREVACID ou PREVACID SoluTab/amoxicilline/clarithromycine
PREVACID ou PREVACID 30mg SoluTab en association à l'amoxicilline plus clarithromycine en trithérapie est indiqué chez l'adulte dans le traitement des patients atteints d'infection à H. pylori et d'ulcère duodénal (actif ou antécédent d'un an d'ulcère duodénal) pour éradiquer H. pylori. Il a été démontré que l'éradication de H. pylori réduit le risque de récidive de l'ulcère duodénal [voir Etudes cliniques ].
Veuillez vous référer aux informations de prescription complètes pour l'amoxicilline et la clarithromycine.
Bithérapie : PREVACID ou PREVACID SoluTab/amoxicilline
PREVACID ou PREVACID 15mg SoluTab en association à l'amoxicilline en bithérapie est indiqué chez l'adulte dans le traitement des patients atteints d'une infection à H. pylori et d'un ulcère duodénal (actif ou ayant un antécédent d'ulcère duodénal) allergiques ou intolérants à la clarithromycine ou chez qui une résistance à la clarithromycine est connue ou soupçonnée (voir les renseignements thérapeutiques de la clarithromycine, section Microbiologie). Il a été démontré que l'éradication de H. pylori réduit le risque de récidive de l'ulcère duodénal [voir Etudes cliniques ].
Veuillez vous référer aux informations de prescription complètes pour l'amoxicilline.
Entretien des ulcères duodénaux guéris
PREVACID et PREVACID SoluTab sont indiqués chez l'adulte pour maintenir la cicatrisation des ulcères duodénaux. Les études contrôlées ne s'étendent pas au-delà de 12 mois [voir Etudes cliniques ].
Traitement de l'ulcère gastrique bénin actif
PREVACID et PREVACID 30 mg SoluTab sont indiqués chez l'adulte pour un traitement à court terme (jusqu'à huit semaines) pour la cicatrisation et le soulagement des symptômes de l'ulcère gastrique bénin actif [voir Etudes cliniques ].
Guérison de l'ulcère gastrique associé aux AINS
PREVACID 30 mg et PREVACID SoluTab sont indiqués chez l'adulte pour le traitement de l'ulcère gastrique associé aux AINS chez les patients qui continuent l'utilisation d'AINS. Les études contrôlées ne se sont pas prolongées au-delà de huit semaines [voir Etudes cliniques ].
Réduction du risque d'ulcère gastrique associé aux AINS
PREVACID 15mg et PREVACID SoluTab sont indiqués chez l'adulte pour réduire le risque d'ulcère gastrique associé aux AINS chez les patients ayant des antécédents d'ulcère gastrique documenté nécessitant l'utilisation d'un AINS. Les études contrôlées ne se sont pas étendues au-delà de 12 semaines [voir Etudes cliniques ].
Traitement du reflux gastro-oesophagien symptomatique (RGO)
PREVACID 15 mg et PREVACID 30 mg SoluTab sont indiqués pour le traitement à court terme chez les adultes et les patients pédiatriques de 12 à 17 ans (jusqu'à huit semaines) et les patients pédiatriques de un à 11 ans (jusqu'à 12 semaines) pour le traitement des brûlures d'estomac et d'autres symptômes associés au RGO [voir Etudes cliniques ].
Traitement de l'œsophagite érosive (EE)
PREVACID 15 mg et PREVACID 30 mg SoluTab sont indiqués pour le traitement à court terme chez les adultes et les patients pédiatriques de 12 à 17 ans (jusqu'à huit semaines) et les patients pédiatriques de un à 11 ans (jusqu'à 12 semaines) pour la guérison et le soulagement des symptômes de tous les niveaux d'EE.
Pour les adultes qui ne guérissent pas avec PREVACID 30 mg ou PREVACID 15 mg SoluTab pendant huit semaines (5 à 10 %), il peut être utile de donner huit semaines supplémentaires de traitement. En cas de récidive de l'œsophagite érosive, une cure supplémentaire de huit semaines de PREVACID 30 mg ou de PREVACID SoluTab peut être envisagée [voir Etudes cliniques ].
Entretien de la guérison de l'EE
PREVACID et PREVACID SoluTab sont indiqués chez l'adulte pour maintenir la cicatrisation de l'EE. Les études contrôlées ne se sont pas étendues au-delà de 12 mois [voir Etudes cliniques ].
Conditions hypersécrétoires pathologiques, y compris le syndrome de Zollinger-Ellison (ZES)
PREVACID 15mg et PREVACID SoluTab sont indiqués chez l'adulte dans le traitement au long cours des états pathologiques d'hypersécrétion, dont le syndrome de Zollinger-Ellison [voir Etudes cliniques ].
DOSAGE ET ADMINISTRATION
Posologie adulte recommandée par indication
Posologie pédiatrique recommandée par indication
Patients pédiatriques âgés de 1 à 11 ans
Dans les études cliniques, PREVACID n'a pas été administré au-delà de 12 semaines chez les enfants de 1 à 11 ans. On ne sait pas si PREVACID est sûr et efficace s'il est utilisé plus longtemps que la durée recommandée. Ne pas dépasser la dose et la durée d'utilisation recommandées chez les patients pédiatriques comme indiqué ci-dessous [voir Utilisation dans des populations spécifiques ].
Insuffisance hépatique
La posologie recommandée est de 15 mg par jour par voie orale chez les patients présentant une insuffisance hépatique sévère (Child-Pugh C) [voir Utilisation dans des populations spécifiques ].
Informations administratives importantes
- Prenez PREVACID ou PREVACID 30mg SoluTab avant les repas.
- Ne pas écraser ou mâcher la gélule PREVACID 15mg ou PREVACID 30mg SoluTab.
- Prenez PREVACID ou PREVACID 30mg SoluTab au moins 30 minutes avant le sucralfate [voir INTERACTIONS MÉDICAMENTEUSES ].
- Les antiacides peuvent être utilisés en concomitance avec PREVACID ou PREVACID SoluTab.
- Doses oubliées : si une dose est oubliée, administrez-la dès que possible. Cependant, si la prochaine dose prévue est due, ne prenez pas la dose oubliée et prenez la dose suivante à temps. Ne prenez pas deux doses à la fois pour compenser une dose oubliée.
Gélules PREVACID
- Avaler tout entier; ne mâche pas.
- Pour les patients qui ont des difficultés à avaler des capsules, les capsules PREVACID peuvent être ouvertes et administrées par voie orale ou via une sonde nasogastrique dans les aliments mous ou les liquides spécifiés ci-dessous.
- L'administration de PREVACID dans des aliments ou des liquides autres que ceux discutés ci-dessous n'a pas été étudiée cliniquement et n'est donc pas recommandée.
Administration dans les aliments mous (compote de pommes, pudding ENSURE, fromage blanc, yaourt ou poires égouttées) :
Administration dans des liquides (jus de pomme, jus d'orange ou jus de tomate) :
Administration avec du jus de pomme par sonde nasogastrique (≥16 français)
PREVACID 15mg Solutab
- Ne pas casser ou couper.
- Placez le comprimé sur la langue, laissez-le se désagréger, avec ou sans eau, jusqu'à ce que les microgranules puissent être avalés. Ne mâchez pas les microgranules.
- Le comprimé se désintègre généralement en moins d'une minute.
- Alternativement, pour les enfants ou d'autres patients qui ont des difficultés à avaler des comprimés, PREVACID SoluTab peut être administré avec de l'eau via une seringue orale ou un tube NG comme suit :
Administration avec de l'eau dans une seringue orale
Administration avec de l'eau via une sonde NG (≥8 français)
COMMENT FOURNIE
Formes posologiques et points forts
PREVACID 15mg Gélules à libération retardée
- La concentration de 15 mg est une capsule opaque, rose et verte portant les inscriptions « TAP » et « PREVACID 15 ».
- La concentration de 30 mg est une capsule opaque, rose et noire portant les inscriptions « TAP » et « PREVACID 30 ».
PREVACID 30 mg SoluTab Comprimés à désintégration orale à libération retardée
- Le dosage de 15 mg est un comprimé rond blanc à blanc jaunâtre, non enrobé, contenant des mouchetures orange à brun foncé avec « 15 » gravé sur un côté.
- Le dosage de 30 mg est un comprimé rond blanc à blanc jaunâtre, non enrobé, contenant des mouchetures orange à brun foncé avec « 30 » gravé sur un côté.
Stockage et manutention
Gélules à libération retardée PREVACID , 15 mg, sont opaques, roses et verts avec « TAP » et « PREVACID 15 » imprimés sur les capsules. Les gélules à libération retardée de 30 mg sont opaques, roses et noires avec « TAP » et « PREVACID 30 » imprimés sur les gélules. Ils sont disponibles comme suit :
PREVACID 30mg SoluTab comprimés à désagrégation orale à libération retardée , 15 mg, sont des comprimés blancs à blanc jaunâtre, ronds non enrobés contenant des taches orange à brun foncé, avec « 15 » gravé sur un côté du comprimé. Les 30 mg sont des comprimés blancs à blanc jaunâtre, ronds non enrobés contenant des mouchetures orange à brun foncé, avec « 30 » gravé sur un côté du comprimé. Les tablettes sont disponibles comme suit :
Conserver à 25 °C (77 °F); excursions autorisées jusqu'à 15-30°C (59-86°F)[voir Température ambiante contrôlée USP ].
Distribué par : Takeda Pharmaceuticals America, Inc., Deerfield, IL 60015. Révisé : juin 2018
EFFETS SECONDAIRES
Les effets indésirables graves suivants sont décrits ci-dessous et ailleurs dans l'étiquetage :
- Néphrite tubulo-interstitielle aiguë [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Diarrhée associée à Clostridium difficile [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Fracture osseuse [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Effets indésirables cutanés graves [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Lupus érythémateux cutané et disséminé [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Carence en cyanocobalamine (vitamine B12) [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Hypomagnésémie et métabolisme minéral [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Polypes de la glande fundique [voir AVERTISSEMENTS ET PRECAUTIONS ]
Expérience des essais cliniques
Étant donné que les essais cliniques sont menés dans des conditions très variables, les taux d'effets indésirables observés dans les essais cliniques d'un médicament ne peuvent pas être directement comparés aux taux des essais cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique clinique.
Dans le monde, plus de 10 000 patients ont été traités avec PREVACID 30 mg dans des essais cliniques de phase 2 ou de phase 3 impliquant différentes posologies et durées de traitement. En général, le traitement par PREVACID 30 mg a été bien toléré dans les essais à court et à long terme.
Les effets indésirables suivants ont été signalés par le médecin traitant comme ayant une relation possible ou probable avec le médicament chez 1 % ou plus des patients traités par PREVACID et se sont produits à un taux plus élevé chez les patients traités par PREVACID que chez les patients traités par placebo dans le tableau 1.
Des céphalées ont également été observées à une incidence supérieure à 1 %, mais elles étaient plus fréquentes sous placebo. L'incidence de diarrhée était semblable entre les patients qui ont reçu le placebo et les patients qui ont reçu 15 et 30 mgs de PREVACID, mais plus haut dans les patients qui ont reçu 60 mgs de PREVACID (2.9, 1.4, 4.2 et 7.4 %, respectivement).
L'événement indésirable possiblement ou probablement lié au traitement le plus souvent signalé au cours du traitement d'entretien était la diarrhée.
Dans l'étude de réduction des risques de PREVACID pour les ulcères gastriques associés aux AINS, l'incidence de la diarrhée chez les patients traités par PREVACID 30 mg, le misoprostol et le placebo était de 5, 22 et 3 %, respectivement.
Une autre étude pour la même indication, où les patients prenaient soit un inhibiteur de la COX-2, soit du lansoprazole et du naproxène, a démontré que le profil de sécurité était similaire à l'étude précédente. Les réactions additionnelles de cette étude non précédemment observées dans d'autres essais cliniques avec PREVACID 30mg ont inclus la contusion, le duodénite, le malaise épigastrique, le trouble oesophagien, la fatigue, la faim, la hernie hiatale, l'enrouement, la vidange gastrique altérée, la métaplasie et l'affaiblissement rénal.
Les expériences défavorables supplémentaires se produisant dans moins de 1 % de patients ou de sujets qui ont reçu 15 mgs PREVACID dans les procès domestiques sont montrées ci-dessous :
Corps dans son ensemble - abdomen hypertrophié, réaction allergique, asthénie, dorsalgie, candidose, carcinome, douleur thoracique (non précisée), frissons, œdème, fièvre, syndrome grippal, mauvaise haleine, infection (non précisée), malaise, cervicalgie, raideur de la nuque, douleur , douleur pelvienne
Système cardiovasculaire - angine de poitrine, arythmie, bradycardie, accident vasculaire cérébral/infarctus cérébral, hypertension/hypotension, migraine, infarctus du myocarde, palpitations, choc (insuffisance circulatoire), syncope, tachycardie, vasodilatation
Système digestif - selles anormales, anorexie, bézoard, cardiospasme, lithiase biliaire, colite, bouche sèche, dyspepsie, dysphagie, entérite, éructation, sténose œsophagienne, ulcère œsophagien, œsophagite, décoloration fécale, flatulence, nodules gastriques/polypes de la glande fundique, gastrite, gastro-entérite, anomalie gastro-intestinale , trouble gastro-intestinal, hémorragie gastro-intestinale, glossite, hémorragie gingivale, hématémèse, augmentation de l'appétit, augmentation de la salivation, méléna, ulcération buccale, nausées et vomissements, nausées et vomissements et diarrhée, candidose gastro-intestinale, trouble rectal, hémorragie rectale, stomatite, ténesme, soif, trouble de la langue, colite ulcéreuse, stomatite ulcéreuse
Système endocrinien - diabète sucré, goitre, hypothyroïdie Système sanguin et lymphatique - anémie, hémolyse, lymphadénopathie
Troubles du métabolisme et de la nutrition - avitaminose, goutte, déshydratation, hyperglycémie/hypoglycémie, œdème périphérique, prise/perte de poids
Système musculo-squelettique - arthralgie, arthrite, troubles osseux, troubles articulaires, crampes dans les jambes, douleurs musculo-squelettiques, myalgie, myasthénie, ptose, synovite
Système nerveux - rêves anormaux, agitation, amnésie, anxiété, apathie, confusion, convulsions, démence, dépersonnalisation, dépression, diplopie, étourdissements, labilité émotionnelle, hallucinations, hémiplégie, aggravation de l'hostilité, hyperkinésie, hypertonie, hypoesthésie, insomnie, diminution/augmentation de la libido, nervosité, névrose, paresthésie, trouble du sommeil, somnolence, troubles de la pensée, tremblements, vertiges
Système respiratoire - asthme, bronchite, augmentation de la toux, dyspnée, épistaxis, hémoptysie, hoquet, néoplasie laryngée, fibrose pulmonaire, pharyngite, trouble pleural, pneumonie, trouble respiratoire, inflammation/infection des voies respiratoires supérieures, rhinite, sinusite, stridor
Peau et Appendices - acné, alopécie, dermatite de contact, peau sèche, éruption fixe, trouble capillaire, éruption maculopapuleuse, trouble des ongles, prurit, éruption cutanée, carcinome cutané, trouble cutané, sudation, urticaire
Sens spéciaux - vision anormale, amblyopie, blépharite, vision trouble, cataracte, conjonctivite, surdité, sécheresse oculaire, trouble oreille/œil, douleur oculaire, glaucome, otite moyenne, parosmie, photophobie, dégénérescence/trouble rétinien, perte du goût, altération du goût, acouphènes, troubles visuels défaut de terrain
Système urogénital - menstruations anormales, hypertrophie mammaire, douleur mammaire, sensibilité mammaire, dysménorrhée, dysurie, gynécomastie, impuissance, tartre rénal, douleur rénale, leucorrhée, ménorragie, trouble menstruel, trouble du pénis, polyurie, trouble testiculaire, douleur urétrale, pollakiurie, rétention urinaire, infection des voies urinaires, urgence urinaire, troubles de la miction, vaginite
Expérience post-commercialisation
Des effets indésirables supplémentaires ont été rapportés depuis la commercialisation de PREVACID et PREVACID 30mg SoluTab. La majorité de ces cas sont d'origine étrangère et une relation avec PREVACID 15 mg ou PREVACID SoluTab n'a pas été établie. Étant donné que ces réactions ont été signalées volontairement par une population de taille inconnue, il est impossible d'en estimer la fréquence. Ces événements sont répertoriés ci-dessous par système de carrosserie COSTART.
Corps dans son ensemble - réactions anaphylactiques/anaphylactoïdes, lupus érythémateux disséminé ;
Système digestif - hépatotoxicité, pancréatite, vomissements ;
Système sanguin et lymphatique - agranulocytose, anémie aplasique, anémie hémolytique, leucopénie, neutropénie, pancytopénie, thrombocytopénie et purpura thrombocytopénique thrombotique;
Infections et infestations - Diarrhée associée à Clostridium difficile ;
Troubles du métabolisme et de la nutrition - hypomagnésémie, hypocalcémie, hypokaliémie, hyponatrémie;
Système musculo-squelettique - fracture osseuse, myosite;
Peau et Appendices - réactions dermatologiques sévères incluant érythème polymorphe, SJS/TEN (certains mortels), DRESS, AGEP, lupus érythémateux cutané ;
Sens spéciaux - trouble de la parole;
Système urogénital - néphrite interstitielle, rétention urinaire.
Thérapie combinée avec l'amoxicilline et la clarithromycine
Dans les essais cliniques utilisant une thérapie combinée avec PREVACID plus amoxicilline et clarithromycine, et PREVACID 30 mg plus amoxicilline, aucun effet indésirable particulier à ces combinaisons de médicaments n'a été observé. Les effets indésirables qui se sont produits ont été limités à ceux qui avaient été précédemment signalés avec PREVACID 15 mg, l'amoxicilline ou la clarithromycine.
Trithérapie : PREVACID/amoxicilline/clarithromycine
Les effets indésirables les plus fréquemment rapportés chez les patients ayant reçu une trithérapie pendant 14 jours étaient la diarrhée (7 %), les céphalées (6 %) et l'altération du goût (5 %). Il n'y avait pas de différences statistiquement significatives dans la fréquence des effets indésirables rapportés entre les régimes de trithérapie de 10 et 14 jours. Aucun effet indésirable lié au traitement n'a été observé à des taux significativement plus élevés avec la trithérapie qu'avec n'importe quel régime de bithérapie.
Bithérapie : PREVACID/amoxicilline
Les effets indésirables les plus fréquemment rapportés chez les patients ayant reçu PREVACID 30 mg trois fois par jour plus amoxicilline trois fois par jour en bithérapie étaient la diarrhée (8 %) et les céphalées (7 %). Aucun effet indésirable lié au traitement n'a été observé à des taux significativement plus élevés avec PREVACID 30 mg trois fois par jour plus amoxicilline trois fois par jour bithérapie qu'avec PREVACID 15 mg seul.
Pour plus d'informations sur les effets indésirables avec les agents antibactériens (amoxicilline et clarithromycine) indiqués en association avec PREVACID ou PREVACID SoluTab, reportez-vous à la section Effets indésirables de leurs informations de prescription.
Valeurs de laboratoire
Les changements suivants dans les paramètres de laboratoire chez les patients qui ont reçu PREVACID 30 mg ont été signalés comme des effets indésirables :
Tests anormaux de la fonction hépatique, augmentation de la SGOT (AST), augmentation de la SGPT (ALT), augmentation de la créatinine, augmentation de la phosphatase alcaline, augmentation des globulines, augmentation de la GGTP, augmentation/diminution/anomalie des globules blancs, rapport AG anormal, globules rouges anormaux, bilirubinémie, augmentation du potassium sanguin, augmentation de l'urée sanguine, présence de cristaux d'urine, éosinophilie, diminution de l'hémoglobine, hyperlipémie, augmentation/diminution des électrolytes, augmentation/diminution du cholestérol, augmentation des glucocorticoïdes, augmentation de la LDH, augmentation/diminution/anomalie des plaquettes, augmentation des taux de gastrine et présence de sang occulte dans les selles. Des anomalies urinaires telles que l'albuminurie, la glycosurie et l'hématurie ont également été rapportées. D'autres anomalies de laboratoire isolées ont été signalées.
Dans les études contrôlées par placebo, lorsque la SGOT (AST) et la SGPT (ALT) ont été évaluées, 0,4 % (4/978) et 0,4 % (11/2677) des patients, qui ont reçu le placebo et PREVACID, respectivement, ont présenté des élévations enzymatiques supérieures à trois fois la limite supérieure de la plage normale lors de la dernière visite de traitement. Aucun de ces patients ayant reçu PREVACID 30 mg n'a signalé de jaunisse à aucun moment de l'étude.
Dans les essais cliniques utilisant une thérapie combinée avec PREVACID 15 mg plus amoxicilline et clarithromycine, et PREVACID plus amoxicilline, aucune augmentation des anomalies de laboratoire particulières à ces combinaisons de médicaments n'a été observée.
Pour plus d'informations sur les changements de valeur de laboratoire avec les agents antibactériens (amoxicilline et clarithromycine) indiqués en association avec PREVACID ou PREVACID 30mg SoluTab, se référer à la section Effets indésirables de leurs informations de prescription.
INTERACTIONS MÉDICAMENTEUSES
Les tableaux 2 et 3 incluent des médicaments avec des interactions médicamenteuses cliniquement importantes et des interactions avec des diagnostics lorsqu'ils sont administrés en concomitance avec PREVACID 15 mg ou PREVACID SoluTab et des instructions pour les prévenir ou les gérer.
Consultez l'étiquetage des médicaments utilisés en concomitance pour obtenir de plus amples informations sur les interactions avec les IPP.
AVERTISSEMENTS
Inclus dans le cadre du PRÉCAUTIONS section.
PRÉCAUTIONS
Présence de malignité gastrique
Chez l'adulte, la réponse symptomatique au traitement par PREVACID 15 mg ou PREVACID SoluTab n'exclut pas la présence d'une tumeur maligne gastrique. Envisager un suivi et des tests diagnostiques supplémentaires chez les patients adultes qui ont une réponse sous-optimale ou une rechute symptomatique précoce après avoir terminé le traitement avec un IPP. Chez les patients plus âgés, envisagez également une endoscopie.
Néphrite tubulo-interstitielle aiguë
Une néphrite tubulo-interstiale (TIN) aiguë a été observée chez des patients prenant des IPP et peut survenir à tout moment au cours du traitement par IPP. Les patients peuvent présenter divers signes et symptômes allant de réactions d'hypersensibilité symptomatiques à des symptômes non spécifiques d'une diminution de la fonction rénale (p. ex., malaise, nausées, anorexie). Dans les séries de cas rapportés, certains patients ont été diagnostiqués sur biopsie et en l'absence de manifestations extra-rénales (p. ex., fièvre, éruption cutanée ou arthralgie). Arrêtez PREVACID ou PREVACID 15 mg SoluTab et évaluez les patients chez qui on soupçonne une TIN aiguë [voir CONTRE-INDICATIONS ].
Diarrhée associée à Clostridium difficile
Des études observationnelles publiées suggèrent que le traitement par IPP comme PREVACID 30 mg et PREVACID 30 mg SoluTab peut être associé à un risque accru de diarrhée associée à Clostridium difficile (DACD), en particulier chez les patients hospitalisés. Ce diagnostic doit être évoqué en cas de diarrhée qui ne s'améliore pas [voir EFFETS INDÉSIRABLES ].
Les patients doivent utiliser la dose la plus faible et la durée la plus courte de traitement par IPP appropriées à l'affection traitée.
La CDAD a été rapportée avec l'utilisation de presque tous les agents antibactériens. Pour plus d'informations spécifiques aux agents antibactériens (clarithromycine et amoxicilline) indiqués pour une utilisation en association avec PREVACID 15 mg ou PREVACID 15 mg SoluTab, reportez-vous à la section Avertissements et précautions de leurs informations de prescription.
Fracture de l'os
Plusieurs études observationnelles publiées suggèrent que le traitement par IPP peut être associé à un risque accru de fractures de la hanche, du poignet ou de la colonne vertébrale liées à l'ostéoporose. Le risque de fracture était accru chez les patients ayant reçu une dose élevée, définie comme de multiples doses quotidiennes, et un traitement par IPP à long terme (un an ou plus). Les patients doivent utiliser la dose la plus faible et la durée la plus courte de traitement par IPP appropriées à l'affection traitée. Les patients à risque de fractures liées à l'ostéoporose doivent être pris en charge conformément aux directives de traitement établies [voir DOSAGE ET ADMINISTRATION , EFFETS INDÉSIRABLES ].
Effets indésirables cutanés graves
Des effets indésirables cutanés graves, y compris le syndrome de Stevens-Johnson (SJS) et la nécrolyse épidermique toxique (NET), la réaction médicamenteuse avec éosinophilie et symptômes systémiques (DRESS) et la pustulose exanthématique aiguë généralisée (PEAG) ont été signalés en association avec l'utilisation d'IPP [voir EFFETS INDÉSIRABLES ]. Arrêtez PREVACID 30 mg ou PREVACID SoluTab dès les premiers signes ou symptômes d'effets indésirables cutanés sévères ou d'autres signes d'hypersensibilité et envisagez une évaluation plus approfondie.
Lupus érythémateux cutané et disséminé
Des cas de lupus érythémateux cutané (CLE) et de lupus érythémateux disséminé (LES) ont été signalés chez des patients prenant des IPP, dont le lansoprazole. Ces événements se sont produits à la fois comme une nouvelle apparition et comme une exacerbation d'une maladie auto-immune existante. La majorité des cas de lupus érythémateux induits par les IPP étaient des CLE.
La forme la plus courante de CLE signalée chez les patients traités par des IPP était la CLE subaiguë (SCLE) et s'est produite dans les semaines ou les années suivant un traitement médicamenteux continu chez des patients allant des nourrissons aux personnes âgées. Généralement, les résultats histologiques ont été observés sans atteinte des organes.
Le lupus érythémateux disséminé (LES) est moins fréquemment rapporté que le CLE chez les patients recevant des IPP. Le LED associé aux IPP est généralement plus léger que le LED non médicamenteux. L'apparition du LES s'est généralement produite quelques jours à quelques années après le début du traitement, principalement chez des patients allant des jeunes adultes aux personnes âgées. La majorité des patients présentaient une éruption cutanée ; cependant, des arthralgies et des cytopénies ont également été signalées.
Évitez l'administration d'IPP plus longtemps que médicalement indiqué. Si des signes ou des symptômes compatibles avec CLE ou SLE sont notés chez les patients recevant PREVACID 15 mg ou PREVACID SoluTab, arrêtez le médicament et référez le patient au spécialiste approprié pour évaluation. La plupart des patients s'améliorent avec l'arrêt de l'IPP seul en quatre à 12 semaines. Les tests sérologiques (par exemple, ANA) peuvent être positifs et les résultats des tests sérologiques élevés peuvent prendre plus de temps à se résoudre que les manifestations cliniques.
Carence en cyanocobalamine (vitamine B12)
Un traitement quotidien avec des médicaments antiacides sur une longue période (p. ex., plus de trois ans) peut entraîner une malabsorption de la cyanocobalamine (vitamine B12) causée par une hypo- ou une achlorhydrie. De rares cas de carence en cyanocobalamine survenant avec un traitement anti-acide ont été rapportés dans la littérature. Ce diagnostic doit être envisagé si des symptômes cliniques compatibles avec un déficit en cyanocobalamine sont observés chez des patients traités par PREVACID ou PREVACID SoluTab.
Hypomagnésémie et métabolisme minéral
De rares cas d'hypomagnésémie, symptomatique et asymptomatique, ont été rapportés chez des patients traités par des IPP pendant au moins trois mois, dans la plupart des cas après un an de traitement. Les événements indésirables graves comprennent la tétanie, les arythmies et les convulsions. L'hypomagnésémie peut entraîner une hypocalcémie et/ou une hypokaliémie et peut exacerber l'hypocalcémie sous-jacente chez les patients à risque. Chez la plupart des patients, le traitement de l'hypomagnésémie a nécessité un remplacement du magnésium et l'arrêt de l'IPP.
Pour les patients qui devraient suivre un traitement prolongé ou qui prennent des IPP avec des médicaments tels que la digoxine ou des médicaments susceptibles de provoquer une hypomagnésémie (p. EFFETS INDÉSIRABLES ].
Envisagez de surveiller les taux de magnésium et de calcium avant l'initiation de PREVACID 30 mg ou de PREVACID SoluTab et périodiquement pendant le traitement chez les patients présentant un risque préexistant d'hypocalcémie (par exemple, hypoparathyroïdie). Compléter avec du magnésium et/ou du calcium, si nécessaire. Si l'hypocalcémie est réfractaire au traitement, envisager d'arrêter l'IPP.
Interactions avec les investigations pour les tumeurs neuroendocrines
Les taux sériques de chromogranine A (CgA) augmentent en raison de la diminution de l'acidité gastrique induite par les médicaments. L'augmentation du taux de CgA peut entraîner des résultats faussement positifs dans les investigations diagnostiques des tumeurs neuroendocrines. Les professionnels de la santé doivent temporairement arrêter le traitement par lansoprazole au moins 14 jours avant d'évaluer les taux de CgA et envisager de répéter le test si les taux initiaux de CgA sont élevés. Si des tests en série sont effectués (par exemple, pour la surveillance), le même laboratoire commercial doit être utilisé pour les tests, car les plages de référence entre les tests peuvent varier [voir INTERACTIONS MÉDICAMENTEUSES , PHARMACOLOGIE CLINIQUE ].
Interaction avec le méthotrexate
La littérature suggère que l'utilisation concomitante d'IPP avec le méthotrexate (principalement à forte dose) peut élever et prolonger les taux sériques de méthotrexate et/ou de son métabolite, pouvant entraîner des toxicités du méthotrexate. En cas d'administration de méthotrexate à forte dose, un arrêt temporaire de l'IPP peut être envisagé chez certains patients [voir INTERACTIONS MÉDICAMENTEUSES , PHARMACOLOGIE CLINIQUE ].
Patients atteints de phénylcétonurie
La phénylalanine peut être nocive pour les patients atteints de phénylcétonurie (PCU). PREVACID 30mg SoluTab contient de la phénylalanine, un composant de l'aspartam. Chaque comprimé de 15 mg contient 2,5 mg et chaque comprimé de 30 mg contient 5,1 mg de phénylalanine. Avant de prescrire PREVACID SoluTab à un patient atteint de PCU, tenez compte de la quantité quotidienne combinée de phénylalanine provenant de toutes les sources, y compris PREVACID 30 mg SoluTab.
Polypes de la glande fundique
L'utilisation d'IPP est associée à un risque accru de polypes des glandes fundiques qui augmente avec une utilisation à long terme, en particulier au-delà d'un an. La plupart des utilisateurs d'IPP qui ont développé des polypes de la glande fundique étaient asymptomatiques et les polypes de la glande fundique ont été identifiés accidentellement à l'endoscopie. Utilisez la durée la plus courte de traitement par IPP appropriée à la condition traitée.
Risque d'épaississement des valves cardiaques chez les patients pédiatriques de moins d'un an
PREVACID 30 mg et PREVACID SoluTab ne sont pas approuvés chez les patients pédiatriques de moins d'un an. Des études non cliniques chez des rats juvéniles avec le lansoprazole ont démontré un effet indésirable de l'épaississement des valves cardiaques. Le risque de lésion valvulaire cardiaque ne semble pas concerner les patients âgés d'un an et plus [voir Utilisation dans des populations spécifiques ].
Informations sur les conseils aux patients
Conseillez au patient de lire l'étiquetage patient approuvé par la FDA ( Guide des médicaments et Mode d'emploi ).
Conseillez aux patients de :
Néphrite tubulo-interstitielle aiguë
Appeler leur professionnel de la santé s'ils présentent des signes et/ou des symptômes associés à une néphrite tubulo-interstitielle aiguë [voir AVERTISSEMENTS ET PRECAUTIONS ].
Diarrhée associée à Clostridium difficile
Appeler immédiatement leur professionnel de la santé s'ils ont une diarrhée qui ne s'améliore pas [voir AVERTISSEMENTS ET PRECAUTIONS ].
Fracture de l'os
De signaler toute fracture, en particulier de la hanche, du poignet ou de la colonne vertébrale, à son professionnel de la santé [voir AVERTISSEMENTS ET PRECAUTIONS ].
Effets indésirables cutanés graves
Pour arrêter PREVACID ou PREVACID 30mg SoluTab et appeler immédiatement leur fournisseur de soins de santé pour une évaluation plus approfondie [voir AVERTISSEMENTS ET PRECAUTIONS ].
Lupus érythémateux cutané et disséminé
D'appeler immédiatement leur fournisseur de soins de santé en cas d'apparition ou d'aggravation des symptômes associés au lupus érythémateux cutané ou disséminé [voir AVERTISSEMENTS ET PRECAUTIONS ].
Carence en cyanocobalamine (vitamine B12)
· De signaler tout symptôme clinique pouvant être associé à une carence en cyanocobalamine à son professionnel de la santé, s'il reçoit PREVACID ou PREVACID SoluTab depuis plus de trois ans [voir AVERTISSEMENTS ET PRECAUTIONS ].
Hypomagnésémie et minéral
Métabolisme Pour signaler tout symptôme clinique pouvant être associé à une hypomagnésémie, une hypocalcémie et/ou une hypokaliémie à leur fournisseur de soins de santé, s'ils ont reçu PREVACID ou PREVACID 15 mg SoluTab pendant au moins trois mois [voir AVERTISSEMENTS ET PRECAUTIONS ].
Interactions médicamenteuses
Conseillez aux patients de signaler à leur professionnel de santé s'ils prennent des produits contenant de la rilpivirine [voir CONTRE-INDICATIONS ] ou méthotrexate à haute dose [voir AVERTISSEMENTS ET PRECAUTIONS ].
Grossesse
Informez une femme enceinte du risque potentiel pour le fœtus. Conseillez aux femmes en âge de procréer d'informer leur fournisseur de soins de santé d'une grossesse connue ou suspectée [voir Utilisation dans des populations spécifiques ].
Administration
- Doses oubliées : si une dose est oubliée, administrez-la dès que possible. Cependant, si la prochaine dose prévue est due, ne prenez pas la dose oubliée et prenez la dose suivante à temps. Ne prenez pas deux doses à la fois pour compenser une dose oubliée.
- PREVACID ou PREVACID 30mg SoluTab doit être pris avant de manger.
- Ne pas écraser ou mâcher la capsule PREVACID 15mg ou PREVACID SoluTab.
- Prenez PREVACID ou PREVACID 30mg SoluTab au moins 30 minutes avant le sucralfate.
- Phénylcétonuriques : Contient de la phénylalanine 2,5 mg par 15 mg de PREVACID 30 mg SoluTab Tablet et 5,1 mg par 30 mg PREVACID SoluTab Tablet.
Gélules PREVACID
- Avaler tout entier; ne mâche pas.
- Pour les patients qui ont des difficultés à avaler les gélules :
- Les gélules de PREVACID 15 mg peuvent être ouvertes et saupoudrées sur de la compote de pommes, du pudding ENSURE, du fromage cottage, du yaourt ou des poires égouttées
- Les gélules de PREVACID 15 mg peuvent également être vidées dans un petit volume de jus de pomme, de jus d'orange ou de jus de tomate.
- Alternativement, les capsules PREVACID peuvent être administrées avec du jus de pomme via une sonde nasogastrique
- Voir les instructions d'utilisation pour une description de toutes les instructions de préparation et d'administration
PREVACID SoluTab
- Ne pas casser ou couper.
- Placez le comprimé sur la langue ; laissez-le se désintégrer, avec ou sans eau, jusqu'à ce que les particules puissent être avalées. Ne mâchez pas les particules.
- Le comprimé se désintègre généralement en moins d'une minute.
- Alternativement, pour les enfants ou autres patients ayant des difficultés à avaler les comprimés, PREVACID 30 mg SoluTab peut être administré avec de l'eau via une seringue orale ou un tube NG, comme décrit dans la notice d'utilisation.
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Dans deux études de cancérogénicité de 24 mois, des rats Sprague-Dawley ont été traités avec des doses orales de lansoprazole de 5 à 150 mg/kg/jour, soit environ une à 40 fois l'exposition sur la surface corporelle (mg/m²) d'une personne de 50 kg. de taille moyenne [1,46 m² de surface corporelle (SC)] compte tenu de la dose humaine recommandée de 30 mg/jour. Le lansoprazole a produit une hyperplasie gastrique des cellules entérochromaffines (ECL) liée à la dose et des carcinoïdes des cellules ECL chez les rats mâles et femelles. Il a également augmenté l'incidence de la métaplasie intestinale de l'épithélium gastrique chez les deux sexes. Chez les rats mâles, le lansoprazole a produit une augmentation liée à la dose des adénomes des cellules interstitielles testiculaires. L'incidence de ces adénomes chez les rats recevant des doses de 15 à 150 mg/kg/jour (quatre à 40 fois la dose humaine recommandée basée sur la BSA) a dépassé la faible incidence de fond (plage = 1,4 à 10 %) pour cette souche de rat.
Dans une étude de cancérogénicité de 24 mois, des souris CD-1 ont été traitées avec des doses orales de lansoprazole de 15 à 600 mg/kg/jour, deux à 80 fois la dose humaine recommandée basée sur la BSA. Le lansoprazole a produit une incidence accrue liée à la dose d'hyperplasie des cellules ECL gastriques. Il a également produit une incidence accrue de tumeurs du foie (adénome hépatocellulaire plus carcinome). L'incidence des tumeurs chez les souris mâles traitées avec 300 et 600 mg/kg/jour (40 à 80 fois la dose humaine recommandée basée sur la BSA) et les souris femelles traitées avec 150 à 600 mg/kg/jour (20 à 80 fois la dose humaine recommandée) dose basée sur la BSA) dépassait les plages d'incidences de fond dans les témoins historiques pour cette souche de souris. Le traitement au lansoprazole a produit un adénome du rete testis chez des souris mâles recevant 75 à 600 mg/kg/jour (10 à 80 fois la dose humaine recommandée basée sur la BSA).
Une étude de cancérogénicité de 26 semaines sur des souris transgéniques p53 (+/-) n'a pas été positive.
Le lansoprazole a donné des résultats positifs au test d'Ames et au test d'aberration chromosomique des lymphocytes humains in vitro. Le lansoprazole n'a pas été génotoxique dans le test ex vivo de synthèse d'ADN non programmée (UDS) des hépatocytes de rat, le test in vivo du micronoyau de souris ou le test d'aberration chromosomique des cellules de moelle osseuse de rat.
Le lansoprazole à des doses orales allant jusqu'à 150 mg/kg/jour (40 fois la dose humaine recommandée basée sur la BSA) s'est avéré n'avoir aucun effet sur la fertilité et la performance reproductive des rats mâles et femelles.
Utilisation dans des populations spécifiques
Grossesse
Résumé des risques
Dans l'ensemble, les données disponibles provenant d'études observationnelles publiées n'indiquent pas d'association d'issues défavorables de la grossesse avec le traitement par lansoprazole (voir Données ).
Dans les études de reproduction animale, l'administration orale de lansoprazole à des rats pendant l'organogenèse jusqu'à la lactation à 6,4 fois la dose maximale recommandée chez l'homme a produit des réductions chez la progéniture du poids du fémur, de la longueur du fémur, de la longueur couronne-croupe et de l'épaisseur de la plaque de croissance (mâles uniquement) le jour postnatal 21 (voir Données ). Ces effets étaient associés à une réduction du gain de poids corporel. Informer les femmes enceintes du risque potentiel pour le fœtus.
Le risque de fond estimé de malformations congénitales majeures et de fausse couche pour les populations indiquées est inconnu. Toutes les grossesses ont un risque de fond de malformation congénitale, de perte ou d'autres résultats indésirables. Dans la population générale des États-Unis, le risque de fond estimé de malformations congénitales majeures et de fausse couche dans les grossesses cliniquement reconnues est de 2 à 4 % et de 15 à 20 %, respectivement.
Si PREVACID 15 mg ou PREVACID 15 mg SoluTab est administré avec de la clarithromycine, les informations sur la grossesse pour la clarithromycine s'appliquent également au schéma thérapeutique combiné. Reportez-vous aux informations de prescription de la clarithromycine pour plus d'informations sur l'utilisation pendant la grossesse.
Données
Données humaines
Les données disponibles provenant d'études observationnelles publiées n'ont pas réussi à démontrer une association entre les résultats indésirables liés à la grossesse et l'utilisation du lansoprazole. Les limites méthodologiques de ces études observationnelles ne permettent pas d'établir ou d'exclure définitivement tout risque médicamenteux pendant la grossesse. Dans une étude prospective menée par le Réseau européen des services d'information sur la tératologie, les résultats d'un groupe de 62 femmes enceintes ayant reçu des doses quotidiennes médianes de 30 mg de lansoprazole ont été comparés à un groupe témoin de 868 femmes enceintes qui n'ont pris aucun IPP. Il n'y avait pas de différence dans le taux de malformations majeures entre les femmes exposées aux IPP et le groupe témoin, correspondant à un risque relatif (RR) = 1,04, [intervalle de confiance (IC) à 95 % 0,25-4,21]. Dans une étude de cohorte rétrospective basée sur la population couvrant toutes les naissances vivantes au Danemark de 1996 à 2008, il n'y a pas eu d'augmentation significative des malformations congénitales majeures lors de l'analyse de l'exposition au lansoprazole au cours du premier trimestre chez 794 naissances vivantes. Une méta-analyse qui a comparé 1 530 femmes enceintes exposées aux IPP au moins au cours du premier trimestre avec 133 410 femmes enceintes non exposées n'a montré aucune augmentation significative du risque de malformations congénitales ou d'avortement spontané avec l'exposition aux IPP (pour les malformations majeures, Odds Ratio (OR) = 1,12 , [IC 95 % 0,86-1,45] et pour les avortements spontanés OR=1,29, [IC 95 % 0,841,97]).
Données animales
Aucun effet indésirable sur le développement embryo-fœtal n'est survenu dans les études réalisées chez des rates gravides à des doses orales de lansoprazole allant jusqu'à 150 mg/kg/jour (40 fois la dose humaine recommandée [30 mg/jour] en fonction de la surface corporelle) administrées pendant l'organogenèse et lapines gravides à des doses orales de lansoprazole allant jusqu'à 30 mg/kg/jour (16 fois la dose humaine recommandée en fonction de la surface corporelle) administrées pendant l'organogenèse.
Une étude de toxicité sur le développement pré et postnatal chez le rat avec des paramètres supplémentaires pour évaluer le développement osseux a été réalisée avec du lansoprazole à des doses orales de 10 à 100 mg/kg/jour (0,7 à 6,4 fois la dose maximale recommandée de lansoprazole humain de 30 mg sur la base de l'ASC [aire sous la courbe concentration plasmatique-temps]) administrée pendant l'organogenèse jusqu'à l'allaitement. Les effets maternels observés à 100 mg/kg/jour (6,4 fois la dose maximale recommandée de lansoprazole humain de 30 mg sur la base de l'ASC) comprenaient une augmentation de la période de gestation, une diminution du gain de poids corporel pendant la gestation et une diminution de la consommation alimentaire. Le nombre de mortinaissances a augmenté à cette dose, ce qui peut avoir été secondaire à la toxicité maternelle. Le poids corporel des ratons a été réduit à 100 mg/kg/jour à partir du 11e jour postnatal. Le poids du fémur, la longueur du fémur et la longueur couronne-croupe ont été réduits à 100 mg/kg/jour le 21e jour postnatal. le groupe de 100 mg/kg/jour à l'âge de 17 à 18 semaines. L'épaisseur de la plaque de croissance a diminué chez les mâles recevant 100 mg/kg/jour au jour 21 après la naissance et a augmenté chez les mâles recevant 30 et 100 mg/kg/jour à l'âge de 17 à 18 semaines. Les effets sur les paramètres osseux étaient associés à une réduction du gain de poids corporel.
Lactation
Résumé des risques
Il n'y a aucune information concernant la présence de lansoprazole dans le lait maternel, les effets sur le nourrisson allaité ou les effets sur la production de lait. Cependant, le lansoprazole et ses métabolites sont présents dans le lait de rat. Les avantages de l'allaitement pour le développement et la santé doivent être pris en compte, ainsi que le besoin clinique de la mère pour PREVACID 30 mg ou PREVACID 30 mg SoluTab et tout effet indésirable potentiel sur l'enfant allaité de PREVACID 30 mg ou PREVACID SoluTab ou de l'affection maternelle sous-jacente.
Utilisation pédiatrique
L'innocuité et l'efficacité de PREVACID 15 mg et de PREVACID 30 mg SoluTab ont été établies chez les patients pédiatriques âgés d'un an à 17 ans pour le traitement à court terme du RGO symptomatique et de l'œsophagite érosive.
Dans les études cliniques sur le RGO symptomatique et l'œsophagite érosive, PREVACID 30 mg n'a pas été administré au-delà de 12 semaines chez des patients âgés d'un an à 11 ans. On ne sait pas si PREVACID 30 mg et PREVACID SoluTab sont sûrs et efficaces s'ils sont utilisés plus longtemps que la durée recommandée. Ne pas dépasser la dose et la durée d'utilisation recommandées chez les patients pédiatriques (voir Données sur la toxicité pour les animaux juvéniles ).
PREVACID n'a pas été efficace chez les patients pédiatriques atteints de RGO symptomatique âgés d'un mois à moins d'un an dans une étude multicentrique, à double insu et contrôlée par placebo. Par conséquent, la sécurité et l'efficacité n'ont pas été établies chez les patients de moins d'un an. Des études non cliniques chez des rats juvéniles ont démontré un effet indésirable d'épaississement des valves cardiaques et de modifications osseuses à des doses de lansoprazole supérieures à la dose humaine équivalente maximale recommandée.
Nouveau-né à moins d'un an
La pharmacocinétique du lansoprazole a été étudiée chez des patients pédiatriques atteints de RGO âgés de moins de 28 jours et de 1 à 11 mois. Par rapport aux adultes en bonne santé recevant 30 mg, les nouveau-nés présentaient une exposition plus élevée (valeurs moyennes de l'ASC normalisée en fonction du poids 2,04 et 1,88 fois plus élevées à des doses de 0,5 et 1 mg/kg/jour, respectivement). Les nourrissons âgés de ≤ 10 semaines présentaient des valeurs de clairance et d'exposition similaires à celles des nouveau-nés. Les nourrissons âgés de plus de 10 semaines ayant reçu 1 mg/kg/jour présentaient des valeurs moyennes d'ASC similaires à celles des adultes ayant reçu une dose de 30 mg.
Le lansoprazole ne s'est pas avéré efficace dans une étude américaine et polonaise de quatre semaines, multicentrique, en double aveugle, contrôlée par placebo, en groupes parallèles de 162 patients âgés d'un mois à moins de 12 mois atteints de RGO symptomatique sur la base d'antécédents médicaux de pleurs/agitation/irritabilité associés aux tétées qui n'avaient pas répondu à la gestion conservatrice du RGO (c.-à-d. intervention non pharmacologique) pendant sept à 14 jours. Les patients ont reçu
lansoprazole sous forme de suspension quotidienne (0,2 à 0,3 mg/kg/jour chez les nourrissons de ≤ 10 semaines ou 1,0 à 1,5 mg/kg/jour chez les nourrissons de plus de 10 semaines ou placebo) pendant un maximum de quatre semaines de traitement en double aveugle.
Le critère principal d'évaluation de l'efficacité a été évalué par une réduction supérieure à 50 % par rapport au départ, soit du pourcentage de tétées avec un épisode de pleurs/agitation/irritabilité, soit de la durée (minutes) d'un épisode de pleurs/agitation/irritabilité dans l'heure suivant l'alimentation.
Il n'y avait aucune différence dans le pourcentage de répondeurs entre le groupe suspension pédiatrique lansoprazole et le groupe placebo (54 % dans les deux groupes).
Aucun événement indésirable n'a été signalé dans les études cliniques pédiatriques (âgés d'un mois à moins de 12 mois) qui n'avait pas été observé auparavant chez l'adulte.
Sur la base des résultats de l'étude d'efficacité de phase 3, le lansoprazole ne s'est pas avéré efficace. Par conséquent, ces résultats ne soutiennent pas l'utilisation du lansoprazole dans le traitement du RGO symptomatique chez les nourrissons.
Un an à 11 ans
Dans une étude multicentrique américaine ouverte et non contrôlée, 66 patients pédiatriques (âgés d'un an à 11 ans) atteints de RGO ont été assignés, en fonction du poids corporel, pour recevoir une dose initiale de PREVACID 15 mg par jour si ≤ 30 kg ou PREVACID 30 mg par jour si plus de 30 kg administré pendant huit à 12 semaines. La dose de PREVACID a été augmentée (jusqu'à 30 mg deux fois par jour) chez 24 des 66 patients pédiatriques après deux semaines ou plus de traitement s'ils restaient symptomatiques. Au départ, 85 % des patients présentaient des symptômes généraux de RGO légers à modérés (évalués par un entretien avec l'investigateur), 58 % avaient un RGO non érosif et 42 % avaient une œsophagite érosive (évaluée par endoscopie).
Après huit à 12 semaines de traitement par PREVACID 15 mg, l'analyse en intention de traiter a démontré une réduction d'environ 50 % de la fréquence et de la sévérité des symptômes du RGO.
Vingt et un des 27 patients atteints d'œsophagite érosive ont été guéris à huit semaines et 100 % des patients ont été guéris à 12 semaines par endoscopie (tableau 4).
Dans une étude portant sur 66 patients pédiatriques âgés d'un an à 11 ans après un traitement par PREVACID 15 mg administré par voie orale à des doses de 15 mg par jour à 30 mg deux fois par jour, les augmentations des taux sériques de gastrine étaient similaires à celles observées dans les études chez l'adulte. Les taux médians de gastrine sérique à jeun ont augmenté de 89 %, passant de 51 pg/mL au départ à 97 pg/mL [intervalle interquartile (25e au 75e centile) de 71 à 130 pg/mL] lors de la visite finale.
La sécurité pédiatrique des gélules de PREVACID 30 mg a été évaluée chez 66 patients pédiatriques âgés de 1 à 11 ans. Des 66 patients avec GERD, 85 % (56/66) ont pris PREVACID 30 mgs depuis huit semaines et 15 % (10/66) l'ont pris depuis 12 semaines.
Les effets indésirables liés au traitement les plus fréquemment signalés (deux patients ou plus) chez les patients âgés de 1 à 11 ans (N = 66) étaient la constipation (5 %) et les céphalées (3 %).
Douze ans à 17 ans
Dans une étude multicentrique américaine, ouverte et non contrôlée, 87 patients adolescents (âgés de 12 à 17 ans) atteints de RGO symptomatique ont été traités par PREVACID pendant huit à 12 semaines. Les endoscopies supérieures initiales ont classé ces patients en deux groupes : 64 (74 %) RGO non érosif et 23 (26 %) œsophagite érosive (EE). Les patients atteints de RGO non érosif ont reçu PREVACID 15 mg par jour pendant huit semaines et les patients atteints d'EE ont reçu PREVACID 30 mg par jour pendant huit à 12 semaines. Au départ, 89 % de ces patients présentaient des symptômes généraux de RGO légers à modérés (évalués par des entretiens avec l'investigateur). Pendant huit semaines de traitement PREVACID 15mg, les patients adolescents ont connu une réduction de 63% de la fréquence et une réduction de 69% de la sévérité des symptômes du RGO sur la base des résultats du journal.
Vingt et un des 22 (95,5 %) patients adolescents atteints d'œsophagite érosive ont été guéris après huit semaines de traitement par PREVACID à 15 mg. Un patient est resté non cicatrisé après 12 semaines de traitement (Tableau 5).
Chez ces 87 patients adolescents, les augmentations des taux sériques de gastrine étaient similaires à celles observées dans les études sur les adultes, les taux médians de gastrine sérique à jeun ont augmenté de 42 %, passant de 45 pg/mL au départ à 64 pg/mL [intervalle interquartile (25e au 75e centile) de 44 à 88 pg/mL] lors de la visite finale. (Les niveaux normaux de gastrine sérique sont de 25 à 111 pg/mL.)
La sécurité des capsules PREVACID a été évaluée chez ces 87 patients adolescents. Sur les 87 adolescents atteints de RGO, 6 % (5/87) ont pris PREVACID 15 mg pendant moins de six semaines, 93 % (81/87) pendant six à 10 semaines et 1 % (1/87) pendant plus de 10 semaines. .
Les effets indésirables liés au traitement les plus fréquemment signalés (au moins 3 %) chez ces patients étaient les maux de tête (7 %), les douleurs abdominales (5 %), les nausées (3 %) et les étourdissements (3 %). Des étourdissements liés au traitement, rapportés dans ces informations thérapeutiques comme survenant chez moins de 1 % des patients adultes, ont été rapportés dans cette étude par trois patients adolescents atteints de RGO non érosif, qui ont eu des étourdissements en même temps que d'autres réactions (telles que migraine, dyspnée, et vomissements).
Données sur la toxicité pour les animaux juvéniles
Épaississement de la valve cardiaque
Dans deux études de toxicité orale, un épaississement de la valve cardiaque mitrale est survenu chez des rats juvéniles traités avec le lansoprazole. L'épaississement des valves cardiaques a été observé principalement avec l'administration orale initiée le jour postnatal 7 (équivalent d'âge des humains nouveau-nés) et le jour postnatal 14 (équivalent d'âge humain d'environ un an) à des doses de 250 mg/kg/jour et plus (au jour postnatal 7 et le jour postnatal 14, respectivement 6,2 fois et 4,2 fois la dose pédiatrique quotidienne de 15 mg chez les patients pédiatriques âgés de 1 à 11 ans pesant 30 kg ou moins, sur la base de l'ASC). Les durées de traitement associées à l'épaississement des valves cardiaques variaient de 5 jours à 8 semaines. Les résultats se sont inversés ou ont eu tendance à être réversibles après une période de récupération sans médicament de 4 semaines. L'incidence de l'épaississement des valvules cardiaques après le début de l'administration le jour postnatal 21 (équivalent d'âge humain d'environ deux ans) a été limitée à un seul rat (1/24) dans les groupes ayant reçu 500 mg/kg/jour pendant 4 ou 8 semaines (environ 5,2 fois la dose pédiatrique quotidienne de 15 mg chez les patients pédiatriques âgés de 1 à 11 ans pesant 30 kg ou moins, sur la base de l'ASC). D'après les marges d'exposition, le risque de lésion valvulaire cardiaque ne semble pas pertinent pour les patients âgés d'un an et plus.
Changements osseux
Dans une étude de toxicité orale de huit semaines chez des rats juvéniles avec une administration initiée le jour postnatal 7, des doses égales ou supérieures à 100 mg/kg/jour (2,5 fois la dose pédiatrique quotidienne de 15 mg chez les enfants âgés de 1 à 11 ans pesant 30 kg ou moins, sur la base de l'ASC) a produit un retard de croissance, avec une altération de la prise de poids observée dès le 10e jour postnatal (âge équivalent aux humains nouveau-nés). À la fin du traitement, les signes de retard de croissance à 100 mg/kg/jour et plus comprenaient des réductions du poids corporel (14 à 44 % par rapport aux témoins), du poids absolu de plusieurs organes, du poids du fémur, de la longueur du fémur et de la couronne. longueur de la croupe. L'épaisseur de la plaque de croissance fémorale n'a été réduite que chez les mâles et uniquement à la dose de 500 mg/kg/jour. Les effets liés au retard de croissance ont persisté jusqu'à la fin de la période de récupération de quatre semaines. Les données à plus long terme n'ont pas été recueillies.
Utilisation gériatrique
Du nombre total de patients (n = 21 486) dans les études cliniques de PREVACID, 16 % des patients étaient âgés de 65 ans et plus, tandis que 4 % avaient 75 ans et plus. Aucune différence globale d'innocuité ou d'efficacité n'a été observée entre ces patients et les patients plus jeunes et d'autres expériences cliniques rapportées n'ont pas identifié de différences significatives dans les réponses entre les patients gériatriques et les patients plus jeunes, mais une plus grande sensibilité de certains individus plus âgés ne peut être exclue [voir PHARMACOLOGIE CLINIQUE ].

Insuffisance hépatique
Chez les patients présentant divers degrés d'insuffisance hépatique chronique, l'exposition au lansoprazole a été augmentée par rapport aux sujets sains ayant une fonction hépatique normale [voir PHARMACOLOGIE CLINIQUE ]. Aucun ajustement posologique de PREVACID ou de PREVACID SoluTab n'est nécessaire chez les patients présentant une insuffisance hépatique légère (Child-Pugh Classe A) ou modérée (Child-Pugh Classe B). La posologie recommandée est de 15 mg par jour par voie orale chez les patients présentant une insuffisance hépatique sévère (Child-Pugh Classe C) [voir DOSAGE ET ADMINISTRATION ].
SURDOSAGE
Le lansoprazole n'est pas éliminé de la circulation par hémodialyse. Dans un cas de surdosage signalé, un patient a consommé 600 mg de PREVACID 15 mg sans effet indésirable. Des doses orales de lansoprazole allant jusqu'à 5 000 mg/kg chez le rat [environ 1 300 fois la dose humaine de 30 mg basée sur la surface corporelle (BSA)] et chez la souris (environ 675,7 fois la dose humaine de 30 mg basée sur la BSA) n'ont pas entraîné de décès ou tout signe clinique.
En cas de surexposition, le traitement doit être symptomatique et de soutien.
En cas de surexposition, appelez votre centre antipoison au 1-800-222-1222 pour obtenir des informations à jour sur la gestion de l'empoisonnement ou de la surexposition.
CONTRE-INDICATIONS
- PREVACID 15 mg et PREVACID 15 mg SoluTab sont contre-indiqués chez les patients présentant une hypersensibilité connue à l'un des composants de la formulation. Les réactions d'hypersensibilité peuvent inclure l'anaphylaxie, le choc anaphylactique, l'œdème de Quincke, le bronchospasme, la néphrite tubulo-interstitielle aiguë et l'urticaire [voir AVERTISSEMENTS ET PRECAUTIONS , EFFETS INDÉSIRABLES ].
- Les inhibiteurs de la pompe à protons (IPP), y compris PREVACID et PREVACID SoluTab, sont contre-indiqués avec les produits contenant de la rilpivirine [voir INTERACTIONS MÉDICAMENTEUSES ].
- Pour connaître les contre-indications des agents antibactériens (clarithromycine et amoxicilline) indiqués en association avec PREVACID ou PREVACID 30mg SoluTab, se référer à la rubrique Contre-indications de leurs informations de prescription.
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
Le lansoprazole appartient à une classe de composés antisécrétoires, les benzimidazoles substitués, qui suppriment la sécrétion d'acide gastrique par inhibition spécifique du système enzymatique (H+, K+)-ATPase à la surface sécrétoire de la cellule pariétale gastrique. Étant donné que ce système enzymatique est considéré comme la pompe à acide (proton) dans la cellule pariétale, le lansoprazole a été caractérisé comme un inhibiteur de la pompe à acide gastrique, en ce qu'il bloque l'étape finale de la production d'acide. Cet effet est lié à la dose et entraîne une inhibition de la sécrétion basale et stimulée d'acide gastrique, quel que soit le stimulus. Le lansoprazole ne présente pas d'activité anticholinergique ou antagoniste de l'histamine de type 2.
Pharmacodynamie
Activité antisécrétoire
Après administration orale, il a été démontré que le lansoprazole diminuait significativement la production d'acide basal et augmentait significativement le pH gastrique moyen et le pourcentage de fois où le pH gastrique était supérieur à trois et supérieur à quatre. Le lansoprazole a également réduit de manière significative la production d'acide gastrique et le volume de sécrétion stimulés par les repas, ainsi que la production d'acide stimulée par la pentagastrine. Chez les patients présentant une hypersécrétion d'acide, le lansoprazole a significativement réduit la sécrétion d'acide gastrique basale et stimulée par la pentagastrine. Le lansoprazole a inhibé les augmentations normales du volume de sécrétion, de l'acidité et de la production d'acide induites par l'insuline.
Les résultats du pH intragastrique d'une étude pharmacodynamique croisée de cinq jours portant sur 15 et 30 mg de lansoprazole une fois par jour sont présentés dans le tableau 6 :
Après la dose initiale dans cette étude, une augmentation du pH gastrique a été observée en une à deux heures avec 30 mg de lansoprazole et en deux à trois heures avec 15 mg de lansoprazole. Après plusieurs doses quotidiennes, une augmentation du pH gastrique a été observée dans la première heure après l'administration de 30 mg de lansoprazole et dans une à deux heures après l'administration de 15 mg de lansoprazole.
La suppression de l'acide peut renforcer l'effet des antimicrobiens dans l'éradication de Helicobacter pylori (H. pylori). Le pourcentage de pH gastrique de temps a été élevé au-dessus de cinq et six a été évalué dans une étude de croisement de PREVACID donné quotidiennement, deux fois par jour et trois fois par jour (la Table 7).
L'inhibition de la sécrétion d'acide gastrique telle que mesurée par le pH intragastrique est progressivement revenue à la normale en deux à quatre jours après des doses multiples. Il n'y avait aucune indication de rebond de l'acidité gastrique.
Effets sur les cellules de type entérochromaffine (ECL)
Au cours de l'exposition à vie de rats recevant jusqu'à 150 mg/kg/jour de lansoprazole administré sept jours sur sept, une hypergastrinémie marquée a été observée, suivie d'une prolifération des cellules ECL et de la formation de tumeurs carcinoïdes, en particulier chez les rats femelles. Les spécimens gastriques de biopsie du corps de l'estomac d'environ 150 patients ont traité sans interruption avec le lansoprazole depuis au moins un an n'ont pas montré l'évidence d'effets de cellule ECL semblables à ceux vus dans les études de rat. Des données à plus long terme sont nécessaires pour exclure la possibilité d'un risque accru de développement de tumeurs gastriques chez les patients recevant un traitement à long terme par le lansoprazole [voir Toxicologie non clinique ].
Autres effets gastriques chez l'homme
Le lansoprazole n'a pas significativement affecté le flux sanguin muqueux dans le fond de l'estomac. En raison de l'effet physiologique normal causé par l'inhibition de la sécrétion d'acide gastrique, une diminution d'environ 17 % du débit sanguin dans l'antre, le pylore et le bulbe duodénal a été observée. Le lansoprazole a significativement ralenti la vidange gastrique des solides digestibles. Le lansoprazole a augmenté les taux sériques de pepsinogène et diminué l'activité de la pepsine dans des conditions basales et en réponse à la stimulation des repas ou à l'injection d'insuline. Comme avec d'autres agents qui élèvent le pH intragastrique, les augmentations du pH gastrique étaient associées à une augmentation des bactéries réductrices de nitrate et à une élévation de la concentration de nitrite dans le suc gastrique chez les patients atteints d'ulcère gastrique. Aucune augmentation significative des concentrations de nitrosamine n'a été observée.
Effets de la gastrine sérique
Chez plus de 2 100 patients, les taux médians de gastrine sérique à jeun ont augmenté de 50 à 100 % par rapport au départ, mais sont restés dans la plage normale après un traitement avec 15 à 60 mg de lansoprazole par voie orale. Ces élévations ont atteint un plateau dans les deux mois suivant le traitement et sont revenues aux niveaux de prétraitement dans les quatre semaines suivant l'arrêt du traitement.
L'augmentation de la gastrine provoque une hyperplasie des cellules de type entérochromaffine et une augmentation des taux sériques de CgA. L'augmentation des taux de CgA peut entraîner des résultats faussement positifs dans les examens diagnostiques des tumeurs neuroendocrines [voir AVERTISSEMENTS ET PRECAUTIONS ].
Effets endocriniens
Des études sur l'homme pendant un an au maximum n'ont pas détecté d'effets cliniquement significatifs sur le système endocrinien. Les hormones étudiées comprennent la testostérone, l'hormone lutéinisante (LH), l'hormone folliculo-stimulante (FSH), la globuline liant les hormones sexuelles (SHBG), le sulfate de déhydroépiandrostérone (DHEA-S), la prolactine, le cortisol, l'estradiol, l'insuline, l'aldostérone, la parathormone, le glucagon, les stimulants thyroïdiens. (TSH), la triiodothyronine (T3), la thyroxine (T4) et l'hormone somatotrope (STH). Le lansoprazole à des doses orales de 15 à 60 mg pendant un an au maximum n'a eu aucun effet cliniquement significatif sur la fonction sexuelle. De plus, le lansoprazole à des doses orales de 15 à 60 mg pendant deux à huit semaines n'a eu aucun effet cliniquement significatif sur la fonction thyroïdienne. Dans des études de cancérogénicité de 24 mois chez des rats Sprague-Dawley avec des doses quotidiennes de lansoprazole allant jusqu'à 150 mg/kg, les changements prolifératifs dans les cellules de Leydig des testicules, y compris les néoplasmes bénins, ont été augmentés par rapport aux rats témoins.
Autres effets
Aucun effet systémique du lansoprazole sur le système nerveux central, les systèmes lymphoïde, hématopoïétique, rénal, hépatique, cardiovasculaire ou respiratoire n'a été observé chez l'homme. Parmi 56 patients qui avaient des évaluations d'oeil de ligne de base étendues, aucune toxicité visuelle n'a été observée après le traitement lansoprazole (jusqu'à 180 mgs/jours) depuis jusqu'à 58 mois. Après une exposition à vie au lansoprazole chez le rat, une atrophie pancréatique focale, une hyperplasie lymphoïde diffuse dans le thymus et une atrophie rétinienne spontanée ont été observées.
Pharmacocinétique
Absorption
PREVACID 15 mg et PREVACID SoluTab contiennent une formulation de granulés à enrobage entérique de lansoprazole (parce que le lansoprazole est acido-labile), de sorte que l'absorption du lansoprazole ne commence qu'après que les granules quittent l'estomac. Les concentrations plasmatiques maximales moyennes de lansoprazole surviennent à environ 1,7 heure. Après l'administration d'une dose unique de 15 à 60 mg de lansoprazole oral, les concentrations plasmatiques maximales (Cmax) du lansoprazole et l'aire sous les courbes de concentration plasmatique (ASC) du lansoprazole étaient approximativement proportionnelles à la dose administrée. Le lansoprazole ne s'accumule pas et sa pharmacocinétique n'est pas modifiée par des doses multiples. La biodisponibilité absolue est supérieure à 80 %. Chez les sujets sains, la demi-vie plasmatique moyenne (± ET) était de 1,5 (± 1,0) heure. La Cmax et l'ASC sont diminuées d'environ 50 à 70 % si le lansoprazole est administré 30 minutes après un repas, par rapport à la condition de jeûne. Il n'y a pas d'effet alimentaire significatif si le lansoprazole est administré avant les repas.
Distribution
Le lansoprazole est lié à 97 % aux protéines plasmatiques. La liaison aux protéines plasmatiques est constante sur la plage de concentration de 0,05 à 5 mcg/mL.
Élimination
Métabolisme
Le lansoprazole est largement métabolisé dans le foie. Deux métabolites ont été identifiés en quantités mesurables dans le plasma (les dérivés sulfinyl et sulfone hydroxylés du lansoprazole). Ces métabolites ont très peu ou pas d'activité antisécrétoire. On pense que le lansoprazole se transforme en deux espèces actives qui inhibent la sécrétion acide en bloquant la pompe à protons [système enzymatique (H+, K+)-ATPase] à la surface de sécrétion de la cellule pariétale gastrique. Les deux espèces actives ne sont pas présentes dans la circulation systémique. La demi-vie d'élimination plasmatique du lansoprazole est inférieure à deux heures tandis que l'effet inhibiteur de l'acide dure plus de 24 heures. Par conséquent, la demi-vie d'élimination plasmatique du lansoprazole ne reflète pas sa durée de suppression de la sécrétion d'acide gastrique.
Excrétion
Suite à l'administration orale de la dose simple de PREVACID, pratiquement aucun lansoprazole inchangé n'a été excrété dans l'urine. Dans une étude, après une dose orale unique de 14Clansoprazole, environ un tiers du rayonnement administré a été excrété dans l'urine et les deux tiers ont été récupérés dans les fèces. Cela implique une excrétion biliaire importante des métabolites du lansoprazole.
Populations spécifiques
Patients pédiatriques
Un à 17 ans
La pharmacocinétique du lansoprazole a été étudiée chez des patients pédiatriques atteints de RGO âgés de un à 11 ans et de 12 à 17 ans dans deux études cliniques distinctes. Chez les enfants âgés de 1 à 11 ans, le lansoprazole a été dosé à 15 mg par jour pour les sujets pesant ≤ 30 kg et à 30 mg par jour pour les sujets pesant plus de 30 kg. Les valeurs moyennes de la Cmax et de l'ASC observées au jour 5 de l'administration étaient similaires entre les deux groupes de dose et n'ont pas été affectées par le poids ou l'âge dans chaque groupe de dose ajustée au poids utilisé dans l'étude. Chez des sujets adolescents âgés de 12 à 17 ans, les sujets ont été randomisés pour recevoir du lansoprazole à raison de 15 ou 30 mg par jour. Les valeurs moyennes de la Cmax et de l'ASC du lansoprazole n'ont pas été affectées par le poids corporel ou l'âge ; et des augmentations presque proportionnelles à la dose des valeurs moyennes de la Cmax et de l'ASC ont été observées entre les deux groupes de dose de l'étude. Dans l'ensemble, la pharmacocinétique du lansoprazole chez les patients pédiatriques âgés de 1 à 17 ans était similaire à celle observée chez les sujets adultes sains.
Patients gériatriques
La clairance du lansoprazole est diminuée chez les personnes âgées, avec une demi-vie d'élimination augmentée d'environ 50 à 100 %. Étant donné que la demi-vie moyenne chez les personnes âgées reste comprise entre 1,9 et 2,9 heures, une administration répétée une fois par jour n'entraîne pas d'accumulation de lansoprazole. Les concentrations plasmatiques maximales n'étaient pas augmentées chez les personnes âgées [voir Utilisation dans des populations spécifiques ].
Patients masculins et féminins
Dans une étude comparant 12 hommes et six femmes ayant reçu du lansoprazole, aucune différence liée au sexe n'a été trouvée dans les résultats de pharmacocinétique et de pH intragastrique.
Groupes raciaux ou ethniques
Les paramètres pharmacokinetic moyens mis en commun de PREVACID de douze études américaines (N=513) ont été comparés aux paramètres pharmacokinetic moyens de deux études asiatiques (N=20). Les ASC moyennes de PREVACID 30 mg chez les sujets asiatiques étaient environ le double de celles observées dans les données américaines regroupées ; cependant, la variabilité interindividuelle était élevée. Les valeurs de Cmax étaient comparables.
Patients atteints d'insuffisance rénale
Chez les patients présentant une insuffisance rénale sévère, la liaison aux protéines plasmatiques a diminué de 1 à 1,5 % après administration de 60 mg de lansoprazole. Les patients atteints d'insuffisance rénale avaient une demi-vie d'élimination raccourcie et une diminution de l'ASC totale (libre et liée). Cependant, l'ASC du lansoprazole libre dans le plasma n'était pas liée au degré d'insuffisance rénale ; et la Cmax et la Tmax (temps nécessaire pour atteindre la concentration maximale) n'étaient pas différentes de la Cmax et de la Tmax des sujets ayant une fonction rénale normale. Par conséquent, la pharmacocinétique du lansoprazole n'était pas cliniquement différente chez les patients présentant une insuffisance rénale légère, modérée ou sévère par rapport aux sujets sains ayant une fonction rénale normale.
Patients atteints d'insuffisance hépatique
Chez les patients atteints d'insuffisance hépatique légère (Child-Pugh Classe A) ou modérée (Child-Pugh Classe B), l'ASC moyenne a été multipliée par environ 3 par rapport aux sujets sains ayant une fonction hépatique normale après plusieurs doses orales de 30 mg de PREVACID 30 mg. pendant sept jours. La demi-vie plasmatique moyenne correspondante du lansoprazole a été prolongée de 1,5 à 4 heures (Child-Pugh A) ou 5 heures (Child-Pugh B).
Chez les patients atteints de cirrhose compensée et décompensée, il y avait une augmentation d'environ 6 et 5 fois de l'ASC, respectivement, par rapport aux sujets sains ayant une fonction hépatique normale après une dose orale unique de 30 mg de PREVACID [voir DOSAGE ET ADMINISTRATION , Utilisation dans des populations spécifiques ].
Études sur les interactions médicamenteuses
Effet du lansoprazole sur d'autres médicaments
Interactions avec le cytochrome P450
Le lansoprazole est métabolisé par le système du cytochrome P450, plus précisément par les isoenzymes CYP3A et CYP2C19. Des études ont montré que PREVACID 15 mg n'a pas d'interactions cliniquement significatives avec d'autres médicaments métabolisés par le système du cytochrome P450, tels que la warfarine, l'antipyrine, l'indométhacine, l'ibuprofène, la phénytoïne, le propranolol, la prednisone, le diazépam ou la clarithromycine chez des sujets sains. Ces composés sont métabolisés par diverses isozymes du cytochrome P450, notamment CYP1A2, CYP2C9, CYP2C19, CYP2D6 et CYP3A.
Théophylline
Quand PREVACID 30 mgs a été administré concomitantly avec theophylline (CYP1A2, CYP3A), une augmentation mineure (10 %) dans l'autorisation de theophylline a été vue. En raison de la faible ampleur et de la direction de l'effet sur la clairance de la théophylline, il est peu probable que cette interaction soit préoccupante sur le plan clinique [voir INTERACTIONS MÉDICAMENTEUSES ].
Méthotrexate et 7-hydroxyméthotrexate
Dans une étude pharmacocinétique ouverte, à un seul bras, d'une durée de huit jours, menée auprès de 28 patients adultes atteints de polyarthrite rhumatoïde (qui nécessitaient l'utilisation chronique de 7,5 à 15 mg de méthotrexate administrés par semaine), l'administration de sept jours de naproxène 500 mg deux fois par jour et de PREVACID 30 mg par jour n'ont eu aucun effet sur la pharmacocinétique du méthotrexate et du 7-hydroxyméthotrexate. Bien que cette étude n'ait pas été conçue pour évaluer l'innocuité de cette combinaison de médicaments, aucun effet indésirable majeur n'a été noté. Cependant, cette étude a été menée avec de faibles doses de méthotrexate. Aucune étude d'interaction médicamenteuse avec des doses élevées de méthotrexate n'a été menée [voir AVERTISSEMENTS ET PRECAUTIONS ].
Amoxicilline
Il a également été démontré que PREVACID 30 mg n'a pas d'interaction cliniquement significative avec l'amoxicilline.
Sucralfate
Dans une étude croisée à dose unique examinant PREVACID 30 mg administré seul et en concomitance avec du sucralfate 1 gramme, l'absorption du lansoprazole a été retardée et la biodisponibilité a été réduite de 17 % lorsqu'il est administré en concomitance avec du sucralfate [voir DOSAGE ET ADMINISTRATION , INTERACTIONS MÉDICAMENTEUSES ].
Antiacides
Dans les essais cliniques, des antiacides ont été administrés en concomitance avec PREVACID 15 mg et il n'y avait aucune preuve d'un changement dans l'efficacité de PREVACID.
Clopidogrel
Le clopidogrel est métabolisé en son métabolite actif en partie par le CYP2C19. Une étude de sujets sains qui étaient des métaboliseurs rapides du CYP2C19, recevant une administration une fois par jour de clopidogrel 75 mg seul ou en concomitance avec PREVACID 30 mg (n = 40), pendant neuf jours a été menée. L'ASC moyenne du métabolite actif du clopidogrel a été réduite d'environ 14 % (le rapport moyen de l'ASC était de 86 %, avec un IC à 90 % de 80 à 92 %) lorsque PREVACID a été co-administré par rapport à l'administration de clopidogrel seul.
Les paramètres pharmacodynamiques ont également été mesurés et ont démontré que la modification de l'inhibition de l'agrégation plaquettaire (induite par 5 mcM d'ADP) était liée à la modification de l'exposition au métabolite actif du clopidogrel. L'effet sur l'exposition au métabolite actif du clopidogrel et sur l'inhibition plaquettaire induite par le clopidogrel n'est pas considéré comme cliniquement important.
Effet d'autres médicaments sur le lansoprazole
Étant donné que le lansoprazole est métabolisé par le CYP2C19 et le CYP3A4, les inducteurs et les inhibiteurs de ces enzymes peuvent potentiellement modifier l'exposition au lansoprazole.
Microbiologie
Microbiologie
Le lansoprazole, la clarithromycine et/ou l'amoxicilline se sont avérés actifs contre la plupart des souches d'Helicobacter pylori in vitro et dans les infections cliniques [voir INDICATIONS ET USAGE ].
Helicobacter Pylori Résistance au prétraitement
La résistance au prétraitement à la clarithromycine (≥2,0 mcg/mL) était de 9,5 % (91/960) par test E et de 11,3 % (12/106) par dilution en gélose dans les essais cliniques de bithérapie et de trithérapie (M93-125, M93-130, M93131, M95-392 et M95-399).
Des isolats sensibles au prétraitement à l'amoxicilline (≤0,25 mcg/mL) sont survenus chez 97,8 % (936/957) et 98,0 % (98/100) des patients dans les essais cliniques de bithérapie et de trithérapie par test E et dilution en gélose, respectivement. Vingt et un des 957 patients (2,2 %) par E-test, et deux des 100 patients (2,0 %) par dilution en gélose, avaient des CMI avant traitement à l'amoxicilline supérieures à 0,25 mcg/mL. Un patient sous trithérapie de 14 jours avait une concentration minimale inhibitrice (CMI) d'amoxicilline prétraitement non confirmée supérieure à 256 mcg/mL par test E et le patient a été éradiqué de H. pylori (Tableau 8).
Les patients non éradiqués de H. pylori après une trithérapie lansoprazole/amoxicilline/clarithromycine auront probablement un H. pylori résistant à la clarithromycine. Par conséquent, pour les patients qui échouent au traitement, des tests de sensibilité à la clarithromycine doivent être effectués lorsque cela est possible. Les patients atteints d'H. pylori résistant à la clarithromycine ne doivent pas être traités par la trithérapie lansoprazole/amoxicilline/clarithromycine ou par des schémas thérapeutiques qui incluent la clarithromycine comme seul agent antimicrobien.
Résultats des tests de sensibilité à l'amoxicilline et résultats cliniques/bactériologiques
Dans les essais cliniques de bithérapie et de trithérapie, 82,6 % (195/236) des patients qui avaient des CMI sensibles à l'amoxicilline avant le traitement (≤ 0,25 mcg/mL) ont été éradiqués de H. pylori. Parmi ceux dont les CMI d'amoxicilline avant le traitement étaient supérieures à 0,25 mcg/mL, trois sur six avaient le H. pylori éradiqué. Au total, 30 % (21/70) des patients ont échoué à la bithérapie lansoprazole 30 mg trois fois par jour/amoxicilline 1 g trois fois par jour et un total de 12,8 % (22/172) des patients ont échoué à la trithérapie de 10 et 14 jours. régimes thérapeutiques. Les résultats de sensibilité post-traitement n'ont pas été obtenus pour 11 des patients qui n'ont pas répondu au traitement. Neuf des 11 patients avec des CMI post-traitement à l'amoxicilline qui ont échoué à la trithérapie avaient également des isolats de H. pylori résistants à la clarithromycine.
Test de sensibilité pour Helicobacter pylori
Pour plus d'informations sur les tests de sensibilité à Helicobacter pylori, voir Section microbiologie dans les renseignements thérapeutiques pour la clarithromycine et l'amoxicilline .
Etudes cliniques
L'ulcère duodénal
Dans une étude américaine multicentrique, en double aveugle, contrôlée par placebo, dose-réponse (15, 30 et 60 mg de PREVACID une fois par jour) portant sur 284 patients atteints d'ulcère duodénal documenté par endoscopie, le pourcentage de patients guéris après deux et quatre semaines était significativement plus élevé avec toutes les doses de PREVACID qu'avec le placebo. Il n'y avait aucune évidence d'une réponse plus grande ou plus tôt avec les deux doses plus hautes comparées avec PREVACID 15 mgs. Sur la base de cette étude et de la deuxième étude décrite ci-dessous, la dose recommandée de PREVACID 15 mg dans l'ulcère duodénal est de 15 mg par jour (Tableau 9).
PREVACID 15 mg a été significativement plus efficace que le placebo pour soulager les douleurs abdominales diurnes et nocturnes et pour diminuer la quantité d'antiacide prise par jour.
Dans une deuxième étude multicentrique américaine, également en double aveugle, contrôlée par placebo, de comparaison de doses (15 et 30 mg de PREVACID 15 mg une fois par jour), et incluant une comparaison avec la ranitidine, chez 280 patients présentant un ulcère duodénal documenté par endoscopie, le pourcentage de patients guéris après quatre semaines était significativement plus élevé avec les deux doses de PREVACID 15 mg qu'avec le placebo. Il n'y avait aucune évidence d'une réponse plus grande ou plus tôt avec la plus haute dose de PREVACID. Bien que la dose de 15 mg de PREVACID ait été supérieure à la ranitidine à quatre semaines, l'absence de différence significative à deux semaines et l'absence de différence entre 30 mg de PREVACID et la ranitidine laisse l'efficacité comparative des deux agents indéterminée (Tableau 10) [ voir INDICATIONS ET USAGE ].
Éradication de H. pylori pour réduire le risque de récidive de l'ulcère duodénal
Des études cliniques randomisées en double aveugle réalisées aux États-Unis chez des patients atteints de H. pylori et d'ulcère duodénal (défini comme un ulcère actif ou des antécédents d'ulcère dans l'année) ont évalué l'efficacité de PREVACID en association avec l'amoxicilline et la clarithromycine comme triple 14 traitement de jour ou en association avec l'amoxicilline en bithérapie de 14 jours pour l'éradication de H. pylori. Sur la base des résultats de ces études, l'innocuité et l'efficacité de deux régimes d'éradication différents ont été établies :
Trithérapie : PREVACID 30 mg deux fois par jour/amoxicilline 1 g deux fois par jour/clarithromycine 500 mg deux fois par jour
Bithérapie : PREVACID 30 mg trois fois par jour/amoxicilline 1 g trois fois par jour
Tous les traitements duraient 14 jours. L'éradication de H. pylori était définie par deux tests négatifs (culture et histologie) quatre à six semaines après la fin du traitement.
La trithérapie s'est avérée plus efficace que toutes les combinaisons possibles de bithérapie. La bithérapie s'est révélée plus efficace que les deux monothérapies. Il a été démontré que l'éradication de H. pylori réduit le risque de récidive de l'ulcère duodénal.
Une étude clinique randomisée en double aveugle réalisée aux États-Unis chez des patients atteints de H. pylori et d'un ulcère duodénal (défini comme un ulcère actif ou des antécédents d'ulcère dans l'année) a comparé l'efficacité de la trithérapie PREVACID pendant 10 et 14 jours. Cette étude a établi que la trithérapie de 10 jours était équivalente à la trithérapie de 14 jours pour éradiquer H. pylori (Tableaux 11 et 12) [voir INDICATIONS ET USAGE ].
Entretien des ulcères duodénaux guéris
Il a été démontré que PREVACID prévient la récidive des ulcères duodénaux. Deux essais contrôlés multicentriques, à double insu et indépendants ont été menés chez des patients présentant des ulcères duodénaux cicatrisés confirmés par endoscopie. Les patients sont restés cicatrisés significativement plus longtemps et le nombre de récidives d'ulcères duodénaux était significativement inférieur chez les patients traités par PREVACID 15 mg que chez les patients traités par placebo sur une période de 12 mois (Tableau 13) [voir INDICATIONS ET USAGE ].
Dans l'essai #2, aucune différence significative n'a été notée entre PREVACID 15 et 30 mg dans le maintien de la rémission.
Ulcère gastrique
Dans une étude américaine multicentrique, en double aveugle, contrôlée par placebo portant sur 253 patients atteints d'ulcère gastrique documenté par endoscopie, le pourcentage de patients guéris à quatre et huit semaines était significativement plus élevé avec PREVACID 15 et 30 mg une fois par jour qu'avec le placebo (Tableau 14 ) [voir INDICATIONS ET USAGE ].
Les patients traités avec n'importe quelle dose de PREVACID ont signalé significativement moins de douleurs abdominales diurnes et nocturnes ainsi que moins de jours d'utilisation d'antiacides et moins de comprimés antiacides utilisés par jour que le groupe placebo.
Une justification indépendante de l'efficacité de PREVACID 30 mg a été fournie par une méta-analyse de données publiées et non publiées.
Guérison de l'ulcère gastrique associé aux AINS
Dans deux études multicentriques américaines et canadiennes, à double insu et contrôlées par traitement actif chez des patients atteints d'un ulcère gastrique associé aux AINS confirmé par endoscopie qui ont continué leur utilisation d'AINS, le pourcentage de patients guéris après huit semaines était statistiquement significativement plus élevé avec 30 mg de PREVACID qu'avec le contrôle actif. Au total, 711 patients ont participé à l'étude et 701 patients ont été traités. Les patients étaient âgés de 18 à 88 ans (âge médian 59 ans), avec 67 % de femmes et 33 % d'hommes. La race était répartie comme suit : 87 % de race blanche, 8 % de race noire, 5 % d'autre. Il n'y avait aucune différence statistiquement significative entre PREVACID 30 mgs tous les jours et le contrôle actif sur le soulagement de symptôme (c.-à-d. douleur abdominale) (la Table 15) [voir INDICATIONS ET USAGE ].
Réduction du risque d'ulcère gastrique associé aux AINS
Dans une grande étude américaine, multicentrique, en double aveugle, contrôlée par placebo et misoprostol (misoprostol en aveugle uniquement pour l'endoscopiste) chez des patients nécessitant l'utilisation chronique d'un AINS et qui avaient des antécédents d'ulcère gastrique documenté par endoscopie, la proportion de les patients restant exempts d'ulcère gastrique à quatre, huit et 12 semaines étaient significativement plus élevés avec 15 ou 30 mg de PREVACID 15 mg qu'avec le placebo. Au total, 537 patients ont été recrutés dans l'étude et 535 patients ont été traités. Les patients étaient âgés de 23 à 89 ans (âge médian 60 ans), avec 65 % de femmes et 35 % d'hommes. La race était répartie comme suit : 90 % Caucasien, 6 % Noir, 4 % Autre. La dose de 30 mg de PREVACID n'a démontré aucun avantage supplémentaire dans la réduction du risque d'ulcère gastrique associé aux AINS par rapport à la dose de 15 mg (Tableau 16) [voir INDICATIONS ET USAGE ].
Reflux gastro-oesophagien symptomatique (RGO)
RGO symptomatique
Dans une étude américaine multicentrique, en double aveugle, contrôlée par placebo portant sur 214 patients présentant des symptômes fréquents de RGO, mais aucune érosion œsophagienne par endoscopie, un soulagement significativement plus important des brûlures d'estomac associées au RGO a été observé avec l'administration de lansoprazole 15 mg une fois par jour jusqu'à huit semaines qu'avec le placebo. Aucun bénéfice supplémentaire significatif du lansoprazole 30 mg une fois par jour n'a été observé.
Les analyses en intention de traiter ont démontré une réduction significative de la fréquence et de la gravité des brûlures d'estomac diurnes et nocturnes. Les données de fréquence et de gravité pour la période de traitement de huit semaines sont présentées dans le tableau 17 et dans les figures 1 et 2 :
Figure 1 : Sévérité moyenne des brûlures d'estomac diurnes par jour d'étude pour les patients évaluables (3=grave, 2=modéré, 1=léger, 0=aucun)
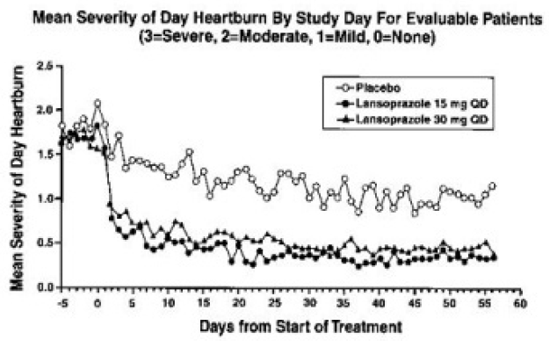
Figure 2 : Sévérité moyenne des brûlures d'estomac nocturnes par jour d'étude pour les patients évaluables (3=grave, 2=modéré, 1=léger, 0=aucun)
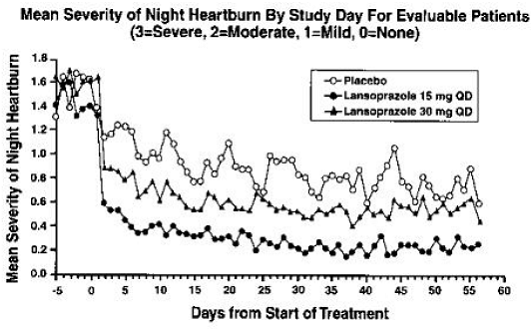
Dans deux études américaines, multicentriques, en double aveugle, contrôlées par la ranitidine portant sur 925 patients au total présentant des symptômes fréquents de RGO, mais pas d'érosions œsophagiennes par endoscopie, le lansoprazole 15 mg était supérieur à la ranitidine 150 mg (deux fois par jour) pour réduire la fréquence et la sévérité des et brûlures d'estomac nocturnes associées au RGO pendant la période de traitement de huit semaines. Aucun bénéfice supplémentaire significatif du lansoprazole 30 mg une fois par jour n'a été observé [voir INDICATIONS ET USAGE ].
Oesophagite érosive
Dans une étude américaine, multicentrique, en double aveugle et contrôlée par placebo portant sur 269 patients admis avec un diagnostic endoscopique d'œsophagite avec un grade muqueux de deux ou plus et des grades trois et quatre signifiant une maladie érosive, les pourcentages de patients présentant une cicatrisation sont présentés dans le tableau 18:
Dans cette étude, tous les groupes PREVACID ont signalé un soulagement significativement plus important des brûlures d'estomac et moins de douleurs abdominales diurnes et nocturnes, ainsi que moins de jours d'utilisation d'antiacides et moins de comprimés antiacides pris par jour que le groupe placebo. Bien que toutes les doses aient été efficaces, la guérison plus précoce dans les deux doses les plus élevées suggère 30 mg par jour comme dose recommandée.
PREVACID a également été comparé dans une étude américaine multicentrique en double aveugle à une faible dose de ranitidine chez 242 patients atteints d'œsophagite érosive par reflux. PREVACID à une dose de 30 mg était significativement plus efficace que la ranitidine à 150 mg deux fois par jour, comme indiqué ci-dessous (Tableau 19).
De plus, les patients traités par PREVACID 30 mg ont signalé moins de brûlures d'estomac le jour et la nuit et ont pris moins de comprimés antiacides pendant moins de jours que les patients prenant de la ranitidine 150 mg deux fois par jour.
Bien que cette étude démontre l'efficacité de PREVACID 15 mg dans la guérison de l'œsophagite érosive, elle ne représente pas une comparaison adéquate avec la ranitidine car la dose recommandée de ranitidine pour l'œsophagite est de 150 mg quatre fois par jour, soit le double de la dose utilisée dans cette étude.
Dans les deux essais décrits et dans plusieurs études plus petites impliquant des patients atteints d'oesophagite érosive modérée à sévère, PREVACID a produit des taux de guérison similaires à ceux indiqués ci-dessus.
Dans une étude américaine multicentrique, en double aveugle et contrôlée par comparateur actif, 30 mg de PREVACID 30 mg ont été comparés à la ranitidine 150 mg deux fois par jour chez 151 patients atteints d'œsophagite érosive par reflux qui répondait mal à un minimum de 12 semaines de traitement avec au moins un antagoniste des récepteurs H2 administré à la dose indiquée pour le soulagement des symptômes ou plus, à savoir cimétidine 800 mg/jour, ranitidine 300 mg/jour, famotidine 40 mg/jour ou nizatidine 300 mg/jour. PREVACID 30 mg était plus efficace que la ranitidine 150 mg deux fois par jour dans la guérison de l'œsophagite par reflux, et le pourcentage de patients guéris était le suivant. Cette étude ne constitue pas une comparaison de l'efficacité des antagonistes des récepteurs H2 de l'histamine avec PREVACID 30 mg, car tous les patients avaient démontré une absence de réponse au mode de traitement des antagonistes des récepteurs H2 de l'histamine. Il indique cependant que PREVACID 30 mg peut être utile chez les patients en échec sur un antagoniste des récepteurs H2 de l'histamine (Tableau 20) [voir INDICATIONS ET USAGE ].
Entretien de la guérison de l'oesophagite érosive
Deux essais contrôlés multicentriques, à double insu et indépendants ont été menés chez des patients atteints d'œsophagite cicatrisée confirmée par endoscopie. Les patients sont restés en rémission significativement plus longtemps et le nombre de récidives d'œsophagite érosive était significativement inférieur chez les patients traités par PREVACID 30 mg que chez les patients traités par placebo sur une période de 12 mois (Tableau 21).
Quel que soit le grade initial de l'œsophagite érosive, PREVACID 15 et 30 mg étaient similaires dans le maintien de la rémission.
Dans une étude américaine randomisée en double aveugle, PREVACID 15 mg par jour (n = 100) a été comparé à la ranitidine 150 mg deux fois par jour (n = 106), à la posologie recommandée, chez des patients atteints d'œsophagite érosive cicatrisée confirmée par endoscopie pendant une Période de 12 mois. Le traitement avec PREVACID 15 mg a permis aux patients de rester guéris (lésions de grade 0) de l'œsophagite érosive pendant des périodes de temps significativement plus longues que ceux traités avec la ranitidine (p INDICATIONS ET USAGE ].
Conditions hypersécrétoires pathologiques, y compris le syndrome de Zollinger-Ellison
Dans des études ouvertes portant sur 57 patients atteints d'hypersécrétions pathologiques, telles que le syndrome de Zollinger-Ellison (ZES) avec ou sans adénomes endocriniens multiples, PREVACID 15 mg a significativement inhibé la sécrétion d'acide gastrique et contrôlé les symptômes associés de diarrhée, d'anorexie et de douleur. Des doses allant de 15 mg un jour sur deux à 180 mg par jour ont maintenu la sécrétion basale d'acide en dessous de 10 mEq/h chez les patients sans chirurgie gastrique antérieure et en dessous de 5 mEq/h chez les patients ayant déjà subi une chirurgie gastrique.
Les doses initiales ont été adaptées aux besoins individuels du patient et des ajustements ont été nécessaires avec le temps chez certains patients [voir DOSAGE ET ADMINISTRATION ]. PREVACID a été bien toléré à ces doses élevées pendant des périodes prolongées (plus de quatre ans chez certains patients). Chez la plupart des patients ZES, les taux sériques de gastrine n'ont pas été modifiés par PREVACID. Cependant, chez certains patients, la gastrine sérique a augmenté à des niveaux supérieurs à ceux présents avant le début du traitement par lansoprazole [voir INDICATIONS ET USAGE ].
INFORMATIONS PATIENTS
PREVACID (prev-a-sid) (lansoprazole) gélules à libération retardée, à usage oral et
PREVACID SoluTab (prev-a-sid sol-u-tab) (lansoprazole) comprimés à désintégration orale à libération retardée
Quelle est l'information la plus importante que je devrais connaître sur PREVACID et PREVACID 15mg SoluTab ?
Vous devez prendre PREVACID et PREVACID 15 mg SoluTab exactement comme prescrit, à la dose la plus faible possible et pendant la durée la plus courte nécessaire.
PREVACID et PREVACID SoluTab peuvent soulager vos symptômes liés à l'acidité, mais vous pourriez quand même avoir de graves problèmes d'estomac.
Discutez avec votre médecin. PREVACID 30 mg et PREVACID 30 mg SoluTab peuvent provoquer des effets indésirables graves, notamment :
- Un type de problème rénal (néphrite tubulo-interstitielle aiguë). Certaines personnes qui prennent des médicaments inhibiteurs de la pompe à protons (IPP), y compris PREVACID 30 mg et PREVACID 15 mg SoluTab, peuvent développer un problème rénal appelé néphrite tubulo-interstitielle aiguë qui peut survenir à tout moment pendant le traitement avec des médicaments IPP, y compris PREVACID et PREVACID SoluTab. Appelez immédiatement votre médecin si vous avez une diminution de la quantité que vous urinez ou si vous avez du sang dans vos urines.
- Diarrhée causée par une infection (Clostridium difficile) dans vos intestins. Appelez immédiatement votre médecin si vous avez des selles liquides ou des douleurs à l'estomac qui ne disparaissent pas. Vous pouvez ou non avoir de la fièvre.
- Fractures osseuses (hanche, poignet ou colonne vertébrale). Des fractures osseuses de la hanche, du poignet ou de la colonne vertébrale peuvent survenir chez les personnes qui prennent plusieurs doses quotidiennes d'IPP et pendant une longue période (un an ou plus). Informez votre médecin si vous avez une fracture osseuse, en particulier à la hanche, au poignet ou à la colonne vertébrale.
- Certains types de lupus érythémateux. Le lupus érythémateux est une maladie auto-immune (les cellules immunitaires du corps attaquent d'autres cellules ou organes du corps). Certaines personnes qui prennent des médicaments IPP, y compris PREVACID 15 mg et PREVACID 30 mg SoluTab, peuvent développer certains types de lupus érythémateux ou avoir une aggravation du lupus qu'ils ont déjà. Appelez immédiatement votre médecin si vous avez des douleurs articulaires nouvelles ou qui s'aggravent ou une éruption cutanée sur les joues ou les bras qui s'aggrave au soleil.
Parlez à votre médecin de votre risque de ces effets secondaires graves.
PREVACID 15mg et PREVACID SoluTab peuvent avoir d'autres effets secondaires graves. Voir "Quels sont les effets secondaires possibles de PREVACID et PREVACID SoluTab?".
Que sont PREVACID et PREVACID 30mg SoluTab ?
Un médicament sur ordonnance appelé inhibiteur de la pompe à protons (IPP) utilisé pour réduire la quantité d'acide dans votre estomac.
Chez l'adulte, PREVACID 15mg et PREVACID SoluTab sont utilisés pour :
- 4 semaines pour la cicatrisation et le soulagement des symptômes des ulcères duodénaux.
- 10 à 14 jours avec certains antibiotiques pour traiter une infection causée par une bactérie appelée H. pylori.
- maintien de la cicatrisation des ulcères duodénaux. PREVACID 30 mg n'a pas été étudié au-delà de 12 mois à cet effet.
- jusqu'à 8 semaines pour la guérison et le soulagement des symptômes des ulcères d'estomac.
- jusqu'à 8 semaines pour la cicatrisation des ulcères d'estomac chez les personnes prenant des analgésiques appelés anti-inflammatoires non stéroïdiens (AINS). PREVACID 30 mg n'a pas été étudié au-delà de 8 semaines dans ce but.
- réduire le risque d'ulcères de l'estomac chez les personnes à risque de développer des ulcères de l'estomac avec des AINS. PREVACID n'a pas été étudié au-delà de 12 semaines à cette fin.
- jusqu'à 8 semaines pour traiter les brûlures d'estomac et d'autres symptômes qui surviennent avec le reflux gastro-œsophagien (RGO). Le RGO survient lorsque l'acide dans votre estomac remonte dans le tube (œsophage) qui relie votre bouche à votre estomac. Cela peut provoquer une sensation de brûlure dans la poitrine ou la gorge, un goût amer ou des rots.
- jusqu'à 8 semaines pour la guérison et le soulagement des symptômes des lésions de la muqueuse de l'œsophage liées à l'acide (appelées œsophagite érosive ou EE). Votre médecin peut prescrire 8 à 16 semaines supplémentaires de PREVACID ou PREVACID 15mg SoluTab pour les patients dont l'EE ne s'améliore pas ou dont les symptômes réapparaissent.
- maintien de la cicatrisation de l'EE. PREVACID n'a pas été étudié au-delà de 12 mois à cette fin.
- le traitement à long terme des conditions où votre estomac produit trop d'acide. Cela inclut une maladie rare appelée syndrome de Zollinger-Ellison.
Enfants: Donnez PREVACID 30 mg et PREVACID 30 mg SoluTab exactement comme prescrit par le médecin de votre enfant. N'augmentez pas la dose de PREVACID et de PREVACID SoluTab et ne donnez pas à votre enfant PREVACID 15 mg et PREVACID 15 mg SoluTab plus longtemps que la durée prescrite par votre médecin.
Chez les enfants de 1 à 11 ans, PREVACID 15mg et PREVACID 15mg SoluTab sont utilisés pour :
- jusqu'à 12 semaines pour traiter les brûlures d'estomac et d'autres symptômes qui peuvent survenir avec le RGO.
- jusqu'à 12 semaines pour la guérison et le soulagement des symptômes de l'EE.
Chez les enfants de 12 à 17 ans, PREVACID et PREVACID SoluTab sont utilisés pour :
- jusqu'à 8 semaines pour traiter les brûlures d'estomac et d'autres symptômes qui peuvent survenir avec le RGO.
- jusqu'à 8 semaines pour la guérison et le soulagement des symptômes de l'EE.
PREVACID 30 mg et PREVACID SoluTab ne sont pas recommandés pour traiter les symptômes du RGO chez les enfants de moins de 1 an et peuvent leur être nocifs.
Ne prenez jamais PREVACID ou PREVACID 15mg SoluTab si vous êtes :
- allergique au lansoprazole, à tout autre médicament IPP ou à l'un des ingrédients de PREVACID 15 mg ou PREVACID 30 mg SoluTab. Voir la fin de ce guide de médication pour une liste complète d'ingrédients dans PREVACID et PREVACID 30mg SoluTab.
- prendre un médicament contenant de la rilpivirine (EDURANT, COMPLERA, ODEFSEY, JULUCA) utilisé pour traiter le VIH-1 (virus de l'immunodéficience humaine).
Avant de prendre PREVACID 15 mg ou PREVACID SoluTab, informez votre médecin de toutes vos conditions médicales, y compris si vous :
- avez un faible taux sanguin de magnésium, de calcium, de potassium ou de sodium ou si vous prenez un diurétique.
- avoir des problèmes de foie.
- souffrez de phénylcétonurie. PREVACID SoluTab contient de l'aspartam.
- êtes enceinte, pensez être enceinte ou envisagez de devenir enceinte. PREVACID ou PREVACID SoluTab peuvent nuire à votre bébé à naître. Parlez à votre médecin des risques possibles pour un bébé à naître si PREVACID 30 mg ou PREVACID 15 mg SoluTab est pris pendant la grossesse.
- allaitez ou envisagez d'allaiter. On ne sait pas si PREVACID ou PREVACID 30mg SoluTab passe dans votre lait maternel. Discutez avec votre médecin de la meilleure façon de nourrir votre bébé si vous prenez PREVACID ou PREVACID SoluTab.
Informez votre médecin de tous les médicaments que vous prenez, y compris les médicaments sur ordonnance et en vente libre, les vitamines et les suppléments à base de plantes. Dites particulièrement à votre médecin si vous prenez du méthotrexate (OTREXUP, RASUVO, TREXALL, REDITREX, XATMEP).
Comment dois-je prendre PREVACID 15mg et PREVACID 30mg SoluTab ?
- Prenez PREVACID 30mg ou PREVACID SoluTab exactement comme prescrit par votre médecin.
- Ne modifiez pas votre dose et n'arrêtez pas de prendre PREVACID 30mg ou PREVACID SoluTab sans en parler avec votre médecin.
- Prenez PREVACID 30mg ou PREVACID 15mg SoluTab avant les repas.
Gélules PREVACID 15 mg :
-
- Avalez les gélules de PREVACID 30mg entières.
- Ne pas écraser ou mâcher les capsules PREVACID.
- Si vous avez du mal à avaler une capsule entière, vous pouvez ouvrir la capsule et prendre le contenu avec certains aliments ou jus. Voir les "Instructions pour l'Utilisation" à la fin de ce Guide de Médication pour les instructions sur la façon dont prendre des capsules PREVACID 30mg avec certains aliments ou jus.
- Voir les "Instructions pour l'Utilisation" à la fin de ce Guide de Médication pour les instructions sur la façon dont mélanger et donner des capsules PREVACID 30 mgs par un tube nasogastric (le tube de NG).
Prevacid SoluTab :
-
- PREVACID 30mg SoluTab est un comprimé qui fond dans la bouche avec ou sans eau.
- Ne pas casser, couper, écraser ou mâcher les comprimés.
- Voir les "Instructions pour l'Utilisation" à la fin de ce Guide de Médication pour les instructions sur la façon dont mélanger et donner PREVACID SoluTab par une seringue et un tube NG.
- Si vous manquez une dose de PREVACID ou PREVACID 30mg SoluTab, prenez-la dès que vous vous en souvenez. S'il est presque l'heure de votre prochaine dose, ne prenez pas la dose oubliée. Prenez votre prochaine dose à l'heure habituelle. Ne prenez pas 2 doses en même temps.
- Si vous avez pris trop de PREVACID ou de PREVACID 30mg SoluTab, appelez immédiatement votre médecin ou votre centre antipoison au 1-800-222-1222 ou rendez-vous à l'urgence de l'hôpital le plus proche.
Quels sont les effets secondaires possibles de PREVACID et PREVACID SoluTab ?
PREVACID et PREVACID SoluTab peuvent provoquer des effets secondaires graves, notamment :
- Voir "Quelle est l'information la plus importante que je devrais connaître sur PREVACID 30mg et PREVACID SoluTab?".
- Faibles niveaux de vitamine B12 dans le corps peut survenir chez les personnes qui ont pris PREVACID 30 mg ou PREVACID SoluTab pendant une longue période (plus de 3 ans). Informez votre médecin si vous présentez des symptômes de faible taux de vitamine B12, notamment un essoufflement, des étourdissements, un rythme cardiaque irrégulier, une faiblesse musculaire, une peau pâle, une sensation de fatigue, des changements d'humeur et des picotements ou un engourdissement dans les bras et les jambes.
- Excroissances de l'estomac (polypes de la glande fundique). Les personnes qui prennent des médicaments IPP pendant une longue période ont un risque accru de développer un certain type de croissance de l'estomac appelé polypes des glandes fundiques, en particulier après avoir pris des médicaments IPP pendant plus d'un an.
- Faibles niveaux de magnésium dans le corps peut survenir chez les personnes qui ont pris PREVACID pendant au moins 3 mois. Informez immédiatement votre médecin si vous présentez des symptômes de faibles niveaux de magnésium, notamment des convulsions, des étourdissements, un rythme cardiaque irrégulier, de la nervosité, des douleurs musculaires ou une faiblesse et des spasmes des mains, des pieds ou de la voix.
- Réactions cutanées sévères. PREVACID 15 mg peut provoquer des réactions cutanées rares mais graves pouvant affecter n'importe quelle partie de votre corps. Ces réactions cutanées graves peuvent nécessiter un traitement à l'hôpital et peuvent mettre la vie en danger :
- Éruption cutanée pouvant présenter des cloques, une desquamation ou des saignements sur n'importe quelle partie de la peau (y compris les lèvres, les yeux, la bouche, le nez, les organes génitaux, les mains ou les pieds).
- Vous pouvez également avoir de la fièvre, des frissons, des courbatures, un essoufflement ou des ganglions lymphatiques hypertrophiés.
Arrêtez de prendre PREVACID et appelez votre docteur tout de suite. Ces symptômes peuvent être le premier signe d'une réaction cutanée sévère.
Les effets secondaires les plus courants de PREVACID et PREVACID SoluTab incluent : diarrhée, douleurs dans la région de l'estomac (abdomen), nausées et constipation.
Ce ne sont pas tous les effets secondaires possibles de PREVACID 30mg et PREVACID 30mg SoluTab.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires.
Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
Comment dois-je conserver PREVACID et PREVACID 30mg SoluTab ?
Conservez PREVACID à la température de pièce entre 68°F à 77°F (20°C à 25°C).
Gardez PREVACID 15 mg et PREVACID SoluTab et tous les médicaments hors de la portée des enfants.
Informations générales sur l'utilisation sûre et efficace de PREVACID 15 mg et de PREVACID SoluTab.
Les médicaments sont parfois prescrits à des fins autres que celles énumérées dans un guide des médicaments. Ne pas utiliser PREVACID ou PREVACID 30mg SoluTab pour des affections pour lesquelles il n'a pas été prescrit. Ne donnez pas PREVACID 30 mg ou PREVACID SoluTab à d'autres personnes, même si elles présentent les mêmes symptômes que vous. Cela peut leur nuire. Vous pouvez demander à votre médecin ou à votre pharmacien des informations sur PREVACID 30 mg et PREVACID 15 mg SoluTab qui sont destinées aux professionnels de la santé.
Quels sont les ingrédients de PREVACID et PREVACID SoluTab ?
Ingrédient actif: lansoprazole.
Ingrédients inactifs dans les gélules PREVACID 30 mg : sphère de sucre, saccharose, copolymère d'acide méthacrylique, hydroxypropylcellulose faiblement substituée, amidon, carbonate de magnésium, talc, polyéthylène glycol, dioxyde de titane, polysorbate 80, hydroxypropylcellulose, dioxyde de silicium colloïdal, D&C Red No. 28, FD&C Blue No. 1, et FD&C rouge n° 40.
PREVACID 15 mg gélule uniquement : FD&C vert n° 3.
Ingrédients inactifs de PREVACID 15mg SoluTab : mannitol, acide méthacrylique, hydroxypropylcellulose, lactose monohydraté-sphère de cellulose microcristalline, citrate de triéthyle, crospovidone, polyacrylate, carbonate de magnésium, aspartame, monostéarate de glycéryle, hypromellose, stéarate de magnésium, acide citrique, dioxyde de titane, talc, arôme artificiel de fraise, polyéthylène glycol, polysorbate 80 et oxyde de fer.
PREVACID SoluTab contient 2,5 mg de phénylalanine dans chaque comprimé de 15 mg et 5,1 mg de phénylalanine dans chaque comprimé de 30 mg.
MODE D'EMPLOI
PREVACID (prev-a-sid) (lansoprazole) gélules à libération retardée, à usage oral et
PREVACID SoluTab (prev-a-sid sol-u-tab) (lansoprazole) comprimés à désintégration orale à libération retardée
Important:
- Prenez PREVACID 15mg ou PREVACID 15mg SoluTab avant les repas.
- Ne pas écraser ou mâcher les gélules PREVACID 15mg ou PREVACID 30mg SoluTab.
- PREVACID ou PREVACID 15mg SoluTab ne doit être utilisé qu'avec les aliments et jus listés ci-dessous.
Gélules à libération retardée PREVACID (Gélules PREVACID 30mg)
Prise de PREVACID 15mg gélules avec certains aliments :
Vous ne pouvez utiliser que de la compote de pommes, du pouding ENSURE, du fromage cottage, du yogourt ou des poires égouttées.
Prendre les gélules PREVACID avec certains jus :
Vous ne pouvez utiliser que du jus de pomme, du jus d'orange ou du jus de tomate.
Administration de capsules PREVACID par une sonde nasogastrique (sonde NG) de taille 16 French ou plus :
Vous ne pouvez utiliser que du jus de pomme.
PREVACID 15 mg SoluTab comprimés à désintégration orale à libération retardée (PREVACID SoluTab)
Pour les patients qui ont du mal à avaler les comprimés, PREVACID SoluTab peut être administré comme suit :
Administration de PREVACID SoluTab avec de l'eau à l'aide d'une seringue orale :
Administration de PREVACID 15 mg SoluTab avec de l'eau par une sonde nasogastrique (sonde NG) de taille 8 French ou plus :
Comment dois-je conserver PREVACID et PREVACID 30mg SoluTab ?
- Conservez les capsules PREVACID et PREVACID 15mg SoluTab à température ambiante entre 68°F et 77°F (20°C à 25°C).
Gardez PREVACID et PREVACID 30mg SoluTab et tous les médicaments hors de la portée des enfants.
Ce mode d'emploi a été approuvé par la Food and Drug Administration des États-Unis.
