Plavix 75mg Clopidogrel Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Plavix 75 mg et comment est-il utilisé ?
Plavix 75 mg est un médicament délivré sur ordonnance utilisé pour traiter les symptômes du syndrome coronarien aigu tels qu'un accident vasculaire cérébral, un caillot sanguin ou un problème cardiaque grave après une crise cardiaque, des douleurs thoraciques sévères ou des problèmes de circulation. Plavix 75 mg peut être utilisé seul ou avec d'autres médicaments.
Plavix 75 mg appartient à une classe de médicaments appelés agents antiplaquettaires, cardiovasculaires, agents antiplaquettaires, hématologiques.
On ne sait pas si Plavix est sûr et efficace chez les enfants.
Quels sont les effets secondaires possibles de Plavix 75mg ?
Plavix 75 mg peut provoquer des effets secondaires graves, notamment :
- peau pâle,
- ecchymoses faciles,
- taches violettes sous la peau ou dans la bouche,
- jaunissement de la peau ou des yeux (jaunisse),
- battements de coeur rapides,
- essoufflement,
- mal de tête,
- fièvre,
- la faiblesse,
- se sentir fatigué,
- peu ou pas de miction,
- saisie (convulsions),
- engourdissement ou faiblesse soudaine,
- confusion, et
- problèmes de vision ou d'élocution
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Plavix incluent :
- augmentation des saignements,
- saignements de nez,
- maux de tête,
- démangeaisons et
- ecchymoses
ATTENTION
DIMINUTION DE L'EFFET ANTIPLAQUETTAIRE CHEZ LES PATIENTS AVEC DEUX ALLÈLES DE PERTE DE FONCTION DU GÈNE CYP2C19
L'efficacité de Plavix 75 mg résulte de son activité antiplaquettaire, qui dépend de sa conversion en un métabolite actif par le système du cytochrome P450 (CYP), principalement le CYP2C19 [voir AVERTISSEMENTS ET PRECAUTIONS , PHARMACOLOGIE CLINIQUE ]. Aux doses recommandées, Plavix forme moins de métabolite actif et a donc un effet réduit sur l'activité plaquettaire chez les patients homozygotes pour les allèles non fonctionnels du gène CYP2C19 (appelés « métaboliseurs lents du CYP2C19 »). Des tests sont disponibles pour identifier les patients métaboliseurs lents du CYP2C19 [voir PHARMACOLOGIE CLINIQUE ]. Envisager l'utilisation d'un autre inhibiteur plaquettaire P2Y12 chez les patients identifiés comme métaboliseurs lents du CYP2C19.
LA DESCRIPTION
Plavix (bisulfate de clopidogrel) est un inhibiteur de la classe des thiénopyridines des récepteurs plaquettaires P2Y12 de l'ADP. Chimiquement, il s'agit de sulfate de méthyle (+)-(S)-α-(2-chlorophényl)-6,7-dihydrothiéno[3,2-c]pyridine-5(4H)-acétate (1:1). La formule empirique du bisulfate de clopidogrel est C16H16ClNO2S•H2SO4 et son poids moléculaire est de 419,9. La formule structurale est la suivante :

Le bisulfate de clopidogrel est une poudre blanche à blanc cassé. Il est pratiquement insoluble dans l'eau à pH neutre mais librement soluble à pH 1. Il se dissout également librement dans le méthanol, se dissout avec parcimonie dans le chlorure de méthylène et est pratiquement insoluble dans l'éther éthylique. Il a une rotation optique spécifique d'environ +56°.
Plavix pour administration orale est fourni sous forme de comprimés pelliculés roses, ronds, biconvexes, en creux et contenant 97,875 mg de bisulfate de clopidogrel, soit l'équivalent molaire de 75 mg de base de clopidogrel, ou de comprimés pelliculés roses, oblongs, en creux contenant 391,5 mg. de bisulfate de clopidogrel qui est l'équivalent molaire de 300 mg de clopidogrel base.
Chaque comprimé contient de l'huile de ricin hydrogénée, de l'hydroxypropylcellulose, du mannitol, de la cellulose microcristalline et du polyéthylèneglycol 6000 comme ingrédients inactifs. Le pelliculage rose contient de l'oxyde de fer, de l'hypromellose 2910, du lactose monohydraté, du dioxyde de titane et de la triacétine. Les tablettes sont polies avec de la cire de Carnauba.
LES INDICATIONS
Syndrome coronarien aigu (SCA)
- Plavix 75 mg est indiqué pour réduire le taux d'infarctus du myocarde (IM) et d'accident vasculaire cérébral chez les patients atteints de SCA sans élévation du segment ST (angor instable [UA]/infarctus du myocarde sans élévation du segment ST [NSTEMI]), y compris les patients qui doivent être pris en charge médicalement et ceux qui doivent être pris en charge par revascularisation coronarienne. Plavix 75 mg doit être administré en association avec de l'aspirine.
- Plavix est indiqué pour réduire le taux d'infarctus du myocarde et d'accident vasculaire cérébral chez les patients présentant un infarctus aigu du myocarde avec élévation du segment ST (STEMI) qui doivent être pris en charge médicalement. Plavix 75 mg doit être administré en association avec de l'aspirine.
IDM récent, accident vasculaire cérébral récent ou maladie artérielle périphérique établie
Chez les patients atteints d'artériopathie périphérique établie ou ayant des antécédents d'infarctus du myocarde (IM) récent ou d'accident vasculaire cérébral récent, Plavix 75 mg est indiqué pour réduire le taux d'IM et d'AVC.
DOSAGE ET ADMINISTRATION
Syndrome coronarien aigu
Chez les patients qui ont besoin d'un effet antiplaquettaire en quelques heures, initiez Plavix avec une dose de charge orale unique de 300 mg, puis continuez à 75 mg une fois par jour. L'initiation de Plavix 75 mg sans dose de charge retardera l'établissement d'un effet antiplaquettaire de plusieurs jours [voir PHARMACOLOGIE CLINIQUE et Etudes cliniques ].
IDM récent, accident vasculaire cérébral récent ou maladie artérielle périphérique établie
75 mg une fois par jour par voie orale sans dose de charge [voir PHARMACOLOGIE CLINIQUE et Etudes cliniques ].
COMMENT FOURNIE
Formes posologiques et points forts
- Comprimés à 75 mg : Comprimés pelliculés roses, ronds, biconvexes portant l'inscription « 75 » gravée sur une face et « 1171 » sur l'autre
- Comprimés à 300 mg : Comprimés pelliculés roses, oblongs, gravés « 300 » d'un côté et « 1332 » de l'autre
Stockage et manutention
Plavix (bisulfate de clopidogrel) 75 mg Les comprimés sont disponibles sous forme de comprimés pelliculés roses, ronds, biconvexes portant l'inscription « 75 » gravée sur une face et « 1171 » sur l'autre. Les comprimés sont fournis comme suit :
CDN 63653-1171-6 Bouteilles de 30 CDN 63653-1171-1 Flacons de 90 CDN 63653-1171-5 Bouteilles de 500 CDN 63653-1171-3 Plaquettes de 100
Plavix (bisulfate de clopidogrel) 300 mg Les comprimés sont disponibles sous forme de comprimés pelliculés roses, oblongs, portant l'inscription « 300 » d'un côté et « 1332 » de l'autre. Les comprimés sont fournis comme suit :
CDN 63653-1332-2 Conditionnements unitaires de 30
Conserver à 25 °C (77 °F); excursions autorisées jusqu'à 15°C-30°C (59°F-86°F) [voir Température ambiante contrôlée USP ].
Distribué par : Bristol-Myers Squibb/Sanofi Pharmaceuticals Partnership, Bridgewater, NJ 08807. Révisé : mars 2021
EFFETS SECONDAIRES
Les effets indésirables graves suivants sont discutés ci-dessous et ailleurs dans l'étiquetage :
- Saignement [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Purpura thrombocytopénique thrombotique [voir AVERTISSEMENTS ET PRECAUTIONS ]
Expérience des essais cliniques
Étant donné que les essais cliniques sont menés dans des conditions et des durées de suivi très variables, les taux d'effets indésirables observés dans les essais cliniques d'un médicament ne peuvent pas être directement comparés aux taux des essais cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique.
L'innocuité de Plavix a été évaluée chez plus de 54 000 patients, dont plus de 21 000 patients traités pendant un an ou plus. Les effets indésirables cliniquement importants observés dans les essais comparant Plavix 75 mg plus aspirine à un placebo plus aspirine et les essais comparant Plavix seul à l'aspirine seule sont discutés ci-dessous.
Saignement
SOIGNER
Dans CURE, l'utilisation de Plavix avec de l'aspirine a été associée à une augmentation des saignements majeurs (principalement gastro-intestinaux et au niveau des sites de ponction) par rapport au placebo avec de l'aspirine (voir tableau 1). L'incidence des hémorragies intracrâniennes (0,1 %) et des hémorragies mortelles (0,2 %) était la même dans les deux groupes. Les autres événements hémorragiques signalés plus fréquemment dans le groupe clopidogrel étaient l'épistaxis, l'hématurie et les ecchymoses.
L'incidence globale des saignements est décrite dans le tableau 1.
COMMETTRE
Dans l'étude COMMIT, des taux similaires d'hémorragies majeures ont été observés dans les groupes Plavix 75 mg et placebo, qui ont tous deux également reçu de l'aspirine (voir tableau 2).
CAPRIE (Plavix vs Aspirine)
Dans l'étude CAPRIE, les hémorragies gastro-intestinales sont survenues à un taux de 2,0 % chez les personnes prenant Plavix 75 mg contre 2,7 % chez celles prenant de l'aspirine ; des saignements nécessitant une hospitalisation sont survenus chez 0,7 % et 1,1 %, respectivement. L'incidence des hémorragies intracrâniennes était de 0,4 % pour Plavix contre 0,5 % pour l'aspirine.
Les autres événements hémorragiques signalés plus fréquemment dans le groupe Plavix 75 mg étaient l'épistaxis et l'hématome.
Autres événements indésirables
Dans CURE et CHARISMA, qui comparaient Plavix plus aspirine à l'aspirine seule, il n'y avait aucune différence dans le taux d'événements indésirables (autres que les saignements) entre Plavix et le placebo.
Dans CAPRIE, qui comparait Plavix 75 mg à l'aspirine, le prurit était plus fréquemment signalé chez les personnes prenant Plavix. Aucune autre différence dans le taux d'événements indésirables (autres que les saignements) n'a été signalée.
Expérience post-commercialisation
Les effets indésirables suivants ont été identifiés lors de l'utilisation post-approbation de Plavix. Étant donné que ces réactions sont signalées volontairement par une population de taille inconnue, il n'est pas toujours possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale avec l'exposition au médicament.
Des hémorragies, y compris d'issue fatale, ont été rapportées chez des patients traités par Plavix.
- Troubles du système sanguin et lymphatique : Agranulocytose, anémie aplasique/pancytopénie, purpura thrombocytopénique thrombotique (PTT), hémophilie A acquise
- Problèmes gastro-intestinaux: Colite (y compris colite ulcéreuse ou lymphocytaire), pancréatite, stomatite, ulcère gastrique/duodénal, diarrhée
- Troubles généraux et affection au site d'administration : Fièvre
- Affections hépatobiliaires : Insuffisance hépatique aiguë, hépatite (non infectieuse), test de la fonction hépatique anormal
- Troubles du système immunitaire : Réactions d'hypersensibilité, réactions anaphylactoïdes, maladie sérique, syndrome insulino-auto-immun, pouvant entraîner une hypoglycémie sévère
- Troubles musculo-squelettiques, du tissu conjonctif et osseux : Myalgie, arthralgie, arthrite
- Troubles du système nerveux : Troubles du goût, céphalées, agueusie
- Troubles psychiatriques: Confusion, hallucinations
- Troubles respiratoires, thoraciques et médiastinaux : Bronchospasme, pneumonie interstitielle, pneumonie à éosinophiles
- Troubles rénaux et urinaires : Augmentation des niveaux de créatinine
- Affections de la peau et du tissu sous-cutané : Rash maculopapulaire, érythémateux ou exfoliatif, urticaire, dermatite bulleuse, eczéma, nécrolyse épidermique toxique, syndrome de Stevens-Johnson, pustulose exanthématique aiguë généralisée (PEAG), œdème de Quincke, syndrome d'hypersensibilité médicamenteuse, éruption médicamenteuse avec éosinophilie et symptômes systémiques (DRESS), érythème polymorphe, lichen plan, prurit généralisé
- Affections vasculaires : Vascularite, hypotension
INTERACTIONS MÉDICAMENTEUSES
Inducteurs du CYP2C19
Étant donné que le clopidogrel est métabolisé en son métabolite actif en partie par le CYP2C19, l'utilisation de médicaments qui induisent l'activité de cette enzyme devrait entraîner une augmentation des concentrations médicamenteuses du métabolite actif du clopidogrel.
La rifampicine induit fortement le CYP2C19 entraînant à la fois une augmentation du taux de métabolite actif du clopidogrel et une inhibition plaquettaire, ce qui en particulier pourrait potentialiser le risque de saignement. Par précaution, éviter l'utilisation concomitante d'inducteurs puissants du CYP2C19 [voir AVERTISSEMENTS ET PRECAUTIONS et PHARMACOLOGIE CLINIQUE ].
Inhibiteurs du CYP2C19
Le clopidogrel est métabolisé en son métabolite actif en partie par le CYP2C19. L'utilisation concomitante de médicaments qui inhibent l'activité de cette enzyme entraîne une réduction des concentrations plasmatiques du métabolite actif du clopidogrel et une réduction de l'inhibition plaquettaire [voir AVERTISSEMENTS ET PRECAUTIONS ].
Oméprazole ou ésoméprazole
Éviter l'utilisation concomitante de Plavix 75 mg avec de l'oméprazole ou de l'ésoméprazole. Dans les études cliniques, l'oméprazole s'est avéré réduire de manière significative l'activité antiplaquettaire de Plavix 75 mg lorsqu'il est administré de façon concomitante ou à 12 heures d'intervalle. Une réduction similaire de l'activité antiplaquettaire a été observée avec l'ésoméprazole administré en concomitance avec Plavix. Le dexlansoprazole, le lansoprazole et le pantoprazole ont eu moins d'effet sur l'activité antiplaquettaire de Plavix que l'oméprazole ou l'ésoméprazole [voir AVERTISSEMENTS ET PRECAUTIONS et PHARMACOLOGIE CLINIQUE ].
Opioïdes
Comme avec d'autres inhibiteurs oraux de P2Y12, l'administration concomitante d'agonistes opioïdes retarde et réduit l'absorption du clopidogrel, vraisemblablement en raison d'un ralentissement de la vidange gastrique, entraînant une exposition réduite à ses métabolites [voir PHARMACOLOGIE CLINIQUE ]. Envisager l'utilisation d'un agent antiplaquettaire parentéral chez les patients atteints d'un syndrome coronarien aigu nécessitant une co-administration de morphine ou d'autres agonistes opioïdes.
Anti-inflammatoires non stéroïdiens (AINS)
L'administration concomitante de Plavix 75 mg et d'AINS augmente le risque d'hémorragie gastro-intestinale.
Warfarine (substrats du CYP2C9)
Bien que l'administration de clopidogrel 75 mg par jour n'ait pas modifié la pharmacocinétique de la S-warfarine (un substrat du CYP2C9) ou l'INR chez les patients recevant un traitement à long terme par la warfarine, la co-administration de Plavix 75 mg avec la warfarine augmente le risque de saignement en raison d'effets indépendants sur hémostase.
Cependant, à fortes concentrations in vitro, le clopidogrel inhibe le CYP2C9.
ISRS et IRSN
Étant donné que les inhibiteurs sélectifs de la recapture de la sérotonine (ISRS) et les inhibiteurs de la recapture de la sérotonine et de la noradrénaline (IRSN) affectent l'activation plaquettaire, l'administration concomitante d'ISRS et d'IRSN avec le clopidogrel peut augmenter le risque de saignement.
Répaglinide (substrats du CYP2C8)
Le métabolite acyl-β-glucuronide du clopidogrel est un puissant inhibiteur du CYP2C8. Plavix 75 mg peut augmenter l'exposition systémique aux médicaments qui sont principalement éliminés par le CYP2C8, nécessitant ainsi un ajustement de la dose et une surveillance appropriée.
Plavix a augmenté les expositions au répaglinide de 3,9 à 5,1 fois [voir PHARMACOLOGIE CLINIQUE ]. Éviter l'utilisation concomitante de répaglinide avec Plavix. Si l'utilisation concomitante ne peut être évitée, initier le répaglinide à 0,5 mg avant chaque repas et ne pas dépasser une dose quotidienne totale de 4 mg. Une fréquence accrue de surveillance de la glycémie peut être nécessaire lors d'une utilisation concomitante.
AVERTISSEMENTS
Inclus dans le cadre du PRÉCAUTIONS section.
PRÉCAUTIONS
Diminution de l'activité antiplaquettaire chez les patients présentant une altération de la fonction CYP2C19
Le clopidogrel est un promédicament. L'inhibition de l'agrégation plaquettaire par le clopidogrel est obtenue grâce à un métabolite actif. Le métabolisme du clopidogrel en son métabolite actif peut être altéré par des variations génétiques du CYP2C19 [voir AVERTISSEMENT ENCADRÉ ].
Le métabolisme du clopidogrel peut également être altéré par des médicaments qui inhibent le CYP2C19, tels que l'oméprazole ou l'ésoméprazole. Éviter l'utilisation concomitante de Plavix avec l'oméprazole ou l'ésoméprazole car les deux réduisent significativement l'activité antiplaquettaire de Plavix [voir INTERACTIONS MÉDICAMENTEUSES ].
Risque général de saignement
Les inhibiteurs de P2Y12 (thiénopyridines), y compris Plavix, augmentent le risque de saignement.
Les inhibiteurs de P2Y12 (Thienopyridines), inhibent l'agrégation plaquettaire pendant toute la durée de vie de la plaquette (7-10 jours). Étant donné que la demi-vie du métabolite actif du clopidogrel est courte, il peut être possible de rétablir l'hémostase en administrant des plaquettes exogènes ; cependant, les transfusions de plaquettes dans les 4 heures suivant la dose de charge ou les 2 heures suivant la dose d'entretien peuvent être moins efficaces.
L'utilisation de médicaments qui induisent l'activité du CYP2C19 devrait entraîner une augmentation des concentrations médicamenteuses du métabolite actif du clopidogrel et pourrait potentialiser le risque de saignement. Par précaution, éviter l'utilisation concomitante d'inducteurs puissants du CYP2C19 [voir INTERACTIONS MÉDICAMENTEUSES et PHARMACOLOGIE CLINIQUE ].
Arrêt de Plavix
L'arrêt de Plavix augmente le risque d'événements cardiovasculaires. Si Plavix doit être temporairement arrêté (par exemple, pour traiter un saignement ou pour une intervention chirurgicale avec un risque majeur de saignement), le reprendre dès que possible. Lorsque cela est possible, interrompez le traitement par Plavix pendant cinq jours avant une telle intervention chirurgicale. Reprendre Plavix 75mg dès que l'hémostase est atteinte.
Purpura thrombocytopénique thrombotique (PTT)
Des TTP, parfois mortels, ont été rapportés suite à l'utilisation de Plavix 75mg, parfois après une courte exposition ( EFFETS INDÉSIRABLES ].
Réactivité croisée parmi les thiénopyridines
Une hypersensibilité incluant éruption cutanée, œdème de Quincke ou réaction hématologique a été rapportée chez des patients recevant Plavix 75 mg, y compris des patients ayant des antécédents d'hypersensibilité ou de réaction hématologique à d'autres thiénopyridines [voir CONTRE-INDICATIONS et EFFETS INDÉSIRABLES ].
Informations sur les conseils aux patients
Conseillez aux patients de lire l'étiquetage patient approuvé par la FDA ( Guide des médicaments ).
Arrêt
Conseillez aux patients de ne pas interrompre Plavix sans en avoir d'abord discuté avec le professionnel de la santé qui l'a prescrit [voir AVERTISSEMENTS ET PRECAUTIONS ].
Saignement
Informez les patients qu'ils :
- aura des ecchymoses et saignera plus facilement
- prendra plus de temps que d'habitude pour arrêter le saignement
- doivent signaler tout saignement imprévu, prolongé ou excessif, ou la présence de sang dans leurs selles ou leurs urines [voir AVERTISSEMENTS ET PRECAUTIONS ]
Purpura thrombotique thrombotique
Demandez aux patients de consulter rapidement un médecin s'ils présentent des symptômes de PTT qui ne peuvent pas être expliqués autrement [voir AVERTISSEMENTS ET PRECAUTIONS ].
Procédures invasives
Conseillez aux patients d'informer les médecins et les dentistes qu'ils prennent Plavix avant toute intervention chirurgicale ou dentaire [voir AVERTISSEMENTS ET PRECAUTIONS ].
Les inhibiteurs de la pompe à protons
Conseillez aux patients de ne pas prendre d'oméprazole ou d'ésoméprazole pendant la prise de Plavix. Le dexlansoprazole, le lansoprazole et le pantoprazole ont eu des effets moins prononcés sur l'activité antiplaquettaire de Plavix 75 mg que l'oméprazole ou l'ésoméprazole [voir INTERACTIONS MÉDICAMENTEUSES ].
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Il n'y avait aucun signe de tumorigénicité lorsque le clopidogrel a été administré pendant 78 semaines à des souris et 104 semaines à des rats à des doses allant jusqu'à 77 mg/kg par jour, ce qui a entraîné des expositions plasmatiques > 25 fois supérieures à celles observées chez l'homme à la dose quotidienne recommandée de 75 mg.
Le clopidogrel n'a pas été génotoxique dans quatre tests in vitro (test d'Ames, test de réparation de l'ADN sur hépatocytes de rat, test de mutation génique sur fibroblastes de hamster chinois et analyse chromosomique en métaphase de lymphocytes humains) et dans un test in vivo (test du micronoyau par voie orale chez souris).
Le clopidogrel s'est avéré n'avoir aucun effet sur la fertilité des rats mâles et femelles traités avant l'accouplement et tout au long de la gestation à des doses orales allant jusqu'à 400 mg/kg par jour (52 fois la dose humaine recommandée sur une base en mg/m²).
Utilisation dans des populations spécifiques
Grossesse
Résumé des risques
Les données disponibles sur les cas rapportés dans la littérature publiée et la surveillance post-commercialisation avec l'utilisation de clopidogrel chez les femmes enceintes n'ont identifié aucun risque associé au médicament de malformations congénitales majeures ou de fausse couche [voir Données ].Il existe des risques pour la femme enceinte et le fœtus associés à l'infarctus du myocarde et à l'accident vasculaire cérébral [voir Considérations cliniques ]. Aucun signe de fœtotoxicité n'a été observé lorsque le clopidogrel a été administré à des rates et des lapines gestantes au cours de l'organogenèse à des doses correspondant à 65 et 78 fois la dose quotidienne recommandée chez l'homme [voir Données ].
Le risque de fond estimé de malformations congénitales majeures et de fausse couche pour les populations indiquées est inconnu. Toutes les grossesses présentent un risque de fond de malformations congénitales, de perte ou d'autres résultats indésirables. Dans la population générale des États-Unis, le risque de fond estimé de malformations congénitales majeures et de fausse couche dans les grossesses cliniquement reconnues est de 2 % à 4 % et de 15 % à 20 %, respectivement.
Considérations cliniques
Risque maternel et/ou embryonnaire/fœtal associé à la maladie
L'infarctus du myocarde et l'AVC sont des urgences médicales. Le traitement de la femme enceinte ne doit pas être suspendu en raison de préoccupations potentielles concernant les effets du clopidogrel sur le fœtus.
Travail ou accouchement
L'utilisation de clopidogrel pendant le travail ou l'accouchement augmentera le risque de saignement et d'hémorragie chez la mère. Éviter le blocage neuraxial pendant l'utilisation du clopidogrel en raison du risque d'hématome rachidien. Dans la mesure du possible, interrompez le clopidogrel 5 à 7 jours avant le travail, l'accouchement ou le blocage neuraxial.
Données
Données humaines
Les données disponibles à partir de rapports de cas publiés sur deux décennies d'utilisation post-commercialisation n'ont pas identifié d'association avec l'utilisation de clopidogrel pendant la grossesse et les malformations congénitales majeures, les fausses couches ou les résultats fœtaux indésirables.
Données animales
Des études toxicologiques sur le développement embryo-fœtal ont été réalisées chez des rats et des lapins gravides avec des doses allant jusqu'à 500 et 300 mg/kg/jour, respectivement, administrées pendant l'organogenèse. Ces doses, correspondant respectivement à 65 et 78 fois la dose quotidienne recommandée chez l'homme, sur une base en mg/m², n'ont révélé aucun signe d'altération de la fertilité ou de fœtotoxicité due au clopidogrel.
Lactation
Résumé des risques
Il n'y a pas de données sur la présence de clopidogrel dans le lait maternel ou sur les effets sur la production de lait. Aucun effet indésirable sur les nourrissons allaités n'a été observé avec l'utilisation maternelle du clopidogrel pendant l'allaitement dans un petit nombre de cas post-commercialisation. Des études chez le rat ont montré que le clopidogrel et/ou ses métabolites sont présents dans le lait. Lorsqu'un médicament est présent dans le lait animal, il est probable que le médicament sera présent dans le lait humain. Les avantages de l'allaitement pour le développement et la santé doivent être pris en compte, ainsi que le besoin clinique de PLAVIX de la mère et tout effet indésirable potentiel sur le nourrisson allaité de PLAVIX 75 mg ou d'une affection maternelle sous-jacente.
Utilisation pédiatrique
La sécurité et l'efficacité dans les populations pédiatriques n'ont pas été établies.
Un essai randomisé contrôlé par placebo (CLARINET) n'a pas démontré de bénéfice clinique du clopidogrel chez les nouveau-nés et les nourrissons atteints de cardiopathie congénitale cyanotique palliée par un shunt artériel systémique-pulmonaire. Les facteurs possibles contribuant à ce résultat étaient la dose de clopidogrel, l'administration concomitante d'aspirine et l'initiation tardive du traitement après la palliation du shunt. Il ne peut être exclu qu'un essai de conception différente démontre un bénéfice clinique dans cette population de patients.
Utilisation gériatrique
Sur le nombre total de sujets dans les études cliniques contrôlées CAPRIE et CURE, environ 50 % des patients traités par Plavix étaient âgés de 65 ans et plus et 15 % avaient 75 ans et plus. Dans COMMIT, environ 58 % des patients traités par Plavix 75 mg avaient 60 ans et plus, dont 26 % avaient 70 ans et plus.
Le risque observé d'événements hémorragiques avec Plavix 75 mg plus aspirine par rapport au placebo plus aspirine par catégorie d'âge est fourni dans le tableau 1 et le tableau 2 pour les essais CURE et COMMIT, respectivement [voir EFFETS INDÉSIRABLES ]. Aucun ajustement posologique n'est nécessaire chez les patients âgés.
Insuffisance rénale
L'expérience est limitée chez les patients atteints d'insuffisance rénale sévère et modérée [voir PHARMACOLOGIE CLINIQUE ].
Insuffisance hépatique
Aucun ajustement posologique n'est nécessaire chez les patients insuffisants hépatiques [voir PHARMACOLOGIE CLINIQUE ].
SURDOSAGE
L'inhibition plaquettaire par Plavix est irréversible et durera toute la vie de la plaquette. Un surdosage après l'administration de clopidogrel peut entraîner des complications hémorragiques. Une dose orale unique de clopidogrel à 1500 ou 2000 mg/kg a été létale chez la souris et le rat et à 3000 mg/kg chez le babouin. Les symptômes de toxicité aiguë étaient des vomissements, une prostration, une respiration difficile et une hémorragie gastro-intestinale chez les animaux.
Sur la base de la plausibilité biologique, la transfusion de plaquettes peut restaurer la capacité de coagulation.
CONTRE-INDICATIONS
Saignement actif
Plavix est contre-indiqué chez les patients présentant des saignements pathologiques actifs tels qu'un ulcère peptique ou une hémorragie intracrânienne.
Hypersensibilité
Plavix 75 mg est contre-indiqué chez les patients présentant une hypersensibilité (par exemple, anaphylaxie) au clopidogrel ou à l'un des composants du produit [voir EFFETS INDÉSIRABLES ].
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
Le clopidogrel est un inhibiteur de l'activation et de l'agrégation plaquettaires par la liaison irréversible de son métabolite actif à la classe P2Y12 des récepteurs ADP sur les plaquettes.
Pharmacodynamie
Le clopidogrel doit être métabolisé par les enzymes CYP450 pour produire le métabolite actif qui inhibe l'agrégation plaquettaire. Le métabolite actif du clopidogrel inhibe sélectivement la liaison de l'adénosine diphosphate (ADP) à son récepteur plaquettaire P2Y12 et l'activation subséquente médiée par l'ADP du complexe glycoprotéine GPIIb/IIIa, inhibant ainsi l'agrégation plaquettaire. Cette action est irréversible. Par conséquent, les plaquettes exposées au métabolite actif du clopidogrel sont affectées pour le reste de leur durée de vie (environ 7 à 10 jours). L'agrégation plaquettaire induite par des agonistes autres que l'ADP est également inhibée en bloquant l'amplification de l'activation plaquettaire par l'ADP libéré.
Une inhibition dose-dépendante de l'agrégation plaquettaire peut être observée 2 heures après des doses orales uniques de Plavix. Des doses répétées de 75 mg de Plavix par jour inhibent l'agrégation plaquettaire induite par l'ADP le premier jour, et l'inhibition atteint l'état d'équilibre entre le jour 3 et le jour 7. À l'état d'équilibre, le niveau d'inhibition moyen observé avec une dose de 75 mg de Plavix par jour était de entre 40% et 60%. L'agrégation plaquettaire et le temps de saignement reviennent progressivement aux valeurs initiales après l'arrêt du traitement, généralement en 5 jours environ.
Patients gériatriques
Les sujets âgés (≥75 ans) et jeunes en bonne santé ont eu des effets similaires sur l'agrégation plaquettaire.
Patients atteints d'insuffisance rénale
Après des doses répétées de 75 mg de Plavix 75 mg par jour, les patients présentant une insuffisance rénale sévère (clairance de la créatinine de 5 à 15 mL/min) et une insuffisance rénale modérée (clairance de la créatinine de 30 à 60 mL/min) ont montré une faible inhibition (25 %) de Agrégation plaquettaire induite par l'ADP.
Patients atteints d'insuffisance hépatique
Après des doses répétées de 75 mg de Plavix par jour pendant 10 jours chez des patients atteints d'insuffisance hépatique sévère, l'inhibition de l'agrégation plaquettaire induite par l'ADP a été similaire à celle observée chez les sujets sains.
Le genre
Dans une petite étude comparant des hommes et des femmes, une moindre inhibition de l'agrégation plaquettaire induite par l'ADP a été observée chez les femmes.
Pharmacocinétique
Le clopidogrel est un promédicament et est métabolisé en un métabolite pharmacologiquement actif et des métabolites inactifs.
Absorption
Après des doses orales uniques et répétées de 75 mg par jour, le clopidogrel est rapidement absorbé. L'absorption est d'au moins 50 %, basée sur l'excrétion urinaire des métabolites du clopidogrel.
Effet de la nourriture
Plavix peut être administré avec ou sans nourriture. Dans une étude menée chez des sujets sains de sexe masculin lorsque Plavix 75 mg par jour a été administré avec un petit-déjeuner standard, l'inhibition moyenne de l'agrégation plaquettaire induite par l'ADP a été réduite de moins de 9 %. Le métabolite actif AUC0-24 était inchangé en présence d'aliments, alors qu'il y avait une diminution de 57 % de la Cmax du métabolite actif. Des résultats similaires ont été observés lorsqu'une dose de charge de 300 mg de Plavix était administrée avec un petit-déjeuner riche en graisses.
Métabolisme
Le clopidogrel est largement métabolisé par deux voies métaboliques principales : l'une médiée par les estérases et conduisant à l'hydrolyse en un dérivé d'acide carboxylique inactif (85 % des métabolites circulants) et l'autre médiée par plusieurs enzymes du cytochrome P450. Les cytochromes oxydent d'abord le clopidogrel en un métabolite intermédiaire 2-oxo-clopidogrel. Le métabolisme ultérieur du métabolite intermédiaire 2-oxoclopidogrel entraîne la formation du métabolite actif, un dérivé thiol du clopidogrel. Le métabolite actif est formé principalement par le CYP2C19 avec des contributions de plusieurs autres enzymes CYP, notamment le CYP1A2, le CYP2B6 et le CYP3A. Le métabolite thiol actif se lie rapidement et de manière irréversible aux récepteurs plaquettaires, inhibant ainsi l'agrégation plaquettaire pendant toute la durée de vie de la plaquette.
La Cmax du métabolite actif est deux fois plus élevée après une dose de charge unique de 300 mg de clopidogrel qu'après quatre jours de dose d'entretien de 75 mg. La Cmax survient environ 30 à 60 minutes après l'administration. Dans la gamme de doses de 75 à 300 mg, la pharmacocinétique du métabolite actif s'écarte de la proportionnalité de la dose : 4 fois la dose entraîne respectivement 2,0 fois et 2,7 fois la Cmax et l'ASC.
Élimination
Après une dose orale de clopidogrel marqué au 14C chez l'homme, environ 50 % de la radioactivité totale a été excrétée dans l'urine et environ 46 % dans les fèces au cours des 5 jours suivant l'administration. Après une dose orale unique de 75 mg, le clopidogrel a une demi-vie d'environ 6 heures. La demi-vie du métabolite actif est d'environ 30 minutes.
Interactions médicamenteuses
Effet d'autres médicaments sur Plavix
Le clopidogrel est métabolisé en son métabolite actif en partie par le CYP2C19.
Inducteurs du CYP2C19
L'utilisation concomitante d'inducteurs puissants du CYP2C19 entraîne une augmentation de la concentration plasmatique du métabolite actif du clopidogrel et une augmentation de l'inhibition plaquettaire.
Rifampine : L'administration concomitante de 300 mg de rifampicine deux fois par jour pendant 7 jours avec une dose de charge de 600 mg de clopidogrel chez des adultes sains a augmenté de 3,8 fois l'ASC et la Cmax moyennes des métabolites thiols du clopidogrel. L'inhibition moyenne de l'agrégation plaquettaire 4 heures après l'administration était supérieure de 34 % en présence de rifampicine par rapport au clopidogrel administré seul.
Inhibiteurs du CYP2C19
L'utilisation concomitante de certains inhibiteurs de cette enzyme entraîne une réduction des concentrations plasmatiques du métabolite actif du clopidogrel et une réduction de l'inhibition plaquettaire.
Inhibiteurs de la pompe à protons (IPP)
L'effet des inhibiteurs de la pompe à protons (IPP) sur l'exposition systémique au métabolite actif du clopidogrel après plusieurs doses de Plavix 75 mg évalué dans des études d'interactions médicamenteuses dédiées est présenté dans la Figure 1.
Figure 1 : Exposition au métabolite actif du clopidogrel après plusieurs doses de Plavix 75 mg seul ou avec des inhibiteurs de la pompe à protons (IPP)
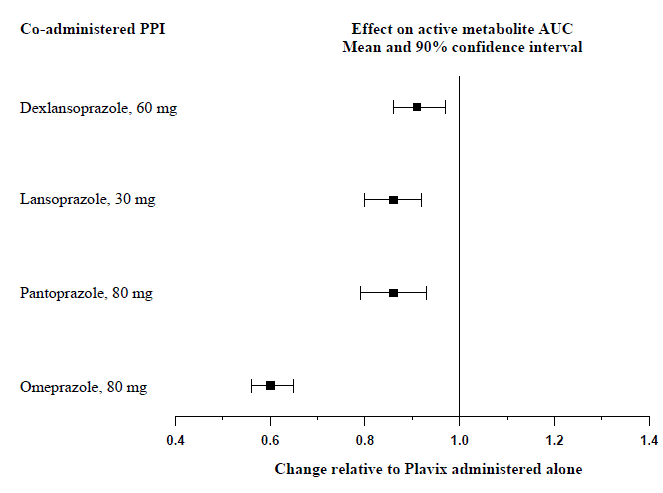
Les paramètres pharmacodynamiques et pharmacocinétiques mesurés dans ces études ont montré que l'interaction était la plus élevée avec l'oméprazole et la plus faible avec le dexlansoprazole.
Opioïdes
L'administration concomitante de 5 mg de morphine intraveineuse avec une dose de charge de 600 mg de clopidogrel chez des adultes sains a diminué l'ASC et la Cmax des métabolites thiols du clopidogrel de 34 %. L'agrégation plaquettaire moyenne était plus élevée jusqu'à 2 à 4 heures avec la co-administration de morphine.
Effet de Plavix 75 mg sur d'autres médicaments
Des études in vitro ont montré que le métabolite glucuronide du clopidogrel est un puissant inhibiteur du CYP2C8. L'administration concomitante de répaglinide avec Plavix a augmenté l'exposition systémique au répaglinide (ASC0-∞) de 5,1 fois après la dose de charge (300 mg) et de 3,9 fois au jour 3 de la dose d'entretien (75 mg) de Plavix [voir INTERACTIONS MÉDICAMENTEUSES ].
Pharmacogénomique
Le CYP2C19 est impliqué dans la formation du métabolite actif et du métabolite intermédiaire 2-oxo-clopidogrel. La pharmacocinétique du métabolite actif du clopidogrel et les effets antiplaquettaires, tels que mesurés par des tests d'agrégation plaquettaire ex vivo, diffèrent selon le génotype CYP2C19. Les patients homozygotes pour les allèles non fonctionnels du gène CYP2C19 sont appelés « métaboliseurs lents du CYP2C19 ». Environ 2 % des patients blancs et 4 % des patients noirs sont des métaboliseurs lents ; la prévalence d'un mauvais métabolisme est plus élevée chez les patients asiatiques (par exemple, 14 % des Chinois). Des tests sont disponibles pour identifier les patients métaboliseurs lents du CYP2C19.
Une étude croisée chez 40 sujets sains, 10 chacun dans les quatre groupes de métaboliseurs du CYP2C19, a évalué les réponses pharmacocinétiques et antiplaquettaires en utilisant 300 mg suivis de 75 mg par jour et 600 mg suivis de 150 mg par jour, chacun pendant un total de 5 jours. Une diminution de l'exposition aux métabolites actifs et une diminution de l'inhibition de l'agrégation plaquettaire ont été observées chez les métaboliseurs lents par rapport aux autres groupes.
Etudes cliniques
Syndrome coronarien aigu
SOIGNER
L'étude CURE a inclus 12 562 patients atteints de SCA sans sus-décalage du segment ST (UA ou NSTEMI) et se présentant dans les 24 heures suivant l'apparition de l'épisode le plus récent de douleur thoracique ou de symptômes compatibles avec une ischémie. Les patients devaient présenter soit des modifications de l'ECG compatibles avec une nouvelle ischémie (sans sus-décalage du segment ST), soit une élévation des enzymes cardiaques ou de la troponine I ou T à au moins deux fois la limite supérieure de la normale.
Les patients ont été randomisés pour recevoir Plavix (dose de charge de 300 mg suivie de 75 mg une fois par jour) ou un placebo, et ont été traités jusqu'à un an. Les patients ont également reçu de l'aspirine (75 à 325 mg une fois par jour) et d'autres thérapies standard telles que l'héparine. L'utilisation d'inhibiteurs de la GPIIb/IIIa n'était pas autorisée pendant les trois jours précédant la randomisation.
La population de patients était majoritairement blanche (82 %) et comprenait 38 % de femmes et 52 % d'âge ≥ 65 ans. Seulement environ 20 % des patients ont subi une revascularisation au cours de l'hospitalisation initiale et peu ont subi une revascularisation urgente ou urgente.
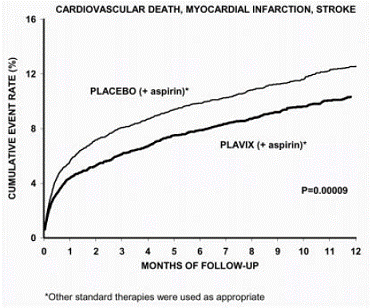
Le nombre de patients présentant le critère de jugement principal (décès CV, IM ou accident vasculaire cérébral) était de 582 (9,3 %) dans le groupe traité par Plavix et de 719 (11,4 %) dans le groupe traité par placebo, soit une réduction du risque relatif de 20 % (95 % IC de 10 % à 28 % ; p
La plupart des bénéfices de Plavix se sont produits au cours des deux premiers mois, mais la différence par rapport au placebo s'est maintenue tout au long de l'essai (jusqu'à 12 mois) (voir Figure 2).
Figure 2 : Décès cardiovasculaire, infarctus du myocarde et accident vasculaire cérébral dans l'étude CURE
L'effet de Plavix 75 mg n'a pas différé de manière significative dans les différents sous-groupes, comme le montre la figure 3. Les avantages associés à Plavix 75 mg étaient indépendants de l'utilisation d'autres thérapies cardiovasculaires aiguës et à long terme, y compris l'héparine/HBPM, la glycoprotéine intraveineuse IIb/IIIa (GPIIb/IIIa), les hypolipémiants, les bêta-bloquants et les inhibiteurs de l'ECA. L'efficacité de Plavix a été observée indépendamment de la dose d'aspirine (75-325 mg une fois par jour). L'utilisation d'anticoagulants oraux, d'antiplaquettaires non étudiés et d'AINS chroniques n'était pas autorisée dans CURE.
Figure 3 : Risque relatif pour les caractéristiques de base du patient et les médicaments/interventions concomitants pendant l'étude pour l'étude CURE
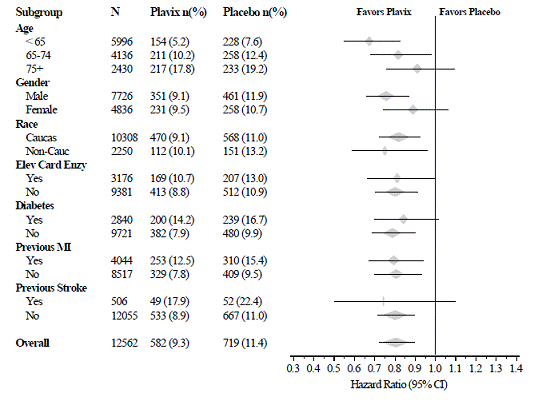
Figure 3 : Risque relatif pour les caractéristiques de base du patient et les médicaments/interventions concomitants pendant l'étude pour l'étude CURE (suite)
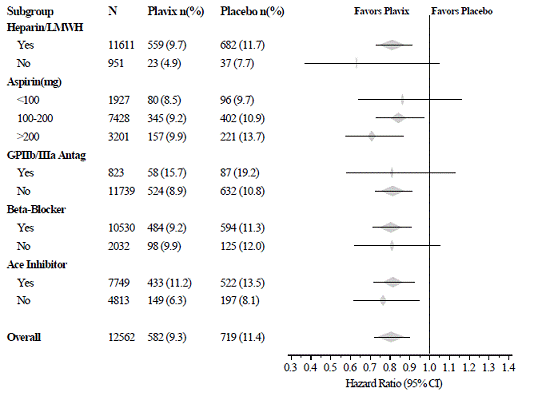
L'utilisation de Plavix dans CURE a été associée à une diminution de l'utilisation de la thérapie thrombolytique (71 patients [1,1 %] dans le groupe Plavix 75 mg, 126 patients [2,0 %] dans le groupe placebo ; réduction du risque relatif de 43 %), et Inhibiteurs GPIIb/IIIa (369 patients [5,9%] dans le groupe Plavix 75mg, 454 patients [7,2%] dans le groupe placebo, réduction du risque relatif de 18%). L'utilisation de Plavix 75 mg dans CURE n'a pas affecté le nombre de patients traités par PAC ou ICP (avec ou sans pose de stent) (2 253 patients [36,0 %] dans le groupe Plavix 75 mg, 2 324 patients [36,9 %] dans le groupe placebo ; réduction du risque de 4,0 %).
COMMETTRE
Chez les patients atteints de STEMI, la sécurité et l'efficacité de Plavix ont été évaluées dans l'étude randomisée, contrôlée contre placebo, en double aveugle, COMMIT. COMMIT a inclus 45 852 patients se présentant dans les 24 heures suivant l'apparition des symptômes d'un infarctus du myocarde avec des anomalies ECG à l'appui (c.-à-d. sus-décalage du segment ST, sous-décalage du segment ST ou bloc de branche gauche). Les patients ont été randomisés pour recevoir Plavix (75 mg une fois par jour) ou un placebo, en association avec de l'aspirine (162 mg par jour), pendant 28 jours ou jusqu'à la sortie de l'hôpital, selon la première éventualité.
Les principaux critères d'évaluation étaient le décès quelle qu'en soit la cause et la première occurrence d'un nouvel infarctus, d'un accident vasculaire cérébral ou du décès.
La population de patients était de 28 % de femmes et 58 % d'âge ≥ 60 ans (26 % d'âge ≥ 70 ans). Cinquante-cinq pour cent (55 %) des patients ont reçu des thrombolytiques et seulement 3 % ont subi une ICP.
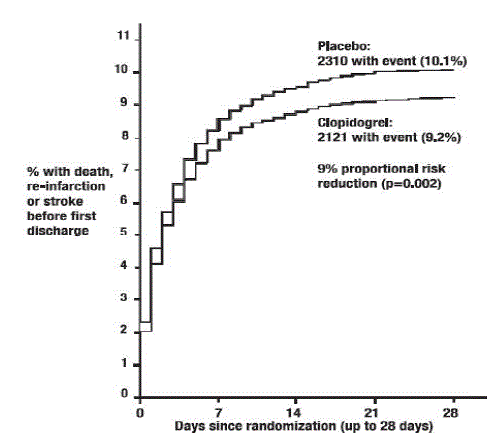
Comme le montrent le tableau 5 et la figure 4 et la figure 5 ci-dessous, Plavix a significativement réduit le risque relatif de décès toutes causes confondues de 7 % (p = 0,029) et le risque relatif de combinaison de réinfarctus, d'accident vasculaire cérébral ou de décès de 9 % ( p=0,002).
Figure 4 : Taux cumulés d'événements de décès dans l'étude COMMIT*
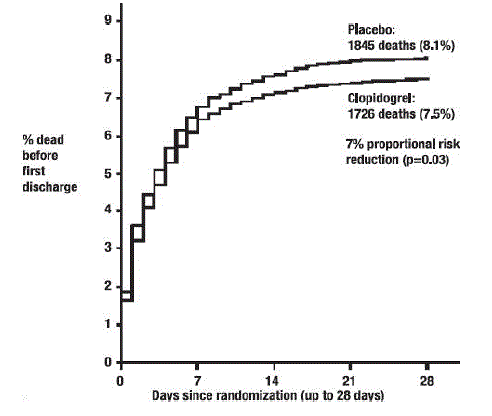
Figure 5 : Taux d'événements cumulés pour le critère d'évaluation combiné ré-infarctus, accident vasculaire cérébral ou décès dans l'étude COMMIT*
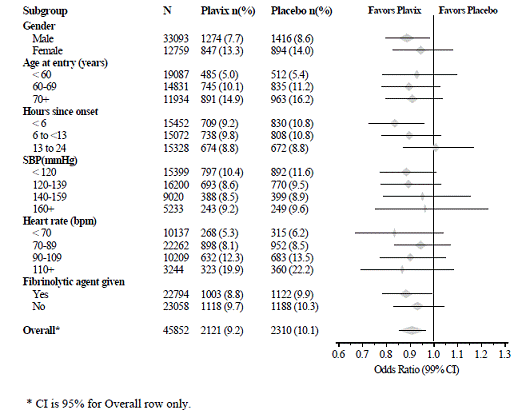
L'effet de Plavix 75 mg n'a pas différé de manière significative dans divers sous-groupes prédéfinis, comme le montre la figure 6. L'effet était également similaire dans les sous-groupes non prédéfinis, y compris ceux basés sur l'emplacement de l'infarctus, la classe de Killip ou les antécédents d'IM. De telles analyses de sous-groupes doivent être interprétées avec prudence.
Figure 6 : Effets de l'ajout de Plavix 75 mg à l'aspirine sur le critère d'évaluation principal combiné dans les sous-groupes de médicaments de base et concomitants pour l'étude COMMIT
Infarctus du myocarde récent, accident vasculaire cérébral récent ou maladie artérielle périphérique établie
CAPRIÉ
L'essai CAPRIE était une étude internationale, randomisée, en double aveugle et en groupes parallèles, portant sur 19 185 patients, 304 centres, comparant Plavix (75 mg par jour) à l'aspirine (325 mg par jour). Pour pouvoir s'inscrire, les patients devaient avoir : 1) des antécédents récents d'infarctus du myocarde (dans les 35 jours) ; 2) antécédents récents d'AVC ischémique (dans les 6 mois) avec au moins une semaine de signes neurologiques résiduels ; et/ou 3) maladie artérielle périphérique (MAP) établie. Les patients ont reçu un traitement randomisé pendant une moyenne de 1,6 ans (maximum de 3 ans).
Le critère de jugement principal de l'essai était le délai avant la première survenue d'un nouvel AVC ischémique (mortel ou non), d'un nouvel infarctus du myocarde (mortel ou non) ou d'un autre décès vasculaire. Les décès difficilement attribuables à des causes non vasculaires ont tous été classés comme vasculaires.
Comme le montre le tableau 6, Plavix a été associé à une incidence plus faible d'événements de résultat, principalement d'infarctus du myocarde. La réduction globale du risque relatif (9,8 % contre 10,6 %) était de 8,7 %, p = 0,045. Des résultats similaires ont été obtenus lorsque la mortalité toutes causes et les AVC toutes causes ont été comptés au lieu de la mortalité vasculaire et des AVC ischémiques (réduction du risque de 6,9 %). Chez les patients qui ont survécu à un accident vasculaire cérébral ou à un infarctus du myocarde pendant l'étude, l'incidence des événements ultérieurs était plus faible dans le groupe Plavix 75 mg.
Les courbes montrant le taux global d'événements sont présentées à la figure 7. Les courbes d'événements se sont séparées tôt et ont continué à diverger au cours de la période de suivi de 3 ans.
Figure 7 : Événements vasculaires mortels ou non mortels dans l'étude CAPRIE
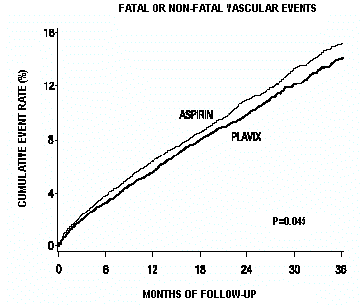
La signification statistique en faveur de Plavix 75 mg par rapport à l'aspirine était marginale (p = 0,045). Cependant, comme l'aspirine est elle-même efficace pour réduire les événements cardiovasculaires chez les patients ayant récemment subi un infarctus du myocarde ou un accident vasculaire cérébral, l'effet de Plavix 75 mg est substantiel.
L'essai CAPRIE a recruté une population ayant récemment subi un IM, un AVC récent ou une MAP. L'efficacité de Plavix 75 mg par rapport à l'aspirine était hétérogène dans ces sous-groupes (p = 0,043) (voir Figure 8). Néanmoins, cette différence peut être une occurrence fortuite car l'essai CAPRIE n'a pas été conçu pour évaluer le bénéfice relatif de Plavix 75 mg par rapport à l'aspirine dans les sous-groupes de patients individuels. Le bénéfice était le plus apparent chez les patients recrutés en raison d'une maladie artérielle périphérique et moins apparent chez les patients victimes d'AVC. Chez les patients inclus dans l'essai sur la seule base d'un infarctus du myocarde récent, Plavix 75 mg n'était pas numériquement supérieur à l'aspirine.
Figure 8 : Risque relatif et IC à 95 % par sous-groupes de référence dans l'étude CAPRIE
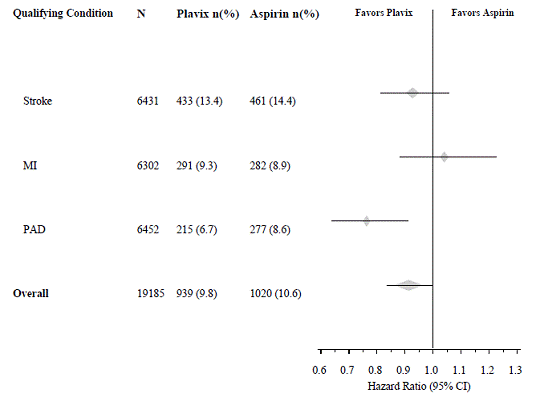
Aucun avantage démontré de Plavix 75 mg plus aspirine chez les patients présentant plusieurs facteurs de risque ou une maladie vasculaire établie
CHARISME
L'essai CHARISMA était une étude de 15 603 sujets, randomisée, en double aveugle et en groupes parallèles comparant Plavix (75 mg par jour) à un placebo pour la prévention des événements ischémiques chez les patients atteints de maladie vasculaire ou de multiples facteurs de risque d'athérosclérose. Tous les sujets ont été traités avec de l'aspirine 75-162 mg par jour. La durée moyenne du traitement était de 23 mois. L'étude n'a pas réussi à démontrer une réduction de l'occurrence du critère d'évaluation principal, un composite de décès d'origine cardiovasculaire, d'IM ou d'AVC. Un total de 534 (6,9 %) patients du groupe Plavix contre 573 (7,4 %) patients du groupe placebo ont présenté un événement de résultat principal (p = 0,22). Les saignements de toutes les sévérités étaient plus fréquents chez les sujets randomisés pour Plavix.
INFORMATIONS PATIENTS
Plavix® (PLAV-iks) (bisulfate de clopidogrel) comprimés
Lisez ce Guide des médicaments avant de commencer à prendre Plavix et chaque fois que vous recevez une recharge. Il peut y avoir de nouvelles informations. Ce Guide de Médication ne prend pas l'endroit de parler avec votre docteur de votre état médical ou de votre traitement.
Quelle est l'information la plus importante que je devrais connaître sur Plavix 75 mg ?
1. Plavix peut ne pas fonctionner aussi bien chez les personnes qui :
- ont certains facteurs génétiques qui affectent la façon dont le corps décompose Plavix. Votre médecin peut effectuer des tests génétiques pour s'assurer que Plavix vous convient.
- prendre certains médicaments, notamment l'oméprazole (Prilosec®) ou l'ésoméprazole (Nexium®). Votre médecin peut modifier le médicament que vous prenez pour les problèmes d'acidité gastrique pendant que vous prenez Plavix.
2. Plavix 75 mg peut provoquer des saignements qui peuvent être graves et parfois mortels. Plavix est un anticoagulant qui réduit le risque de formation de caillots sanguins dans votre corps. Pendant que vous prenez Plavix :
- vous pouvez avoir des ecchymoses et saigner plus facilement
- vous êtes plus susceptible d'avoir des saignements de nez
- il faudra plus de temps pour que tout saignement s'arrête
Appelez immédiatement votre médecin si vous présentez l'un de ces signes ou symptômes de saignement :
- saignement inattendu ou saignement qui dure longtemps
- sang dans vos urines (urine rose, rouge ou brune)
- selles rouges ou noires (ressemblant à du goudron)
- des ecchymoses qui surviennent sans cause connue ou qui grossissent
- cracher du sang ou des caillots sanguins
- vomir du sang ou votre vomi ressemble à du marc de café
N'arrêtez pas de prendre Plavix 75 mg sans en parler au médecin qui vous l'a prescrit. Les personnes qui arrêtent de prendre Plavix 75 mg trop tôt ont un risque plus élevé d'avoir une crise cardiaque ou de mourir. Si vous devez arrêter Plavix en raison d'un saignement, votre risque de crise cardiaque peut être plus élevé.
Qu'est-ce que Plavix 75mg ?
Plavix est un médicament d'ordonnance utilisé pour traiter les personnes qui présentent l'un des éléments suivants :
- douleur thoracique due à des problèmes cardiaques
- mauvaise circulation dans les jambes (maladie artérielle périphérique)
- une crise cardiaque
- un accident vasculaire cérébral
Plavix est utilisé seul ou avec de l'aspirine pour réduire le risque d'avoir un autre problème grave au niveau du cœur ou des vaisseaux sanguins, tel qu'une crise cardiaque, un accident vasculaire cérébral ou un caillot sanguin pouvant entraîner la mort.
Les plaquettes sont des cellules sanguines qui aident votre sang à coaguler normalement. Plavix 75 mg aide à empêcher les plaquettes de se coller les unes aux autres et de former un caillot pouvant obstruer une artère.
On ne sait pas si Plavix 75 mg est sûr et efficace chez les enfants.
Qui ne devrait pas prendre Plavix 75mg ?
Ne prenez pas Plavix si vous :
- souffrez actuellement d'une maladie qui provoque des saignements, comme un ulcère de l'estomac
- êtes allergique au clopidogrel ou à d'autres ingrédients de Plavix. Voir la fin de cette notice pour une liste complète des ingrédients de Plavix.
Que dois-je dire à mon médecin avant de prendre Plavix 75 mg ?
Avant de prendre Plavix, informez votre médecin si vous :
- avez des antécédents d'ulcères intestinaux (gastro-intestinaux) ou d'estomac
- avez des antécédents de problèmes de saignement
- prévoyez subir une intervention chirurgicale ou dentaire. Voir « Comment dois-je prendre Plavix ? »
- êtes enceinte ou envisagez de devenir enceinte. On ne sait pas si Plavix 75 mg nuira à votre bébé à naître
- allaitez ou envisagez d'allaiter. On ne sait pas si Plavix 75 mg passe dans votre lait maternel. Une décision doit être prise avec votre fournisseur de soins de santé pour éviter ou interrompre l'allaitement lorsque la poursuite de Plavix est nécessaire.
- avez eu une allergie ou une réaction à tout médicament utilisé pour traiter votre maladie.
Dites à tous vos médecins et à votre dentiste que vous prenez Plavix. Ils doivent parler au médecin qui vous a prescrit Plavix 75 mg avant de subir une intervention chirurgicale ou une procédure invasive.
Informez votre médecin de tous les médicaments que vous prenez, y compris les médicaments sur ordonnance et en vente libre, les vitamines et les suppléments à base de plantes.
Plavix 75 mg peut affecter le fonctionnement d'autres médicaments, et d'autres médicaments peuvent affecter le fonctionnement de Plavix. Voir "Quelle est l'information la plus importante que je devrais connaître sur Plavix 75mg ?"
Plavix 75 mg peut augmenter les taux sanguins d'autres médicaments tels que le répaglinide (Prandin®).
La prise de Plavix avec certains autres médicaments peut augmenter votre risque de saignement.
Prévenez surtout votre médecin si vous prenez :
- aspirine, surtout si vous avez eu un accident vasculaire cérébral. Demandez toujours à votre médecin si vous devez prendre de l'aspirine avec Plavix 75 mg pour traiter votre état.
- Anti-inflammatoires non stéroïdiens (AINS). Demandez à votre médecin ou à votre pharmacien une liste des médicaments AINS si vous n'êtes pas sûr.
- warfarine (Coumadin®, Jantoven®).
- les inhibiteurs sélectifs de la recapture de la sérotonine (ISRS) et les inhibiteurs de la recapture de la sérotonine et de la noradrénaline (IRSN). Demandez à votre médecin ou à votre pharmacien une liste des médicaments ISRS ou SNRI si vous n'êtes pas sûr.
- rifampicine (utilisée pour traiter les infections graves)
Connaissez les médicaments que vous prenez. Conservez-en une liste pour la montrer à votre médecin ou à votre pharmacien lorsque vous recevez un nouveau médicament.
Comment dois-je prendre Plavix ?
- Prenez Plavix exactement comme votre médecin vous l'a indiqué.
- Ne modifiez pas votre dose et n'arrêtez pas de prendre Plavix 75 mg sans en parler d'abord à votre médecin. L'arrêt de Plavix peut augmenter votre risque de crise cardiaque ou d'accident vasculaire cérébral.
- Prenez Plavix 75 mg avec de l'aspirine selon les instructions de votre médecin.
- Si vous oubliez une dose, prenez Plavix dès que vous vous en souvenez. S'il est presque l'heure de votre prochaine dose, sautez la dose oubliée. Prenez la dose suivante à l'heure habituelle. Ne prenez pas 2 doses de Plavix 75 mg en même temps sauf si votre médecin vous le demande.
- Si vous avez pris trop de Plavix, appelez votre médecin ou rendez-vous immédiatement aux urgences les plus proches.
- Discutez avec votre médecin de l'arrêt de votre Plavix 75 mg avant de subir une intervention chirurgicale. Votre médecin peut vous dire d'arrêter de prendre Plavix 75 mg au moins 5 jours avant votre intervention chirurgicale afin d'éviter des saignements excessifs pendant l'intervention.
Quels sont les effets secondaires possibles de Plavix ?
Plavix 75 mg peut provoquer des effets secondaires graves, notamment :
- Voir « Quelles sont les informations les plus importantes que je devrais connaître sur Plavix ? »
- Un problème de coagulation sanguine appelé purpura thrombotique thrombocytopénique (PTT). Le TTP peut survenir avec Plavix 75 mg, parfois après une courte période (moins de 2 semaines). Le PTT est un problème de coagulation sanguine où des caillots sanguins se forment dans les vaisseaux sanguins ; et peut se produire n'importe où dans le corps. Le PTT doit être traité immédiatement dans un hôpital, car il peut entraîner la mort. Consultez immédiatement un médecin si vous présentez l'un de ces symptômes et qu'il ne peut être expliqué par une autre condition médicale :
- taches violacées (appelées purpura) sur la peau ou dans la bouche (muqueuses) dues à des saignements sous la peau
- votre peau ou le blanc de vos yeux est jaune (jaunisse)
- vous vous sentez fatigué ou faible
- ta peau est très pâle
- fièvre
- fréquence cardiaque rapide ou sensation d'essoufflement
- mal de tête
- changements de discours
- confusion
- coma
- accident vasculaire cérébral
- saisie
- faible quantité d'urine ou urine rose ou contenant du sang
- douleur dans la région de l'estomac (abdominale)
- nausées, vomissements ou diarrhée
- changements de vision
- symptômes persistants d'hypoglycémie
Dites à votre médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas. Informez votre médecin si vous développez une réaction allergique, y compris des réactions cutanées, lors de la prise de Plavix.
Ce ne sont pas tous les effets secondaires possibles de Plavix. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
Comment dois-je conserver Plavix 75 mg ?
- Conservez Plavix 75mg entre 59°F et 86°F (15°C et 30°C).
Gardez Plavix et tous les médicaments hors de la portée des enfants.
Informations générales sur Plavix
Les médicaments sont parfois utilisés à des fins autres que celles énumérées dans un guide des médicaments. Ne prenez pas Plavix 75 mg pour une affection pour laquelle il n'a pas été prescrit. Ne donnez pas Plavix à d'autres personnes, même si elles présentent les mêmes symptômes que vous. Cela peut leur nuire.
Ce guide de médication résume les informations les plus importantes sur Plavix. Si vous souhaitez plus d'informations, parlez-en à votre médecin. Demandez à votre médecin ou à votre pharmacien des informations sur Plavix qui ont été écrites pour les professionnels de la santé.
Pour plus d'informations, rendez-vous sur www.sanofi-aventis.us ou www.bms.com ou appelez le 1-800-321-1335.
Quels sont les ingrédients de Plavix 75mg ?
Ingrédient actif: bisulfate de clopidogrel
Ingrédients inactifs:
Comprimé : huile de ricin hydrogénée, hydroxypropylcellulose, mannitol, cellulose microcristalline, polyéthylène glycol 6000
Pelliculage : oxyde de fer, hypromellose 2910, lactose monohydraté, dioxyde de titane, triacétine, cire de carnauba
Ce Guide de Médication a été approuvé par l'US Food and Drug.
