Cordarone 100mg, 50mg Amiodarone Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Cordarone 100 mg et comment est-il utilisé ?
Cordarone 100 mg IV est un médicament d'ordonnance utilisé pour traiter les symptômes du rythme cardiaque irrégulier (arythmies ventriculaires).
- Cordarone IV peut être utilisé seul ou avec d'autres médicaments.
- Cordarone 50mg IV appartient à une classe de médicaments appelés Antidysrhythmisc, III.
Quels sont les effets secondaires possibles de Cordarone 100mg ?
Cordarone 100 mg peut provoquer des effets secondaires graves, notamment :
- essoufflement,
- évanouissement,
- battements cardiaques rapides ou irréguliers,
- douleur thoracique,
- respiration sifflante, et
- difficulté à respirer
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Cordarone 100 mg IV incluent :
- pression artérielle basse (hypotension),
- rythme cardiaque lent,
- crise cardiaque,
- nausée,
- fièvre,
- insuffisance cardiaque congestive,
- rythme cardiaque anormal,
- choc cardiogénique et
- anomalies des tests de la fonction hépatique
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Cordarone. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
ATTENTION
TOXICITE PULMONAIRE, HEPATIQUE et CARDIAQUE
CORDARONE 100 mg est destiné à être utilisé uniquement chez les patients présentant les arythmies potentiellement mortelles indiquées, car son utilisation s'accompagne d'une toxicité importante [voir INDICATIONS ET UTILISATION].
CORDARONE peut provoquer une toxicité pulmonaire (pneumopathie d'hypersensibilité ou pneumonite interstitielle/alvéolaire) qui a entraîné une maladie cliniquement manifeste à des taux aussi élevés que 17 % chez certaines séries de patients. La toxicité pulmonaire a été mortelle environ 10 % du temps. Obtenir une radiographie pulmonaire de base et des tests de la fonction pulmonaire, y compris la capacité de diffusion, lorsque le traitement par CORDARONE à 100 mg est initié. Répéter l'anamnèse, l'examen physique et la radiographie pulmonaire tous les 3 à 6 mois [voir MISES EN GARDE ET PRÉCAUTIONS].
CORDARONE peut causer une hépatotoxicité, qui peut être mortelle. Obtenir des transaminases hépatiques de base et périodiques et interrompre ou réduire la dose si l'augmentation dépasse trois fois la normale, ou double chez un patient avec une ligne de base élevée. Cesser CORDARONE si le patient présente des signes ou des symptômes de lésions hépatiques cliniques [voir MISES EN GARDE ET PRÉCAUTIONS].
CORDARONE peut exacerber les arythmies. Initier CORDARONE 50 mg dans un contexte clinique où des électrocardiogrammes continus et une réanimation cardiaque sont disponibles [voir MISES EN GARDE ET PRÉCAUTIONS].
LA DESCRIPTION
CORDARONE (chlorhydrate d'amiodarone) est un médicament antiarythmique disponible pour administration orale sous forme de comprimés roses sécables contenant 200 mg de chlorhydrate d'amiodarone. Les ingrédients inactifs présents sont le dioxyde de silicium colloïdal, le lactose, le stéarate de magnésium, la povidone, l'amidon et le FD&C Red 40. CORDARONE est un dérivé du benzofurane : 2-butyl-3-benzofuranyl 4-[2-(diethylamino)-ethoxy]- 3, Chlorhydrate de 5-diiodophénylcétone.
La formule structurale est la suivante :
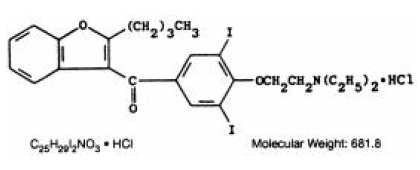
Amiodarone HCl est une poudre cristalline de couleur blanche à crème. Il est légèrement soluble dans l'eau, soluble dans l'alcool et librement soluble dans le chloroforme. Il contient 37,3% d'iode en poids.
LES INDICATIONS
CORDARONE est indiqué pour le traitement de la fibrillation ventriculaire récurrente documentée menaçant le pronostic vital et de la tachycardie récurrente hémodynamiquement instable menaçant le pronostic vital chez les adultes qui n'ont pas répondu à des doses adéquates d'autres antiarythmiques disponibles ou lorsque les autres agents ne peuvent être tolérés.
DOSAGE ET ADMINISTRATION
La posologie doit être individualisée en fonction de la sévérité de l'arythmie et de la réponse. Utilisez la dose efficace la plus faible. Obtenir une radiographie pulmonaire de base, des tests de la fonction pulmonaire, des tests de la fonction thyroïdienne et des aminotransférases hépatiques. Corriger l'hypokaliémie, l'hypomagnésémie et l'hypocalcémie avant d'initier le traitement
Dosage recommandé
Initier le traitement avec des doses de charge de 800 à 1600 mg/jour jusqu'à l'apparition de la réponse thérapeutique initiale (habituellement 1 à 3 semaines). Une fois qu'un contrôle adéquat de l'arythmie est atteint, ou si les effets secondaires deviennent importants, réduire la dose de CORDARONE 50 mg à 600 à 800 mg/jour pendant un mois, puis à la dose d'entretien, habituellement 400 mg/jour.
Administration
Administrer CORDARONE de manière cohérente en ce qui concerne les repas [voir PHARMACOLOGIE CLINIQUE ]. L'administration de CORDARONE en doses fractionnées avec les repas est suggérée pour des doses quotidiennes totales de 1000 mg ou plus, ou en cas d'intolérance gastro-intestinale.
COMMENT FOURNIE
Formes posologiques et points forts
Comprimés à 200 mg : comprimés ronds, convexes, roses avec un « C » en relief et marqué « 200 » sur une face, avec le verso sécable et marqué « WYETH » et « 4188 ».
Stockage et manutention
Comprimés CORDARONE® (chlorhydrate d'amiodarone) sont disponibles en flacons de 60 comprimés comme suit :
200mg , CDN 0008-4188-04, comprimés ronds, à face convexe, roses avec un « C » en relief et marqué « 200 » sur une face, avec le verso sécable et marqué « WYETH » et « 4188 ».
Gardez bien fermé.
Conserver à température ambiante contrôlée, 20° à 25°C (68° à 77°F).
Protéger de la lumière.
Distribuer dans un récipient étanche et résistant à la lumière.
Fabriqué par Sanofi Winthrop Industrie, 1, rue de la Vierge, 33440 Ambares, France. Distribué par : Wyeth Pharmaceuticals Inc., une filiale de Pfizer Inc., Philadelphie, PA 19101. Révisé : octobre 2018
EFFETS SECONDAIRES
Les effets indésirables graves suivants sont décrits plus en détail dans d'autres rubriques des informations de prescription :
- Toxicité pulmonaire [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Lésions hépatiques [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Arythmie aggravée [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Déficience visuelle et perte de vision [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Anomalies thyroïdiennes [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Bradycardie [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Neuropathie périphérique [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Photosensibilité et décoloration de la peau [voir AVERTISSEMENTS ET PRECAUTIONS ]
Expérience des essais cliniques
Étant donné que les essais cliniques sont menés dans des conditions très variables, les taux d'effets indésirables observés dans les essais cliniques d'un médicament ne peuvent pas être directement comparés aux taux des essais cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique.
À la dose d'entretien habituelle (400 mg/jour) et au-dessus, CORDARONE 100 mg provoque des effets indésirables chez environ les trois quarts de tous les patients, entraînant l'arrêt chez 7 à 18 %.
Dans des enquêtes portant sur près de 5 000 patients traités dans des études ouvertes aux États-Unis et dans des rapports publiés sur le traitement par CORDARONE, les effets indésirables nécessitant le plus fréquemment l'arrêt de CORDARONE comprenaient des infiltrats pulmonaires ou une fibrose, une tachycardie ventriculaire paroxystique, une insuffisance cardiaque congestive et une élévation des enzymes hépatiques. D'autres symptômes provoquant moins souvent des interruptions comprenaient des troubles visuels, une photosensibilité, une décoloration bleue de la peau, une hyperthyroïdie et une hypothyroïdie.
Les taux d'effets secondaires suivants sont basés sur une étude rétrospective de 241 patients traités pendant 2 à 1 515 jours (moyenne 441,3 jours) :
Thyroïde
Fréquent : hypothyroïdie, hyperthyroïdie.
Cardiovasculaire
Fréquent : insuffisance cardiaque congestive, arythmies cardiaques, dysfonctionnement du nœud SA.
Gastro-intestinal
Très fréquent : Nausées, vomissements.
Fréquents : constipation, anorexie, douleurs abdominales.
Dermatologique
Fréquent : dermatite solaire/photosensibilité.
Neurologique
Fréquent : malaise et fatigue, tremblements/mouvements involontaires anormaux, manque de coordination, démarche anormale/ataxie, étourdissements, paresthésies, diminution de la libido, insomnie, céphalées, troubles du sommeil.
Ophtalmique
Fréquent : Troubles visuels.
Hépatique
Fréquent : tests de la fonction hépatique anormaux, troubles hépatiques non spécifiques.
Respiratoire
Fréquent : Inflammation pulmonaire ou fibrose.
Autre
Fréquent : bouffées vasomotrices, goût et odeur anormaux, œdème, salivation anormale, anomalies de la coagulation.
Peu fréquent : coloration bleue de la peau, éruption cutanée, ecchymoses spontanées, alopécie, hypotension et anomalies de la conduction cardiaque.
Expérience post-commercialisation
Les réactions défavorables suivantes ont été identifiées pendant l'utilisation de post-approbation de CORDARONE. Étant donné que ces réactions sont signalées volontairement par une population de taille incertaine, il n'est pas toujours possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale avec l'exposition au médicament.
Hématologique anémie hémolytique, anémie aplasique, pancytopénie, neutropénie, thrombocytopénie, agranulocytose, granulome.
Immunitaire : réaction anaphylactique/anaphylactoïde (y compris choc), œdème de Quincke.
Neurologique : pseudotumeur cérébrale, symptômes parkinsoniens tels qu'akinésie et bradykinésie (parfois réversibles à l'arrêt du traitement), polyneuropathie démyélinisante.
Psychiatrique : hallucination, état confusionnel, désorientation, délire.
Cardiaque : hypotension (parfois mortelle), arrêt sinusal.
Respiratoire : pneumonie à éosinophiles, syndrome de détresse respiratoire aiguë en post-opératoire, bronchospasme, bronchiolite oblitérante organisant une pneumonie, hémorragie alvéolaire pulmonaire, épanchement pleural, pleurésie.
Gastro-intestinal : pancréatite, pancréatite aiguë.
Hépatique : hépatite, hépatite cholestatique, cirrhose.
Troubles de la peau et du tissu sous-cutané urticaire, nécrolyse épidermique toxique (parfois mortelle), érythème polymorphe, syndrome de Stevens-Johnson, dermatite exfoliative, dermatite bulleuse, éruption médicamenteuse avec éosinophilie et symptômes systémiques (DRESS), eczéma, prurit, cancer de la peau, syndrome lupique.
Musculo-squelettique : myopathie, faiblesse musculaire, rhabdomyolyse.
Rénal : insuffisance rénale, insuffisance rénale, insuffisance rénale aiguë.
Reproducteur : épididymite, impuissance.
Corps dans son ensemble : fièvre, bouche sèche.
Endocrine et métabolique : nodules thyroïdiens/ cancer de la thyroïde, syndrome de sécrétion inappropriée d'hormone antidiurétique (SIADH).
Vasculaire : vascularite.
INTERACTIONS MÉDICAMENTEUSES
En raison de la longue demi-vie de l'amiodarone, attendez-vous à ce que les interactions médicamenteuses persistent pendant des semaines ou des mois après l'arrêt de l'amiodarone.
Les interactions médicamenteuses avec l'amiodarone sont décrites dans le tableau 1 ci-dessous.
AVERTISSEMENTS
Inclus dans le cadre du PRÉCAUTIONS section.
PRÉCAUTIONS
Persistance des effets indésirables
En raison de la longue demi-vie de l'amiodarone (15 à 142 jours) et de son métabolite actif, la déséthylamiodarone (14 à 75 jours), les effets indésirables et les interactions médicamenteuses peuvent persister plusieurs semaines après l'arrêt de l'amiodarone [voir PHARMACOLOGIE CLINIQUE ].
Toxicité pulmonaire
CORDARONE peut provoquer un syndrome clinique de toux et de dyspnée progressive accompagné de données fonctionnelles, radiographiques, de scintigraphie au gallium et pathologiques compatibles avec une toxicité pulmonaire. La toxicité pulmonaire secondaire à CORDARONE peut résulter d'une toxicité indirecte ou directe représentée par une pneumonie d'hypersensibilité (y compris une pneumonie à éosinophiles) ou une pneumonie interstitielle/alvéolaire, respectivement. Les taux de toxicité pulmonaire ont été rapportés comme étant aussi élevés que 17% et mortels dans environ 10% des cas. Obtenir une radiographie pulmonaire de base et des tests de la fonction pulmonaire, y compris la capacité de diffusion, lorsque le traitement par CORDARONE à 50 mg est instauré. Répétez l'anamnèse, l'examen physique et la radiographie pulmonaire tous les 3 à 6 mois ou si des symptômes apparaissent. Envisager un traitement antiarythmique alternatif si le patient présente des signes ou des symptômes de toxicité pulmonaire. La prednisone 40 à 60 mg/jour dégressif sur plusieurs semaines peut être utile dans le traitement de la toxicité pulmonaire.
Syndrome de détresse respiratoire de l'adulte (SDRA)
Après l'opération, des cas de SDRA ont été signalés chez des patients recevant un traitement par CORDARONE et ayant subi une chirurgie cardiaque ou non cardiaque. Bien que les patients répondent généralement bien à une thérapie respiratoire vigoureuse, dans de rares cas, l'issue a été fatale.
Lésion hépatique
Des élévations asymptomatiques des taux d'enzymes hépatiques sont fréquemment observées, mais CORDARONE 100 mg peut provoquer des lésions hépatiques potentiellement mortelles. L'histologie ressemble à celle de l'hépatite alcoolique ou de la cirrhose. Obtenir les transaminases hépatiques de base et périodiques. Si les transaminases dépassent trois fois la normale, ou doublent chez un patient avec une ligne de base élevée, arrêtez ou réduisez la dose de CORDARONE 100 mg, obtenez des tests de suivi et traitez de manière appropriée.
Arythmie aggravée
CORDARONE 100mg peut exacerber l'arythmie présente chez environ 2 à 5% des patients ou provoquer une nouvelle fibrillation ventriculaire, une tachycardie ventriculaire incessante, une résistance accrue à la cardioversion et une tachycardie ventriculaire polymorphe associée à un allongement de l'intervalle QTc (Torsade de Pointes [TdP]).
Corrigez l'hypokaliémie, l'hypomagnésémie et l'hypocalcémie avant de commencer le traitement par CORDARONE, car ces troubles peuvent exagérer le degré d'allongement de l'intervalle QTc et augmenter le potentiel de TdP. Portez une attention particulière à l'équilibre électrolytique et acido-basique chez les patients souffrant de diarrhée sévère ou prolongée ou recevant des médicaments affectant les niveaux d'électrolytes, tels que des diurétiques, des laxatifs, des corticostéroïdes systémiques ou de l'amphotéricine B.
Déficience visuelle et perte de vision
Neuropathie optique et névrite optique
Des cas de neuropathie optique et de névrite optique, entraînant généralement une déficience visuelle et parfois une cécité permanente, ont été rapportés chez des patients traités par l'amiodarone et peuvent survenir à tout moment au cours du traitement. Si des symptômes de déficience visuelle apparaissent, tels que des modifications de l'acuité visuelle et une diminution de la vision périphérique, envisagez d'arrêter CORDARONE 100 mg et référez-vous rapidement pour un examen ophtalmologique. Un examen ophtalmologique régulier, y compris une scopie du fond d'œil et un examen à la lampe à fente, est recommandé pendant l'administration de CORDARONE [voir EFFETS INDÉSIRABLES ].
Microdépôts cornéens
Des microdépôts cornéens apparaissent chez la majorité des adultes traités par CORDARONE. Ils ne sont généralement perceptibles que par un examen à la lampe à fente, mais provoquent des symptômes tels que des halos visuels ou une vision floue chez jusqu'à 10% des patients. Les microdépôts cornéens sont réversibles à la réduction de la dose ou à l'arrêt du traitement. Les microdépôts asymptomatiques seuls ne sont pas une raison de réduire la dose ou d'arrêter le traitement [voir EFFETS INDÉSIRABLES ].
Anomalies thyroïdiennes
CORDARONE 50 mg inhibe la conversion périphérique de la thyroxine (T4) en triiodothyronine (T3) et peut entraîner une augmentation des taux de thyroxine, une diminution des taux de T3 et une augmentation des taux de T3 inverse inactive (rT3) chez les patients cliniquement euthyroïdiens. CORDARONE 50 mg peut provoquer soit une hypothyroïdie (rapportée chez jusqu'à 10 % des patients), soit une hyperthyroïdie (survenant chez environ 2 % des patients). Surveiller la fonction thyroïdienne avant le traitement et périodiquement par la suite, en particulier chez les patients âgés et chez tout patient ayant des antécédents de nodules thyroïdiens, de goitre ou d'autres dysfonctionnements thyroïdiens.
L'hyperthyroïdie peut induire une percée d'arythmie. Si de nouveaux signes d'arythmie apparaissent, la possibilité d'une hyperthyroïdie doit être envisagée. Des médicaments antithyroïdiens, des β-bloquants adrénergiques, une corticothérapie temporaire peuvent être nécessaires pour traiter les symptômes de l'hyperthyroïdie. L'action des médicaments antithyroïdiens peut être retardée dans la thyrotoxicose induite par l'amiodarone en raison de quantités importantes d'hormones thyroïdiennes préformées stockées dans la glande. Le traitement par l'iode radioactif est contre-indiqué en raison de la faible absorption d'iode radioactif associée à l'hyperthyroïdie induite par l'amiodarone. L'hyperthyroïdie induite par CORDARONE peut être suivie d'une période transitoire d'hypothyroïdie.
L'hypothyroïdie peut être primaire ou consécutive à la résolution d'une hyperthyroïdie induite par l'amiodarone. Une hypothyroïdie sévère et un coma myxoedémateux, parfois mortels, ont été rapportés en association avec le traitement par l'amiodarone. Chez certains patients cliniquement hypothyroïdiens traités par l'amiodarone, les valeurs de l'indice de thyroxine libre peuvent être normales. Gérer l'hypothyroïdie en réduisant la dose ou en arrêtant la supplémentation en CORDARONE et en hormone thyroïdienne.
Bradycardie
CORDARONE provoque une bradycardie symptomatique ou un arrêt sinusal avec suppression des foyers d'échappement chez 2 à 4 % des patients. Le risque est majoré par les troubles électrolytiques ou l'utilisation concomitante d'antiarythmiques ou de chronotropes négatifs [voir INTERACTIONS MÉDICAMENTEUSES ]. La bradycardie peut nécessiter un stimulateur cardiaque pour contrôler la fréquence.
Des cas post-commercialisation de bradycardie symptomatique, certains nécessitant l'insertion d'un stimulateur cardiaque et au moins un mortel, ont été rapportés lorsque le lédipasvir/sofosbuvir ou le sofosbuvir avec le siméprévir ont été initiés chez des patients sous amiodarone. La bradycardie s'est généralement manifestée en quelques heures à quelques jours, mais dans certains cas, elle s'est présentée jusqu'à 2 semaines après le début du traitement antiviral. La bradycardie a généralement disparu après l'arrêt du traitement antiviral. Le mécanisme de cet effet est inconnu. Surveiller la fréquence cardiaque chez les patients prenant ou ayant récemment arrêté l'amiodarone au début du traitement antiviral [voir INTERACTIONS MÉDICAMENTEUSES ].
Dispositifs cardiaques implantables
Chez les patients porteurs de défibrillateurs ou de stimulateurs cardiaques implantés, l'administration chronique de médicaments anti-arythmiques peut affecter les seuils de stimulation ou de défibrillation. Par conséquent, au début et pendant le traitement par l'amiodarone, les seuils de stimulation et de défibrillation doivent être évalués.
Toxicité fœtale
CORDARONE peut nuire au fœtus lorsqu'il est administré à une femme enceinte. L'exposition fœtale peut augmenter le potentiel d'effets cardiaques, thyroïdiens, neurodéveloppementaux, neurologiques et de croissance chez le nouveau-né [voir Utilisation dans des populations spécifiques ].
Neuropathie périphérique
L'administration chronique de CORDARONE peut mener à la neuropathie périphérique, qui peut ne pas résoudre quand CORDARONE est arrêté.
Photosensibilité et décoloration de la peau
CORDARONE induit une photosensibilisation chez environ 10 % des patients ; une certaine protection peut être assurée par des crèmes solaires ou des vêtements de protection. Pendant un traitement à long terme, une décoloration bleu-gris de la peau exposée peut se produire. Le risque peut être accru chez les patients de teint clair ou ceux qui s'exposent excessivement au soleil. Une certaine inversion de la décoloration peut se produire à l'arrêt du médicament.
Opération
Agents anesthésiques volatils
Les patients sous CORDARONE 100 mg peuvent être plus sensibles aux effets dépresseurs du myocarde et de conduction des anesthésiques halogénés par inhalation.
Informations sur les conseils aux patients
Conseillez au patient de lire l'étiquetage patient approuvé par la FDA ( Guide des médicaments ).
Informez les femmes enceintes du risque potentiel pour le fœtus. Conseillez aux femmes en âge de procréer d'informer leur médecin prescripteur d'une grossesse connue ou suspectée [voir Utilisation dans des populations spécifiques ].
Aviser les femmes que l'allaitement n'est pas recommandé pendant le traitement par CORDARONE [voir Utilisation dans des populations spécifiques ].
Conseillez aux patients d'éviter le jus de pamplemousse et le millepertuis.
Conseillez aux patients de consulter un médecin s'ils présentent des signes et des symptômes de toxicité pulmonaire, d'aggravation d'arythmie, de bradycardie, de déficience visuelle ou d'hypo- et d'hyperthyroïdie.
L'étiquette de ce produit a peut-être été mise à jour. Pour des informations complètes sur la prescription, veuillez visiter www.pfizer.com.
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Le chlorhydrate d'amiodarone a été associé à une augmentation statistiquement significative et liée à la dose de l'incidence des tumeurs thyroïdiennes (adénome folliculaire et/ou carcinome) chez le rat. L'incidence des tumeurs thyroïdiennes était supérieure à celle du groupe témoin à la plus faible dose testée, c'est-à-dire 5 mg/kg/jour (environ 0,08 fois la dose d'entretien maximale recommandée chez l'homme*).
Les études de mutagénicité (tests d'Ames, du micronoyau et lysogène) avec CORDARONE ont été négatives.
Dans une étude dans laquelle le chlorhydrate d'amiodarone a été administré à des rats mâles et femelles, commençant 9 semaines avant l'accouplement, une diminution de la fertilité a été observée à une dose de 90 mg/kg/jour (environ 1,4 fois la dose d'entretien humaine maximale recommandée*).
*600 mg chez un patient de 60 kg (dose comparée en fonction de la surface corporelle)
Utilisation dans des populations spécifiques
Grossesse
Résumé des risques
Les données disponibles issues des rapports post-commercialisation et des séries de cas publiées indiquent que l'utilisation d'amiodarone chez la femme enceinte peut augmenter le risque d'effets indésirables sur le fœtus, notamment l'hypothyroïdie et l'hyperthyroïdie néonatale, la bradycardie néonatale, les anomalies neurodéveloppementales, l'accouchement prématuré et le retard de croissance fœtale. L'amiodarone et son métabolite, la déséthylamiodarone (DEA), traversent le placenta. Les arythmies sous-jacentes non traitées, y compris les arythmies ventriculaires, pendant la grossesse présentent un risque pour la mère et le fœtus (voir Considérations cliniques ). Dans les études animales, l'administration d'amiodarone à des lapins, des rats et des souris au cours de l'organogenèse a entraîné une toxicité embryofœtale à des doses inférieures à la dose d'entretien maximale recommandée chez l'homme (voir Données ). Informez les femmes enceintes du risque potentiel pour le fœtus.
Le risque de fond estimé de malformations congénitales majeures et de fausse couche pour la population indiquée est inconnu. Toutes les grossesses ont un risque de fond de malformation congénitale, de perte ou d'autres résultats indésirables. Dans la population générale des États-Unis, le risque de fond estimé de malformations congénitales majeures et de fausse couche dans les grossesses cliniquement reconnues est de 2 % à 4 % et de 15 % à 20 %, respectivement.
Considérations cliniques
Risque maternel et/ou embryonnaire/fœtal associé à la maladie
L'incidence de la tachycardie ventriculaire est augmentée et peut être plus symptomatique pendant la grossesse. Les arythmies ventriculaires surviennent le plus souvent chez les femmes enceintes atteintes d'une cardiomyopathie sous-jacente, d'une cardiopathie congénitale, d'une cardiopathie valvulaire ou d'un prolapsus de la valve mitrale. La plupart des épisodes de tachycardie sont déclenchés par des battements ectopiques et la survenue d'épisodes d'arythmie peut donc augmenter pendant la grossesse en raison de la propension accrue à l'activité ectopique. Des arythmies interminables peuvent également survenir pendant la grossesse, car les niveaux de traitement thérapeutique peuvent être difficiles à maintenir en raison de l'augmentation du volume de distribution et de l'augmentation du métabolisme des médicaments inhérentes à la grossesse.
Effets indésirables fœtaux/néonatals
Il a été démontré que l'amiodarone et son métabolite traversent le placenta. Les effets indésirables sur le fœtus associés à l'utilisation de l'amiodarone par la mère pendant la grossesse peuvent inclure la bradycardie néonatale, l'allongement de l'intervalle QT et les extrasystoles ventriculaires périodiques, l'hypothyroïdie néonatale (avec ou sans goitre) détectée avant la naissance ou chez le nouveau-né et signalée même après quelques jours d'exposition, l'hyperthyroxinémie néonatale, anomalies neurodéveloppementales indépendantes de la fonction thyroïdienne, y compris retard de la parole et difficultés avec le langage écrit et l'arithmétique, retard du développement moteur et ataxie, nystagmus saccadé avec titubation synchrone de la tête, retard de croissance fœtale et naissance prématurée. Surveiller le nouveau-né pour déceler les signes et symptômes de troubles thyroïdiens et d'arythmies cardiaques.
Travail et accouchement
Le risque d'arythmie peut augmenter pendant le travail et l'accouchement. Les patientes traitées par CORDARONE doivent être surveillées en permanence pendant le travail et l'accouchement [voir AVERTISSEMENTS ET PRECAUTIONS ].
Données
Données animales
Chez des rats et des lapins gravides pendant la période d'organogenèse, le chlorhydrate d'amiodarone à des doses de 25 mg/kg/jour (environ 0,4 et 0,9 fois, respectivement, la dose d'entretien humaine maximale recommandée*) n'a eu aucun effet indésirable sur le fœtus. Chez le lapin, 75 mg/kg/jour (environ 2,7 fois la dose d'entretien maximale recommandée chez l'homme*) ont provoqué des avortements chez plus de 90 % des animaux. Chez le rat, des doses de 50 mg/kg/jour ou plus ont été associées à un léger déplacement des testicules et à une incidence accrue d'ossification incomplète de certains os du crâne et des doigts; à 100 mg/kg/jour ou plus, le poids corporel des fœtus était réduit; à 200 mg/kg/jour, il y avait une incidence accrue de résorption fœtale. (Ces doses chez le rat sont d'environ 0,8, 1,6 et 3,2 fois la dose d'entretien maximale recommandée chez l'homme*) environ 0,04 fois la dose d'entretien humaine maximale recommandée*).
*600 mg chez un patient de 60 kg (doses comparées selon la surface corporelle)
Lactation
Résumé des risques
L'amiodarone et l'un de ses principaux métabolites, la DEA, sont présents dans le lait maternel à raison de 3,5 % à 45 % de la dose d'amiodarone ajustée en fonction du poids maternel. Il existe des cas d'hypothyroïdie et de bradycardie chez les nourrissons allaités, bien qu'il ne soit pas clair si ces effets sont dus à l'exposition à l'amiodarone dans le lait maternel. L'allaitement n'est pas recommandé pendant le traitement par CORDARONE [voir AVERTISSEMENTS ET PRECAUTIONS ].
Femelles et mâles de potentiel reproducteur
Infertilité
D'après des études sur la fertilité animale, CORDARONE peut réduire la fertilité féminine et masculine. On ne sait pas si cet effet est réversible. [voir Toxicologie non clinique ].
Utilisation pédiatrique
L'innocuité et l'efficacité de CORDARONE chez les patients pédiatriques n'ont pas été établies.
Utilisation gériatrique
Les sujets normaux de plus de 65 ans présentent une clairance plus faible et une demi-vie du médicament plus longue que les sujets plus jeunes [voir PHARMACOLOGIE CLINIQUE ]. En général, la sélection de la dose pour un patient âgé doit être prudente, en commençant généralement à l'extrémité inférieure de la plage posologique, reflétant la plus grande fréquence de diminution de la fonction hépatique, rénale ou cardiaque et de maladie concomitante ou d'un autre traitement médicamenteux.
SURDOSAGE
Il y a eu des cas, certains mortels, de surdosage de CORDARONE 50 mg.
Surveillez le rythme cardiaque et la pression artérielle du patient et, si une bradycardie s'ensuit, un agoniste β-adrénergique ou un stimulateur cardiaque peut être utilisé. Traiter l'hypotension avec une perfusion tissulaire inadéquate avec des agents inotropes et vasopresseurs positifs. Ni CORDARONE 50 mg ni son métabolite ne sont dialysables.
CONTRE-INDICATIONS
- Choc cardiogénique.
- Maladie du sinus, bloc auriculo-ventriculaire du deuxième ou du troisième degré, bradycardie entraînant une syncope sans stimulateur cardiaque fonctionnel.
- Hypersensibilité connue au médicament ou à l'un de ses composants, y compris l'iode.
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
L'amiodarone est considérée comme un antiarythmique de classe III, mais elle possède les caractéristiques électrophysiologiques des quatre classes de Vaughan Williams. Comme les médicaments de classe I, l'amiodarone bloque les canaux sodiques à des fréquences de stimulation rapides et, comme les médicaments de classe II, l'amiodarone exerce une action antisympathique non compétitive. L'un de ses principaux effets, en cas d'administration prolongée, est d'allonger le potentiel d'action cardiaque, effet de classe III. L'effet chronotrope négatif de l'amiodarone dans les tissus ganglionnaires est similaire à l'effet des médicaments de classe IV. En plus de bloquer les canaux sodiques, l'amiodarone bloque les canaux potassiques myocardiques, ce qui contribue au ralentissement de la conduction et à la prolongation de la réfractaire. L'action antisympathique et le blocage des canaux calciques et potassiques sont responsables des effets dromotropes négatifs sur le nœud sinusal et du ralentissement de la conduction et de la prolongation de la réfractaire dans le nœud auriculo-ventriculaire (AV). Son action vasodilatatrice peut diminuer la charge cardiaque et par conséquent la consommation d'oxygène du myocarde.
CORDARONE prolonge la durée du potentiel d'action de toutes les fibres cardiaques tout en provoquant une réduction minimale de dV/dt (vitesse maximale de montée du potentiel d'action). La période réfractaire est prolongée dans tous les tissus cardiaques. CORDARONE augmente la période réfractaire cardiaque sans influencer le potentiel membranaire de repos, sauf dans les cellules automatiques où la pente du prépotentiel est réduite, réduisant généralement l'automaticité. Ces effets électrophysiologiques se traduisent par une diminution de la fréquence sinusale de 15 à 20 %, une augmentation des intervalles PR et QT d'environ 10 %, le développement d'ondes U et des modifications du contour des ondes T. Ces changements ne devraient pas nécessiter l'arrêt de CORDARONE 50 mg car ils sont la preuve de son action pharmacologique, bien que CORDARONE puisse provoquer une bradycardie sinusale marquée ou un arrêt sinusal et un bloc cardiaque [voir AVERTISSEMENTS ET PRECAUTIONS ].
Hémodynamique
Dans les études animales et après administration intraveineuse chez l'homme, CORDARONE 100 mg détend les muscles lisses vasculaires, réduit la résistance vasculaire périphérique (postcharge) et augmente légèrement l'index cardiaque. Après administration orale, cependant, CORDARONE 100 mg ne produit aucun changement significatif de la fraction d'éjection ventriculaire gauche (FEVG), même chez les patients présentant une dépression de la FEVG. Après administration intraveineuse aiguë chez l'homme, CORDARONE 100 mg peut avoir un léger effet inotrope négatif.
Pharmacodynamie
Il n'y a pas de relation bien établie entre la concentration plasmatique et l'efficacité, mais il semble que des concentrations bien inférieures à 1 mg/L soient souvent inefficaces et que des niveaux supérieurs à 2,5 mg/L ne soient généralement pas nécessaires. Les mesures de la concentration plasmatique peuvent être utilisées pour identifier les patients dont les taux sont anormalement bas et qui pourraient bénéficier d'une augmentation de la dose, ou anormalement élevés, et qui pourraient subir une réduction de la posologie dans l'espoir de minimiser les effets secondaires.
Les effets sur les rythmes anormaux ne sont pas observés avant 2 à 3 jours et nécessitent généralement 1 à 3 semaines, même lorsqu'une dose de charge est utilisée. Il peut y avoir une augmentation continue de l'effet pendant des périodes encore plus longues. Il est prouvé que le délai d'effet est plus court lorsqu'un régime de dose de charge est utilisé.
Conformément à la lenteur de l'élimination, les effets antiarythmiques persistent pendant des semaines ou des mois après l'arrêt de CORDARONE à 50 mg, mais le moment de la récidive est variable et imprévisible. En général, lorsque le médicament est repris après la récurrence de l'arythmie, le contrôle est établi relativement rapidement par rapport à la réponse initiale, vraisemblablement parce que les réserves tissulaires n'étaient pas totalement épuisées.
Pharmacocinétique
Absorption
Après administration orale chez l'homme, CORDARONE est absorbé lentement et de manière variable. La biodisponibilité de CORDARONE est d'environ 50 %. Les concentrations plasmatiques maximales sont atteintes 3 à 7 heures après une dose unique. Les concentrations plasmatiques avec une administration chronique de 100 à 600 mg/jour sont approximativement proportionnelles à la dose, avec une augmentation moyenne de 0,5 mg/L pour chaque tranche de 100 mg/jour. Ces moyennes comportent toutefois une variabilité individuelle considérable.
La nourriture augmente le taux et l'étendue de l'absorption de CORDARONE. Les effets de la nourriture sur la biodisponibilité de CORDARONE ont été étudiés chez 30 sujets en bonne santé qui ont reçu une dose unique de 600 mg immédiatement après avoir consommé un repas riche en graisses et après une nuit de jeûne. L'aire sous la courbe de la concentration plasmatique en fonction du temps (ASC) et la concentration plasmatique maximale (Cmax) de l'amiodarone ont augmenté de 2,3 (intervalle de 1,7 à 3,6) et de 3,8 (intervalle de 2,7 à 4,4) fois, respectivement, en présence de nourriture. La nourriture a également augmenté le taux d'absorption de l'amiodarone, diminuant le temps jusqu'au pic de concentration plasmatique (Tmax) de 37 %. L'ASC moyenne et la Cmax moyenne du principal métabolite de l'amiodarone, la DEA, ont augmenté de 55 % (intervalle de 58 à 101 %) et de 32 % (intervalle de 4 à 84 %), respectivement, mais il n'y a pas eu de modification du Tmax en présence de aliments.
Distribution
CORDARONE est fortement lié aux protéines (environ 96%). CORDARONE a un volume de distribution très important mais variable, en moyenne d'environ 60 L/kg, en raison d'une accumulation importante dans divers sites, en particulier le tissu adipeux et les organes hautement perfusés, tels que le foie, les poumons et la rate.
Un métabolite majeur de CORDARONE 50mg, DEA, a été identifié chez l'homme ; il s'accumule encore plus dans presque tous les tissus. Aucune donnée n'est disponible sur l'activité de la DEA chez l'homme, mais chez l'animal, elle a des effets électrophysiologiques et antiarythmiques significatifs généralement similaires à l'amiodarone elle-même. Le rôle précis de la DEA et sa contribution à l'activité antiarythmique de l'amiodarone orale ne sont pas certains. Le développement d'effets ventriculaires maximaux de classe III après l'administration orale de CORDARONE 100 mg chez l'homme est plus étroitement corrélé avec l'accumulation de DEA au fil du temps qu'avec l'accumulation d'amiodarone.
Élimination
Suite à l'administration d'une dose unique chez 12 sujets sains, CORDARONE a présenté une pharmacocinétique multicompartimentale avec une demi-vie d'élimination terminale plasmatique apparente moyenne de 58 jours (intervalle de 15 à 142 jours) pour l'amiodarone et de 36 jours (intervalle de 14 à 75 jours) pour le principe actif. métabolite (DEA). Chez les patients, après l'arrêt du traitement oral chronique, il a été démontré que CORDARONE 100 mg a une élimination biphasique avec une réduction initiale de 50 % des taux plasmatiques après 2,5 à 10 jours. Une phase d'élimination plasmatique terminale beaucoup plus lente montre une demi-vie du composé parent allant de 26 à 107 jours, avec une moyenne d'environ 53 jours et la plupart des patients dans la plage de 40 à 55 jours. En l'absence de période de charge, les concentrations plasmatiques à l'état d'équilibre, à dose orale constante, seraient donc atteintes entre 130 et 535 jours, avec une moyenne de 265 jours. Pour le métabolite, la demi-vie moyenne d'élimination plasmatique était d'environ 61 jours. Ces données reflètent probablement une élimination initiale du médicament des tissus bien perfusés (la phase de demi-vie de 2,5 à 10 jours), suivie d'une phase terminale représentant une élimination extrêmement lente des compartiments tissulaires mal perfusés tels que la graisse.
La variation considérable entre les sujets dans les deux phases d'élimination, ainsi que l'incertitude quant au compartiment qui est essentiel à l'effet du médicament, nécessitent une attention aux réponses individuelles une fois que le contrôle de l'arythmie est atteint avec des doses de charge, car la dose d'entretien correcte est déterminée, en partie, par les taux d'élimination. Individualiser les doses d'entretien de CORDARONE [voir DOSAGE ET ADMINISTRATION ].
Métabolisme
L'amiodarone est métabolisée en DEA par le groupe enzymatique du cytochrome P450 (CYP), en particulier le CYP3A et le CYP2C8. L'isoenzyme CYP3A est présente à la fois dans le foie et les intestins. In vitro, l'amiodarone et la DEA présentent un potentiel d'inhibition des CYP2C9, CYP2C19, CYP2D6, CYP3A, CYP2A6, CYP2B6 et CYP2C8. L'amiodarone et la DEA ont également le potentiel d'inhiber certains transporteurs tels que la glycoprotéine P et le transporteur de cations organiques (OCT2).
Excrétion
L'amiodarone est éliminée principalement par métabolisme hépatique et excrétion biliaire et l'excrétion d'amiodarone ou de DEA dans l'urine est négligeable. Ni l'amiodarone ni la DEA ne sont dialysables.
Populations spécifiques
Effet de l'âge
Les sujets normaux de plus de 65 ans présentent des clairances plus faibles (environ 100 ml/h/kg) que les sujets plus jeunes (environ 150 ml/h/kg) et une augmentation de la t½ d'environ 20 à 47 jours.
Insuffisance rénale
L'insuffisance rénale n'influence pas la pharmacocinétique de l'amiodarone ou de la DEA.
Insuffisance hépatique
Après une dose unique d'amiodarone intraveineuse chez des patients cirrhotiques, des valeurs de Cmax et de concentration moyenne significativement plus faibles sont observées pour la DEA, mais les taux moyens d'amiodarone sont inchangés.
Maladie cardiaque
Chez les patients présentant une dysfonction ventriculaire gauche sévère, la pharmacocinétique de l'amiodarone n'est pas significativement altérée mais la t½ terminale d'élimination de la DEA est prolongée.
Bien qu'aucun ajustement posologique chez les patients présentant des anomalies rénales, hépatiques ou cardiaques n'ait été défini au cours d'un traitement chronique par l'amiodarone orale, une surveillance clinique étroite est prudente chez les patients âgés et ceux présentant une dysfonction ventriculaire gauche sévère.
Interactions médicamenteuses
Effets d'autres agents sur l'amiodarone
Jus de pamplemousse : le jus de pamplemousse administré à des volontaires sains a augmenté l'ASC de l'amiodarone de 50 % et la Cmax de 84 %, et a réduit la DEA à des concentrations non quantifiables.
La cimétidine inhibe le CYP3A et peut augmenter les taux sériques d'amiodarone.
La cholestyramine réduit la circulation entérohépatique de l'amiodarone, augmentant ainsi son élimination. Cela entraîne une réduction des taux sériques et de la demi-vie de l'amiodarone.
Effets de l'amiodarone sur les agents
Substrats CYP3A
L'amiodarone prise en concomitance avec la quinidine augmente la concentration sérique de quinidine de 33 % après deux jours. L'amiodarone prise en concomitance avec le procaïnamide pendant moins de sept jours augmente les concentrations plasmatiques de procaïnamide et de n-acétyl procaïnamide de 55 % et 33 %, respectivement.
La loratadine, un antihistaminique non sédatif, est principalement métabolisée par le CYP3A et son métabolisme peut être inhibé par l'amiodarone.
Le métabolisme de la lidocaïne peut être inhibé par l'amiodarone.
Le cyclophosphamide est une prodrogue métabolisée par le CYP450, y compris le CYP3A, en un métabolite actif. Le métabolisme du cyclophosphamide peut être inhibé par l'amiodarone.
Le clopidogrel, un promédicament inactif de la thiénopyridine, est métabolisé dans le foie par le CYP3A en un métabolite actif. Une interaction potentielle entre le clopidogrel et l'amiodarone entraînant une inhibition inefficace de l'agrégation plaquettaire a été rapportée.
Antibiotiques macrolides/cétolides
L'amiodarone peut inhiber le métabolisme des antibiotiques macrolides/cétolides (à l'exception de l'azithromycine) et des antifongiques azolés systémiques.
Substrats de glycoprotéine P
L'amiodarone prise en concomitance avec la digoxine augmente la concentration sérique de digoxine de 70 % après un jour.
Le dabigatran etexilate pris en concomitance avec l'amiodarone orale peut entraîner une élévation de la concentration sérique de dabigatran.
Le dextrométhorphane est un substrat du CYP2D6 et du CYP3A. L'amiodarone inhibe le CYP2D6. L'administration orale chronique (> 2 semaines) d'amiodarone altère le métabolisme du dextrométhorphane et peut entraîner une augmentation des concentrations sériques.
INFORMATIONS PATIENTS
CORDARONE® (KOR-DU-RON) (amiodarone) comprimés
Quelle est l'information la plus importante que je devrais connaître sur CORDARONE 50 mg ?
CORDARONE peut provoquer des effets secondaires graves pouvant entraîner la mort, notamment :
- problèmes pulmonaires
- problèmes de foie
- aggravation des problèmes de rythme cardiaque
Appelez votre fournisseur de soins de santé ou obtenez de l'aide médicale immédiatement si vous présentez l'un des symptômes suivants pendant le traitement par CORDARONE :
- difficulté à respirer, respiration sifflante, essoufflement, toux douleur à la poitrine, crachats de sang ou fièvre
- nausées ou vomissements, urine brune ou foncée, sensation de fatigue plus intense que d'habitude, jaunissement de la peau ou du blanc des yeux (jaunisse) ou douleur dans la partie supérieure droite de l'estomac
- le cœur bat la chamade, saute un battement, bat vite ou lentement, se sent étourdi ou s'évanouit
- problèmes de vision, y compris une vision floue, voir des halos ou vos yeux deviennent sensibles à la lumière. Vous devriez subir des examens de la vue réguliers avant et pendant le traitement par CORDARONE.
CORDARONE doit être instauré dans un hôpital afin que votre état de santé puisse être étroitement surveillé.
CORDARONE ne doit être utilisé que pour traiter les personnes chez qui on a diagnostiqué des problèmes de rythme cardiaque potentiellement mortels appelés arythmies ventriculaires, lorsque les autres traitements n'ont pas fonctionné ou que vous ne pouvez pas les tolérer.
CORDARONE 50mg peut provoquer d'autres effets secondaires graves. Voir « Quels sont les effets secondaires possibles de CORDARONE 100 mg ? » Si vous ressentez des effets indésirables graves pendant le traitement, vous devrez peut-être arrêter CORDARONE, modifier votre dose ou suivre un traitement médical. Discutez avec votre fournisseur de soins de santé avant d'arrêter de prendre CORDARONE.
Vous pouvez encore avoir des effets secondaires après l'arrêt de CORDARONE parce que le médicament reste dans votre corps pendant des mois après l'arrêt du traitement.
Vous devriez avoir des contrôles réguliers, des analyses de sang, des radiographies pulmonaires avant et pendant le traitement par CORDARONE 100 mg pour vérifier les effets secondaires graves. Vous devriez également passer des tests de la fonction pulmonaire avant de commencer le traitement par CORDARONE.
Qu'est-ce que CORDARONE ?
CORDARONE est un médicament d'ordonnance utilisé pour traiter les personnes chez qui on a diagnostiqué des problèmes de rythme cardiaque potentiellement mortels appelés arythmies ventriculaires, lorsque les autres traitements n'ont pas fonctionné ou que vous ne pouvez pas les tolérer. On ne sait pas si CORDARONE est sûr et efficace chez les enfants.
Qui ne devrait pas prendre CORDARONE 100mg ?
Ne prenez pas CORDARONE 100 mg si vous :
- avez un problème cardiaque grave appelé choc cardiogénique
- avez certains types de maladie cardiaque appelés bloc cardiaque, avec ou sans rythme cardiaque lent
- vous avez un rythme cardiaque lent avec des étourdissements ou des étourdissements, et vous n'avez pas de stimulateur cardiaque implanté
- êtes allergique à l'amiodarone, à l'iode ou à l'un des autres ingrédients de CORDARONE. Voir la fin de ce Guide de Médication pour une liste complète d'ingrédients dans CORDARONE.
Avant de prendre CORDARONE 100 mg, informez votre fournisseur de soins de santé de toutes vos conditions médicales, y compris si vous :
- avez des problèmes pulmonaires ou respiratoires
- avoir des problèmes de foie
- avez ou avez eu des problèmes de thyroïde
- avoir un rythme cardiaque lent ou des problèmes de tension artérielle
- avez la diarrhée ou avez eu la diarrhée pendant une longue période
- on vous a dit que vous avez de faibles taux de potassium, de magnésium ou de calcium dans le sang
- avoir un stimulateur cardiaque ou un défibrillateur implanté
- si vous envisagez de subir une intervention chirurgicale sous anesthésie générale
- êtes enceinte ou envisagez de devenir enceinte. CORDARONE peut nuire à votre bébé à naître. Informez immédiatement votre fournisseur de soins de santé si vous tombez enceinte pendant le traitement par CORDARONE. CORDARONE 100 mg peut rester dans votre corps pendant des mois après l'arrêt du traitement.
- allaitez ou envisagez d'allaiter. CORDARONE 100mg peut passer dans votre lait maternel et peut nuire à votre bébé. Vous ne devez pas allaiter pendant que vous prenez CORDARONE. CORDARONE peut rester dans votre corps pendant des mois après l'arrêt du traitement. Discutez avec votre fournisseur de soins de santé de la meilleure façon de nourrir votre bébé pendant cette période.
Informez votre fournisseur de soins de santé de tous les médicaments que vous prenez, y compris les médicaments sur ordonnance et en vente libre, les vitamines et les suppléments à base de plantes. CORDARONE 50 mg et certains autres médicaments peuvent s'influencer mutuellement et provoquer des effets indésirables graves. Vous pouvez demander à votre pharmacien une liste des médicaments qui interagissent avec CORDARONE.
Comment devrais-je prendre CORDARONE?
- Lorsque vous sortez de l'hôpital, prenez CORDARONE exactement comme votre médecin vous l'a dit.
- Votre fournisseur de soins de santé vous dira combien de CORDARONE vous devez prendre et quand le prendre.
- Votre fournisseur de soins de santé peut modifier votre dose de CORDARONE 50 mg au besoin si votre rythme cardiaque est contrôlé ou si vous présentez certains effets secondaires. Votre fournisseur de soins de santé doit vous surveiller attentivement lorsque votre dose de CORDARONE 50 mg est modifiée.
- Prenez votre dose de CORDARONE de la même manière à chaque fois, avec ou sans nourriture.
- Si vous avez pris trop de CORDARONE 100 mg, appelez votre fournisseur de soins de santé ou rendez-vous immédiatement aux urgences de l'hôpital le plus proche. Si vous oubliez une dose, attendez et prenez votre prochaine dose à l'heure habituelle. Ne prenez pas deux doses en même temps. Continuez avec votre prochaine dose régulièrement programmée.
Que dois-je éviter pendant que je prends CORDARONE ?
- Évitez de boire du jus de pamplemousse pendant le traitement avec CORDARONE. Boire du jus de pamplemousse avec CORDARONE 50 mg peut augmenter la quantité de CORDARONE dans votre sang, ce qui peut entraîner des effets secondaires.
- CORDARONE 100 mg peut rendre votre peau sensible au soleil. Vous pourriez avoir de graves coups de soleil. Utilisez un écran solaire et portez un chapeau et des vêtements qui couvrent votre peau pour vous protéger si vous devez être exposé au soleil. Parlez à votre médecin si vous attrapez un coup de soleil. Voir « Problèmes de peau » dans la section Guide des médicaments « Quels sont les effets secondaires possibles de CORDARONE ? » dessous.
Quels sont les effets secondaires possibles de CORDARONE ?
CORADARONE peut provoquer des effets secondaires graves, notamment :
- Voir "Quelle est l'information la plus importante que je devrais connaître sur CORDARONE ?"
- Problèmes nerveux. CORDARONE 100 mg peut causer des problèmes nerveux. Appelez votre fournisseur de soins de santé si vous développez des symptômes de problèmes nerveux, notamment : une sensation de « picotements » ou un engourdissement dans les mains, les jambes ou les pieds, une faiblesse musculaire, des mouvements incontrôlés, une mauvaise coordination ou des difficultés à marcher.
- Problèmes de peau. CORDARONE peut rendre votre peau plus sensible au soleil ou prendre une couleur gris bleuâtre. Les personnes qui ont la peau claire ou les personnes qui s'exposent beaucoup au soleil peuvent être plus à risque de développer ces problèmes de peau. Une partie de la couleur de la peau gris bleuâtre peut revenir à la normale après l'arrêt de CORDARONE.
- Problèmes de thyroïde. CORDARONE peut provoquer soit une diminution de la fonction thyroïdienne (hypothyroïdie), qui peut parfois être grave, soit une thyroïde hyperactive (hyperthyroïdie), qui peut être grave.
- Si vous développez une diminution de la fonction thyroïdienne pendant le traitement par CORDARONE, votre professionnel de la santé devra peut-être réduire votre dose ou arrêter votre traitement par CORDARONE, et éventuellement vous prescrire un médicament pour remplacer votre hormone thyroïdienne.
- Une thyroïde hyperactive peut vous amener à produire trop d'hormones thyroïdiennes. Vous pouvez avoir des battements cardiaques anormaux même pendant que vous recevez CORDARONE. Votre fournisseur de soins de santé peut vous prescrire certains médicaments pour traiter votre thyroïde hyperactive. Appelez votre fournisseur de soins de santé si vous obtenez des battements cardiaques anormaux pendant le traitement avec CORDARONE. Cela peut signifier que vous avez une thyroïde hyperactive.
- Votre fournisseur de soins de santé devrait faire des tests pour vérifier votre fonction thyroïdienne avant de commencer et pendant le traitement par CORDARONE.
- Appelez votre fournisseur de soins de santé si vous développez l'un des symptômes suivants d'un problème de thyroïde pendant le traitement par CORDARONE :
- la faiblesse
- perte de poids ou prise de poids
- intolérance à la chaleur ou au froid
- amincissement des cheveux
- transpiration
- changements dans vos menstruations
- gonflement du cou (goitre)
- nervosité
- irritabilité
- agitation
- diminution de la concentration
- se sentir déprimé (chez les personnes âgées)
- tremblement
Les effets secondaires les plus courants de CORDARONE comprennent :
- problèmes pulmonaires
- problèmes de rythme cardiaque
- problèmes cardiaques
- problèmes de foie
CORDARONE 50 mg peut affecter la fertilité chez les hommes et les femmes. On ne sait pas si les effets sont réversibles. Parlez à votre fournisseur de soins de santé si vous avez des inquiétudes au sujet de la fertilité.
Ce ne sont pas tous les effets secondaires possibles de CORDARONE. Pour plus d'informations, demandez à votre fournisseur de soins de santé ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
Comment dois-je conserver CORDARONE?
- Conservez CORDARONE 100mg à température ambiante entre 20° et 25°C (68° et 77°F).
- Conservez CORDARONE dans un récipient hermétiquement fermé et conservez CORDARONE 50 mg à l'abri de la lumière.
Gardez CORDARONE 50 mg et tous les médicaments hors de la portée des enfants.
Informations générales sur l'utilisation sûre et efficace de CORDARONE
Les médicaments sont parfois prescrits à des fins autres que celles énumérées dans un guide des médicaments. N'utilisez pas CORDARONE pour une condition pour laquelle il n'a pas été prescrit. Ne donnez pas CORDARONE à d'autres personnes, même si elles présentent les mêmes symptômes que vous. Cela peut leur nuire. Vous pouvez demander à votre pharmacien ou à votre professionnel de la santé des informations sur CORDARONE rédigées à l'intention des professionnels de la santé.
Quels sont les ingrédients de CORDARONE 100mg ?
Ingrédient actif: chlorhydrate d'amiodarone
Ingrédients inactifs: dioxyde de silicium colloïdal, lactose, stéarate de magnésium, povidone, amidon et FD&C Red 40.
Ce guide de médication a été approuvé par la Food and Drug Administration des États-Unis.
