Micardis 20mg, 40mg, 80mg Telmisartan Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Micardis 40 mg et comment est-il utilisé ?
Micardis est un médicament délivré sur ordonnance utilisé pour traiter les symptômes de l'hypertension artérielle et pour réduire le risque de maladies cardiovasculaires telles que les accidents vasculaires cérébraux et les crises cardiaques. Micardis 20 mg peut être utilisé seul ou avec d'autres médicaments.
Micardis 80 mg appartient à une classe de médicaments appelés ARA.
On ne sait pas si Micardis est sûr et efficace chez les enfants de moins de 18 ans.
Quels sont les effets secondaires possibles de Micardis ?
Micardis 80 mg peut provoquer des effets indésirables graves, notamment :
- étourdissement,
- gonflement,
- prise de poids rapide,
- nausée,
- la faiblesse,
- sensation de picotement,
- douleur thoracique,
- battements cardiaques irréguliers et
- perte de mouvement
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Micardis comprennent :
- nez encombré,
- douleur des sinus,
- maux de dos, et
- diarrhée
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Micardis. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
ATTENTION
TOXICITÉ FŒTALE
- Lorsqu'une grossesse est détectée, arrêter MICARDIS 40 mg dès que possible [voir AVERTISSEMENTS ET PRECAUTIONS et Utilisation dans des populations spécifiques ].
- Les médicaments qui agissent directement sur le système rénine-angiotensine peuvent causer des lésions et la mort du fœtus en développement [voir AVERTISSEMENTS ET PRECAUTIONS et Utilisation dans des populations spécifiques ].
LA DESCRIPTION
MICARDIS 40 mg est un antagoniste non peptidique des récepteurs de l'angiotensine II (type AT1).
Le telmisartan est chimiquement décrit comme 4'-[(1,4'-diméthyl-2''-propyl [2,6''-bi-1H-benzimidazol]-1''-yl)méthyl ]-[1,1'-biphényl]-2-acide carboxylique. Sa formule empirique est C33H30N4O2, son poids moléculaire est de 514,63 et sa formule structurelle est :
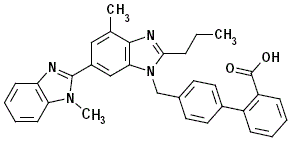
Le telmisartan est un solide blanc à légèrement jaunâtre. Il est pratiquement insoluble dans l'eau et dans la gamme de pH de 3 à 9, peu soluble dans les acides forts (sauf insoluble dans l'acide chlorhydrique) et soluble dans les bases fortes.
MICARDIS 20 mg est disponible sous forme de comprimés pour administration orale, contenant 20 mg, 40 mg ou 80 mg de telmisartan. Les comprimés contiennent les ingrédients inactifs suivants : hydroxyde de sodium, méglumine, povidone, sorbitol et stéarate de magnésium. Les comprimés MICARDIS sont hygroscopiques et doivent être protégés de l'humidité.
LES INDICATIONS
MICARDIS HCT (telmisartan et hydrochlorothiazide) est indiqué pour le traitement de l'hypertension, pour abaisser la tension artérielle. L'abaissement de la pression artérielle réduit le risque d'événements cardiovasculaires mortels et non mortels, principalement des accidents vasculaires cérébraux et des infarctus du myocarde. Ces avantages ont été observés dans des essais contrôlés de médicaments antihypertenseurs appartenant à une grande variété de classes pharmacologiques, y compris les classes auxquelles ce médicament appartient principalement. Il n'y a pas d'essais contrôlés démontrant une réduction des risques avec MICARDIS HCT.
Le contrôle de l'hypertension artérielle doit faire partie d'une gestion globale des risques cardiovasculaires, y compris, le cas échéant, le contrôle des lipides, la gestion du diabète, la thérapie antithrombotique, l'arrêt du tabac, l'exercice et un apport limité en sodium. De nombreux patients auront besoin de plus d'un médicament pour atteindre leurs objectifs de tension artérielle. Pour des conseils spécifiques sur les objectifs et la gestion, consultez les directives publiées, telles que celles du Comité national mixte sur la prévention, la détection, l'évaluation et le traitement de l'hypertension artérielle (JNC) du National High Blood Pressure Education Program.
De nombreux médicaments antihypertenseurs, appartenant à une variété de classes pharmacologiques et avec différents mécanismes d'action, ont été montrés dans des essais contrôlés randomisés pour réduire la morbidité et la mortalité cardiovasculaires, et on peut conclure qu'il s'agit de la réduction de la pression artérielle, et non d'une autre propriété pharmacologique de les médicaments, qui est en grande partie responsable de ces avantages. Le bénéfice cardiovasculaire le plus important et le plus constant a été une réduction du risque d'accident vasculaire cérébral, mais des réductions de l'infarctus du myocarde et de la mortalité cardiovasculaire ont également été observées régulièrement.
Une pression systolique ou diastolique élevée entraîne un risque cardiovasculaire accru, et l'augmentation du risque absolu par mmHg est plus importante à des pressions artérielles plus élevées, de sorte que même des réductions modestes de l'hypertension sévère peuvent apporter des avantages substantiels. La réduction du risque relatif de la réduction de la pression artérielle est similaire dans les populations avec un risque absolu variable, de sorte que le bénéfice absolu est plus important chez les patients qui présentent un risque plus élevé indépendamment de leur hypertension (par exemple, les patients atteints de diabète ou d'hyperlipidémie), et ces patients seraient attendus bénéficier d'un traitement plus agressif à un objectif de tension artérielle plus basse.
Certains médicaments antihypertenseurs ont des effets plus faibles sur la pression artérielle (en monothérapie) chez les patients noirs, et de nombreux médicaments antihypertenseurs ont des indications et des effets supplémentaires approuvés (p. ex., sur l'angor, l'insuffisance cardiaque ou la néphropathie diabétique). Ces considérations peuvent guider le choix du traitement [voir Etudes cliniques ].
MICARDIS 40 mg HCT n'est pas indiqué pour le traitement initial de l'hypertension [voir DOSAGE ET ADMINISTRATION ].
MICARDIS HCT peut être utilisé seul ou en association avec d'autres antihypertenseurs.
DOSAGE ET ADMINISTRATION
Informations sur le dosage
Initier un patient dont la tension artérielle n'est pas suffisamment contrôlée par le telmisartan en monothérapie 80 mg sur MICARDIS 40 mg HCT, 80 mg/12,5 mg une fois par jour. La dose peut être augmentée jusqu'à 160 mg/25 mg après 2 à 4 semaines, si nécessaire.
Initier un patient dont la tension artérielle n'est pas suffisamment contrôlée par 25 mg une fois par jour d'hydrochlorothiazide, ou qui est contrôlée mais qui présente une hypokaliémie avec ce régime sur MICARDIS HCT 80 mg/12,5 mg une fois par jour. La dose peut être augmentée jusqu'à 160 mg/25 mg après 2 à 4 semaines, si nécessaire.
Les patients titrés aux composants individuels (telmisartan et hydrochlorothiazide) peuvent à la place recevoir la dose correspondante de MICARDIS 20 mg HCT.
MICARDIS 20mg HCT peut être administré avec d'autres antihypertenseurs.
Ajustement de dose pour l'insuffisance hépatique
Initier les patients souffrant de troubles obstructifs des voies biliaires ou d'insuffisance hépatique sous surveillance médicale étroite en utilisant l'association 40 mg/12,5 mg. Les comprimés MICARDIS 40mg HCT ne sont pas recommandés chez les patients présentant une insuffisance hépatique sévère [voir Utilisation dans des populations spécifiques et PHARMACOLOGIE CLINIQUE ].
Instructions d'administration importantes
Les comprimés MICARDIS HCT ne doivent être retirés des plaquettes qu'immédiatement avant l'administration.
COMMENT FOURNIE
Formes posologiques et points forts
- 40 mg/12,5 mg, comprimés rouges et blancs portant le logo Boehringer Ingelheim et H4
- 80 mg/12,5 mg, comprimés rouges et blancs portant le logo Boehringer Ingelheim et H8
- 80 mg/25 mg, comprimés jaunes et blancs portant le logo Boehringer Ingelheim et H9
Stockage et manutention
MICARDIS 20 mg HCT est disponible en trois dosages sous forme de comprimés biconvexes à deux couches, de forme oblongue, non enrobés contenant du telmisartan et de l'hydrochlorothiazide :
- Comprimé à 40 mg/12,5 mg : rouge et blanc (peut contenir des points rouges) portant le symbole de la société Boehringer Ingelheim et H4 ; scellés sous blister individuel dans des boîtes de 30 comprimés sous forme de 3 x 10 cartes ( CDN 0597-0043-37)
- Comprimé à 80 mg/12,5 mg : rouge et blanc (peut contenir des taches rouges) portant le symbole de la société Boehringer Ingelheim et H8 ; scellés sous blister individuel dans des boîtes de 30 comprimés sous forme de 3 x 10 cartes ( CDN 0597-0044-37)
- Comprimé à 80 mg/25 mg : jaune et blanc (peut contenir des points jaunes) portant le symbole de la société Boehringer Ingelheim et H9 ; scellés sous blister individuel dans des boîtes de 30 comprimés sous forme de 3 x 10 cartes ( CDN 0597-0042-37)
Stockage
Conserver à 25 °C (77 °F); excursions autorisées jusqu'à 15°C-30°C (59°F-86°F) [voir USP Température ambiante contrôlée]. Les comprimés ne doivent être retirés des plaquettes qu'immédiatement avant l'administration.
Distribué par : Boehringer Ingelheim Pharmaceuticals, Inc. Ridgefield, CT 06877 États-Unis. Révisé : Octobre 2018
EFFETS SECONDAIRES
Les effets indésirables suivants sont discutés ailleurs dans l'étiquetage :
- Hypotension [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Insuffisance rénale [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Électrolytes et troubles métaboliques [voir AVERTISSEMENTS ET PRECAUTIONS ]
Expérience des essais cliniques
Étant donné que les études cliniques sont menées dans des conditions très variables, les taux d'effets indésirables observés dans les études cliniques d'un médicament ne peuvent pas être directement comparés aux taux des études cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique.
L'innocuité de MICARDIS HCT a été évaluée chez plus de 1700 patients, dont 716 traités pour l'hypertension pendant plus de 6 mois et 420 pendant plus d'un an. Les effets indésirables se sont limités à ceux précédemment rapportés avec le telmisartan et/ou l'hydrochlorothiazide.
Les effets indésirables survenant à une incidence ≥ 2 % chez les patients traités par telmisartan/hydrochlorothiazide et à un taux plus élevé que chez les patients traités par placebo, sont présentés dans le tableau 1 [voir Etudes cliniques ].
Les autres effets indésirables observés avec l'association telmisartan/hydrochlorothiazide ont été : douleurs (y compris dorsales et abdominales), dyspepsie, érythème, vomissements, bronchite et pharyngite.
Les effets indésirables sont survenus à peu près aux mêmes taux chez les hommes et les femmes, les patients plus âgés et plus jeunes et les patients noirs et non noirs.
Telmisartan
Les autres événements indésirables signalés avec le telmisartan sont énumérés ci-dessous :
Système nerveux autonome: impuissance, augmentation de la transpiration, bouffées vasomotrices
Corps dans son ensemble : allergie, fièvre, douleur aux jambes, douleur à la poitrine
Cardiovasculaire: palpitations, angine de poitrine, ECG anormal, hypertension, œdème périphérique
Système nerveux central: insomnie, somnolence, migraine, paresthésie, contractions musculaires involontaires, hypoesthésie
Gastro-intestinal : flatulences, constipation, gastrite, bouche sèche, hémorroïdes, reflux gastro-oesophagien, mal de dents
Hépato-biliaire : élévations des enzymes hépatiques ou de la bilirubine sérique
Métabolique: goutte, hypercholestérolémie, diabète sucré
Musculo-squelettique : arthrite, arthralgie, crampes aux jambes, myalgie
Psychiatrique: anxiété, dépression, nervosité
Mécanisme de résistance : infection, abcès, otite moyenne
Respiratoire: asthme, rhinite, dyspnée, épistaxis
Peau: dermatite, eczéma, prurit
Urinaire: fréquence mictionnelle, cystite
Vasculaire: trouble cérébrovasculaire
Sens spéciaux : vision anormale, conjonctivite, acouphènes, mal d'oreille
Hydrochlorothiazide
D'autres événements indésirables qui ont été signalés avec l'hydrochlorothiazide sont énumérés ci-dessous :
Corps dans son ensemble : la faiblesse
Digestif: pancréatite, ictère (ictère cholestatique intrahépatique), sialadénite, crampes, irritation gastrique
Hématologique : anémie aplasique, agranulocytose, leucopénie, anémie hémolytique, thrombocytopénie
Hypersensibilité : purpura, photosensibilité, urticaire, angéite nécrosante (vascularite et vascularite cutanée), fièvre, détresse respiratoire incluant pneumonite et œdème pulmonaire, réactions anaphylactiques
Métabolique: hyperglycémie, glycosurie
Musculo-squelettique : spasmes musculaires
Système nerveux/psychiatrique : agitation
Rénal: néphrite interstitielle
Peau: érythème polymorphe dont syndrome de Stevens-Johnson, dermatite exfoliative dont nécrolyse épidermique toxique
Sens spéciaux : vision trouble transitoire, xanthopsie
Résultats de laboratoire clinique
Créatinine, azote uréique sanguin (BUN)
Des augmentations de l'urée (≥ 11,2 mg/dL) et de la créatinine sérique (≥ 0,5 mg/dL) ont été observées chez 2,8 % et 1,4 %, respectivement, des patients souffrant d'hypertension essentielle traités par les comprimés MICARDIS 80 mg HCT dans des essais contrôlés. Aucun patient n'a interrompu le traitement par MICARDIS 80 mg comprimés HCT en raison d'une augmentation de l'urée ou de la créatinine [voir AVERTISSEMENTS ET PRECAUTIONS ].
Expérience post-commercialisation
Les effets indésirables suivants ont été identifiés lors de l'utilisation post-approbation de MICARDIS HCT. Étant donné que ces réactions sont signalées volontairement par une population de taille incertaine, il n'est pas toujours possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale avec l'exposition au médicament.
Troubles du système sanguin et lymphatique : éosinophilie
Troubles cardiaques : fibrillation auriculaire, insuffisance cardiaque congestive, infarctus du myocarde, tachycardie, bradycardie
Troubles de l'oreille et du labyrinthe : vertige
Troubles généraux et conditions au site d'administration : asthénie, œdème
Hépato-biliaire : Fonction hépatique anormale/trouble du foie
Troubles du système immunitaire : Réaction anaphylactique
Infections et infestations : infection urinaire
Enquêtes : CPK augmenté
Troubles du métabolisme et de la nutrition : hypoglycémie (chez les patients diabétiques)
Troubles musculosquelettiques et du tissu conjonctif : douleurs tendineuses (dont tendinite, ténosynovite), rhabdomyolyse
Troubles du système nerveux : syncope, maux de tête
Troubles rénaux et urinaires : insuffisance rénale, insuffisance rénale, y compris insuffisance rénale aiguë
Troubles de l'appareil reproducteur et des seins : dysérection
Troubles respiratoires, thoraciques et médiastinaux : tousser
Troubles de la peau et du tissu sous-cutané : éruption médicamenteuse (éruption cutanée toxique principalement signalée comme toxicodermie, éruption cutanée et urticaire), œdème de Quincke (avec issue fatale)
Trouble vasculaire : hypotension orthostatique
INTERACTIONS MÉDICAMENTEUSES
Agents augmentant le potassium sérique
La co-administration de telmisartan avec d'autres médicaments qui augmentent les taux de potassium sérique peut entraîner une hyperkaliémie. Surveiller le potassium sérique chez ces patients.
Lithium
Des augmentations des concentrations sériques de lithium et de la toxicité du lithium ont été rapportées lors de l'utilisation concomitante de diurétiques thiazidiques ou d'antagonistes des récepteurs de l'angiotensine II, y compris le telmisartan. Surveiller les taux de lithium chez les patients recevant MICARDIS 80 mg HCT et du lithium.
Agents anti-inflammatoires non stéroïdiens, y compris les inhibiteurs sélectifs de Cyclooxygenas E-2
Telmisartan
Agents anti-inflammatoires non stéroïdiens, y compris les inhibiteurs sélectifs de la cyclooxygénase-2 (inhibiteurs de la COX-2) : chez les patients âgés, hypovolémiques (y compris ceux sous traitement diurétique) ou dont la fonction rénale est altérée, la co-administration d'AINS, y compris les inhibiteurs sélectifs de la COX-2, avec les ARA, y compris le telmisartan, peuvent entraîner une détérioration de la fonction rénale, y compris une éventuelle insuffisance rénale aiguë. Ces effets sont généralement réversibles. L'effet antihypertenseur des ARA peut être atténué par les AINS. Par conséquent, surveiller périodiquement la fonction rénale et la tension artérielle chez les patients recevant MICARDIS 40 mg HCT et des AINS.
Hydrochlorothiazide
L'administration d'un agent anti-inflammatoire non stéroïdien, y compris un inhibiteur sélectif de la COX2, peut réduire les effets diurétiques, natriurétiques et antihypertenseurs des diurétiques. Par conséquent, lorsque MICARDIS HCT et des agents anti-inflammatoires non stéroïdiens, y compris des inhibiteurs sélectifs de la COX2, sont utilisés de façon concomitante, observer attentivement pour déterminer si l'effet désiré du diurétique est obtenu.
Double blocage du système rénine-angiotens-in-aldostérone et modifications de la fonction rénale
Le double blocage du système rénine-angiotensine-aldostérone (RAS) avec les inhibiteurs de l'angiotensine, les inhibiteurs de l'ECA ou l'aliskirène est associé à des risques accrus d'hypotension, d'hyperkaliémie et d'insuffisance rénale. L'essai ONTARGET a recruté 25 620 patients âgés de ≥ 55 ans atteints d'athérosclérose ou de diabète avec lésions des organes cibles, les a randomisés pour recevoir uniquement le telmisartan (ARA), le ramipril (inhibiteur de l'ECA) ou l'association, et les a suivis pendant une durée médiane de 56 mois . Les patients qui ont reçu l'association d'ARA et d'inhibiteur de l'ECA n'ont obtenu aucun bénéfice supplémentaire (pas de réduction supplémentaire du risque de décès cardiovasculaire, d'infarctus du myocarde, d'accident vasculaire cérébral ou d'hospitalisation pour insuffisance cardiaque) par rapport à l'ARA en monothérapie ou à l'inhibiteur de l'ECA en monothérapie, mais ont présenté une augmentation incidence de dysfonctionnement rénal (p. ex., insuffisance rénale aiguë) par rapport aux groupes de monothérapie.
En général, évitez l'utilisation combinée d'inhibiteurs du RAS. Surveillez étroitement la pression artérielle, la fonction rénale et les électrolytes chez les patients sous MICARDIS 40 mg HCT et d'autres agents qui affectent le SRA.
Ne pas co-administrer l'aliskirène avec MICARDIS HCT chez les patients diabétiques. Éviter l'utilisation concomitante d'aliskirène avec MICARDIS HCT chez les patients insuffisants rénaux (DFG
Digoxine
Lorsque le telmisartan a été co-administré avec la digoxine, des augmentations médianes de la concentration plasmatique maximale de digoxine (49 %) et de la concentration minimale (20 %) ont été observées. Surveiller les taux de digoxine chez les patients prenant simultanément MICARDIS 40 mg HCT et de la digoxine.
Médicaments antidiabétiques (agents oraux et insuline)
Un ajustement posologique des antidiabétiques peut être nécessaire en cas de co-administration avec l'hydrochlorothiazide.
Résines de cholestyramine et de colestipol
L'absorption de l'hydrochlorothiazide est altérée en présence de résines échangeuses d'anions. Décaler le dosage de l'hydrochlorothiazide et de la résine de manière à ce que l'hydrochlorothiazide soit administré au moins 4 heures avant ou 4 à 6 heures après l'administration de la résine.
AVERTISSEMENTS
Inclus dans le cadre du "PRÉCAUTIONS" Section
PRÉCAUTIONS
Toxicité fœtale
Telmisartan
L'utilisation de médicaments qui agissent sur le système rénine-angiotensine au cours des deuxième et troisième trimestres de la grossesse réduit la fonction rénale fœtale et augmente la morbidité et la mortalité fœtales et néonatales. L'oligohydramnios qui en résulte peut être associé à une hypoplasie pulmonaire fœtale et à des déformations squelettiques. Les effets indésirables néonataux potentiels comprennent l'hypoplasie crânienne, l'anurie, l'hypotension, l'insuffisance rénale et la mort. Lorsqu'une grossesse est détectée, arrêtez MICARDIS HCT dès que possible.
Hydrochlorothiazide
Les thiazides traversent la barrière placentaire et apparaissent dans le sang de cordon. Les effets indésirables incluent la jaunisse fœtale ou néonatale et la thrombocytopénie [voir Utilisation dans des populations spécifiques ].
Hypotension chez les patients souffrant d'une déplétion volumique ou sodée
Chez les patients dont le système rénine-angiotensine est activé, tels que les patients présentant une hypovolémie ou une déplétion sodée (p. ex., ceux traités par de fortes doses de diurétiques), une hypotension symptomatique peut survenir après l'initiation du traitement par MICARDIS HCT. Corrigez le volume ou la déplétion en sel avant l'administration de MICARDIS 80 mg HCT.
Fonction rénale altérée
Des modifications de la fonction rénale, y compris une insuffisance rénale aiguë, peuvent être causées par des médicaments qui inhibent le système rénine-angiotensine et par des diurétiques. Les patients dont la fonction rénale peut dépendre en partie de l'activité du système rénine-angiotensine (p. ex., les patients présentant une sténose de l'artère rénale, une maladie rénale chronique, une insuffisance cardiaque congestive sévère ou une déplétion volémique) peuvent présenter un risque particulier de développer une oligurie, une azotémie progressive , ou insuffisance rénale aiguë sur MICARDIS HCT. Surveiller périodiquement la fonction rénale chez ces patients. Envisager de suspendre ou d'arrêter le traitement chez les patients qui développent une diminution cliniquement significative de la fonction rénale sous MICARDIS HCT.
Électrolytes et troubles métaboliques
Les médicaments, y compris le telmisartan, qui inhibent le système rénine-angiotensine peuvent provoquer une hyperkaliémie, en particulier chez les patients insuffisants rénaux, diabétiques ou en association avec d'autres inhibiteurs des récepteurs de l'angiotensine ou des inhibiteurs de l'ECA et l'utilisation concomitante d'autres médicaments qui augmentent les taux de potassium sérique [voir INTERACTIONS MÉDICAMENTEUSES ].
L'hydrochlorothiazide peut provoquer une hypokaliémie et une hyponatrémie. Il a été démontré que les thiazides augmentent l'excrétion urinaire de magnésium ; cela peut entraîner une hypomagnésémie. L'hypomagnésémie peut entraîner une hypokaliémie qui peut être difficile à traiter malgré la réplétion potassique. Surveiller périodiquement les électrolytes sériques.
Dans les essais contrôlés utilisant l'association telmisartan/hydrochlorothiazide, aucun patient ayant reçu 40 mg/12,5 mg, 80 mg/12,5 mg ou 80 mg/25 mg n'a présenté de diminution du potassium ≥ 1,4 mEq/L, et aucun patient n'a présenté d'hyperkaliémie.
L'hydrochlorothiazide diminue l'excrétion urinaire de calcium et peut provoquer des élévations de la calcémie.
L'hydrochlorothiazide peut altérer la tolérance au glucose et augmenter les taux sériques de cholestérol et de triglycérides.
Une hyperuricémie peut survenir ou une goutte franche peut être précipitée chez certains patients recevant un traitement thiazidique. Comme le telmisartan diminue l'acide urique, le telmisartan en association avec l'hydrochlorothiazide atténue l'hyperuricémie induite par les diurétiques.
Réaction d'hypersensibilité
Hydrochlorothiazide
Des réactions d'hypersensibilité à l'hydrochlorothiazide peuvent survenir chez les patients avec ou sans antécédents d'allergie ou d'asthme bronchique, mais sont plus probables chez les patients ayant de tels antécédents [voir CONTRE-INDICATIONS ].
Myopie aiguë et glaucome secondaire à angle fermé
L'hydrochlorothiazide, un sulfamide, peut provoquer une réaction idiosyncrasique, entraînant une myopie aiguë transitoire et un glaucome aigu à angle fermé. Les symptômes comprennent l'apparition aiguë d'une diminution de l'acuité visuelle ou de douleurs oculaires et surviennent généralement quelques heures à quelques semaines après l'initiation du médicament. Un glaucome aigu à angle fermé non traité peut entraîner une perte de vision permanente. Le traitement principal consiste à arrêter l'hydrochlorothiazide le plus rapidement possible. Des traitements médicaux ou chirurgicaux rapides peuvent devoir être envisagés si la pression intraoculaire reste incontrôlée. Les facteurs de risque de développer un glaucome aigu à angle fermé peuvent inclure des antécédents d'allergie aux sulfamides ou à la pénicilline.
Le lupus érythémateux disséminé
Il a été rapporté que les diurétiques thiazidiques provoquent une exacerbation ou une activation du lupus érythémateux disséminé.
Patients post-sympathectomie
Les effets antihypertenseurs de l'hydrochlorothiazide peuvent être renforcés chez le patient post-sympathectomie.
Informations sur les conseils aux patients
Conseillez au patient de lire l'étiquetage patient approuvé par la FDA ( INFORMATIONS PATIENTS ).
Grossesse
Informer les patientes en âge de procréer des conséquences de l'exposition à MICARDIS 40 mg HCT pendant la grossesse. Discutez des options de traitement avec les femmes qui envisagent de devenir enceintes. Dites aux patientes de signaler les grossesses à leur médecin dès que possible [voir AVERTISSEMENTS ET PRECAUTIONS et Utilisation dans des populations spécifiques ].
Lactation
Conseillez aux femmes qui allaitent de ne pas allaiter pendant le traitement par MICARDIS HCT [voir Utilisation dans des populations spécifiques ].
Hypotension symptomatique et syncope
Informez les patients que des étourdissements peuvent survenir, en particulier pendant les premiers jours de traitement, et de le signaler à leur fournisseur de soins de santé. Informez les patients qu'un apport hydrique insuffisant, une transpiration excessive, une diarrhée ou des vomissements peuvent entraîner une chute excessive de la pression artérielle, avec les mêmes conséquences d'étourdissements et d'éventuelles syncopes. Conseillez aux patients de contacter leur fournisseur de soins de santé en cas de syncope [voir AVERTISSEMENTS ET PRECAUTIONS ].
Suppléments de potassium
Conseillez aux patients de ne pas utiliser de suppléments de potassium ou de substituts de sel contenant du potassium sans consulter le fournisseur de soins de santé prescripteur [voir AVERTISSEMENTS ET PRECAUTIONS et INTERACTIONS MÉDICAMENTEUSES ].
Myopie aiguë et glaucome secondaire à angle fermé
Conseillez aux patients d'arrêter MICARDIS 80 mg HCT et de consulter immédiatement un médecin s'ils présentent des symptômes de myopie aiguë ou de glaucome à angle fermé secondaire [voir AVERTISSEMENTS ET PRECAUTIONS ].
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Telmisartan Et Hydrochlorothiazide
Aucune étude de cancérogénicité, de mutagénicité ou de fertilité n'a été menée avec l'association de telmisartan et d'hydrochlorothiazide.
Telmisartan
Il n'y a eu aucune preuve de cancérogénicité lorsque le telmisartan a été administré dans l'alimentation de souris et de rats pendant une période allant jusqu'à 2 ans. Les doses les plus élevées administrées aux souris (1000 mg/kg/jour) et aux rats (100 mg/kg/jour) sont, sur une base mg/m2, environ 59 et 13 fois, respectivement, la dose maximale recommandée chez l'homme (MRHD) de telmisartan. Il a été démontré que ces mêmes doses fournissent des expositions systémiques moyennes au telmisartan > 100 fois et > 25 fois, respectivement, l'exposition systémique chez les humains recevant la MRHD de telmisartan (80 mg/jour).
Les tests de génotoxicité n'ont révélé aucun effet lié au telmisartan, que ce soit au niveau des gènes ou des chromosomes. Ces tests comprenaient des tests de mutagénicité bactérienne avec Salmonella et E. coli (Ames), un test de mutation génique avec des cellules V79 de hamster chinois, un test cytogénétique avec des lymphocytes humains et un test du micronoyau de souris.
Aucun effet lié au médicament sur la performance reproductive des rats mâles et femelles n'a été noté à 100 mg/kg/jour (la dose la plus élevée administrée), environ 13 fois, sur une base mg/m2, la MRHD du telmisartan. Cette dose chez le rat a entraîné une exposition systémique moyenne (ASC du telmisartan telle que déterminée au jour 6 de la grossesse) au moins 50 fois l'exposition systémique moyenne chez l'homme à la MRHD (80 mg/jour).
Hydrochlorothiazide
Des études d'alimentation de deux ans chez des souris et des rats menées sous les auspices du National Toxicology Program (NTP) n'ont révélé aucune preuve d'un potentiel carcinogène de l'hydrochlorothiazide chez les souris femelles (à des doses allant jusqu'à environ 600 mg/kg/jour) ou chez les mâles. et les rats femelles (à des doses allant jusqu'à environ 100 mg/kg/jour). Le NTP, cependant, a trouvé des preuves équivoques d'hépatocarcinogénicité chez les souris mâles.
L'hydrochlorothiazide n'était pas génotoxique in vitro dans le test de mutagénicité d'Ames sur les souches de Salmonella typhimurium TA 98, TA 100, TA 1535, TA 1537 et TA 1538 et dans le test des ovaires de hamster chinois (CHO) pour les aberrations chromosomiques, ou in vivo dans les tests utilisant les chromosomes des cellules germinales de la souris, les chromosomes de la moelle osseuse du hamster chinois et le gène du trait létal récessif lié au sexe de la drosophile. Des résultats positifs ont été obtenus dans le test in vitro CHO Sister Chromatid Exchange (clastogénicité), dans le test Mouse Lymphoma Cell (mutagénicité) et dans le test de non-disjonction Aspergillus nidulans.
L'hydrochlorothiazide n'a eu aucun effet indésirable sur la fertilité des souris et des rats des deux sexes dans des études au cours desquelles ces espèces ont été exposées, via leur régime alimentaire, à des doses allant jusqu'à 100 et 4 mg/kg, respectivement, avant l'accouplement et tout au long de la gestation.
Utilisation dans des populations spécifiques
Grossesse
Résumé des risques
MICARDIS HCT peut être nocif pour le fœtus lorsqu'il est administré à une femme enceinte. L'utilisation de médicaments qui agissent sur le système rénine-angiotensine au cours des deuxième et troisième trimestres de la grossesse réduit la fonction rénale fœtale et augmente la morbidité et la mortalité fœtales et néonatales (voir Considérations cliniques ). La plupart des études épidémiologiques examinant les anomalies fœtales après exposition à l'utilisation d'antihypertenseurs au cours du premier trimestre n'ont pas distingué les médicaments affectant le système rénine-angiotensine des autres agents antihypertenseurs. Des études chez le rat et le lapin avec le telmisartan ont montré une fœtotoxicité uniquement à des doses maternellement toxiques (voir Données ). Lorsqu'une grossesse est détectée, arrêtez MICARDIS HCT dès que possible.
Le risque de fond estimé de malformations congénitales majeures et de fausse couche pour la population indiquée est inconnu. Toutes les grossesses ont un risque de fond de malformation congénitale, de perte ou d'autres résultats indésirables. Dans la population générale des États-Unis, le risque de fond estimé de malformations congénitales majeures et de fausse couche dans les grossesses cliniquement reconnues est de 2 % à 4 % et de 15 % à 20 %, respectivement.
Considérations cliniques
Risque maternel et/ou embryonnaire/fœtal associé à la maladie
L'hypertension pendant la grossesse augmente le risque maternel de prééclampsie, de diabète gestationnel, d'accouchement prématuré et de complications à l'accouchement (p. ex., nécessité d'une césarienne et hémorragie post-partum). L'hypertension augmente le risque fœtal de retard de croissance intra-utérin et de mort intra-utérine. Les femmes enceintes souffrant d'hypertension doivent être étroitement surveillées et prises en charge en conséquence.
Effets indésirables fœtaux/néonatals
Telmisartan
L'utilisation de médicaments qui agissent sur le SRA au cours des deuxième et troisième trimestres de la grossesse peut entraîner les effets suivants : oligohydramnios, réduction de la fonction rénale fœtale entraînant une anurie et une insuffisance rénale, hypoplasie pulmonaire fœtale, déformations du squelette, y compris hypoplasie crânienne, hypotension et décès . Dans le cas inhabituel où il n'y a pas d'alternative appropriée au traitement par des médicaments affectant le système rénine-angiotensine pour un patient particulier, informer la mère du risque potentiel pour le fœtus.
Chez les patientes prenant MICARDIS HCT pendant la grossesse, effectuer des échographies en série pour évaluer l'environnement intra-amniotique. Des tests fœtaux peuvent être appropriés, en fonction de la semaine de gestation. Si un oligohydramnios est observé, interrompre MICARDIS HCT, à moins que cela ne soit considéré comme salvateur pour la mère. Les patients et les médecins doivent toutefois savoir que l'oligohydramnios peut n'apparaître qu'après que le fœtus a subi une lésion irréversible.
Observer attentivement les nourrissons ayant des antécédents d'exposition in utero à MICARDIS 20 mg HCT pour l'hypotension, l'oligurie et l'hyperkaliémie. En cas d'oligurie ou d'hypotension, maintenir la tension artérielle et la perfusion rénale. Des exsanguinotransfusions ou une dialyse peuvent être nécessaires pour inverser l'hypotension et remplacer la fonction rénale [voir Utilisation dans des populations spécifiques ].
Hydrochlorothiazide
Les thiazides traversent le placenta et l'utilisation de thiazides pendant la grossesse est associée à un risque d'ictère fœtal ou néonatal, de thrombocytopénie et d'éventuels autres effets indésirables survenus chez l'adulte.
Données
Données animales
MICARDIS 40mg HCT
Une étude de toxicité pour le développement a été réalisée chez le rat avec des doses de telmisartan/hydrochlorothiazide de 3,2/1,0, 15/4,7, 50/15,6 et 0/15,6 mg/kg/jour. Bien que les deux combinaisons de doses plus élevées aient semblé être plus toxiques (diminution significative du gain de poids corporel) pour les mères que l'un ou l'autre médicament seul, il n'a pas semblé y avoir d'augmentation de la toxicité pour les embryons en développement.
Telmisartan
Aucun effet tératogène n'a été observé lorsque le telmisartan a été administré à des rates gravides à des doses orales allant jusqu'à 50 mg/kg/jour et à des lapines gravides à des doses orales allant jusqu'à 45 mg/kg/jour. Chez les lapins, une létalité embryonnaire associée à une toxicité maternelle (réduction du gain de poids corporel et de la consommation alimentaire) a été observée à 45 mg/kg/jour (environ 12 fois la dose humaine recommandée maximale [MRHD] de 80 mg sur une base mg/m2). Chez le rat, des doses de telmisartan toxiques pour la mère (réduction de la prise de poids corporel et de la consommation alimentaire) de 15 mg/kg/jour (environ 1,9 fois la MRHD sur une base en mg/m2), administrées en fin de gestation et pendant la lactation, ont produit des effets indésirables. chez les nouveau-nés, y compris une viabilité réduite, un faible poids à la naissance, un retard de maturation et une diminution de la prise de poids. Les doses sans effet observé pour la toxicité pour le développement chez le rat et le lapin, 5 et 15 mg/kg/jour, respectivement, sont respectivement d'environ 0,64 et 3,7 fois, sur une base en mg/m2, la MRHD du telmisartan (80 mg/jour ).
Hydrochlorothiazide
Les études dans lesquelles l'hydrochlorothiazide a été administré à des souris et des rats gravides pendant leurs périodes respectives d'organogenèse majeure à des doses allant jusqu'à 3000 et 1000 mg/kg/jour, respectivement (environ 600 et 400 fois la MRHD), n'ont fourni aucune preuve d'effet nocif pour le fœtus .
Les thiazides peuvent traverser le placenta et les concentrations atteintes dans la veine ombilicale se rapprochent de celles du plasma maternel. L'hydrochlorothiazide, comme les autres diurétiques, peut provoquer une hypoperfusion placentaire. Il s'accumule dans le liquide amniotique, avec des concentrations rapportées jusqu'à 19 fois supérieures à celles du plasma de la veine ombilicale. L'utilisation de thiazides pendant la grossesse est associée à un risque d'ictère ou de thrombocytopénie fœtale ou néonatale. Puisqu'ils n'empêchent ni ne modifient l'évolution de la gestose EPH (œdème, protéinurie, hypertension) (pré-éclampsie), ces médicaments ne doivent pas être utilisés pour traiter l'hypertension chez les femmes enceintes. L'utilisation de l'hydrochlorothiazide pour d'autres indications (par exemple, les maladies cardiaques) pendant la grossesse doit être évitée.
Lactation
Résumé des risques
Il n'existe aucune information concernant la présence de MICARDIS 20 mg HCT ou de telmisartan dans le lait maternel, les effets sur le nourrisson allaité ou les effets sur la production de lait. Des études publiées limitées signalent que l'hydrochlorothiazide est présent dans le lait maternel. Cependant, les informations sont insuffisantes pour déterminer les effets de l'hydrochlorothiazide sur le nourrisson allaité ou les effets de l'hydrochlorothiazide sur la production de lait. Le telmisartan est présent dans le lait des rates allaitantes. (voir Données ). En raison du risque d'effets indésirables graves chez le nourrisson allaité, y compris l'hypotension, l'hyperkaliémie et l'insuffisance rénale, conseiller à la femme qui allaite de ne pas allaiter pendant le traitement par MICARDIS HCT.
Données
Le telmisartan était présent dans le lait des rates allaitantes à des concentrations 1,5 à 2 fois supérieures à celles trouvées dans le plasma de 4 à 8 heures après l'administration.
Utilisation pédiatrique
L'innocuité et l'efficacité de MICARDIS HCT chez les patients pédiatriques n'ont pas été établies.
Nouveau-nés ayant des antécédents d'exposition in utero à MICARDIS HCT
En cas d'oligurie ou d'hypotension, maintenir la tension artérielle et la perfusion rénale. Des exsanguinotransfusions ou une dialyse peuvent être nécessaires pour inverser l'hypotension et/ou remplacer les troubles de la fonction rénale.
Utilisation gériatrique
Dans les essais cliniques contrôlés (n = 1017), environ 20 % des patients traités par telmisartan/hydrochlorothiazide étaient âgés de 65 ans ou plus et 5 % avaient 75 ans ou plus. Aucune différence globale dans l'efficacité et la sécurité du telmisartan/hydrochlorothiazide n'a été observée chez ces patients par rapport aux patients plus jeunes. D'autres expériences cliniques rapportées n'ont pas identifié de différences dans les réponses entre les patients âgés et les patients plus jeunes, mais une plus grande sensibilité de certains individus plus âgés ne peut être exclue. En général, la sélection de la dose pour un patient âgé doit être prudente, en commençant généralement à l'extrémité inférieure de la plage posologique, reflétant la fréquence plus élevée de diminution de la fonction hépatique, rénale ou cardiaque et de maladies concomitantes ou d'autres traitements médicamenteux.
Utilisation chez les patients atteints d'insuffisance hépatique
Les patients présentant des troubles obstructifs des voies biliaires ou une insuffisance hépatique doivent débuter le traitement sous surveillance médicale étroite en utilisant l'association 40 mg/12,5 mg.
Telmisartan
Comme la majorité du telmisartan est éliminée par excrétion biliaire, on peut s'attendre à ce que les patients présentant des troubles obstructifs des voies biliaires ou une insuffisance hépatique aient une clairance réduite et des taux sanguins plus élevés.
Hydrochlorothiazide
Des altérations mineures de l'équilibre hydrique et électrolytique peuvent précipiter un coma hépatique chez les patients présentant une fonction hépatique altérée ou une maladie hépatique évolutive.
Utilisation chez les patients atteints d'insuffisance rénale
La sécurité et l'efficacité de MICARDIS 40 mg HCT chez les patients présentant une insuffisance rénale sévère (ClCr ≤ 30 mL/min) n'ont pas été établies. Chez les patients présentant une insuffisance rénale sévère, les comprimés MICARDIS 80mg HCT ne sont pas recommandés. Aucun ajustement posologique n'est nécessaire chez les patients présentant une insuffisance rénale légère (ClCr de 60 à 90 mL/min) ou modérée (ClCr de 30 à 60 mL/min).
SURDOSAGE
Telmisartan
Des données limitées sont disponibles concernant le surdosage de telmisartan chez l'homme. Les manifestations les plus probables d'un surdosage en telmisartan sont l'hypotension, les étourdissements et la tachycardie ; une bradycardie peut survenir à la suite d'une stimulation parasympathique (vagale). En cas d'hypotension symptomatique, un traitement de soutien doit être institué. Le telmisartan n'est pas éliminé par hémodialyse.
Hydrochlorothiazide
Les signes et symptômes les plus fréquemment observés chez les patients présentant un surdosage en hydrochlorothiazide sont ceux causés par une déplétion électrolytique (hypokaliémie, hypochlorémie, hyponatrémie) et une déshydratation résultant d'une diurèse excessive. Si de la digitaline a également été administrée, l'hypokaliémie peut accentuer les arythmies cardiaques. Le degré d'élimination de l'hydrochlorothiazide par hémodialyse n'a pas été établi. La DL orale de l'hydrochlorothiazide est supérieure à 10 g/kg chez la souris et le rat.
CONTRE-INDICATIONS
MICARDIS HCT est contre-indiqué :
- Chez les patients hypersensibles à l'un des composants de ce produit [voir AVERTISSEMENTS ET PRECAUTIONS ].
- Chez les patients souffrant d'anurie.
- Pour la co-administration avec l'aliskirène chez les patients diabétiques [voir INTERACTIONS MÉDICAMENTEUSES ].
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
MICARDIS 40mg HCT
MICARDIS 20 mg HCT est une association de deux médicaments aux propriétés antihypertensives : un diurétique thiazidique, l'hydrochlorothiazide, et un antagoniste des récepteurs de l'angiotensine II (ARA), le telmisartan.
Telmisartan
L'angiotensine II est formée à partir de l'angiotensine I dans une réaction catalysée par l'enzyme de conversion de l'angiotensine (ACE, kininase II). L'angiotensine II est le principal agent presseur du système rénine-angiotensine, avec des effets qui comprennent la vasoconstriction, la stimulation de la synthèse et de la libération d'aldostérone, la stimulation cardiaque et la réabsorption rénale du sodium. Le telmisartan bloque les effets vasoconstricteurs et sécréteurs d'aldostérone de l'angiotensine II en bloquant sélectivement la liaison de l'angiotensine II au récepteur AT1 dans de nombreux tissus, tels que les muscles lisses vasculaires et la glande surrénale. Son action est donc indépendante des voies de synthèse de l'angiotensine II.
Il existe également un récepteur AT2 trouvé dans de nombreux tissus, mais AT2 n'est pas connu pour être associé à l'homéostasie cardiovasculaire. Le telmisartan a une bien plus grande affinité (> 3 000 fois) pour le récepteur AT1 que pour le récepteur AT2.
Le telmisartan n'inhibe pas l'ECA (kininase II) et ne se lie pas ou ne bloque pas d'autres récepteurs hormonaux ou canaux ioniques connus pour être importants dans la régulation cardiovasculaire.
Le blocage du récepteur de l'angiotensine II inhibe la rétroaction régulatrice négative de l'angiotensine II sur la sécrétion de rénine, mais l'augmentation résultante de l'activité de la rénine plasmatique et des taux circulants d'angiotensine II ne surmonte pas l'effet du telmisartan sur la pression artérielle.
Hydrochlorothiazide
L'hydrochlorothiazide est un diurétique thiazidique. Les thiazides affectent les mécanismes tubulaires rénaux de la réabsorption des électrolytes, augmentant directement l'excrétion de sel de sodium et de chlorure en quantités approximativement équivalentes. Indirectement, l'action diurétique de l'hydrochlorothiazide réduit le volume plasmatique, avec pour conséquence une augmentation de l'activité de la rénine plasmatique, une augmentation de la sécrétion d'aldostérone, une augmentation de la perte urinaire de potassium et une diminution de la kaliémie. La liaison rénine-aldostérone est médiée par l'angiotensine II, de sorte que la co-administration d'un ARA tend à inverser la perte de potassium associée à ces diurétiques. Le mécanisme de l'effet antihypertenseur des thiazides n'est pas entièrement élucidé.
Pharmacodynamie
Telmisartan
Chez des volontaires sains, une dose de 80 mg de telmisartan a inhibé la réponse pressive à une perfusion intraveineuse d'angiotensine II d'environ 90 % aux concentrations plasmatiques maximales avec une inhibition d'environ 40 % persistant pendant 24 heures.
La concentration plasmatique de l'angiotensine II et l'activité de la rénine plasmatique ont augmenté de manière dose-dépendante après une administration unique de telmisartan à des sujets sains et une administration répétée à des patients hypertendus. L'administration une fois par jour de jusqu'à 80 mg de telmisartan à des sujets sains n'a pas influencé les concentrations plasmatiques d'aldostérone. Dans des études à doses multiples chez des patients hypertendus, il n'y a eu aucune modification cliniquement significative des électrolytes (kaliémie ou sodium sérique) ou de la fonction métabolique (y compris les taux sériques de cholestérol, de triglycérides, de HDL, de LDL, de glucose ou d'acide urique).
Les effets antihypertenseurs du telmisartan ont été étudiés dans six essais cliniques contrôlés contre placebo incluant un total de 1773 patients souffrant d'hypertension légère à modérée (pression artérielle diastolique de 95 à 114 mmHg), dont 1031 ont été traités par telmisartan. Suite à l'administration une fois par jour de telmisartan, l'ampleur de la réduction de la pression artérielle par rapport au départ après soustraction du placebo était d'environ (SBP/DBP) 6-8/6 mmHg pour 20 mg, 9-13/6-8 mmHg pour 40 mg et 12 -13/7-8 mmHg pour 80 mg. Des doses plus importantes (jusqu'à 160 mg) n'ont pas semblé entraîner une diminution supplémentaire de la pression artérielle.
Le début de l'activité antihypertensive se produit dans les 3 heures, avec une réduction maximale d'environ 4 semaines. Aux doses de 20, 40 et 80 mg, l'effet antihypertenseur de l'administration uniquotidienne de telmisartan s'est maintenu pendant toute la durée de l'intervalle posologique de 24 heures.
Chez 30 patients hypertendus ayant une fonction rénale normale traités pendant 8 semaines par le telmisartan 80 mg ou le telmisartan 80 mg en association avec l'hydrochlorothiazide 12,5 mg, il n'y a eu aucun changement cliniquement significatif par rapport à l'inclusion du débit sanguin rénal, du débit de filtration glomérulaire, de la fraction de filtration, de la résistance rénovasculaire, ou la clairance de la créatinine.
Hydrochlorothiazide
Après administration orale d'hydrochlorothiazide, la diurèse débute dans les 2 heures, culmine en 4 heures environ et dure environ 6 à 12 heures.
Interactions médicamenteuses
Hydrochlorothiazide
Alcool, barbituriques ou narcotiques
Une potentialisation de l'hypotension orthostatique peut survenir.
Relaxants des muscles squelettiques
Réactivité accrue possible aux myorelaxants tels que les dérivés du curare.
Corticostéroïdes, ACTH
Déplétion électrolytique intensifiée, en particulier hypokaliémie.
Amines vasopressives (p. ex. noradrénaline)
Possible diminution de la réponse aux amines vasopressives mais pas suffisante pour empêcher leur utilisation.
Pharmacocinétique
Telmisartan
Absorption:
Après administration orale, les concentrations maximales (Cmax) de telmisartan sont atteintes 0,5 à 1 heure après l'administration. La nourriture diminue légèrement la biodisponibilité du telmisartan, avec une diminution de l'aire sous la courbe concentration plasmatique en fonction du temps (ASC) d'environ 6 % avec 40 mg et d'environ 20 % après une dose de 160 mg. MICARDIS 20mg HCT peut être administré avec ou sans nourriture. La biodisponibilité absolue du telmisartan est dose-dépendante. À 40 et 160 mg, la biodisponibilité était de 42 % et 58 %, respectivement. La pharmacocinétique du telmisartan avec MICARDIS 20 mg administré par voie orale n'est pas linéaire sur l'intervalle de doses de 20 à 160 mg, avec des augmentations plus que proportionnelles des concentrations plasmatiques (Cmax et ASC) avec des doses croissantes. Le telmisartan présente une cinétique de décroissance bi-exponentielle avec une demi-vie d'élimination terminale d'environ 24 heures. Les concentrations plasmatiques minimales de telmisartan administré une fois par jour représentent environ 10 à 25 % des concentrations plasmatiques maximales. Le telmisartan a un indice d'accumulation dans le plasma de 1,5 à 2,0 lors d'administrations répétées une fois par jour.
Distribution:
Le telmisartan est fortement lié aux protéines plasmatiques (> 99,5 %), principalement l'albumine et la glycoprotéine α1-acide. La liaison aux protéines plasmatiques est constante sur la plage de concentration atteinte avec les doses recommandées. Le volume de distribution du telmisartan est d'environ 500 litres, indiquant une liaison tissulaire supplémentaire.
Métabolisme:
Le telmisartan est métabolisé par conjugaison pour former un acyl glucuronide pharmacologiquement inactif ; le glucuronide du composé parent est le seul métabolite identifié dans le plasma et l'urine humains. Après une dose unique, le glucuronide représente environ 11 % de la radioactivité mesurée dans le plasma. Les isoenzymes du cytochrome P450 ne sont pas impliquées dans le métabolisme du telmisartan.
Élimination:
Après administration intraveineuse ou orale de telmisartan marqué au 14C, la majeure partie de la dose administrée (> 97 %) a été éliminée sous forme inchangée dans les fèces par excrétion biliaire ; seules des quantités infimes ont été trouvées dans l'urine (0,91 % et 0,49 % de la radioactivité totale, respectivement).
La clairance plasmatique totale du telmisartan est > 800 mL/min. La demi-vie terminale et la clairance totale semblent être indépendantes de la dose.
Hydrochlorothiazide
L'hydrochlorothiazide n'est pas métabolisé mais est rapidement éliminé par les reins. Lorsque les taux plasmatiques ont été suivis pendant au moins 24 heures, la demi-vie plasmatique varie entre 5,6 et 14,8 heures. Au moins 61 % de la dose orale sont éliminés sous forme inchangée dans les 24 heures.
L'hydrochlorothiazide traverse la barrière placentaire mais pas la barrière hémato-encéphalique et est excrété dans le lait maternel.
Populations spécifiques
Telmisartan
Insuffisance rénale
Le telmisartan n'est pas éliminé du sang par hémofiltration [voir AVERTISSEMENTS ET PRECAUTIONS , et Utilisation dans des populations spécifiques ].
Insuffisance hépatique
Chez les insuffisants hépatiques, les concentrations plasmatiques de telmisartan sont augmentées et la biodisponibilité absolue approche les 100 % [voir Utilisation dans des populations spécifiques ].
Le genre
Les concentrations plasmatiques de telmisartan sont généralement 2 à 3 fois plus élevées chez les femmes que chez les hommes. Dans les essais cliniques, cependant, aucune augmentation significative de la réponse tensionnelle ou de l'incidence de l'hypotension orthostatique n'a été observée chez les femmes. Aucun ajustement posologique n'est nécessaire.
Patients gériatriques
La pharmacocinétique du telmisartan ne diffère pas entre les personnes âgées et les personnes de moins de 65 ans.
Études sur les interactions médicamenteuses
Telmisartan
Ramipril
La co-administration de telmisartan 80 mg une fois par jour et de ramipril 10 mg une fois par jour chez des sujets sains augmente la Cmax et l'ASC du ramipril à l'état d'équilibre de 2,3 et 2,1 fois, respectivement, et la Cmax et l'ASC du ramiprilat de 2,4 et 1,5 fois, respectivement. . En revanche, la Cmax et l'ASC du telmisartan diminuent respectivement de 31 % et 16 %. Lors de la co-administration de telmisartan et de ramipril, la réponse peut être plus importante en raison des effets pharmacodynamiques éventuellement additifs des médicaments combinés, et également en raison de l'exposition accrue au ramipril et au ramiprilat en présence de telmisartan.
Autres drogues
La co-administration de telmisartan n'a pas entraîné d'interaction cliniquement significative avec l'acétaminophène, l'amlodipine, le glyburide, la simvastatine, l'hydrochlorothiazide, la warfarine ou l'ibuprofène. Le telmisartan n'est pas métabolisé par le système du cytochrome P450 et n'a eu aucun effet in vitro sur les enzymes du cytochrome P450, à l'exception d'une certaine inhibition du CYP2C19. On ne s'attend pas à ce que le telmisartan interagisse avec les médicaments qui inhibent les enzymes du cytochrome P450 ; il ne devrait pas non plus interagir avec les médicaments métabolisés par les enzymes du cytochrome P450, à l'exception d'une éventuelle inhibition du métabolisme des médicaments métabolisés par le CYP2C19.
Etudes cliniques
Telmisartan Et Hydrochlorothiazide
Dans des essais cliniques contrôlés portant sur plus de 2500 patients hypertendus, 1017 patients ont été exposés au telmisartan (20 mg à 160 mg) et à l'hydrochlorothiazide concomitant (6,25 mg à 25 mg). Ces essais comprenaient un essai factoriel (étude 1) avec des combinaisons de telmisartan (20 mg, 40 mg, 80 mg, 160 mg ou placebo) et d'hydrochlorothiazide (6,25 mg, 12,5 mg, 25 mg et placebo). L'essai factoriel a randomisé 818 patients, dont 493 (60 %) hommes ; 596 (73 %) non-noirs et 222 (27 %) noirs ; et 143 (18 %) âgés de ≥ 65 ans (l'âge médian était de 53 ans). La pression artérielle moyenne en décubitus dorsal au départ pour la population totale était de 154/101 mmHg.
L'association de telmisartan et d'hydrochlorothiazide a entraîné des diminutions additives ajustées au placebo des pressions artérielles systolique et diastolique au creux de 16-21/9-11 mmHg pour des doses comprises entre 40 mg/12,5 mg et 80 mg/25 mg, par rapport à 9-13 /7-8 mmHg pour le telmisartan 40 mg à 80 mg en monothérapie et 4/4 mmHg pour l'hydrochlorothiazide 12,5 mg en monothérapie. L'effet antihypertenseur était indépendant de l'âge ou du sexe. Il n'y a pratiquement pas eu de modification de la fréquence cardiaque chez les patients traités par l'association de telmisartan et d'hydrochlorothiazide dans l'essai contrôlé par placebo.
Quatre autres études portant sur des patients hypertendus d'une durée d'au moins six mois ont permis l'ajout d'hydrochlorothiazide chez les patients qui n'étaient pas suffisamment contrôlés par la dose randomisée de monothérapie par telmisartan ou qui n'avaient pas obtenu de réponse tensionnelle adéquate après avoir terminé la titration du telmisartan. Dans des études contrôlées contre comparateur actif, l'ajout de 12,5 mg d'hydrochlorothiazide à des doses titrées de telmisartan chez des patients n'ayant pas obtenu ou maintenu une réponse adéquate avec le telmisartan en monothérapie a encore réduit les pressions artérielles systolique et diastolique.
INFORMATIONS PATIENTS
MICARDIS® HCT (my-CAR-dis HCT) (telmis artan et hydrochlorothiazide) Comprimés
Lisez ces informations patient avant de commencer à prendre les comprimés MICARDIS HCT et chaque fois que vous recevez une recharge. Il peut y avoir de nouvelles informations. Ces informations ne remplacent pas une discussion avec votre médecin au sujet de votre état de santé ou de votre traitement.
Quelles sont les informations les plus importantes que je devrais connaître sur les comprimés de MICARDIS 20mg HCT ?
MICARDIS HCT peut causer des lésions ou la mort d'un bébé à naître. Discutez avec votre médecin d'autres moyens d'abaisser votre tension artérielle si vous envisagez de devenir enceinte. Si vous tombez enceinte pendant que vous prenez MICARDIS 20 mg HCT, informez-en immédiatement votre médecin.
Qu'est-ce que MICARDIS HCT ?
MICARDIS 40mg HCT est un médicament délivré sur ordonnance utilisé pour traiter l'hypertension artérielle.
MICARDIS 40 mg HCT contient :
- le telmisartan, un antagoniste des récepteurs de l'angiotensine (ARB)
- hydrochlorothiazide, une pilule d'eau ou un diurétique
Votre médecin peut vous prescrire d'autres médicaments à prendre avec MICARDIS 80 mg HCT pour traiter votre hypertension artérielle.
On ne sait pas si MICARDIS 40 mg HCT est sûr et efficace chez les enfants.
Ne prenez jamais MICARDIS 20mg HCT comprimés si vous :
- avoir un débit urinaire faible ou nul
- êtes allergique (hypersensible) aux principes actifs (telmisartan ou hydrochlorothiazide) ou à l'un des autres composants mentionnés à la fin de cette notice
Que dois-je dire à mon médecin avant d'utiliser MICARDIS 40mg HCT comprimés ?
Avant de prendre MICARDIS 20mg HCT comprimés, informez votre médecin si vous :
- êtes enceinte ou planifiez une grossesse. Voir "Quelle est l'information la plus importante que je devrais connaître sur les comprimés MICARDIS 20mg HCT ?"
- allaitez ou envisagez d'allaiter. MICARDIS 80 mg HCT peut passer dans votre lait maternel et nuire à votre bébé. Vous et votre médecin devez décider si vous allez prendre MICARDIS HCT ou allaiter. Vous ne devriez pas faire les deux. Discutez avec votre médecin de la meilleure façon de nourrir votre bébé si vous prenez les comprimés MICARDIS HCT.
- on vous a dit que vous avez des niveaux anormaux de sel corporel (électrolytes) dans votre sang
- avoir des problèmes de foie
- avez de l'asthme ou des antécédents d'asthme
- avoir le lupus
- avoir le diabète
- avoir des problèmes rénaux
- avoir d'autres conditions médicales
Informez votre médecin de tous les médicaments que vous prenez, y compris les médicaments sur ordonnance et en vente libre, les vitamines et les suppléments à base de plantes. Informez également votre médecin si vous buvez de l'alcool.
MICARDIS 20 mg HCT peut affecter le fonctionnement d'autres médicaments, et d'autres médicaments peuvent affecter le fonctionnement de MICARDIS 20 mg HCT. Prévenez surtout votre médecin si vous prenez :
- aliskirène
- digoxine (Lanoxin®)
- lithium (Lithobid®, carbonate de lithium, citrate de lithium)
- autres médicaments utilisés pour traiter votre hypertension artérielle ou un problème cardiaque
- pilules d'eau (diurétique)
- aspirine ou autres anti-inflammatoires non stéroïdiens (AINS)
- suppléments de potassium ou substitut de sel contenant du potassium
- médicament utilisé pour traiter le diabète, y compris l'insuline
- analgésiques narcotiques
- somnifères
- médicament stéroïdien ou hormone corticotrope (ACTH)
- barbituriques
- certains médicaments hypocholestérolémiants (résines utilisées pour réduire le cholestérol, par exemple, les résines de cholestyramine et de colestipol)
Demandez à votre médecin si vous n'êtes pas sûr de prendre l'un des médicaments énumérés ci-dessus.
Connaissez les médicaments que vous prenez. Conservez-en une liste et montrez-la à votre médecin ou à votre pharmacien lorsque vous recevez un nouveau médicament.
Comment dois-je prendre les comprimés MICARDIS HCT ?
- Prenez les comprimés MICARDIS 40mg HCT exactement comme votre médecin vous l'a dit.
- Votre médecin vous dira quelle quantité de MICARDIS HCT prendre et quand le prendre.
- Ne modifiez pas votre dose à moins que votre médecin ne vous le dise.
- Prenez MICARDIS HCT une fois par jour.
- Prenez les comprimés MICARDIS 20mg HCT avec ou sans nourriture.
- Si vous avez pris trop de MICARDIS HCT, appelez votre médecin ou rendez-vous immédiatement aux urgences de l'hôpital le plus proche.
- Lis le "Comment ouvrir le blister" à la fin de cette notice avant d'utiliser MICARDIS 20mg HCT. Discutez avec votre médecin si vous ne comprenez pas les instructions.
Quels sont les effets secondaires possibles des comprimés MICARDIS 80mg HCT ?
Les comprimés MICARDIS 20 mg HCT peuvent provoquer des effets indésirables graves, notamment :
- Blessure ou décès de votre bébé à naître. Voir "Quelle est l'information la plus importante que je devrais connaître sur les comprimés MICARDIS HCT ?"
- Pression artérielle basse (hypotension) est plus susceptible de se produire si vous :
- prendre des pilules d'eau (diurétiques)
- suivent un régime pauvre en sel
- obtenir des traitements de dialyse
- avoir des problèmes cardiaques
- tomber malade avec des vomissements ou de la diarrhée
- ne buvez pas assez de liquides
- transpire beaucoup
- Problèmes rénaux , qui peut s'aggraver si vous souffrez déjà d'une maladie rénale. Vous pouvez avoir des changements dans les résultats de vos tests rénaux et vous pourriez avoir besoin d'une dose plus faible de comprimés MICARDIS 40 mg HCT. Appelez votre médecin si vous avez :
- gonflement des pieds, des chevilles ou des mains
- prise de poids inexpliquée
- Problèmes de foie, qui peut s'aggraver chez les personnes qui ont déjà des problèmes de foie et qui prennent MICARDIS 40 mg HCT.
- Problèmes oculaires. L'un des médicaments contenus dans MICARDIS HCT peut provoquer des problèmes oculaires pouvant entraîner une perte de vision. Les symptômes de problèmes oculaires peuvent survenir quelques heures à quelques semaines après le début de MICARDIS
HCT. Informez immédiatement votre médecin si vous avez :
- diminution de la vision
- douleur oculaire
- Réactions allergiques. Informez immédiatement votre médecin si vous présentez l'un de ces symptômes :
- gonflement du visage, de la langue, de la gorge
- difficulté à respirer
- Aggravation du lupus . Informez votre médecin si votre lupus s'aggrave ou devient actif pendant que vous prenez MICARDIS 20 mg HCT.
- Modification du niveau de sels corporels (électrolytes) dans vos problèmes sanguins et liquidiens . Votre médecin peut faire des tests pour vérifier votre sang. Appelez immédiatement votre médecin si vous avez :
- bouche sèche
- la soif
- fatigue
- envie de dormir
- agitation
- confusion
- convulsions
- battements de coeur rapides
- la faiblesse
- douleurs musculaires ou crampes
- très faible débit urinaire
- nausées ou vomissements
Si vous vous sentez faible ou étourdi, allongez-vous et appelez immédiatement votre médecin.
Appelez immédiatement votre médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants des comprimés MICARDIS 80mg HCT incluent:
- infections des voies respiratoires supérieures, y compris douleur/congestion des sinus et mal de gorge
- vertiges
- se sentir fatigué
- symptômes pseudo-grippaux
- mal au dos
- diarrhée
- nausée
Ce ne sont pas tous les effets secondaires possibles avec les comprimés MICARDIS 20mg HCT. Dites à votre médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas. Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
Comment conserver les comprimés MICARDIS 80mg HCT ?
- Conservez les comprimés MICARDIS HCT à température ambiante entre 68 °F et 77 °F (20 °C et 25 °C).
- Ne retirez les comprimés MICARDIS 40mg HCT des plaquettes que juste avant de les prendre.
Conservez les comprimés MICARDIS 80 mg HCT et tous les médicaments hors de la portée des enfants.
Informations générales sur les comprimés MICARDIS 40mg HCT :
Les médicaments sont parfois prescrits à des fins autres que celles énumérées dans une notice d'information destinée aux patients. N'utilisez pas les comprimés MICARDIS HCT pour une affection pour laquelle il n'a pas été prescrit. Ne donnez pas les comprimés MICARDIS 20mg HCT à d'autres personnes, même si elles ont la même maladie que vous. Cela peut leur nuire.
Cette notice d'information destinée aux patients résume les informations les plus importantes sur les comprimés MICARDIS HCT. Si vous souhaitez plus d'informations, parlez-en à votre médecin. Vous pouvez demander à votre pharmacien ou à votre médecin des informations sur les comprimés MICARDIS 20mg HCT destinés aux professionnels de la santé.
Pour les informations de prescription actuelles, scannez le code ci-dessous ou appelez Boehringer Ingelheim Pharmaceuticals, Inc. au 1-800-542-6257 ou (TTY) 1-800-459-9906.
Quels sont les ingrédients des comprimés MICARDIS 20mg HCT ?
Ingrédients actifs : telmisartan et hydrochlorothiazide
Ingrédients inactifs : hydroxyde de sodium, méglumine, povidone, sorbitol, stéarate de magnésium, lactose monohydraté, cellulose microcristalline, amidon de maïs et glycolate d'amidon sodique
Les comprimés à 40 mg/12,5 mg et à 80 mg/12,5 mg contiennent également : oxyde de fer rouge.
Les comprimés à 80 mg/25 mg contiennent également : oxyde de fer jaune.
Qu'est-ce que l'hypertension artérielle (hypertension) ?
La tension artérielle est la force dans vos vaisseaux sanguins lorsque votre cœur bat et lorsque votre cœur se repose. Vous avez une pression artérielle élevée lorsque la force est trop forte. Les médicaments qui abaissent votre tension artérielle réduisent votre risque d'avoir un accident vasculaire cérébral ou une crise cardiaque.
L'hypertension artérielle oblige le cœur à travailler plus fort pour pomper le sang dans le corps et endommage les vaisseaux sanguins. Les comprimés MICARDIS 80mg HCT peuvent aider vos vaisseaux sanguins à se détendre afin que votre tension artérielle soit plus basse.
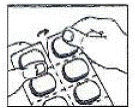
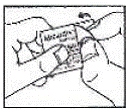
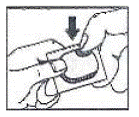
Comment ouvrir le blister :
Ces informations destinées aux patients ont été approuvées par la Food and Drug Administration des États-Unis.
