Nimotop 30mg Nimodipine Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Nimotop 30 mg et comment est-il utilisé ?
Nimotop est un médicament d'ordonnance utilisé pour traiter les symptômes de l'anévrisme (hémorragie sous-arachnoïdienne). Nimotop peut être utilisé seul ou avec d'autres médicaments.
Nimotop appartient à une classe de médicaments appelés bloqueurs des canaux calciques ; Neurologiques, Autres ; Bloqueurs des canaux calciques, dihydrophyridine.
On ne sait pas si Nimotop 30 mg est sûr et efficace chez les enfants.
Quels sont les effets secondaires possibles de Nimotop ?
Nimotop peut provoquer des effets secondaires graves, notamment :
- urticaire,
- difficulté à respirer,
- gonflement du visage, des lèvres, de la langue ou de la gorge,
- étourdissement,
- rythme cardiaque rapide ou lent, et
- gonflement ou vos chevilles ou vos pieds
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Nimotop incluent :
- pression artérielle basse (sensation de tête légère),
- nausée,
- maux d'estomac,
- rythme cardiaque lent et
- douleur musculaire
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Nimotop. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
NE PAS ADMINISTRER NIMOTOP (nimodipine) PAR VOIE INTRAVEINEUSE OU PAR D'AUTRES VOIES PARENTÉRALES. DES DÉCÈS ET DES ÉVÉNEMENTS INDÉSIRABLES GRAVES MENAÇANT LA VIE SE SONT PRODUITS LORSQUE LE CONTENU DES CAPSULES DE NIMOTOP (nimodipine) A ÉTÉ INJECTÉ PAR PARENTÉRALE (Voir MISES EN GARDE et POSOLOGIE ET ADMINISTRATION).
LA DESCRIPTION
Nimotop® (nimodipine) appartient à la classe d'agents pharmacologiques appelés inhibiteurs calciques. La nimodipine est l'isopropyl 2 - méthoxyéthyl 1, 4 - dihydro - 2, 6 - diméthyl - 4 - (m-nitrophényl) - 3, 5 - pyridinedicarboxylate. Il a un poids moléculaire de 418,5 et une formule moléculaire de C21H26N2O7. La formule structurale est :
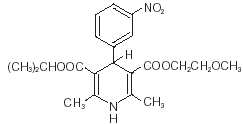
La nimodipine est une substance cristalline jaune, pratiquement insoluble dans l'eau.
Les capsules NIMOTOP® (nimodipine) sont formulées sous forme de capsules de gélatine molle pour administration orale. Chaque capsule remplie de liquide contient 30 mg de nimodipine dans un véhicule de glycérine, d'huile de menthe poivrée, d'eau purifiée et de polyéthylène glycol 400. L'enveloppe de la capsule de gélatine molle contient de la gélatine, de la glycérine, de l'eau purifiée et du dioxyde de titane.
LES INDICATIONS
Nimotop® (nimodipine) est indiqué pour l'amélioration des résultats neurologiques en réduisant l'incidence et la sévérité des déficits ischémiques chez les patients présentant une hémorragie sous-arachnoïdienne due à la rupture d'anévrismes intracrâniens de la baie, quel que soit leur état neurologique post-ictus (c.-à-d. Hunt et Hess Grades IV).
DOSAGE ET ADMINISTRATION
NE PAS ADMINISTRER LES CAPSULES DE NIMOTOP (nimodipine) PAR VOIE INTRAVEINEUSE OU PAR D'AUTRES VOIES PARENTÉRALES (voir MISES EN GARDE). Si Nimotop (nimodipine) est administré par inadvertance par voie intraveineuse, une hypotension cliniquement significative peut nécessiter un soutien cardiovasculaire avec des agents vasopresseurs. Des traitements spécifiques en cas de surdosage d'inhibiteurs calciques doivent également être administrés rapidement.
Nimotop (nimodipine) est administré par voie orale sous forme de capsules de gélatine molle de couleur ivoire de 30 mg pour l'hémorragie sous-arachnoïdienne.
La dose orale est de 60 mg (deux gélules de 30 mg) toutes les 4 heures pendant 21 jours consécutifs, de préférence au moins une heure avant ou deux heures après les repas. Le traitement par Nimotop® (nimodipine) par voie orale doit commencer dans les 96 heures suivant l'hémorragie sous-arachnoïdienne.
Si la gélule ne peut pas être avalée, par exemple au moment de l'intervention chirurgicale, ou si le patient est inconscient, un trou doit être percé aux deux extrémités de la gélule avec une aiguille de calibre 18 et le contenu de la gélule doit être extrait dans une seringue. Une seringue parentérale peut être utilisée pour extraire le liquide à l'intérieur de la capsule, mais le liquide doit toujours être transféré dans une seringue qui ne peut pas recevoir d'aiguille et qui est conçue pour une administration par voie orale ou via une sonde naso-gastrique ou un PEG. Pour aider à minimiser les erreurs d'administration, il est recommandé que la seringue utilisée pour l'administration soit étiquetée « Ne pas utiliser en IV ». Le contenu doit ensuite être vidé dans la sonde naso-gastrique in situ du patient et lavé dans la sonde avec 30 mL de solution saline normale (0,9 %). L'efficacité et la sécurité de ce mode d'administration n'ont pas été démontrées dans des essais cliniques.
Les patients atteints de cirrhose hépatique ont une clairance considérablement réduite et une Cmax environ doublée. La posologie doit être réduite à 30 mg toutes les 4 heures, avec une surveillance étroite de la pression artérielle et de la fréquence cardiaque.
COMMENT FOURNIE
Chaque capsule de gélatine molle de couleur ivoire NIMOTOP® (nimodipine) porte le mot Nimotop 30 mg et contient 30 mg de nimodipine. Les gélules de 30 mg sont conditionnées dans des sachets en aluminium à dose unitaire et fournies dans des cartons contenant 100 gélules. Le produit est également disponible dans des sachets en aluminium à dose unitaire à l'épreuve des enfants contenant 30 gélules par carton. Les gélules doivent être conservées dans l'emballage en aluminium d'origine du fabricant à 25 °C (77 °F), des excursions autorisées jusqu'à 15-30 °C (59-86 °F) [voir USP à température ambiante contrôlée].
Les gélules doivent être protégées de la lumière et du gel.
Distribué par : Bayer Pharmaceuticals Corporation, 400 Morgan Lane, West Haven, CT 06516. Fabriqué par : Catalent Pharma Solutions St. Petersburg, FL 33716. Date de révision FDA : 1/20/2006
EFFETS SECONDAIRES
Des effets indésirables ont été signalés par 92 des 823 patients atteints d'hémorragie sous-arachnoïdienne (11,2 %) qui ont reçu de la nimodipine. L'effet indésirable le plus fréquemment rapporté était une diminution de la tension artérielle chez 4,4 % de ces patients. Vingt-neuf des 479 (6,1 %) patients traités par placebo ont également signalé des effets indésirables. Les événements rapportés avec une fréquence supérieure à 1 % sont présentés ci-dessous par dose.
DOSE q4h Nombre de patients (%) Nimodipine
Aucun autre effet indésirable n'a été rapporté par les patients ayant reçu 0,35 mg/kg q4h, 30 mg q4h ou 120 mg q4h. Les effets indésirables avec un taux d'incidence inférieur à 1 % dans le groupe recevant la dose de 60 mg q4h étaient : hépatite ; démangeaison; hémorragie gastro-intestinale; thrombocytopénie; anémie; palpitations; vomissement; rinçage; diaphorèse; respiration sifflante; toxicité de la phénytoïne; étourdissements; vertiges; vasospasme de rebond ; jaunisse; hypertension; hématome.
Les effets indésirables avec un taux d'incidence inférieur à 1 % dans le groupe recevant la dose de 90 mg q4h étaient : démangeaisons, hémorragie gastro-intestinale ; thrombocytopénie; détérioration neurologique; vomissement; diaphorèse; insuffisance cardiaque congestive; hyponatrémie; diminution du nombre de plaquettes ; coagulation intravasculaire disséminée; thrombose veineuse profonde.
Comme on peut le voir dans le tableau, les effets secondaires qui semblent liés à l'utilisation de la nimodipine sur la base d'une incidence accrue avec une dose plus élevée ou un taux plus élevé par rapport au contrôle placebo, comprenaient une diminution de la pression artérielle, des œdèmes et des maux de tête qui sont des actions pharmacologiques connues des inhibiteurs calciques. Il convient de noter, cependant, que l'HSA s'accompagne fréquemment d'altérations de la conscience qui conduisent à une sous-déclaration des expériences indésirables. Les patients qui ont reçu de la nimodipine dans les essais cliniques pour d'autres indications ont signalé des bouffées vasomotrices (2,1 %), des maux de tête (4,1 %) et une rétention hydrique (0,3 %), des réponses typiques aux inhibiteurs calciques. En tant qu'inhibiteur calcique, la nimodipine peut avoir le potentiel d'exacerber l'insuffisance cardiaque chez les patients sensibles ou d'interférer avec la conduction AV, mais ces événements n'ont pas été observés.
Aucun effet cliniquement significatif sur les facteurs hématologiques, la fonction rénale ou hépatique ou le métabolisme des glucides n'a été causalement associé à la nimodipine orale. Des cas isolés de taux élevés de glucose sérique non à jeun (0,8 %), de taux élevés de LDH (0,4 %), de diminution du nombre de plaquettes (0,3 %), de taux élevés de phosphatase alcaline (0,2 %) et de taux élevés de SGPT (0,2 %) ont été signalés. rarement.

Toxicomanie et dépendance
Aucun cas de toxicomanie ou de dépendance à Nimotop® (nimodipine) n'a été signalé.
INTERACTIONS MÉDICAMENTEUSES
Il est possible que l'action cardiovasculaire d'autres inhibiteurs calciques soit renforcée par l'ajout de Nimotop® (nimodipine).
En Europe, il a été observé que Nimotop® (nimodipine) renforçait occasionnellement l'effet de composés antihypertenseurs pris de manière concomitante par des patients souffrant d'hypertension ; ce phénomène n'a pas été observé dans les essais cliniques nord-américains.
Une étude menée sur huit volontaires sains a montré une augmentation de 50 % des concentrations plasmatiques maximales moyennes de nimodipine et une augmentation de 90 % de l'aire moyenne sous la courbe, après une cure d'une semaine de cimétidine à 1 000 mg/jour et de nimodipine à 90 mg/jour. . Cet effet peut être médié par l'inhibition connue du cytochrome hépatique P-450 par la cimétidine, qui pourrait diminuer le métabolisme de premier passage de la nimodipine.
AVERTISSEMENTS
DÉCÈS DÛ À L'ADMINISTRATION INTRAVEINEUSE PAR INADVERTANCE : NE PAS ADMINISTRER NIMOTOP (nimodipine) PAR VOIE INTRAVEINEUSE OU PAR D'AUTRES VOIES PARENTÉRALES. DES DÉCÈS ET DES ÉVÉNEMENTS INDÉSIRABLES GRAVES MENAÇANT LA VIE, Y COMPRIS L'ARRÊT CARDIAQUE, L'EFFONDREMENT CARDIO-VASCULAIRE, L'HYPOTENSION ET LA BRADYCARDIE, SE SONT PRODUITS LORSQUE LE CONTENU DES CAPSULES DE NIMOTOP (nimodipine) A ÉTÉ INJECTÉ PAR VOIE PARENTÉRALE (VOIR POSOLOGIE ET ADMINISTRATION).
PRÉCAUTIONS
Général: Tension artérielle : la nimodipine a les effets hémodynamiques attendus d'un inhibiteur calcique, bien qu'ils ne soient généralement pas marqués. Cependant, l'administration intraveineuse du contenu des capsules Nimotop (nimodipine) a entraîné de graves conséquences indésirables, notamment la mort, un arrêt cardiaque, un collapsus cardiovasculaire, une hypotension et une bradycardie. Chez les patients atteints d'hémorragie sous-arachnoïdienne ayant reçu Nimotop® (nimodipine) dans les études cliniques, environ 5 % ont présenté une baisse de la pression artérielle et environ 1 % ont quitté l'étude à cause de cela (tous n'ont pas pu être attribués à la nimodipine). Néanmoins, la pression artérielle doit être étroitement surveillée pendant le traitement par Nimotop® (nimodipine) sur la base de sa pharmacologie connue et des effets connus des inhibiteurs calciques. (voir AVERTISSEMENTS et DOSAGE ET ADMINISTRATION )
Maladie hépatique : Le métabolisme de Nimotop® (nimodipine) est diminué chez les patients présentant une fonction hépatique altérée. Ces patients doivent faire surveiller étroitement leur tension artérielle et leur pouls et recevoir une dose plus faible (voir DOSAGE ET ADMINISTRATION ).
De rares cas de pseudo-obstruction intestinale et d'iléus ont été rapportés chez des patients traités par la nimodipine. Une relation causale n'a pas été établie. La condition a répondu à une gestion conservatrice.
Interactions avec les tests de laboratoire : Aucun connu.
Carcinogenèse, mutagenèse, altération de la fertilité : Dans une étude de deux ans, des incidences plus élevées d'adénocarcinome de l'utérus et d'adénome à cellules de Leydig des testicules ont été observées chez des rats ayant reçu un régime alimentaire contenant 1800 ppm de nimodipine (équivalant à 91 à 121 mg/kg/jour de nimodipine) que chez les témoins placebo. . Cependant, les différences n'étaient pas statistiquement significatives et les taux les plus élevés se situaient bien dans la plage de contrôle historique pour ces tumeurs dans la souche Wistar.
La nimodipine s'est avérée non cancérogène dans une étude de 91 semaines chez la souris, mais la dose élevée de 1800 ppm de nimodipine dans l'alimentation (546 à 774 mg/kg/jour) a raccourci l'espérance de vie des animaux. Les études de mutagénicité, y compris les tests d'Ames, du micronoyau et de la létalité dominante se sont révélées négatives. La nimodipine n'a pas altéré la fertilité et les performances reproductives générales des rats Wistar mâles et femelles après des doses orales allant jusqu'à 30 mg/kg/jour lorsqu'elles ont été administrées quotidiennement pendant plus de 10 semaines chez les mâles et 3 semaines chez les femelles avant l'accouplement et en continu. au jour 7 de la grossesse. Cette dose chez un rat est environ 4 fois la dose clinique équivalente de 60 mg q4h chez un patient de 50 kg.
Grossesse: Catégorie de grossesse C. Il a été démontré que la nimodipine a un effet tératogène chez les lapins himalayens. Les incidences de malformations et de fœtus rabougris ont augmenté aux doses orales de 1 et 10 mg/kg/jour administrées (par gavage) du jour 6 au jour 18 de la grossesse, mais pas à 3,0 mg/kg/jour dans l'une des deux études identiques chez le lapin. Dans la deuxième étude, une incidence accrue de fœtus rabougris a été observée à 1,0 mg/kg/jour, mais pas à des doses plus élevées. La nimodipine était embryotoxique, provoquant une résorption et un retard de croissance des fœtus chez des rats Long Evans à raison de 100 mg/kg/jour administrés par gavage du jour 6 au jour 15 de la grossesse. Dans deux autres études chez le rat, des doses de 30 mg/kg/jour de nimodipine administrées par gavage à partir du 16e jour de gestation et poursuivies jusqu'au sacrifice (jour 20 de la grossesse ou jour 21 post-partum) ont été associées à des incidences plus élevées de variations squelettiques, de fœtus rabougris et de mortinaissances mais pas de malformations. Il n'y a pas d'études adéquates et bien contrôlées chez les femmes enceintes pour évaluer directement l'effet sur les fœtus humains. La nimodipine ne doit être utilisée pendant la grossesse que si le bénéfice potentiel justifie le risque potentiel pour le fœtus.
Mères allaitantes : Il a été démontré que la nimodipine et/ou ses métabolites apparaissent dans le lait de rat à des concentrations beaucoup plus élevées que dans le plasma maternel. On ne sait pas si le médicament est excrété dans le lait maternel. Étant donné que de nombreux médicaments sont excrétés dans le lait maternel, il est conseillé aux mères qui allaitent de ne pas allaiter leur bébé lorsqu'elles prennent le médicament.
Utilisation pédiatrique : La sécurité et l'efficacité chez les enfants n'ont pas été établies.
Utilisation gériatrique : Les études cliniques sur la nimodipine n'ont pas inclus un nombre suffisant de sujets âgés de 65 ans et plus pour déterminer s'ils répondent différemment des sujets plus jeunes. L'autre expérience clinique annoncée n'a pas identifié de différences dans les réponses entre les patients assez âgés et plus jeunes. En général, la posologie chez les patients âgés doit être prudente, reflétant la plus grande fréquence de diminution de la fonction hépatique, rénale ou cardiaque, et de maladie concomitante ou d'un autre traitement médicamenteux.
SURDOSAGE
Il n'y a eu aucun rapport de surdosage suite à l'administration orale de Nimotop® (nimodipine). On s'attendrait à ce que les symptômes de surdosage soient liés à des effets cardiovasculaires tels qu'une vasodilatation périphérique excessive avec une hypotension systémique marquée. Une hypotension cliniquement significative due à un surdosage de Nimotop® (nimodipine) peut nécessiter un soutien cardiovasculaire actif avec des agents vasopresseurs. Des traitements spécifiques en cas de surdosage d'inhibiteurs calciques doivent également être administrés rapidement. Étant donné que Nimotop® (nimodipine) est fortement lié aux protéines, la dialyse ne devrait pas être bénéfique.
CONTRE-INDICATIONS
Aucun connu.
PHARMACOLOGIE CLINIQUE
Mécanisme d'action : La nimodipine est un inhibiteur calcique. Les processus contractiles des cellules musculaires lisses dépendent des ions calcium, qui pénètrent dans ces cellules lors de la dépolarisation sous forme de courants transmembranaires ioniques lents. La nimodipine inhibe le transfert des ions calcium dans ces cellules et inhibe ainsi les contractions des muscles lisses vasculaires. Dans les expérimentations animales, la nimodipine a eu un effet plus important sur les artères cérébrales que sur les artères ailleurs dans le corps, peut-être parce qu'elle est hautement lipophile, lui permettant de traverser la barrière hémato-encéphalique ; des concentrations de nimodipine aussi élevées que 12,5 ng/mL ont été détectées dans le liquide céphalo-rachidien de patients atteints d'hémorragie sous-arachnoïdienne (HSA) traités à la nimodipine. Le mécanisme d'action précis de la nimodipine chez l'homme n'est pas connu. Bien que les études cliniques décrites ci-dessous démontrent un effet favorable de la nimodipine sur la sévérité des déficits neurologiques causés par le vasospasme cérébral suite à l'HSA, il n'existe aucune preuve artériographique que le médicament prévienne ou soulage le spasme de ces artères. Cependant, on ne sait pas si la méthodologie artériographique utilisée était adéquate pour détecter un effet cliniquement significatif, le cas échéant, sur le vasospasme.
Pharmacocinétique et Métabolisme : Chez l'homme, la nimodipine est rapidement absorbée après administration orale et les concentrations maximales sont généralement atteintes en une heure. La demi-vie d'élimination terminale est d'environ 8 à 9 heures, mais les vitesses d'élimination antérieures sont beaucoup plus rapides, équivalant à une demi-vie de 1 à 2 heures; une conséquence est la nécessité d'administrations fréquentes (toutes les 4 heures). Il n'y avait aucun signe d'accumulation lorsque la nimodipine était administrée trois fois par jour pendant sept jours. La nimodipine est liée à plus de 95 % aux protéines plasmatiques. La liaison était indépendante de la concentration sur la plage de 10 ng/mL à 10 µg/mL. La nimodipine est éliminée presque exclusivement sous forme de métabolites et moins de 1 % est récupérée dans les urines sous forme inchangée. De nombreux métabolites, tous inactifs ou considérablement moins actifs que le composé parent, ont été identifiés. En raison d'un métabolisme de premier passage élevé, la biodisponibilité de la nimodipine est en moyenne de 13 % après administration orale. La biodisponibilité est significativement augmentée chez les patients atteints de cirrhose hépatique, avec une Cmax environ le double de celle des normaux, ce qui nécessite une diminution de la dose dans ce groupe de patients (voir DOSAGE ET ADMINISTRATION ). Dans une étude portant sur 24 hommes volontaires en bonne santé, l'administration de gélules de nimodipine après un petit-déjeuner standard a entraîné une diminution de 68 % de la concentration plasmatique maximale et une diminution de 38 % de la biodisponibilité par rapport à l'administration à jeun.
Dans une seule étude en groupes parallèles impliquant 24 sujets âgés (âgés de 59 à 79 ans) et 24 sujets plus jeunes (âgés de 22 à 40 ans), l'ASC et la Cmax observées de la nimodipine étaient environ 2 fois plus élevées dans la population âgée par rapport à l'étude plus jeune. sujets après administration orale (administrée en une dose unique de 30 mg et dosée à l'état d'équilibre avec 30 mg tid pendant 6 jours). Cependant, la réponse clinique à ces différences pharmacocinétiques liées à l'âge n'a pas été considérée comme significative. (Voir PRÉCAUTIONS : Utilisation gériatrique.)
Essais cliniques: Il a été démontré que la nimodipine, dans 4 essais randomisés, en double aveugle et contrôlés par placebo, réduisait la sévérité des déficits neurologiques résultant du vasospasme chez les patients ayant eu récemment une hémorragie sous-arachnoïdienne (HSA). Les essais ont utilisé des doses allant de 20 à 30 mg à 90 mg toutes les 4 heures, le médicament étant administré pendant 21 jours dans 3 études et pendant au moins 18 jours dans l'autre. Trois des quatre essais ont suivi des patients pendant 3 à 6 mois. Trois des essais ont étudié des patients relativement bien portants, avec tous ou la plupart des patients dans les grades Hunt et Hess I à III (essentiellement exempts de déficits focaux après le saignement initial) le quatrième a étudié des patients beaucoup plus malades, les grades Hunt et Hess III - V. Deux études , un américain, un français, étaient de conception similaire, avec des patients atteints d'HSA relativement intacts randomisés pour recevoir de la nimodipine ou un placebo. Dans chacun, un jugement a été porté sur la question de savoir si un déficit de développement tardif était dû à un spasme ou à d'autres causes, et les déficits ont été classés. Les deux études ont montré significativement moins de déficits sévères dus aux spasmes dans le groupe nimodipine ; la deuxième étude (française) a montré moins de déficits liés aux spasmes de toutes les sévérités. Aucun effet n'a été observé sur les déficits non liés aux spasmes.
Une troisième étude de grande envergure a été réalisée au Royaume-Uni chez des patients atteints d'HSA avec tous les degrés de gravité (mais 89 % étaient dans les grades I-III). La nimodipine a été dosée à 60 mg toutes les 4 heures. Les résultats n'ont pas été définis comme liés ou non aux spasmes, mais il y a eu une réduction significative du taux global d'infarctus et de résultats neurologiques gravement invalidants à 3 mois :
Une étude canadienne a inclus des patients beaucoup plus malades (Hunt et Hess Grades III-V), qui avaient un taux élevé de décès et d'invalidité, et ont utilisé une dose de 90 mg toutes les 4 heures, mais était par ailleurs similaire aux deux premières études. L'analyse des déficits ischémiques retardés, dont beaucoup résultent de spasmes, a montré une réduction significative des déficits liés aux spasmes. Parmi les patients analysés (72 nimodipine, 82 placebo), il y avait les résultats suivants.
Lorsque les données ont été combinées pour les études canadiennes et britanniques, la différence de traitement sur le taux de réussite (c'est-à-dire une bonne récupération) sur l'échelle de résultats de Glasgow était de 25,3 % (nimodipine) contre 10,9 % (placebo) pour Hunt et Hess Grades IV ou V . Le tableau ci-dessous montre que la nimodipine tend à améliorer la bonne récupération des patients atteints d'HSA présentant un mauvais état neurologique post-ictus, tout en diminuant le nombre d'incapacités sévères et de survie végétative.
Une étude de dosage comparant des doses de 30, 60 et 90 mg a révélé un taux généralement faible de déficits neurologiques liés aux spasmes, mais aucune relation dose-réponse.
INFORMATIONS PATIENTS
Aucune information fournie. Veuillez vous référer au AVERTISSEMENTS et PRÉCAUTIONS sections.
