Cartia XT 180mg Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Cartia et comment est-il utilisé ?
Cartia est un médicament d'ordonnance utilisé pour traiter les symptômes de la douleur thoracique (angine), de l'hypertension artérielle (hypertension), de la tachycardie paroxystique supraventriculaire et de la fibrillation auriculaire (flutter). Cartia peut être utilisé seul ou avec d'autres médicaments.
Cartia appartient à une classe de médicaments appelés Antidysrhythmics, IV; Bloqueurs de canaux calciques; Bloqueurs des canaux calciques, non dihydropyridine.
Quels sont les effets secondaires possibles de Cartia ?
Cartia peut provoquer des effets secondaires graves, notamment :
- douleur thoracique,
- battements de coeur lents,
- des battements de cœur battants,
- flottant dans ta poitrine,
- étourdissement,
- gonflement,
- prise de poids rapide,
- essoufflement,
- fièvre,
- mal de gorge,
- Yeux brûlants,
- douleurs cutanées et
- éruption cutanée rouge ou violette avec cloques et desquamation
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Cartia comprennent :
- léger mal de tête,
- légers étourdissements et
- symptômes du rhume (nez bouché, éternuements, mal de gorge)
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Cartia. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
LA DESCRIPTION
Le chlorhydrate de diltiazem est un inhibiteur de l'influx cellulaire des ions calcium (bloqueur des canaux lents ou antagoniste du calcium). Chimiquement, le chlorhydrate de diltiazem est le 1,5-benzothiazépine-4(5H)one,3-(acétyloxy)-5-[2-(diméthylamino)éthyl]-2, 3-dihydro-2-(4-méthoxyphényl)-, monochlorhydrate ,(+)-cis-. La structure chimique est :
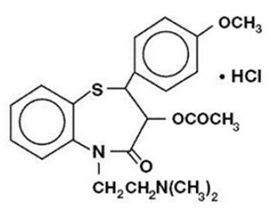
Le chlorhydrate de diltiazem est une poudre cristalline blanche à blanc cassé au goût amer. Il est soluble dans l'eau, le méthanol et le chloroforme. Il a un poids moléculaire de 450,98. La gélule à libération prolongée de chlorhydrate de diltiazem (dose une fois par jour) est formulée sous forme de gélule à libération prolongée une fois par jour contenant 120 mg, 180 mg, 240 mg ou 300 mg de chlorhydrate de diltiazem.
De plus, chaque capsule contient les ingrédients inactifs suivants : citrate d'acétyltributyle, copolymère d'ammoniométhacrylate-NF, D & C rouge #28, D & C jaune #10, D & C jaune #10 laque d'aluminium, éthylcellulose, FD & C bleu #1 Laque d'Aluminium, FD & C Bleu #2 Laque d'Aluminium, FD & C Rouge #40, FD & C Rouge #40 Laque d'Aluminium, gélatine-NF, stéarate de magnésium, copolymère d'acide méthacrylique-NF, propylène glycol, polysorbate 80-NF, amidon , saccharose, talc USP et dioxyde de titane. Les gélules de 180 mg et 240 mg contiennent de l'oxyde de fer jaune. De plus, la gélule de 240 mg contient également de l'oxyde de fer noir et de l'oxyde de fer rouge.
Pour administration orale.
Ce médicament est conforme à USP Drug Release 9.
LES INDICATIONS
Les gélules à libération prolongée de chlorhydrate de diltiazem USP (dose une fois par jour) sont indiquées pour le traitement de l'hypertension. Il peut être utilisé seul ou en association avec d'autres médicaments antihypertenseurs.
Les gélules à libération prolongée de chlorhydrate de diltiazem USP (dose une fois par jour) sont indiquées pour la prise en charge de l'angor chronique stable et de l'angor dû à un spasme de l'artère coronaire.
DOSAGE ET ADMINISTRATION
Les patients contrôlés par le diltiazem seul ou en association avec d'autres médicaments peuvent être remplacés par des gélules à libération prolongée de chlorhydrate de diltiazem USP (dose une fois par jour) à la dose quotidienne totale équivalente la plus proche. Des doses plus élevées de gélules à libération prolongée de chlorhydrate de diltiazem USP (dose une fois par jour) peuvent être nécessaires chez certains patients. Les patients doivent être étroitement surveillés. Une titration ultérieure à des doses plus élevées ou plus faibles peut être nécessaire et doit être initiée lorsque cela est cliniquement justifié. L'expérience clinique générale est limitée avec des doses supérieures à 360 mg, mais des doses allant jusqu'à 540 mg ont été étudiées dans des essais cliniques. L'incidence des effets secondaires augmente à mesure que la dose augmente avec un bloc AV du premier degré, des étourdissements et une bradycardie sinusale portant la relation la plus forte avec la dose.
Hypertension
La posologie doit être ajustée par titration aux besoins individuels du patient. Lorsqu'il est utilisé en monothérapie, les doses initiales raisonnables sont de 180 à 240 mg une fois par jour, bien que certains patients puissent répondre à des doses plus faibles. L'effet antihypertenseur maximal est généralement observé après 14 jours de traitement chronique; par conséquent, les ajustements posologiques doivent être programmés en conséquence. La gamme posologique habituelle étudiée dans les essais cliniques était de 240 à 360 mg une fois par jour. Certains patients peuvent répondre à des doses plus élevées allant jusqu'à 480 mg une fois par jour.
Angine
Les posologies pour le traitement de l'angor doivent être adaptées aux besoins de chaque patient, en commençant par une dose de 120 ou 180 mg une fois par jour. Certains patients peuvent répondre à des doses plus élevées allant jusqu'à 480 mg une fois par jour. Si nécessaire, le titrage peut être effectué sur une période de 7 à 14 jours.
Capsules à libération prolongée de chlorhydrate de diltiazem USP (dose une fois par jour)
Utilisation concomitante avec d'autres agents cardiovasculaires
COMMENT FOURNIE
REMARQUE : LE PRODUIT PEUT AVOIR UNE ODEUR.
Conditions de stockage
Conserver à 20° à 25°C (68° à 77°F) [Voir Température ambiante contrôlée USP ].
Évitez l'excès d'humidité.
Dispenser dans un récipient étanche et résistant à la lumière tel que défini dans l'USP.
Fabriqué par : Actavis Laboratories FL, Inc., Fort Lauderdale, FL 33314 États-Unis. Distribué par : Actavis Pharma, Inc., Parsippany, NJ 07054 États-Unis. Révisé : décembre 2014
EFFETS SECONDAIRES
Les effets indésirables graves ont été rares dans les études réalisées à ce jour, mais il faut reconnaître que les patients présentant une fonction ventriculaire altérée et des anomalies de la conduction cardiaque ont généralement été exclus de ces études.
Le tableau suivant présente les effets indésirables les plus fréquents signalés dans les essais contrôlés par placebo sur l'angine de poitrine et l'hypertension chez des patients recevant des gélules à libération prolongée de chlorhydrate de diltiazem (dose une fois par jour) jusqu'à 360 mg, les taux chez les patients sous placebo étant présentés à titre de comparaison.
Capsule à libération prolongée de chlorhydrate de diltiazem (une fois par jour) Essais contrôlés par placebo sur l'angine et l'hypertension combinés
Dans les essais cliniques de gélules de chlorhydrate de diltiazem à libération prolongée (dose une fois par jour), de comprimés de chlorhydrate de diltiazem et de gélules de chlorhydrate de diltiazem à libération prolongée impliquant plus de 3200 patients, les événements les plus fréquents (c'est-à-dire plus de 1 %) étaient l'œdème (4,6 %) , céphalées (4,6 %), étourdissements (3,5 %), asthénie (2,6 %), bloc AV du premier degré (2,4 %), bradycardie (1,7 %), bouffées vasomotrices (1,4 %), nausées (1,4 %) et éruption cutanée ( 1,2 %).
De plus, les événements suivants ont été rapportés peu fréquemment (moins de 1 %) dans les essais sur l'angine de poitrine ou l'hypertension :
Cardiovasculaire: Angine, arythmie, bloc AV (deuxième ou troisième degré), bloc de branche, insuffisance cardiaque congestive, anomalies de l'ECG, hypotension, palpitations, syncope, tachycardie, extrasystoles ventriculaires.
Système nerveux: Rêves anormaux, amnésie, dépression, anomalie de la marche, hallucinations, insomnie, nervosité, paresthésie, changement de personnalité, somnolence, acouphènes, tremblements.
Gastro-intestinal : Anorexie, constipation, diarrhée, bouche sèche, dysgueusie, dyspepsie, légère élévation des SGOT, SGPT, LDH et de la phosphatase alcaline (voir AVERTISSEMENTS , Lésion hépatique aiguë ), soif, vomissements, prise de poids.
Dermatologique : Pétéchies, photosensibilité, prurit, urticaire.
Autre: Amblyopie, augmentation des CPK, dyspnée, épistaxis, irritation des yeux, hyperglycémie, hyperuricémie, impuissance, crampes musculaires, congestion nasale, nycturie, douleurs ostéoarticulaires, polyurie, difficultés sexuelles.
Les événements post-commercialisation suivants ont été signalés peu fréquemment chez des patients recevant du diltiazem : pustulose exanthématique aiguë généralisée, réactions allergiques, alopécie, œdème de Quincke (y compris œdème facial ou périorbitaire), asystole, érythème polymorphe (y compris syndrome de Stevens-Johnson, nécrolyse épidermique toxique), dermatite exfoliative , symptômes extrapyramidaux, hyperplasie gingivale, anémie hémolytique, augmentation du temps de saignement, leucopénie, photosensibilité (y compris kératose lichénoïde et hyperpigmentation des zones cutanées exposées au soleil), purpura, rétinopathie, myopathie et thrombocytopénie. De plus, des événements tels que l'infarctus du myocarde ont été observés qui ne sont pas facilement distinguables de l'histoire naturelle de la maladie chez ces patients. Un certain nombre de cas bien documentés d'éruption cutanée généralisée, certains caractérisés comme une vascularite leucocytoclasique, ont été signalés. Cependant, une relation définitive de cause à effet entre ces événements et le traitement par le diltiazem n'a pas encore été établie.
Pour signaler des RÉACTIONS INDÉSIRABLES SUSPECTÉES, contactez Actavis au 1-800-272-5525 ou la FDA au 1-800-FDA-1088 ou www.fda.gov/medwatch.
INTERACTIONS MÉDICAMENTEUSES
En raison du potentiel d'effets additifs, la prudence et une titration prudente sont recommandées chez les patients recevant du diltiazem en concomitance avec d'autres agents connus pour affecter la contractilité et/ou la conduction cardiaque (voir AVERTISSEMENTS ). Des études pharmacologiques indiquent qu'il peut y avoir des effets additifs dans le prolongement de la conduction AV lors de l'utilisation concomitante de bêta-bloquants ou de digitaliques avec le diltiazem (voir AVERTISSEMENTS ).
Comme avec tous les médicaments, il faut faire preuve de prudence lors du traitement de patients avec plusieurs médicaments. Le diltiazem est à la fois un substrat et un inhibiteur du système enzymatique du cytochrome P-450 3A4. D'autres médicaments qui sont des substrats, des inhibiteurs ou des inducteurs spécifiques de ce système enzymatique peuvent avoir un impact significatif sur l'efficacité et le profil d'effets secondaires du diltiazem. Les patients prenant d'autres médicaments qui sont des substrats du CYP450 3A4, en particulier les patients atteints d'insuffisance rénale et/ou hépatique, peuvent nécessiter un ajustement posologique lors du démarrage ou de l'arrêt du diltiazem administré de manière concomitante afin de maintenir des taux sanguins thérapeutiques optimaux.
Anesthésiques
La dépression de la contractilité, de la conductivité et de l'automaticité cardiaques ainsi que la dilatation vasculaire associée aux anesthésiques peuvent être potentialisées par les inhibiteurs calciques. En cas d'utilisation concomitante, les anesthésiques et les inhibiteurs calciques doivent être titrés avec précaution.
Benzodiazépines
Des études ont montré que le diltiazem augmentait l'ASC du midazolam et du triazolam de 3 à 4 fois et la Cmax de 2 fois, par rapport au placebo. La demi-vie d'élimination du midazolam et du triazolam a également augmenté (de 1,5 à 2,5 fois) lors de la co-administration avec le diltiazem. Ces effets pharmacocinétiques observés lors de l'administration concomitante de diltiazem peuvent entraîner une augmentation des effets cliniques (p. ex., sédation prolongée) du midazolam et du triazolam.
Bêta-bloquants
Des études nationales contrôlées et non contrôlées suggèrent que l'utilisation concomitante de diltiazem et de bêtabloquants est généralement bien tolérée, mais les données disponibles ne sont pas suffisantes pour prédire les effets d'un traitement concomitant chez les patients présentant une dysfonction ventriculaire gauche ou des anomalies de la conduction cardiaque.
L'administration de chlorhydrate de diltiazem en concomitance avec du propranolol chez cinq volontaires sains a entraîné une augmentation des taux de propranolol chez tous les sujets et la biodisponibilité du propranolol a augmenté d'environ 50 %. In vitro, le propranolol semble être déplacé de ses sites de liaison par le diltiazem. Si un traitement combiné est initié ou arrêté en même temps que le propranolol, un ajustement de la dose de propranolol peut être justifié (voir AVERTISSEMENTS ).
Buspirone
Chez neuf sujets sains, le diltiazem a augmenté de manière significative l'ASC moyenne de la buspirone de 5,5 fois et la Cmax de 4,1 fois par rapport au placebo. Le T½ et le Tmax de la buspirone n'ont pas été significativement affectés par le diltiazem. Des effets renforcés et une toxicité accrue de la buspirone peuvent être possibles lors d'une administration concomitante avec le diltiazem. Des ajustements de dose ultérieurs peuvent être nécessaires lors de la co-administration et doivent être basés sur une évaluation clinique.
Carbamazépine
L'administration concomitante de diltiazem et de carbamazépine a entraîné une élévation des taux sériques de carbamazépine (40 % à 72 % d'augmentation), entraînant une toxicité dans certains cas. Les patients recevant ces médicaments simultanément doivent être surveillés pour une éventuelle interaction médicamenteuse.
Cimétidine
Une étude menée sur six volontaires sains a montré une augmentation significative des concentrations plasmatiques maximales de diltiazem (58 %) et de l'aire sous la courbe (53 %) après une cure d'une semaine de cimétidine à raison de 1 200 mg par jour et une dose unique de diltiazem 60 mg. La ranitidine a produit des augmentations plus petites et non significatives. L'effet peut être médié par l'inhibition connue de la cimétidine du cytochrome hépatique P-450, le système enzymatique responsable du métabolisme de premier passage du diltiazem. Les patients recevant actuellement un traitement par le diltiazem doivent être étroitement surveillés afin de détecter toute modification de l'effet pharmacologique lors de l'initiation et de l'arrêt du traitement par la cimétidine. Un ajustement de la dose de diltiazem peut être justifié.
Clonidine
Une bradycardie sinusale entraînant une hospitalisation et l'insertion d'un stimulateur cardiaque a été rapportée en association avec l'utilisation concomitante de clonidine et de diltiazem. Surveiller la fréquence cardiaque chez les patients recevant simultanément du diltiazem et de la clonidine.
Ciclosporine
Une interaction pharmacocinétique entre le diltiazem et la cyclosporine a été observée au cours d'études impliquant des patients transplantés rénaux et cardiaques. Chez les greffés rénaux et cardiaques, une réduction de la dose de cyclosporine allant de 15 % à 48 % a été nécessaire pour maintenir des concentrations minimales de cyclosporine similaires à celles observées avant l'ajout de diltiazem. Si ces agents doivent être administrés simultanément, les concentrations de cyclosporine doivent être surveillées, en particulier lors de l'instauration, de l'ajustement ou de l'arrêt du traitement par le diltiazem.

L'effet de la cyclosporine sur les concentrations plasmatiques de diltiazem n'a pas été évalué.
Digitale
L'administration de diltiazem avec de la digoxine chez 24 sujets sains de sexe masculin a augmenté les concentrations plasmatiques de digoxine d'environ 20 %. Un autre chercheur n'a trouvé aucune augmentation des niveaux de digoxine chez 12 patients atteints de maladie coronarienne. Étant donné qu'il y a eu des résultats contradictoires concernant l'effet des niveaux de digoxine, il est recommandé de surveiller les niveaux de digoxine lors de l'initiation, de l'ajustement et de l'arrêt du traitement par le diltiazem afin d'éviter une éventuelle sur- ou sous-numérisation (voir AVERTISSEMENTS ).
Quinidine
Le diltiazem augmente significativement l'ASC(0-→) de la quinidine de 51 %, la T½ de 36 % et diminue sa CL orale de 33 %. La surveillance des effets indésirables de la quinidine peut être justifiée et la dose ajustée en conséquence.
Rifampine
L'administration concomitante de rifampicine et de diltiazem a réduit les concentrations plasmatiques de diltiazem à des niveaux indétectables. L'administration concomitante de diltiazem et de rifampicine ou de tout inducteur connu du CYP3A4 doit être évitée dans la mesure du possible et un traitement alternatif doit être envisagé.
Statines
Le diltiazem est un inhibiteur du CYP3A4 et il a été démontré qu'il augmente significativement l'ASC de certaines statines. Le risque de myopathie et de rhabdomyolyse avec les statines métabolisées par le CYP3A4 peut être augmenté en cas d'utilisation concomitante de diltiazem. Lorsque cela est possible, utilisez une statine non métabolisée par le CYP3A4 avec du diltiazem ; sinon, des ajustements de dose pour le diltiazem et la statine doivent être envisagés ainsi qu'une surveillance étroite des signes et symptômes de tout événement indésirable lié aux statines.
Dans une étude croisée sur des volontaires sains (N = 10), la co-administration d'une dose unique de 20 mg de simvastatine à la fin d'un traitement de 14 jours avec 120 mg de diltiazem SR deux fois par jour a entraîné une augmentation de 5 fois de l'ASC moyenne de la simvastatine par rapport à la simvastatine seul. Les sujets avec des expositions moyennes accrues à l'état d'équilibre au diltiazem ont montré une plus grande augmentation de l'exposition à la simvastatine. Des simulations informatiques ont montré qu'à une dose quotidienne de 480 mg de diltiazem, une augmentation moyenne de 8 à 9 fois de l'ASC de la simvastatine peut être attendue. Si l'administration concomitante de simvastatine et de diltiazem est nécessaire, limiter les doses quotidiennes de simvastatine à 10 mg et de diltiazem à 240 mg.
Dans une étude randomisée, ouverte et croisée à 4 voies portant sur dix sujets, la co-administration de diltiazem (120 mg de diltiazem deux fois par jour SR pendant 2 semaines) avec une dose unique de 20 mg de lovastatine a entraîné une augmentation de 3 à 4 fois de la moyenne ASC de la lovastatine et par rapport à la lovastatine seule. Dans la même étude, il n'y a pas eu de changement significatif de l'ASC de la pravastatine à dose unique de 20 mg et pendant l'administration concomitante de diltiazem. Les taux plasmatiques de diltiazem n'ont pas été significativement affectés par la lovastatine ou la pravastatine.
AVERTISSEMENTS
Conduction cardiaque
Le diltiazem prolonge les périodes réfractaires du nœud AV sans prolonger de manière significative le temps de récupération du nœud sinusal, sauf chez les patients atteints de maladie du sinus. Cet effet peut rarement entraîner des fréquences cardiaques anormalement lentes (en particulier chez les patients atteints de maladie du sinus) ou un bloc AV du deuxième ou du troisième degré (13 patients sur 3290 ou 0,40 %). L'utilisation concomitante de diltiazem avec des bêta-bloquants ou des digitaliques peut entraîner des effets additifs sur la conduction cardiaque. Un patient souffrant d'angor de Prinzmetal a développé des périodes d'asystolie (2 à 5 secondes) après une dose unique de 60 mg de diltiazem (voir EFFETS INDÉSIRABLES ).
Insuffisance cardiaque congestive
Bien que le diltiazem ait un effet inotrope négatif dans les préparations de tissus animaux isolés, les études hémodynamiques chez l'homme ayant une fonction ventriculaire normale n'ont pas montré de réduction de l'indice cardiaque ni d'effets négatifs constants sur la contractilité (dp/dt). Une étude aiguë du diltiazem oral chez des patients présentant une altération de la fonction ventriculaire (fraction d'éjection 24 % ± 6 %) a montré une amélioration des indices de la fonction ventriculaire sans diminution significative de la fonction contractile (dp/dt). Une aggravation de l'insuffisance cardiaque congestive a été rapportée chez des patients présentant une altération préexistante de la fonction ventriculaire. L'expérience de l'utilisation du chlorhydrate de diltiazem en association avec des bêta-bloquants chez les patients présentant une fonction ventriculaire altérée est limitée. Il faut être prudent lors de l'utilisation de cette combinaison.
Hypotension
Les diminutions de la pression artérielle associées au traitement par le diltiazem peuvent parfois entraîner une hypotension symptomatique.
Lésion hépatique aiguë
Des élévations légères des transaminases avec et sans élévation concomitante de la phosphatase alcaline et de la bilirubine ont été observées dans les études cliniques. Ces élévations étaient généralement transitoires et fréquemment résolues même avec un traitement continu au diltiazem. Dans de rares cas, des élévations significatives des enzymes telles que la phosphatase alcaline, la LDH, la SGOT, la SGPT et d'autres phénomènes compatibles avec une lésion hépatique aiguë ont été notées. Ces réactions ont eu tendance à se produire tôt après le début du traitement (1 à 8 semaines) et ont été réversibles à l'arrêt du traitement médicamenteux. La relation avec le diltiazem est incertaine dans certains cas, mais probable dans d'autres (voir PRÉCAUTIONS ).
PRÉCAUTIONS
Général
Le chlorhydrate de diltiazem est largement métabolisé par le foie et excrété par les reins et dans la bile. Comme pour tout médicament administré sur des périodes prolongées, les paramètres de laboratoire de la fonction rénale et hépatique doivent être surveillés à intervalles réguliers. Le médicament doit être utilisé avec prudence chez les patients présentant une insuffisance rénale ou hépatique. Dans des études subaiguës et chroniques sur des chiens et des rats conçues pour produire une toxicité, des doses élevées de diltiazem ont été associées à des lésions hépatiques. Dans des études hépatiques subaiguës spéciales, des doses orales de 125 mg/kg et plus chez le rat ont été associées à des modifications histologiques du foie, réversibles à l'arrêt du médicament. Chez le chien, des doses de 20 mg/kg ont également été associées à des modifications hépatiques ; cependant, ces changements étaient réversibles avec le dosage continu.
Événements dermatologiques (voir EFFETS INDÉSIRABLES peut être transitoire et peut disparaître malgré l'utilisation continue du diltiazem. Cependant, des éruptions cutanées évoluant vers un érythème polymorphe et/ou une dermatite exfoliative ont également été rarement rapportées. Si une réaction dermatologique persiste, le médicament doit être arrêté.
Carcinogenèse, mutagenèse, altération de la fertilité
Une étude de 24 mois chez le rat à des doses orales allant jusqu'à 100 mg/kg/jour et une étude de 21 mois chez la souris à des doses orales allant jusqu'à 30 mg/kg/jour n'ont montré aucun signe de cancérogénicité. Il n'y a pas non plus eu de réponse mutagène in vitro ou in vivo dans des tests sur des cellules de mammifères ou in vitro dans des bactéries. Aucun signe d'altération de la fertilité n'a été observé dans une étude réalisée chez des rats mâles et femelles à des doses orales allant jusqu'à 100 mg/kg/jour.
Grossesse
Catégorie C. Des études de reproduction ont été menées chez des souris, des rats et des lapins. L'administration de doses allant de cinq à dix fois supérieures (en mg/kg) à la dose thérapeutique quotidienne recommandée a entraîné une létalité embryonnaire et fœtale. Ces doses, dans certaines études, ont été rapportées comme provoquant des anomalies squelettiques. Dans les études périnatales/postnatales, il y avait une incidence accrue de mortinaissances à des doses de 20 fois la dose humaine ou plus.
Il n'y a pas d'études bien contrôlées chez les femmes enceintes; par conséquent, n'utilisez le diltiazem chez la femme enceinte que si le bénéfice potentiel justifie le risque potentiel pour le fœtus.
Mères allaitantes
Le diltiazem est excrété dans le lait maternel. Un rapport suggère que les concentrations dans le lait maternel peuvent se rapprocher des niveaux sériques. Si l'utilisation du diltiazem est jugée essentielle, une autre méthode d'alimentation du nourrisson doit être instituée.
Utilisation pédiatrique
L'innocuité et l'efficacité chez les patients pédiatriques n'ont pas été établies.
Utilisation gériatrique
Les études cliniques sur le diltiazem n'ont pas inclus un nombre suffisant de sujets âgés de 65 ans et plus pour déterminer s'ils réagissent différemment des sujets plus jeunes. L'autre expérience clinique annoncée n'a pas identifié de différences dans les réponses entre les patients assez âgés et plus jeunes. En général, la sélection de la dose pour un patient âgé doit être prudente, en commençant généralement à l'extrémité inférieure de la plage posologique, reflétant la plus grande fréquence de diminution de la fonction hépatique, rénale ou cardiaque et de maladie concomitante ou d'un autre traitement médicamenteux.
SURDOSAGE
Les DL50 orales chez les souris et les rats vont de 415 à 740 mg/kg et de 560 à 810 mg/kg, respectivement. Les DL50 intraveineuses chez ces espèces étaient respectivement de 60 et 38 mg/kg. La DL50 orale chez le chien est considérée comme supérieure à 50 mg/kg, tandis que la létalité a été observée chez le singe à 360 mg/kg.
La dose toxique chez l'homme n'est pas connue. En raison d'un métabolisme important, les taux sanguins après une dose standard de diltiazem peuvent varier de plus de dix fois, ce qui limite l'utilité des taux sanguins dans les cas de surdosage.
Des cas de surdosage de diltiazem en quantités allant de
Les événements observés après un surdosage de diltiazem comprenaient une bradycardie, une hypotension, un bloc cardiaque et une insuffisance cardiaque. La plupart des rapports de surdosage décrivaient une mesure médicale de soutien et/ou un traitement médicamenteux. La bradycardie a fréquemment répondu favorablement à l'atropine, tout comme le bloc cardiaque, bien que la stimulation cardiaque ait également été fréquemment utilisée pour traiter le bloc cardiaque. Des fluides et des vasopresseurs ont été utilisés pour maintenir la pression artérielle et, en cas d'insuffisance cardiaque, des agents inotropes ont été administrés. De plus, certains patients ont reçu un traitement par assistance ventilatoire, lavage gastrique, charbon actif et/ou calcium intraveineux.
L'efficacité de l'administration intraveineuse de calcium pour inverser les effets pharmacologiques d'un surdosage de diltiazem a été incohérente. Dans quelques cas signalés, une surdose d'inhibiteurs calciques associée à une hypotension et à une bradycardie qui était initialement réfractaire à l'atropine est devenue plus sensible à l'atropine après que les patients ont reçu du calcium par voie intraveineuse. Dans certains cas, du calcium par voie intraveineuse a été administré (1 g de chlorure de calcium ou 3 g de gluconate de calcium) en 5 minutes et répété toutes les 10 à 20 minutes si nécessaire. Le gluconate de calcium a également été administré en perfusion continue à raison de 2 g par heure pendant 10 heures. Des perfusions de calcium pendant 24 heures ou plus peuvent être nécessaires. Les patients doivent être surveillés pour des signes d'hypercalcémie.
En cas de surdosage ou de réponse exagérée, des mesures de soutien appropriées doivent être utilisées en plus de la décontamination gastro-intestinale. Le diltiazem ne semble pas être éliminé par péritonéale ou par hémodialyse. Des données limitées suggèrent que la plasmaphérèse ou l'hémoperfusion au charbon peuvent accélérer l'élimination du diltiazem après un surdosage. Sur la base des effets pharmacologiques connus du diltiazem et/ou des expériences cliniques rapportées, les mesures suivantes peuvent être envisagées :
Bradycardie : Administrer de l'atropine (0,6 à 1 mg). S'il n'y a pas de réponse au blocage vagal, administrer l'isoprotérénol avec prudence.
Bloc AV de haut degré : Traiter comme pour la bradycardie ci-dessus. Le bloc AV fixe de haut degré doit être traité par stimulation cardiaque.
Insuffisance cardiaque : Administrer des agents inotropes (isoprotérénol, dopamine ou dobutamine) et des diurétiques.
Hypotension : Vasopresseurs (p. ex., dopamine ou noradrénaline).
Le traitement et la posologie réels doivent dépendre de la gravité de la situation clinique ainsi que du jugement et de l'expérience du médecin traitant.
CONTRE-INDICATIONS
Le diltiazem est contre-indiqué chez (1) les patients présentant une maladie du sinus sauf en présence d'un stimulateur ventriculaire fonctionnel, (2) les patients présentant un bloc AV du deuxième ou du troisième degré sauf en présence d'un stimulateur ventriculaire fonctionnel, (3) les patients présentant un hypotension (moins de 90 mm Hg systolique), (4) patients ayant démontré une hypersensibilité au médicament et (5) patients présentant un infarctus aigu du myocarde et une congestion pulmonaire documentée par radiographie à l'admission.
PHARMACOLOGIE CLINIQUE
On pense que les effets thérapeutiques des gélules à libération prolongée de chlorhydrate de diltiazem USP (dose une fois par jour) sont liés à sa capacité à inhiber l'influx cellulaire d'ions calcium pendant la dépolarisation membranaire des muscles lisses cardiaques et vasculaires.
Mécanismes d'action
Hypertension
Les capsules de la libération prolongée d'hydrochlorure de Diltiazem USP (le dosage une fois par jour) produit son effet antihypertensive principalement par la relaxation de muscle lisse vasculaire et la diminution résultante de résistance vasculaire périphérique. L'ampleur de la réduction de la tension artérielle est liée au degré d'hypertension; ainsi les personnes hypertendues ressentent un effet antihypertenseur, alors qu'il n'y a qu'une baisse modeste de la pression artérielle chez les normotendus.
Angine
Il a été démontré que les capsules à libération prolongée de chlorhydrate de diltiazem USP (dose une fois par jour) produisent des augmentations de la tolérance à l'exercice, probablement en raison de sa capacité à réduire la demande en oxygène du myocarde. Ceci est accompli via des réductions de la fréquence cardiaque et de la pression artérielle systémique à des charges de travail sous-maximales et maximales. Le diltiazem s'est avéré être un puissant dilatateur des artères coronaires, à la fois épicardiques et sous-endocardiques. Les spasmes coronariens spontanés et induits par l'ergonovine sont inhibés par le diltiazem.
Dans les modèles animaux, le diltiazem interfère avec le courant lent entrant (dépolarisant) dans les tissus excitables. Il provoque un découplage excitation-contraction dans divers tissus myocardiques sans modification de la configuration du potentiel d'action. Le diltiazem produit un relâchement du muscle lisse vasculaire coronaire et une dilatation des grandes et des petites artères coronaires à des niveaux de médicament qui provoquent peu ou pas d'effet inotrope négatif. Les augmentations résultantes du débit sanguin coronaire (épicardique et sous-endocardique) se produisent dans les modèles ischémiques et non ischémiques et s'accompagnent de diminutions dose-dépendantes de la pression artérielle systémique et de diminutions de la résistance périphérique.
Effets hémodynamiques et électrophysiologiques
Comme les autres antagonistes des canaux calciques, le diltiazem diminue la conduction sino-auriculaire et auriculo-ventriculaire dans les tissus isolés et a un effet inotrope négatif dans les préparations isolées. Chez l'animal intact, un allongement de l'intervalle AH peut être observé à des doses plus élevées.
Chez l'homme, le diltiazem prévient les spasmes coronariens spontanés et provoqués par l'ergonovine. Il provoque une diminution de la résistance vasculaire périphérique et une baisse modeste de la pression artérielle chez les personnes normotendues et, dans les études de tolérance à l'effort chez les patients atteints de cardiopathie ischémique, réduit le produit fréquence cardiaque-pression artérielle pour une charge de travail donnée. Les études réalisées à ce jour, principalement chez des patients ayant une bonne fonction ventriculaire, n'ont pas mis en évidence d'effet inotrope négatif ; le débit cardiaque, la fraction d'éjection et la pression télédiastolique du ventricule gauche n'ont pas été affectés. Ces données n'ont aucune valeur prédictive en ce qui concerne les effets chez les patients présentant une fonction ventriculaire médiocre, et une augmentation de l'insuffisance cardiaque a été rapportée chez des patients présentant une altération préexistante de la fonction ventriculaire. Il existe encore peu de données sur l'interaction du diltiazem et des bêta-bloquants chez les patients ayant une fonction ventriculaire déficiente. La fréquence cardiaque au repos est généralement légèrement réduite par le diltiazem.
Chez les patients hypertendus, les gélules à libération prolongée de chlorhydrate de diltiazem USP (dose une fois par jour) produisent des effets antihypertenseurs à la fois en position couchée et debout. Dans une étude dose-réponse à double insu et parallèle utilisant des doses allant de 90 à 540 mg une fois par jour, les gélules à libération prolongée de chlorhydrate de diltiazem (dose une fois par jour) ont abaissé la tension artérielle diastolique en décubitus dorsal d'une manière apparemment linéaire sur toute la durée de l'étude. gamme de doses étudiée. Les variations de la pression artérielle diastolique, mesurées au creux, pour le placebo, 90 mg, 180 mg, 360 mg et 540 mg étaient de -2,9, -4,5, -6,1, -9,5 et -10,5 mm Hg, respectivement. L'hypotension orthostatique est rarement notée lors de la prise soudaine d'une position verticale. Aucune tachycardie réflexe n'est associée aux effets antihypertenseurs chroniques. Les gélules à libération prolongée de chlorhydrate de diltiazem USP (dose une fois par jour) diminuent la résistance vasculaire, augmentent le débit cardiaque (en augmentant le volume d'éjection systolique); et produit une légère diminution ou aucun changement de la fréquence cardiaque. Pendant l'exercice dynamique, les augmentations de la pression diastolique sont inhibées, tandis que la pression systolique maximale réalisable est généralement réduite. La thérapie chronique avec les capsules de la libération prolongée d'hydrochlorure diltiazem USP (le dosage une fois par jour) ne produit aucun changement ou une augmentation de catecholamines de plasma. Aucune augmentation de l'activité de l'axe rénine-angiotensine-aldostérone n'a été observée. Les capsules de la libération prolongée d'hydrochlorure Diltiazem USP (le dosage une fois par jour) réduisent les effets rénaux et périphériques d'angiotensin II. Les modèles animaux hypertendus répondent au diltiazem par des réductions de la pression artérielle et une augmentation du débit urinaire et de la natriurèse sans modification du rapport sodium/potassium urinaire.
Dans une étude dose-réponse en double aveugle et parallèle portant sur des doses de 60 mg à 480 mg une fois par jour, la capsule à libération prolongée de chlorhydrate de diltiazem (dose une fois par jour) a augmenté le temps jusqu'à l'arrêt de l'exercice de manière linéaire sur toute la dose gamme étudiée. L'amélioration du temps jusqu'à la fin de l'exercice en utilisant un protocole d'exercice de Bruce, mesurée au creux, pour le placebo, 60 mg, 120 mg, 240 mg, 360 mg et 480 mg était de 29, 40, 56, 51, 69 et 68 secondes , respectivement. Au fur et à mesure que les doses de capsule à libération prolongée de chlorhydrate de diltiazem (dose une fois par jour) étaient augmentées, la fréquence globale de l'angine de poitrine diminuait. La capsule de chlorhydrate de diltiazem à libération prolongée (dose une fois par jour), 180 mg une fois par jour, ou un placebo a été administrée dans une étude en double aveugle à des patients recevant un traitement concomitant avec des nitrates à action prolongée et/ou des bêta-bloquants. Une augmentation significative du temps jusqu'à la fin de l'exercice et une diminution significative de la fréquence globale des angines ont été observées. Dans cet essai, la fréquence globale des événements indésirables dans le groupe de traitement des gélules à libération prolongée de chlorhydrate de diltiazem (dose une fois par jour) était la même que dans le groupe placebo.
Le diltiazem intraveineux à des doses de 20 mg prolonge le temps de conduction AH et les périodes réfractaires fonctionnelles et efficaces du nœud AV d'environ 20 %. Dans une étude portant sur des doses orales uniques de 300 mg de chlorhydrate de diltiazem chez six volontaires sains, l'allongement maximal moyen de la PR était de 14 % sans cas de bloc AV supérieur au premier degré. L'allongement de l'intervalle AH associé au diltiazem n'est pas plus prononcé chez les patients présentant un bloc cardiaque du premier degré. Chez les patients atteints de maladie des sinus, le diltiazem prolonge significativement la durée du cycle sinusal (jusqu'à 50 % dans certains cas).
L'administration orale chronique de chlorhydrate de diltiazem à des patients à des doses allant jusqu'à 540 mg/jour a entraîné de légères augmentations de l'intervalle PR et produit occasionnellement un allongement anormal (voir AVERTISSEMENTS ).
Pharmacocinétique et métabolisme
Le diltiazem est bien absorbé par le tractus gastro-intestinal et est soumis à un important effet de premier passage, donnant une biodisponibilité absolue (par rapport à l'administration intraveineuse) d'environ 40 %. Le diltiazem subit un métabolisme important dans lequel seulement 2 à 4 % du médicament inchangé apparaissent dans l'urine. Les médicaments qui induisent ou inhibent les enzymes microsomales hépatiques peuvent modifier la disposition du diltiazem.
La mesure de la radioactivité totale après une courte administration IV chez des volontaires sains suggère la présence d'autres métabolites non identifiés, qui atteignent des concentrations plus élevées que celles du diltiazem et sont éliminés plus lentement ; la demi-vie de la radioactivité totale est d'environ 20 heures contre 2 à 5 heures pour le diltiazem.
Des études de liaison in vitro montrent que le diltiazem est lié à 70 % à 80 % aux protéines plasmatiques. Des études compétitives in vitro sur la liaison du ligand ont également montré que la liaison du diltiazem n'est pas altérée par les concentrations thérapeutiques de digoxine, d'hydrochlorothiazide, de phénylbutazone, de propranolol, d'acide salicylique ou de warfarine. La demi-vie d'élimination plasmatique après l'administration d'un seul ou de plusieurs médicaments est d'environ 3,0 à 4,5 heures. Le désacétyl diltiazem est également présent dans le plasma à des niveaux de 10 % à 20 % du médicament mère et est de 25 % à 50 % aussi puissant qu'un vasodilatateur coronarien comme le diltiazem. Les concentrations plasmatiques thérapeutiques minimales de diltiazem semblent se situer entre 50 et 200 ng/mL. Il y a un écart par rapport à la linéarité lorsque les dosages sont augmentés ; la demi-vie est légèrement augmentée avec la dose. Une étude comparant des patients ayant une fonction hépatique normale à des patients atteints de cirrhose a révélé une augmentation de la demi-vie et une augmentation de 69 % de la biodisponibilité chez les patients atteints d'insuffisance hépatique. Une seule étude portant sur neuf patients présentant une insuffisance rénale sévère n'a montré aucune différence dans le profil pharmacocinétique du diltiazem par rapport aux patients ayant une fonction rénale normale.
Capsules à libération prolongée de chlorhydrate de diltiazem (dose une fois par jour)
Lorsqu'on le compare à un régime de comprimés de diltiazem à l'état d'équilibre, plus de 95 % du médicament est absorbé à partir de la formulation de gélules à libération prolongée de chlorhydrate de diltiazem (dose une fois par jour). Une dose unique de 360 mg de la gélule entraîne des taux plasmatiques détectables en 2 heures et des taux plasmatiques maximaux entre 10 et 14 heures; l'absorption se produit tout au long de l'intervalle de dosage. Lorsque la capsule à libération prolongée de chlorhydrate de diltiazem (dose une fois par jour) a été coadministrée avec un petit-déjeuner riche en graisses, le degré d'absorption du diltiazem n'a pas été affecté. Le dumping de dose ne se produit pas. La demi-vie d'élimination apparente après administration unique ou répétée est de 5 à 8 heures. Un écart de linéarité similaire à celui observé avec les comprimés de diltiazem et les gélules de chlorhydrate de diltiazem (deux fois par jour) est observé. Comme la dose de gélules à libération prolongée de chlorhydrate de diltiazem (dose une fois par jour) est augmentée d'une dose quotidienne de 120 mg à 240 mg, il y a une augmentation de l'aire sous la courbe de 2,7 fois. Lorsque la dose est augmentée de 240 mg à 360 mg, il y a une augmentation de l'aire sous la courbe de 1,6 fois.
INFORMATIONS PATIENTS
Aucune information fournie. Veuillez vous référer au AVERTISSEMENTS et PRÉCAUTIONS sections.
