Le traitement des troubles de la digestion: Nexium 20mg, 40mg Esomeprazole Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Nexium et comment est-il utilisé ?
Nexium est un médicament d'ordonnance utilisé pour traiter les symptômes du reflux gastro-oesophagien (RGO) et d'autres conditions où il y a un excès d'acide gastrique comme le syndrome de Zollinger-Ellison. Nexium peut être utilisé seul ou avec d'autres médicaments.
Nexium 20 mg est un inhibiteur de la pompe à protons.
On ne sait pas si Nexium 20 mg est sûr et efficace chez les enfants de moins de 1 mois pour les médicaments intraveineux et de 1 an pour les médicaments oraux.
Quels sont les effets secondaires de Nexium 40mg ?
Nexium peut provoquer des effets secondaires graves, notamment :
- fortes douleurs à l'estomac,
- diarrhée aqueuse ou sanglante,
- saisie (convulsions),
- peu ou pas de miction,
- sang dans les urines,
- gonflement,
- prise de poids rapide,
- vertiges,
- rythme cardiaque rapide ou irrégulier,
- tremblements ou mouvements musculaires saccadés,
- se sentir nerveux,
- crampes musculaires,
- spasmes musculaires dans les mains et les pieds,
- toux ou sensation d'étouffement,
- douleurs articulaires et
- éruption cutanée sur les joues ou les bras qui s'aggrave au soleil
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Nexium 40 mg incluent :
- mal de tête,
- somnolence,
- diarrhée légère,
- nausée,
- Douleur d'estomac,
- gaz,
- la constipation et
- bouche sèche
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Nexium. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
LA DESCRIPTION
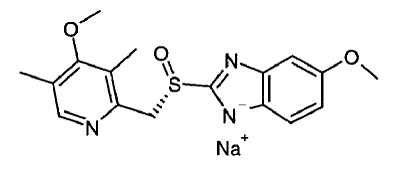
L'ingrédient actif de NEXIUM® IV (ésoméprazole sodique) pour injection est le (S)-5-méthoxy-2[[(4-méthoxy-3,5-diméthyl-2-pyridinyl)-méthyl]sulfinyl]-1 H-benzimidazole sodium, un inhibiteur de la pompe à protons qui inhibe la sécrétion d'acide gastrique. L'ésoméprazole est l'isomère S de l'oméprazole, qui est un mélange des isomères S et R. Sa formule empirique est C17H18N3O3SNa avec un poids moléculaire de 367,4 g/mol (sel de sodium) et 345,4 g/mol (composé parent).
L'ésoméprazole sodique est très soluble dans l'eau et librement soluble dans l'éthanol (95 %). La formule structurale est :
NEXIUM 20 mg IV pour injection est fourni sous forme de gâteau ou de poudre stérile, lyophilisé, blanc à blanc cassé, poreux dans un flacon de 5 mL, destiné à l'administration intraveineuse après reconstitution avec du chlorure de sodium injectable à 0,9 %, USP ; Lactate de Ringer injectable, USP ou dextrose injectable à 5 %, USP. NEXIUM IV pour injection contient 21,3 mg ou 42,5 mg d'ésoméprazole sodique équivalent à 20 mg ou 40 mg d'ésoméprazole, 1,5 mg d'édétate disodique et de l'hydroxyde de sodium qs pour l'ajustement du pH. Le pH de la solution reconstituée de NEXIUM IV pour injection dépend du volume de reconstitution et se situe entre 9 et 11. La stabilité de l'ésoméprazole sodique en solution aqueuse dépend fortement du pH. Le taux de dégradation augmente avec la diminution du pH.
LES INDICATIONS
Traitement du reflux gastro-œsophagien (RGO) avec œsophagite érosive (EE)
NEXIUM IV est indiqué pour le traitement à court terme du RGO avec EE chez les adultes et les patients pédiatriques de 1 mois à 17 ans, inclusivement comme alternative au traitement par voie orale lorsque NEXIUM 40 mg par voie orale n'est pas possible ou approprié.
Réduction du risque de récidive des ulcères gastriques ou duodénaux après endoscopie thérapeutique chez l'adulte
NEXIUM 40 mg IV est indiqué pour la réduction du risque de récidive hémorragique des ulcères gastriques ou duodénaux après endoscopie thérapeutique des ulcères aigus hémorragiques gastriques ou duodénaux chez l'adulte.
DOSAGE ET ADMINISTRATION
Posologie pour le RGO avec EE
Patients adultes
La posologie recommandée chez l'adulte est de 20 mg ou 40 mg de NEXIUM 40 mg IV administré une fois par jour par injection intraveineuse (sur au moins 3 minutes) ou perfusion intraveineuse (10 minutes à 30 minutes) pendant 10 jours maximum [voir DOSAGE ET ADMINISTRATION ].
Patients pédiatriques
La posologie recommandée pour les patients pédiatriques est basée sur l'âge et le poids corporel, comme indiqué dans le tableau 1 ci-dessous. Administrer en perfusion intraveineuse de 10 à 30 minutes une fois par jour pendant 10 jours maximum [voir DOSAGE ET ADMINISTRATION ].
Achèvement du traitement
- La sécurité et l'efficacité de NEXIUM 20 mg IV pendant plus de 10 jours n'ont pas été démontrées.
- Dès qu'un traitement par voie orale est possible ou approprié, interrompez le traitement intraveineux par NEXIUM 40 mg IV et poursuivez le traitement par NEXIUM 20 mg par voie orale.
Posologie pour la réduction du risque de récidive d'ulcères gastriques ou duodénaux après endoscopie thérapeutique chez l'adulte
La posologie recommandée pour un adulte est de 80 mg de NEXIUM IV administré en perfusion intraveineuse de 30 minutes suivie d'une perfusion continue de 8 mg/heure pendant une durée totale de traitement de 72 heures (c. perfusion) [voir DOSAGE ET ADMINISTRATION ].
La thérapie intraveineuse vise uniquement la prise en charge initiale aiguë des ulcères gastriques ou duodénaux hémorragiques et ne constitue pas un traitement complet. Administrer un traitement anti-acide oral après un traitement intraveineux pendant un traitement complet.
Ajustement posologique pour l'insuffisance hépatique
RGO avec EE
Pour les patients présentant une insuffisance hépatique sévère (classe C de Child-Pugh), la posologie maximale est de 20 mg une fois par jour [voir Utilisation dans des populations spécifiques ].
Réduction du risque de récidive des ulcères gastriques ou duodénaux après endoscopie thérapeutique chez l'adulte
Chez les patients présentant une insuffisance hépatique légère à modérée (classes Child-Pugh A et B, respectivement), administration de 80 mg en perfusion intraveineuse de 30 minutes, suivie d'une perfusion continue de 6 mg/heure pendant 71,5 heures.
Chez les patients atteints d'insuffisance hépatique sévère (classe C de Child-Pugh), administration de 80 mg en perfusion intraveineuse de 30 minutes, suivie d'une perfusion continue de 4 mg/heure pendant 71,5 heures [voir Utilisation dans des populations spécifiques ].
Instructions de préparation et d'administration pour le RGO avec EE
Ne pas administrer NEXIUM 40 mg IV en concomitance avec d'autres médicaments par le même site intraveineux et/ou la même tubulure.
Les antiacides oraux peuvent être utilisés pendant le traitement par NEXIUM 20mg IV
Injection intraveineuse pendant au moins 3 minutes chez des patients adultes
Perfusion intraveineuse de 10 à 30 minutes chez des patients adultes et pédiatriques
Stockage
Conservez la solution finale (dilué) de NEXIUM IV à la température ambiante jusqu'à 30°C (86°F) et administrez dans la période de temps indiquée comme énuméré dans la Table 2 ci-dessous.
Instructions de préparation et d'administration pour la réduction du risque de récidive d'ulcères gastriques ou duodénaux chez l'adulte
Ne pas administrer NEXIUM 40 mg IV en concomitance avec d'autres médicaments par le même site intraveineux et/ou la même tubulure.
Des antiacides oraux peuvent être utilisés pendant le traitement par NEXIUM IV
Dose de charge (80 mg)
Perfusion continue
Stockage
- Conservez la solution finale (diluée) de NEXIUM IV à température ambiante jusqu'à 30°C (86°F) et administrez-la dans les 12 heures.
COMMENT FOURNIE
Formes posologiques et points forts
Pour injection : 40 mg d'ésoméprazole sous forme de poudre lyophilisée blanche à blanc cassé dans un flacon à dose unique pour reconstitution.
Stockage et manutention
NEXIUM 20 mg IV est fourni dans un flacon unidose sous forme de poudre lyophilisée blanche à blanc cassé pour reconstitution contenant 40 mg d'ésoméprazole.
NEXIUM 40mg IV . est disponible comme suit :
Stockage
Conserver à 25 °C (77 °F); excursions autorisées jusqu'à 15° à 30°C (59° à 86°F). [Voir Température ambiante contrôlée USP .] Protéger de la lumière. Conserver dans le carton jusqu'au moment de l'utilisation.
Après reconstitution et administration, jeter toute portion inutilisée de la solution d'ésoméprazole [voir DOSAGE ET ADMINISTRATION ].
Fabriqué pour : AstraZeneca Pharmaceuticals LP Wilmington, DE 19850. Révisé : mars 2022
EFFETS SECONDAIRES
Les effets indésirables graves suivants sont décrits ci-dessous et ailleurs dans l'étiquetage :
- Néphrite tubulo-interstitielle aiguë [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Diarrhée associée à Clostridium difficile [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Fracture osseuse [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Effets indésirables cutanés graves [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Lupus érythémateux cutané et disséminé [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Hypomagnésémie et métabolisme minéral [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Polypes de la glande fundique [voir AVERTISSEMENTS ET PRECAUTIONS ]
Expérience des essais cliniques
Étant donné que les essais cliniques sont menés dans des conditions très variables, les taux d'effets indésirables observés dans les essais cliniques d'un médicament ne peuvent pas être directement comparés aux taux des essais cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique.
RGO symptomatique et EE
Adultes
L'innocuité de NEXIUM IV est basée sur les résultats d'essais cliniques menés dans quatre populations différentes, y compris des sujets sains (n = 204) et des patients souffrant d'ulcères gastriques ou duodénaux hémorragiques (n = 375). Les données décrites ci-dessous reflètent l'exposition à NEXIUM 20 mg IV chez 359 patients dans des essais contrôlés activement : RGO symptomatique avec ou sans antécédent d'EE (n = 199) et patients avec EE (n = 160). La population était âgée de 18 à 77 ans; 45 % d'hommes, 52 % de race blanche, 17 % de race noire, 3 % d'Asie et 28 % d'autre race. La plupart des patients ont reçu des doses de 20 ou 40 mg sous forme de perfusion ou d'injection. Les effets indésirables survenant chez au moins 1 % des patients sont énumérés ci-dessous dans le tableau 3 :
Le traitement intraveineux par NEXIUM 20 mg IV 20 et 40 mg administré en injection ou en perfusion s'est avéré avoir un profil d'innocuité similaire à celui de l'ésoméprazole oral.
Pédiatrie
Une étude randomisée, ouverte et multinationale pour évaluer la pharmacocinétique de doses intraveineuses répétées de NEXIUM IV une fois par jour chez des patients pédiatriques âgés de 1 mois à 17 ans inclus a été réalisée [voir PHARMACOLOGIE CLINIQUE ]. Les résultats d'innocuité sont cohérents avec le profil d'innocuité connu de l'ésoméprazole et aucun signal d'innocuité inattendu n'a été identifié.
Réduction du risque de récidive des ulcères gastriques ou duodénaux chez les adultes
Les données décrites dans le tableau 4 ci-dessous reflètent l'exposition à NEXIUM 20 mg IV chez 375 patients qui se sont présentés avec un saignement d'ulcère gastrique ou duodénal confirmé par endoscopie dans un essai contrôlé par placebo. La population était âgée de 18 à 98 ans; 68 % d'hommes, 87 % de race blanche, 1 % de race noire, 7 % d'Asie et 4 % d'autre race. Après hémostase endoscopique, les patients ont reçu soit un placebo, soit 80 mg de NEXIUM IV en perfusion intraveineuse de 30 minutes suivi d'une perfusion continue de 8 mg/heure pendant une durée totale de traitement de 72 heures. Après la période initiale de 72 heures, tous les patients ont reçu un IPP oral pendant 27 jours.
À l'exception des réactions au site d'injection décrites ci-dessus, le traitement intraveineux par NEXIUM 20 mg IV administré en injection ou en perfusion s'est avéré avoir un profil d'innocuité similaire à celui de l'ésoméprazole oral.
Expérience post-commercialisation
Les effets indésirables suivants ont été identifiés lors de l'utilisation post-approbation de l'ésoméprazole. Étant donné que ces réactions sont signalées volontairement par une population de taille incertaine, il n'est pas toujours possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale avec l'exposition au médicament.
Troubles du système sanguin et lymphatique : agranulocytose, pancytopénie;
Troubles oculaires : Vision floue;
Problèmes gastro-intestinaux: pancréatite; stomatite; colite microscopique; polypes des glandes fundiques;
Troubles hépatobiliaires : insuffisance hépatique, hépatite avec ou sans ictère ;
Troubles du système immunitaire : réaction/choc anaphylactique ; le lupus érythémateux disséminé;
Infections et infestations : candidose gastro-intestinale ;
Troubles du métabolisme et de la nutrition : hypomagnésémie (peut entraîner une hypocalcémie et/ou une hypokaliémie) [voir AVERTISSEMENTS ET PRECAUTIONS ], hyponatrémie ;
Troubles musculosquelettiques et du tissu conjonctif : faiblesse musculaire, myalgie, fracture osseuse;
Troubles du système nerveux : encéphalopathie hépatique, troubles du goût;
Troubles psychiatriques: agressivité, agitation, dépression, hallucination ;
Troubles rénaux et urinaires : néphrite interstitielle;
Troubles de l'appareil reproducteur et des seins : gynécomastie;
Troubles respiratoires, thoraciques et médiastinaux : bronchospasme;
Troubles de la peau et du tissu sous-cutané : alopécie, érythème polymorphe, hyperhidrose, photosensibilité, syndrome de Stevens-Johnson, nécrolyse épidermique toxique (NET, parfois mortelle), réaction médicamenteuse avec éosinophilie et symptômes systémiques (DRESS) et pustulose exanthématique aiguë généralisée (PEAG), lupus érythémateux cutané.
On peut également s'attendre à ce que des réactions indésirables associées à l'oméprazole se produisent avec NEXIUM IV Voir les informations de prescription complètes pour l'oméprazole oral pour des informations de sécurité complètes.
INTERACTIONS MÉDICAMENTEUSES
Les tableaux 5 et 6 incluent les médicaments ayant des interactions médicamenteuses cliniquement importantes et des interactions avec les diagnostics lorsqu'ils sont administrés en concomitance avec l'ésoméprazole et des instructions pour les prévenir ou les gérer.
Consultez l'étiquetage des médicaments utilisés en concomitance pour obtenir de plus amples informations sur les interactions avec les IPP.
AVERTISSEMENTS
Inclus dans le cadre du PRÉCAUTIONS section.
PRÉCAUTIONS
Présence de malignité gastrique
Dans les adultes, la réponse symptomatique à la thérapie avec NEXIUM IV n'exclut pas la présence de malignité gastrique. Envisager un suivi et des tests diagnostiques supplémentaires chez les patients adultes qui ont une réponse sous-optimale ou une rechute symptomatique précoce après avoir terminé le traitement avec un IPP. Chez les patients plus âgés, envisagez également une endoscopie.
Néphrite tubulo-interstitielle aiguë
Une néphrite tubulo-interstitielle (TIN) aiguë a été observée chez des patients prenant des IPP et peut survenir à tout moment au cours du traitement par IPP. Les patients peuvent présenter divers signes et symptômes allant de réactions d'hypersensibilité symptomatiques à des symptômes non spécifiques de diminution de la fonction rénale (p. ex., malaise, nausées, anorexie). Dans les séries de cas rapportés, certains patients ont été diagnostiqués sur biopsie et en l'absence de manifestations extra-rénales (p. ex., fièvre, éruption cutanée ou arthralgie). Arrêter NEXIUM 20 mg IV et évaluer les patients chez qui l'on soupçonne une TIN aiguë [voir CONTRE-INDICATIONS ].
Diarrhée associée à Clostridium difficile
Des études observationnelles publiées suggèrent qu'un traitement par IPP comme NEXIUM 20 mg IV peut être associé à un risque accru de diarrhée associée à Clostridium difficile, en particulier chez les patients hospitalisés. Ce diagnostic doit être évoqué en cas de diarrhée qui ne s'améliore pas [voir EFFETS INDÉSIRABLES ].
Les patients doivent utiliser la dose la plus faible et la durée la plus courte de traitement par IPP appropriées à l'affection traitée.
Fracture de l'os
Plusieurs études observationnelles publiées suggèrent que le traitement par inhibiteur de la pompe à protons (IPP) peut être associé à un risque accru de fractures de la hanche, du poignet ou de la colonne vertébrale liées à l'ostéoporose. Le risque de fracture était accru chez les patients ayant reçu une dose élevée, définie comme de multiples doses quotidiennes, et un traitement par IPP à long terme (un an ou plus). Les patients doivent utiliser la dose la plus faible et la durée la plus courte de traitement par IPP appropriées à l'affection traitée. Les patients à risque de fractures liées à l'ostéoporose doivent être pris en charge conformément aux directives de traitement établies [voir DOSAGE ET ADMINISTRATION , EFFETS INDÉSIRABLES ].
Effets indésirables cutanés graves
Des effets indésirables cutanés graves, y compris le syndrome de Stevens-Johnson (SJS) et la nécrolyse épidermique toxique (NET), la réaction médicamenteuse avec éosinophilie et symptômes systémiques (DRESS) et la pustulose exanthématique aiguë généralisée (PEAG) ont été signalés en association avec l'utilisation d'IPP [voir EFFETS INDÉSIRABLES ]. Arrêtez NEXIUM IV aux premiers signes ou symptômes de réactions indésirables cutanées graves ou d'autres signes d'hypersensibilité et envisagez une évaluation plus approfondie.
Lupus érythémateux cutané et disséminé
Des cas de lupus érythémateux cutané (CLE) et de lupus érythémateux disséminé (LES) ont été rapportés chez des patients prenant des IPP, y compris l'ésoméprazole. Ces événements se sont produits à la fois comme une nouvelle apparition et comme une exacerbation d'une maladie auto-immune existante. La majorité des cas de lupus érythémateux induits par les IPP étaient des CLE.
La forme la plus courante de CLE signalée chez les patients traités par des IPP était la CLE subaiguë (SCLE) et s'est produite dans les semaines ou les années suivant un traitement médicamenteux continu chez des patients allant des nourrissons aux personnes âgées. Généralement, les résultats histologiques ont été observés sans atteinte des organes.
Le lupus érythémateux disséminé (LES) est moins fréquemment rapporté que le CLE chez les patients recevant des IPP. Le LED associé aux IPP est généralement plus léger que le LED non médicamenteux. L'apparition du LES s'est généralement produite quelques jours à quelques années après le début du traitement, principalement chez des patients allant des jeunes adultes aux personnes âgées. La majorité des patients présentaient une éruption cutanée ; cependant, des arthralgies et des cytopénies ont également été signalées.
Évitez l'administration d'IPP plus longtemps que médicalement indiqué. Si des signes ou des symptômes compatibles avec le CLE ou le SLE sont notés chez les patients recevant NEXIUM 20 mg IV, arrêtez le médicament et référez le patient au spécialiste approprié pour évaluation. La plupart des patients s'améliorent avec l'arrêt de l'IPP seul en 4 à 12 semaines. Les tests sérologiques (par exemple, ANA) peuvent être positifs et les résultats des tests sérologiques élevés peuvent prendre plus de temps à se résoudre que les manifestations cliniques.
Interaction avec le clopidogrel
Éviter l'utilisation concomitante de NEXIUM IV avec le clopidogrel. Le clopidogrel est un promédicament. L'inhibition de l'agrégation plaquettaire par le clopidogrel est entièrement due à un métabolite actif. Le métabolisme du clopidogrel en son métabolite actif peut être altéré par l'utilisation concomitante de médicaments, tels que l'ésoméprazole, qui inhibent l'activité du CYP2C19. L'utilisation concomitante de clopidogrel avec 40 mg d'ésoméprazole réduit l'activité pharmacologique du clopidogrel. Lors de l'utilisation de NEXIUM IV, envisager un traitement antiplaquettaire alternatif [voir INTERACTIONS MÉDICAMENTEUSES ].
Hypomagnésémie et métabolisme minéral
De rares cas d'hypomagnésémie, symptomatique et asymptomatique, ont été rapportés chez des patients traités par des IPP pendant au moins trois mois, dans la plupart des cas après un an de traitement. Les événements indésirables graves comprennent la tétanie, les arythmies et les convulsions. L'hypomagnésémie peut entraîner une hypocalcémie et/ou une hypokaliémie et peut exacerber l'hypocalcémie sous-jacente chez les patients à risque. Chez la plupart des patients, le traitement de l'hypomagnésémie a nécessité un remplacement du magnésium et l'arrêt de l'IPP.
Pour les patients qui devraient suivre un traitement prolongé ou qui prennent des IPP avec des médicaments tels que la digoxine ou des médicaments susceptibles de provoquer une hypomagnésémie (p. EFFETS INDÉSIRABLES ].
Envisagez de surveiller les niveaux de magnésium et de calcium avant l'initiation de NEXIUM IV et périodiquement pendant le traitement chez les patients présentant un risque préexistant d'hypocalcémie (par exemple, hypoparathyroïdie). Compléter avec du magnésium et/ou du calcium, si nécessaire. Si l'hypocalcémie est réfractaire au traitement, envisager d'arrêter l'IPP.
Interaction avec le millepertuis ou la rifampicine
Les médicaments qui induisent le CYP2C19 ou le CYP3A4 (tels que le millepertuis ou la rifampicine) peuvent diminuer considérablement les concentrations d'ésoméprazole [voir INTERACTIONS MÉDICAMENTEUSES ]. Éviter l'utilisation concomitante de NEXIUM 40 mg IV avec du millepertuis ou de la rifampicine.
Interactions avec les investigations diagnostiques pour les tumeurs neuroendocrines
Les taux sériques de chromogranine A (CgA) augmentent en raison de la diminution de l'acidité gastrique induite par les médicaments. L'augmentation du taux de CgA peut entraîner des résultats faussement positifs dans les investigations diagnostiques des tumeurs neuroendocrines. Les professionnels de la santé doivent temporairement arrêter le traitement par l'ésoméprazole au moins 14 jours avant d'évaluer les taux de CgA et envisager de répéter le test si les taux initiaux de CgA sont élevés. Si des tests en série sont effectués (par exemple, pour la surveillance), le même laboratoire commercial doit être utilisé pour les tests, car les plages de référence entre les tests peuvent varier [voir INTERACTIONS MÉDICAMENTEUSES ].
Interaction avec le méthotrexate
La littérature suggère que l'utilisation concomitante d'IPP avec le méthotrexate (principalement à forte dose ; voir les informations de prescription du méthotrexate) peut élever et prolonger les taux sériques de méthotrexate et/ou de son métabolite, entraînant éventuellement des toxicités du méthotrexate. En cas d'administration de méthotrexate à forte dose, un arrêt temporaire de l'IPP peut être envisagé chez certains patients [voir INTERACTIONS MÉDICAMENTEUSES ].
Polypes de la glande fundique
L'utilisation d'IPP est associée à un risque accru de polypes des glandes fundiques qui augmente avec une utilisation à long terme, en particulier au-delà d'un an. La plupart des utilisateurs d'IPP qui ont développé des polypes de la glande fundique étaient asymptomatiques et les polypes de la glande fundique ont été identifiés accidentellement à l'endoscopie. Utilisez la durée la plus courte de traitement par IPP appropriée à la condition traitée.
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Le potentiel carcinogène de l'ésoméprazole a été évalué à l'aide d'études sur l'oméprazole. Dans deux études de cancérogénicité orale de 24 mois chez le rat, l'oméprazole à des doses quotidiennes de 1,7, 3,4, 13,8, 44,0 et 140,8 mg/kg/jour (environ 0,4 à 34 fois la dose humaine de 40 mg/jour exprimée sur une surface corporelle surface) a produit des carcinoïdes à cellules ECL gastriques d'une manière liée à la dose chez les rats mâles et femelles ; l'incidence de cet effet était nettement plus élevée chez les rats femelles, qui présentaient des taux sanguins d'oméprazole plus élevés. Les carcinoïdes gastriques surviennent rarement chez le rat non traité. De plus, une hyperplasie des cellules ECL était présente dans tous les groupes traités des deux sexes. Dans l'une de ces études, des rats femelles ont été traités avec 13,8 mg d'oméprazole/kg/jour (environ 3,4 fois la dose humaine de 40 mg/jour sur la base de la surface corporelle) pendant 1 an, puis suivis pendant une année supplémentaire sans le médicament . Aucun carcinoïde n'a été observé chez ces rats. Une incidence accrue d'hyperplasie des cellules ECL liée au traitement a été observée au bout d'un an (94 % des patients traités contre 10 % des témoins). À la deuxième année, la différence entre les rats traités et les rats témoins était beaucoup plus petite (46 % contre 26 %), mais présentait toujours plus d'hyperplasie dans le groupe traité. Un adénocarcinome gastrique a été observé chez un rat (2 %). Aucune tumeur similaire n'a été observée chez les rats mâles ou femelles traités pendant 2 ans. Pour cette souche de rat, aucune tumeur similaire n'a été notée historiquement, mais une découverte impliquant une seule tumeur est difficile à interpréter. Une étude de 78 semaines sur la cancérogénicité de l'oméprazole par voie orale chez la souris n'a pas montré d'augmentation de la fréquence des tumeurs, mais l'étude n'a pas été concluante.
L'ésoméprazole s'est révélé négatif dans le test de mutation d'Ames, dans le test in vivo d'aberration chromosomique des cellules de moelle osseuse de rat et dans le test in vivo du micronoyau de souris. L'ésoméprazole, cependant, était positif dans le test in vitro d'aberration chromosomique des lymphocytes humains. L'oméprazole s'est révélé positif dans le test in vitro d'aberration chromosomique des lymphocytes humains, dans le test in vivo d'aberration chromosomique dans les cellules de moelle osseuse de souris et dans le test in vivo du micronoyau de souris.
Les effets potentiels de l'ésoméprazole sur la fertilité et la performance reproductive ont été évalués à l'aide d'études sur l'oméprazole. L'oméprazole à des doses orales allant jusqu'à 138 mg/kg/jour chez le rat (environ 34 fois la dose humaine de 40 mg/jour sur la base de la surface corporelle) s'est avéré n'avoir aucun effet sur les performances de reproduction des animaux parents.
Utilisation dans des populations spécifiques
Grossesse
Résumé des risques
Il n'y a pas d'études adéquates et bien contrôlées avec l'ésoméprazole chez la femme enceinte. L'ésoméprazole est l'isomère s de l'oméprazole. Les données épidémiologiques disponibles ne parviennent pas à démontrer un risque accru de malformations congénitales majeures ou d'autres résultats indésirables de la grossesse avec l'utilisation d'oméprazole au premier trimestre. Des études de reproduction chez des rats et des lapins ont entraîné une létalité embryonnaire dose-dépendante à des doses d'oméprazole qui étaient environ 3,4 à 34 fois une dose humaine orale de 40 mg (sur la base d'une surface corporelle pour une personne de 60 kg).
Aucune tératogénicité n'a été observée dans les études de reproduction chez l'animal avec l'administration orale d'esoméprazole magnésien chez le rat et le lapin à des doses d'environ 68 fois et 42 fois, respectivement, une dose humaine orale de 40 mg (basée sur la surface corporelle pour une personne de 60 kg) . Des modifications de la morphologie osseuse ont été observées chez la progéniture de rats ayant reçu pendant la majeure partie de la grossesse et de l'allaitement des doses égales ou supérieures à environ 34 fois une dose humaine orale de 40 mg. Lorsque l'administration maternelle était confinée à la gestation uniquement, il n'y avait aucun effet sur la morphologie de la physe osseuse chez la progéniture à tout âge (voir Données ).
Les risques de fond estimés de malformations congénitales majeures et de fausses couches pour la population indiquée sont inconnus. Toutes les grossesses ont un risque de fond de malformation congénitale, de perte ou d'autres résultats indésirables. Dans la population générale des États-Unis, le risque de fond estimé de malformations congénitales majeures et de fausse couche dans les grossesses cliniquement reconnues est de 2 % à 4 % et de 15 % à 20 %, respectivement.
Données
Données humaines
L'ésoméprazole est l'isomère S de l'oméprazole. Quatre études épidémiologiques ont comparé la fréquence des anomalies congénitales chez les nourrissons nés de femmes ayant utilisé l'oméprazole pendant la grossesse avec la fréquence des anomalies chez les nourrissons de femmes exposées à des antagonistes des récepteurs H2 ou à d'autres témoins.
Une étude épidémiologique de cohorte rétrospective basée sur la population du registre médical suédois des naissances, couvrant environ 99 % des grossesses, de 1995 à 99, a fait état de 955 nourrissons (824 exposés au cours du premier trimestre, dont 39 exposés au-delà du premier trimestre et 131 exposés après le premier trimestre) dont les mères ont utilisé l'oméprazole pendant la grossesse. Le nombre de nourrissons exposés in utero à l'oméprazole qui présentaient une malformation, un faible poids à la naissance, un faible score d'Apgar ou une hospitalisation était similaire au nombre observé dans cette population. Le nombre de nourrissons nés avec des malformations septales ventriculaires et le nombre de nourrissons mort-nés étaient légèrement plus élevés chez les nourrissons exposés à l'oméprazole que le nombre attendu dans cette population.

Une étude de cohorte rétrospective basée sur la population couvrant toutes les naissances vivantes au Danemark de 1996 à 2009, a fait état de 1 800 naissances vivantes dont les mères ont utilisé de l'oméprazole au cours du premier trimestre de la grossesse et de 837 317 naissances vivantes dont les mères n'ont utilisé aucun inhibiteur de la pompe à protons. Le taux global de malformations congénitales chez les nourrissons nés de mères ayant été exposées à l'oméprazole au cours du premier trimestre était de 2,9 % et de 2,6 % chez les nourrissons nés de mères non exposées à un inhibiteur de la pompe à protons au cours du premier trimestre.
Une étude de cohorte rétrospective a rapporté 689 femmes enceintes exposées soit aux anti-H2 soit à l'oméprazole au cours du premier trimestre (134 exposées à l'oméprazole) et 1 572 femmes enceintes non exposées à l'un ou l'autre au cours du premier trimestre. Le taux global de malformation chez les descendants nés de mères ayant été exposées au premier trimestre à l'oméprazole, un anti-H2, ou n'ayant pas été exposées était de 3,6 %, 5,5 % et 4,1 %, respectivement.
Une petite étude de cohorte observationnelle prospective a suivi 113 femmes exposées à l'oméprazole pendant la grossesse (89 % avec des expositions au cours du premier trimestre). Le taux rapporté de malformations congénitales majeures était de 4 % dans le groupe oméprazole, de 2 % chez les témoins exposés à des agents non tératogènes et de 2,8 % chez les témoins appariés par la maladie. Les taux d'avortements spontanés et électifs, d'accouchements prématurés, d'âge gestationnel à l'accouchement et de poids moyen à la naissance étaient similaires entre les groupes.
Plusieurs études n'ont rapporté aucun effet indésirable apparent à court terme sur le nourrisson lorsqu'une dose unique d'oméprazole par voie orale ou intraveineuse a été administrée à plus de 200 femmes enceintes comme prémédication pour une césarienne sous anesthésie générale.
Données animales
Oméprazole
Études de reproduction menées avec l'oméprazole chez le rat à des doses orales allant jusqu'à 138 mg/kg/jour (environ 34 fois une dose humaine orale de 40 mg sur la base de la surface corporelle) et chez le lapin à des doses allant jusqu'à 69,1 mg/kg/jour ( environ 34 fois une dose humaine orale de 40 mg sur la base de la surface corporelle) au cours de l'organogenèse n'a révélé aucune preuve d'un potentiel tératogène de l'oméprazole. Chez le lapin, l'oméprazole à une dose comprise entre 6,9 et 69,1 mg/kg/jour (environ 3,4 à 34 fois une dose humaine orale de 40 mg sur la base de la surface corporelle) administrée pendant l'organogenèse a produit des augmentations liées à la dose de la létalité embryonnaire, résorptions fœtales et interruptions de grossesse. Chez le rat, une toxicité embryo/fœtale liée à la dose et une toxicité sur le développement postnatal ont été observées chez la progéniture issue de parents traités par l'oméprazole à raison de 13,8 à 138,0 mg/kg/jour (environ 3,4 à 34 fois une dose humaine orale de 40 mg sur une surface corporelle). superficie), administré avant l'accouplement pendant toute la période de lactation.
Ésoméprazole
Aucun effet sur le développement embryo-fœtal n'a été observé dans les études de reproduction avec l'ésoméprazole magnésien chez le rat à des doses orales allant jusqu'à 280 mg/kg/jour (environ 68 fois une dose humaine orale de 40 mg sur la base de la surface corporelle) ou chez le lapin à doses orales jusqu'à 86 mg/kg/jour (environ 41 fois la dose humaine sur la base de la surface corporelle) administrées pendant l'organogenèse.
Une étude de toxicité sur le développement pré et postnatal chez le rat avec des paramètres supplémentaires pour évaluer le développement osseux a été réalisée avec l'ésoméprazole magnésien à des doses orales de 14 à 280 mg/kg/jour (environ 3,4 à 68 fois une dose humaine orale de 40 mg sur un corps). sur la base de la surface). La survie néonatale/postnatale précoce (de la naissance au sevrage) a diminué à des doses égales ou supérieures à 138 mg/kg/jour (environ 34 fois une dose humaine orale de 40 mg sur la base de la surface corporelle). Le poids corporel et le gain de poids corporel ont été réduits et des retards neurocomportementaux ou de développement général dans la période suivant immédiatement le sevrage étaient évidents à des doses égales ou supérieures à 69 mg/kg/jour (environ 17 fois une dose humaine orale de 40 mg sur un sur la base de la surface). De plus, une diminution de la longueur du fémur, de la largeur et de l'épaisseur de l'os cortical, une diminution de l'épaisseur de la plaque de croissance tibiale et une hypocellularité minime à légère de la moelle osseuse ont été observées à des doses égales ou supérieures à 14 mg/kg/jour (environ 3,4 fois une administration orale humaine dose de 40 mg sur la base de la surface corporelle). Une dysplasie physaire dans le fémur a été observée chez la progéniture de rats traités avec des doses orales d'ésoméprazole magnésien à des doses égales ou supérieures à 138 mg/kg/jour (environ 34 fois une dose humaine orale de 40 mg sur la base de la surface corporelle).
Des effets sur les os maternels ont été observés chez des rates gravides et allaitantes dans une étude de toxicité prénatale et postnatale lorsque l'ésoméprazole magnésien a été administré à des doses orales de 14 à 280 mg/kg/jour (environ 3,4 à 68 fois une dose humaine orale de 40 mg sur sur la base de la surface corporelle). Lorsque les rats ont reçu une dose du 7e jour de gestation jusqu'au sevrage au 21e jour postnatal, une diminution statistiquement significative du poids du fémur maternel allant jusqu'à 14 % (par rapport au traitement par placebo) a été observée à des doses égales ou supérieures à 138 mg/kg/jour. (environ 34 fois une dose humaine orale de 40 mg sur la base de la surface corporelle).
Une étude sur le développement prénatal et postnatal chez des rats avec de l'ésoméprazole strontium (utilisant des doses équimolaires par rapport à l'étude sur l'ésoméprazole magnésien) a produit des résultats similaires chez les mères et les petits comme décrit ci-dessus.
Une étude de suivi de la toxicité pour le développement chez le rat avec d'autres points temporels pour évaluer le développement de l'os du chiot du jour 2 postnatal à l'âge adulte a été réalisée avec l'ésoméprazole magnésien à des doses orales de 280 mg/kg/jour (environ 68 fois une dose humaine orale de 40 mg sur sur la base de la surface corporelle) où l'administration d'ésoméprazole s'est déroulée du 7e jour de gestation ou du 16e jour de gestation jusqu'à la parturition. Lorsque l'administration maternelle était confinée à la gestation uniquement, il n'y avait aucun effet sur la morphologie de la physe osseuse chez la progéniture à tout âge.
Lactation
Résumé des risques
L'ésoméprazole est l'isomère S de l'oméprazole et des données limitées suggèrent que l'oméprazole peut être présent dans le lait maternel. Il n'y a pas de données cliniques sur les effets de l'ésoméprazole sur le nourrisson allaité ou sur la production de lait. Les avantages de l'allaitement pour le développement et la santé doivent être pris en compte, ainsi que le besoin clinique de la mère pour NEXIUM 20 mg et tout effet indésirable potentiel sur le nourrisson allaité de NEXIUM ou de l'affection maternelle sous-jacente.
Utilisation pédiatrique
L'innocuité et l'efficacité de NEXIUM 20 mg IV ont été établies chez les patients pédiatriques âgés de 1 mois à 17 ans pour le traitement à court terme du RGO avec EE, comme alternative au traitement par voie orale lorsque NEXIUM 40 mg par voie orale n'est pas possible ou approprié.
L'utilisation de NEXIUM 40 mg IV dans ce groupe d'âge est basée sur l'extrapolation de l'efficacité adulte aux enfants et la sélection de la dose basée sur l'appariement de l'exposition des enfants aux adultes étayée par les preuves suivantes : a) résultats observés à partir d'une étude pharmacocinétique (PK) sur NEXIUM 20 mg IV pour injection chez les patients pédiatriques, b) les prédictions d'un modèle pharmacocinétique de population comparant les données pharmacocinétiques intraveineuses entre les patients adultes et pédiatriques, et c) la relation entre l'exposition et les résultats pharmacodynamiques obtenus à partir des données orales adultes et pédiatriques et d) les résultats pharmacocinétiques de études adéquates et bien contrôlées qui ont appuyé l'approbation de NEXIUM 40 mg IV chez l'adulte [voir EFFETS INDÉSIRABLES , PHARMACOLOGIE CLINIQUE , Etudes cliniques ].
L'innocuité et l'efficacité de NEXIUM IV n'ont pas été établies chez les patients âgés de moins de 1 mois pour le traitement du RGO avec EE ou pour la réduction du risque de récidive de l'ulcère gastrique ou duodénal suite à une endoscopie thérapeutique.
Données sur les animaux juvéniles
Dans une étude de toxicité chez le rat juvénile, l'ésoméprazole a été administré avec des sels de magnésium et de strontium à des doses orales d'environ 34 à 68 fois une dose humaine quotidienne de 40 mg en fonction de la surface corporelle. Des augmentations de la mortalité ont été observées à la dose élevée, et à toutes les doses d'ésoméprazole, il y a eu des diminutions du poids corporel, du gain de poids corporel, du poids et de la longueur du fémur, et des diminutions de la croissance globale [voir Toxicologie non clinique ].
Utilisation gériatrique
Dans un essai clinique portant sur des patients souffrant d'ulcères gastriques ou duodénaux hémorragiques, 52 % des 375 patients randomisés pour recevoir NEXIUM IV étaient âgés de 65 ans et plus. Aucune différence globale d'innocuité et d'efficacité n'a été observée entre les personnes âgées et les personnes plus jeunes, et d'autres expériences cliniques rapportées avec NEXIUM 40 mg IV et l'ésoméprazole oral n'ont pas identifié de différences dans les réponses entre les patients âgés et les patients plus jeunes, mais une plus grande sensibilité de certaines personnes plus âgées ne peut pas être exclu.
Insuffisance hépatique
RGO avec EE
L'exposition à l'ésoméprazole a été considérablement augmentée chez les patients présentant une insuffisance hépatique sévère (Child-Pugh Classe C), mais pas chez les patients présentant une insuffisance hépatique légère à modérée (Child-Pugh Classes A et B) par rapport aux patients ayant une fonction hépatique normale [voir PHARMACOLOGIE CLINIQUE ].
Chez l'adulte, aucun ajustement posologique n'est nécessaire en cas d'insuffisance hépatique légère à modérée. Pour les patients atteints d'insuffisance hépatique sévère, la posologie maximale recommandée est de 20 mg une fois par jour [voir DOSAGE ET ADMINISTRATION ].
Réduction du risque de récidive des ulcères gastriques ou duodénaux après endoscopie thérapeutique
Il n'y a pas de données pharmacocinétiques disponibles pour NEXIUM 20 mg IV administré en administration intraveineuse continue chez les patients insuffisants hépatiques. L'exposition à l'oméprazole par voie intraveineuse, dont l'ésoméprazole est un énantiomère, a augmenté chez les patients présentant tous les degrés d'insuffisance hépatique par rapport aux sujets ayant une fonction hépatique normale [voir PHARMACOLOGIE CLINIQUE ].
Pour les patients adultes, aucun ajustement posologique de la dose de charge initiale de NEXIUM IV 80 mg n'est nécessaire chez les patients présentant un degré quelconque d'insuffisance hépatique. Réduire le débit de la perfusion continue à 6 mg/heure pour les patients présentant une insuffisance hépatique légère à modérée (Child-Pugh Classes A et B) et à 4 mg/heure pour les patients présentant une insuffisance hépatique sévère (Child-Pugh Classe C) [voir DOSAGE ET ADMINISTRATION ].
SURDOSAGE
Les symptômes décrits dans le cadre d'un surdosage volontaire de NEXIUM 40 mg (expérience limitée à des doses supérieures à 240 mg/jour) sont transitoires. Les rapports de surdosage avec l'oméprazole chez l'homme peuvent également être pertinents. Les doses allaient jusqu'à 2 400 mg (120 fois la dose clinique habituelle recommandée). Les manifestations étaient variables, mais comprenaient confusion, somnolence, vision floue, tachycardie, nausées, diaphorèse, bouffées vasomotrices, maux de tête, bouche sèche et autres effets indésirables similaires à ceux observés aux doses recommandées. Voir les informations de prescription complètes pour l'oméprazole oral pour des informations de sécurité complètes. Aucun antidote spécifique de l'ésoméprazole n'est connu. Étant donné que l'ésoméprazole est fortement lié aux protéines, on ne s'attend pas à ce qu'il soit éliminé par dialyse. En cas de surdosage, le traitement doit être symptomatique et de soutien.
En cas de surexposition, appelez votre centre antipoison au 1-800-222-1222 pour obtenir des informations à jour sur la gestion d'un empoisonnement ou d'un surdosage.
CONTRE-INDICATIONS
- NEXIUM 20 mg IV est contre-indiqué chez les patients présentant une hypersensibilité connue aux benzimidazoles substitués ou à tout composant de la formulation. Les réactions d'hypersensibilité peuvent inclure l'anaphylaxie, le choc anaphylactique, l'œdème de Quincke, le bronchospasme, la néphrite tubulo-interstitielle aiguë et l'urticaire [voir AVERTISSEMENTS ET PRECAUTIONS , EFFETS INDÉSIRABLES ].
- Les inhibiteurs de la pompe à protons (IPP), y compris NEXIUM 20 mg IV, sont contre-indiqués chez les patients recevant des produits contenant de la rilpivirine [voir INTERACTIONS MÉDICAMENTEUSES ].
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
L'ésoméprazole appartient à une classe de composés antisécrétoires, les benzimidazoles substitués, qui suppriment la sécrétion d'acide gastrique par inhibition spécifique du système enzymatique H+/K+ ATPase à la surface sécrétoire de la cellule pariétale gastrique. L'ésoméprazole est protoné et converti dans le compartiment acide de la cellule pariétale formant l'inhibiteur actif, le sulfénamide achiral. Étant donné que ce système enzymatique est considéré comme la pompe à acide (proton) dans la muqueuse gastrique, l'ésoméprazole a été caractérisé comme un inhibiteur de la pompe à acide gastrique, en ce qu'il bloque l'étape finale de la production d'acide. Cet effet est lié à la dose et conduit à l'inhibition de la sécrétion d'acide basale et stimulée, quel que soit le stimulus.
Pharmacodynamie
Activité antisécrétoire
L'effet de l'ésoméprazole sur le pH intragastrique sur 24 heures chez des sujets sains a été évalué dans deux études de 20 mg et 40 mg de NEXIUM 20 mg IV en perfusion intraveineuse une fois par jour pendant 30 minutes pendant 5 jours, comme indiqué dans le tableau 7.
Les effets de l'ésoméprazole sur le pH intragastrique sur 24 heures suite à l'administration d'une perfusion intraveineuse de 80 mg de NEXIUM.IV pendant 30 minutes suivie d'une perfusion continue de 8 mg/heure pendant 23,5 heures ont été évalués dans deux études.
Chez les sujets caucasiens sains H. pylori négatifs (n = 24), le % de temps sur 24 heures (IC à 95 %) lorsque le pH intragastrique était > 6 et > 7 était de 52,3 % (40,3, 64,4) et de 4,8 % (1,8, 7.8), respectivement.
Chez des sujets chinois sains positifs pour H. pylori (n = 8) et négatifs pour H. pylori (n = 11), le pourcentage de temps sur 24 heures (IC à 95 %) lorsque le pH intragastrique était > 6 et > 7 était de 53 % ( 45,6, 60,3) et 15,1 % (9,5, 20,7). Le pourcentage de temps avec un pH intragastrique > 6 [59 % contre 47 %] et avec un pH > 7 [17 % contre 11 %] avait tendance à être plus important chez les sujets positifs pour H. pylori par rapport aux sujets négatifs pour H. pylori.
Effets de la gastrine sérique
L'effet de l'ésoméprazole sur les concentrations sériques de gastrine a été évalué chez environ 2 700 patients lors d'essais cliniques sur l'ésoméprazole par voie orale jusqu'à 8 semaines et chez plus de 1 300 patients traités jusqu'à 12 mois. Le niveau moyen de gastrine à jeun a augmenté de manière dose-dépendante. L'augmentation des concentrations sériques de gastrine a atteint un plateau dans les deux à trois mois suivant le traitement et est revenue aux niveaux de base dans les quatre semaines suivant l'arrêt du traitement.
L'augmentation de la gastrine provoque une hyperplasie des cellules de type entérochromaffine et une augmentation des taux sériques de chromogranine A (CgA). L'augmentation des taux de CgA peut entraîner des résultats faussement positifs dans les examens diagnostiques des tumeurs neuroendocrines [voir AVERTISSEMENTS ET PRECAUTIONS ].
Effets sur les cellules de type entérochromaffine (ECL)
Aucune donnée n'est disponible sur les effets de l'ésoméprazole intraveineux sur les cellules ECL.
Des échantillons de biopsie gastrique humaine ont été obtenus de plus de 3 000 patients (enfants et adultes) traités par voie orale avec de l'oméprazole dans des essais cliniques à long terme. L'incidence de l'hyperplasie des cellules ECL dans ces études a augmenté avec le temps ; cependant, aucun cas de carcinoïdes à cellules ECL, de dysplasie ou de néoplasie n'a été observé chez ces patients [voir Toxicologie non clinique ].
Chez plus de 1 000 patients traités par ésoméprazole oral (10 mg, 20 mg ou 40 mg/jour) jusqu'à 12 mois, la prévalence de l'hyperplasie des cellules ECL a augmenté avec le temps et la dose. Aucun patient n'a développé de carcinoïdes à cellules ECL, de dysplasie ou de néoplasie dans la muqueuse gastrique.
Effets endocriniens
L'ésoméprazole n'a eu aucun effet sur la fonction thyroïdienne lorsqu'il a été administré à des doses orales de 20 mg ou 40 mg pendant 4 semaines. D'autres effets de l'ésoméprazole sur le système endocrinien ont été évalués dans des études sur l'oméprazole. Des doses orales d'oméprazole 30 mg ou 40 mg par jour pendant 2 à 4 semaines n'ont eu aucun effet sur le métabolisme des glucides, les taux circulants d'hormone parathyroïdienne, de cortisol, d'estradiol, de testostérone, de prolactine, de cholécystokinine ou de sécrétine.
Pharmacocinétique
Absorption
La pharmacocinétique de l'ésoméprazole chez des sujets sains suite à l'administration de NEXIUM IV 20 mg et 40 mg une fois par jour en perfusion intraveineuse pendant 30 minutes pendant 5 jours est présentée dans le tableau 8.
Suite à l'administration intraveineuse de NEXIUM 40 mg IV chez 24 sujets sains en dose de charge de 80 mg en 30 minutes suivie d'une perfusion continue de 8 mg/heure pendant 23,5 heures (pour un total de 24 heures), les paramètres pharmacocinétiques de l'ésoméprazole [valeur moyenne géométrique (IC à 95 %)] étaient les suivantes : ASCt 111,1 micromol*h/L (100,5, 122,7 micromol*h/L), Cmax 15,0 micromol/L (13,5, 16,6 micromol/L) et concentration plasmatique à l'état d'équilibre (Css) 3,9 micromoles/L (3,5, 4,5 micromoles/L). Dans une autre étude sur des sujets caucasiens en bonne santé, on a administré le même schéma thérapeutique.
L'ésoméprazole est un inhibiteur temps-dépendant du CYP2C19, entraînant une auto-inhibition et une pharmacocinétique non linéaire. L'exposition systémique augmente de manière plus que proportionnelle à la dose après plusieurs doses orales d'ésoméprazole. Par rapport à la première dose, l'exposition systémique (Cmax et ASC0-24h) à l'état d'équilibre après une administration une fois par jour a augmenté de 43 % et 90 %, respectivement, par rapport à la première dose pour la dose de 20 mg et a augmenté de 95 % et 159 %, respectivement, pour la dose de 40 mg.
Distribution
L'ésoméprazole est lié à 97 % aux protéines plasmatiques. La liaison aux protéines plasmatiques est constante sur la plage de concentration de 2 à 20 micromol/L. Le volume apparent de distribution à l'état d'équilibre chez les sujets sains est d'environ 16 L.
Élimination
Métabolisme
L'ésoméprazole est largement métabolisé dans le foie par le système enzymatique du cytochrome P450 (CYP). Les métabolites de l'ésoméprazole sont dépourvus d'activité antisécrétoire. La majeure partie du métabolisme de l'ésoméprazole dépend de l'isoenzyme CYP2C19, qui forme les métabolites hydroxy et desméthyl. La quantité restante dépend du CYP3A4 qui forme le métabolite sulfone.
Excrétion
L'ésoméprazole est excrété sous forme de métabolites principalement dans l'urine mais aussi dans les fèces. Moins de 1 % de la molécule mère est excrétée dans l'urine. L'ésoméprazole est complètement éliminé du plasma et il n'y a pas d'accumulation lors de l'administration une fois par jour. La demi-vie d'élimination plasmatique de l'ésoméprazole après l'administration intraveineuse de NEXIUM IV est d'environ 1,1 à 1,4 heure et se prolonge avec l'augmentation des doses.
La clairance plasmatique (CL) est d'environ 5,9 à 7,2 L/h lors de l'administration de NEXIUM 40 mg IV en perfusion intraveineuse de 80 mg en 30 minutes suivie d'une perfusion continue de 8 mg/heure pendant 23,5 heures.
Populations spécifiques
Patients gériatriques
Les valeurs de l'ASC et de la Cmax de l'ésoméprazole étaient légèrement plus élevées (25 % et 18 %, respectivement) chez les personnes âgées par rapport aux sujets plus jeunes à l'état d'équilibre. Cette augmentation de l'exposition n'est pas considérée comme cliniquement pertinente.
Patients pédiatriques
La pharmacocinétique de l'ésoméprazole a été évaluée chez 50 patients pédiatriques âgés de 0 à 17 ans inclus (dont 44 patients pédiatriques âgés de 1 mois à 17 ans) dans une étude randomisée, ouverte, multinationale et à doses multiples de 20 mg de NEXIUM 40 mg IV administrés en une injection intraveineuse de 3 minutes une fois par jour. Les valeurs de l'ASC plasmatique de l'ésoméprazole étaient 183 % et 60 % plus élevées chez les patients pédiatriques âgés de 6 à 11 ans et de 12 à 17 ans, respectivement, par rapport aux adultes.
Des analyses pharmacocinétiques ultérieures ont prédit que les schémas posologiques suivants permettraient d'obtenir des expositions plasmatiques à l'état d'équilibre comparables (ASC0-24) à celles observées chez les patients adultes ayant reçu 20 mg de NEXIUM IV une fois par jour : 0,5 mg/kg une fois par jour pour les patients pédiatriques âgés de 1 mois à 11 mois d'âge, 10 mg une fois par jour pour les patients pédiatriques de 1 an à 17 ans avec un poids corporel inférieur à 55 kg, et 20 mg une fois par jour pour les patients pédiatriques de 1 an à 17 ans avec un poids corporel de 55 kg et plus. Il a été prédit que l'augmentation de la durée de la perfusion de 3 minutes à 10 minutes ou 30 minutes produirait des valeurs de Cmax à l'état d'équilibre comparables à celles observées chez les patients adultes aux doses de 40 mg et 20 mg de NEXIUM IV, respectivement [voir Utilisation dans des populations spécifiques ].
Patients masculins et féminins
Les valeurs de l'ASC et de la Cmax de l'ésoméprazole étaient légèrement plus élevées (13 %) chez les femmes que chez les hommes à l'état d'équilibre lorsqu'elles étaient administrées par voie orale. Des différences similaires ont été observées pour l'administration intraveineuse d'ésoméprazole. Cette augmentation de l'exposition n'est pas considérée comme cliniquement pertinente.
Patients atteints d'insuffisance rénale
La pharmacocinétique de l'ésoméprazole chez les insuffisants rénaux ne devrait pas être modifiée par rapport aux sujets sains car moins de 1 % de l'ésoméprazole est excrété sous forme inchangée dans les urines.
Patients atteints d'insuffisance hépatique
La pharmacocinétique à l'état d'équilibre de l'ésoméprazole obtenue après administration de 40 mg par voie orale une fois par jour à 4 patients présentant chacun une insuffisance hépatique légère (Child-Pugh Classe A), modérée (Child-Pugh Classe B) et sévère (Child-Pugh Classe C) était par rapport à ceux obtenus chez 36 patients masculins et féminins atteints de RGO avec une fonction hépatique normale. Chez les patients atteints d'insuffisance hépatique légère à modérée, les ASC se situaient dans la fourchette attendue chez les patients ayant une fonction hépatique normale. Chez les patients atteints d'insuffisance hépatique sévère, les ASC étaient 2 à 3 fois plus élevées que chez les patients ayant une fonction hépatique normale. [voir Utilisation dans des populations spécifiques ].
Aucune donnée pharmacocinétique n'est disponible pour l'ésoméprazole administré par voie intraveineuse continue chez les patients présentant une insuffisance hépatique. La pharmacocinétique de l'oméprazole intraveineux 80 mg perfusé pendant 30 minutes, suivi de 8 mg/heure pendant 47,5 heures chez les patients atteints d'une maladie légère (Child-Pugh Classe A ; n = 5), modérée (Child-Pugh Classe B ; n = 4) et une insuffisance hépatique sévère (Child-Pugh Classe C ; n=3) ont été comparées à celles obtenues chez 24 sujets sains hommes et femmes. Chez les patients présentant une insuffisance hépatique légère et modérée, la clairance de l'oméprazole et la concentration plasmatique à l'état d'équilibre étaient respectivement d'environ 35 % inférieures et 50 % supérieures à celles des sujets sains. Chez les patients présentant une insuffisance hépatique sévère, la clairance de l'oméprazole était de 50 % de celle des sujets sains et la concentration plasmatique à l'état d'équilibre était le double de celle des sujets sains [voir Utilisation dans des populations spécifiques ].
Études sur les interactions médicamenteuses
Effet de l'ésoméprazole/oméprazole sur d'autres médicaments
Des études in vitro et in vivo ont montré que l'ésoméprazole n'est pas susceptible d'inhiber les CYP 1A2, 2A6, 2C9, 2D6, 2E1 et 3A4.
Antirétroviraux
Pour certains médicaments antirétroviraux, tels que la rilpivirine, l'atazanavir et le nelfinavir, une diminution des concentrations sériques a été rapportée lorsqu'ils sont administrés avec l'oméprazole [voir INTERACTIONS MÉDICAMENTEUSES ].
Rilpivirine
Après plusieurs doses de rilpivirine (150 mg, par jour) et d'oméprazole (20 mg, par jour), l'ASC a diminué de 40 %, la Cmax de 40 % et la Cmin de 33 % pour la rilpivirine [voir CONTRE-INDICATIONS ].
Nelfinavir
Après plusieurs doses de nelfinavir (1250 mg, deux fois par jour) et d'oméprazole (40 mg par jour), l'ASC a diminué de 36 % et 92 %, la Cmax de 37 % et 89 % et la Cmin de 39 % et 75 % respectivement pour le nelfinavir et le M8. .
Atazanavir
Après plusieurs doses d'atazanavir (400 mg, par jour) et d'oméprazole (40 mg, par jour, 2 heures avant l'atazanavir), l'ASC a diminué de 94 %, la Cmax de 96 % et la Cmin de 95 %.
Saquinavir
Suite à l'administration répétée de saquinavir/ritonavir (1000/100 mg) deux fois par jour pendant 15 jours avec l'oméprazole 40 mg par jour co-administré les jours 11 à 15. L'ASC a été augmentée de 82 %, la Cmax de 75 % et la Cmin de 106 %. Le mécanisme derrière cette interaction n'est pas entièrement élucidé.
Clopidogrel
Dans une étude croisée, des sujets sains ont reçu du clopidogrel (dose de charge de 300 mg suivie de 75 mg par jour comme dose d'entretien pendant 28 jours) seul et avec de l'ésoméprazole (40 mg par voie orale une fois par jour en même temps que le clopidogrel) pendant 29 jours. L'exposition au métabolite actif du clopidogrel a été réduite de 35 à 40 % au cours de cette période lorsque le clopidogrel et l'ésoméprazole ont été administrés ensemble. Les paramètres pharmacodynamiques ont également été mesurés et ont démontré que la modification de l'inhibition de l'agrégation plaquettaire était liée à la modification de l'exposition au métabolite actif du clopidogrel [voir AVERTISSEMENTS ET PRECAUTIONS , INTERACTIONS MÉDICAMENTEUSES ].
Mycophénolate mofétil
L'administration d'oméprazole 20 mg deux fois par jour pendant 4 jours et d'une dose unique de 1000 mg de MMF environ une heure après la dernière dose d'oméprazole à 12 sujets sains dans une étude croisée a entraîné une réduction de 52 % de la Cmax et une réduction de 23 % dans l'AUC de MPA [voir INTERACTIONS MÉDICAMENTEUSES ].
Cilostazol
L'oméprazole agit comme un inhibiteur du CYP2C19. L'oméprazole, administré à raison de 40 mg par jour pendant une semaine à 20 sujets sains dans une étude croisée, a augmenté la Cmax et l'ASC du cilostazol de 18 % et 26 % respectivement. La Cmax et l'ASC de l'un des métabolites actifs, le 3,4-dihydro-cilostazol, qui a 4 à 7 fois l'activité du cilostazol, ont été augmentées de 29 % et 69 %, respectivement. La co-administration de cilostazol avec l'oméprazole devrait augmenter les concentrations de cilostazol et du métabolite actif mentionné ci-dessus [voir INTERACTIONS MÉDICAMENTEUSES ].
Diazépam
La co-administration d'ésoméprazole 30 mg et de diazépam, un substrat du CYP2C19, a entraîné une diminution de 45 % de la clairance du diazépam. Des taux plasmatiques accrus de diazépam ont été observés 12 heures après l'administration et au-delà. Cependant, à ce moment-là, les taux plasmatiques de diazépam étaient inférieurs à l'intervalle thérapeutique, et il est donc peu probable que cette interaction ait une pertinence clinique.
Digoxine
L'administration concomitante d'oméprazole 20 mg une fois par jour et de digoxine chez des sujets sains a augmenté la biodisponibilité de la digoxine de 10 % (30 % chez deux sujets) [voir INTERACTIONS MÉDICAMENTEUSES ].
Autres drogues
L'administration concomitante d'ésoméprazole et de naproxène (AINS non sélectifs) n'a pas identifié de modifications cliniquement pertinentes des profils pharmacocinétiques de ces AINS.
Effet d'autres médicaments sur l'ésoméprazole/oméprazole
Millepertuis
Dans une étude croisée chez 12 sujets sains de sexe masculin, le millepertuis (300 mg trois fois par jour pendant 14 jours) a significativement réduit l'exposition systémique à l'oméprazole chez les métaboliseurs lents du CYP2C19 (la Cmax et l'ASC ont diminué de 37,5 % et de 37,9 %, respectivement) et métaboliseurs rapides (Cmax et ASC diminuées de 49,6 % et 43,9 %, respectivement) [voir INTERACTIONS MÉDICAMENTEUSES ].
Voriconazole
L'administration concomitante d'oméprazole et de voriconazole (un inhibiteur combiné du CYP2C19 et du CYP3A4) a plus que doublé l'exposition à l'oméprazole. Lorsque le voriconazole (400 mg toutes les 12 heures pendant un jour, suivi de 200 mg une fois par jour pendant 6 jours) a été administré avec de l'oméprazole (40 mg une fois par jour pendant 7 jours) à des sujets sains, la Cmax à l'état d'équilibre et l'ASC0-24 de l'oméprazole significativement augmenté : en moyenne 2 fois (IC à 90 % : 1,8, 2,6) et 4 fois (IC à 90 % : 3,3, 4,4), respectivement, par rapport à l'administration d'oméprazole sans voriconazole [voir INTERACTIONS MÉDICAMENTEUSES ].
Autres drogues
La co-administration d'ésoméprazole avec des contraceptifs oraux, le diazépam, la phénytoïne, la quinidine, le naproxène (AINS non sélectifs) n'a pas semblé modifier le profil pharmacocinétique de l'ésoméprazole.
Microbiologie
Effets sur l'écologie microbienne gastro-intestinale
La diminution de l'acidité gastrique due à tout moyen, y compris les inhibiteurs de la pompe à protons, augmente le nombre gastrique de bactéries normalement présentes dans le tractus gastro-intestinal. Le traitement avec des inhibiteurs de la pompe à protons peut entraîner une légère augmentation du risque d'infections gastro-intestinales telles que Salmonella et Campylobacter et, chez les patients hospitalisés, éventuellement aussi Clostridium difficile.
Pharmacogénomique
Le CYP2C19, une enzyme polymorphe, est impliqué dans le métabolisme de l'ésoméprazole. L'allèle CYP2C19*1 est entièrement fonctionnel tandis que les allèles CYP2C19*2 et *3 ne sont pas fonctionnels. Il existe d'autres allèles associés à une fonction enzymatique nulle ou réduite. Les patients porteurs de deux allèles entièrement fonctionnels sont des métaboliseurs rapides et ceux porteurs de deux allèles de perte de fonction sont des métaboliseurs lents. L'exposition systémique à l'ésoméprazole varie en fonction du statut métabolique du patient : métaboliseurs lents > métaboliseurs intermédiaires > métaboliseurs rapides. Environ 3 % des Caucasiens et 15 à 20 % des Asiatiques sont des métaboliseurs lents du CYP2C19.
Les expositions systémiques à l'ésoméprazole étaient légèrement plus élevées (environ 17 %) chez les métaboliseurs intermédiaires du CYP2C19 (IM ; n = 6) par rapport aux métaboliseurs rapides (EM ; n = 17) du CYP2C19. Des différences pharmacocinétiques similaires ont été notées entre ces génotypes dans une étude sur des sujets sains chinois qui comprenait 7 EM et 11 IM. Il existe très peu d'informations pharmacocinétiques sur les métaboliseurs lents (MP) issues de ces études.
À l'état d'équilibre suivant l'administration une fois par jour de NEXIUM 40 mg IV 40 mg, le rapport de l'ASC chez les métaboliseurs lents à l'ASC dans le reste de la population (EM) est d'environ 1,5. Cette modification de l'exposition n'est pas considérée comme cliniquement significative.
Toxicologie animale et/ou pharmacologie
Études de reproduction
Des études de reproduction ont été réalisées chez le rat à des doses orales allant jusqu'à 280 mg/kg/jour (environ 68 fois une dose humaine orale de 40 mg sur la base de la surface corporelle) et chez le lapin à des doses orales allant jusqu'à 86 mg/kg/jour. (environ 42 fois une dose humaine orale de 40 mg sur la base de la surface corporelle) et n'ont révélé aucun signe d'altération de la fertilité ou d'atteinte au fœtus due à l'ésoméprazole [voir Utilisation dans des populations spécifiques ].
Étude sur les animaux juvéniles
Une étude de toxicité de 28 jours avec une phase de récupération de 14 jours a été menée chez des rats juvéniles avec de l'ésoméprazole magnésien à des doses de 70 à 280 mg/kg/jour (environ 17 à 68 fois une dose humaine orale quotidienne de 40 mg sur une surface corporelle). base de zone). Une augmentation du nombre de décès à la dose élevée de 280 mg/kg/jour a été observée lorsque des rats juvéniles ont reçu de l'ésoméprazole magnésien du jour postnatal 7 au jour postnatal 35. De plus, des doses égales ou supérieures à 140 mg/kg/jour jour (environ 34 fois une dose humaine orale quotidienne de 40 mg sur la base de la surface corporelle), produit des diminutions liées au traitement du poids corporel (environ 14 %) et du gain de poids corporel, des diminutions du poids et de la longueur du fémur, et affecte globalement croissance. Des résultats comparables décrits ci-dessus ont également été observés dans cette étude avec un autre sel d'ésoméprazole, l'ésoméprazole strontium, à des doses équimolaires d'ésoméprazole.
Etudes cliniques
Suppression de l'acide dans le RGO
Quatre études multicentriques, ouvertes et croisées à deux périodes ont été menées pour comparer les effets pharmacodynamiques de l'ésoméprazole après administration intraveineuse ou orale sur la suppression de l'acide chez 206 patients présentant des symptômes de RGO avec ou sans œsophagite érosive. Les patients ont été randomisés pour recevoir 20 ou 40 mg de NEXIUM 40 mg IV ou d'ésoméprazole oral une fois par jour pendant 10 jours (période 1), puis ont été commutés dans la période 2 vers l'autre formulation pendant 10 jours, correspondant à leur dose respective de la période 1. NEXIUM 40 mg IV 20 mg et 40 mg a été administré en injection de 3 minutes dans deux des études et en perfusion de 15 minutes dans les deux autres études.
La population de patients variait de 18 à 72 ans ; 54 % étaient des femmes ; 53 % de race blanche, 24 % de race noire, 5 % d'Asie et 17 % d'autre race. La production d'acide basale (BAO) et la production d'acide maximale (MAO) ont été déterminées 22 à 24 heures après l'administration de la période 1, jour 11 ; sur Période 2, Jour 3 ; et à la période 2, jour 11. La BAO et la MAO ont été estimées à partir de prélèvements continus d'une heure du contenu gastrique avant et après (respectivement) l'injection sous-cutanée de 6,0 mcg/kg de pentagastrine.
Dans ces études, après 10 jours d'administration une fois par jour, NEXIUM IV 20 mgs et 40 mgs étaient semblables au dosage oral correspondant d'esomeprazole dans leur capacité de supprimer BAO et MAO dans ces patients GERD (voir la Table 9 ci-dessous).
Il n'y a eu aucun changement majeur dans la suppression de l'acide lors du passage entre les formes posologiques intraveineuses et orales.
Ulcères gastriques ou duodénaux
Une étude clinique randomisée, en double aveugle et contrôlée par placebo a été menée chez 764 patients qui présentaient un saignement d'ulcère gastrique ou duodénal confirmé par endoscopie. La population était âgée de 18 à 98 ans; 68 % étaient des hommes, 87 % de race blanche, 1 % de race noire, 7 % d'Asie et 4 % d'autre race. Suite à l'hémostase endoscopique, les patients ont été randomisés pour recevoir soit un placebo soit NEXIUM IV 80 mg en perfusion intraveineuse de 30 minutes suivie d'une perfusion continue de 8 mg/heure pendant un total de 72 heures. Après la période initiale de 72 heures, tous les patients ont reçu un IPP oral pendant 27 jours. La survenue de saignements répétés dans les 3 jours suivant la randomisation était de 5,9 % dans le groupe traité par NEXIUM 20 mg IV, contre 10,3 % dans le groupe placebo (différence entre les traitements : -4,4 % ; intervalle de confiance à 95 % : -8,3 %, -0,6 % ; p = 0,03 ). Cette différence de traitement était similaire à celle observée au jour 7 et au jour 30, au cours desquels tous les patients recevaient un IPP par voie orale.
Une étude monocentrique randomisée, en double aveugle et contrôlée par placebo menée à Hong Kong a également démontré une réduction par rapport au placebo du risque de récidive hémorragique dans les 72 heures chez les patients souffrant d'ulcères gastriques ou duodénaux hémorragiques ayant reçu de l'oméprazole racémique, dont 50 % est l'ésoméprazole S-énantiomère.
INFORMATIONS PATIENTS
Effets indésirables
Conseillez aux patients de signaler à leur fournisseur de soins de santé s'ils présentent des signes ou des symptômes compatibles avec :
- Réactions d'hypersensibilité [voir CONTRE-INDICATIONS ]
- Néphrite tubulo-interstitielle aiguë [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Diarrhée associée à Clostridium difficile [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Fracture osseuse [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Effets indésirables cutanés graves [voir AVERTISSEMENTS ET PRECAUTIONS ].
- Lupus érythémateux cutané et disséminé [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Hypomagnésémie et métabolisme minéral [voir AVERTISSEMENTS ET PRECAUTIONS ]
Interactions médicamenteuses
Conseillez aux patients de signaler à leur fournisseur de soins de santé avant de commencer un traitement avec l'un des éléments suivants :
- Produits contenant de la rilpivirine [voir CONTRE-INDICATIONS ]
- Clopidogrel [voir AVERTISSEMENTS ET PRECAUTIONS ]
- millepertuis ou rifampicine [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Méthotrexate à haute dose [voir AVERTISSEMENTS ET PRECAUTIONS ]
Administration
- Informer les patients que des antiacides peuvent être utilisés pendant la prise de NEXIUM 40 mg IV
