Rhinocort 100mcg Budesonide Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Rhinocort Aqua et comment est-il utilisé ?
Le spray nasal Rhinocort Aqua (budésonide) est un stéroïde utilisé pour traiter les symptômes nasaux tels que la congestion, les éternuements et l'écoulement nasal causés par des allergies saisonnières ou tout au long de l'année. Le spray nasal Rhinocort Aqua est également utilisé pour empêcher les polypes nasaux de revenir après l'ablation chirurgicale.
Quels sont les effets secondaires de Rhinocort 100mcg Aqua ?
Les effets secondaires courants du vaporisateur nasal Rhinocort Aqua comprennent :
- sécheresse ou irritation du nez/de la gorge,
- mal de gorge,
- toux,
- éternuements,
- saignements de nez,
- goût/odeur désagréable,
- plaies ou plaques blanches à l'intérieur ou autour du nez, ou
- douleur, enflure, brûlure, démangeaison ou irritation autour du nez.
Informez votre médecin si vous avez des effets secondaires rares mais graves du spray nasal Rhinocort Aqua, notamment:
- perte de goût ou d'odorat, ou
- douleur ou plaies dans le nez.
LA DESCRIPTION
Le budésonide, l'ingrédient actif de RHINOCORT AQUA (budésonide) vaporisateur nasal, est un corticostéroïde synthétique anti-inflammatoire.
Il est désigné chimiquement sous le nom de (RS)-11-bêta, 16-alpha, 17, 21-tétrahydroxypregna-l,4-diène-3,20-dione cyclique 16, 17-acétal avec butyraldéhyde.
Le budésonide est fourni sous la forme d'un mélange de deux épimères (22R et 22S).
La formule empirique du budésonide est C25H34O6 et son poids moléculaire est de 430,5.
Sa formule structurale est :
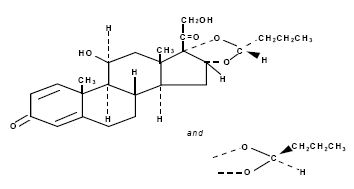
Le budésonide est une poudre blanche à blanc cassé, inodore, pratiquement insoluble dans l'eau et dans l'heptane, peu soluble dans l'éthanol et librement soluble dans le chloroforme.
Son coefficient de partage entre l'octanol et l'eau à pH 5 est de 1,6 x103.
RHINOCORT AQUA (budésonide) vaporisateur nasal est une formulation de pulvérisation manuelle à dose mesurée et non parfumée contenant une suspension micronisée de budésonide dans un milieu aqueux. De la cellulose microcristalline et de la carboxyméthylcellulose sodique, du dextrose anhydre, du polysorbate 80, de l'édétate disodique, du sorbate de potassium et de l'eau purifiée sont contenus dans ce milieu ; de l'acide chlorhydrique est ajouté pour ajuster le pH à un objectif de 4,5.
RHINOCORT 100mcg AQUA Nasal Spray délivre 32 mcg de budésonide par pulvérisation.
Chaque flacon de RHINOCORT 100 mcg AQUA (budésonide) vaporisateur nasal 32 mcg contient 120 pulvérisations mesurées après l'amorçage initial.
Avant la première utilisation, le récipient doit être secoué doucement et la pompe doit être amorcée en actionnant huit fois. Si elle est utilisée quotidiennement, la pompe n'a pas besoin d'être réamorcée. S'il n'est pas utilisé pendant deux jours consécutifs, réamorcer avec une pulvérisation ou jusqu'à ce qu'une fine pulvérisation apparaisse. S'il n'est pas utilisé pendant plus de 14 jours, rincer l'applicateur et réamorcer avec deux pulvérisations ou jusqu'à ce qu'une fine pulvérisation apparaisse.
LES INDICATIONS
Traitement de la rhinite allergique saisonnière ou perannuelle
Le vaporisateur nasal RHINOCORT AQUA (budésonide) est indiqué pour le traitement des symptômes nasaux de la rhinite allergique saisonnière ou apériodique chez les adultes et les enfants de six ans et plus.
DOSAGE ET ADMINISTRATION
La posologie initiale recommandée pour les adultes et les enfants de 6 ans et plus est de 64 mcg par jour administrés en une pulvérisation par narine de RHINOCORT AQUA (budésonide) vaporisateur nasal 32 mcg une fois par jour. Certains patients qui ne parviennent pas à maîtriser leurs symptômes à la posologie initiale recommandée peuvent bénéficier d'une posologie augmentée. La posologie maximale recommandée pour les adultes (âgés de 12 ans et plus) est de 256 mcg par jour administrée en quatre pulvérisations par narine une fois par jour de RHINOCORT AQUA (budésonide) vaporisateur nasal 32 mcg et la dose maximale recommandée pour les patients pédiatriques (6 à
Il est toujours souhaitable de titrer un patient individuel à la dose minimale efficace pour réduire la possibilité d'effets secondaires. Une amélioration des symptômes nasaux peut être notée chez les patients dans les 10 heures suivant la première utilisation de RHINOCORT 100 mcg AQUA (budésonide) vaporisateur nasal, cependant, l'amélioration clinique prend généralement 1 à 2 jours avec un bénéfice maximal en environ 2 semaines. Lorsque le bénéfice maximal a été atteint et que les symptômes ont été contrôlés, la réduction de la posologie peut être efficace pour maintenir le contrôle des symptômes de la rhinite allergique chez les patients initialement contrôlés par des doses plus élevées.
Avant la première utilisation, le récipient doit être secoué doucement et la pompe doit être amorcée en actionnant huit fois. Si elle est utilisée quotidiennement, la pompe n'a pas besoin d'être réamorcée. S'il n'est pas utilisé pendant deux jours consécutifs, réamorcer avec une pulvérisation ou jusqu'à ce qu'une fine pulvérisation apparaisse. S'il n'est pas utilisé pendant plus de 14 jours, rincer l'applicateur et réamorcer avec deux pulvérisations ou jusqu'à ce qu'une fine pulvérisation apparaisse. Agiter doucement le récipient avant chaque utilisation.
Illustré Instructions d'utilisation pour le patient accompagner chaque paquet de RHINOCORT AQUA (budésonide) vaporisateur nasal 32 mcg.
COMMENT FOURNIE
Formes posologiques et dosages
RHINOCORT AQUA (budésonide) vaporisateur nasal est une suspension pour vaporisateur nasal. Chaque pulvérisation délivre 32 mcg de budésonide. Chaque flacon de RHINOCORT 100 mcg AQUA (budésonide) vaporisateur nasal 32 mcg contient 120 pulvérisations mesurées après l'amorçage initial.
RHINOCORT 100mcg AQUA (budésonide) Vaporisateur nasal 32 mcg est disponible dans un flacon en verre ambré avec un vaporisateur doseur et un capuchon de protection vert. RHINOCORT 100mcg AQUA (budésonide) Vaporisateur nasal 32 mcg ( CDN 0186-1070-08) fournit 120 pulvérisations dosées après l'amorçage initial ; poids net de remplissage 8,6 g. Le flacon de RHINOCORT 100mcg AQUA (budesonide) Nasal Spray 32 mcg a été rempli avec un excès pour permettre l'activité d'amorçage. Le flacon doit être jeté après 120 pulvérisations après l'amorçage initial, car la quantité de budésonide délivrée par pulvérisation par la suite peut être sensiblement inférieure à la dose indiquée sur l'étiquette. Chaque pulvérisation délivre 32 mcg de budésonide au patient.
Le vaporisateur nasal RHINOCORT 100 mcg AQUA (budésonide) doit être conservé à température ambiante contrôlée, entre 20 et 25 °C (68 et 77 °F), avec la valve vers le haut. Ne pas congeler. Protéger de la lumière. Agiter doucement avant utilisation. Ne pas vaporiser dans les yeux.
Distribué par : AstraZeneca LP, Wilmington, DE 19850. Révisé : 12/2010
EFFETS SECONDAIRES
L'utilisation systémique et intranasale de corticostéroïdes peut entraîner les effets suivants :
- Épistaxis, infection à Candida albicans, perforation de la cloison nasale et troubles de la cicatrisation [voir AVERTISSEMENTS ET PRECAUTIONS ].
- Hypersensibilité, y compris anaphylaxie [voir AVERTISSEMENTS ET PRECAUTIONS ].
- Immunosuppression [voir AVERTISSEMENTS ET PRECAUTIONS ].
- Hypercorticisme et suppression surrénalienne [voir AVERTISSEMENTS ET PRECAUTIONS ].
- Effet de croissance [voir AVERTISSEMENTS ET PRECAUTIONS et Utilisation dans des populations spécifiques ].
- Glaucome et cataracte [voir AVERTISSEMENTS ET PRECAUTIONS ].
Expérience des essais cliniques
Étant donné que les essais cliniques sont menés dans des conditions très variables, les taux d'effets indésirables observés dans les essais cliniques d'un médicament ne peuvent pas être directement comparés aux taux des essais cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique.
L'incidence des effets indésirables courants dans le tableau 1 est basée sur deux essais cliniques contrôlés américains et cinq non américains menés auprès de 1 526 patients atteints de rhinite saisonnière ou apériodique chez des adultes et des enfants de ≥ 6 ans traités par RHINOCORT AQUA (budésonide) en vaporisateur nasal à des doses allant jusqu'à 400 mcg une fois par jour pendant 3 à 6 semaines. Cette population comprenait 745 femmes et 781 hommes avec un âge moyen de 31 ans (intervalle de 6 à 85 ans, 349 avaient 6
Un profil d'effets indésirables similaire a été observé dans le sous-groupe de patients pédiatriques âgés de 6 à 12 ans. Ces patients sont inclus dans le tableau 1.
Deux à trois pour cent (2 à 3 %) des patients des essais cliniques ont arrêté le traitement en raison d'effets indésirables. Aucun effet secondaire systémique lié aux corticostéroïdes n'a été signalé au cours des études cliniques contrôlées avec le vaporisateur nasal RHINOCORT AQUA (budésonide).
Si les doses recommandées sont dépassées, ou si les individus sont particulièrement sensibles, des symptômes d'hypercorticisme, c'est-à-dire le syndrome de Gushing, et une suppression surrénalienne peuvent survenir.
Expérience post-commercialisation
Les effets indésirables suivants ont été signalés lors de l'utilisation post-approbation du vaporisateur nasal RHINOCORT AQUA (budésonide). Étant donné que ces réactions sont signalées volontairement par une population de taille incertaine, il n'est pas toujours possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale avec l'exposition au médicament.
Troubles du système immunitaire : réactions d'hypersensibilité immédiates et retardées (y compris réaction anaphylactique, urticaire, rash, dermatite, œdème de Quincke et prurit), [voir AVERTISSEMENTS ET PRECAUTIONS et CONTRE-INDICATIONS ]
Troubles oculaires : glaucome, augmentation de la pression intraoculaire, cataractes [voir AVERTISSEMENTS ET PRECAUTIONS ]
Troubles respiratoires, thoraciques et médiastinaux : perforation de la cloison nasale, anosmie, troubles du pharynx (irritation de la gorge, douleur à la gorge, gonflement de la gorge, brûlure de la gorge et démangeaisons de la gorge) et respiration sifflante
Troubles cardiaques : palpitations
Troubles musculo-squelettiques et du tissu conjonctif : suppression de la croissance [voir AVERTISSEMENTS ET PRECAUTIONS et Utilisation dans des populations spécifiques ]
INTERACTIONS MÉDICAMENTEUSES
Inhibiteurs du cytochrome P450 3A4
La principale voie de métabolisme des corticostéroïdes, y compris le budésonide, est via l'isoenzyme 3A4 (CYP3A4) du cytochrome P450 (CYP). Après administration orale de kétoconazole, un puissant inhibiteur du CYP3A4, la concentration plasmatique moyenne du budésonide administré par voie orale a augmenté. L'administration concomitante de CYP3A4 peut inhiber le métabolisme du budésonide et augmenter l'exposition systémique à celui-ci. La prudence s'impose lorsqu'on envisage la co-administration de RHINOCORT AQUA (budésonide) en vaporisateur nasal avec du kétoconazole à long terme et d'autres inhibiteurs puissants connus du CYP3A4 (p. AVERTISSEMENTS ET PRECAUTIONS et PHARMACOLOGIE CLINIQUE ].
AVERTISSEMENTS
Inclus dans le cadre du PRÉCAUTIONS section.
PRÉCAUTIONS
Effets nasaux locaux
Épistaxis
Dans les études cliniques d'une durée de 3 à 52 semaines, des épistaxis ont été observées plus fréquemment chez les patients traités par RHINOCORT 100 mcg AQUA (budésonide) en vaporisateur nasal que chez ceux ayant reçu le placebo [voir EFFETS INDÉSIRABLES ].
Infection à Candida
Dans les études cliniques avec le budésonide administré par voie intranasale, le développement d'infections localisées du nez et du pharynx avec Candida albicans s'est produit. Lorsqu'une telle infection se développe, elle peut nécessiter un traitement local ou systémique approprié et l'arrêt du traitement par RHINOCORT AQUA (budésonide) en vaporisateur nasal. Les patients utilisant RHINOCORT AQUA (budésonide) en vaporisateur nasal pendant plusieurs mois ou plus doivent être examinés périodiquement pour détecter des signes d'infection à Candida ou d'autres signes d'effets indésirables sur la muqueuse nasale.
Perforation septale nasale
Des cas de perforation de la cloison nasale ont été signalés après l'application intranasale de corticostéroïdes, y compris le budésonide [voir EFFETS INDÉSIRABLES ].
Mauvaise cicatrisation des plaies
En raison de l'effet inhibiteur des corticostéroïdes sur la cicatrisation des plaies, les patients qui ont récemment présenté des ulcères septaux nasaux, une chirurgie nasale ou un traumatisme nasal ne doivent pas utiliser de corticostéroïde nasal jusqu'à ce que la cicatrisation se produise.
Réactions d'hypersensibilité, y compris l'anaphylaxie
Des réactions d'hypersensibilité incluant réaction anaphylactique, urticaire, rash, dermatite, œdème de Quincke et prurit peuvent survenir [voir CONTRE-INDICATIONS et RÉACTIONS INDÉSIRABLES, expérience post-commercialisation ].
Immunosuppression
Les patients qui prennent des médicaments qui suppriment le système immunitaire sont plus sensibles aux infections que les individus en bonne santé. La varicelle et la rougeole, par exemple, peuvent avoir une évolution plus grave, voire mortelle, chez les enfants ou les adultes sensibles utilisant des corticostéroïdes. Chez ces enfants ou adultes qui n'ont pas eu ces maladies ou qui ont été correctement immunisés, des précautions particulières doivent être prises pour éviter toute exposition. On ne sait pas comment la dose, la voie et la durée de l'administration de corticostéroïdes affectent le risque de développer une infection disséminée. La contribution de la maladie sous-jacente et/ou de la corticothérapie antérieure au risque n'est pas non plus connue. En cas d'exposition à la varicelle, un traitement par immunoglobuline varicelle-zona (VZIG) ou immunoglobuline intraveineuse groupée (WIG), selon le cas, peut être indiqué. En cas d'exposition à la rougeole, une prophylaxie avec un pool d'immunoglobulines intramusculaires (IG) peut être indiquée. (Voir les notices d'emballage respectives pour des informations complètes sur la prescription de VZIG et IG ). Si la varicelle se développe, un traitement avec des agents antiviraux peut être envisagé.
L'évolution clinique de la varicelle ou de la rougeole chez les patients sous corticostéroïdes intranasaux ou inhalés n'a pas été étudiée. Bien qu'il n'y ait pas de données sur les corticostéroïdes intranasaux, une étude clinique a examiné la réponse immunitaire au vaccin contre la varicelle chez des patients asthmatiques âgés de 12 mois à 8 ans qui ont été traités avec la suspension pour inhalation de budésonide.
Une étude clinique ouverte et non randomisée a examiné la réponse immunitaire au vaccin contre la varicelle chez 243 patients asthmatiques âgés de 12 mois à 8 ans qui ont été traités avec une suspension pour inhalation de budésonide à raison de 0,25 mg à 1 mg par jour (n = 151) ou une thérapie non corticostéroïde contre l'asthme. (n = 92) (c.-à-d. bêta-agonistes, antagonistes des récepteurs des leucotriènes ou cromones). Le pourcentage de patients développant un titre d'anticorps séroprotecteurs ≥ 5,0 (valeur gpELISA) en réponse à la vaccination était similaire chez les patients traités avec la suspension pour inhalation de budésonide (85 %) par rapport aux patients traités avec un traitement de l'asthme sans corticoïdes (90 %). Aucun patient traité par la suspension pour inhalation de budésonide n'a développé de varicelle suite à la vaccination.
Les corticostéroïdes doivent être utilisés avec prudence, voire pas du tout, chez les patients atteints d'une infection tuberculeuse active ou quiescente, d'infections fongiques, bactériennes, virales systémiques ou parasitaires non traitées ; ou l'herpès simplex oculaire.
Effets de l'axe hypothalamo-hypophyso-surrénalien
Hypercorticisme et suppression surrénalienne : Lorsque des stéroïdes intranasaux sont utilisés à des doses supérieures à celles recommandées ou chez des personnes sensibles aux doses recommandées, des effets corticostéroïdes systémiques tels qu'un hypercorticisme et une suppression surrénalienne peuvent apparaître. Si de tels changements se produisent, la posologie de RHINOCORT 100 mcg AQUA (budésonide) en vaporisateur nasal doit être interrompue lentement, conformément aux procédures acceptées pour l'arrêt de la corticothérapie orale.
Le remplacement d'un corticostéroïde systémique par un corticostéroïde topique peut s'accompagner de signes d'insuffisance surrénalienne et, en outre, certains patients peuvent présenter des symptômes de sevrage des corticostéroïdes, par exemple des douleurs articulaires et/ou musculaires, de la fatigue, une faiblesse, des nausées, des vomissements, une hypotension, lassitude et dépression. Les patients précédemment traités pendant des périodes prolongées avec des corticostéroïdes systémiques doivent être sevrés lentement lorsqu'ils sont transférés aux corticostéroïdes topiques et surveillés attentivement pour une insuffisance surrénalienne aiguë en réponse au stress. Chez les patients souffrant d'asthme ou d'autres affections cliniques nécessitant une corticothérapie systémique à long terme, une diminution trop rapide des corticostéroïdes systémiques peut entraîner une exacerbation sévère de leurs symptômes.
Interactions avec les inhibiteurs puissants du cytochrome P450 3A4
La prudence s'impose lorsqu'on envisage la co-administration de RHINOCORT AQUA en vaporisateur nasal avec du kétoconazole et d'autres inhibiteurs puissants connus du CYP3A4 (p. une exposition systémique au budésonide peut survenir [voir INTERACTIONS MÉDICAMENTEUSES, PHARMACOLOGIE CLINIQUE ].
Effet sur la croissance
Les corticostéroïdes intranasaux, y compris le budésonide, peuvent entraîner une réduction de la vitesse de croissance lorsqu'ils sont administrés à des patients pédiatriques. Surveiller régulièrement la croissance des patients pédiatriques recevant un traitement à long terme avec RHINOCORT 100 mcg AQUA (budésonide) vaporisateur nasal. Pour minimiser les effets systémiques des corticostéroïdes intranasaux, y compris le vaporisateur nasal RHINOCORT AQUA (budésonide), titrez la dose de chaque patient à la dose la plus faible qui contrôle efficacement ses symptômes [voir Utilisation dans des populations spécifiques, utilisation pédiatrique ].
Glaucome et Cataractes
Un glaucome, une augmentation de la pression intraoculaire et des cataractes ont été rapportés suite à l'application intranasale de corticostéroïdes, y compris le budésonide. Par conséquent, une surveillance étroite est justifiée chez les patients présentant une modification de la vision ou ayant des antécédents d'augmentation de la pression intraoculaire, de glaucome et/ou de cataracte [voir EFFETS INDÉSIRABLES ].
Informations sur les conseils aux patients
[Voir Étiquetage des patients approuvé par la FDA ]
Les patients traités par RHINOCORT 100 mcg AQUA (budésonide) en vaporisateur nasal doivent recevoir les informations et instructions suivantes. Ces informations sont destinées à aider le patient à utiliser le médicament de manière sûre et efficace. Il ne s'agit pas d'une divulgation de tous les effets indésirables ou intentionnels possibles. Pour une utilisation appropriée du spray nasal RHINOCORT 100mcg AQUA (budésonide) et pour obtenir une amélioration maximale, le patient doit lire et suivre l'étiquetage patient approuvé par la FDA.
Effets nasaux locaux
Les patients doivent être informés que des épistaxis et des infections localisées à Candida albicans se sont produites dans le nez et le pharynx chez certains patients. Si une candidose se développe, elle doit être traitée par un traitement local ou systémique approprié et interrompre le traitement par RHINOCORT 100 mcg AQUA (budésonide) Vaporisateur nasal. De plus, les corticostéroïdes nasaux sont associés à une perforation septale nasale et à une altération de la cicatrisation des plaies. Les patients qui ont récemment subi des ulcères nasaux, une chirurgie nasale ou un traumatisme nasal ne doivent pas utiliser RHINOCORT AQUA (budésonide) en vaporisateur nasal tant que la guérison n'est pas terminée [voir AVERTISSEMENTS ET PRECAUTIONS ].
Hypersensibilité, y compris anaphylaxie
Les patients doivent être informés que des réactions d'hypersensibilité, notamment réaction anaphylactique, urticaire, éruption cutanée, dermatite, œdème de Quincke et prurit, ont été signalées lors de l'utilisation de RHINOCORT AQUA (budésonide) en vaporisateur nasal. Cesser
RHINOCORT AQUA (budésonide) vaporisateur nasal si de telles réactions surviennent [voir CONTRE-INDICATIONS, AVERTISSEMENTS ET PRECAUTIONS et EFFETS INDÉSIRABLES ].
Immunosuppression
Les patients qui reçoivent des doses immunosuppressives de corticostéroïdes doivent être avertis d'éviter toute exposition à la varicelle ou à la rougeole et, en cas d'exposition, de consulter leur médecin sans délai. Les patients doivent être informés de l'aggravation potentielle d'une tuberculose existante, d'une infection fongique, bactérienne, virale ou parasitaire, ou d'un herpès simplex oculaire [voir AVERTISSEMENTS ET PRECAUTIONS ].
Vitesse de croissance réduite
Les patients doivent être informés que les corticostéroïdes intranasaux, y compris le budésonide, peuvent entraîner une réduction de la vitesse de croissance lorsqu'ils sont administrés à des patients pédiatriques. Les médecins doivent suivre de près la croissance des enfants et des adolescents prenant des corticostéroïdes par n'importe quelle voie [voir AVERTISSEMENTS ET PRECAUTIONS ].
Glaucome et Cataractes
Les patients doivent être informés que l'utilisation à long terme de corticostéroïdes intranasaux, y compris le budésonide, peut augmenter le risque de certains problèmes oculaires (cataracte et glaucome). Les patients doivent informer leur fournisseur de soins de santé si un changement de vision est noté lors de l'utilisation de RHINOCORT AQUA (budésonide) en vaporisateur nasal [voir AVERTISSEMENTS ET PRECAUTIONS ].
Utiliser quotidiennement
Les patients doivent utiliser le vaporisateur nasal RHINOCORT 100mcg AQUA (budésonide) à intervalles réguliers puisque son efficacité dépend de son utilisation régulière. Les patients peuvent remarquer une amélioration des symptômes nasaux dans les 10 heures suivant la première utilisation du vaporisateur nasal RHINOCORT AQUA (budésonide). Le bénéfice maximal peut ne pas être atteint avant environ 2 semaines après le début du traitement [voir DOSAGE ET ADMINISTRATION ].
Les patients doivent prendre le médicament comme indiqué et ne doivent pas dépasser la dose prescrite. Le patient doit contacter le médecin si les symptômes ne s'améliorent pas après deux semaines ou si l'état s'aggrave. Les patients qui présentent des épisodes récurrents d'épistaxis (saignements de nez) ou d'inconfort de la cloison nasale pendant qu'ils prennent ce médicament doivent contacter leur médecin. Pour une utilisation appropriée du vaporisateur nasal RHINOCORT AQUA (budésonide) et pour obtenir une amélioration maximale, le patient doit lire et suivre attentivement les informations patient qui l'accompagnent. N'utilisez pas RHINOCORT 100mcg AQUA (budésonide) vaporisateur nasal après que le nombre de vaporisations indiqué sur l'étiquette a été utilisé (n'inclut pas l'amorçage) ou après la date de péremption indiquée sur la boîte ou l'étiquette du flacon.
Comment utiliser RHINOCORT 100mcg AQUA (budésonide) Vaporisateur nasal
Les patients doivent être soigneusement informés de l'utilisation de ce médicament afin d'assurer une administration optimale de la dose [voir INFORMATIONS PATIENTS ].
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Dans une étude orale de 104 semaines chez des rats Sprague-Dawley, une augmentation statistiquement significative de l'incidence des gliomes a été observée chez les rats mâles recevant une dose orale de budésonide de 50 mcg/kg/jour (environ le double de la dose intranasale quotidienne maximale recommandée chez adultes et enfants sur une base mcg/m2). Aucune tumorigénicité n'a été observée chez les rats mâles à des doses orales allant jusqu'à 25 mcg/kg (approximativement égales à la dose intranasale quotidienne maximale recommandée chez les adultes et les enfants sur une base mcg/m2, et chez les rats femelles à des doses orales allant jusqu'à 50 mcg/kg environ deux fois la dose intranasale quotidienne maximale recommandée chez les adultes et les enfants sur une base de mcg/m2). Dans deux études supplémentaires de deux ans chez des rats mâles Fischer et Sprague-Dawley, le budésonide n'a causé aucun gliome à une dose orale de 50 mcg/kg (environ deux fois la dose intranasale quotidienne maximale recommandée chez les adultes et les enfants sur une base mcg/m2). Cependant, chez les rats mâles Sprague-Dawley, le budésonide a provoqué une augmentation statistiquement significative de l'incidence des tumeurs hépatocellulaires à une dose orale de 50 mcg/kg (environ le double de la dose intranasale quotidienne maximale recommandée chez les adultes et les enfants sur une base mcg/m2 ). Les corticostéroïdes de référence simultanés (prednisolone et acétonide de triamcinolone) dans ces deux études ont montré des résultats similaires.
Il n'y avait aucune preuve d'effet cancérogène lorsque le budésonide a été administré par voie orale pendant 91 semaines à des souris à des doses allant jusqu'à 200 mcg/kg/jour (environ 3 fois la dose intranasale quotidienne maximale recommandée chez les adultes et les enfants sur une base mcg/m2) .
Le budésonide ne s'est pas révélé mutagène ou clastogène dans six systèmes de test différents : test d'Ames Salmonella/microsome sur plaque, test du micronoyau de la souris, test du lymphome de la souris, test d'aberration chromosomique dans les lymphocytes humains, test létal récessif lié au sexe chez Drosophila melanogaster et analyse de la réparation de l'ADN chez le rat culture d'hépatocytes.
Chez le rat, le budésonide n'a eu aucun effet sur la fertilité à des doses sous-cutanées allant jusqu'à 80 mcg/kg (environ 3 fois la dose intranasale quotidienne maximale recommandée chez l'adulte sur une base de mcg/m2).
À une dose sous-cutanée de 20 mcg/kg/jour (inférieure à la dose intranasale quotidienne maximale recommandée chez l'adulte sur une base de mcg/m2), diminution du gain de poids maternel, de la viabilité prénatale et de la viabilité des jeunes à la naissance et pendant l'allaitement ont été observés. Aucun de ces effets n'a été noté à 5 mcg/kg (moins que la dose intranasale quotidienne maximale recommandée chez les adultes sur une base mcg/m2).
Utilisation dans des populations spécifiques
Grossesse
Effets tératogènes : Catégorie de grossesse B. L'impact du budésonide sur les résultats de la grossesse humaine a été évalué par des évaluations des registres des naissances liées à l'utilisation maternelle de budésonide inhalé (c'est-à-dire PULMICORT TURBUHALER) et de budésonide administré par voie intranasale (c'est-à-dire RHINOCORT 100mcg AQUA (budésonide) Vaporisateur nasal). Les résultats d'études épidémiologiques de cohorte prospectives basées sur la population examinant les données de trois registres suédois couvrant environ 99 % des grossesses de 1995 à 2001 (c'est-à-dire, registre médical suédois des naissances ; registre des malformations congénitales ; registre de cardiologie infantile) malformations congénitales dues à l'utilisation de budésonide inhalé ou intranasal au début de la grossesse.
Les malformations congénitales ont été étudiées chez 2 014 nourrissons nés de mères déclarant utiliser du budésonide inhalé pour l'asthme en début de grossesse (habituellement 10 à 12 semaines après la dernière période menstruelle), période pendant laquelle la plupart des malformations d'organes majeurs surviennent.1 Le taux global de malformations congénitales était similaire par rapport au taux de la population générale (3,8 % contre 3,5 %, respectivement). Le nombre de nourrissons nés avec des fentes orofaciales et des malformations cardiaques était similaire au nombre attendu dans la population générale (4 enfants contre 3,3 et 18 enfants contre 17-18, respectivement). Dans une étude de suivi portant le nombre total de nourrissons à 2 534, le taux de malformations congénitales globales chez les nourrissons dont les mères ont été exposées au budésonide inhalé en début de grossesse n'était pas différent du taux de tous les nouveau-nés au cours de la même période (3,6 % ).2 Une troisième étude du registre médical suédois des naissances de 2 968 grossesses exposées au budésonide inhalé, dont la majorité étaient des expositions au premier trimestre, a rapporté l'âge gestationnel, le poids à la naissance, la durée de naissance, les mortinaissances et les naissances multiples similaires pour les nourrissons exposés par rapport à nourrissons non exposés.3
Les malformations congénitales ont été étudiées chez 2 113 nourrissons nés de mères déclarant avoir utilisé du budésonide intranasal en début de grossesse. Le taux de malformations congénitales globales était similaire à celui de la population générale (4,5 % contre 3,5 %, respectivement). L'odds ratio (OR) ajusté était de 1,06 (IC à 95 % 0,86-1,31). Le nombre de nourrissons nés avec des fentes orofaciales était similaire au nombre attendu dans la population générale (3 enfants contre 3, respectivement). Le nombre de nourrissons nés avec des malformations cardiaques a dépassé celui attendu dans la population générale (28 enfants contre 17,8 respectivement). L'exposition systémique au budésonide intranasal est 6 fois inférieure à celle du budésonide inhalé et aucune association d'anomalies cardiaques n'a été observée avec des expositions plus élevées au budésonide.
Malgré les découvertes sur les animaux, il semblerait que la possibilité de dommages au fœtus soit faible si le médicament est utilisé pendant la grossesse. Néanmoins, étant donné que les études chez l'homme ne peuvent exclure la possibilité d'effets nocifs, le vaporisateur nasal RHINOCORT AQUA (budésonide) ne doit être utilisé pendant la grossesse qu'en cas de nécessité absolue.
Le budésonide a entraîné une perte fœtale, une diminution du poids des ratons et des anomalies squelettiques à une dose sous-cutanée chez les lapins qui était environ 2 fois la dose intranasale quotidienne maximale recommandée chez les adultes sur une base mcg/m2 et à une dose sous-cutanée chez les rats qui était environ 16 fois la dose intranasale quotidienne maximale recommandée chez les adultes sur une base mcg/m2. Aucun effet tératogène ou embryocide n'a été observé chez le rat lorsque le budésonide a été administré par inhalation à des doses allant jusqu'à environ 8 fois la dose intranasale quotidienne maximale recommandée chez l'adulte sur une base mcg/m2.
L'expérience avec les corticostéroïdes oraux depuis leur introduction en doses pharmacologiques, par opposition aux doses physiologiques, suggère que les rongeurs sont plus sujets aux effets tératogènes des corticostéroïdes que les humains.
Effets non tératogènes : L'hypoadrénalisme peut survenir chez les nourrissons nés de mères recevant des corticostéroïdes pendant la grossesse. Ces nourrissons doivent être surveillés attentivement.
Mères allaitantes
Le budésonide est sécrété dans le lait maternel. Les données sur le budésonide administré par inhalateur de poudre sèche indiquent que la dose orale quotidienne totale de budésonide disponible dans le lait maternel pour le nourrisson est d'environ 0,3 % à 1 % de la dose inhalée par la mère [voir PHARMACOLOGIE CLINIQUE, Pharmacocinétique, Populations particulières, Soins infirmiers ]. Aucune étude n'a été menée chez les femmes qui allaitent spécifiquement avec RHINOCORT 100mcg AQUA Nasal Spray; cependant, la dose de budésonide disponible pour le nourrisson dans le lait maternel, en pourcentage de la dose maternelle, devrait être similaire. Le vaporisateur nasal RHINOCORT AQUA (budésonide) ne doit être utilisé chez les femmes qui allaitent que si cela est cliniquement approprié. Les prescripteurs doivent peser les avantages connus de l'allaitement pour la mère et le nourrisson par rapport aux risques potentiels d'une exposition minimale au budésonide chez le nourrisson. Les considérations posologiques comprennent la prescription ou l'ajustement à la dose la plus faible cliniquement efficace et l'utilisation de RHINOCORT 100 mcg AQUA (budésonide) vaporisateur nasal immédiatement après l'allaitement afin de maximiser l'intervalle de temps entre l'administration et l'allaitement afin de minimiser l'exposition du nourrisson.
Utilisation pédiatrique
La sécurité et l'efficacité chez les patients pédiatriques de moins de 6 ans n'ont pas été établies.
Des études cliniques contrôlées ont montré que les corticostéroïdes intranasaux peuvent entraîner une réduction de la vitesse de croissance chez les patients pédiatriques. Cet effet a été observé en l'absence de preuves de laboratoire de la suppression de l'axe hypothalamo-hypophyso-surrénalien (HHS), ce qui suggère que la vitesse de croissance est un indicateur plus sensible de l'exposition systémique aux corticostéroïdes chez les patients pédiatriques que certains tests couramment utilisés de la fonction de l'axe HHS. . Les effets à long terme de cette réduction de la vitesse de croissance associée aux corticostéroïdes intranasaux, y compris l'impact sur la taille adulte finale, sont inconnus. Le potentiel de croissance « de rattrapage » après l'arrêt du traitement par des corticostéroïdes intranasaux n'a pas été suffisamment étudié.
La croissance des patients pédiatriques recevant des corticostéroïdes intranasaux, y compris le vaporisateur nasal RHINOCORT 100 mcg AQUA (budésonide), doit être surveillée régulièrement (p. ex., par stadiométrie). Les effets potentiels sur la croissance d'un traitement prolongé doivent être mis en balance avec les bénéfices cliniques obtenus et les risques et bénéfices associés aux thérapies alternatives. Pour minimiser les effets systémiques des corticostéroïdes intranasaux, y compris le vaporisateur nasal RHINOCORT AQUA (budésonide), chaque patient doit être titré à la dose la plus faible qui contrôle efficacement ses symptômes.
Une étude de croissance clinique contrôlée par placebo d'un an a été menée chez 229 patients pédiatriques (âgés de 4 à 8 ans) pour évaluer l'effet de RHINOCORT AQUA (budésonide) en vaporisateur nasal (dose unique quotidienne de 64 mcg, la dose initiale recommandée pour les enfants de 6 ans et plus) sur la vitesse de croissance. Sur une population de 141 patients recevant RHINOCORT 100 mcg AQUA (budésonide) en vaporisateur nasal et 67 patients recevant un placebo, l'estimation ponctuelle de la vitesse de croissance avec RHINOCORT AQUA (budésonide) en vaporisateur nasal était inférieure de 0,25 cm/an à celle observée avec le placebo (intervalle de confiance à 95 % allant de 0,59 cm/an de moins que le placebo à 0,08 cm/an de plus que le placebo).
Dans une étude portant sur des enfants asthmatiques âgés de 5 à 12 ans, ceux traités avec du budésonide administré via un inhalateur de poudre sèche 200 mcg deux fois par jour (n = 311) ont présenté une réduction de croissance de 1,1 centimètre (0,433 pouce) par rapport à ceux recevant un placebo ( n=418) au bout d'un an ; la différence entre ces deux groupes de traitement n'a pas augmenté davantage au cours des trois années de traitement supplémentaire. Au bout de quatre ans, les enfants traités avec un inhalateur de poudre sèche de budésonide et les enfants traités avec un placebo avaient des vitesses de croissance similaires. Les conclusions tirées de cette étude peuvent être faussées par l'utilisation inégale des corticostéroïdes dans les groupes de traitement et l'inclusion de données provenant de patients atteignant la puberté au cours de l'étude.
Les effets systémiques des corticostéroïdes inhalés sont liés à l'exposition systémique à ces médicaments. Des études pharmacocinétiques ont démontré que chez les adultes et les enfants, l'exposition systémique au budésonide aux doses les plus élevées recommandées de RHINOCORT AQUA (budésonide) vaporisateur nasal ne devrait pas être supérieure à l'exposition aux doses recommandées les plus faibles via un inhalateur de poudre sèche. Par conséquent, les effets systémiques (axe HPA et croissance) du budésonide délivré par le vaporisateur nasal RHINOCORT AQUA (budésonide) ne devraient pas être supérieurs à ceux rapportés pour le budésonide inhalé lorsqu'il est administré via l'inhalateur de poudre sèche.
La possibilité que RHINOCORT 100 mcg AQUA (budésonide) en vaporisateur nasal provoque une suppression de la croissance chez les patients sensibles ou lorsqu'il est administré à des doses supérieures à 64 mcg par jour ne peut être exclu. La gamme posologique recommandée chez les patients âgés de 6 à 11 ans est de 64 à 128 mcg par jour [voir DOSAGE ET ADMINISTRATION ].
Utilisation gériatrique
Sur les 2 461 patients des études cliniques sur le vaporisateur nasal RHINOCORT 100 mcg AQUA (budésonide), 5 % étaient âgés de 60 ans et plus. Aucune différence globale d'innocuité ou d'efficacité n'a été observée entre ces sujets et les sujets plus jeunes, à l'exception d'un effet indésirable rapportant une fréquence d'épistaxis qui augmentait avec l'âge. De plus, d'autres expériences cliniques rapportées n'ont pas identifié d'autres différences dans les réponses entre les patients âgés et les patients plus jeunes, mais une plus grande sensibilité de certaines personnes âgées ne peut être exclue.
Insuffisance hépatique
Aucune étude pharmacocinétique formelle utilisant RHINOCORT 100 mcg AQUA (budésonide) en vaporisateur nasal n'a été menée chez des patients atteints d'insuffisance hépatique. Cependant, étant donné que le budésonide est principalement éliminé par métabolisme hépatique, une altération de la fonction hépatique peut entraîner une accumulation de budésonide dans le plasma. Par conséquent, les patients atteints de maladie hépatique doivent être étroitement surveillés.
SURDOSAGE
Un surdosage aigu avec cette forme posologique est peu probable car un flacon pulvérisateur de 120 de RHINOCORT 100 mcg AQUA (budésonide) vaporisateur nasal 32 mcg ne contient qu'environ 5,4 mg de budésonide. Un surdosage chronique peut entraîner des signes/symptômes d'hypercorticisme [voir AVERTISSEMENTS ET PRECAUTIONS ].
CONTRE-INDICATIONS
RHINOCORT AQUA (budésonide) vaporisateur nasal est contre-indiqué chez les patients présentant une hypersensibilité à l'un de ses ingrédients [voir AVERTISSEMENTS ET PRECAUTIONS ].
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
Le budésonide est un corticostéroïde anti-inflammatoire qui présente une puissante activité glucocorticoïde et une faible activité minéralocorticoïde. Dans les modèles in vitro et animaux standard, le budésonide a une affinité environ 200 fois plus élevée pour le récepteur des glucocorticoïdes et une puissance anti-inflammatoire topique 1000 fois plus élevée que le cortisol (dosage de l'œdème de l'oreille à l'huile de croton de rat). En tant que mesure de l'activité systémique, le budésonide est 40 fois plus puissant que le cortisol lorsqu'il est administré par voie sous-cutanée et 25 fois plus puissant lorsqu'il est administré par voie orale dans le test d'involution du thymus chez le rat. La signification clinique de ceci est inconnue.
L'activité de RHINOCORT 100mcg AQUA Nasal Spray est due au médicament parent, le budésonide. Dans les études d'affinité pour les récepteurs des glucocorticoïdes, la forme 22R était deux fois plus active que l'épimère 22S. Des études in vitro ont indiqué que les deux formes de budésonide ne s'interconvertissent pas.
Le mécanisme précis des actions des corticostéroïdes sur l'inflammation dans la rhinite allergique saisonnière et perannuelle n'est pas bien connu. L'inflammation est un élément important dans la pathogenèse de la rhinite allergique saisonnière et apériodique. Les corticostéroïdes ont un large éventail d'activités inhibitrices contre plusieurs types de cellules (p. ex. mastocytes, éosinophiles, neutrophiles, macrophages et lymphocytes) et médiateurs (p. ex. histamine, eicosanoïdes, leucotriènes et cytokines) impliqués dans les réactions allergiques et non allergiques. inflammation. Ces actions anti-inflammatoires des corticostéroïdes peuvent contribuer à leur efficacité dans la rhinite allergique saisonnière et perannuelle.
Pharmacodynamie
Une étude clinique de 3 semaines sur la rhinite saisonnière, comparant l'inhalateur nasal RHINOCORT 100 mcg, le budésonide ingéré par voie orale et un placebo chez 98 patients atteints de rhinite allergique due au pollen de bouleau, a démontré que l'effet thérapeutique de l'inhalateur nasal RHINOCORT peut être attribué aux effets topiques de budésonide.

Effets d'axe HPA
Les effets de RHINOCORT 100mcg AQUA (budésonide) vaporisateur nasal sur la fonction surrénalienne ont été évalués dans plusieurs essais cliniques. Dans un essai clinique de quatre semaines, 61 patients adultes ayant reçu 256 mcg par jour de vaporisateur nasal RHINOCORT AQUA (budésonide) n'ont démontré aucune différence significative par rapport aux patients recevant un placebo dans les taux plasmatiques de cortisol mesurés avant et 60 minutes après 0,25 mg de cosyntropine intramusculaire. Il n'y avait pas de différences constantes dans les mesures de cortisol urinaire sur 24 heures chez les patients recevant jusqu'à 400 mcg par jour. Des résultats similaires ont été observés dans une étude portant sur 150 enfants et adolescents âgés de 6 à 17 ans atteints de rhinite perannuelle qui ont été traités avec 256 mcg par jour pendant jusqu'à 12 mois.
Après un traitement avec la dose quotidienne maximale recommandée de RHINOCORT AQUA (budésonide) en vaporisateur nasal (256 mcg) pendant sept jours, il y a eu une diminution faible, mais statistiquement significative, de l'aire sous la courbe plasmatique du cortisol-temps sur 24 heures (ASC0-24h ) chez des volontaires adultes sains.
Une suppression liée à la dose de l'excrétion urinaire de cortisol sur 24 heures a été observée après l'administration de RHINOCORT AQUA (budésonide) en vaporisateur nasal à des doses allant de 100 à 800 mcg par jour pendant jusqu'à quatre jours chez 78 volontaires adultes en bonne santé. La pertinence clinique de ces résultats est inconnue.
Pharmacocinétique
Absorption
Après l'administration intranasale d'une dose unique de vaporisateur nasal RHINOCORT AQUA (budésonide) (128 mcg), la concentration plasmatique maximale moyenne d'environ 0,3 nmol/L se produit environ 0,5 heure après l'administration. Par rapport à une dose intraveineuse, environ 34 % de la dose intranasale délivrée atteint la circulation systémique, dont la majeure partie est absorbée par la muqueuse nasale. Alors que le budésonide est bien absorbé par le tractus gastro-intestinal, la biodisponibilité orale du budésonide est faible (~ 10 %), principalement en raison d'un important métabolisme de premier passage dans le foie.
Distribution
Le volume de distribution du budésonide était d'environ 2 à 3 L/kg. Il était lié à 85 à 90 % aux protéines plasmatiques. Le volume de distribution de l'épimère 22R est presque le double de celui de l'épimère 22S. La liaison aux protéines était constante sur une plage de concentration (1-100 nmol/L) obtenue avec et dépassant les doses recommandées de RHINOCORT 100mcg AQUA Nasal Spray. Le budésonide a montré peu ou pas de liaison à la globuline liant les corticostéroïdes. Le budésonide s'est rapidement équilibré avec les globules rouges d'une manière indépendante de la concentration avec un rapport sang/plasma d'environ 0,8.
Métabolisme
Des études in vitro avec des homogénats de foie humain ont montré que le budésonide est rapidement et largement métabolisé. Deux métabolites majeurs formés via la biotransformation catalysée par l'isoenzyme 3A4 (CYP3A4) du cytochrome P450 (CYP) ont été isolés et identifiés comme étant la 16α-hydroxyprednisolone et la 6p-hydroxybudésonide. L'activité corticostéroïde de chacun de ces deux métabolites est inférieure à 1 % de celle de la molécule mère. Aucune différence qualitative entre les schémas métaboliques in vitro et in vivo n'a été détectée. Une inactivation métabolique négligeable a été observée dans les préparations de poumon et de sérum humains.
Excrétion/Élimination
La forme 22R du budésonide était préférentiellement éliminée par le foie avec une clairance systémique de 1,4 L/min contre 1,0 L/min pour la forme 22S. La demi-vie terminale, de 2 à 3 heures, était la même pour les deux épimères et était indépendante de la dose. Le budésonide a été excrété dans l'urine et les fèces sous forme de métabolites. Environ 2/3 d'une dose intranasale radiomarquée ont été récupérés dans l'urine et le reste dans les fèces. Aucun budésonide inchangé n'a été détecté dans les urines.
Populations spécifiques
Gériatrique
La pharmacocinétique de RHINOCORT 100 mcg AQUA (budésonide) en vaporisateur nasal chez les patients gériatriques n'a pas été spécifiquement étudiée.
Pédiatrique
Après l'administration de RHINOCORT 100 mcg AQUA (budésonide) en vaporisateur nasal, le temps nécessaire pour atteindre les concentrations maximales du médicament et la demi-vie plasmatique étaient similaires chez les enfants et les adultes. Les enfants présentaient des concentrations plasmatiques environ deux fois supérieures à celles observées chez les adultes, principalement en raison des différences de poids entre les enfants et les adultes.
Le genre
Aucune étude pharmacocinétique spécifique n'a été menée pour évaluer l'effet du sexe sur la pharmacocinétique du budésonide. Cependant, après l'administration de 400 mcg de RHINOCORT 100 mcg AQUA (budésonide) en vaporisateur nasal à 7 hommes et 8 femmes volontaires dans une étude pharmacocinétique, aucune différence majeure entre les sexes n'a été observée dans les paramètres pharmacocinétiques.
Course
Aucune étude spécifique n'a été entreprise pour évaluer l'effet de la race sur la pharmacocinétique du budésonide.
Mères allaitantes
La disposition du budésonide lorsqu'il est administré par inhalation orale à partir d'un inhalateur de poudre sèche à des doses de 200 ou 400 mcg deux fois par jour pendant au moins 3 mois a été étudiée chez huit femmes allaitantes souffrant d'asthme de 1 à 6 mois après l'accouchement. L'exposition systémique au budésonide chez ces femmes semble être comparable à celle observée chez les femmes non allaitantes souffrant d'asthme dans d'autres études. Le lait maternel obtenu plus de huit heures après l'administration a révélé que la concentration maximale de budésonide pour les doses de 400 et 800 mcg était de 0,39 et 0,78 nmol/L, respectivement, et s'est produite dans les 45 minutes suivant l'administration. La dose orale quotidienne estimée de budésonide du lait maternel au nourrisson était d'environ 0,007 et 0,014 mcg/kg/jour pour les deux schémas posologiques utilisés dans cette étude, ce qui représente environ 0,3 % à 1 % de la dose inhalée par la mère. Les taux de budésonide dans les échantillons de plasma prélevés sur cinq nourrissons environ 90 minutes après l'allaitement (et environ 140 minutes après l'administration du médicament à la mère) étaient inférieurs aux niveaux quantifiables ( Utilisation dans des populations spécifiques, mères allaitantes ].
Insuffisance rénale ou hépatique
La pharmacocinétique du budésonide n'a pas été étudiée chez les patients insuffisants rénaux. Une fonction hépatique réduite peut affecter l'élimination des corticostéroïdes. La pharmacocinétique du budésonide a été affectée par une altération de la fonction hépatique, comme en témoigne une disponibilité systémique doublée après ingestion orale. La pertinence de ce résultat pour le budésonide administré par voie intranasale n'a pas été établie.
Interactions médicament-médicament
Inhibiteurs des enzymes du cytochrome P450
Kétoconazole : Le kétoconazole, un puissant inhibiteur de l'isoenzyme 3A4 (CYP3A4) du cytochrome P450 (CYP), la principale enzyme métabolique des corticostéroïdes, a augmenté les taux plasmatiques de budésonide ingéré par voie orale [voir AVERTISSEMENTS ET PRECAUTIONS et INTERACTIONS MÉDICAMENTEUSES ].
Cimétidine : Aux doses recommandées, la cimétidine, un inhibiteur non spécifique des enzymes CYP, a eu un effet léger mais cliniquement non significatif sur la pharmacocinétique du budésonide oral.
Toxicologie animale et/ou pharmacologie
Le budésonide était tératogène et embryocide chez le lapin et le rat. Le budésonide a entraîné une perte fœtale, une diminution du poids des ratons et des anomalies squelettiques à une dose sous-cutanée de 25 mcg/kg chez le lapin (environ 2 fois la dose intranasale quotidienne maximale recommandée chez l'adulte sur une base mcg/m2) et à une dose sous-cutanée de 500 mcg /kg chez le rat (environ 16 fois la dose intranasale quotidienne maximale recommandée chez l'adulte sur une base de mcg/m2). Aucun effet tératogène ou embryocide n'a été observé chez le rat lorsque le budésonide a été administré par inhalation à des doses allant jusqu'à 250 mcg/kg (environ 8 fois la dose intranasale quotidienne maximale recommandée chez l'adulte sur une base mcg/m2).
Etudes cliniques
L'efficacité thérapeutique du vaporisateur nasal RHINOCORT AQUA (budésonide) a été évaluée dans des essais cliniques contrôlés par placebo sur la rhinite allergique saisonnière et apériodique d'une durée de 3 à 6 semaines.
Le nombre de patients traités par budésonide dans ces études était de 90 hommes et 51 femmes âgés de 6 à 12 ans et de 691 hommes et 694 femmes âgés de 12 ans et plus. Les patients étaient majoritairement caucasiens.
Dans l'ensemble, les résultats de ces essais cliniques ont montré que le vaporisateur nasal RHINOCORT AQUA (budésonide) administré une fois par jour permet une réduction statistiquement significative de la gravité des symptômes nasaux de la rhinite allergique saisonnière et apériodique, y compris l'écoulement nasal, les éternuements et la congestion nasale.
Une amélioration des symptômes nasaux peut être notée chez les patients dans les 10 heures suivant la première utilisation du vaporisateur nasal RHINOCORT 100 mcg AQUA (budésonide). Ce délai d'apparition est corroboré par une étude d'unité d'exposition environnementale chez des patients atteints de rhinite allergique saisonnière qui a démontré que le vaporisateur nasal RHINOCORT 100 mcg AQUA (budésonide) a entraîné une amélioration statistiquement significative des symptômes nasaux par rapport au placebo en 10 heures. Un autre soutien provient d'une étude clinique de patients atteints de rhinite allergique perannuelle qui a démontré une amélioration statistiquement significative des symptômes nasaux pour le vaporisateur nasal RHINOCORT AQUA (budésonide) et pour le comparateur actif (furoate de mométasone) par rapport au placebo après 8 heures. Le début a également été évalué dans cette étude avec le débit inspiratoire nasal de pointe et ce paramètre n'a pas montré d'efficacité pour l'un ou l'autre des traitements actifs. Bien que des améliorations statistiquement significatives des symptômes nasaux par rapport au placebo aient été notées dans les 8 à 10 heures dans ces études, environ la moitié aux deux tiers de l'amélioration clinique ultime avec RHINOCORT 100 mcg AQUA (budésonide) en vaporisateur nasal se produit au cours des 1 à 2 premiers jours, et le bénéfice maximal peut ne pas être atteint avant environ 2 semaines après le début du traitement.
RÉFÉRENCES
Kallen B, Rydhstroem H, Aberg A. Malformations congénitales après l'utilisation de budésonide inhalé en début de grossesse. Obstet Gynecol 1999; 93:392-395.
2 Ericson A, Kallen B. Utilisation de drogues pendant la grossesse : méthode d'enregistrement suédoise unique qui peut être améliorée. Agence suédoise des produits médicaux 1999 ; 1:8-11.
3 Norjavaara E, Gerhardsson de Verdier M. Résultats de grossesse normaux dans une étude basée sur la population incluant 2968 femmes enceintes exposées au budésonide. J Allergy Clin Immunol 2003;! 11:736-742.
INFORMATIONS PATIENTS
RHINOCORT 100mcg AQUA (budésonide) ® (RINE-o-cort AH-kwa) (budésonide) vaporisateur nasal
Pour une utilisation dans votre nez uniquement
Lisez les informations destinées aux patients fournies avec RHINOCORT 100 mcg AQUA (budésonide) vaporisateur nasal avant de commencer à l'utiliser et chaque fois que vous recevez une recharge. Il peut y avoir de nouvelles informations. Ces informations ne remplacent pas une discussion avec votre fournisseur de soins de santé au sujet de votre état de santé ou de votre traitement. Si vous avez des questions sur le vaporisateur nasal RHINOCORT AQUA (budésonide), consultez votre fournisseur de soins de santé ou votre pharmacien.
Qu'est-ce que le spray nasal RHINOCORT 100mcg AQUA (budésonide) ?
RHINOCORT AQUA (budésonide) vaporisateur nasal est un médicament d'ordonnance utilisé pour traiter les symptômes d'allergies saisonnières et permanentes chez les adultes et les enfants de 6 ans et plus.
Le vaporisateur nasal RHINOCORT AQUA contient du budésonide, qui est un corticostéroïde artificiel (synthétique). Les corticostéroïdes intranasaux sont des hormones naturelles présentes dans le corps qui réduisent l'enflure de la muqueuse du nez. Lorsque vous vaporisez RHINOCORT 100 mcg AQUA (budésonide) en vaporisateur nasal dans votre nez, cela aide à réduire les symptômes nasaux de la rhinite allergique (inflammation de la muqueuse du nez), tels que le nez bouché, l'écoulement nasal, les démangeaisons et les éternuements.
L'innocuité et l'efficacité de RHINOCORT 100mcg AQUA (budésonide) vaporisateur nasal n'ont pas été démontrées chez les enfants de moins de 6 ans.
Qui ne devrait pas utiliser le vaporisateur nasal RHINOCORT AQUA (budésonide)?
N'utilisez jamais RHINOCORT 100mcg AQUA (budésonide) Vaporisateur nasal :
- si vous êtes allergique au budésonide ou à l'un des ingrédients du vaporisateur nasal RHINOCORT AQUA. Voir la fin de cette notice pour la liste complète des ingrédients de RHINOCORT AQUA (budésonide) vaporisateur nasal.
Que dois-je dire à mon fournisseur de soins de santé avant d'utiliser le vaporisateur nasal RHINOCORT 100mcg AQUA (budésonide) ?
Avant d'utiliser RHINOCORT AQUA (budésonide) vaporisateur nasal, informez votre fournisseur de soins de santé ou votre pharmacien si vous :
- avez récemment côtoyé une personne atteinte de varicelle ou de rougeole
- avoir des problèmes de foie
- avez des infections non traitées
- avez déjà eu une infection appelée tuberculose
- avoir une infection oculaire
- avez récemment subi une intervention chirurgicale ou une blessure au nez
- avoir d'autres conditions médicales
- êtes enceinte ou envisagez de devenir enceinte. On ne sait pas si le vaporisateur nasal RHINOCORT 100 mcg AQUA (budésonide) nuira à votre bébé à naître. Parlez à votre médecin si vous êtes enceinte ou envisagez de devenir enceinte.
- allaitez ou envisagez d'allaiter. RHINOCORT 100mcg AQUA (budésonide) vaporisateur nasal peut passer dans votre lait maternel. Discutez avec votre médecin de la meilleure façon de nourrir votre bébé si vous prenez le vaporisateur nasal RHINOCORT AQUA (budésonide).
Informez votre professionnel de la santé de tous les médicaments que vous prenez, compris les médicaments sur ordonnance et en vente libre, les vitamines et les suppléments à base de plantes.
RHINOCORT AQUA (budésonide) vaporisateur nasal peut affecter la façon dont d'autres médicaments agissent, et d'autres médicaments peuvent affecter la façon dont RHINOCORT 100mcg AQUA (budésonide) vaporisateur nasal fonctionne.
Connaissez les médicaments que vous prenez. Conservez une liste de vos médicaments avec vous pour la montrer à votre fournisseur de soins de santé et à votre pharmacien lorsque vous recevez un nouveau médicament.
Comment dois-je utiliser RHINOCORT 100mcg AQUA (budésonide) Vaporisateur nasal?
- Le vaporisateur nasal RHINOCORT 100mcg AQUA (budésonide) doit être utilisé uniquement dans le nez. Ne le vaporisez pas dans vos yeux ou votre bouche.
- Utilisez le vaporisateur nasal RHINOCORT AQUA (budésonide) exactement comme votre professionnel de la santé vous l'a indiqué.
- Il est très important que vous utilisiez RHINOCORT AQUA (budésonide) vaporisateur nasal régulièrement. N'arrêtez pas d'utiliser le vaporisateur nasal RHINOCORT AQUA (budésonide) et ne modifiez pas votre dose sans en parler à votre fournisseur de soins de santé, même si vous vous sentez mieux.
- Parlez à votre fournisseur de soins de santé si vos symptômes ne s'améliorent pas après avoir pris le vaporisateur nasal RHINOCORT AQUA (budésonide) pendant 2 semaines ou si vos symptômes s'aggravent.
- Un adulte doit aider un jeune enfant à utiliser ce médicament.
- Voir les instructions d'utilisation pour les patients à la fin de cette notice pour des informations complètes sur la façon d'utiliser RHINOCORT AQUA (budésonide) vaporisateur nasal.
Quels sont les effets secondaires possibles du vaporisateur nasal RHINOCORT AQUA (budésonide)?
RHINOCORT 100 mcg AQUA (budésonide) vaporisateur nasal peut causer des effets secondaires graves, notamment :
- trou dans le cartilage à l'intérieur du nez (perforation septale nasale). Dites à votre fournisseur de soins de santé si vous avez un sifflement de votre nez lorsque vous respirez.
- cicatrisation lente des plaies. Vous ne devez pas utiliser RHINOCORT 100mcg AQUA (budésonide) vaporisateur nasal jusqu'à ce que votre nez soit cicatrisé si vous avez une plaie au nez, si vous avez subi une intervention chirurgicale au nez ou si votre nez a été blessé.
- infection fongique dans le nez.
- réactions allergiques. Informez votre fournisseur de soins de santé ou obtenez une aide médicale immédiatement si vous avez :
- éruption cutanée, rougeur ou gonflement
- démangeaisons sévères
- gonflement du visage, de la bouche et de la langue
- problèmes du système immunitaire qui peuvent augmenter votre risque d'infections. Vous êtes plus susceptible de contracter des infections si vous prenez des médicaments qui affaiblissent la capacité de votre corps à combattre les infections. Évitez tout contact avec des personnes atteintes de maladies contagieuses telles que la varicelle ou la rougeole lors de l'utilisation du vaporisateur nasal RHINOCORT AQUA (budésonide). Les symptômes d'infection peuvent inclure de la fièvre, des douleurs, des courbatures, des frissons, une sensation de fatigue, des nausées et des vomissements.
- insuffisance surrénalienne, L'insuffisance surrénale est une condition dans laquelle les glandes surrénales ne produisent pas suffisamment d'hormones stéroïdes. Les symptômes de l'insuffisance surrénalienne peuvent inclure de la fatigue, de la faiblesse, des nausées, des vomissements et une pression artérielle basse.
- croissance ralentie ou retardée chez les enfants. La croissance d'un enfant doit être contrôlée régulièrement lors de l'utilisation de RHINOCORT 100mcg AQUA (budésonide) en vaporisateur nasal.
- problèmes oculaires, comme le glaucome et la cataracte. Informez votre fournisseur de soins de santé si vous avez un changement de vision ou si vous avez des antécédents d'augmentation de la pression intraoculaire, de glaucome et/ou de cataracte.
Appelez votre fournisseur de soins de santé ou obtenez de l'aide médicale immédiatement si vous présentez des symptômes de l'un des effets secondaires graves énumérés ci-dessus.
Les effets secondaires les plus courants du vaporisateur nasal RHINOCORT 100mcg AQUA (budésonide) comprennent :
- saignements de nez
- mal de gorge
- difficultés respiratoires telles que respiration sifflante ou oppression thoracique
- toux
- irritation du nez
Dites à votre fournisseur de soins de santé si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles du vaporisateur nasal RHINOCORT 100mcg AQUA (budésonide). Pour plus d'informations, demandez à votre fournisseur de soins de santé ou votre pharmacien.
Appelez votre fournisseur de soins de santé pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088 ou www.fda.gov/medwatch.
Vous pouvez signaler les effets secondaires à AstraZeneca au 1-800-236-9933.
Que dois-je savoir sur la rhinite allergique ?
"Rhinite" signifie inflammation de la muqueuse du nez. Il est parfois appelé "rhume des foins". La rhinite allergique peut être causée par des allergies au pollen, aux squames animales, aux acariens de la poussière domestique et aux spores de moisissures. Si vous souffrez de rhinite allergique, votre nez devient bouché, coule et démange. Vous pouvez également éternuer beaucoup. Vous pouvez avoir les yeux rouges, qui démangent et qui larmoient; irritation de la gorge; ou des oreilles bouchées qui démangent.
Le vaporisateur nasal RHINOCORT AQUA (budésonide) aide à soulager vos symptômes nasaux.
Si vous avez également les yeux qui piquent et qui larmoient, vous devez en informer votre fournisseur de soins de santé. Il ou elle peut prescrire des médicaments supplémentaires pour traiter ces symptômes.
Comment dois-je conserver le vaporisateur nasal RHINOCORT AQUA (budésonide)?
- Conserver le vaporisateur nasal RHINOCORT AQUA (budésonide) entre 68 °F et 77 °F (20 °C et 25 °C).
- Ne pas congeler le vaporisateur nasal RHINOCORT AQUA (budésonide).
- Protégez RHINOCORT 100mcg AQUA (budésonide) Vaporisateur nasal de la lumière.
- N'utilisez pas RHINOCORT 100mcg AQUA (budésonide) vaporisateur nasal après que le nombre de vaporisations indiqué sur l'étiquette a été utilisé (n'inclut pas l'amorçage) ou après la date de péremption indiquée sur la boîte ou l'étiquette du flacon.
- Gardez le capuchon protecteur vert sur le vaporisateur nasal RHINOCORT AQUA (budésonide) lorsqu'il n'est pas utilisé. (S'il te plait regarde Avant utilisation au verso ).
- Gardez RHINOCORT 100mcg AQUA (budésonide) vaporisateur nasal et tous les médicaments hors de la portée des enfants.
Informations générales sur l'utilisation sûre et efficace de RHINOCORT AQUA (budésonide) vaporisateur nasal :
N'utilisez pas RHINOCORT 100mcg AQUA (budésonide) vaporisateur nasal pour une affection pour laquelle il n'a pas été prescrit. Ne donnez pas le vaporisateur nasal RHINOCORT AQUA (budésonide) à d'autres personnes, même si elles présentent les mêmes symptômes que vous. Cela peut leur nuire.
Cette notice d'information destinée aux patients résume les informations les plus importantes sur le vaporisateur nasal RHINOCORT 100 mcg AQUA (budésonide). Si vous souhaitez plus d'informations, parlez-en à votre fournisseur de soins de santé. Vous pouvez demander à votre pharmacien ou à votre professionnel de la santé des informations sur le vaporisateur nasal RHINOCORT 100mcg AQUA (budésonide) destiné aux professionnels de la santé.
Pour plus d'informations, rendez-vous sur www.astrazeneca-us.com ou appelez AstraZeneca au 1-800-236-9933.
Quels sont les ingrédients du vaporisateur nasal RHINOCORT AQUA (budésonide) ?
Ingrédient actif: budésonide
Ingrédients inactifs: Cellulose microcristalline et carboxyméthylcellulose sodique, dextrose anhydre, polysorbate 80, édétate disodique, sorbate de potassium, eau purifiée et acide chlorhydrique.
Instructions d'utilisation pour les patients
Pour une utilisation dans votre nez uniquement. Ne pas vaporiser dans les yeux ou la bouche.
Lisez attentivement les instructions d'utilisation pour les patients avant de commencer à utiliser RHINOCORT 100mcg AQUA (budésonide) vaporisateur nasal. Si vous avez des questions, demandez à votre fournisseur de soins de santé
Figure A 
Comment amorcer votre vaporisateur nasal RHINOCORT AQUA (budésonide)
Avant d'utiliser le vaporisateur nasal RHINOCORT AQUA (budésonide), le flacon doit être amorcé. Pour amorcer le vaporisateur nasal RHINOCORT 100mcg AQUA (budésonide) :
1. Tirez pour retirer le capuchon de protection vert du pulvérisateur nasal.
2. Agiter doucement le flacon pendant quelques secondes avant chaque utilisation.
3. Tenez fermement le flacon, comme illustré à la figure B, avec votre index et votre majeur de chaque côté de l'embout de pulvérisation et votre pouce sous le flacon.
Figure B 
4. Activez la pompe en appuyant rapidement et fermement sur le col blanc tout en tenant la base du flacon avec votre pouce.
5. Avant votre première utilisation de RHINOCORT AQUA (budésonide) vaporisateur nasal, secouez doucement le flacon. La pompe doit être amorcée en appuyant 8 fois sur le collier blanc. La pompe est maintenant prête à être utilisée. Si elle est utilisée quotidiennement, la pompe n'a pas besoin d'être réamorcée. S'il n'est pas utilisé pendant 2 jours consécutifs, réamorcer avec 1 pulvérisation ou jusqu'à ce qu'une fine pulvérisation apparaisse. Si elle n'est pas utilisée pendant plus de 14 jours, rincez l'embout de pulvérisation de la pompe en suivant les étapes de nettoyage indiquées à la fin de cette notice. Après le nettoyage, réamorcer avec 2 pulvérisations ou jusqu'à ce qu'une fine pulvérisation apparaisse.
Chaque bouteille de vaporisateur nasal RHINOCORT AQUA (budésonide) contient suffisamment de médicament pour que vous puissiez pulvériser le médicament à partir de la bouteille 120 fois après l'amorçage de la bouteille.
Vous ne devez pas utiliser le flacon de RHINOCORT 100mcg AQUA (budésonide) Spray Nasal après 120 pulvérisations. Des pulvérisations supplémentaires après 120 peuvent ne pas contenir la bonne quantité de médicament. Vous devez garder une trace du nombre de pulvérisations que vous utilisez pour chaque flacon de RHINOCORT 100mcg AQUA Nasal Spray et jeter tout médicament restant dans le flacon. Rechargez votre ordonnance tous les mois.
Comment utiliser votre spray nasal RHINOCORT 100mcg AQUA (budésonide)
Suivez ces instructions pour l'utilisation quotidienne du vaporisateur nasal RHINOCORT AQUA (budésonide) :
Figure C 
4. Insérez l'embout de pulvérisation dans votre narine (l'embout ne doit pas pénétrer loin dans votre nez). Fermez l'autre narine avec un doigt et penchez légèrement la tête vers l'avant pour que le jet soit dirigé vers l'arrière de votre nez (voir Figure D ).
Figure D 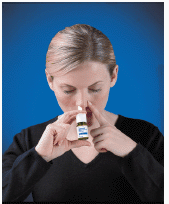
5. Pour chaque pulvérisation, activez la pompe en appuyant rapidement et fermement sur la collerette blanche tout en tenant la base du flacon avec votre pouce. Respirez doucement vers l'intérieur par la narine.
6. Après avoir vaporisé dans votre narine, penchez la tête en arrière pendant quelques secondes (voir Figure E ).
Figure E 
7. Si une deuxième pulvérisation est nécessaire dans la même narine, répétez les étapes 3 à 6.
8. Répétez les étapes 3 à 7 pour votre autre narine.
9. Évitez de vous moucher pendant 15 minutes après avoir utilisé le vaporisateur nasal RHINOCORT 100 mcg AQUA (budésonide).
10. Essuyez la buse de pulvérisation avec un chiffon propre (voir Figure F ) et replacez le capuchon de protection vert. Conservez le flacon en position verticale.
Figure F 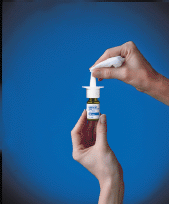
Comment nettoyer votre spray nasal RHINOCORT 100mcg AQUA (budésonide)
Chiffre G 
Rincez régulièrement le capuchon de protection vert et la buse de pulvérisation. Pour faire ça:
Pour plus d'informations sur le vaporisateur nasal RHINOCORT 100mcg AQUA (budésonide) ® , veuillez appeler le centre d'information d'AstraZeneca, du lundi au vendredi, de 8 h à 18 h HE, à l'exception des jours fériés au 1-800-236-9933.
