Flonase Nasal Spray 50mcg Fluticasone Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Flonase et comment est-il utilisé ?
Flonase est un médicament délivré sur ordonnance utilisé pour traiter les symptômes de la rhinite allergique (éternuements, écoulement nasal et yeux qui piquent ou larmoient) et des polypes nasaux. Flonase peut être utilisé seul ou avec d'autres médicaments.
Flonase appartient à une classe de médicaments appelés corticostéroïdes, intranasaux, immunosuppresseurs, PHD.
On ne sait pas si Flonase est sûr et efficace chez les enfants de moins de 4 ans.
Quels sont les effets secondaires possibles de Flonase ?
Flonase peut provoquer des effets secondaires graves, notamment :
- saignements de nez sévères ou continus,
- respiration bruyante,
- nez qui coule,
- en croûte autour de tes narines,
- rougeurs, plaies ou plaques blanches dans la bouche ou la gorge,
- fièvre,
- des frissons,
- courbatures,
- Vision floue,
- douleur oculaire,
- voir des halos autour des lumières,
- blessures qui ne guérissent pas,
- aggravation de la fatigue,
- faiblesse musculaire,
- étourdissement,
- des nausées et
- vomissement
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Flonase comprennent :
- petit saignement de nez,
- brûlure ou démangeaison dans le nez,
- plaies ou plaques blanches à l'intérieur ou autour du nez,
- toux,
- difficulté à respirer,
- mal de tête,
- mal au dos,
- douleur des sinus,
- mal de gorge,
- fièvre,
- des nausées et
- vomissement
LA DESCRIPTION
Le composant actif de FLONASE Spray Nasal 50mcg est le propionate de fluticasone, un corticostéroïde ayant le nom chimique S-(fluorométhyl) 6α,9-difluoro-11β,17-dihydroxy-16α-méthyl-3oxoandrosta-1,4-diène-17β-carbothioate , 17-propionate et la structure chimique suivante :
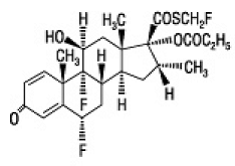
Le propionate de fluticasone est une poudre blanche d'un poids moléculaire de 500,6 et la formule empirique est C25H31F3O5S. Il est pratiquement insoluble dans l'eau, librement soluble dans le diméthylsulfoxyde et le diméthylformamide, et légèrement soluble dans le méthanol et l'éthanol à 95 %.
FLONASE Vaporisateur Nasal, 50 mcg est une suspension aqueuse de propionate de fluticasone microfine pour administration topique sur la muqueuse nasale au moyen d'un vaporisateur doseur et atomiseur. Le vaporisateur nasal FLONASE 50 mcg contient également de la cellulose microcristalline et de la carboxyméthylcellulose sodique, du dextrose, 0,02 % p/p de chlorure de benzalkonium, du polysorbate 80 et 0,25 % p/p d'alcool phényléthylique, et a un pH compris entre 5 et 7.
Après l'amorçage initial, chaque actionnement délivre 50 mcg de propionate de fluticasone dans 100 mg de formulation à travers l'adaptateur nasal.
LES INDICATIONS
Le vaporisateur nasal FLONASE® est indiqué pour la prise en charge des symptômes nasaux de la rhinite non allergique apériodique chez les patients adultes et pédiatriques âgés de 4 ans et plus.
DOSAGE ET ADMINISTRATION
Administrer le vaporisateur nasal FLONASE uniquement par voie intranasale. Amorcer le vaporisateur nasal FLONASE avant la première utilisation ou après une période de non-utilisation (1 semaine ou plus) en secouant bien le contenu et en libérant 6 vaporisations dans l'air loin du visage. Agiter doucement le vaporisateur nasal FLONASE avant chaque utilisation.
Les patients doivent utiliser le vaporisateur nasal FLONASE à intervalles réguliers car son efficacité dépend de son utilisation régulière. L'effet maximal peut prendre plusieurs jours et les patients individuels connaîtront un délai variable d'apparition et un degré différent de soulagement des symptômes.
Adultes
La posologie initiale recommandée chez l'adulte est de 2 pulvérisations (50 mcg de propionate de fluticasone chacune) dans chaque narine une fois par jour (dose quotidienne totale, 200 mcg). La même dose quotidienne totale, 1 pulvérisation dans chaque narine administrée deux fois par jour (par exemple, 8 h et 20 h) est également efficace. Après les premiers jours, les patients peuvent être en mesure de réduire leur dose à 1 pulvérisation dans chaque narine une fois par jour pour le traitement d'entretien.
Les doses quotidiennes totales maximales ne doivent pas dépasser 2 pulvérisations dans chaque narine (dose totale, 200 mcg/jour). Il n'y a aucune preuve que le dépassement de la dose recommandée soit plus efficace.
Adolescents et enfants (âgés de 4 ans et plus)
La posologie initiale recommandée chez les adolescents et les enfants âgés de 4 ans et plus est de 1 pulvérisation dans chaque narine une fois par jour (dose quotidienne totale, 100 mcg). Les patients qui ne répondent pas de manière adéquate à 1 pulvérisation dans chaque narine peuvent utiliser 2 pulvérisations dans chaque narine une fois par jour (dose quotidienne totale, 200 mcg). Une fois le contrôle adéquat obtenu, la posologie doit être réduite à 1 pulvérisation dans chaque narine une fois par jour.
La dose quotidienne totale maximale ne doit pas dépasser 2 pulvérisations dans chaque narine (200 mcg/jour). Il n'y a aucune preuve que le dépassement de la dose recommandée soit plus efficace.
COMMENT FOURNIE
Formes posologiques et points forts
FLONASE Spray Nasal est une suspension pour pulvérisation nasale. Chaque pulvérisation de 100 mg délivre 50 mcg de propionate de fluticasone.
Stockage et manutention
FLONASE Le vaporisateur nasal, 50 mcg est fourni dans un flacon en verre ambré muni d'une pompe de pulvérisation doseuse blanche, d'un adaptateur nasal blanc et d'un couvercle anti-poussière vert dans une boîte de 1 ( CDN 0173-0453-01) avec approuvé par la FDA Étiquetage des patients (voir Instructions d'utilisation pour le patient pour un actionnement correct de l'appareil ). Chaque bouteille contient un poids net de remplissage de 16 g et fournira 120 actionnements. Chaque actionnement délivre 50 mcg de propionate de fluticasone dans 100 mg de formulation à travers l'adaptateur nasal. La quantité correcte de médicament dans chaque pulvérisation ne peut pas être garantie après 120 pulvérisations, même si la bouteille n'est pas complètement vide. La bouteille doit être jetée lorsque le nombre d'actionnements indiqué sur l'étiquette a été utilisé.
Conserver entre 4° et 30°C (39° et 86°F).
GlaxoSmithKline Research Triangle Park, NC 27709. Révisé : janvier 2015
EFFETS SECONDAIRES
L'utilisation systémique et locale de corticostéroïdes peut entraîner les effets suivants :
- Épistaxis, ulcération nasale, infection à Candida albicans, perforation septale nasale et troubles de la cicatrisation [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Cataractes et glaucome [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Immunosuppression [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Hypercorticisme et suppression surrénalienne [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Effet sur la croissance [voir AVERTISSEMENTS ET PRECAUTIONS ]
Expérience des essais cliniques
Étant donné que les essais cliniques sont menés dans des conditions très variables, les taux d'effets indésirables observés dans les essais cliniques d'un médicament ne peuvent pas être directement comparés aux taux des essais cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique.
Dans des essais cliniques contrôlés aux États-Unis, plus de 3 300 sujets atteints de rhinite allergique et non allergique ont reçu un traitement par propionate de fluticasone intranasal. En général, les effets indésirables dans les essais cliniques ont été principalement associés à une irritation des muqueuses nasales, et les effets indésirables ont été signalés à peu près à la même fréquence par les sujets traités par placebo. Moins de 2 % des sujets des essais cliniques ont abandonné en raison d'effets indésirables ; ce taux était similaire pour le véhicule placebo et les comparateurs actifs.
Les données de sécurité décrites ci-dessous sont basées sur 7 essais cliniques contrôlés par placebo chez des sujets atteints de rhinite allergique. Les 7 essais ont inclus 536 sujets (57 filles et 108 garçons âgés de 4 à 11 ans, 137 femmes et 234 adolescents et adultes de sexe masculin) traités par FLONASE 200 mcg une fois par jour pendant 2 à 4 semaines et 2 essais cliniques contrôlés par placebo qui ont inclus 246 sujets (119 adolescentes et 127 adolescents et adultes) traités par FLONASE 200 mcg une fois par jour pendant 6 mois (Tableau 1). Sont également inclus dans le tableau 1 les effets indésirables de 2 essais dans lesquels 167 enfants (45 filles et 122 garçons âgés de 4 à 11 ans) ont été traités avec FLONASE 100 mcg une fois par jour pendant 2 à 4 semaines.
D'autres effets indésirables avec FLONASE Spray Nasal 50 mcg observés avec une incidence inférieure ou égale à 3 % mais supérieure ou égale à 1 % et plus fréquents qu'avec le placebo comprenaient : sang dans le mucus nasal, écoulement nasal, douleurs abdominales, diarrhée, fièvre, des symptômes pseudo-grippaux, des douleurs, des étourdissements et une bronchite.
Expérience post-commercialisation
En plus des événements indésirables rapportés dans les essais cliniques, les événements indésirables suivants ont été identifiés lors de l'utilisation post-approbation du propionate de fluticasone intranasal. Étant donné que ces réactions sont signalées volontairement par une population de taille incertaine, il n'est pas toujours possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale avec l'exposition au médicament. Ces événements ont été choisis pour inclusion en raison de leur gravité, de leur fréquence de déclaration ou de leur lien de causalité avec le propionate de fluticasone ou une combinaison de ces facteurs.
Troubles généraux et conditions au site d'administration
Réactions d'hypersensibilité, y compris œdème de Quincke, éruption cutanée, œdème du visage et de la langue, prurit, urticaire, bronchospasme, respiration sifflante, dyspnée et réactions anaphylactiques/anaphylactoïdes, qui dans de rares cas étaient graves.
Troubles de l'oreille et du labyrinthe
Altération ou perte du sens du goût et/ou de l'odorat et, rarement, perforation septale nasale, ulcère nasal, mal de gorge, irritation et sécheresse de la gorge, toux, enrouement et modifications de la voix.
Troubles oculaires
Sécheresse et irritation, conjonctivite, vision floue, glaucome, augmentation de la pression intraoculaire et cataractes.
Des cas de retard de croissance ont été rapportés avec les corticostéroïdes intranasaux, y compris FLONASE [voir AVERTISSEMENTS ET PRECAUTIONS ].
INTERACTIONS MÉDICAMENTEUSES
Inhibiteurs du cytochrome P450 3A4
Le propionate de fluticasone est un substrat du CYP3A4. L'utilisation d'inhibiteurs puissants du CYP3A4 (p. ex., ritonavir, atazanavir, clarithromycine, indinavir, itraconazole, néfazodone, nelfinavir, saquinavir, kétoconazole, télithromycine, conivaptan, lopinavir, néfazodone, voriconazole) avec le vaporisateur nasal FLONASE n'est pas recommandée en raison de l'augmentation des effets indésirables systémiques des corticostéroïdes. peut se produire.
Ritonavir
Un essai d'interaction médicamenteuse avec un spray nasal aqueux de propionate de fluticasone chez des sujets sains a montré que le ritonavir (un puissant inhibiteur du CYP3A4) peut augmenter de manière significative l'exposition plasmatique au propionate de fluticasone, entraînant une réduction significative des concentrations sériques de cortisol [voir PHARMACOLOGIE CLINIQUE ]. Au cours de l'utilisation post-commercialisation, des interactions médicamenteuses cliniquement significatives ont été rapportées chez des patients recevant des produits à base de propionate de fluticasone, y compris FLONASE, avec du ritonavir, entraînant des effets corticostéroïdes systémiques, notamment le syndrome de Cushing et une suppression surrénalienne.
Kétoconazole
L'administration concomitante de propionate de fluticasone inhalé par voie orale (1 000 mcg) et de kétoconazole (200 mg une fois par jour) a entraîné une augmentation de 1,9 fois de l'exposition plasmatique au propionate de fluticasone et une diminution de 45 % de l'aire sous la courbe du cortisol plasmatique (ASC), mais n'a eu aucun effet. sur l'excrétion urinaire de cortisol.
AVERTISSEMENTS
Inclus dans le cadre du PRÉCAUTIONS section.
PRÉCAUTIONS
Effets nasaux locaux
Épistaxis
Dans les essais cliniques d'une durée de 2 à 26 semaines, des épistaxis ont été observées plus fréquemment chez les sujets traités par le vaporisateur nasal FLONASE que chez ceux ayant reçu le placebo [voir EFFETS INDÉSIRABLES ].
Ulcération nasale
Des cas post-commercialisation d'ulcération nasale ont été rapportés chez des patients traités par le vaporisateur nasal FLONASE [voir EFFETS INDÉSIRABLES ].
Infection à Candida
Dans les essais cliniques avec le propionate de fluticasone administré par voie intranasale, le développement d'infections localisées du nez et du pharynx avec Candida albicans s'est produit. Lorsqu'une telle infection se développe, elle peut nécessiter un traitement local approprié et l'arrêt du vaporisateur nasal FLONASE. Les patients utilisant le vaporisateur nasal FLONASE pendant plusieurs mois ou plus doivent être examinés périodiquement pour rechercher des signes d'infection à Candida ou d'autres signes d'effets indésirables sur la muqueuse nasale.
Perforation septale nasale
Des cas post-commercialisation de perforation septale nasale ont été signalés chez des patients traités par le vaporisateur nasal FLONASE [voir EFFETS INDÉSIRABLES ].
Mauvaise cicatrisation des plaies
En raison de l'effet inhibiteur des corticostéroïdes sur la cicatrisation des plaies, les patients qui ont récemment subi des ulcères nasaux, une chirurgie nasale ou un traumatisme nasal doivent éviter d'utiliser le vaporisateur nasal FLONASE jusqu'à ce que la cicatrisation se produise.
Glaucome et cataracte
L'utilisation de corticostéroïdes intranasaux et inhalés peut entraîner le développement d'un glaucome et/ou de cataractes. Par conséquent, une surveillance étroite est justifiée chez les patients présentant une modification de la vision ou ayant des antécédents d'augmentation de la pression intraoculaire, de glaucome et/ou de cataracte.
Réactions d'hypersensibilité, y compris l'anaphylaxie
Des réactions d'hypersensibilité (p. ex., anaphylaxie, œdème de Quincke, urticaire, dermatite de contact et éruption cutanée) ont été signalées après l'administration du vaporisateur nasal FLONASE. Arrêter FLONASE
Vaporisateur nasal si de telles réactions se produisent [voir CONTRE-INDICATIONS ]. Rarement, des réactions d'hypersensibilité immédiates peuvent survenir après l'administration du vaporisateur nasal FLONASE.
Immunosuppression
Les personnes qui utilisent des médicaments qui suppriment le système immunitaire sont plus sensibles aux infections que les personnes en bonne santé. La varicelle et la rougeole, par exemple, peuvent avoir une évolution plus grave, voire mortelle, chez les enfants ou les adultes sensibles utilisant des corticostéroïdes. Chez ces enfants ou adultes qui n'ont pas eu ces maladies ou qui ont été correctement immunisés, des précautions particulières doivent être prises pour éviter toute exposition. On ne sait pas comment la dose, la voie et la durée de l'administration de corticostéroïdes affectent le risque de développer une infection disséminée. La contribution de la maladie sous-jacente et/ou de la corticothérapie antérieure au risque n'est pas non plus connue. Si un patient est exposé à la varicelle, une prophylaxie avec des immunoglobulines varicelle-zona (VZIG) peut être indiquée. Si un patient est exposé à la rougeole, une prophylaxie avec un pool d'immunoglobulines intramusculaires (IG) peut être indiquée. (Voir les informations de prescription complètes pour VZIG et IG. Si la varicelle se développe, un traitement avec des agents antiviraux peut être envisagé.
Les corticostéroïdes intranasaux doivent être utilisés avec prudence, voire pas du tout, chez les patients atteints d'infections tuberculeuses actives ou quiescentes des voies respiratoires ; infections systémiques fongiques, bactériennes, virales ou parasitaires; ou l'herpès simplex oculaire.
Hypercorticisme et suppression surrénalienne
Lorsque des corticostéroïdes intranasaux sont utilisés à des doses supérieures à celles recommandées ou chez des personnes sensibles aux doses recommandées, des effets corticostéroïdes systémiques tels qu'un hypercorticisme et une suppression surrénalienne peuvent apparaître. Si de tels changements se produisent, la posologie de FLONASE en vaporisateur nasal doit être interrompue lentement conformément aux procédures acceptées pour l'arrêt de la corticothérapie orale.
Le remplacement d'un corticoïde systémique par un corticoïde topique peut s'accompagner de signes d'insuffisance surrénalienne. De plus, certains patients peuvent présenter des symptômes de sevrage des corticostéroïdes (p. ex., douleurs articulaires et/ou musculaires, lassitude, dépression). Les patients précédemment traités pendant des périodes prolongées avec des corticostéroïdes systémiques et transférés à des corticostéroïdes topiques doivent être étroitement surveillés pour une insuffisance surrénalienne aiguë en réponse au stress. Chez les patients souffrant d'asthme ou d'autres affections cliniques nécessitant une corticothérapie systémique à long terme, une diminution rapide des doses de corticostéroïdes systémiques peut provoquer une exacerbation sévère de leurs symptômes.
Interactions médicamenteuses avec de puissants inhibiteurs du cytochrome P450 3A4
L'utilisation d'inhibiteurs puissants du cytochrome P450 3A4 (CYP3A4) (p. ex., ritonavir, atazanavir, clarithromycine, indinavir, itraconazole, néfazodone, nelfinavir, saquinavir, kétoconazole, télithromycine, conivaptan, lopinavir, néfazodone, voriconazole) avec le vaporisateur nasal FLONASE n'est pas recommandée car une augmentation des effets indésirables systémiques des corticostéroïdes peut survenir [voir INTERACTIONS MÉDICAMENTEUSES , PHARMACOLOGIE CLINIQUE ].
Effet sur la croissance
Les corticostéroïdes intranasaux peuvent entraîner une réduction de la vitesse de croissance lorsqu'ils sont administrés à des patients pédiatriques [voir Utilisation dans des populations spécifiques ]. Surveillez régulièrement la croissance des patients pédiatriques recevant le vaporisateur nasal FLONASE. Pour minimiser les effets systémiques des corticostéroïdes intranasaux, y compris le vaporisateur nasal FLONASE, titrez la dose de chaque patient à la dose la plus faible qui contrôle efficacement ses symptômes [voir DOSAGE ET ADMINISTRATION , Utilisation dans des populations spécifiques ].
Informations sur les conseils aux patients
Conseillez au patient de lire l'étiquetage patient approuvé par la FDA ( RENSEIGNEMENTS POUR LE PATIENT et mode d'emploi ).
Effets nasaux locaux
Informez les patients que le traitement par le vaporisateur nasal FLONASE 50 mcg peut entraîner des effets indésirables, notamment une épistaxis et une ulcération nasale. Une infection à Candida peut également survenir lors d'un traitement par le vaporisateur nasal FLONASE. De plus, le vaporisateur nasal FLONASE 50 mcg a été associé à une perforation septale nasale et à une altération de la cicatrisation des plaies. Les patients qui ont récemment subi des ulcères nasaux, une chirurgie nasale ou un traumatisme nasal ne doivent pas utiliser le vaporisateur nasal FLONASE 50 mcg jusqu'à ce que la guérison se produise [voir AVERTISSEMENTS ET PRECAUTIONS ].
Glaucome et Cataractes
Informez les patients que le glaucome et les cataractes sont associés à l'utilisation de corticostéroïdes par voie nasale et inhalée. Conseillez aux patients d'informer leurs fournisseurs de soins de santé si un changement dans la vision est noté lors de l'utilisation du vaporisateur nasal FLONASE [voir AVERTISSEMENTS ET PRECAUTIONS ].
Réactions d'hypersensibilité, y compris l'anaphylaxie
Informez les patients que des réactions d'hypersensibilité, y compris l'anaphylaxie, l'œdème de Quincke, l'urticaire, la dermatite de contact et les éruptions cutanées, peuvent survenir après l'administration du vaporisateur nasal FLONASE. Si de telles réactions se produisent, les patients doivent cesser d'utiliser le vaporisateur nasal FLONASE [voir AVERTISSEMENTS ET PRECAUTIONS ].
Immunosuppression
Avertir les patients qui prennent des doses immunosuppressives de corticostéroïdes pour éviter l'exposition à la varicelle ou à la rougeole et s'ils sont exposés à consulter leur professionnel de la santé sans délai. Informer les patients de l'aggravation potentielle d'une tuberculose existante ; infections fongiques, bactériennes, virales ou parasitaires; ou l'herpès simplex oculaire [voir AVERTISSEMENTS ET PRECAUTIONS ].
Vitesse de croissance réduite
Informez les parents que le vaporisateur nasal FLONASE 50 mcg peut entraîner une réduction de la vitesse de croissance lorsqu'il est administré à des patients pédiatriques. Les médecins doivent suivre de près la croissance des enfants et des adolescents prenant des corticostéroïdes par n'importe quelle voie [voir AVERTISSEMENTS ET PRECAUTIONS , Utilisation pédiatrique ].
Utiliser quotidiennement pour un meilleur effet
Informez les patients qu'ils doivent utiliser le vaporisateur nasal FLONASE 50 mcg de façon régulière. FLONASE Spray Nasal 50mcg, comme les autres corticostéroïdes, n'a pas d'effet immédiat sur les symptômes de la rhinite. Le bénéfice maximal peut ne pas être atteint avant plusieurs jours. Les patients ne doivent pas augmenter la dose prescrite mais doivent contacter leur médecin si les symptômes ne s'améliorent pas ou si l'état s'aggrave.
Gardez le spray hors des yeux et de la bouche
Informez les patients qu'ils doivent éviter de pulvériser le vaporisateur nasal FLONASE dans leurs yeux et leur bouche.
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Le propionate de fluticasone n'a démontré aucun potentiel tumorigène chez la souris à des doses orales allant jusqu'à 1 000 mcg/kg (environ 20 fois la MRHDID chez l'adulte et environ 10 fois la MRHDID chez l'enfant sur une base de mcg/m²) pendant 78 semaines ou chez le rat à des doses par inhalation jusqu'à à 57 mcg/kg (environ 2 fois le MRHDID chez l'adulte et environ l'équivalent du MRHDID chez l'enfant sur une base de mcg/m²) pendant 104 semaines.
Le propionate de fluticasone n'a pas induit de mutation génique dans les cellules procaryotes ou eucaryotes in vitro. Aucun effet clastogène significatif n'a été observé dans les lymphocytes périphériques humains en culture in vitro ou dans le test du micronoyau de souris.
Aucune évidence d'affaiblissement de fertilité n'a été observée dans les rats mâles et femelles aux doses sous-cutanées jusqu'à 50 mcg/kg (environ 2 fois le MRHDID dans les adultes sur une base de mcg/m²). Le poids de la prostate a été significativement réduit à une dose sous-cutanée de 50 mcg/kg.
Etudes cliniques
Rhinite apériodique non allergique
Trois essais randomisés, en double aveugle, en groupes parallèles et contrôlés par placebo ont été menés chez 1 191 sujets pour étudier l'utilisation régulière de FLONASE en vaporisateur nasal 50 mcg chez des sujets atteints de rhinite non allergique perannuelle. Ces essais ont évalué les scores totaux des symptômes nasaux (TNSS) évalués par les sujets qui comprenaient l'obstruction nasale, l'écoulement post-nasal, la rhinorrhée chez les sujets traités pendant 28 jours de traitement en double aveugle et dans 1 des 3 essais pendant 6 mois de traitement en ouvert. Deux de ces essais ont démontré que les sujets traités avec le vaporisateur nasal FLONASE (100 mcg deux fois par jour) présentaient des diminutions statistiquement significatives du TNSS par rapport aux sujets traités avec le véhicule.
Utilisation dans des populations spécifiques
Grossesse
Effets tératogènes
Catégorie de grossesse C. Il n'y a pas d'essais adéquats et bien contrôlés avec le vaporisateur nasal FLONASE chez les femmes enceintes. Les corticostéroïdes se sont avérés tératogènes chez les animaux de laboratoire lorsqu'ils sont administrés par voie systémique à des doses relativement faibles. Étant donné que les études sur la reproduction chez l'animal ne sont pas toujours prédictives de la réponse humaine, le vaporisateur nasal FLONASE ne doit être utilisé pendant la grossesse que si le bénéfice potentiel justifie le risque potentiel pour le fœtus. Il faut conseiller aux femmes de contacter leur médecin si elles tombent enceintes pendant qu'elles prennent le vaporisateur nasal FLONASE.
Souris et rats à des doses de propionate de fluticasone d'environ 1 et 4 fois, respectivement, la dose intranasale quotidienne humaine recommandée maximale (MRHDID) pour les adultes (sur une base en mg/m² à des doses sous-cutanées maternelles de 45 et 100 mcg/kg/jour, respectivement) ont montré une toxicité fœtale caractéristique des composés corticostéroïdes puissants, y compris un retard de croissance embryonnaire, un omphalocèle, une fente palatine et un retard de l'ossification crânienne. Aucune tératogénicité n'a été observée chez le rat à des doses allant jusqu'à 3 fois la MRHDID (sur une base en mg/m² à des doses maternelles d'inhalation allant jusqu'à 68,7 mcg/kg/jour).
Chez les lapins, une réduction du poids fœtal et une fente palatine ont été observées à une dose de propionate de fluticasone d'environ 0,3 fois la MRHDID pour les adultes (sur une base en mg/m² à une dose maternelle sous-cutanée de 4 mcg/kg/jour). Cependant, aucun effet tératogène n'a été rapporté à des doses de propionate de fluticasone jusqu'à environ 20 fois la MRHDID pour les adultes (sur une base en mg/m² à une dose orale maternelle jusqu'à 300 mcg/kg/jour). Aucun propionate de fluticasone n'a été détecté dans le plasma dans cette étude, ce qui correspond à la faible biodisponibilité établie après administration orale [voir PHARMACOLOGIE CLINIQUE ].
Le propionate de fluticasone a traversé le placenta après administration sous-cutanée à des souris et à des rats et administration orale à des lapins.
L'expérience avec les corticostéroïdes oraux depuis leur introduction à des doses pharmacologiques, par opposition aux doses physiologiques, suggère que les rongeurs sont plus sujets aux effets tératogènes des corticostéroïdes que les humains. De plus, comme il y a une augmentation naturelle de la production de corticostéroïdes pendant la grossesse, la plupart des femmes auront besoin d'une dose de corticostéroïde exogène plus faible et beaucoup n'auront pas besoin de traitement aux corticostéroïdes pendant la grossesse.
Effets non tératogènes
L'hypoadrénalisme peut survenir chez les nourrissons nés de mères recevant des corticostéroïdes pendant la grossesse. Ces nourrissons doivent être étroitement surveillés.
Mères allaitantes
On ne sait pas si le propionate de fluticasone est excrété dans le lait maternel humain. Cependant, d'autres corticostéroïdes ont été détectés dans le lait maternel. L'administration sous-cutanée à des rats en lactation de propionate de fluticasone tritié à une dose d'environ 0,4 fois la MRHDID pour les adultes sur une base en mg/m² a entraîné une radioactivité mesurable dans le lait.
Puisqu'il n'y a pas de données provenant d'essais contrôlés sur l'utilisation intranasale de FLONASE en vaporisateur nasal 50 mcg par les mères qui allaitent, la prudence s'impose lorsque FLONASE en vaporisateur nasal 50 mcg est administré à une femme qui allaite.
Utilisation pédiatrique
L'innocuité et l'efficacité du vaporisateur nasal FLONASE chez les enfants âgés de 4 ans et plus ont été établies [voir EFFETS INDÉSIRABLES , PHARMACOLOGIE CLINIQUE ].Six cent cinquante (650) sujets âgés de 4 à 11 ans et 440 sujets âgés de 12 à 17 ans ont été étudiés dans des essais cliniques américains avec le spray nasal de propionate de fluticasone. La sécurité et l'efficacité de FLONASE Spray Nasal 50mcg chez les enfants de moins de 4 ans n'ont pas été établies.
Effets sur la croissance
Des essais cliniques contrôlés ont montré que les corticostéroïdes intranasaux peuvent entraîner une réduction de la vitesse de croissance lorsqu'ils sont administrés à des patients pédiatriques. Cet effet a été observé en l'absence de preuves de laboratoire de suppression de l'axe hypothalamo-hypophyso-surrénalien (HHS), ce qui suggère que la vitesse de croissance est un indicateur plus sensible de l'exposition systémique aux corticostéroïdes chez les patients pédiatriques que certains tests couramment utilisés de la fonction de l'axe HHS. Les effets à long terme de cette réduction de la vitesse de croissance associée aux corticostéroïdes intranasaux, y compris l'impact sur la taille adulte finale, sont inconnus. Le potentiel de « rattrapage » de la croissance après l'arrêt du traitement par des corticostéroïdes intranasaux n'a pas été suffisamment étudié. La croissance des patients pédiatriques recevant des corticostéroïdes intranasaux, y compris le vaporisateur nasal FLONASE, doit être surveillée régulièrement (p. ex., par stadiométrie). Les effets potentiels sur la croissance d'un traitement prolongé doivent être mis en balance avec les bénéfices cliniques obtenus et les risques associés aux thérapies alternatives. Pour minimiser les effets systémiques des corticostéroïdes intranasaux, y compris le vaporisateur nasal FLONASE, la posologie de chaque patient doit être ajustée à la posologie la plus faible qui contrôle efficacement ses symptômes.
Un essai contrôlé par placebo d'une durée d'un an a été mené chez 150 sujets pédiatriques (âgés de 3 à 9 ans) pour évaluer l'effet du vaporisateur nasal FLONASE (dose quotidienne unique de 200 mcg) sur la vitesse de croissance. Dans la population primaire recevant FLONASE en vaporisateur nasal (n = 56) et un placebo (n = 52), l'estimation ponctuelle de la vitesse de croissance avec FLONASE en vaporisateur nasal à 50 mcg était inférieure de 0,14 cm/an à celle du placebo (IC à 95 % : -0,54 ; 0,27 cm /an). Ainsi, aucun effet statistiquement significatif sur la croissance n'a été noté par rapport au placebo. Aucune preuve de modifications cliniquement pertinentes de la fonction de l'axe HPA ou de la densité minérale osseuse n'a été observée, évaluées respectivement par l'excrétion de cortisol urinaire sur 12 heures et l'absorptiométrie à rayons X à double énergie.
La possibilité que FLONASE Spray nasal 50 mcg provoque une suppression de la croissance chez les patients sensibles ou lorsqu'il est administré à des doses supérieures à celles recommandées ne peut être exclu.
Utilisation gériatrique
Un nombre limité de sujets âgés de 65 ans et plus (n = 129) ou de 75 ans et plus (n = 11) ont été traités par le vaporisateur nasal FLONASE dans des essais cliniques. Bien que le nombre de sujets soit trop petit pour permettre une analyse séparée de l'efficacité et de la sécurité, les effets indésirables rapportés dans cette population étaient similaires à ceux rapportés par les patients plus jeunes. En général, la sélection de la dose pour un patient âgé doit être prudente, en commençant généralement à l'extrémité inférieure de la plage posologique, reflétant la plus grande fréquence de diminution de la fonction hépatique, rénale ou cardiaque et de maladie concomitante ou d'un autre traitement médicamenteux.
Insuffisance hépatique
Aucun essai pharmacocinétique formel utilisant FLONASE en vaporisateur nasal 50 mcg n'a été mené chez des sujets atteints d'insuffisance hépatique. Étant donné que le propionate de fluticasone est principalement éliminé par métabolisme hépatique, une altération de la fonction hépatique peut entraîner une accumulation de propionate de fluticasone dans le plasma. Par conséquent, les patients atteints de maladie hépatique doivent être étroitement surveillés.

Insuffisance rénale
Des essais pharmacocinétiques officiels utilisant FLONASE en vaporisateur nasal n'ont pas été menés chez des sujets atteints d'insuffisance rénale.
SURDOSAGE
Un surdosage chronique peut entraîner des signes/symptômes d'hypercorticisme (voir PRÉCAUTIONS ). L'administration intranasale de 2 mg (10 fois la dose recommandée) de propionate de fluticasone deux fois par jour pendant 7 jours à des volontaires sains a été bien tolérée. Des doses orales uniques allant jusqu'à 16 mg ont été étudiées chez des volontaires humains sans qu'aucun effet toxique aigu n'ait été signalé. Des doses orales répétées jusqu'à 80 mg par jour pendant 10 jours chez les volontaires et des doses orales répétées jusqu'à 10 mg par jour pendant 14 jours chez les patients ont été bien tolérées. Les effets indésirables étaient de gravité légère ou modérée et les incidences étaient similaires dans les groupes de traitement actif et placebo. Un surdosage aigu avec cette forme posologique est peu probable car 1 flacon de vaporisateur nasal FLONASE (propionate de fluticasone) contient environ 8 mg de propionate de fluticasone.
Les doses létales médianes orales et sous-cutanées chez la souris et le rat étaient > 1 000 mg/kg (> 20 000 et > 41 000 fois, respectivement, la dose intranasale quotidienne maximale recommandée chez l'adulte et > 10 000 et > 20 000 fois, respectivement, la dose intranasale quotidienne maximale recommandée). dose chez les enfants sur une base mg/m2).
CONTRE-INDICATIONS
FLONASE (propionate de fluticasone) vaporisateur nasal est contre-indiqué chez les patients présentant une hypersensibilité à l'un de ses ingrédients.
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
Le propionate de fluticasone est un corticostéroïde synthétique trifluoré à activité anti-inflammatoire. Il a été démontré in vitro que le propionate de fluticasone présente une affinité de liaison pour le récepteur des glucocorticoïdes humains qui est 18 fois supérieure à celle de la dexaméthasone, près du double de celle du 17-monopropionate de béclométhasone (BMP), le métabolite actif du dipropionate de béclométhasone, et plus de 3 fois supérieure. du budésonide. Les données du test de vasoconstriction McKenzie chez l'homme concordent avec ces résultats. La signification clinique de ces résultats est inconnue.
Le mécanisme précis par lequel le propionate de fluticasone affecte les symptômes de la rhinite n'est pas connu. Il a été démontré que les corticostéroïdes ont un large éventail d'effets sur plusieurs types de cellules (p. ex., mastocytes, éosinophiles, neutrophiles, macrophages, lymphocytes) et médiateurs (p. ex., histamine, eicosanoïdes, leucotriènes, cytokines) impliqués dans l'inflammation. Dans 7 essais menés chez des adultes, le vaporisateur nasal FLONASE a réduit les éosinophiles de la muqueuse nasale chez 66 % des patients (35 % pour le placebo) et les basophiles chez 39 % des patients (28 % pour le placebo). La relation directe entre ces résultats et le soulagement à long terme des symptômes n'est pas connue.
Pharmacodynamie
Effet d'axe HPA
Les effets systémiques potentiels de FLONASE Nasal Spray 50mcg sur l'axe HPA ont été évalués. Le vaporisateur nasal FLONASE 50 mcg administré à raison de 200 mcg une fois par jour ou 400 mcg deux fois par jour a été comparé à un placebo ou à de la prednisone orale 7,5 ou 15 mg administrée le matin. Le vaporisateur nasal FLONASE à l'une ou l'autre des doses pendant 4 semaines n'a pas affecté la réponse surrénalienne à la stimulation par la cosyntropine pendant 6 heures, tandis que les deux doses de prednisone orale ont considérablement réduit la réponse à la cosyntropine.
Électrophysiologie cardiaque
Aucune étude spécifiquement conçue pour évaluer l'effet de FLONASE sur l'intervalle QT n'a été menée.
Pharmacocinétique
L'activité de FLONASE Spray Nasal 50 mcg est due au médicament parent, le propionate de fluticasone. En raison de la faible biodisponibilité par voie intranasale, la majorité des données pharmacocinétiques ont été obtenues par d'autres voies d'administration.
Absorption
Des calculs indirects indiquent que le propionate de fluticasone administré par voie intranasale a une biodisponibilité absolue moyenne inférieure à 2 %. Des essais utilisant l'administration orale de médicaments marqués et non marqués ont démontré que la biodisponibilité systémique orale du propionate de fluticasone est négligeable (
Distribution
Après administration intraveineuse, la phase initiale d'élimination du propionate de fluticasone a été rapide et cohérente avec sa solubilité élevée dans les lipides et sa liaison tissulaire. Le volume de distribution était en moyenne de 4,2 L/kg.
Le pourcentage de propionate de fluticasone lié aux protéines plasmatiques humaines était en moyenne de 99 %. Le propionate de fluticasone se lie faiblement et de manière réversible aux érythrocytes et n'est pas lié de manière significative à la transcortine humaine.
Élimination
Après administration intraveineuse, le propionate de fluticasone a présenté une cinétique polyexponentielle et une demi-vie d'élimination terminale d'environ 7,8 heures. La clairance sanguine totale du propionate de fluticasone est élevée (moyenne : 1 093 mL/min), la clairance rénale représentant moins de 0,02 % du total.
Métabolisme: Le seul métabolite circulant détecté chez l'homme est l'acide 17β-carboxylique dérivé du propionate de fluticasone, qui se forme par la voie CYP3A4. Ce métabolite avait moins d'affinité (environ 1/2 000) que la molécule mère pour le récepteur des glucocorticoïdes du cytosol pulmonaire humain in vitro et une activité pharmacologique négligeable dans les études animales. D'autres métabolites détectés in vitro à l'aide de cellules d'hépatome humain en culture n'ont pas été détectés chez l'homme.
Excrétion: Moins de 5 % d'une dose orale radiomarquée a été excrétée dans l'urine sous forme de métabolites, le reste étant excrété dans les fèces sous forme de médicament mère et de métabolites.
Populations particulières
Le spray nasal de propionate de fluticasone n'a été étudié dans aucune population particulière et aucune donnée pharmacocinétique spécifique au sexe n'a été obtenue.
Interactions médicamenteuses
Inhibiteurs du Cytochrome P450 3A4 : Ritonavir : Le propionate de fluticasone est un substrat du CYP3A4. L'administration concomitante de propionate de fluticasone et du puissant inhibiteur du CYP3A4, le ritonavir, n'est pas recommandée sur la base d'un essai croisé à doses multiples sur les interactions médicamenteuses chez 18 sujets sains. Un spray nasal aqueux de propionate de fluticasone (200 mcg une fois par jour) a été co-administré pendant 7 jours avec du ritonavir (100 mg deux fois par jour). Les concentrations plasmatiques de propionate de fluticasone après un vaporisateur nasal aqueux de propionate de fluticasone seul étaient indétectables (
Kétoconazole : L'administration concomitante de propionate de fluticasone inhalé par voie orale (1 000 mcg) et de kétoconazole (200 mg une fois par jour) a entraîné une augmentation de 1,9 fois de l'exposition plasmatique au propionate de fluticasone et une diminution de 45 % de l'ASC du cortisol plasmatique, mais n'a eu aucun effet sur l'excrétion urinaire du cortisol.
Érythromycine : Dans une étude d'interaction médicamenteuse à doses multiples, la co-administration de propionate de fluticasone inhalé par voie orale (500 mcg deux fois par jour) et d'érythromycine (333 mg 3 fois par jour) n'a pas affecté la pharmacocinétique du propionate de fluticasone.
INFORMATIONS PATIENTS
FLONASE® [flow'naz] (propionate de fluticasone) Vaporisateur nasal, 50 mcg
Lisez les informations destinées aux patients fournies avec le vaporisateur nasal FLONASE avant de commencer à l'utiliser et chaque fois que vous recevez une recharge. Il peut y avoir de nouvelles informations. Ces informations patient ne remplacent pas la discussion avec votre fournisseur de soins de santé au sujet de votre état de santé ou de votre traitement.
Qu'est-ce que le vaporisateur nasal FLONASE?
FLONASE Spray nasal 50 mcg est un médicament délivré sur ordonnance utilisé pour traiter les symptômes nasaux non allergiques tels que l'écoulement nasal, le nez bouché, les éternuements et les démangeaisons nasales chez les adultes et les enfants âgés de 4 ans et plus.
On ne sait pas si le vaporisateur nasal FLONASE 50 mcg est sûr et efficace chez les enfants de moins de 4 ans.
Qui ne devrait pas utiliser FLONASE Spray Nasal 50mcg?
N'utilisez pas le vaporisateur nasal FLONASE 50 mcg si vous êtes allergique au propionate de fluticasone ou à l'un des ingrédients du vaporisateur nasal FLONASE. Voir "Quels sont les ingrédients de FLONASE Spray Nasal 50mcg?" ci-dessous pour une liste complète des ingrédients.
Que dois-je dire à mon fournisseur de soins de santé avant d'utiliser le vaporisateur nasal FLONASE 50 mcg?
Informez votre fournisseur de soins de santé de tous vos problèmes de santé, y compris si vous :
- avez ou avez eu des plaies nasales, une chirurgie nasale ou une lésion nasale.
- avez des problèmes oculaires, comme la cataracte ou le glaucome.
- avoir un problème de système immunitaire.
- êtes allergique à l'un des ingrédients du vaporisateur nasal FLONASE, à tout autre médicament ou produit alimentaire. Voir « Quels sont les ingrédients du vaporisateur nasal FLONASE ? » ci-dessous pour une liste complète des ingrédients.
- avez tout type d'infection virale, bactérienne ou fongique.
- sont exposés à la varicelle ou à la rougeole.
- avoir d'autres conditions médicales.
- êtes enceinte ou planifiez une grossesse. On ne sait pas si le vaporisateur nasal FLONASE peut nuire à votre bébé à naître.
- allaitez ou envisagez d'allaiter. On ne sait pas si FLONASE Spray nasal 50 mcg passe dans votre lait maternel et s'il peut nuire à votre bébé.
Informez votre professionnel de la santé de tous les médicaments que vous prenez, y compris les médicaments sur ordonnance et en vente libre, les vitamines et les suppléments à base de plantes. FLONASE Spray Nasal et certains autres médicaments peuvent interagir les uns avec les autres. Cela peut provoquer des effets secondaires graves. Surtout, informez votre fournisseur de soins de santé si vous prenez des médicaments antifongiques ou anti-VIH.
Connaissez les médicaments que vous prenez. Conservez-en une liste pour la montrer à votre fournisseur de soins de santé et à votre pharmacien lorsque vous recevez un nouveau médicament.
Comment dois-je utiliser le vaporisateur nasal FLONASE?
Lisez les instructions étape par étape pour utiliser le vaporisateur nasal FLONASE à la fin de ces renseignements destinés aux patients.
- Le vaporisateur nasal FLONASE doit être utilisé uniquement dans le nez. Ne le vaporisez pas dans vos yeux ou votre bouche.
- Les enfants doivent utiliser le vaporisateur nasal FLONASE avec l'aide d'un adulte, selon les instructions du fournisseur de soins de santé de l'enfant.
- Utilisez FLONASE Spray nasal 50 mcg exactement comme votre professionnel de la santé vous l'a indiqué. N'utilisez pas le vaporisateur nasal FLONASE plus souvent que prescrit.
- Le vaporisateur nasal FLONASE peut prendre plusieurs jours d'utilisation régulière pour que vos symptômes de rhinite s'améliorent. Si vos symptômes ne s'améliorent pas ou s'aggravent, appelez votre fournisseur de soins de santé.
- Vous obtiendrez les meilleurs résultats si vous continuez à utiliser le vaporisateur nasal FLONASE régulièrement chaque jour sans manquer une dose. Une fois que vous commencerez à vous sentir mieux, votre fournisseur de soins de santé pourra diminuer votre dose. Ne pas arrêtez d'utiliser le vaporisateur nasal FLONASE 50 mcg à moins que votre fournisseur de soins de santé ne vous dise de le faire.
Quels sont les effets secondaires possibles de FLONASE Spray Nasal 50mcg?
Le vaporisateur nasal FLONASE 50 mcg peut causer des effets secondaires graves, notamment :
- problèmes de nez. Les problèmes de nez peuvent inclure :
- saignements de nez.
- plaies (ulcères) dans le nez.
- une certaine infection fongique du nez, de la bouche et/ou de la gorge (muguet).
- trou dans le cartilage de votre nez (perforation septale nasale). Les symptômes de la perforation septale nasale peuvent inclure :
- croûte dans le nez
- saignements de nez
- nez qui coule
- sifflement lorsque vous respirez
- cicatrisation lente des plaies. Vous ne devez pas utiliser le vaporisateur nasal FLONASE tant que votre nez n'est pas cicatrisé si vous avez une plaie au nez, si vous avez subi une intervention chirurgicale au nez ou si votre nez a été blessé.
- problèmes oculaires, y compris le glaucome et la cataracte. Vous devriez avoir des examens de la vue réguliers pendant que vous utilisez le vaporisateur nasal FLONASE.
- réactions allergiques graves. Appelez votre fournisseur de soins de santé ou obtenez des soins médicaux d'urgence si vous présentez l'un des signes suivants d'une réaction allergique grave :
- éruption
- urticaire
- gonflement du visage, de la bouche et de la langue
- problèmes de respiration
- affaiblissement du système immunitaire et risque accru de contracter des infections (immunosuppression). La prise de médicaments qui affaiblissent votre système immunitaire vous rend plus susceptible de contracter des infections et peut aggraver certaines infections. Ces infections peuvent inclure la tuberculose (TB), les infections oculaires à herpès simplex et les infections causées par des champignons, des bactéries, des virus et des parasites. Évitez tout contact avec des personnes atteintes d'une maladie contagieuse telle que la varicelle ou la rougeole lors de l'utilisation du vaporisateur nasal FLONASE. Si vous entrez en contact avec une personne qui a la varicelle ou la rougeole, appelez immédiatement votre fournisseur de soins de santé. Les symptômes d'une infection peuvent inclure :
- fièvre
- se sentir fatigué
- la douleur
- nausée
- douleurs
- vomissement
- des frissons
- diminution des taux d'hormones stéroïdes (insuffisance surrénalienne). L'insuffisance surrénalienne se produit lorsque vos glandes surrénales ne produisent pas suffisamment d'hormones stéroïdes. Cela peut se produire lorsque vous arrêtez de prendre des corticostéroïdes oraux (tels que la prednisone) et que vous commencez à prendre un médicament contenant un stéroïde inhalé (tel que le vaporisateur nasal FLONASE). Les symptômes de l'insuffisance surrénalienne peuvent inclure :
- se sentir fatigué
- manque d'énergie
- la faiblesse
- nausée et vomissements
- Pression artérielle faible
- croissance ralentie chez les enfants. La croissance d'un enfant doit être vérifiée souvent.
Les effets secondaires les plus courants du vaporisateur nasal FLONASE 50 mcg comprennent :
- mal de tête
- nausée et vomissements
- mal de gorge
- difficulté à respirer
- saignements de nez
- toux
- brûlure ou démangeaison du nez
Informez votre fournisseur de soins de santé de tout effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires du vaporisateur nasal FLONASE. Demandez à votre fournisseur de soins de santé ou à votre pharmacien pour plus d'informations.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
Comment conserver FLONASE Spray Nasal 50mcg?
- Conservez FLONASE entre 39°F et 86°F (4°C et 30°C).
Gardez FLONASE Spray Nasal 50mcg et tous les médicaments hors de la portée des enfants.
Informations générales sur l'utilisation sûre et efficace du vaporisateur nasal FLONASE.
Des médicaments sont parfois prescrits à des fins non mentionnées dans une notice d'information destinée aux patients. N'utilisez pas le vaporisateur nasal FLONASE pour une affection pour laquelle il n'a pas été prescrit. Ne donnez pas votre vaporisateur nasal FLONASE à d'autres personnes, même si elles souffrent de la même maladie que vous. Cela peut leur nuire.
Cette notice d'information destinée aux patients résume les informations les plus importantes sur le vaporisateur nasal FLONASE. Si vous souhaitez plus d'informations, parlez-en à votre fournisseur de soins de santé. Vous pouvez demander à votre pharmacien ou à votre professionnel de la santé des informations sur le vaporisateur nasal FLONASE qui ont été rédigées pour les professionnels de la santé.
Pour plus d'informations sur le vaporisateur nasal FLONASE, appelez le 1-888-825-5249.
Quels sont les ingrédients de FLONASE Spray Nasal 50mcg?
Ingrédient actif : propionate de fluticasone.
Ingrédients inactifs : cellulose microcristalline, carboxyméthylcellulose sodique, dextrose, chlorure de benzalkonium à 0,02 % en poids, polysorbate 80 et alcool phényléthylique à 0,25 % en poids.
Mode d'emploi
FLONASE® [flow'naz] (propionate de fluticasone) vaporisateur nasal, 50 mcg
Le vaporisateur nasal FLONASE 50 mcg doit être utilisé uniquement dans le nez.
Lisez ces informations avant de commencer à utiliser votre vaporisateur nasal FLONASE.
Composants de votre vaporisateur nasal FLONASE (Voir Figure A)
Figure A 
Votre vaporisateur nasal FLONASE 50 mcg doit être amorcé avant de l'utiliser pour la première fois et lorsque vous ne l'avez pas utilisé pendant une semaine ou plus.
Comment amorcer votre vaporisateur nasal FLONASE
- Secouez doucement le flacon puis retirez le couvercle anti-poussière (voir figure B).
Figure B 
- Tenez le flacon comme indiqué (voir la figure C) avec l'applicateur nasal pointant vers l'extérieur de vous et avec votre index et votre majeur de chaque côté de l'applicateur nasal et votre pouce sous le flacon.
- Appuyez et relâchez 6 fois jusqu'à ce qu'une fine pulvérisation apparaisse (voir Figure C). La pompe est maintenant prête à être utilisée.
Figure C 
Utilisation de votre vaporisateur nasal FLONASE :
Étape 1 . Mouchez-vous pour dégager vos narines.
Étape 2 . Fermez 1 narine. Inclinez légèrement la tête vers l'avant et, en gardant le flacon droit, insérez délicatement l'applicateur nasal dans l'autre narine (voir figure D).
Figure D 
Étape 3 Commencez à inspirer par le nez et, tout en inspirant, appuyez fermement et rapidement 1 fois sur l'applicateur pour libérer le spray. Pour obtenir une dose complète, utilisez votre index et votre majeur pour pulvériser tout en soutenant la base du flacon avec votre pouce. Évitez de vaporiser dans vos yeux. Inspirez doucement par la narine (voir figure E).
Figure E 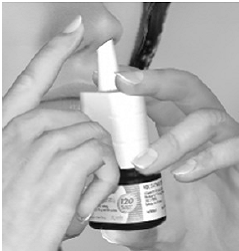
Étape 4 . Expirez par la bouche.
Étape 5 . Si une deuxième pulvérisation est nécessaire dans cette narine, répétez les étapes 2 à 4.
Étape 6 . Répétez les étapes 2 à 5 dans l'autre narine.
Étape 7 . Essuyez l'applicateur nasal avec un tissu propre et replacez le cache anti-poussière (voir figure F).
Figure F 
N'utilisez pas ce flacon plus longtemps que le nombre de pulvérisations indiqué sur l'étiquette, même si le flacon n'est pas complètement vide. Avant de jeter la bouteille, vous devriez parler à votre fournisseur de soins de santé pour voir si une recharge est nécessaire. Ne prenez pas de doses supplémentaires ou n'arrêtez pas de prendre FLONASE Spray Nasal 50mcg sans en parler à votre fournisseur de soins de santé.
Nettoyage de votre vaporisateur nasal FLONASE :
Votre spray nasal doit être nettoyé au moins 1 fois par semaine.
1. Retirez le cache anti-poussière puis tirez doucement vers le haut pour libérer l'applicateur nasal.
2. Lavez l'applicateur et le cache-poussière sous l'eau chaude du robinet. Laisser sécher à température ambiante.
3. Remettez l'applicateur et le cache-poussière sur le flacon.
4. Si l'applicateur nasal se bouche, il peut être retiré et laissé tremper dans de l'eau tiède. Rincez l'applicateur nasal à l'eau froide du robinet. Séchez l'applicateur nasal et replacez-le sur le flacon. N'essayez pas de débloquer l'applicateur nasal en insérant une épingle ou un autre objet pointu.
Conservation de votre vaporisateur nasal FLONASE :
- Conservez FLONASE Spray Nasal 50mcg entre 39°F et 86°F (4°C et 30°C).
- N'utilisez pas votre vaporisateur nasal FLONASE après la date indiquée comme « EXP » sur l'étiquette ou la boîte.
