Clarinex 5mg Desloratadine Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
CLARINEX® (desloratadine) Comprimés
LA DESCRIPTION
Les comprimés CLARINEX (desloratadine) sont des comprimés bleu clair, ronds et pelliculés contenant 5 mg de desloratadine, un antihistaminique, à administrer par voie orale. Les comprimés CLARINEX 5 mg contiennent également les excipients suivants : phosphate de calcium dibasique dihydraté USP, cellulose microcristalline NF, amidon de maïs NF, talc USP, cire de carnauba NF, cire blanche NF, matériau d'enrobage composé de lactose monohydraté, hypromellose, dioxyde de titane, polyéthylène glycol et Laque d'aluminium FD&C bleu n° 2.
La solution orale CLARINEX est un liquide clair de couleur orange contenant 0,5 mg/1 mL de desloratadine. La solution buvable contient les ingrédients inactifs suivants : propylène glycol USP, solution de sorbitol USP, acide citrique (anhydre) USP, citrate de sodium dihydraté USP, benzoate de sodium NF, édétate disodique USP, eau purifiée USP. Il contient également du sucre granulé, des arômes naturels et artificiels pour le chewing-gum et le colorant FDC Yellow #6.
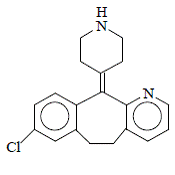
La desloratadine est une poudre blanche à blanc cassé légèrement soluble dans l'eau, mais très soluble dans l'éthanol et le propylène glycol. Il a une formule empirique : C19H19ClN2 et un poids moléculaire de 310,8. Le nom chimique est 8-chloro-6,11-dihydro-11-(4- pipéridinylidène)-5H-benzo[5,6]cyclohepta[1,2-b]pyridine et a la structure suivante :
LES INDICATIONS
Rhinite allergique saisonnière
CLARINEX® est indiqué pour le soulagement des symptômes nasaux et non nasaux de la rhinite allergique saisonnière chez les patients de 2 ans et plus.
Rhinite allergique perannuelle
CLARINEX est indiqué pour le soulagement des symptômes nasaux et non nasaux de la rhinite allergique perannuelle chez les patients âgés de 6 mois et plus.
Urticaire idiopathique chronique
CLARINEX 5 mg est indiqué pour le soulagement symptomatique du prurit, la réduction du nombre et de la taille des urticaires chez les patients atteints d'urticaire idiopathique chronique âgés de 6 mois et plus.
DOSAGE ET ADMINISTRATION
Bien qu'une formulation de comprimés à désintégration orale de desloratadine puisse être disponible sur le marché, les comprimés CLARINEX® RediTabs® ne sont plus commercialisés.
Les comprimés CLARINEX 5 mg, la solution buvable ou les comprimés RediTabs peuvent être pris sans tenir compte des repas. Placer les comprimés CLARINEX (desloratadine) RediTabs sur la langue et laisser se désintégrer avant d'avaler. La désintégration des comprimés se produit rapidement. Administrer avec ou sans eau. Prendre le comprimé immédiatement après ouverture de la plaquette.
La dose de solution buvable CLARINEX adaptée à l'âge doit être administrée avec un compte-gouttes ou une seringue disponible dans le commerce et calibré pour délivrer 2 ml et 2,5 ml (½ cuillère à thé).
Adultes et adolescents de 12 ans et plus
La dose recommandée de comprimés CLARINEX ou de comprimés CLARINEX RediTabs est d'un comprimé de 5 mg une fois par jour. La dose recommandée de solution buvable CLARINEX est de 2 cuillerées à thé (5 mg dans 10 ml) une fois par jour.
Enfants de 6 à 11 ans
La dose recommandée de solution buvable CLARINEX est de 1 cuillerée à thé (2,5 mg dans 5 ml) une fois par jour. La dose recommandée de comprimés CLARINEX RediTabs est d'un comprimé de 2,5 mg une fois par jour.
Enfants de 12 mois à 5 ans
La dose recommandée de CLARINEX 5 mg solution buvable est de ½ cuillerée à thé (1,25 mg dans 2,5 mL) une fois par jour.
Enfants de 6 à 11 mois
La dose recommandée de solution buvable CLARINEX est de 2 ml (1 mg) une fois par jour.
Adultes atteints d'insuffisance hépatique ou rénale
Chez les patients adultes présentant une insuffisance hépatique ou rénale, une dose initiale d'un comprimé de 5 mg tous les deux jours est recommandée sur la base des données pharmacocinétiques. La recommandation posologique pour les enfants atteints d'insuffisance hépatique ou rénale ne peut être faite en raison du manque de données [voir PHARMACOLOGIE CLINIQUE ].
COMMENT FOURNIE
Formes posologiques et points forts
Les comprimés CLARINEX sont des comprimés pelliculés bleu clair portant l'inscription « C5 » en relief contenant 5 mg de desloratadine. La solution orale CLARINEX est un liquide clair de couleur orange contenant 0,5 mg de desloratadine/1 mL.
Stockage et manutention
CLARINEX 5mg Comprimés : Comprimés pelliculés bleu clair « C5 » en relief, conditionnés dans des flacons en plastique polyéthylène haute densité de 100 ( CDN 0085-1264-01).
CLARINEX 5mg Solution buvable : Liquide clair de couleur orange contenant 0,5 mg/1 ml de desloratadine dans un flacon en verre ambré de 16 onces ( CDN 0085-1334-01) et une bouteille en verre ambré de 4 onces ( CDN 0085-1334-02).
Stockage
Comprimés CLARINEX : Protégez l'emballage de l'unité d'utilisation et l'emballage hospitalier à dose unitaire de l'humidité excessive. Conserver à 25 °C (77 °F); excursions autorisées jusqu'à 15-30°C (59-86°F) [voir Température ambiante contrôlée USP ]. Sensible à la chaleur. Éviter l'exposition à ou au-dessus de 30°C (86°F).
Solution buvable CLARINEX : Conserver à 25 °C (77 °F); excursions autorisées jusqu'à 15-30°C (59-86°F) [voir Température ambiante contrôlée USP ]. Protéger de la lumière.
Fabriqué pour : Merck Sharp & Dohme Corp., une filiale de MERCK & CO., INC., Whitehouse Station, NJ 08889, USA. Révisé : mars 2019
EFFETS SECONDAIRES
Les effets indésirables suivants sont discutés plus en détail dans d'autres sections de l'étiquette :
- Réactions d'hypersensibilité. [Voir AVERTISSEMENTS ET PRECAUTIONS ]
Expérience des essais cliniques
Étant donné que les essais cliniques sont menés dans des conditions très variables, les taux d'effets indésirables observés dans les essais cliniques d'un médicament ne peuvent pas être directement comparés aux taux des essais cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique clinique.
Adultes et adolescents
Rhinite allergique
Dans des essais contrôlés par placebo à doses multiples, 2834 patients âgés de 12 ans ou plus ont reçu des comprimés CLARINEX à des doses de 2,5 mg à 20 mg par jour, dont 1655 patients ont reçu la dose quotidienne recommandée de 5 mg. Chez les patients recevant 5 mg par jour, le taux d'événements indésirables était similaire entre CLARINEX 5 mg et les patients traités par placebo. Le pourcentage de patients qui se sont retirés prématurément en raison d'événements indésirables était de 2,4 % dans le groupe CLARINEX 5 mg et de 2,6 % dans le groupe placebo. Il n'y a eu aucun événement indésirable grave dans ces essais chez les patients recevant de la desloratadine. Tous les événements indésirables qui ont été signalés par un pourcentage supérieur ou égal à 2 % des patients ayant reçu la dose quotidienne recommandée de comprimés CLARINEX à 5 mg (5 mg une fois par jour) et qui étaient plus fréquents avec les comprimés CLARINEX qu'avec le placebo, sont répertoriés dans le tableau 1.
La fréquence et l'ampleur des anomalies de laboratoire et électrocardiographiques étaient similaires chez CLARINEX et chez les patients traités par placebo.
Il n'y avait aucune différence dans les événements indésirables pour les sous-groupes de patients tels que définis par le sexe, l'âge ou la race.
Urticaire idiopathique chronique
Dans des essais contrôlés par placebo à doses multiples sur l'urticaire chronique idiopathique, 211 patients âgés de 12 ans ou plus ont reçu des comprimés CLARINEX à 5 mg et 205 ont reçu un placebo. Les événements indésirables qui ont été signalés par un pourcentage supérieur ou égal à 2 % des patients ayant reçu CLARINEX 5 mg comprimés et qui étaient plus fréquents avec CLARINEX 5 mg qu'avec le placebo étaient (taux pour CLARINEX 5 mg et le placebo, respectivement) : maux de tête (14 %, 13 %) , nausées (5 %, 2 %), fatigue (5 %, 1 %), étourdissements (4 %, 3 %), pharyngite (3 %, 2 %), dyspepsie (3 %, 1 %) et myalgie (3 %, 1%).
Pédiatrie
Deux cent quarante-six sujets pédiatriques âgés de 6 mois à 11 ans ont reçu la solution orale CLARINEX pendant 15 jours dans le cadre de trois essais cliniques contrôlés par placebo. Les sujets pédiatriques âgés de 6 à 11 ans ont reçu 2,5 mg une fois par jour, les sujets âgés de 1 à 5 ans ont reçu 1,25 mg une fois par jour et les sujets âgés de 6 à 11 mois ont reçu 1,0 mg une fois par jour.
Chez les sujets âgés de 6 à 11 ans, aucun événement indésirable individuel n'a été signalé par 2 % ou plus des sujets.
Chez les sujets âgés de 2 à 5 ans, les événements indésirables signalés pour CLARINEX et le placebo chez au moins 2 % des sujets recevant CLARINEX 5 mg en solution buvable et à une fréquence supérieure à celle du placebo étaient la fièvre (5,5 %, 5,4 %), l'infection des voies urinaires (3,6 %, 0 %) et varicelle (3,6 %, 0 %).
Chez les sujets âgés de 12 à 23 mois, les événements indésirables signalés pour le produit CLARINEX à 5 mg et le placebo chez au moins 2 % des sujets recevant la solution orale CLARINEX et à une fréquence supérieure au placebo étaient la fièvre (16,9 %, 12,9 %), la diarrhée ( 15,4 %, 11,3 %), infections des voies respiratoires supérieures (10,8 %, 9,7 %), toux (10,8 %, 6,5 %), augmentation de l'appétit (3,1 %, 1,6 %), labilité émotionnelle (3,1 %, 0 %), épistaxis ( 3,1 %, 0 %), infection parasitaire (3,1 %, 0 %), pharyngite (3,1 %, 0 %), éruption maculopapuleuse (3,1 %, 0 %).
Chez les sujets âgés de 6 mois à 11 mois, les événements indésirables signalés pour CLARINEX 5 mg et le placebo chez au moins 2 % des sujets recevant CLARINEX 5 mg solution buvable et à une fréquence supérieure au placebo étaient des infections des voies respiratoires supérieures (21,2 %, 12,9 %), diarrhée (19,7 %, 8,1 %), fièvre (12,1 %, 1,6 %), irritabilité (12,1 %, 11,3 %), toux (10,6 %, 9,7 %), somnolence (9,1 %, 8,1 %), bronchite (6,1 %, 0 %), otite moyenne (6,1 %, 1,6 %), vomissements (6,1 %, 3,2 %), anorexie (4,5 %, 1,6 %), pharyngite (4,5 %, 1,6 %), insomnie (4,5 %, 0 %), rhinorrhée (4,5 %, 3,2 %), érythème (3,0 %, 1,6 %) et nausées (3,0 %, 0 %).
Aucun changement cliniquement significatif n'a été observé dans les paramètres électrocardiographiques, y compris l'intervalle QTc. Un seul des 246 sujets pédiatriques recevant CLARINEX 5 mg solution buvable dans les essais cliniques a arrêté le traitement en raison d'un événement indésirable.
Expérience post-commercialisation
Étant donné que les événements indésirables sont signalés volontairement par une population de taille incertaine, il n'est pas toujours possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale avec l'exposition au médicament. Les événements indésirables spontanés suivants ont été rapportés lors de la commercialisation de la desloratadine :
Troubles cardiaques : tachycardie, palpitations
Troubles respiratoires, thoraciques et médiastinaux : dyspnée
Affections de la peau et du tissu sous-cutané : éruption cutanée, prurit
Troubles du système nerveux : hyperactivité psychomotrice, troubles du mouvement (dont dystonie, tics et symptômes extrapyramidaux), convulsions (rapportées chez des patients avec ou sans trouble convulsif connu)
Troubles du système immunitaire : réactions d'hypersensibilité (telles que urticaire, œdème et anaphylaxie)
Enquêtes : enzymes hépatiques élevées, y compris la bilirubine
Affections hépatobiliaires : hépatite
Troubles du métabolisme et de la nutrition : Augmentation de l'appétit
INTERACTIONS MÉDICAMENTEUSES
Inhibiteurs du cytochrome P450 3A4
Dans des études cliniques contrôlées, la co-administration de desloratadine avec du kétoconazole, de l'érythromycine ou de l'azithromycine a entraîné une augmentation des concentrations plasmatiques de desloratadine et de 3-hydroxydesloratadine, mais il n'y a eu aucune modification cliniquement pertinente du profil de sécurité de la desloratadine. [Voir PHARMACOLOGIE CLINIQUE ]
Fluoxétine
Dans des études cliniques contrôlées, la co-administration de desloratadine avec la fluoxétine, un inhibiteur sélectif de la recapture de la sérotonine (ISRS), a entraîné une augmentation des concentrations plasmatiques de desloratadine et de 3-hydroxydesloratadine, mais il n'y a eu aucune modification cliniquement pertinente du profil de sécurité de la desloratadine. [Voir PHARMACOLOGIE CLINIQUE ]
Cimétidine
Dans des études cliniques contrôlées, la co-administration de desloratadine avec la cimétidine, un antagoniste des récepteurs H2 de l'histamine, a entraîné une augmentation des concentrations plasmatiques de desloratadine et de 3-hydroxydesloratadine, mais il n'y a pas eu de modifications cliniquement pertinentes du profil de sécurité de la desloratadine. [Voir PHARMACOLOGIE CLINIQUE ]
Toxicomanie et dépendance
Il n'y a aucune information indiquant qu'un abus ou une dépendance se produise avec les comprimés CLARINEX.
AVERTISSEMENTS
Inclus dans le cadre du PRÉCAUTIONS section.
PRÉCAUTIONS
Réactions d'hypersensibilité
Des réactions d'hypersensibilité telles que rash, prurit, urticaire, œdème, dyspnée et anaphylaxie ont été rapportées après l'administration de desloratadine. Si une telle réaction se produit, le traitement par CLARINEX 5 mg doit être arrêté et un traitement alternatif doit être envisagé. [Voir EFFETS INDÉSIRABLES ]
Informations sur les conseils aux patients
Conseillez au patient de lire l'étiquetage patient approuvé par la FDA ( INFORMATIONS PATIENTS ).
Informations pour les patients
- Les patients doivent être informés qu'ils doivent utiliser CLARINEX 5 mg conformément aux instructions.
- Comme il n'y a pas d'effets alimentaires sur la biodisponibilité, les patients peuvent être informés que CLARINEX 5mg comprimés, solution buvable ou RediTabs comprimés peuvent être pris sans tenir compte des repas.
- Les patients doivent être avertis de ne pas augmenter la dose ou la fréquence d'administration car les études n'ont pas démontré une efficacité accrue à des doses plus élevées et une somnolence peut survenir.
- Phénylcétonuriques : les comprimés CLARINEX RediTabs contiennent de la phénylalanine.
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Études de cancérogénicité
Le potentiel carcinogène de la desloratadine a été évalué à l'aide d'une étude sur la loratadine chez le rat et d'une étude sur la desloratadine chez la souris. Dans une étude de 2 ans chez le rat, la loratadine a été administrée dans l'alimentation à des doses allant jusqu'à 25 mg/kg/jour (les expositions estimées à la desloratadine et aux métabolites de la desloratadine étaient d'environ 30 fois l'ASC chez l'homme à la dose orale quotidienne recommandée). Une incidence significativement plus élevée de tumeurs hépatocellulaires (adénomes et carcinomes combinés) a été observée chez les mâles recevant 10 mg/kg/jour de loratadine et chez les mâles et les femelles recevant 25 mg/kg/jour de loratadine. L'exposition estimée à la desloratadine et aux métabolites de la desloratadine chez les rats ayant reçu 10 mg/kg de loratadine était d'environ 7 fois l'ASC chez l'homme à la dose orale quotidienne recommandée. La signification clinique de ces résultats lors de l'utilisation à long terme de la desloratadine n'est pas connue.
Dans une étude alimentaire de 2 ans chez la souris, les mâles et les femelles ayant reçu jusqu'à 16 mg/kg/jour et 32 mg/kg/jour de desloratadine, respectivement, n'ont montré aucune augmentation significative de l'incidence des tumeurs. Les expositions estimées à la desloratadine et aux métabolites de la desloratadine chez la souris à ces doses étaient respectivement de 12 et 27 fois l'ASC chez l'homme à la dose orale quotidienne recommandée.
Études de génotoxicité
Dans les études de génotoxicité avec la desloratadine, il n'y avait aucune preuve de potentiel génotoxique dans un test de mutation inverse (test de mutagénicité bactérienne sur microsome de mammifère Salmonella/E. ).
Altération de la fertilité
Il n'y a eu aucun effet sur la fertilité des femelles chez le rat à des doses de desloratadine allant jusqu'à 24 mg/kg/jour (les expositions estimées à la desloratadine et aux métabolites de la desloratadine étaient d'environ 130 fois l'ASC chez l'homme à la dose orale quotidienne recommandée). Une diminution spécifique de la fertilité chez les mâles, démontrée par des taux de conception réduits chez les femelles, une diminution du nombre et de la motilité des spermatozoïdes et des modifications histopathologiques des testicules, s'est produite à une dose orale de desloratadine de 12 mg/kg chez le rat (les expositions estimées à la desloratadine et aux métabolites de la desloratadine étaient d'environ 45 fois la ASC chez l'homme à la dose orale quotidienne recommandée). La desloratadine n'a eu aucun effet sur la fertilité chez le rat à une dose orale de 3 mg/kg/jour (les expositions estimées à la desloratadine et aux métabolites de la desloratadine étaient d'environ 8 fois l'ASC chez l'homme à la dose orale quotidienne recommandée).
Utilisation dans des populations spécifiques
Grossesse
Catégorie de grossesse C
Il n'y a pas d'études adéquates et bien contrôlées chez les femmes enceintes. Étant donné que les études de reproduction chez l'animal ne sont pas toujours prédictives de la réponse humaine, la desloratadine ne doit être utilisée pendant la grossesse qu'en cas de nécessité absolue.
La desloratadine n'était pas tératogène chez le rat ou le lapin à environ 210 et 230 fois, respectivement, l'aire sous la courbe concentration-temps (ASC) chez l'homme à la dose orale quotidienne recommandée. Une augmentation de la perte pré-implantatoire et une diminution du nombre d'implantations et de fœtus ont cependant été notées dans une étude distincte chez des rats femelles à environ 120 fois l'ASC chez l'homme à la dose orale quotidienne recommandée. Une réduction du poids corporel et un réflexe de redressement lent ont été rapportés chez les chiots à environ 50 fois ou plus que l'ASC chez l'homme à la dose orale quotidienne recommandée. La desloratadine n'a eu aucun effet sur le développement des ratons à environ 7 fois l'ASC chez l'homme à la dose orale quotidienne recommandée. En comparaison, les ASC faisaient référence à l'exposition à la desloratadine chez les lapins et à la somme des expositions à la desloratadine et à ses métabolites chez les rats, respectivement. [Voir Toxicologie non clinique ]
Mères allaitantes
La desloratadine passe dans le lait maternel ; par conséquent, une décision doit être prise soit d'interrompre l'allaitement soit d'arrêter la desloratadine, en tenant compte du bénéfice du médicament pour la mère qui allaite et du risque possible pour l'enfant.
Utilisation pédiatrique
La dose recommandée de CLARINEX 5 mg solution buvable dans la population pédiatrique est basée sur la comparaison d'études croisées de la concentration plasmatique de CLARINEX 5 mg chez les adultes et les sujets pédiatriques. L'innocuité de CLARINEX solution buvable a été établie chez 246 sujets pédiatriques âgés de 6 mois à 11 ans dans trois études cliniques contrôlées par placebo. L'évolution de la rhinite allergique saisonnière et perannuelle et de l'urticaire chronique idiopathique et les effets de CLARINEX étant suffisamment similaires dans les populations pédiatriques et adultes, cela permet une extrapolation des données d'efficacité adultes aux patients pédiatriques. L'efficacité de CLARINEX 5 mg solution buvable dans ces tranches d'âge est étayée par des preuves issues d'études adéquates et bien contrôlées de CLARINEX 5 mg comprimés chez l'adulte. L'innocuité et l'efficacité des comprimés CLARINEX 5 mg ou de la solution buvable CLARINEX 5 mg n'ont pas été démontrées chez les patients pédiatriques de moins de 6 mois. [Voir PHARMACOLOGIE CLINIQUE ]
Le comprimé CLARINEX RediTabs 2,5 mg n'a pas été évalué chez les patients pédiatriques. La bioéquivalence du comprimé CLARINEX 5 mg RediTabs et du comprimé RediTabs précédemment commercialisé a été établie chez l'adulte. Conjointement avec les études de recherche de dose en pédiatrie décrites, les données pharmacocinétiques de CLARINEX 5 mg RediTabs soutiennent l'utilisation de la dose de 2,5 mg chez les patients pédiatriques âgés de 6 à 11 ans.
Utilisation gériatrique
Les études cliniques sur la desloratadine n'ont pas inclus un nombre suffisant de sujets âgés de 65 ans et plus pour déterminer s'ils répondent différemment des sujets plus jeunes. D'autres expériences cliniques rapportées n'ont pas identifié de différences entre les patients âgés et les patients plus jeunes. En général, la sélection de la dose pour un patient âgé doit être prudente, reflétant la fréquence plus élevée de diminution de la fonction hépatique, rénale ou cardiaque et de maladie concomitante ou d'un autre traitement médicamenteux. [Voir PHARMACOLOGIE CLINIQUE ]
Insuffisance rénale
Un ajustement posologique chez les patients insuffisants rénaux est recommandé [voir DOSAGE ET ADMINISTRATION et PHARMACOLOGIE CLINIQUE ].
Insuffisance hépatique
Un ajustement posologique chez les patients insuffisants hépatiques est recommandé [voir DOSAGE ET ADMINISTRATION et PHARMACOLOGIE CLINIQUE ].
SURDOSAGE
En cas de surdosage, envisager des mesures standard pour éliminer tout médicament non absorbé. Un traitement symptomatique et de soutien est recommandé. La desloratadine et la 3-hydroxydesloratadine ne sont pas éliminées par hémodialyse.
Les informations concernant le surdosage aigu sont limitées à l'expérience des rapports d'événements indésirables post-commercialisation et des essais cliniques menés pendant le développement du produit CLARINEX 5 mg. Dans un essai de détermination de dose, à des doses de 10 mg et 20 mg/jour, une somnolence a été signalée.
Dans une autre étude, aucun événement indésirable cliniquement pertinent n'a été signalé chez des volontaires sains, hommes et femmes, qui ont reçu des doses quotidiennes uniques de CLARINEX 45 mg pendant 10 jours [voir PHARMACOLOGIE CLINIQUE ].

La létalité est survenue chez le rat à des doses orales de 250 mg/kg ou plus (les expositions estimées à la desloratadine et au métabolite de la desloratadine étaient d'environ 120 fois l'ASC chez l'homme à la dose orale quotidienne recommandée). La dose létale médiane orale chez la souris était de 353 mg/kg (les expositions estimées à la desloratadine étaient d'environ 290 fois la dose orale quotidienne humaine sur une base en mg/m²). Aucun décès n'est survenu à des doses orales allant jusqu'à 250 mg/kg chez le singe (l'exposition estimée à la desloratadine était d'environ 810 fois la dose orale quotidienne chez l'homme sur une base en mg/m²).
CONTRE-INDICATIONS
CLARINEX 5 mg comprimés, RediTabs et solution buvable sont contre-indiqués chez les patients hypersensibles à ce médicament ou à l'un de ses ingrédients ou à la loratadine [voir AVERTISSEMENTS ET PRECAUTIONS et EFFETS INDÉSIRABLES ].
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
La desloratadine est un antagoniste tricyclique de l'histamine à action prolongée avec une activité antagoniste sélective des récepteurs H1 de l'histamine. Les données de liaison aux récepteurs indiquent qu'à une concentration de 2 à 3 ng/mL (7 nanomolaires), la desloratadine présente une interaction significative avec le récepteur H1 de l'histamine humaine. La desloratadine a inhibé la libération d'histamine par les mastocytes humains in vitro. Les résultats d'une étude de distribution dans les tissus radiomarqués chez le rat et d'une étude de liaison au récepteur radioligand H1 chez le cobaye ont montré que la desloratadine ne traversait pas facilement la barrière hémato-encéphalique. La signification clinique de cette découverte est inconnue.
Pharmacodynamie
papule et fusée éclairante
Des études sur les papules cutanées à l'histamine humaine après des doses uniques et répétées de 5 mg de desloratadine ont montré que le médicament présente un effet antihistaminique après 1 heure; cette activité peut persister jusqu'à 24 heures. Il n'y avait aucun signe de tachyphylaxie cutanée induite par l'histamine dans le groupe desloratadine 5 mg au cours de la période de traitement de 28 jours. La pertinence clinique des tests cutanés à l'histamine n'est pas connue.
Effets sur QTc
Des doses quotidiennes uniques de 45 mg ont été administrées à des volontaires masculins et féminins normaux pendant 10 jours. Tous les ECG obtenus dans cette étude ont été lus manuellement en aveugle par un cardiologue. Chez les sujets traités par CLARINEX, il y a eu une augmentation de la fréquence cardiaque moyenne de 9,2 bpm par rapport au placebo. L'intervalle QT a été corrigé pour la fréquence cardiaque (QTc) par les méthodes de Bazett et de Fridericia. En utilisant le QTc (Bazett), il y a eu une augmentation moyenne de 8,1 msec chez les sujets traités par CLARINEX par rapport au placebo. En utilisant QTc (Fridericia), il y a eu une augmentation moyenne de 0,4 msec chez les sujets traités par CLARINEX par rapport au placebo. Aucun effet indésirable cliniquement pertinent n'a été signalé.
Pharmacocinétique
Absorption
Après administration orale d'un comprimé de desloratadine 5 mg une fois par jour pendant 10 jours à des volontaires sains normaux, le temps moyen jusqu'aux concentrations plasmatiques maximales (Tmax) s'est produit environ 3 heures après l'administration et les concentrations plasmatiques maximales moyennes à l'état d'équilibre (Cmax) et l'ASC de 4 ng/mL et 56,9 ng.h/mL ont été observés, respectivement. Ni les aliments ni le jus de pamplemousse n'ont eu d'effet sur la biodisponibilité (Cmax et ASC) de la desloratadine.
Le profil pharmacocinétique de CLARINEX solution buvable a été évalué dans une étude croisée à trois voies chez 30 volontaires adultes. Une dose unique de 10 mL de solution orale CLARINEX contenant 5 mg de desloratadine était bioéquivalente à une dose unique de comprimé CLARINEX à 5 mg. La nourriture n'a eu aucun effet sur la biodisponibilité (ASC et Cmax) de CLARINEX 5 mg solution buvable.
Le profil pharmacocinétique des comprimés CLARINEX 5mg RediTabs a été évalué dans une étude croisée à trois voies chez 24 volontaires adultes. Un seul comprimé CLARINEX RediTabs contenant 5 mg de desloratadine était bioéquivalent à un seul comprimé CLARINEX RediTabs de 5 mg (formulation originale) pour la desloratadine et la 3-hydroxydesloratadine. La nourriture et l'eau n'ont eu aucun effet sur la biodisponibilité (ASC et Cmax) des comprimés CLARINEX RediTabs.
Distribution
La desloratadine et la 3-hydroxydesloratadine sont respectivement liées à environ 82 % à 87 % et 85 % à 89 % aux protéines plasmatiques. La liaison aux protéines de la desloratadine et de la 3-hydroxydesloratadine n'a pas été altérée chez les sujets présentant une insuffisance rénale.
Métabolisme
La desloratadine (un métabolite majeur de la loratadine) est largement métabolisée en 3-hydroxydesloratadine, un métabolite actif, qui est ensuite glucuronidé. La ou les enzymes responsables de la formation de la 3-hydroxydesloratadine n'ont pas été identifiées. Les données des essais cliniques indiquent qu'un sous-ensemble de la population générale a une capacité réduite à former de la 3-hydroxydesloratadine et est un mauvais métaboliseur de la desloratadine. Dans les études pharmacocinétiques (n = 3748), environ 6 % des sujets étaient des métaboliseurs lents de la desloratadine (définis comme un sujet avec un rapport ASC de la 3-hydroxydesloratadine à la desloratadine inférieur à 0,1, ou un sujet avec une demi-vie de la desloratadine supérieure à 50 heures ). Ces études pharmacocinétiques ont inclus des sujets âgés de 2 à 70 ans, dont 977 sujets âgés de 2 à 5 ans, 1575 sujets âgés de 6 à 11 ans et 1196 sujets âgés de 12 à 70 ans. Il n'y avait pas de différence dans la prévalence des métaboliseurs lents entre les groupes d'âge. La fréquence des métaboliseurs lents était plus élevée chez les Noirs (17 %, n = 988) que chez les Caucasiens (2 %, n = 1 462) et les Hispaniques (2 %, n = 1 063). L'exposition médiane (ASC) à la desloratadine chez les métaboliseurs lents était environ 6 fois plus élevée que chez les sujets qui ne sont pas des métaboliseurs lents. Les sujets métaboliseurs lents de la desloratadine ne peuvent pas être identifiés de manière prospective et seront exposés à des niveaux plus élevés de desloratadine après administration de la dose recommandée de desloratadine. Dans les études d'innocuité cliniques multidoses, où le statut du métaboliseur a été identifié, un total de 94 métaboliseurs lents et 123 métaboliseurs normaux ont été recrutés et traités avec la solution orale CLARINEX pendant 15 à 35 jours. Dans ces études, aucune différence globale de sécurité n'a été observée entre les métaboliseurs lents et les métaboliseurs normaux. Bien qu'il n'ait pas été observé dans ces études, un risque accru d'effets indésirables liés à l'exposition chez les patients métaboliseurs lents ne peut être exclu.
Élimination
La demi-vie d'élimination plasmatique moyenne de la desloratadine était d'environ 27 heures. Les valeurs de Cmax et d'ASC ont augmenté de manière proportionnelle à la dose après des doses orales uniques comprises entre 5 et 20 mg. Le degré d'accumulation après 14 jours d'administration correspondait à la demi-vie et à la fréquence d'administration. Une étude sur le bilan massique humain a documenté une récupération d'environ 87 % de la dose de 14C-desloratadine, qui était également distribuée dans l'urine et les fèces sous forme de produits métaboliques. L'analyse de la 3hydroxydesloratadine plasmatique a montré des valeurs de Tmax et de demi-vie similaires à celles de la desloratadine.
Populations particulières
Sujets gériatriques
Chez les sujets âgés (≥ 65 ans ; n = 17) après administration de doses multiples de CLARINEX 5 mg, comprimés, les valeurs moyennes de la Cmax et de l'ASC de la desloratadine étaient supérieures de 20 % à celles observées chez les sujets plus jeunes (
Sujets pédiatriques
Chez les sujets âgés de 6 à 11 ans, une dose unique de 5 ml de solution orale CLARINEX contenant 2,5 mg de desloratadine a entraîné des concentrations plasmatiques de desloratadine similaires à celles obtenues chez les adultes ayant reçu un seul comprimé CLARINEX à 5 mg. Chez les sujets âgés de 2 à 5 ans, une dose unique de 2,5 mL de solution buvable CLARINEX contenant 1,25 mg de desloratadine a entraîné des concentrations plasmatiques de desloratadine similaires à celles obtenues chez les adultes ayant reçu un seul comprimé CLARINEX à 5 mg. Cependant, la Cmax et l'ASC du métabolite (3-hydroxydesloratadine) étaient 1,27 et 1,61 fois plus élevées pour la dose de 5 mg de solution buvable administrée chez l'adulte par rapport à la Cmax et l'ASC obtenues chez les enfants de 2 à 11 ans recevant 1,25- 2,5 mg de solution buvable CLARINEX.
Une dose unique de 2,5 ml ou 1,25 ml de solution orale CLARINEX 5 mg contenant respectivement 1,25 mg ou 0,625 mg de desloratadine a été administrée à des sujets âgés de 6 à 11 mois et de 12 à 23 mois. Les résultats d'une analyse pharmacocinétique de population ont indiqué qu'une dose de 1 mg pour les sujets âgés de 6 à 11 mois et de 1,25 mg pour les sujets âgés de 12 à 23 mois est nécessaire pour obtenir des concentrations plasmatiques de desloratadine similaires à celles obtenues chez les adultes ayant reçu une dose unique de 5- mg de solution orale CLARINEX.
Le comprimé CLARINEX 5 mg RediTabs 2,5 mg n'a pas été évalué chez les patients pédiatriques. La bioéquivalence du comprimé CLARINEX 5 mg RediTabs et des comprimés CLARINEX 5 mg RediTabs originaux a été établie chez l'adulte. En conjonction avec les études de recherche de dose en pédiatrie décrites, les données pharmacocinétiques des comprimés CLARINEX 5 mg RediTabs soutiennent l'utilisation de la dose de 2,5 mg chez les patients pédiatriques âgés de 6 à 11 ans.
Insuffisance rénale
La pharmacocinétique de la desloratadine après une dose unique de 7,5 mg a été caractérisée chez des patients présentant une insuffisance légère (n = 7 ; clairance de la créatinine 51-69 mL/min/1,73 m²), modérée (n = 6 ; clairance de la créatinine 34-43 mL/min/1,73 m² ), et les patients atteints d'insuffisance rénale sévère (n = 6 ; clairance de la créatinine 5-29 mL/min/1,73 m²) ou dépendants de l'hémodialyse (n = 6). Chez les patients atteints d'insuffisance rénale légère et modérée, les valeurs médianes de la Cmax et de l'ASC ont augmenté d'environ 1,2 et 1,9 fois, respectivement, par rapport aux sujets ayant une fonction rénale normale. Chez les patients atteints d'insuffisance rénale sévère ou dépendants de l'hémodialyse, les valeurs de la Cmax et de l'ASC ont augmenté d'environ 1,7 et 2,5 fois, respectivement. Des modifications minimes des concentrations de 3-hydroxydesloratadine ont été observées. La desloratadine et la 3-hydroxydesloratadine ont été mal éliminées par hémodialyse. La liaison aux protéines plasmatiques de la desloratadine et de la 3-hydroxydesloratadine n'a pas été altérée par l'insuffisance rénale. Un ajustement posologique chez les patients insuffisants rénaux est recommandé [voir DOSAGE ET ADMINISTRATION ].
Insuffisance hépatique
La pharmacocinétique de la desloratadine a été caractérisée après une dose orale unique chez des patients présentant une insuffisance hépatique légère (n = 4), modérée (n = 4) et sévère (n = 4) telle que définie par la classification de Child-Pugh de la fonction hépatique et 8 sujets avec fonction hépatique normale. Les patients atteints d'insuffisance hépatique, quelle que soit leur gravité, présentaient une augmentation d'environ 2,4 fois de l'ASC par rapport aux sujets normaux. La clairance orale apparente de la desloratadine chez les patients présentant une insuffisance hépatique légère, modérée et sévère était de 37 %, 36 % et 28 % de celle des sujets normaux, respectivement. Une augmentation de la demi-vie d'élimination moyenne de la desloratadine chez les patients insuffisants hépatiques a été observée. Pour la 3-hydroxydesloratadine, les valeurs moyennes de Cmax et d'ASC pour les patients atteints d'insuffisance hépatique n'étaient pas statistiquement significativement différentes de celles des sujets ayant une fonction hépatique normale. Un ajustement posologique chez les patients insuffisants hépatiques est recommandé [voir DOSAGE ET ADMINISTRATION ].
Le genre
Les sujets féminins traités pendant 14 jours avec les comprimés CLARINEX à 5 mg présentaient respectivement des valeurs de Cmax et d'ASC de la desloratadine 10 % et 3 % supérieures à celles des sujets masculins. Les valeurs de la Cmax et de l'ASC de la 3-hydroxydesloratadine ont également augmenté de 45 % et 48 %, respectivement, chez les femmes par rapport aux hommes. Cependant, ces différences apparentes ne sont probablement pas cliniquement pertinentes et, par conséquent, aucun ajustement posologique n'est recommandé.
Course
Après 14 jours de traitement avec les comprimés CLARINEX, les valeurs de la Cmax et de l'ASC de la desloratadine étaient respectivement supérieures de 18 % et 32 % chez les Noirs par rapport aux Caucasiens. Pour la 3-hydroxydesloratadine, il y avait une réduction correspondante de 10 % des valeurs de Cmax et d'ASC chez les Noirs par rapport aux Caucasiens. Ces différences ne sont probablement pas cliniquement pertinentes et, par conséquent, aucun ajustement posologique n'est recommandé.
Interactions médicamenteuses
Dans deux études pharmacologiques cliniques croisées contrôlées chez des volontaires sains de sexe masculin (n = 12 dans chaque étude) et de sexe féminin (n = 12 dans chaque étude), la desloratadine 7,5 mg (1,5 fois la dose quotidienne) une fois par jour a été co-administrée avec de l'érythromycine 500 mg toutes les 8 heures ou kétoconazole 200 mg toutes les 12 heures pendant 10 jours. Dans trois études pharmacologiques cliniques contrôlées distinctes en groupes parallèles, la desloratadine à la dose clinique de 5 mg a été co-administrée avec l'azithromycine 500 mg suivi de 250 mg une fois par jour pendant 4 jours (n = 18) ou avec la fluoxétine 20 mg une fois par jour pendant 7 jours après une période de prétraitement de 23 jours avec de la fluoxétine (n = 18) ou avec de la cimétidine 600 mg toutes les 12 heures pendant 14 jours (n = 18) à l'état d'équilibre chez des volontaires masculins et féminins en bonne santé. Bien qu'une augmentation des concentrations plasmatiques (Cmax et ASC0-24 h) de la desloratadine et de la 3-hydroxydesloratadine ait été observée (voir tableau 2), il n'y a pas eu de modification cliniquement pertinente du profil de sécurité de la desloratadine, tel qu'évalué par les paramètres électrocardiographiques (y compris l'intervalle QT corrigé), les tests de laboratoire clinique, les signes vitaux et les événements indésirables.
Toxicologie animale et/ou pharmacologie Études de toxicologie reproductive
La desloratadine n'était pas tératogène chez le rat à des doses allant jusqu'à 48 mg/kg/jour (les expositions estimées à la desloratadine et à son métabolite étaient d'environ 210 fois l'ASC chez l'homme à la dose orale quotidienne recommandée) ou chez le lapin à des doses allant jusqu'à 60 mg/kg/jour. jour (les expositions estimées à la desloratadine étaient d'environ 230 fois l'ASC chez l'homme à la dose orale quotidienne recommandée). Dans une étude distincte, une augmentation de la perte préimplantatoire et une diminution du nombre d'implantations et de fœtus ont été notées chez les rats femelles à 24 mg/kg (les expositions estimées à la desloratadine et aux métabolites de la desloratadine étaient d'environ 120 fois l'ASC chez l'homme à la dose orale quotidienne recommandée). dose). Une réduction du poids corporel et un ralentissement du réflexe de redressement ont été rapportés chez les ratons à des doses de 9 mg/kg/jour ou plus (les expositions estimées à la desloratadine et aux métabolites de la desloratadine étaient environ 50 fois ou supérieures à l'ASC chez l'homme à la dose orale quotidienne recommandée). La desloratadine n'a eu aucun effet sur le développement des ratons à une dose orale de 3 mg/kg/jour (les expositions estimées à la desloratadine et aux métabolites de la desloratadine étaient d'environ 7 fois l'ASC chez l'homme à la dose orale quotidienne recommandée).
Etudes cliniques
Rhinite allergique saisonnière
L'efficacité clinique et l'innocuité des comprimés CLARINEX ont été évaluées chez plus de 2 300 patients âgés de 12 à 75 ans atteints de rhinite allergique saisonnière. Au total, 1 838 patients ont reçu 2,5 à 20 mg/jour de CLARINEX dans le cadre de 4 essais cliniques à double insu, randomisés et contrôlés par placebo d'une durée de 2 à 4 semaines menés aux États-Unis. Les résultats de ces études ont démontré l'efficacité et la tolérance de CLARINEX 5 mg dans le traitement des patients adultes et adolescents atteints de rhinite allergique saisonnière. Dans un essai de dosage, CLARINEX 2,5 à 20 mg/jour a été étudié. Les doses de 5, 7,5, 10 et 20 mg/jour étaient supérieures au placebo ; et aucun avantage supplémentaire n'a été observé à des doses supérieures à 5,0 mg. Dans la même étude, une augmentation de l'incidence de la somnolence a été observée aux doses de 10 mg/jour et 20 mg/jour (5,2 % et 7,6 %, respectivement), par rapport au placebo (2,3 %).
Dans deux études de 4 semaines portant sur 924 patients (âgés de 15 à 75 ans) atteints de rhinite allergique saisonnière et d'asthme concomitant, CLARINEX 5 mg, comprimés 5 mg une fois par jour, a amélioré les symptômes de la rhinite, sans diminution de la fonction pulmonaire. Cela confirme la sécurité de l'administration de CLARINEX 5 mg comprimés aux patients adultes atteints de rhinite allergique saisonnière avec un asthme léger à modéré.
Les comprimés CLARINEX à 5 mg une fois par jour ont réduit de manière significative le score total des symptômes (la somme des scores individuels des symptômes nasaux et non nasaux) chez les patients atteints de rhinite allergique saisonnière. Voir le tableau 3.
Il n'y avait aucune différence significative dans l'efficacité de CLARINEX 5 mg, comprimés à 5 mg entre les sous-groupes de patients définis par le sexe, l'âge ou la race.
Rhinite allergique perannuelle
L'efficacité et la sécurité cliniques des comprimés CLARINEX 5 mg ont été évaluées chez plus de 1300 patients âgés de 12 à 80 ans atteints de rhinite allergique perannuelle. Au total, 685 patients ont reçu 5 mg/jour de CLARINEX 5 mg dans deux essais cliniques à double insu, randomisés et contrôlés par placebo d'une durée de 4 semaines menés aux États-Unis et dans le monde. Dans l'une de ces études, il a été démontré que CLARINEX 5 mg, comprimés à 5 mg une fois par jour, réduisait significativement le score total des symptômes chez les patients atteints de rhinite allergique perannuelle (tableau 4).
Urticaire idiopathique chronique
L'efficacité et la sécurité de CLARINEX 5 mg, comprimés à 5 mg une fois par jour ont été étudiées chez 416 patients atteints d'urticaire chronique idiopathique âgés de 12 à 84 ans, dont 211 ont reçu CLARINEX. Dans deux essais cliniques randomisés en double aveugle, contrôlés par placebo, d'une durée de six semaines, à l'évaluation primaire pré-spécifiée d'une semaine, les comprimés CLARINEX ont réduit de manière significative la sévérité du prurit par rapport au placebo (tableau 5). Les critères d'évaluation secondaires ont également été évalués et, au cours de la première semaine de traitement, CLARINEX 5 mg, comprimés à 5 mg, a réduit les critères d'évaluation secondaires, le « nombre d'urticaires » et la « taille de la plus grande ruche », par rapport au placebo.
L'innocuité clinique de la solution orale CLARINEX a été documentée dans trois études d'innocuité de 15 jours, à double insu et contrôlées par placebo chez des sujets pédiatriques ayant des antécédents documentés de rhinite allergique, d'urticaire idiopathique chronique ou de sujets candidats à un traitement antihistaminique. Dans la première étude, 2,5 mg de solution buvable CLARINEX ont été administrés à 60 sujets pédiatriques âgés de 6 à 11 ans. La deuxième étude a évalué 1,25 mg de solution buvable CLARINEX administrée à 55 sujets pédiatriques âgés de 2 à 5 ans. Dans la troisième étude, 1,25 mg de solution orale CLARINEX à 5 mg a été administré à 65 sujets pédiatriques âgés de 12 à 23 mois et 1,0 mg de solution orale CLARINEX a été administré à 66 sujets pédiatriques âgés de 6 à 11 mois. Les résultats de ces études ont démontré l'innocuité de CLARINEX 5 mg solution buvable chez les sujets pédiatriques âgés de 6 mois à 11 ans.
INFORMATIONS PATIENTS
CLARINEX® (CLA-RI-NEX) (desloratadine) comprimés, RediTabs® et solution buvable
Lisez les informations destinées aux patients fournies avec CLARINEX® avant de commencer à le prendre et chaque fois que vous recevez une recharge. Il peut y avoir de nouvelles informations. Cette notice est un résumé des informations destinées aux patients. Votre médecin ou votre pharmacien peut vous donner des informations supplémentaires. Cette notice ne remplace pas la discussion avec votre médecin de votre état de santé ou de votre traitement.
Qu'est-ce que CLARINEX 5mg ?
CLARINEX est un médicament délivré sur ordonnance qui contient le médicament desloratadine (un antihistaminique).
CLARINEX est utilisé pour aider à contrôler les symptômes de :
- rhinite allergique saisonnière (éternuements, nez bouché, nez qui coule et démangeaisons du nez) chez les personnes de 2 ans et plus.
- rhinite allergique perannuelle (éternuements, nez bouché, nez qui coule et démangeaisons du nez) chez les personnes de 6 mois et plus.
- l'urticaire chronique idiopathique (démangeaisons à long terme) et pour réduire le nombre et la taille de l'urticaire chez les personnes de 6 mois et plus.
CLARINEX n'est pas destiné aux enfants de moins de 6 mois.
Qui ne devrait pas prendre CLARINEX ?
Ne prenez jamais CLARINEX 5 mg si vous :
- êtes allergique à la desloratadine ou à l'un des ingrédients des comprimés CLARINEX, des comprimés CLARINEX RediTabs® ou de la solution orale CLARINEX. Voir la fin de cette notice pour une liste complète des ingrédients.
- êtes allergique à la loratadine (Alavert, Claritin).
Adressez-vous à votre médecin avant de prendre ce médicament si vous avez des questions sur la prise ou non de ce médicament.
Que dois-je dire à mon médecin avant de prendre CLARINEX 5 mg ?
Avant de prendre CLARINEX 5 mg, informez votre médecin si vous :
- avez des problèmes de foie ou de rein.
- avoir d'autres conditions médicales.
- êtes enceinte ou envisagez de devenir enceinte. On ne sait pas si CLARINEX 5 mg nuira à votre bébé à naître. Parlez à votre médecin si vous êtes enceinte ou envisagez de devenir enceinte.
- allaitez ou envisagez d'allaiter. CLARINEX 5mg peut passer dans votre lait maternel. Discutez avec votre médecin de la meilleure façon de nourrir votre bébé si vous prenez CLARINEX.
Informez votre médecin de tous les médicaments que vous prenez, y compris les médicaments sur ordonnance et en vente libre, les vitamines et les suppléments à base de plantes. CLARINEX 5 mg peut affecter le mode d'action d'autres médicaments, et d'autres médicaments peuvent affecter le fonctionnement de CLARINEX 5 mg. Prévenez surtout votre médecin si vous prenez :
- kétoconazole (Nizoral)
- érythromycine (Ery-tab, Eryc, PCE)
- azithromycine (Zithromax, Zmax)
- antihistaminiques
- fluoxétine (Prozac)
- cimétidine (Tagamet)
Connaissez les médicaments que vous prenez. Conservez une liste de vos médicaments et montrez-la à votre médecin et à votre pharmacien lorsque vous recevez un nouveau médicament.
Comment dois-je prendre CLARINEX ?
- Prenez CLARINEX 5 mg exactement comme votre médecin vous l'a indiqué.
- Ne modifiez pas votre dose de CLARINEX 5 mg et ne prenez pas plus souvent que prescrit.
- CLARINEX 5 mg peut être pris avec ou sans nourriture.
- Placez CLARINEX RediTabs Tablet sur votre langue et laissez-le se dissoudre avant de l'avaler. CLARINEX 5mg RediTabs peut être pris avec ou sans eau. Prenez votre comprimé CLARINEX 5mg RediTabs immédiatement après avoir ouvert la plaquette thermoformée.
- Prenez la solution buvable CLARINEX avec un compte-gouttes ou une seringue orale pouvant mesurer 2 ml ou 2,5 ml. Demandez à votre pharmacien un compte-gouttes ou une seringue si vous n'en avez pas.
- Si vous avez pris trop de CLARINEX, appelez votre médecin ou consultez immédiatement un médecin.
Quels sont les effets secondaires possibles des comprimés CLARINEX ?
CLARINEX 5 mg peut provoquer des effets indésirables graves, notamment :
- Réactions allergiques. Arrêtez de prendre CLARINEX 5 mg et appelez immédiatement votre médecin ou obtenez une aide d'urgence si vous présentez l'un de ces symptômes :
- éruption
- démangeaison
- urticaire
- gonflement des lèvres, de la langue, du visage et de la gorge
- essoufflement ou difficulté à respirer
Les effets secondaires les plus courants de CLARINEX chez les adultes et les enfants de 12 ans et plus atteints de rhinite allergique comprennent :
- mal de gorge
- bouche sèche
- douleur musculaire
- fatigue
- envie de dormir
- les douleurs menstruelles
Une somnolence ou une fatigue accrue peut survenir si vous prenez plus de CLARINEX que la quantité prescrite par votre médecin.
Dites à votre médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de CLARINEX. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
Comment dois-je conserver CLARINEX 5mg ?
- Magasin Comprimés CLARINEX entre 59 °F et 86 °F (15 °C et 30 °C).
- Comprimés CLARINEX sont sensibles à la chaleur. Ne pas entreposer au-dessus de 86 °F (30 °C).
- Protéger CLARINEX 5mg Comprimés de l'humidité.
- Magasin CLARINEX 5mg Solution buvable entre 59 °F et 86 °F (15 °C et 30 °C). Protégez CLARINEX 5 mg solution buvable de la lumière.
Donjon Comprimés CLARINEX, Comprimés RediTabs , et Solution orale et tous les médicaments hors de portée des enfants.
Informations générales sur CLARINEX
Les médicaments sont parfois prescrits à des fins autres que celles énumérées dans une notice d'information destinée aux patients. N'utilisez pas CLARINEX 5 mg pour une affection pour laquelle il n'a pas été prescrit. Ne donnez pas CLARINEX 5 mg à d'autres personnes, même si elles souffrent de la même maladie que vous. Cela peut leur nuire.
Cette notice d'information destinée aux patients résume les informations les plus importantes sur CLARINEX. Si vous souhaitez plus d'informations, parlez-en à votre médecin. Vous pouvez demander à votre pharmacien ou à votre médecin des informations sur CLARINEX destinées aux professionnels de la santé.
Pour plus d'informations, rendez-vous sur www.CLARINEX.com
Quels sont les ingrédients de CLARINEX 5mg ?
Ingrédient actif: desloratadine
Patients atteints de phénylcétonurie : Les comprimés CLARINEX RediTabs contiennent de la phénylalanine.
Ingrédients inactifs des comprimés CLARINEX 5 mg : phosphate de calcium dibasique dihydraté USP, cellulose microcristalline NF, amidon de maïs NF, talc USP, cire de carnauba NF, cire blanche NF, matériau d'enrobage composé de lactose monohydraté, d'hypromellose, de dioxyde de titane, de polyéthylène glycol et de laque d'aluminium FD&C Blue #2.
Ingrédients inactifs de la solution orale CLARINEX 5 mg : propylène glycol USP, solution de sorbitol USP, acide citrique (anhydre) USP, citrate de sodium dihydraté USP, benzoate de sodium NF, édétate disodique USP, eau purifiée USP. Il contient également du sucre granulé, des arômes naturels et artificiels pour le chewing-gum et le colorant FDC Yellow #6.
