Glucovance 400/2.50mg, 500/5mg Metformin Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Glucovance 2,50 mg et comment est-il utilisé ?
Glucovance 400 mg est un médicament délivré sur ordonnance utilisé pour traiter les symptômes du diabète sucré de type 2. Glucovance peut être utilisé seul ou avec d'autres médicaments.
Glucovance appartient à une classe de médicaments appelés antidiabétiques, sulfonylurées/biguanides.
On ne sait pas si Glucovance 2,50 mg est sûr et efficace chez les enfants.
Quels sont les effets secondaires possibles de Glucovance 400mg ?
Glucovance peut provoquer des effets secondaires graves, notamment :
- urticaire,
- difficulté à respirer,
- gonflement du visage, des lèvres, de la langue ou de la gorge,
- gonflement,
- prise de poids rapide,
- essoufflement,
- extrême faiblesse,
- Vision floue,
- transpiration,
- difficulté à parler,
- tremblements,
- Douleur d'estomac,
- confusion,
- convulsions,
- douleurs musculaires inhabituelles,
- difficulté à respirer,
- Douleur d'estomac,
- vomissement,
- rythme cardiaque irrégulier,
- vertiges,
- avoir froid,
- faiblesse, et
- fatigue
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Glucovance incluent :
- hypoglycémie,
- nausée,
- diarrhée,
- maux d'estomac, et
- mal de tête
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Glucovance. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
LA DESCRIPTION
Les comprimés GLUCOVANCE® (Glyburide et Metformine HCl) contiennent 2 antihyperglycémiants oraux utilisés dans la prise en charge du diabète de type 2, le glyburide et le chlorhydrate de metformine.
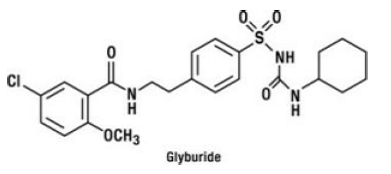
Le glyburide est un antihyperglycémiant oral de la classe des sulfonylurées. Le nom chimique du glyburide est 1-[[p-[2-(5-chloro-o-anisamido)éthyl]phényl]sulfonyl]-3-cyclo-hexylurée. Le glyburide est un composé cristallin blanc à blanc cassé avec une formule moléculaire de C23H28ClN3O5S et un poids moléculaire de 494,01. Le glyburide utilisé dans GLUCOVANCE 5 mg a une distribution granulométrique de 25 % de sous-dimensionnement ne dépassant pas 6 μm, 50 % de sous-dimensionnement ne dépassant pas 7 à 10 μm et 75 % de sous-dimensionnement ne dépassant pas 21 μm. La formule structurale est représentée ci-dessous.
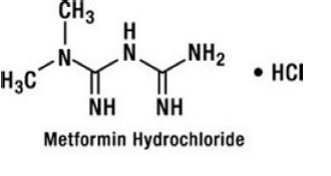
Le chlorhydrate de metformine est un antihyperglycémiant oral utilisé dans la prise en charge du diabète de type 2. Le chlorhydrate de metformine (monochlorhydrate de diamide de N,N-diméthylimidodicarbonimidique) n'est pas lié chimiquement ou pharmacologiquement aux sulfonylurées, aux thiazolidinediones ou aux inhibiteurs de l'α-glucosidase. C'est un composé cristallin blanc à blanc cassé avec une formule moléculaire de C4H12ClN5 (monochlorhydrate) et un poids moléculaire de 165,63. Le chlorhydrate de metformine est facilement soluble dans l'eau et pratiquement insoluble dans l'acétone, l'éther et le chloroforme. Le pKa de la metformine est de 12,4. Le pH d'une solution aqueuse à 1 % de chlorhydrate de metformine est de 6,68. La formule structurelle est comme indiqué:
GLUCOVANCE 500 mg est disponible pour administration orale en comprimés contenant 1,25 mg de glyburide avec 250 mg de chlorhydrate de metformine, 2,5 mg de glyburide avec 500 mg de chlorhydrate de metformine et 5 mg de glyburide avec 500 mg de chlorhydrate de metformine. De plus, chaque comprimé contient les ingrédients inactifs suivants : cellulose microcristalline, povidone, croscarmellose sodique et stéarate de magnésium. Les comprimés sont pelliculés, ce qui permet une différenciation des couleurs.
LES INDICATIONS
Les comprimés GLUCOVANCE (Glyburide et Metformine HCl) sont indiqués comme complément au régime alimentaire et à l'exercice physique pour améliorer le contrôle glycémique chez les adultes atteints de diabète sucré de type 2.
DOSAGE ET ADMINISTRATION
considérations générales
La posologie de GLUCOVANCE doit être individualisée en fonction de l'efficacité et de la tolérance sans dépasser la dose quotidienne maximale recommandée de 20 mg de glyburide/2000 mg de metformine. GLUCOVANCE doit être administré avec les repas et doit être initié à faible dose, avec une augmentation progressive de la dose comme décrit ci-dessous, afin d'éviter l'hypoglycémie (en grande partie due au glyburide), de réduire les effets indésirables gastro-intestinaux (en grande partie dus à la metformine) et de permettre la détermination de la dose minimale efficace pour un contrôle adéquat de la glycémie chez chaque patient.
Lors du traitement initial et lors de la titration de la dose, une surveillance appropriée de la glycémie doit être utilisée pour déterminer la réponse thérapeutique à GLUCOVANCE 2,50 mg et pour identifier la dose minimale efficace pour le patient. Par la suite, l'HbA1c doit être mesurée à des intervalles d'environ 3 mois pour évaluer l'efficacité du traitement. L'objectif thérapeutique chez tous les patients atteints de diabète de type 2 est de réduire le FPG, le PPG et l'HbA1c à la normale ou aussi proche que possible de la normale. Idéalement, la réponse au traitement devrait être évaluée à l'aide de l'HbA (hémoglobine glycosylée), qui est un meilleur indicateur du contrôle glycémique à long terme que la glycémie seule.
Aucune étude n'a été réalisée examinant spécifiquement la sécurité et l'efficacité du passage au traitement par GLUCOVANCE 400 mg chez les patients prenant simultanément du glyburide (ou une autre sulfonylurée) et de la metformine. Des modifications de l'équilibre glycémique peuvent survenir chez ces patients, avec possibilité d'hyperglycémie ou d'hypoglycémie. Toute modification du traitement du diabète de type 2 doit être entreprise avec prudence et surveillance appropriée.
GLUCOVANCE chez les patients dont le contrôle glycémique est insuffisant en raison d'un régime alimentaire et d'exercices physiques
Dose initiale recommandée : 1,25 mg/250 mg une ou deux fois par jour avec les repas.
Chez les patients diabétiques de type 2 dont l'hyperglycémie ne peut être prise en charge de manière satisfaisante par un régime alimentaire et de l'exercice seuls, la dose initiale recommandée de GLUCOVANCE 400 mg est de 1,25 mg/250 mg une fois par jour avec un repas. En traitement initial chez les patients ayant une HbA1c initiale > 9 % ou une FPG > 200 mg/dL, une dose initiale de GLUCOVANCE 1,25 mg/250 mg deux fois par jour avec les repas du matin et du soir peut être utilisée. Les augmentations posologiques doivent être effectuées par paliers de 1,25 mg/250 mg par jour toutes les 2 semaines jusqu'à la dose minimale efficace nécessaire pour obtenir un contrôle adéquat de la glycémie. Dans les essais cliniques de GLUCOVANCE en traitement initial, il n'y a pas eu d'expérience avec des doses quotidiennes totales > 10 mg/2000 mg par jour. GLUCOVANCE 5 mg/500 mg ne doit pas être utilisé en traitement initial en raison d'un risque accru d'hypoglycémie.
Utilisation de GLUCOVANCE 500 mg chez les patients dont le contrôle glycémique est insuffisant sous sulfonylurée et/ou metformine
Dose initiale recommandée : 2,5 mg/500 mg ou 5 mg/500 mg deux fois par jour avec les repas.
Chez les patients insuffisamment contrôlés soit par le glyburide (ou un autre sulfamide hypoglycémiant) soit par la metformine seule, la dose initiale recommandée de GLUCOVANCE est de 2,5 mg/500 mg ou 5 mg/500 mg deux fois par jour avec les repas du matin et du soir. Afin d'éviter les hypoglycémies, la dose initiale de GLUCOVANCE 2,50 mg ne doit pas dépasser les doses quotidiennes de glyburide ou de metformine déjà prises. La dose quotidienne doit être augmentée par paliers ne dépassant pas 5 mg/500 mg jusqu'à la dose minimale efficace pour obtenir un contrôle adéquat de la glycémie ou jusqu'à une dose maximale de 20 mg/2 000 mg par jour.
Pour les patients précédemment traités par une association de glyburide (ou d'une autre sulfonylurée) plus metformine, en cas de passage à GLUCOVANCE, la dose initiale ne doit pas dépasser la dose quotidienne de glyburide (ou dose équivalente d'une autre sulfonylurée) et de metformine déjà prise. Les patients doivent être étroitement surveillés afin de détecter tout signe ou symptôme d'hypoglycémie suite à un tel changement et la dose de GLUCOVANCE doit être ajustée comme décrit ci-dessus pour obtenir un contrôle adéquat de la glycémie.
Ajout de thiazolidinediones à la thérapie GLUCOVANCE
Pour les patients insuffisamment contrôlés par GLUCOVANCE, une thiazolidinedione peut être ajoutée au traitement par GLUCOVANCE 400 mg. Lorsqu'une thiazolidinedione est ajoutée au traitement par GLUCOVANCE, la dose actuelle de GLUCOVANCE 500 mg peut être poursuivie et la thiazolidinedione initiée à sa dose initiale recommandée. Pour les patients nécessitant un contrôle glycémique supplémentaire, la dose de thiazolidinedione peut être augmentée en fonction du schéma de titration recommandé. L'amélioration du contrôle glycémique que l'on peut obtenir avec GLUCOVANCE plus une thiazolidinedione peut augmenter le risque d'hypoglycémie à tout moment de la journée. Chez les patients qui développent une hypoglycémie lors de l'administration de GLUCOVANCE 5 mg et d'une thiazolidinedione, il convient d'envisager de réduire la dose du composant glyburide de GLUCOVANCE. Si cliniquement justifié, un ajustement des posologies des autres composants du traitement antidiabétique doit également être envisagé.
Patients recevant du colesevelam
Lorsque le colesevelam est co-administré avec le glyburide, la concentration plasmatique maximale et l'exposition totale au glyburide sont réduites. Par conséquent, GLUCOVANCE doit être administré au moins 4 heures avant le colesevelam.
Populations de patients spécifiques
GLUCOVANCE est déconseillé pendant la grossesse. La posologie initiale et d'entretien de GLUCOVANCE doit être prudente chez les patients âgés, en raison du risque de diminution de la fonction rénale dans cette population. Tout ajustement posologique nécessite une évaluation soigneuse de la fonction rénale. Généralement, les patients âgés, affaiblis et dénutris ne doivent pas être titrés à la dose maximale de GLUCOVANCE pour éviter le risque d'hypoglycémie. La surveillance de la fonction rénale est nécessaire pour aider à la prévention de l'acidose lactique associée à la metformine, en particulier chez les personnes âgées. (Voir AVERTISSEMENTS .)
COMMENT FOURNIE
Comprimés GLUCOVANCE® (Glyburide et Metformine HCl)
GLUCOVANCE 1,25 mg/250 mg comprimé est un comprimé pelliculé jaune pâle, en forme de capsule, aux bords biseautés, biconvexe, portant l'inscription " BMS " en creux sur un côté et " 6072 ” en creux sur le côté opposé.
GLUCOVANCE 2,5 mg/500 mg comprimé est un comprimé pelliculé orange pâle, en forme de capsule, à bords biseautés, biconvexe portant l'inscription " BMS " en creux sur un côté et " 6073 ” en creux sur le côté opposé.
GLUCOVANCE 5 mg/500 mg comprimé est un comprimé pelliculé jaune, en forme de gélule, à bords biseautés, biconvexe portant l'inscription " BMS " en creux sur un côté et " 6074 ” en creux sur le côté opposé.
Stockage
Conserver à des températures allant jusqu'à 25°C (77°F). [Voir Température ambiante contrôlée USP .]
Répartir dans des récipients résistants à la lumière.
Distribué par : Bristol-Myers Squibb Company, Princeton, NJ 08543 USA 1158884A7. Rév. octobre 2013
EFFETS SECONDAIRES
GLUCOVANCE
Dans les essais cliniques en double aveugle impliquant GLUCOVANCE 2,50 mg en traitement initial ou en traitement de deuxième intention, un total de 642 patients ont reçu GLUCOVANCE 2,50 mg, 312 ont reçu un traitement par metformine, 324 ont reçu un traitement par glyburide et 161 ont reçu un placebo. Le pourcentage de patients ayant signalé des événements et les types d'événements indésirables signalés dans les essais cliniques de GLUCOVANCE (tous dosages) en traitement initial et en traitement de deuxième intention sont indiqués dans le tableau 6.
Dans un essai clinique contrôlé rosiglitazone versus placebo chez des patients traités par GLUCOVANCE (n=365), 181 patients ont reçu GLUCOVANCE 5mg avec rosiglitazone et 184 ont reçu GLUCOVANCE avec placebo.
Un œdème a été rapporté chez 7,7 % (14/181) des patients traités par la rosiglitazone contre 2,2 % (4/184) des patients traités par placebo. Une prise de poids moyenne de 3 kg a été observée chez les patients traités par la rosiglitazone.
Des réactions de type disulfirame ont été très rarement rapportées chez des patients traités par des comprimés de glyburide.
Hypoglycémie
Dans les essais cliniques contrôlés de GLUCOVANCE 5 mg, il n'y a eu aucun épisode hypoglycémique nécessitant une intervention médicale et/ou un traitement pharmacologique ; tous les événements ont été gérés par les patients. L'incidence des symptômes d'hypoglycémie rapportés (tels que étourdissements, tremblements, transpiration et faim) dans l'essai thérapeutique initial de GLUCOVANCE 2,50 mg est résumée dans le tableau 7. La fréquence des symptômes d'hypoglycémie chez les patients traités par GLUCOVANCE 1,25 mg/250 mg était plus élevée chez les patients avec une HbA1c initiale 8 %. Pour les patients ayant une HbA1c initiale comprise entre 8 % et 11 % traités par GLUCOVANCE 2,5 mg/500 mg en traitement initial, la fréquence des symptômes hypoglycémiques était de 30 % à 35 %. En traitement de deuxième ligne chez les patients insuffisamment contrôlés par sulfamide hypoglycémiant seul, environ 6,8% de l'ensemble des patients traités par GLUCOVANCE 2,50mg ont présenté des symptômes hypoglycémiques. Lorsque la rosiglitazone a été ajoutée au traitement par GLUCOVANCE 2,50 mg, 22 % des patients ont rapporté 1 ou plusieurs mesures de glucose au bout du doigt ≤ 50 mg/dL, contre 3,3 % des patients sous placebo. Tous les événements hypoglycémiques ont été gérés par les patients et seulement 1 patient a arrêté pour hypoglycémie. (Voir PRÉCAUTIONS : Général : Ajout de thiazolidinediones à la thérapie GLUCOVANCE .)
Réactions gastro-intestinales
L'incidence des effets indésirables gastro-intestinaux (GI) (diarrhée, nausées/vomissements et douleurs abdominales) dans l'essai thérapeutique initial est résumée dans le tableau 7. plus fréquentes à des doses plus élevées.
Dans les essais contrôlés,
Dans les rapports post-commercialisation, un ictère cholestatique et une hépatite peuvent survenir rarement et évoluer vers une insuffisance hépatique ; GLUCOVANCE 5 mg doit être arrêté si cela se produit.
INTERACTIONS MÉDICAMENTEUSES
GLUCOVANCE
Certains médicaments ont tendance à produire une hyperglycémie et peuvent entraîner une perte de contrôle de la glycémie. Ces médicaments comprennent les thiazides et autres diurétiques, les corticostéroïdes, les phénothiazines, les produits thyroïdiens, les œstrogènes, les contraceptifs oraux, la phénytoïne, l'acide nicotinique, les sympathomimétiques, les inhibiteurs calciques et l'isoniazide. Lorsque de tels médicaments sont administrés à un patient recevant GLUCOVANCE 400 mg, le patient doit être étroitement surveillé afin de détecter toute perte de contrôle glycémique. Lorsque de tels médicaments sont retirés à un patient recevant GLUCOVANCE, le patient doit être étroitement surveillé pour détecter toute hypoglycémie. La metformine est liée de manière négligeable aux protéines plasmatiques et est donc moins susceptible d'interagir avec des médicaments fortement liés aux protéines tels que les salicylates, les sulfamides, le chloramphénicol et le probénécide par rapport aux sulfonylurées, qui sont fortement liées aux protéines sériques.
Glyburide
L'action hypoglycémiante des sulfonylurées peut être potentialisée par certains médicaments, notamment les anti-inflammatoires non stéroïdiens et d'autres médicaments fortement liés aux protéines, les salicylates, les sulfamides, le chloramphénicol, le probénécide, les coumarines, les inhibiteurs de la monoamine oxydase et les agents bloquants bêta-adrénergiques. Lorsque de tels médicaments sont administrés à un patient recevant GLUCOVANCE, le patient doit être étroitement surveillé pour détecter toute hypoglycémie. Lorsque de tels médicaments sont retirés à un patient recevant GLUCOVANCE 2,50 mg, le patient doit être étroitement surveillé pour détecter toute perte de contrôle glycémique.
Un risque accru d'élévation des enzymes hépatiques a été observé chez les patients recevant du glyburide en même temps que du bosentan. Par conséquent, l'administration concomitante de GLUCOVANCE et de bosentan est contre-indiquée.
Une interaction possible entre le glyburide et la ciprofloxacine, un antibiotique fluoroquinolone, a été rapportée, entraînant une potentialisation de l'action hypoglycémiante du glyburide. Le mécanisme de cette interaction n'est pas connu.
Une interaction potentielle entre le miconazole oral et les hypoglycémiants oraux entraînant une hypoglycémie sévère a été rapportée. On ne sait pas si cette interaction se produit également avec les préparations intraveineuses, topiques ou vaginales de miconazole.
Colesevelam : L'administration concomitante de colesevelam et de glyburide a entraîné des réductions de l'ASC et de la Cmax du glyburide de 32 % et 47 %, respectivement. Les réductions de l'ASC et de la Cmax du glyburide étaient de 20 % et 15 %, respectivement, lorsqu'il était administré 1 heure avant, et n'étaient pas significativement modifiées (-7 % et 4 %, respectivement) lorsqu'il était administré 4 heures avant le colesevelam.
Chlorhydrate de metformine
Furosémide
Une étude d'interaction médicamenteuse à dose unique metformine-furosémide chez des sujets sains a démontré que les paramètres pharmacocinétiques des deux composés étaient affectés par la co-administration. Le furosémide a augmenté la Cmax plasmatique et sanguine de la metformine de 22 % et l'ASC sanguine de 15 %, sans modification significative de la clairance rénale de la metformine. Lorsqu'il est administré avec de la metformine, la Cmax et l'ASC du furosémide sont respectivement inférieures de 31 % et 12 % à celles administrées seules, et la demi-vie terminale est diminuée de 32 %, sans aucune modification significative de la clairance rénale du furosémide. Aucune information n'est disponible sur l'interaction de la metformine et du furosémide lorsqu'ils sont co-administrés de manière chronique.
Nifédipine
Une étude d'interaction médicamenteuse à dose unique metformine-nifédipine chez des volontaires sains normaux a démontré que la co-administration de nifédipine augmentait la Cmax plasmatique de la metformine et l'ASC de 20 % et 9 %, respectivement, et augmentait la quantité excrétée dans l'urine. Le Tmax et la demi-vie n'ont pas été modifiés. La nifédipine semble améliorer l'absorption de la metformine. La metformine a eu des effets minimes sur la nifédipine.
Médicaments cationiques
Les médicaments cationiques (p. ex., amiloride, digoxine, morphine, procaïnamide, quinidine, quinine, ranitidine, triamtérène, triméthoprime ou vancomycine) qui sont éliminés par sécrétion tubulaire rénale ont théoriquement le potentiel d'interagir avec la metformine en entrant en compétition pour les systèmes de transport tubulaire rénal courants. Une telle interaction entre la metformine et la cimétidine orale a été observée chez des volontaires sains normaux dans le cadre d'études d'interactions médicamenteuses metformine-cimétidine à dose unique et à doses multiples, avec une augmentation de 60 % des concentrations plasmatiques et sanguines maximales de metformine et une augmentation de 40 % des concentrations plasmatiques. et ASC de la metformine dans le sang total. Il n'y a eu aucun changement dans la demi-vie d'élimination dans l'étude à dose unique. La metformine n'a eu aucun effet sur la pharmacocinétique de la cimétidine. Bien que de telles interactions restent théoriques (sauf pour la cimétidine), une surveillance attentive du patient et un ajustement posologique de GLUCOVANCE et/ou du médicament interférant sont recommandés chez les patients prenant des médicaments cationiques excrétés via le système sécrétoire tubulaire rénal proximal.
Autre
Chez des volontaires sains, la pharmacocinétique de la metformine et du propranolol et de la metformine et de l'ibuprofène n'a pas été affectée lors de la co-administration dans des études d'interaction à dose unique.
AVERTISSEMENTS
Chlorhydrate de metformine
Acidose lactique
L'acidose lactique est une complication métabolique rare mais grave qui peut survenir en raison de l'accumulation de metformine pendant le traitement par les comprimés GLUCOVANCE (Glyburide et Metformine HCl) ; lorsqu'elle survient, elle est mortelle dans environ 50 % des cas. L'acidose lactique peut également survenir en association avec un certain nombre d'affections physiopathologiques, y compris le diabète sucré, et chaque fois qu'il existe une hypoperfusion et une hypoxémie tissulaires importantes. L'acidose lactique se caractérise par des taux sanguins élevés de lactate (> 5 mmol/L), une diminution du pH sanguin, des perturbations électrolytiques avec un trou anionique accru et une augmentation du rapport lactate/pyruvate. Lorsque la metformine est incriminée comme cause d'acidose lactique, des taux plasmatiques de metformine > 5 μg/mL sont généralement retrouvés.
L'incidence rapportée d'acidose lactique chez les patients recevant du chlorhydrate de metformine est très faible (environ 0,03 cas/1000 patients-années, avec environ 0,015 cas mortels/1000 patients-années). Dans plus de 20 000 patients-années d'exposition à la metformine dans les essais cliniques, aucun cas d'acidose lactique n'a été signalé. Les cas signalés sont survenus principalement chez des patients diabétiques présentant une insuffisance rénale importante, y compris à la fois une maladie rénale intrinsèque et une hypoperfusion rénale, souvent dans le cadre de multiples problèmes médicaux/chirurgicaux concomitants et de multiples médicaments concomitants. Les patients atteints d'insuffisance cardiaque congestive nécessitant une prise en charge pharmacologique, en particulier ceux atteints d'insuffisance cardiaque congestive instable ou aiguë qui présentent un risque d'hypoperfusion et d'hypoxémie, présentent un risque accru d'acidose lactique. Le risque d'acidose lactique augmente avec le degré de dysfonctionnement rénal et l'âge du patient. Le risque d'acidose lactique peut donc être significativement diminué par une surveillance régulière de la fonction rénale chez les patients prenant de la metformine et par l'utilisation de la dose minimale efficace de metformine. En particulier, le traitement des personnes âgées doit être accompagné d'une surveillance attentive de la fonction rénale. Le traitement par GLUCOVANCE 2,50 mg ne doit pas être instauré chez les patients âgés de ≥ 80 ans sauf si la mesure de la clairance de la créatinine démontre que la fonction rénale n'est pas altérée, car ces patients sont plus susceptibles de développer une acidose lactique. De plus, GLUCOVANCE doit être rapidement interrompu en présence de toute affection associée à une hypoxémie, une déshydratation ou une septicémie. Étant donné qu'une fonction hépatique altérée peut limiter de manière significative la capacité d'éliminer le lactate, GLUCOVANCE doit généralement être évité chez les patients présentant des signes cliniques ou biologiques de maladie hépatique. Les patients doivent être mis en garde contre une consommation excessive d'alcool, aiguë ou chronique, lors de la prise de GLUCOVANCE 2,50 mg, car l'alcool potentialise les effets du chlorhydrate de metformine sur le métabolisme du lactate. De plus, GLUCOVANCE 5mg doit être temporairement arrêté avant tout examen de radiocontraste intravasculaire et pour tout acte chirurgical (voir aussi PRECAUTIONS).
Le début de l'acidose lactique est souvent subtil et accompagné uniquement de symptômes non spécifiques tels que malaise, myalgies, détresse respiratoire, somnolence croissante et détresse abdominale non spécifique. Il peut y avoir une hypothermie, une hypotension et des bradyarythmies résistantes associées avec une acidose plus marquée. Le patient et son médecin doivent être conscients de l'importance possible de tels symptômes et le patient doit être informé d'informer immédiatement le médecin s'ils surviennent (voir également PRÉCAUTIONS). GLUCOVANCE 500 mg doit être arrêté jusqu'à ce que la situation soit clarifiée. Les électrolytes sériques, les cétones, la glycémie et, si indiqué, le pH sanguin, les taux de lactate et même les taux sanguins de metformine peuvent être utiles. Une fois qu'un patient est stabilisé à n'importe quel niveau de dose de GLUCOVANCE, les symptômes gastro-intestinaux, qui sont fréquents lors de l'initiation du traitement par la metformine, sont peu susceptibles d'être liés au médicament. L'apparition ultérieure de symptômes gastro-intestinaux pourrait être due à une acidose lactique ou à une autre maladie grave.
Des taux de lactate plasmatique veineux à jeun supérieurs à la limite supérieure de la normale mais inférieurs à 5 mmol/L chez les patients prenant GLUCOVANCE n'indiquent pas nécessairement une acidose lactique imminente et peuvent s'expliquer par d'autres mécanismes, tels qu'un diabète ou une obésité mal contrôlés, une activité physique vigoureuse, ou des problèmes techniques dans la manipulation des échantillons. (Voir aussi PRÉCAUTIONS.)
L'acidose lactique doit être suspectée chez tout patient diabétique présentant une acidose métabolique sans signe d'acidocétose (cétonurie et cétonémie).
L'acidose lactique est une urgence médicale qui doit être traitée en milieu hospitalier. Chez un patient atteint d'acidose lactique qui prend GLUCOVANCE 500 mg, le médicament doit être arrêté immédiatement et des mesures générales de soutien doivent être instituées rapidement. Étant donné que le chlorhydrate de metformine est dialysable (avec une clairance allant jusqu'à 170 ml/min dans de bonnes conditions hémodynamiques), une hémodialyse rapide est recommandée pour corriger l'acidose et éliminer la metformine accumulée. Une telle prise en charge entraîne souvent une inversion rapide des symptômes et une récupération. (Voir aussi CONTRE-INDICATIONS et PRÉCAUTIONS.)
MISE EN GARDE SPÉCIALE SUR LE RISQUE ACCRU DE MORTALITÉ CARDIOVASCULAIRE
Il a été rapporté que l'administration d'hypoglycémiants oraux était associée à une augmentation de la mortalité cardiovasculaire par rapport au traitement par régime seul ou régime plus insuline. Cet avertissement est basé sur l'étude menée par l'University Group Diabetes Program (UGDP), un essai clinique prospectif à long terme conçu pour évaluer l'efficacité des médicaments hypoglycémiants pour prévenir ou retarder les complications vasculaires chez les patients atteints de diabète non insulino-dépendant. L'étude a impliqué 823 patients qui ont été assignés au hasard à 1 des 4 groupes de traitement (Diabetes 19 (Suppl. 2):747-830, 1970).
L'UGDP a rapporté que les patients traités pendant 5 à 8 ans avec un régime plus une dose fixe de tolbutamide (1,5 g par jour) avaient un taux de mortalité cardiovasculaire d'environ 2,5 fois celui des patients traités avec un régime seul. Une augmentation significative de la mortalité totale n'a pas été observée, mais l'utilisation du tolbutamide a été interrompue en raison de l'augmentation de la mortalité cardiovasculaire, limitant ainsi la possibilité pour l'étude de montrer une augmentation de la mortalité globale. Malgré la controverse concernant l'interprétation de ces résultats, les conclusions de l'étude de l'UGDP fournissent une base adéquate à cet avertissement. Le patient doit être informé des risques et bénéfices potentiels du glyburide et des autres modes de traitement.
Bien qu'un seul médicament de la classe des sulfonylurées (tolbutamide) ait été inclus dans cette étude, il est prudent, du point de vue de la sécurité, de considérer que cette mise en garde peut également s'appliquer à d'autres médicaments hypoglycémiants de cette classe, compte tenu de leurs étroites similitudes de mode d'action. et la structure chimique.
PRÉCAUTIONS
Général
Résultats macrovasculaires
Il n'y a pas eu d'études cliniques établissant des preuves concluantes d'une réduction du risque macrovasculaire avec GLUCOVANCE 5 mg ou tout autre médicament antidiabétique.
GLUCOVANCE
Hypoglycémie
GLUCOVANCE 400 mg est capable de produire une hypoglycémie ou des symptômes hypoglycémiques. Par conséquent, une sélection, une posologie et des instructions appropriées du patient sont importantes pour éviter les épisodes hypoglycémiques potentiels. Le risque d'hypoglycémie est augmenté lorsque l'apport calorique est insuffisant, lorsqu'un exercice intense n'est pas compensé par une supplémentation calorique ou lors d'une utilisation concomitante avec d'autres hypoglycémiants ou de l'éthanol. L'insuffisance rénale ou hépatique peut entraîner des taux élevés de glyburide et de chlorhydrate de metformine, et l'insuffisance hépatique peut également diminuer la capacité gluconéogénique, ce qui augmente le risque de réactions hypoglycémiques. Les patients âgés, affaiblis ou souffrant de malnutrition et ceux souffrant d'insuffisance surrénalienne ou hypophysaire ou d'intoxication alcoolique sont particulièrement sensibles aux effets hypoglycémiants. L'hypoglycémie peut être difficile à reconnaître chez les personnes âgées et les personnes qui prennent des médicaments bêta-bloquants.
Glyburide
L'anémie hémolytique
Le traitement des patients présentant un déficit en glucose-6-phosphate déshydrogénase (G6PD) avec des agents sulfonylurées peut entraîner une anémie hémolytique. GLUCOVANCE 400 mg appartenant à la classe des sulfamides hypoglycémiants, la prudence s'impose chez les patients présentant un déficit en G6PD et une alternative non sulfonylurée doit être envisagée. Dans les rapports post-commercialisation, une anémie hémolytique a également été rapportée chez des patients qui n'avaient pas de déficit connu en G6PD.
Chlorhydrate de metformine
Surveillance de la fonction rénale
La metformine est connue pour être en grande partie excrétée par les reins, et le risque d'accumulation de metformine et d'acidose lactique augmente avec le degré d'altération de la fonction rénale. Ainsi, les patients dont la créatininémie est supérieure à la limite supérieure de la normale pour leur âge ne doivent pas recevoir GLUCOVANCE. Chez les patients d'un âge avancé, GLUCOVANCE 400 mg doit être titré avec précaution afin d'établir la dose minimale pour un effet glycémique adéquat, car le vieillissement est associé à une altération de la fonction rénale. Chez les patients âgés, en particulier ceux âgés de ≥ 80 ans, la fonction rénale doit être surveillée régulièrement et, de manière générale, GLUCOVANCE 2,50 mg ne doit pas être titré jusqu'à la dose maximale (voir AVERTISSEMENTS et DOSAGE ET ADMINISTRATION ). Avant le début du traitement par GLUCOVANCE 2,50 mg et au moins une fois par an par la suite, la fonction rénale doit être évaluée et vérifiée comme étant normale. Chez les patients chez qui l'apparition d'un dysfonctionnement rénal est anticipée, la fonction rénale doit être évaluée plus fréquemment et GLUCOVANCE doit être arrêté en cas de signes d'insuffisance rénale.
Utilisation de médicaments concomitants pouvant affecter la fonction rénale ou l'élimination de la metformine
Médicament(s) concomitant(s) susceptible(s) d'affecter la fonction rénale ou d'entraîner des modifications hémodynamiques importantes ou pouvant interférer avec l'élimination de la metformine, tels que les médicaments cationiques qui sont éliminés par la sécrétion tubulaire rénale (voir INTERACTIONS MÉDICAMENTEUSES ), doit être utilisé avec prudence.
Études radiologiques impliquant l'utilisation de produits de contraste iodés intravasculaires (par exemple, urographie intraveineuse, cholangiographie intraveineuse, angiographie et tomodensitométrie (TDM) avec produits de contraste intravasculaires)
Les études de contraste intravasculaire avec des substances iodées peuvent entraîner une altération aiguë de la fonction rénale et ont été associées à une acidose lactique chez les patients recevant de la metformine (voir CONTRE-INDICATIONS ). Par conséquent, chez les patients chez lesquels une telle étude est prévue, GLUCOVANCE 400 mg doit être temporairement arrêté au moment ou avant la procédure, et suspendu pendant 48 heures après la procédure et réinstauré uniquement après que la fonction rénale a été réévaluée et jugée Ordinaire.
États hypoxiques
Un collapsus cardiovasculaire (choc) quelle qu'en soit la cause, une insuffisance cardiaque congestive aiguë, un infarctus aigu du myocarde et d'autres affections caractérisées par une hypoxémie ont été associés à une acidose lactique et peuvent également provoquer une azotémie prérénale. Lorsque de tels événements surviennent chez des patients sous traitement par GLUCOVANCE 2,50 mg, le médicament doit être rapidement arrêté.
Interventions chirurgicales
Le traitement par GLUCOVANCE 400 mg doit être temporairement suspendu pour toute intervention chirurgicale (à l'exception des interventions mineures non associées à un apport alimentaire et hydrique restreint) et ne doit pas être repris tant que la prise orale du patient n'a pas repris et que la fonction rénale n'a pas été évaluée comme normale.
Consommation d'alcool
L'alcool est connu pour potentialiser l'effet de la metformine sur le métabolisme du lactate. Les patients doivent donc être mis en garde contre une consommation excessive d'alcool, aiguë ou chronique, pendant le traitement par GLUCOVANCE. En raison de son effet sur la capacité gluconéogénique du foie, l'alcool peut également augmenter le risque d'hypoglycémie.
Fonction hépatique altérée
Une altération de la fonction hépatique ayant été associée à certains cas d'acidose lactique, GLUCOVANCE 500 mg doit généralement être évité chez les patients présentant des signes cliniques ou biologiques d'atteinte hépatique.
Niveaux de vitamine B12
Dans des essais cliniques contrôlés avec la metformine d'une durée de 29 semaines, une diminution à des niveaux inférieurs à la normale de la vitamine B12 sérique précédemment normale, sans manifestations cliniques, a été observée chez environ 7 % des patients. Une telle diminution, peut-être due à une interférence avec l'absorption de B12 par le complexe B12-facteur intrinsèque, est cependant très rarement associée à une anémie et semble être rapidement réversible avec l'arrêt de la supplémentation en metformine ou en vitamine B. La mesure des paramètres hématologiques sur une base annuelle est conseillée chez les patients sous metformine et toute anomalie apparente doit faire l'objet d'une investigation et d'une prise en charge appropriées (voir PRÉCAUTIONS : Tests de laboratoire ).
Certains individus (ceux dont l'apport ou l'absorption de vitamine B12 ou de calcium est insuffisant) semblent être prédisposés à développer des taux de vitamine B12 inférieurs à la normale. Chez ces patients, des mesures de routine de la vitamine B12 sérique à des intervalles de 2 à 3 ans peuvent être utiles.
Changement de l'état clinique des patients atteints de diabète de type 2 précédemment contrôlé
Un patient atteint de diabète de type 2 précédemment bien contrôlé par la metformine qui développe des anomalies de laboratoire ou une maladie clinique (en particulier une maladie vague et mal définie) doit être évalué rapidement pour rechercher des signes d'acidocétose ou d'acidose lactique. L'évaluation doit inclure les électrolytes et les cétones sériques, la glycémie et, si indiqué, le pH sanguin, les taux de lactate, de pyruvate et de metformine. En cas d'acidose, quelle qu'en soit la forme, GLUCOVANCE doit être arrêté immédiatement et d'autres mesures correctives appropriées initiées (voir également AVERTISSEMENTS ).
Ajout de thiazolidinediones à la thérapie GLUCOVANCE 500 mg
Hypoglycémie
Les patients recevant GLUCOVANCE 2,50 mg en association avec une thiazolidinedione peuvent présenter un risque d'hypoglycémie.
Gain de poids
Une prise de poids a été observée avec l'ajout de rosiglitazone à GLUCOVANCE 5 mg, similaire à celle rapportée pour le traitement par la thiazolidinedione seule.
Effets hépatiques
Lorsqu'une thiazolidinedione est utilisée en association avec GLUCOVANCE 2,50 mg, une surveillance périodique des tests de la fonction hépatique doit être effectuée conformément aux recommandations de l'étiquette pour la thiazolidinedione.
Informations pour les patients
GLUCOVANCE
Les patients doivent être informés des risques et bénéfices potentiels de GLUCOVANCE 500 mg et des modes de traitement alternatifs. Ils doivent également être informés de l'importance du respect des instructions diététiques ; un programme d'exercice régulier; et des tests réguliers de la glycémie, de l'hémoglobine glycosylée, de la fonction rénale et des paramètres hématologiques.
Les risques d'acidose lactique associés au traitement par la metformine, ses symptômes et les conditions qui prédisposent à son développement, comme indiqué dans les sections MISES EN GARDE et PRÉCAUTIONS, doivent être expliqués aux patients. Les patients doivent être avisés d'arrêter GLUCOVANCE immédiatement et d'informer rapidement leur médecin en cas d'hyperventilation inexpliquée, de myalgie, de malaise, de somnolence inhabituelle ou d'autres symptômes non spécifiques. Une fois qu'un patient est stabilisé à n'importe quelle dose de GLUCOVANCE, il est peu probable que les symptômes gastro-intestinaux, qui sont fréquents lors de l'initiation du traitement par la metformine, soient liés au médicament. L'apparition ultérieure de symptômes gastro-intestinaux pourrait être due à une acidose lactique ou à une autre maladie grave.
Les risques d'hypoglycémie, ses symptômes et son traitement, ainsi que les conditions qui prédisposent à son développement doivent être expliqués aux patients et aux membres responsables de la famille.
Les patients doivent être déconseillés de consommer trop d'alcool, qu'ils soient aigus ou chroniques, pendant le traitement par GLUCOVANCE. (Voir INFORMATIONS PATIENT imprimées dessous.)
Tests de laboratoire
Des mesures périodiques de la glycémie à jeun (FBG) et de l'HbA1c doivent être effectuées pour surveiller la réponse thérapeutique.
Une surveillance initiale et périodique des paramètres hématologiques (p. ex., hémoglobine/hématocrite et indices érythrocytaires) et de la fonction rénale (créatinine sérique) doit être effectuée, au moins une fois par an. Bien que l'anémie mégaloblastique ait rarement été observée avec le traitement par la metformine, si cela est suspecté, une carence en vitamine B12 doit être exclue.
Carcinogenèse, mutagenèse, altération de la fertilité
Aucune étude animale n'a été menée avec les produits combinés de GLUCOVANCE. Les données suivantes sont basées sur les résultats d'études réalisées avec les produits individuels.
Glyburide
Des études chez le rat avec du glyburide seul à des doses allant jusqu'à 300 mg/kg/jour (environ 145 fois la dose quotidienne maximale recommandée pour l'homme [MRHD] de 20 mg pour le composant glyburide de GLUCOVANCE 5 mg sur la base de comparaisons de surface corporelle) pendant 18 mois ont révélé aucun effet cancérigène. Dans une étude d'oncogénicité de 2 ans sur le glyburide chez la souris, il n'y a eu aucun signe de tumeurs liées au traitement.
Il n'y avait aucune preuve de potentiel mutagène du glyburide seul dans les tests in vitro suivants : test sur les microsomes de Salmonella (test d'Ames) et dans le test d'endommagement de l'ADN/élution alcaline.
Chlorhydrate de metformine
Des études de cancérogénicité à long terme ont été réalisées avec la metformine seule chez le rat (durée d'administration de 104 semaines) et la souris (durée d'administration de 91 semaines) à des doses allant jusqu'à 900 mg/kg/jour et 1 500 mg/kg/jour, respectivement. Ces doses sont toutes deux environ 4 fois la dose MRHD de 2000 mg du composant metformine de GLUCOVANCE 400 mg sur la base de comparaisons de surface corporelle. Aucune preuve de cancérogénicité avec la metformine seule n'a été trouvée chez les souris mâles ou femelles. De même, aucun potentiel tumorigène n'a été observé avec la metformine seule chez les rats mâles. Il y avait, cependant, une incidence accrue de polypes utérins stromaux bénins chez les rats femelles traités avec 900 mg/kg/jour de metformine seule.
Il n'y avait aucune preuve d'un potentiel mutagène de la metformine seule dans les tests in vitro suivants : test d'Ames (S. typhimurium), test de mutation génique (cellules de lymphome de souris) ou test d'aberrations chromosomiques (lymphocytes humains). Les résultats du test in vivo du micronoyau chez la souris étaient également négatifs.
La fertilité des rats mâles ou femelles n'a pas été affectée par la metformine seule lorsqu'elle a été administrée à des doses aussi élevées que 600 mg/kg/jour, soit environ 3 fois la dose MRHD du composant metformine de GLUCOVANCE 400 mg sur la base de comparaisons de surface corporelle.
Grossesse
Effets tératogènes
Catégorie de grossesse B
Des informations récentes suggèrent fortement que des taux de glycémie anormaux pendant la grossesse sont associés à une incidence plus élevée d'anomalies congénitales. La plupart des experts recommandent que l'insuline soit utilisée pendant la grossesse pour maintenir la glycémie aussi près que possible de la normale. Les études de reproduction chez l'animal n'étant pas toujours prédictives de la réponse humaine, GLUCOVANCE 400 mg ne doit pas être utilisé pendant la grossesse sauf en cas de nécessité absolue. (Voir ci-dessous.)

Il n'y a pas d'études adéquates et bien contrôlées chez les femmes enceintes avec GLUCOVANCE ou ses composants individuels. Aucune étude animale n'a été menée avec les produits combinés de GLUCOVANCE. Les données suivantes sont basées sur les résultats d'études réalisées avec les produits individuels.
Glyburide
Des études de reproduction ont été réalisées chez des rats et des lapins à des doses allant jusqu'à 500 fois la dose MRHD de 20 mg du composant glyburide de GLUCOVANCE 500 mg sur la base de comparaisons de surface corporelle et n'ont révélé aucun signe d'altération de la fertilité ou de préjudice au fœtus dû au glyburide.
Chlorhydrate de metformine
La metformine seule n'était pas tératogène chez le rat ou le lapin à des doses allant jusqu'à 600 mg/kg/jour. Cela représente une exposition d'environ 2 et 6 fois la dose MRHD de 2000 mg du composant metformine de GLUCOVANCE 500 mg sur la base des comparaisons de surface corporelle pour les rats et les lapins, respectivement. La détermination des concentrations fœtales a démontré une barrière placentaire partielle à la metformine.
Effets non tératogènes
Une hypoglycémie sévère prolongée (4 à 10 jours) a été signalée chez des nouveau-nés nés de mères qui recevaient une sulfonylurée au moment de l'accouchement. Cela a été rapporté plus fréquemment avec l'utilisation d'agents à demi-vie prolongée. Il est déconseillé d'utiliser GLUCOVANCE 400mg pendant la grossesse. Cependant, s'il est utilisé, GLUCOVANCE doit être arrêté au moins 2 semaines avant la date de livraison prévue. (Voir Grossesse : Effets tératogènes : Catégorie de grossesse B .)
Mères allaitantes
Bien que l'on ne sache pas si le glyburide est excrété dans le lait maternel, certains sulfonylurées sont connus pour être excrétés dans le lait maternel. Des études chez des rats allaitants montrent que la metformine est excrétée dans le lait et atteint des niveaux comparables à ceux du plasma. Des études similaires n'ont pas été menées chez les mères allaitantes. Étant donné que le risque d'hypoglycémie chez les nourrissons allaités peut exister, une décision doit être prise soit d'interrompre l'allaitement soit d'arrêter GLUCOVANCE, en tenant compte de l'importance du médicament pour la mère. Si GLUCOVANCE est arrêté, et si le régime alimentaire seul est insuffisant pour contrôler la glycémie, une insulinothérapie doit être envisagée.
Utilisation pédiatrique
La sécurité et l'efficacité de GLUCOVANCE 500 mg ont été évaluées dans un essai randomisé, en double aveugle, contrôlé par comparateur actif, d'une durée de 26 semaines, impliquant un total de 167 patients pédiatriques (âgés de 9 à 16 ans) atteints de diabète de type 2. Il n'a pas été démontré statistiquement que GLUCOVANCE 500 mg soit supérieur à la metformine ou au glyburide en ce qui concerne la réduction de l'HbA1c par rapport à l'inclusion (voir tableau 5). Aucun résultat de sécurité inattendu n'a été associé à GLUCOVANCE 2,50 mg dans cet essai.
Utilisation gériatrique
Sur les 642 patients ayant reçu GLUCOVANCE dans les études cliniques en double aveugle, 23,8 % avaient 65 ans et plus tandis que 2,8 % avaient 75 ans et plus. Sur les 1302 patients ayant reçu GLUCOVANCE 500mg dans les études cliniques en ouvert, 20,7% avaient 65 ans et plus tandis que 2,5% avaient 75 ans et plus. Aucune différence globale d'efficacité ou de sécurité n'a été observée entre ces patients et les patients plus jeunes, et d'autres expériences cliniques rapportées n'ont pas identifié de différences de réponse entre les patients âgés et les patients plus jeunes, mais une plus grande sensibilité de certains individus plus âgés ne peut être exclue.
Le chlorhydrate de metformine est connu pour être en grande partie excrété par les reins et comme le risque de réactions indésirables graves au médicament est plus élevé chez les patients présentant une insuffisance rénale, GLUCOVANCE 500 mg ne doit être utilisé que chez les patients présentant une fonction rénale normale (voir CONTRE-INDICATIONS , AVERTISSEMENTS , et PHARMACOLOGIE CLINIQUE : Pharmacocinétique ). Le vieillissement étant associé à une altération de la fonction rénale, GLUCOVANCE 5 mg doit être utilisé avec prudence au fur et à mesure que l'âge augmente. Des précautions doivent être prises dans le choix de la dose et doivent être basées sur une surveillance attentive et régulière de la fonction rénale. Généralement, les patients âgés ne doivent pas être titrés à la dose maximale de GLUCOVANCE (voir aussi AVERTISSEMENTS et DOSAGE ET ADMINISTRATION ).
SURDOSAGE
Glyburide
Le surdosage de sulfonylurées, y compris les comprimés de glyburide, peut entraîner une hypoglycémie. Les symptômes hypoglycémiques légers, sans perte de conscience ni signes neurologiques, doivent être traités de manière agressive avec du glucose par voie orale et des ajustements de la posologie du médicament et/ou des habitudes alimentaires. Une surveillance étroite doit se poursuivre jusqu'à ce que le médecin soit assuré que le patient est hors de danger. Des réactions hypoglycémiques sévères avec coma, convulsions ou autres troubles neurologiques surviennent rarement, mais constituent des urgences médicales nécessitant une hospitalisation immédiate. Si un coma hypoglycémique est diagnostiqué ou suspecté, le patient doit recevoir une injection intraveineuse rapide d'une solution de glucose concentrée (50%). Cela doit être suivi d'une perfusion continue d'une solution de glucose plus diluée (10 %) à un débit qui maintiendra la glycémie à un niveau supérieur à 100 mg/dL. Les patients doivent être étroitement surveillés pendant au moins 24 à 48 heures, car l'hypoglycémie peut réapparaître après une guérison clinique apparente.
Chlorhydrate de metformine
Un surdosage de chlorhydrate de metformine s'est produit, y compris l'ingestion de quantités > 50 g. Une hypoglycémie a été signalée dans environ 10 % des cas, mais aucune association causale avec le chlorhydrate de metformine n'a été établie. Une acidose lactique a été rapportée dans environ 32 % des cas de surdosage de metformine (voir AVERTISSEMENTS ). La metformine est dialysable avec une clairance allant jusqu'à 170 mL/min dans de bonnes conditions hémodynamiques. Par conséquent, l'hémodialyse peut être utile pour éliminer le médicament accumulé chez les patients chez qui un surdosage en metformine est suspecté.
CONTRE-INDICATIONS
GLUCOVANCE 2,50 mg est contre-indiqué chez les patients présentant :
GLUCOVANCE 500 mg doit être temporairement arrêté chez les patients subissant des études radiologiques impliquant l'administration intravasculaire de produits de contraste iodés, car l'utilisation de tels produits peut entraîner une altération aiguë de la fonction rénale. (Voir également PRÉCAUTIONS .)
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
GLUCOVANCE associe le glyburide et le chlorhydrate de metformine, 2 agents antihyperglycémiants aux mécanismes d'action complémentaires, pour améliorer le contrôle glycémique chez les patients atteints de diabète de type 2.
Le glyburide semble abaisser la glycémie de manière aiguë en stimulant la libération d'insuline par le pancréas, un effet dépendant du fonctionnement des cellules bêta dans les îlots pancréatiques. Le mécanisme par lequel le glyburide abaisse la glycémie lors d'une administration à long terme n'a pas été clairement établi. Avec une administration chronique chez des patients atteints de diabète de type 2, l'effet hypoglycémiant persiste malgré une diminution progressive de la réponse sécrétoire d'insuline au médicament. Des effets extrapancréatiques peuvent être impliqués dans le mécanisme d'action des hypoglycémiants oraux à base de sulfonylurée.
Le chlorhydrate de metformine est un agent antihyperglycémiant qui améliore la tolérance au glucose chez les patients atteints de diabète de type 2, en abaissant la glycémie basale et postprandiale. Le chlorhydrate de metformine diminue la production hépatique de glucose, diminue l'absorption intestinale du glucose et améliore la sensibilité à l'insuline en augmentant l'absorption et l'utilisation périphériques du glucose.
Pharmacocinétique
Absorption et biodisponibilité
GLUCOVANCE
Dans les études de biodisponibilité de GLUCOVANCE 2,5 mg/500 mg et 5 mg/500 mg, l'aire moyenne sous la courbe concentration plasmatique en fonction du temps (ASC) du composant glyburide était respectivement de 18 % et 7 % supérieure à celle de la Micronase® marque de glyburide coadministré avec la metformine. Le composant glyburide de GLUCOVANCE n'est donc pas bioéquivalent à Micronase®. Le composant metformine de GLUCOVANCE 400 mg est bioéquivalent à la metformine co-administrée avec le glyburide.
Après administration d'un seul comprimé de GLUCOVANCE 5 mg/500 mg avec une solution de glucose à 20 % ou une solution de glucose à 20 % avec de la nourriture, il n'y a eu aucun effet de la nourriture sur la Cmax et un effet relativement faible de la nourriture sur l'ASC du glyburide composant. Le Tmax pour le composant glyburide a été raccourci de 7,5 heures à 2,75 heures avec de la nourriture par rapport au même dosage de comprimé administré à jeun avec une solution de glucose à 20 %. La signification clinique d'un Tmax plus précoce pour le glyburide après un repas n'est pas connue. L'effet de la nourriture sur la pharmacocinétique du composant metformine était indéterminé.
Glyburide
Des études à dose unique avec des comprimés Micronase® chez des sujets normaux démontrent une absorption significative du glyburide en 1 heure, des concentrations maximales de médicament à environ 4 heures et des concentrations faibles mais détectables à 24 heures. Les taux sériques moyens de glyburide, tels que reflétés par les aires sous la courbe concentration sérique en fonction du temps, augmentent proportionnellement aux augmentations correspondantes de la dose. La bioéquivalence n'a pas été établie entre GLUCOVANCE 500 mg et les produits à base de glyburide à ingrédient unique.
Chlorhydrate de metformine
La biodisponibilité absolue d'un comprimé de chlorhydrate de metformine à 500 mg administré à jeun est d'environ 50 % à 60 %. Des études utilisant des doses orales uniques de comprimés de metformine de 500 mg et 1500 mg, et de 850 mg à 2550 mg, indiquent qu'il existe un manque de proportionnalité de la dose avec l'augmentation des doses, ce qui est dû à une diminution de l'absorption plutôt qu'à une altération de l'élimination. La nourriture diminue l'ampleur de et retarde légèrement l'absorption de la metformine, comme le montrent une concentration maximale inférieure d'environ 40 % et une ASC plasmatique inférieure de 25 % et une prolongation de 35 minutes du temps jusqu'à la concentration plasmatique maximale après l'administration d'une seule dose de 850 mg. comprimé de metformine avec de la nourriture, par rapport au même dosage administré à jeun. La pertinence clinique de ces diminutions est inconnue.
Distribution
Glyburide
Les sulfonylurées sont fortement liées aux protéines sériques. Le déplacement des sites de liaison aux protéines par d'autres médicaments peut entraîner une action hypoglycémiante accrue. In vitro, la liaison protéique du glyburide est majoritairement non ionique, alors que celle des autres sulfonylurées (chlorpropamide, tolbutamide, tolazamide) est majoritairement ionique. Les médicaments acides, tels que la phénylbutazone, la warfarine et les salicylates, déplacent les sulfonylurées à liaison ionique des protéines sériques dans une bien plus grande mesure que le glyburide à liaison non ionique. Il n'a pas été démontré que cette différence de liaison aux protéines entraîne moins d'interactions médicamenteuses avec les comprimés de glyburide en utilisation clinique.
Chlorhydrate de metformine
Le volume apparent de distribution (V/F) de la metformine après des doses orales uniques de 850 mg était en moyenne de 654 ± 358 L. La metformine est liée de manière négligeable aux protéines plasmatiques. La metformine se répartit dans les érythrocytes, probablement en fonction du temps. Aux doses cliniques et aux schémas posologiques usuels de metformine, les concentrations plasmatiques à l'état d'équilibre de la metformine sont atteintes en 24 à 48 heures et sont généralement
Métabolisme et élimination
Glyburide
La diminution du glyburide dans le sérum des individus sains normaux est biphasique ; la demi-vie terminale est d'environ 10 heures. Le principal métabolite du glyburide est le dérivé 4-trans-hydroxy. Un deuxième métabolite, le dérivé 3-cis-hydroxy, est également présent. Ces métabolites ne contribuent probablement pas à une action hypoglycémiante significative chez l'homme puisqu'ils ne sont que faiblement actifs (respectivement 1/400 et 1/40 aussi actifs que le glyburide) chez le lapin. Le glyburide est excrété sous forme de métabolites dans la bile et l'urine, environ 50 % par chaque voie. Cette double voie d'excrétion est qualitativement différente de celle des autres sulfonylurées, qui sont principalement excrétées dans l'urine.
Chlorhydrate de metformine
Des études à dose unique intraveineuse chez des sujets normaux démontrent que la metformine est excrétée sous forme inchangée dans les urines et ne subit pas de métabolisme hépatique (aucun métabolite n'a été identifié chez l'homme) ni d'excrétion biliaire. La clairance rénale (voir tableau 1) est environ 3,5 fois supérieure à la clairance de la créatinine, ce qui indique que la sécrétion tubulaire est la principale voie d'élimination de la metformine. Après administration orale, environ 90 % du médicament absorbé est éliminé par voie rénale dans les 24 premières heures, avec une demi-vie d'élimination plasmatique d'environ 6,2 heures. Dans le sang, la demi-vie d'élimination est d'environ 17,6 heures, suggérant que la masse érythrocytaire pourrait être un compartiment de distribution.
Populations particulières
Patients atteints de diabète de type 2
Les études à doses multiples avec le glyburide chez les patients atteints de diabète de type 2 montrent des courbes concentration-temps du niveau de médicament similaires aux études à dose unique, indiquant l'absence d'accumulation de médicament dans les dépôts tissulaires.
En présence d'une fonction rénale normale, il n'y a pas de différences entre la pharmacocinétique d'une dose unique ou de doses multiples de metformine entre les patients atteints de diabète de type 2 et les sujets normaux (voir tableau 1), et il n'y a pas non plus d'accumulation de metformine dans l'un ou l'autre des groupes aux heures cliniques habituelles. doses.
Insuffisance hépatique
Aucune étude pharmacocinétique n'a été menée chez des patients insuffisants hépatiques pour le glyburide ou la metformine.
Insuffisance rénale
Aucune information n'est disponible sur la pharmacocinétique du glyburide chez les insuffisants rénaux.
Chez les patients présentant une diminution de la fonction rénale (sur la base de la clairance de la créatinine), la demi-vie plasmatique et sanguine de la metformine est prolongée et la clairance rénale est diminuée proportionnellement à la diminution de la clairance de la créatinine (voir tableau 1 ; également, voir AVERTISSEMENTS ).
Gériatrie
Il n'existe aucune information sur la pharmacocinétique du glyburide chez les patients âgés.
Des données limitées provenant d'études pharmacocinétiques contrôlées de la metformine chez des sujets âgés en bonne santé suggèrent que la clairance plasmatique totale est diminuée, la demi-vie est prolongée et la Cmax est augmentée, par rapport aux sujets jeunes en bonne santé. D'après ces données, il apparaît que la modification de la pharmacocinétique de la metformine avec l'âge s'explique principalement par une modification de la fonction rénale (voir Tableau 1). Le traitement par la metformine ne doit pas être instauré chez les patients âgés de ≥ 80 ans à moins que la mesure de la clairance de la créatinine ne démontre que la fonction rénale n'est pas réduite.
Pédiatrie
Après l'administration d'un seul comprimé oral de GLUCOPHAGE® (chlorhydrate de metformine) à 500 mg avec de la nourriture, la moyenne géométrique de la Cmax et de l'ASC de la metformine différait
Après administration d'un seul comprimé oral de GLUCOVANCE avec de la nourriture, la C et l'ASC moyennes géométriques normalisées en fonction de la dose du glyburide chez les patients pédiatriques atteints de diabète de type 2 (11-16 ans, n = 28, poids corporel moyen de 97 kg) différaient
Le genre
Il n'existe aucune information sur l'effet du sexe sur la pharmacocinétique du glyburide.
Les paramètres pharmacocinétiques de la metformine ne différaient pas significativement chez les sujets avec ou sans diabète de type 2 lorsqu'ils étaient analysés selon le sexe (hommes = 19, femmes = 16). De même, dans des études cliniques contrôlées chez des patients atteints de diabète de type 2, l'effet antihyperglycémiant de la metformine était comparable chez les hommes et les femmes.
Course
Aucune information n'est disponible sur les différences raciales dans la pharmacocinétique du glyburide.
Aucune étude des paramètres pharmacocinétiques de la metformine en fonction de la race n'a été réalisée. Dans des études cliniques contrôlées de la metformine chez des patients atteints de diabète de type 2, l'effet antihyperglycémique était comparable chez les Blancs (n = 249), les Noirs (n = 51) et les Hispaniques (n = 24).
Etudes cliniques
Patients ayant un contrôle glycémique inadéquat sur le régime alimentaire et l'exercice seul
Dans un essai clinique américain multicentrique en double aveugle de 20 semaines, un total de 806 patients diabétiques de type 2 n'ayant jamais pris de médicaments, dont l'hyperglycémie n'était pas suffisamment contrôlée par un régime alimentaire et de l'exercice physique seuls (glycémie à jeun de base [FPG]
Le traitement par GLUCOVANCE a entraîné une réduction significativement plus importante de l'HbA et de la glycémie postprandiale (PPG) par rapport au glyburide, à la metformine ou au placebo. De plus, le traitement par GLUCOVANCE a entraîné une réduction plus importante du taux de FPG par rapport au glyburide, à la metformine ou au placebo, mais les différences entre le glyburide et la metformine n'ont pas atteint une signification statistique.
Les modifications du profil lipidique associées au traitement par GLUCOVANCE 2,50 mg ont été similaires à celles observées avec le glyburide, la metformine et le placebo.
L'essai en double aveugle contrôlé par placebo décrit ci-dessus a limité le recrutement aux patients ayant une HbA1c
Patients dont le contrôle glycémique est insuffisant sous sulfonylurée seule
Dans un essai clinique américain de 16 semaines, en double aveugle et contrôlé par comparateur actif, un total de 639 patients atteints de diabète de type 2 insuffisamment contrôlés (moyenne initiale HbA1c 9,5 %, moyenne initiale FPG 213 mg/dL) tout en étant traités avec au moins la moitié de la dose maximale d'une sulfonylurée (p. ex., glyburide 10 mg, glipizide 20 mg) ont été randomisés pour recevoir du glyburide (dose fixe, 20 mg), de la metformine (500 mg), GLUCOVANCE 2,5 mg/500 mg ou GLUCOVANCE 5 mg /500 mg. Les doses de metformine et de GLUCOVANCE ont été titrées jusqu'à un maximum de 4 comprimés par jour selon les besoins pour atteindre une FPG
Après 16 semaines, il n'y avait pas de changement significatif de l'HbA moyenne chez les patients randomisés pour recevoir du glyburide ou de la metformine. Le traitement par GLUCOVANCE 2,50 mg à des doses allant jusqu'à 20 mg/2 000 mg par jour a entraîné une baisse significative de l'HbA, de la FPG et de la PPG par rapport à l'inclusion par rapport au glyburide ou à la metformine seuls.
Ajout de thiazolidinediones à la thérapie GLUCOVANCE 400 mg
Dans un essai clinique américain multicentrique en double aveugle de 24 semaines, les patients atteints de diabète de type 2 insuffisamment contrôlés par un traitement antihyperglycémiant oral actuel (soit en monothérapie soit en association) ont d'abord été remplacés par des comprimés en ouvert de GLUCOVANCE 2,5 mg/500 mg et titrés à une dose quotidienne maximale de 10 mg/2000 mg. Un total de 365 patients insuffisamment contrôlés (HbA1c > 7,0% et ≤ 10%) après 10 à 12 semaines d'une dose quotidienne de GLUCOVANCE 500mg d'au moins 7,5 mg/1500 mg ont été randomisés pour recevoir un traitement d'appoint par la rosiglitazone 4 mg ou un placebo une fois par jour . Après 8 semaines, la dose de rosiglitazone a été augmentée jusqu'à un maximum de 8 mg par jour selon les besoins pour atteindre une glycémie moyenne cible de 126 mg/dL ou HbA1c
Chez les patients n'ayant pas atteint un contrôle glycémique adéquat avec GLUCOVANCE 400 mg, l'ajout de rosiglitazone, par rapport au placebo, a entraîné une baisse significative de l'HbA et du FPG.
INFORMATIONS PATIENTS
GLUCOVANCE® (glyburide et chlorhydrate de metformine) Comprimés
AVERTISSEMENT : Un petit nombre de personnes ayant pris du chlorhydrate de metformine ont développé une maladie grave appelée acidose lactique. Des reins qui fonctionnent correctement sont nécessaires pour aider à prévenir l'acidose lactique. La plupart des personnes souffrant de problèmes rénaux ne doivent pas prendre GLUCOVANCE. (Voir les questions nos 9 à 13.)
Q1. Pourquoi dois-je prendre GLUCOVANCE 5mg ?
Votre médecin vous a prescrit GLUCOVANCE 500 mg pour traiter votre diabète de type 2. Ceci est également connu sous le nom de diabète sucré non insulino-dépendant.
Q2. Qu'est-ce que le diabète de type 2 ?
Les personnes atteintes de diabète ne sont pas en mesure de produire suffisamment d'insuline et/ou de répondre normalement à l'insuline que leur corps produit. Lorsque cela se produit, le sucre (glucose) s'accumule dans le sang. Cela peut entraîner de graves problèmes médicaux, notamment des lésions rénales, des amputations et la cécité. Le diabète est également étroitement lié aux maladies cardiaques. L'objectif principal du traitement du diabète est d'abaisser votre glycémie à un niveau normal.
Q3. Pourquoi est-il important de contrôler le diabète de type 2 ?
L'objectif principal du traitement du diabète est d'abaisser votre glycémie à un niveau normal. Des études ont montré qu'un bon contrôle de la glycémie peut prévenir ou retarder les complications, telles que les maladies cardiaques, les maladies rénales ou la cécité.
Q4. Comment le diabète de type 2 est-il généralement contrôlé ?
L'hyperglycémie peut être réduite par un régime alimentaire et de l'exercice, un certain nombre de médicaments oraux et des injections d'insuline. Avant de prendre GLUCOVANCE 2,50 mg, vous devez d'abord essayer de contrôler votre diabète par l'exercice et la perte de poids. Même si vous prenez GLUCOVANCE, vous devez toujours faire de l'exercice et suivre le régime recommandé pour votre diabète.
Q5. GLUCOVANCE 400mg agit-il différemment des autres médicaments pour contrôler la glycémie ?
Oui. GLUCOVANCE 400mg associe 2 hypoglycémiants, le glyburide et la metformine. Ces 2 médicaments agissent ensemble pour améliorer les différents défauts métaboliques trouvés dans le diabète de type 2. Le glyburide abaisse la glycémie principalement en provoquant la libération d'une plus grande quantité d'insuline par le corps, et la metformine abaisse la glycémie, en partie, en aidant votre corps à utiliser plus efficacement votre propre insuline. Ensemble, ils sont efficaces pour vous aider à mieux contrôler votre glycémie.
Q6. Que se passe-t-il si ma glycémie est encore trop élevée ?
Lorsque la glycémie ne peut pas être suffisamment abaissée par GLUCOVANCE, votre médecin peut vous prescrire de l'insuline injectable ou prendre d'autres mesures pour contrôler votre diabète.
Q7. GLUCOVANCE 400mg peut-il provoquer des effets indésirables ?
GLUCOVANCE 2,50 mg, comme tous les médicaments hypoglycémiants, peut provoquer des effets indésirables chez certains patients. La plupart de ces effets secondaires sont mineurs. Cependant, il existe également des effets secondaires graves, mais rares, liés à GLUCOVANCE (voir Q9-Q13).
Q8. Quels sont les effets indésirables les plus courants de GLUCOVANCE 500 mg ?
Les effets indésirables les plus fréquents de GLUCOVANCE 5 mg sont généralement mineurs tels que diarrhée, nausées et maux d'estomac. Si ces effets indésirables surviennent, ils surviennent généralement au cours des premières semaines de traitement. Prendre votre GLUCOVANCE avec les repas peut aider à réduire ces effets secondaires.
Moins fréquemment, des symptômes d'hypoglycémie (faible taux de sucre dans le sang), tels que des étourdissements, des étourdissements, des tremblements ou la faim, peuvent survenir. Le risque de symptômes hypoglycémiques augmente lorsque des repas sont sautés, que l'on consomme trop d'alcool ou que l'on fait de l'exercice intense sans suffisamment de nourriture. Suivre les conseils de votre médecin peut vous aider à éviter ces symptômes.
Q9. Y a-t-il des effets indésirables graves que GLUCOVANCE peut provoquer ?
Les personnes atteintes d'une affection connue sous le nom de déficit en glucose-6-phosphate déshydrogénase (G6PD) et qui prennent GLUCOVANCE peuvent développer une anémie hémolytique (dégradation rapide des globules rouges). Le déficit en G6PD est généralement héréditaire. Informez votre médecin si vous ou un membre de votre famille avez reçu un diagnostic de déficit en G6PD avant de commencer à prendre GLUCOVANCE.
GLUCOVANCE provoque rarement des effets indésirables graves. L'effet indésirable le plus grave que GLUCOVANCE 2,50 mg peut provoquer est appelé acidose lactique.
Q10. Qu'est-ce que l'acide lactique et peut-il m'arriver?
L'acidose lactique est causée par une accumulation d'acide lactique dans le sang. L'acidose lactique associée à la metformine est rare et s'est produite principalement chez les personnes dont les reins ne fonctionnaient pas normalement. Une acidose lactique a été signalée chez environ 1 patient sur 33 000 prenant de la metformine au cours d'une année. Bien que rare, si une acidose lactique survient, elle peut être mortelle dans jusqu'à la moitié des cas.
Il est également important que votre foie fonctionne normalement lorsque vous prenez GLUCOVANCE. Votre foie aide à éliminer l'acide lactique de votre circulation sanguine.
Votre médecin surveillera votre diabète et pourra effectuer des tests sanguins sur vous de temps à autre pour s'assurer que vos reins et votre foie fonctionnent normalement.
Il n'y a aucune preuve que GLUCOVANCE cause des dommages aux reins ou au foie.
Q11. Existe-t-il d'autres facteurs de risque d'acidose lactique ?
Votre risque de développer une acidose lactique suite à la prise de GLUCOVANCE 400 mg est très faible tant que vos reins et votre foie sont en bonne santé. Cependant, certains facteurs peuvent augmenter votre risque car ils peuvent affecter la fonction rénale et hépatique. Vous devriez discuter de votre risque avec votre médecin.
Vous ne devez pas prendre GLUCOVANCE 400 mg si :
- Vous avez des problèmes rénaux ou hépatiques chroniques
- Vous avez une insuffisance cardiaque congestive qui est traitée avec des médicaments, par exemple, la digoxine (Lanoxin®) ou le furosémide (Lasix®)
- Vous buvez de l'alcool de façon excessive (tout le temps ou « binge drinking » à court terme)
- Vous êtes gravement déshydraté (vous avez perdu une grande quantité de fluides corporels)
- Vous allez subir certaines radiographies avec des produits de contraste injectables
- Vous allez vous faire opérer
- Vous développez une maladie grave, telle qu'une crise cardiaque, une infection grave ou un accident vasculaire cérébral
- Vous avez ≥ 80 ans et n'avez PAS fait tester votre fonction rénale
Q12. Quels sont les symptômes de l'acidose lactique ?
Certains des symptômes incluent : se sentir très faible, fatigué ou mal à l'aise ; douleur musculaire inhabituelle; difficulté à respirer; malaise gastrique inhabituel ou inattendu; avoir froid; se sentir étourdi ou étourdi; ou développer soudainement un rythme cardiaque lent ou irrégulier.
Si vous remarquez ces symptômes ou si votre état de santé a soudainement changé, arrêtez de prendre les comprimés de GLUCOVANCE et appelez immédiatement votre médecin. L'acidose lactique est une urgence médicale qui doit être traitée à l'hôpital.
Q13. Que doit savoir mon médecin pour diminuer mon risque d'acidose lactique ?
Informez votre médecin si vous souffrez d'une maladie entraînant des vomissements sévères, de la diarrhée et/ou de la fièvre, ou si votre consommation de liquides est considérablement réduite. Ces situations peuvent entraîner une déshydratation sévère, et il peut être nécessaire d'arrêter momentanément la prise de GLUCOVANCE 400 mg.
Vous devez informer votre médecin si vous allez subir une intervention chirurgicale ou des procédures radiographiques spécialisées nécessitant l'injection d'agents de contraste. Le traitement par GLUCOVANCE 2,50 mg devra être arrêté temporairement dans de tels cas.
Q14. Puis-je prendre GLUCOVANCE 500mg avec d'autres médicaments ?
Rappelez à votre médecin que vous prenez GLUCOVANCE 2,50 mg lorsqu'un nouveau médicament vous est prescrit ou qu'un changement est apporté à la façon dont vous prenez un médicament déjà prescrit. GLUCOVANCE 400 mg peut interférer avec le fonctionnement de certains médicaments et certains médicaments peuvent interférer avec l'action de GLUCOVANCE.
Ne prenez pas GLUCOVANCE si vous prenez du bosentan utilisé pour l'hypertension artérielle pulmonaire (HTAP), qui est une pression artérielle élevée dans les vaisseaux des poumons.
Q15. Que faire si je tombe enceinte pendant que je prends GLUCOVANCE 400 mg ?
Informez votre médecin si vous envisagez de tomber enceinte ou si vous êtes tombée enceinte. Comme avec les autres médicaments oraux pour contrôler la glycémie, vous ne devez pas prendre GLUCOVANCE pendant la grossesse.
Habituellement, votre médecin vous prescrira de l'insuline pendant que vous êtes enceinte. Comme pour tous les médicaments, vous et votre médecin devez discuter de l'utilisation de GLUCOVANCE 5 mg si vous allaitez un enfant.
Q16. Comment prendre GLUCOVANCE ?
Votre médecin vous dira combien de comprimés de GLUCOVANCE prendre et à quelle fréquence. Cela devrait également être imprimé sur l'étiquette de votre ordonnance. Vous commencerez probablement par une faible dose de GLUCOVANCE 400 mg et votre posologie sera augmentée progressivement jusqu'à ce que votre glycémie soit contrôlée.
Q17. Où puis-je obtenir plus d'informations sur GLUCOVANCE 400 mg ?
Cette notice est un résumé des informations les plus importantes concernant GLUCOVANCE. Si vous avez des questions ou des problèmes, parlez à votre médecin ou à un autre professionnel de la santé du diabète de type 2 ainsi que de GLUCOVANCE et de ses effets secondaires. Il existe également une notice (notice) destinée aux professionnels de santé que votre pharmacien peut vous faire lire.
