Actos 15mg, 30mg Pioglitazone Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce qu'Actos et comment est-il utilisé ?
Actos 15 mg est un médicament délivré sur ordonnance utilisé pour traiter les symptômes du diabète sucré de type 2. Actos peut être utilisé seul ou avec d'autres médicaments.
Actos est un médicament antidiabétique, les thiazolidinediones.
On ne sait pas si Actos 15 mg est sûr et efficace chez les enfants.
Quels sont les effets secondaires possibles d'Actos 15mg ?
Actos peut provoquer des effets secondaires graves, notamment :
- essoufflement (surtout en position allongée),
- fatigue inhabituelle,
- gonflement,
- prise de poids rapide,
- urine rose ou rouge,
- miction douloureuse ou difficile,
- envie nouvelle ou aggravée d'uriner,
- changements de vision, et
- douleur soudaine et inhabituelle dans la main, le bras ou le pied
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants d'Actos comprennent :
- mal de tête,
- douleurs musculaires et
- symptômes du rhume (nez bouché, douleurs aux sinus, éternuements, mal de gorge)
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Ce ne sont pas tous les effets secondaires possibles d'Actos. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
ATTENTION
INSUFFISANCE CARDIAQUE CONGESTIVE
- Les thiazolidinediones, y compris ACTOS 15 mg, provoquent ou exacerbent une insuffisance cardiaque congestive chez certains patients [voir AVERTISSEMENTS ET PRECAUTIONS ].
- Après le début d'ACTOS 30 mg et après l'augmentation de la dose, surveiller attentivement les patients afin de détecter tout signe ou symptôme d'insuffisance cardiaque (par exemple, prise de poids excessive et rapide, dyspnée et/ou œdème). Si une insuffisance cardiaque se développe, elle doit être prise en charge conformément aux normes de soins en vigueur et l'arrêt ou la réduction de la dose d'ACTOS 15 mg doit être envisagé.
- ACTOS n'est pas recommandé chez les patients présentant une insuffisance cardiaque symptomatique.
- L'initiation d'ACTOS chez les patients atteints d'insuffisance cardiaque de classe III ou IV établie par la New York Heart Association (NYHA) est contre-indiquée [voir CONTRE-INDICATIONS et AVERTISSEMENTS ET PRECAUTIONS ].
LA DESCRIPTION
Les comprimés ACTOS sont une thiazolidinedione et un agoniste du récepteur gamma activé par les proliférateurs de peroxysomes (PPAR) qui contient un médicament antidiabétique oral : la pioglitazone.
Le monochlorhydrate de pioglitazone [(±)-5-[[4-[2-(5-éthyl-2-pyridinyl) éthoxy] phényl] méthyl]-2,4-] thiazolidinedione contient un carbone asymétrique, et le composé est synthétisé et utilisé comme mélange racémique. Les deux énantiomères de la pioglitazone s'interconvertissent in vivo. Aucune différence n'a été trouvée dans l'activité pharmacologique entre les deux énantiomères. La formule structurelle est comme indiqué:
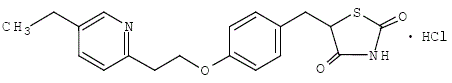
Le chlorhydrate de pioglitazone est une poudre cristalline blanche inodore dont la formule moléculaire est C19H20N2O3S•HCl et un poids moléculaire de 392,90 daltons. Il est soluble dans le N,Ndiméthylformamide, légèrement soluble dans l'éthanol anhydre, très légèrement soluble dans l'acétone et l'acétonitrile, pratiquement insoluble dans l'eau et insoluble dans l'éther.
ACTOS est disponible sous forme de comprimé pour administration orale contenant 15 mg, 30 mg ou 45 mg de pioglitazone (comme base) formulé avec les excipients suivants : lactos 30 mg monohydraté NF, hydroxypropylcellulose NF, carboxyméthylcellulose calcique NF et stéarate de magnésium NF.
LES INDICATIONS
Monothérapie et thérapie combinée
ACTOS 30 mg est indiqué en complément d'un régime alimentaire et d'exercices physiques pour améliorer le contrôle glycémique chez les adultes atteints de diabète sucré de type 2 dans de multiples contextes cliniques [voir Etudes cliniques ].
Limites d'utilisation importantes
ACTOS 15 mg n'exerce son effet antihyperglycémiant qu'en présence d'insuline endogène. ACTOS 30 mg ne doit pas être utilisé pour traiter le diabète de type 1 ou l'acidocétose diabétique, car il ne serait pas efficace dans ces contextes.
Soyez prudent chez les patients atteints d'une maladie du foie [voir AVERTISSEMENTS ET PRECAUTIONS ].
DOSAGE ET ADMINISTRATION
Recommandations pour tous les patients
ACTOS 15 mg doit être pris une fois par jour et peut être pris sans tenir compte des repas.
La dose initiale recommandée pour les patients sans insuffisance cardiaque congestive est de 15 mg ou 30 mg une fois par jour.
La dose initiale recommandée pour les patients atteints d'insuffisance cardiaque congestive (classe NYHA I ou II) est de 15 mg une fois par jour.
La dose peut être titrée par paliers de 15 mg jusqu'à un maximum de 45 mg une fois par jour en fonction de la réponse glycémique déterminée par l'HbA1c.
Après le début d'ACTOS 30 mg ou avec une augmentation de la dose, surveiller attentivement les patients afin de détecter tout effet indésirable lié à la rétention d'eau, comme la prise de poids, l'œdème et les signes et symptômes d'insuffisance cardiaque congestive [voir AVERTISSEMENT DE BOÎTE et AVERTISSEMENTS ET PRECAUTIONS ].
Des tests hépatiques (alanine sérique et aspartate aminotransférases, phosphatase alcaline et bilirubine totale) doivent être obtenus avant d'initier ACTOS. La surveillance périodique de routine des tests hépatiques pendant le traitement par ACTOS 30 mg n'est pas recommandée chez les patients sans maladie hépatique. Les patients qui présentent des anomalies des tests hépatiques avant le début d'ACTOS ou qui présentent des anomalies des tests hépatiques pendant le traitement par ACTOS doivent être pris en charge comme décrit dans la section Mises en garde et précautions [voir AVERTISSEMENTS ET PRECAUTIONS et PHARMACOLOGIE CLINIQUE ].
Utilisation concomitante avec un sécrétagogue de l'insuline ou de l'insuline
Si une hypoglycémie survient chez un patient co-administré par ACTOS 30 mg et un sécrétagogue de l'insuline (par exemple, une sulfonylurée), la dose du sécrétagogue de l'insuline doit être réduite.
En cas d'hypoglycémie chez un patient co-administré par ACTOS 30 mg et insuline, la dose d'insuline doit être diminuée de 10 % à 25 %. Les ajustements ultérieurs de la dose d'insuline doivent être individualisés en fonction de la réponse glycémique.
Utilisation concomitante avec des inhibiteurs puissants du CYP2C8
L'administration concomitante d'ACTOS 30 mg et de gemfibrozil, un puissant inhibiteur du CYP2C8, augmente d'environ 3 fois l'exposition à la pioglitazone. Par conséquent, la dose maximale recommandée d'ACTOS est de 15 mg par jour lorsqu'il est utilisé en association avec le gemfibrozil ou d'autres inhibiteurs puissants du CYP2C8 [voir INTERACTIONS MÉDICAMENTEUSES et PHARMACOLOGIE CLINIQUE ].
COMMENT FOURNIE
Formes posologiques et points forts
Le comprimé rond contient de la pioglitazone comme suit :
- 15 mg : Blanc à blanc cassé, gravé « ACTOS » d'un côté et « 15 » de l'autre
- 30 mg : Blanc à blanc cassé, gravé « ACTOS » d'un côté et « 30 » de l'autre
- 45 mg : Blanc à blanc cassé, gravé « ACTOS » d'un côté et « 45 » de l'autre
Stockage et manutention
ACTO est disponible en comprimés de 15 mg, 30 mg et 45 mg comme suit :
Comprimé de 15 mg : Comprimé blanc à blanc cassé, rond, convexe, non sécable avec « ACTOS » sur une face et « 15 » sur l'autre, disponible en :
CDN 64764-151-04 Flacons de 30 CDN 64764-151-05 Bouteilles de 90 CDN 64764-151-06 Bouteilles de 500
Comprimé de 30 mg Comprimé blanc à blanc cassé, rond, plat, non sécable avec « ACTOS » sur une face et « 30 » sur l'autre, disponible en :
CDN 64764-301-14 Bouteilles de 30 CDN 64764-301-15 Bouteilles de 90 CDN 64764-301-16 Bouteilles de 500
Comprimé de 45 mg : Comprimé blanc à blanc cassé, rond, plat, non sécable avec « ACTOS » sur une face et « 45 » sur l'autre, disponible en :
CDN 64764-451-24 Bouteilles de 30 CDN 64764-451-25 Bouteilles de 90 CDN 64764-451-26 Bouteilles de 500
Stockage
Conserver à 25 °C (77 °F); les excursions permises à 15-30°C (59-86°F) [voient USP la Température de Pièce Contrôlée]. Conserver le récipient bien fermé et à l'abri de la lumière, de l'humidité et de l'humidité.
Distribué par : Takeda Pharmaceuticals America, Inc. Deerfield, IL 60015. Révisé : décembre 2017
EFFETS SECONDAIRES
Les effets indésirables graves suivants sont discutés ailleurs dans l'étiquetage :
- Insuffisance cardiaque congestive [voir AVERTISSEMENT DE BOÎTE et AVERTISSEMENTS ET PRECAUTIONS ]
- Œdème [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Fractures [voir AVERTISSEMENTS ET PRECAUTIONS ]
Expérience des essais cliniques
Étant donné que les essais cliniques sont menés dans des conditions très variables, les taux d'effets indésirables observés dans les essais cliniques d'un médicament ne peuvent pas être directement comparés aux taux des essais cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique.
Plus de 8 500 patients atteints de diabète de type 2 ont été traités avec ACTOS dans le cadre d'essais cliniques randomisés, en double aveugle et contrôlés, dont 2 605 patients atteints de diabète de type 2 et de maladies macrovasculaires traités avec ACTOS 30 mg dans l'essai clinique PROactive. Dans ces essais, plus de 6 000 patients ont été traités avec ACTOS pendant six mois ou plus, plus de 4 500 patients ont été traités avec ACTOS 15 mg pendant un an ou plus et plus de 3 000 patients ont été traités avec ACTOS pendant au moins deux ans.
Dans six essais regroupés de 16 à 26 semaines contre placebo en monothérapie et de 16 à 24 semaines en traitement d'association en association, l'incidence des arrêts prématurés dus à des événements indésirables était de 4,5 % pour les patients traités par ACTOS 30 mg et de 5,8 % pour le comparateur. malades traités. Les événements indésirables les plus fréquents ayant conduit à l'arrêt étaient liés à un contrôle glycémique inadéquat, bien que l'incidence de ces événements ait été plus faible (1,5 %) avec ACTOS 30 mg qu'avec le placebo (3,0 %).
Dans l'essai PROactive, l'incidence des abandons en raison d'événements indésirables était de 9,0 % pour les patients traités par ACTOS 30 mg et de 7,7 % pour les patients traités par placebo. L'insuffisance cardiaque congestive a été l'événement indésirable grave entraînant le sevrage le plus fréquent, survenant chez 1,3 % des patients traités par ACTOS 30 mg et 0,6 % des patients traités par placebo.
Événements indésirables courants : essais de monothérapie de 16 à 26 semaines
Un résumé de l'incidence et du type d'effets indésirables courants signalés dans trois essais groupés de monothérapie contre placebo de 16 à 26 semaines d'ACTOS est fourni dans le tableau 1. Les termes qui sont signalés représentent ceux qui se sont produits à une incidence > 5 % et plus fréquemment. chez les patients traités par ACTOS 15 mg que chez les patients ayant reçu le placebo. Aucun de ces événements indésirables n'était lié à la dose d'ACTOS.
Événements indésirables courants : Essais de thérapie combinée complémentaire de 16 à 24 semaines
Un résumé de l'incidence globale et des types d'effets indésirables courants signalés dans les essais sur l'ajout d'ACTOS à la sulfonylurée est fourni dans le tableau 2. Les termes qui sont signalés représentent ceux qui se sont produits à une incidence > 5 % et plus fréquemment avec le taux le plus élevé testé. dose d'ACTOS.
Un résumé de l'incidence globale et des types d'effets indésirables courants signalés dans les essais portant sur ACTOS 30 mg en association avec la metformine est fourni dans le tableau 3. Les termes rapportés représentent ceux qui se sont produits à une incidence > 5 % et plus fréquemment avec dose testée d'ACTOS.
Le tableau 4 résume l'incidence et les types d'événements indésirables courants signalés dans les essais sur l'association ACTOS à l'insuline. Les termes rapportés représentent ceux qui se sont produits à une incidence > 5 % et plus fréquemment avec la dose testée la plus élevée d'ACTOS.
Un résumé de l'incidence globale et des types d'événements indésirables courants signalés dans l'essai PROactive est fourni dans le tableau 5. Les termes qui sont signalés représentent ceux qui se sont produits à une incidence > 5 % et plus fréquemment chez les patients traités par ACTOS que chez les patients qui reçu un placebo.
Insuffisance cardiaque congestive
Un résumé de l'incidence des événements indésirables liés à l'insuffisance cardiaque congestive est fourni dans le tableau 6 pour les essais d'appoint de 16 à 24 semaines sur la sulfonylurée, pour les essais d'appoint sur 16 à 24 semaines à l'insuline et pour le complément de 16 à 24 semaines aux essais de metformine. Aucun des événements n'a été mortel.
Des patients atteints de diabète de type 2 et d'insuffisance cardiaque congestive de classe II de la NYHA ou de classe III précoce ont été randomisés pour recevoir 24 semaines de traitement en double aveugle avec soit ACTOS 30 mg à des doses quotidiennes de 30 mg à 45 mg (n = 262) soit du glyburide à des doses quotidiennes de 10 mg à 15 mg (n = 256). Un résumé de l'incidence des événements indésirables liés à l'insuffisance cardiaque congestive rapportés dans cette étude est fourni dans le tableau 7.
Les événements d'insuffisance cardiaque congestive entraînant une hospitalisation survenus au cours de l'essai PROactive sont résumés dans le tableau 8.
Sécurité cardiovasculaire
Dans l'essai PROactive, 5238 patients atteints de diabète de type 2 et ayant des antécédents de maladie macrovasculaire ont été randomisés pour recevoir ACTOS (N = 2605), titré jusqu'à 45 mg par jour ou un placebo (N = 2633) en plus du traitement standard. Presque tous les patients (95 %) recevaient des médicaments cardiovasculaires (bêta-bloquants, IEC, antagonistes des récepteurs de l'angiotensine II, inhibiteurs calciques, nitrates, diurétiques, aspirine, statines et fibrates). Au départ, les patients avaient un âge moyen de 62 ans, une durée moyenne de diabète de 9,5 ans et une HbA1c moyenne de 8,1 %. La durée moyenne de suivi était de 34,5 mois. L'objectif principal de cet essai était d'examiner l'effet d'ACTOS sur la mortalité et la morbidité macrovasculaire chez les patients atteints de diabète sucré de type 2 qui présentaient un risque élevé d'événements macrovasculaires. La principale variable d'efficacité était le délai jusqu'à la première occurrence de tout événement dans un critère d'évaluation composite cardiovasculaire qui comprenait la mortalité toutes causes confondues, l'infarctus du myocarde (IM) non mortel, y compris l'IM silencieux, l'accident vasculaire cérébral, le syndrome coronarien aigu, l'intervention cardiaque, y compris le pontage aortocoronarien ou intervention percutanée, amputation majeure de la jambe au-dessus de la cheville et pontage ou revascularisation de la jambe. Au total, 514 (19,7 %) patients traités par ACTOS 15 mg et 572 (21,7 %) patients sous placebo ont présenté au moins un événement à partir du critère composite principal (rapport de risque 0,90 ; intervalle de confiance à 95 % : 0,80, 1,02 ; p = 0,10 ).
Bien qu'il n'y ait pas eu de différence statistiquement significative entre ACTOS et le placebo pour l'incidence à trois ans d'un premier événement dans ce composite, il n'y a eu aucune augmentation de la mortalité ou du nombre total d'événements macrovasculaires avec ACTOS. Le nombre de premières occurrences et le nombre total d'événements individuels contribuant au critère composite principal sont indiqués dans le tableau 9.
Gain de poids
Une prise de poids liée à la dose survient lorsqu'ACTOS 30 mg est utilisé seul ou en association avec d'autres médicaments antidiabétiques. Le mécanisme de la prise de poids n'est pas clair mais implique probablement une combinaison de rétention d'eau et d'accumulation de graisse.
Les tableaux 10 et 11 résument les changements de poids corporel avec ACTOS et le placebo dans les essais de monothérapie randomisée en double aveugle de 16 à 26 semaines et de traitement combiné d'appoint de 16 à 24 semaines et dans l'essai PROactive.
Œdème
L'œdème induit par la prise d'ACTOS est réversible à l'arrêt d'ACTOS. L'œdème ne nécessite généralement pas d'hospitalisation, sauf en cas d'insuffisance cardiaque congestive concomitante. Un résumé de la fréquence et des types d'événements indésirables liés à l'œdème survenus dans les études cliniques d'ACTOS 30 mg est fourni dans le tableau 12.
Effets hépatiques
Il n'y a eu aucune preuve d'hépatotoxicité induite avec ACTOS dans la base de données des essais cliniques contrôlés ACTOS à ce jour. Un essai randomisé en double aveugle d'une durée de 3 ans comparant ACTOS 15 mg au glyburide en complément de la metformine et de l'insulinothérapie a été spécifiquement conçu pour évaluer l'incidence de l'élévation des ALAT sériques à plus de trois fois la limite supérieure de la plage de référence, mesurée toutes les huit semaines pendant les 48 premières semaines de l'essai puis toutes les 12 semaines par la suite. Au total, 3 patients sur 1 051 (0,3 %) traités par ACTOS et 9 patients sur 1 046 (0,9 %) traités par le glyburide ont développé des valeurs d'ALT supérieures à trois fois la limite supérieure de la plage de référence. Aucun des patients traités par ACTOS dans la base de données des essais cliniques contrôlés ACTOS à ce jour n'a eu d'ALT sérique supérieure à trois fois la limite supérieure de la plage de référence et une bilirubine totale correspondante supérieure à deux fois la limite supérieure de la plage de référence, une combinaison prédictive du potentiel de lésions hépatiques graves d'origine médicamenteuse.
Hypoglycémie
Dans les essais cliniques d'ACTOS 15 mg, des événements indésirables d'hypoglycémie ont été rapportés sur la base du jugement clinique des investigateurs et n'ont pas nécessité de confirmation par un test de glycémie au doigt.
Dans l'essai de 16 semaines en association avec la sulfonylurée, l'incidence des hypoglycémies rapportées était de 3,7 % avec ACTOS 30 mg et de 0,5 % avec le placebo. Dans l'essai de 16 semaines en complément de l'insuline, l'incidence des hypoglycémies signalées était de 7,9 % avec ACTOS 15 mg, de 15,4 % avec ACTOS 30 mg et de 4,8 % avec le placebo.
L'incidence des hypoglycémies signalées était plus élevée avec ACTOS à 45 mg qu'avec ACTOS à 30 mg dans l'essai de 24 semaines en association avec la sulfonylurée (15,7 % contre 13,4 %) et dans l'essai de 24 semaines en association à l'insuline (47,8 %). % contre 43,5 %).
Trois patients de ces quatre essais ont été hospitalisés en raison d'une hypoglycémie. Les trois patients recevaient ACTOS 30 mg (0,9 %) au cours de l'essai de 24 semaines en complément de l'insuline. Quatorze autres patients ont signalé une hypoglycémie grave (définie comme causant une interférence considérable avec les activités habituelles du patient) qui n'a pas nécessité d'hospitalisation. Ces patients recevaient ACTOS 45 mg en association avec une sulfonylurée (n = 2) ou ACTOS 30 mg ou 45 mg en association avec de l'insuline (n = 12).
Tumeurs de la vessie urinaire
Des tumeurs ont été observées dans la vessie de rats mâles dans l'étude de cancérogénicité de deux ans [voir Toxicologie non clinique ]. Au cours de l'essai clinique PROactive de trois ans, 14 patients sur 2605 (0,54%) randomisés pour recevoir ACTOS et 5 sur 2633 (0,19%) randomisés pour recevoir un placebo ont reçu un diagnostic de cancer de la vessie. Après exclusion des patients chez qui l'exposition au médicament à l'étude était inférieure à un an au moment du diagnostic de cancer de la vessie, il y a eu 6 cas (0,23 %) sous ACTOS 15 mg et 2 cas (0,08 %) sous placebo. Après la fin de l'essai, un grand sous-ensemble de patients a été observé jusqu'à 10 années supplémentaires, avec peu d'exposition supplémentaire à ACTOS. Au cours des 13 années de suivi PROactif et observationnel, la survenue d'un cancer de la vessie n'a pas différé entre les patients randomisés pour recevoir ACTOS ou le placebo (HR = 1,00 ; IC à 95 % : 0,59-1,72) [voir AVERTISSEMENTS ET PRECAUTIONS ].
Anomalies de laboratoire
Effets hématologiques
ACTOS 15 mg peut entraîner une diminution de l'hémoglobine et de l'hématocrite. Dans les essais de monothérapie contrôlés par placebo, les valeurs moyennes d'hémoglobine ont diminué de 2 % à 4 % chez les patients traités par ACTOS, par rapport à une variation moyenne de l'hémoglobine de -1 % à +1 % chez les patients traités par placebo. Ces changements sont principalement survenus au cours des 4 à 12 premières semaines de traitement et sont restés relativement constants par la suite. Ces modifications peuvent être liées à une augmentation du volume plasmatique associée au traitement par ACTOS 30 mg et ne sont pas susceptibles d'être associées à des effets hématologiques cliniquement significatifs.
Créatine Phosphokinase
Au cours de la mesure spécifiée dans le protocole de la créatine phosphokinase (CPK) sérique dans les essais cliniques d'ACTOS 15 mg, une élévation isolée de la CPK à plus de 10 fois la limite supérieure de la plage de référence a été notée chez neuf (0,2 %) patients traités par ACTOS (valeurs de 2150 à 11400 UI/L) et chez aucun patient traité par un comparateur. Six de ces neuf patients ont continué à recevoir ACTOS 15 mg, deux patients ont présenté une élévation des CPK le dernier jour de l'administration et un patient a arrêté ACTOS en raison de l'élévation. Ces élévations ont disparu sans aucune séquelle clinique apparente. La relation entre ces événements et le traitement par ACTOS 30 mg n'est pas connue.
Expérience post-commercialisation
Les effets indésirables suivants ont été identifiés lors de l'utilisation post-approbation d'ACTOS. Étant donné que ces réactions sont signalées volontairement par une population de taille incertaine, il n'est généralement pas possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale avec l'exposition au médicament.
- Apparition ou aggravation d'un œdème maculaire diabétique avec diminution de l'acuité visuelle [voir AVERTISSEMENTS ET PRECAUTIONS ].
- Insuffisance hépatique mortelle et non mortelle [voir AVERTISSEMENTS ET PRECAUTIONS ].
Des rapports post-commercialisation d'insuffisance cardiaque congestive ont été rapportés chez des patients traités par ACTOS, avec ou sans maladie cardiaque connue antérieurement et avec et sans administration concomitante d'insuline.
Dans l'expérience post-commercialisation, des augmentations de poids inhabituellement rapides et des augmentations supérieures à celles généralement observées dans les essais cliniques ont été rapportées. Les patients qui subissent de telles augmentations doivent être évalués pour une accumulation de liquide et des événements liés au volume tels qu'un œdème excessif et une insuffisance cardiaque congestive [voir AVERTISSEMENT DE BOÎTE et AVERTISSEMENTS ET PRECAUTIONS ].
INTERACTIONS MÉDICAMENTEUSES
Inhibiteurs puissants du CYP2C8
Un inhibiteur du CYP2C8 (par exemple, le gemfibrozil) augmente significativement l'exposition (aire sous la courbe concentration sérique en fonction du temps ou ASC) et la demi-vie (t½) de la pioglitazone. Par conséquent, la dose maximale recommandée d'ACTOS est de 15 mg par jour s'il est utilisé en association avec le gemfibrozil ou d'autres inhibiteurs puissants du CYP2C8 [voir DOSAGE ET ADMINISTRATION et PHARMACOLOGIE CLINIQUE ].
Inducteurs du CYP2C8
Un inducteur du CYP2C8 (par exemple, la rifampicine) peut diminuer de manière significative l'exposition (AUC) de la pioglitazone. Par conséquent, si un inducteur du CYP2C8 est démarré ou arrêté pendant le traitement par ACTOS 30 mg, des modifications du traitement du diabète peuvent être nécessaires en fonction de la réponse clinique sans dépasser la dose quotidienne maximale recommandée de 45 mg pour ACTOS [voir PHARMACOLOGIE CLINIQUE ].
Topiramate
Une diminution de l'exposition à la pioglitazone et à ses métabolites actifs a été notée lors de l'administration concomitante de pioglitazone et de topiramate [voir PHARMACOLOGIE CLINIQUE ]. La pertinence clinique de cette diminution est inconnue ; cependant, lorsqu'ACTOS et le topiramate sont utilisés en concomitance, surveiller les patients pour un contrôle glycémique adéquat.
AVERTISSEMENTS
Inclus dans le cadre du "PRÉCAUTIONS" Section
PRÉCAUTIONS
Insuffisance cardiaque congestive
ACTOS 15 mg, comme les autres thiazolidinediones, peut provoquer une rétention d'eau liée à la dose lorsqu'il est utilisé seul ou en association avec d'autres médicaments antidiabétiques et est plus fréquent lorsqu'ACTOS 30 mg est utilisé en association avec de l'insuline. La rétention d'eau peut entraîner ou aggraver une insuffisance cardiaque congestive. Les patients doivent être surveillés afin de détecter tout signe ou symptôme d'insuffisance cardiaque congestive. Si une insuffisance cardiaque congestive se développe, elle doit être prise en charge conformément aux normes de soins en vigueur et l'arrêt ou la réduction de la dose d'ACTOS doit être envisagé [voir AVERTISSEMENT DE BOÎTE , CONTRE-INDICATIONS , et EFFETS INDÉSIRABLES ].
Hypoglycémie
Les patients recevant ACTOS en association avec de l'insuline ou d'autres médicaments antidiabétiques (en particulier les sécrétagogues de l'insuline tels que les sulfonylurées) peuvent présenter un risque d'hypoglycémie. Une réduction de la dose du médicament antidiabétique concomitant peut être nécessaire pour réduire le risque d'hypoglycémie [voir DOSAGE ET ADMINISTRATION ].
Effets hépatiques
Des cas d'insuffisance hépatique mortelle et non mortelle ont été rapportés après la commercialisation chez des patients prenant ACTOS 15 mg, bien que les rapports ne contiennent pas suffisamment d'informations nécessaires pour établir la cause probable. Il n'y a eu aucune preuve d'hépatotoxicité induite par le médicament dans la base de données des essais cliniques contrôlés d'ACTOS 30 mg à ce jour [voir EFFETS INDÉSIRABLES ].
Les patients atteints de diabète de type 2 peuvent avoir une stéatose hépatique ou une maladie cardiaque avec insuffisance cardiaque congestive épisodique, qui peuvent tous deux provoquer des anomalies des tests hépatiques, et ils peuvent également avoir d'autres formes de maladie du foie, dont beaucoup peuvent être traitées ou prises en charge. Par conséquent, il est recommandé d'obtenir un panel de tests hépatiques (alanine aminotransférase sérique [ALT], aspartate aminotransférase [AST], phosphatase alcaline et bilirubine totale) et d'évaluer le patient avant de commencer le traitement par ACTOS. Chez les patients présentant des tests hépatiques anormaux, ACTOS 15 mg doit être initié avec prudence.
Mesurez rapidement les tests hépatiques chez les patients qui signalent des symptômes pouvant indiquer une lésion hépatique, notamment de la fatigue, de l'anorexie, une gêne abdominale supérieure droite, des urines foncées ou une jaunisse. Dans ce contexte clinique, s'il s'avère que le patient présente des tests hépatiques anormaux (ALAT supérieure à 3 fois la limite supérieure de l'intervalle de référence), le traitement par ACTOS 15 mg doit être interrompu et une investigation doit être effectuée pour établir la cause probable. ACTOS ne doit pas être réintroduit chez ces patients sans autre explication des anomalies des tests hépatiques.
Les patients qui ont un taux sérique d'ALT supérieur à trois fois la plage de référence avec une bilirubine totale sérique supérieure à deux fois la plage de référence sans autres étiologies sont à risque de lésions hépatiques graves d'origine médicamenteuse et ne doivent pas reprendre ACTOS. Pour les patients présentant des élévations moindres de l'ALT sérique ou de la bilirubine et avec une autre cause probable, le traitement par ACTOS peut être utilisé avec prudence.
Tumeurs de la vessie urinaire
Des tumeurs ont été observées dans la vessie de rats mâles dans l'étude de cancérogénicité de deux ans [voir Toxicologie non clinique ]. De plus, au cours de l'essai clinique PROactive de trois ans, 14 patients sur 2 605 (0,54 %) randomisés pour recevoir ACTOS 15 mg et 5 sur 2 633 (0,19 %) randomisés pour recevoir un placebo ont reçu un diagnostic de cancer de la vessie. Après exclusion des patients chez qui l'exposition au médicament à l'étude était inférieure à un an au moment du diagnostic de cancer de la vessie, il y a eu 6 (0,23 %) cas sous ACTOS 30 mg et deux (0,08 %) cas sous placebo. Après la fin de l'essai, un grand sous-ensemble de patients a été observé jusqu'à 10 années supplémentaires, avec peu d'exposition supplémentaire à ACTOS. Au cours des 13 années de suivi PROactif et observationnel, la survenue d'un cancer de la vessie n'a pas différé entre les patients randomisés pour recevoir ACTOS 30 mg ou le placebo (HR = 1,00 ; [IC 95 % : 0,59-1,72]).
Les résultats concernant le risque de cancer de la vessie chez les patients exposés à ACTOS varient selon les études observationnelles ; certains n'ont pas trouvé de risque accru de cancer de la vessie associé à ACTOS 30 mg, tandis que d'autres l'ont fait.
Une vaste étude de cohorte observationnelle prospective de 10 ans menée aux États-Unis n'a trouvé aucune augmentation statistiquement significative du risque de cancer de la vessie chez les patients diabétiques ayant déjà été exposés à ACTOS, par rapport à ceux n'ayant jamais été exposés à ACTOS (HR = 1,06 [IC à 95 % 0,89-1,26 ]).
Une étude de cohorte rétrospective menée avec des données du Royaume-Uni a trouvé une association statistiquement significative entre une exposition antérieure à ACTOS et le cancer de la vessie (HR : 1,63 ; [IC à 95 % : 1,22-2,19]).
Les associations entre la dose cumulée ou la durée cumulée d'exposition à ACTOS 15 mg et le cancer de la vessie n'ont pas été détectées dans certaines études, y compris l'étude observationnelle de 10 ans aux États-Unis, mais l'étaient dans d'autres. Les résultats incohérents et les limites inhérentes à ces études et à d'autres empêchent des interprétations concluantes des données d'observation.
ACTOS peut être associé à une augmentation du risque de tumeurs de la vessie. Les données sont insuffisantes pour déterminer si la pioglitazone est un promoteur tumoral des tumeurs de la vessie.
Par conséquent, ACTOS ne doit pas être utilisé chez les patients atteints d'un cancer de la vessie actif et les avantages du contrôle glycémique par rapport aux risques inconnus de récidive du cancer avec ACTOS doivent être pris en compte chez les patients ayant des antécédents de cancer de la vessie.
Œdème
Dans les essais cliniques contrôlés, des œdèmes ont été signalés plus fréquemment chez les patients traités par ACTOS 30 mg que chez les patients sous placebo et sont liés à la dose [voir EFFETS INDÉSIRABLES ]. Dans l'expérience post-commercialisation, des cas d'apparition ou d'aggravation d'œdèmes ont été signalés.
ACTOS 15 mg doit être utilisé avec prudence chez les patients présentant un œdème. Étant donné que les thiazolidinediones, y compris ACTOS, peuvent provoquer une rétention hydrique, qui peut exacerber ou entraîner une insuffisance cardiaque congestive, ACTOS 30 mg doit être utilisé avec prudence chez les patients à risque d'insuffisance cardiaque congestive. Les patients traités par ACTOS doivent être surveillés afin de détecter tout signe et symptôme d'insuffisance cardiaque congestive [voir AVERTISSEMENT DE BOÎTE , Insuffisance cardiaque congestive et INFORMATIONS PATIENTS ].
fractures
Dans PROactive (l'essai clinique prospectif sur la pioglitazone dans les événements macrovasculaires), 5238 patients atteints de diabète de type 2 et ayant des antécédents de maladie macrovasculaire ont été randomisés pour recevoir ACTOS (N = 2605), titré jusqu'à 45 mg par jour ou un placebo (N = 2633) en plus de la norme de soins. Au cours d'un suivi moyen de 34,5 mois, l'incidence des fractures osseuses chez les femmes était de 5,1 % (44/870) pour ACTOS 30 mg versus 2,5 % (23/905) pour le placebo. Cette différence a été notée après la première année de traitement et a persisté au cours de l'étude. La majorité des fractures observées chez les patientes étaient des fractures non vertébrales, notamment du membre inférieur et du membre supérieur distal. Aucune augmentation de l'incidence des fractures n'a été observée chez les hommes traités par ACTOS (1,7 %) versus placebo (2,1 %). Le risque de fracture doit être pris en compte dans la prise en charge des patients, en particulier les patientes, traités par ACTOS et une attention particulière doit être accordée à l'évaluation et au maintien de la santé osseuse conformément aux normes de soins en vigueur.
Œdème maculaire
Des cas d'œdème maculaire ont été rapportés depuis la commercialisation chez des patients diabétiques qui prenaient ACTOS ou une autre thiazolidinedione. Certains patients présentaient une vision floue ou une diminution de l'acuité visuelle, mais d'autres ont été diagnostiqués lors d'un examen ophtalmologique de routine.
La plupart des patients avaient un œdème périphérique au moment où l'œdème maculaire a été diagnostiqué. Certains patients ont présenté une amélioration de leur œdème maculaire après l'arrêt de la thiazolidinedione.
Les patients diabétiques doivent subir des examens de la vue réguliers par un ophtalmologiste conformément aux normes de soins en vigueur. Les patients diabétiques qui signalent des symptômes visuels doivent être rapidement référés à un ophtalmologiste, quels que soient les médicaments sous-jacents du patient ou d'autres signes physiques [voir EFFETS INDÉSIRABLES ].
Résultats macrovasculaires
Il n'y a pas eu d'études cliniques établissant des preuves concluantes d'une réduction du risque macrovasculaire avec ACTOS.
Informations sur les conseils aux patients
Voir l'étiquetage des patients approuvé par la FDA ( INFORMATIONS PATIENTS ).
- Il est important de demander aux patients de respecter les instructions diététiques et de faire tester régulièrement leur glycémie et leur hémoglobine glycosylée. Pendant les périodes de stress telles que la fièvre, un traumatisme, une infection ou une intervention chirurgicale, les besoins en médicaments peuvent changer et il convient de rappeler aux patients de consulter rapidement un médecin.
- Les patients qui présentent une prise de poids inhabituellement rapide ou un œdème ou qui développent un essoufflement ou d'autres symptômes d'insuffisance cardiaque pendant qu'ils sont traités par ACTOS doivent immédiatement signaler ces symptômes à un médecin.
- Dites aux patients d'arrêter rapidement de prendre ACTOS et de consulter immédiatement un médecin en cas de nausées, de vomissements, de douleurs abdominales, de fatigue, d'anorexie ou d'urine foncée inexpliquées, car ces symptômes peuvent être dus à une hépatotoxicité.
- Dites aux patients de signaler rapidement tout signe d'hématurie macroscopique ou d'autres symptômes tels que la dysurie ou l'urgence urinaire qui se développent ou augmentent pendant le traitement car ils peuvent être dus à un cancer de la vessie.
- Dites aux patients de prendre ACTOS 15 mg une fois par jour. ACTOS 15 mg peut être pris avec ou sans repas. Si une dose est oubliée un jour, la dose ne doit pas être doublée le jour suivant.
- Lors de l'utilisation d'une thérapie combinée avec de l'insuline ou d'autres médicaments antidiabétiques, les risques d'hypoglycémie, ses symptômes et son traitement, ainsi que les conditions qui prédisposent à son développement doivent être expliqués aux patients et aux membres de leur famille.
- Informer les patientes que le traitement par ACTOS 30 mg, comme les autres thiazolidinediones, peut entraîner une grossesse non désirée chez certaines femmes anovulatoires préménopausées en raison de son effet sur l'ovulation [voir Utilisation dans des populations spécifiques ].
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Une étude de cancérogénicité de deux ans a été menée chez des rats mâles et femelles à des doses orales allant jusqu'à 63 mg/kg (environ 14 fois la dose orale humaine maximale recommandée de 45 mg basée sur mg/m2). Des tumeurs induites par les médicaments n'ont été observées dans aucun organe, à l'exception de la vessie des rats mâles. Des néoplasmes à cellules transitionnelles bénins et/ou malins ont été observés chez des rats mâles à 4 mg/kg/jour et plus (approximativement égal à la dose orale humaine maximale recommandée basée sur mg/m2). Les calculs urinaires avec irritation et hyperplasie subséquentes ont été postulés comme le mécanisme des tumeurs de la vessie observées chez les rats mâles. Une étude mécaniste de deux ans chez des rats mâles utilisant l'acidification alimentaire pour réduire la formation de calculs a été achevée en 2009. L'acidification alimentaire a diminué mais n'a pas aboli les changements hyperplasiques dans la vessie. La présence de calculs a exacerbé la réponse hyperplasique à la pioglitazone mais n'a pas été considérée comme la cause principale des modifications hyperplasiques.
La pertinence pour l'homme des résultats de la vessie chez le rat mâle ne peut être exclue.
Une étude de cancérogénicité de deux ans a également été menée chez des souris mâles et femelles à des doses orales allant jusqu'à 100 mg/kg/jour (environ 11 fois la dose orale maximale recommandée chez l'homme en mg/m2). Aucune tumeur induite par le médicament n'a été observée dans aucun organe.
Le chlorhydrate de pioglitazone n'a pas été mutagène dans une batterie d'études de toxicologie génétique, y compris le test bactérien d'Ames, un test de mutation génique directe sur des cellules de mammifères (CHO/HPRT et AS52/XPRT), un test de cytogénétique in vitro utilisant des cellules CHL, un test de synthèse d'ADN non programmé , et un test de micronoyau in vivo.
Aucun effet indésirable sur la fertilité n'a été observé chez les rats mâles et femelles à des doses orales allant jusqu'à 40 mg/kg de chlorhydrate de pioglitazone par jour avant et pendant l'accouplement et la gestation (environ neuf fois la dose orale humaine maximale recommandée en mg/m2).
Utilisation dans des populations spécifiques
Grossesse
Résumé des risques
Les données limitées avec ACTOS chez les femmes enceintes ne sont pas suffisantes pour déterminer un risque associé au médicament de malformations congénitales majeures ou de fausse couche. Il existe des risques pour la mère et le fœtus associés à un diabète mal contrôlé pendant la grossesse [voir Considérations cliniques ].
Dans les études de reproduction chez l'animal, aucun effet indésirable sur le développement n'a été observé lorsque la pioglitazone a été administrée à des rats et des lapins gravides pendant l'organogenèse à des expositions allant jusqu'à 5 et 35 fois la dose clinique de 45 mg, respectivement, en fonction de la surface corporelle [voir Données ].
Le risque de fond estimé de malformations congénitales majeures est de 6 à 10 % chez les femmes atteintes de diabète prégestationnel avec une HbA1c > 7 et a été rapporté comme étant aussi élevé que 20 à 25 % chez les femmes avec une HbA1c > 10. Le risque de fond estimé de fausse couche pour la population indiquée est inconnu. Dans la population générale des États-Unis, le risque de fond estimé de malformations congénitales majeures et de fausse couche dans les grossesses cliniquement reconnues est de 2 à 4 % et de 15 à 20 %, respectivement.
Considérations cliniques
Risque maternel et/ou embryonnaire/fœtal associé à la maladie
Un diabète mal contrôlé pendant la grossesse augmente le risque maternel d'acidocétose diabétique, de prééclampsie, d'avortements spontanés, d'accouchement prématuré, de mortinaissance et de complications à l'accouchement. Un diabète mal contrôlé augmente le risque fœtal de malformations congénitales majeures, de mortinatalité et de morbidité liée à la macrosomie.
Données
Données animales
La pioglitazone administrée à des rates gravides pendant l'organogenèse n'a pas provoqué d'effets indésirables sur le développement à une dose de 20 mg/kg (~ 5 fois la dose clinique de 45 mg), mais a retardé la parturition et réduit la viabilité embryofœtale à 40 et 80 mg/kg, ou ≥ 9 fois la dose clinique de 45 mg, par surface corporelle. Chez des lapines gravides ayant reçu de la pioglitazone pendant l'organogenèse, aucun effet indésirable sur le développement n'a été observé à 80 mg/kg (~35 fois la dose clinique de 45 mg), mais une viabilité embryofœtale réduite à 160 mg/kg, ou ~69 fois la dose clinique de 45 mg dose, par surface corporelle. Lorsque des rats gravides ont reçu de la pioglitazone en fin de gestation et de lactation, un retard du développement postnatal, attribué à une diminution du poids corporel, est survenu chez la progéniture à des doses maternelles de 10 mg/kg et plus ou ≥ 2 fois la dose clinique de 45 mg, selon la surface corporelle.
Lactation
Résumé des risques
Il n'existe aucune information concernant la présence de pioglitazone dans le lait maternel, les effets sur le nourrisson allaité ou les effets sur la production de lait. La pioglitazone est présente dans le lait de rat ; cependant, en raison des différences spécifiques aux espèces dans la physiologie de la lactation, les données animales peuvent ne pas prédire de manière fiable les niveaux de médicament dans le lait maternel. Les avantages de l'allaitement pour le développement et la santé doivent être pris en compte, ainsi que le besoin clinique d'ACTOS 15 mg pour la mère et tout effet indésirable potentiel d'ACTOS 30 mg ou de l'affection maternelle sous-jacente sur le nourrisson allaité.
Femelles et mâles de potentiel reproducteur
Discuter du risque de grossesse non désirée chez les femmes préménopausées, car le traitement par ACTOS, comme d'autres thiazolidinediones, peut entraîner l'ovulation chez certaines femmes anovulatoires.
Utilisation pédiatrique
L'innocuité et l'efficacité d'ACTOS chez les patients pédiatriques n'ont pas été établies.
ACTOS 15 mg n'est pas recommandé chez les patients pédiatriques en raison des effets indésirables observés chez les adultes, notamment la rétention d'eau et l'insuffisance cardiaque congestive, les fractures et les tumeurs de la vessie [voir AVERTISSEMENTS ET PRECAUTIONS ].
Utilisation gériatrique
Au total, 92 patients (15,2 %) traités par ACTOS dans les trois essais groupés de 16 à 26 semaines en double aveugle, contrôlés par placebo, en monothérapie étaient âgés de ≥ 65 ans et deux patients (0,3 %) étaient âgés de ≥ 75 ans. Dans les deux essais regroupés de 16 à 24 semaines en association avec une sulfonylurée, 201 patients (18,7 %) traités par ACTOS 30 mg étaient âgés de ≥ 65 ans et 19 (1,8 %) étaient âgés de ≥ 75 ans. Dans les deux essais regroupés de 16 à 24 semaines en association à la metformine, 155 patients (15,5 %) traités par ACTOS étaient âgés de ≥ 65 ans et 19 (1,9 %) étaient âgés de ≥ 75 ans. Dans les deux essais regroupés de 16 à 24 semaines en complément de l'insuline, 272 patients (25,4 %) traités par ACTOS étaient âgés de ≥ 65 ans et 22 (2,1 %) étaient âgés de ≥ 75 ans.
Dans PROactive, 1 068 patients (41,0 %) traités par ACTOS avaient ≥ 65 ans et 42 (1,6 %) avaient ≥ 75 ans.
Dans les études pharmacocinétiques avec la pioglitazone, aucune différence significative n'a été observée dans les paramètres pharmacocinétiques entre les patients âgés et les patients plus jeunes [voir PHARMACOLOGIE CLINIQUE ].
Bien que les expériences cliniques n'aient pas identifié de différences d'efficacité et de sécurité entre les personnes âgées (≥ 65 ans) et les patients plus jeunes, ces conclusions sont limitées par la petite taille des échantillons pour les patients ≥ 75 ans.
SURDOSAGE
Au cours des essais cliniques contrôlés, un cas de surdosage avec ACTOS 30 mg a été rapporté. Un patient de sexe masculin a pris 120 mg par jour pendant quatre jours, puis 180 mg par jour pendant sept jours. Le patient a nié tout symptôme clinique pendant cette période.
En cas de surdosage, un traitement de soutien approprié doit être instauré en fonction des signes cliniques et des symptômes du patient.
CONTRE-INDICATIONS
- Initiation chez les patients atteints d'insuffisance cardiaque établie de classe NYHA III ou IV [voir AVERTISSEMENT DE BOÎTE ].
- Utilisation chez les patients présentant une hypersensibilité connue à la pioglitazone ou à tout autre composant d'ACTOS.
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
ACTOS 15 mg est une thiazolidinedione dont le mécanisme d'action dépend de la présence d'insuline. ACTOS diminue la résistance à l'insuline dans la périphérie et dans le foie, ce qui entraîne une augmentation de l'élimination du glucose dépendant de l'insuline et une diminution de la production hépatique de glucose. La pioglitazone n'est pas un sécrétagogue de l'insuline. La pioglitazone est un agoniste du récepteur gamma activé par les proliférateurs de peroxysomes (PPAR?). Les récepteurs PPAR se trouvent dans les tissus importants pour l'action de l'insuline tels que le tissu adipeux, les muscles squelettiques et le foie. Activation du PPAR ? Les récepteurs nucléaires modulent la transcription d'un certain nombre de gènes sensibles à l'insuline impliqués dans le contrôle du métabolisme du glucose et des lipides.
Dans les modèles animaux de diabète, la pioglitazone réduit l'hyperglycémie, l'hyperinsulinémie et l'hypertriglycéridémie caractéristiques des états insulinorésistants tels que le diabète de type 2. Les changements métaboliques produits par la pioglitazone entraînent une augmentation de la réactivité des tissus insulino-dépendants et sont observés dans de nombreux modèles animaux de résistance à l'insuline.
Étant donné que la pioglitazone renforce les effets de l'insuline circulante (en diminuant la résistance à l'insuline), elle n'abaisse pas la glycémie chez les modèles animaux dépourvus d'insuline endogène.
Pharmacodynamie
Des études cliniques démontrent qu'ACTOS 15mg améliore la sensibilité à l'insuline chez les patients insulinorésistants. ACTOS améliore la réactivité cellulaire à l'insuline, augmente l'élimination du glucose dépendant de l'insuline et améliore la sensibilité hépatique à l'insuline. Chez les patients atteints de diabète de type 2, la diminution de la résistance à l'insuline produite par ACTOS entraîne une diminution des concentrations plasmatiques de glucose, une diminution des concentrations plasmatiques d'insuline et une diminution des valeurs d'HbA1c. Dans des essais cliniques contrôlés, ACTOS a eu un effet additif sur le contrôle glycémique lorsqu'il est utilisé en association avec une sulfonylurée, la metformine ou l'insuline [voir Etudes cliniques ].
Des patients présentant des anomalies lipidiques ont été inclus dans des essais cliniques avec ACTOS. Dans l'ensemble, les patients traités par ACTOS 15 mg ont présenté des diminutions moyennes des triglycérides sériques, des augmentations moyennes du cholestérol HDL et aucune modification moyenne constante du LDL et du cholestérol total. Il n'existe aucune preuve concluante d'un bénéfice macrovasculaire avec ACTOS [voir AVERTISSEMENTS ET PRECAUTIONS et EFFETS INDÉSIRABLES ].
Dans une étude de 26 semaines, contrôlée par placebo et en monothérapie à dose variable, la moyenne des triglycérides sériques a diminué dans les groupes de dose de 15 mg, 30 mg et 45 mg d'ACTOS 15 mg par rapport à une augmentation moyenne dans le groupe placebo. Le cholestérol HDL moyen a augmenté de manière plus importante chez les patients traités par ACTOS 30 mg que chez les patients sous placebo. Il n'y avait pas de différences constantes pour le LDL et le cholestérol total chez les patients traités par ACTOS par rapport au placebo (voir tableau 14).
Dans les deux autres études en monothérapie (16 semaines et 24 semaines) et dans les études en association avec une sulfonylurée (16 semaines et 24 semaines), la metformine (16 semaines et 24 semaines) ou l'insuline (16 semaines et 24 semaines), les résultats étaient généralement conforme aux données ci-dessus.
Pharmacocinétique
Après administration une fois par jour d'ACTOS 15 mg, les concentrations sériques à l'état d'équilibre de la pioglitazone et de ses principaux métabolites actifs, M-III (dérivé céto de la pioglitazone) et M-IV (dérivé hydroxylé de la pioglitazone), sont atteintes en sept jours. A l'état d'équilibre, le M-III et le M-IV atteignent des concentrations sériques égales ou supérieures à celle de la pioglitazone. À l'état d'équilibre, tant chez les volontaires sains que chez les patients atteints de diabète de type 2, la pioglitazone représente environ 30 % à 50 % des concentrations sériques totales maximales de pioglitazone (pioglitazone plus métabolites actifs) et 20 % à 25 % de l'ASC totale.
La Cmax, l'ASC et les concentrations sériques minimales (Cmin) de la pioglitazone et du M-III et du M-IV ont augmenté proportionnellement aux doses administrées de 15 mg et 30 mg par jour.
Absorption
Après administration orale de pioglitazone, le Tmax de la pioglitazone était inférieur à deux heures. La nourriture retarde le Tmax à trois à quatre heures mais ne modifie pas le degré d'absorption (AUC).
Distribution
Le volume de distribution apparent moyen (Vd/F) de la pioglitazone après administration d'une dose unique est de 0,63 ± 0,41 (moyenne ± ET) L/kg de poids corporel. La pioglitazone est fortement liée aux protéines (> 99 %) dans le sérum humain, principalement à l'albumine sérique. La pioglitazone se lie également à d'autres protéines sériques, mais avec une affinité moindre. M-III et M-IV sont également fortement liés (> 98 %) à l'albumine sérique.
Métabolisme
La pioglitazone est largement métabolisée par hydroxylation et oxydation ; les métabolites se transforment également en partie en conjugués glucuronide ou sulfaté. Les métabolites M-III et M-IV sont les principaux métabolites actifs circulants chez l'homme.
Les données in vitro démontrent que plusieurs isoformes du CYP sont impliquées dans le métabolisme de la pioglitazone, notamment le CYP2C8 et, dans une moindre mesure, le CYP3A4 avec des contributions supplémentaires de diverses autres isoformes, notamment le CYP1A1 principalement extrahépatique. Une étude in vivo de la pioglitazone en association avec le gemfibrozil, un puissant inhibiteur du CYP2C8, a montré que la pioglitazone est un substrat du CYP2C8 [voir DOSAGE ET ADMINISTRATION et INTERACTIONS MÉDICAMENTEUSES ]. Les rapports urinaires 6β-hydroxycortisol/cortisol mesurés chez les patients traités par ACTOS 30 mg ont montré que la pioglitazone n'est pas un puissant inducteur de l'enzyme CYP3A4.
Excrétion et élimination
Après administration orale, environ 15 à 30 % de la dose de pioglitazone sont récupérés dans les urines. L'élimination rénale de la pioglitazone est négligeable et le médicament est excrété principalement sous forme de métabolites et de leurs conjugués. On suppose que la plus grande partie de la dose orale est excrétée dans la bile sous forme inchangée ou sous forme de métabolites et éliminée dans les fèces.
La demi-vie sérique moyenne (t1/2) de la pioglitazone et de ses métabolites (M-III et M-IV) varie de trois à sept heures et de 16 à 24 heures, respectivement. La pioglitazone a une clairance apparente, CL/F, calculée comme étant de cinq à sept L/h.
Insuffisance rénale
La demi-vie d'élimination sérique de la pioglitazone, du M-III et du M-IV reste inchangée chez les patients présentant une insuffisance rénale modérée (clairance de la créatinine [CLcr] 30 à 50 ml/min) et sévère (CLcr
Insuffisance hépatique
Par rapport aux témoins sains, les sujets présentant une fonction hépatique altérée (Child-Turcotte-Pugh Grade B/C) ont une réduction d'environ 45 % de la pioglitazone et de la pioglitazone totale (pioglitazone, M-III et M-IV) de la Cmax moyenne, mais aucun changement de la les valeurs moyennes de l'ASC. Par conséquent, aucun ajustement posologique chez les patients insuffisants hépatiques n'est nécessaire.
Il existe des rapports post-commercialisation d'insuffisance hépatique avec ACTOS et les essais cliniques ont généralement exclu les patients avec des taux sériques d'ALT > 2,5 fois la limite supérieure de la plage de référence. Soyez prudent chez les patients atteints d'une maladie du foie [voir AVERTISSEMENTS ET PRECAUTIONS ].
Patients gériatriques
Chez les sujets âgés sains, la Cmax de la pioglitazone n'était pas significativement différente, mais les valeurs de l'ASC étaient environ 21 % supérieures à celles obtenues chez les sujets plus jeunes. La t1/2 moyenne de la pioglitazone a également été allongée chez les sujets âgés (environ dix heures) par rapport aux sujets plus jeunes (environ sept heures). Ces changements n'étaient pas d'une ampleur qui serait considérée comme cliniquement pertinente.
Patients pédiatriques
La sécurité et l'efficacité de la pioglitazone chez les patients pédiatriques n'ont pas été établies. ACTOS 15 mg n'est pas recommandé chez les patients pédiatriques [voir Utilisation dans des populations spécifiques ].
Le genre
Les valeurs moyennes de la Cmax et de l'ASC de la pioglitazone ont augmenté de 20 % à 60 % chez les femmes par rapport aux hommes. Dans les essais cliniques contrôlés, les diminutions de l'HbA1c par rapport au départ étaient généralement plus importantes chez les femmes que chez les hommes (différence moyenne moyenne de l'HbA1c de 0,5 %). Étant donné que le traitement doit être individualisé pour chaque patient afin d'obtenir un contrôle glycémique, aucun ajustement posologique n'est recommandé en fonction du sexe uniquement.
Origine ethnique
Les données pharmacocinétiques parmi les divers groupes ethniques ne sont pas disponibles.
Interactions médicament-médicament
Toxicologie animale et/ou pharmacologie
Une hypertrophie cardiaque a été observée chez des souris (100 mg/kg), des rats (4 mg/kg et plus) et des chiens (3 mg/kg) traités par voie orale avec du chlorhydrate de pioglitazone (environ 11, 1 et 2 fois la dose orale maximale recommandée chez l'humain). dose pour les souris, les rats et les chiens, respectivement, en mg/m2). Dans une étude d'un an chez le rat, une mort précoce liée au médicament due à un dysfonctionnement cardiaque apparent s'est produite à une dose orale de 160 mg/kg/jour (environ 35 fois la dose orale maximale recommandée chez l'homme en mg/m2). Une hypertrophie cardiaque a été observée dans une étude de 13 semaines chez des singes à des doses orales de 8,9 mg/kg et plus (environ quatre fois la dose orale humaine maximale recommandée en mg/m2), mais pas dans une étude de 52 semaines à des doses orales jusqu'à 32 mg/kg (environ 13 fois la dose orale humaine maximale recommandée basée sur mg/m2).
Etudes cliniques
Monothérapie
Trois essais randomisés, à double insu et contrôlés par placebo d'une durée de 16 à 26 semaines ont été menés pour évaluer l'utilisation d'ACTOS en monothérapie chez des patients atteints de diabète de type 2. Ces essais ont examiné ACTOS 15 mg à des doses allant jusqu'à 45 mg ou un placebo une fois par jour chez un total de 865 patients.
Dans un essai de monothérapie à dose variable de 26 semaines, 408 patients atteints de diabète de type 2 ont été randomisés pour recevoir 7,5 mg, 15 mg, 30 mg ou 45 mg d'ACTOS, ou un placebo une fois par jour. La thérapie avec tout agent antidiabétique antérieur a été interrompue huit semaines avant la période en double aveugle. Le traitement avec 15 mg, 30 mg et 45 mg d'ACTOS 30 mg a produit des améliorations statistiquement significatives de l'HbA1c et de la glycémie à jeun (FPG) au point final par rapport au placebo (voir Figure 1, Tableau 17).
La figure 1 montre l'évolution temporelle des variations de l'HbA1c dans cette étude de 26 semaines.
Figure 1. Changement moyen par rapport au départ pour l'HbA1c dans une étude de dosage contrôlée par placebo de 26 semaines (valeurs observées)
Dans un essai de monothérapie contrôlé par placebo de 24 semaines, 260 patients atteints de diabète de type 2 ont été randomisés dans l'un des deux groupes de traitement ACTOS à titration forcée ou dans un groupe placebo à titration fictive. La thérapie avec tout agent antidiabétique antérieur a été interrompue six semaines avant la période en double aveugle. Dans un groupe de traitement par ACTOS 15 mg, les patients ont reçu une dose initiale de 7,5 mg une fois par jour. Après quatre semaines, la dose a été augmentée à 15 mg une fois par jour et après quatre autres semaines, la dose a été augmentée à 30 mg une fois par jour pour le reste de l'essai (16 semaines). Dans le deuxième groupe de traitement par ACTOS, les patients ont reçu une dose initiale de 15 mg une fois par jour et ont été titrés à 30 mg une fois par jour et 45 mg une fois par jour d'une manière similaire. Le traitement par ACTOS 15 mg, tel que décrit, a produit des améliorations statistiquement significatives de l'HbA1c et du FPG au point final par rapport au placebo (voir tableau 18).
Dans un essai de monothérapie de 16 semaines, 197 patients atteints de diabète de type 2 ont été randomisés pour recevoir 30 mg d'ACTOS ou un placebo une fois par jour. La thérapie avec tout agent antidiabétique antérieur a été interrompue six semaines avant la période en double aveugle. Le traitement avec 30 mg d'ACTOS a produit des améliorations statistiquement significatives de l'HbA1c et du FPG au point final par rapport au placebo (voir Tableau 19).
Thérapie combinée
Trois essais cliniques randomisés, en double aveugle et contrôlés par placebo de 16 semaines ont été menés pour évaluer les effets d'ACTOS (15 mg et/ou 30 mg) sur le contrôle glycémique chez des patients atteints de diabète de type 2 insuffisamment contrôlés (HbA1c ≥ 8 %) malgré un traitement en cours par une sulfonylurée, la metformine ou l'insuline. De plus, trois essais cliniques randomisés en double aveugle de 24 semaines ont été menés pour évaluer les effets d'ACTOS 30 mg versus ACTOS 45 mg sur le contrôle glycémique chez des patients atteints de diabète de type 2 insuffisamment contrôlés (HbA1c ≥ 8 %) malgré les traitement avec une sulfonylurée, la metformine ou l'insuline. Le traitement antérieur du diabète peut avoir été une monothérapie ou une thérapie combinée.
Complément aux essais sur les sulfonylurées
Deux essais cliniques ont été menés avec ACTOS en association avec une sulfonylurée. Les deux études ont inclus des patients atteints de diabète de type 2 recevant n'importe quelle dose d'une sulfonylurée, seule ou en association avec un autre agent antidiabétique. Tous les autres agents antidiabétiques ont été arrêtés au moins trois semaines avant le début du traitement à l'étude.
Dans la première étude, 560 patients ont été randomisés pour recevoir 15 mg ou 30 mg d'ACTOS 30 mg ou un placebo une fois par jour pendant 16 semaines en plus de leur régime actuel de sulfonylurée. Le traitement par ACTOS en complément d'une sulfonylurée a produit des améliorations statistiquement significatives de l'HbA1c et de la FPG au point final par rapport au placebo en complément d'une sulfonylurée (voir Tableau 20).
Dans le deuxième essai, 702 patients ont été randomisés pour recevoir 30 mg ou 45 mg d'ACTOS une fois par jour pendant 24 semaines en plus de leur régime actuel de sulfonylurée. La réduction moyenne de l'HbA1c par rapport au départ à la semaine 24 était de 1,6 % pour la dose de 30 mg et de 1,7 % pour la dose de 45 mg (voir tableau 21). La réduction moyenne par rapport à la ligne de base à la semaine 24 du FPG était de 52 mg/dL pour la dose de 30 mg et de 56 mg/dL pour la dose de 45 mg.
L'effet thérapeutique d'ACTOS en association avec une sulfonylurée a été observé chez les patients quelle que soit la dose de sulfonylurée.
Complément aux essais de metformine
Deux essais cliniques ont été menés avec ACTOS 30 mg en association avec la metformine. Les deux essais incluaient des patients atteints de diabète de type 2 recevant n'importe quelle dose de metformine, seule ou en association avec un autre agent antidiabétique. Tous les autres agents antidiabétiques ont été arrêtés au moins trois semaines avant le début du traitement à l'étude.
Dans le premier essai, 328 patients ont été randomisés pour recevoir soit 30 mg d'ACTOS soit un placebo une fois par jour pendant 16 semaines en plus de leur régime actuel de metformine. Le traitement par ACTOS 30 mg en complément de la metformine a produit des améliorations statistiquement significatives de l'HbA1c et du FPG au point final par rapport au placebo en complément de la metformine (voir tableau 22).
Dans le deuxième essai, 827 patients ont été randomisés pour recevoir 30 mg ou 45 mg d'ACTOS 30 mg une fois par jour pendant 24 semaines en plus de leur régime actuel de metformine. La réduction moyenne de l'HbA1c par rapport au départ à la semaine 24 était de 0,8 % pour la dose de 30 mg et de 1,0 % pour la dose de 45 mg (voir Tableau 23). La réduction moyenne par rapport à la ligne de base à la semaine 24 du FPG était de 38 mg/dL pour la dose de 30 mg et de 51 mg/dL pour la dose de 45 mg.
L'effet thérapeutique d'ACTOS en association avec la metformine a été observé chez les patients quelle que soit la dose de metformine.
Complément aux essais sur l'insuline
Deux essais cliniques ont été menés avec ACTOS 15 mg en association avec de l'insuline. Les deux essais incluaient des patients atteints de diabète de type 2 sous insuline, seule ou en association avec un autre agent antidiabétique. Tous les autres agents antidiabétiques ont été arrêtés avant le début du traitement à l'étude. Dans le premier essai, 566 patients ont été randomisés pour recevoir 15 mg ou 30 mg d'ACTOS 15 mg ou un placebo une fois par jour pendant 16 semaines en plus de leur régime d'insuline. Le traitement par ACTOS 30 mg en complément de l'insuline a produit des améliorations statistiquement significatives de l'HbA1c et de la FPG au point final par rapport au placebo en complément de l'insuline (voir tableau 24). La dose quotidienne moyenne d'insuline au départ dans chaque groupe de traitement était d'environ 70 unités. La majorité des patients (75 % dans l'ensemble, 86 % traités par placebo, 77 % traités par ACTOS 15 mg et 61 % traités par ACTOS 30 mg) n'ont présenté aucun changement dans leur dose quotidienne d'insuline entre l'inclusion et la visite finale de l'étude. La variation moyenne par rapport à l'inclusion de la dose quotidienne d'insuline (y compris les patients sans modification de la dose d'insuline) était de -3 unités chez les patients traités par ACTOS 15 mg, -8 unités chez les patients traités par ACTOS 30 mg et -1 unité chez les patients traité par placebo.
Dans le deuxième essai, 690 patients recevant une médiane de 60 unités d'insuline par jour ont été randomisés pour recevoir 30 mg ou 45 mg d'ACTOS une fois par jour pendant 24 semaines en plus de leur régime actuel d'insuline. La réduction moyenne de l'HbA1c par rapport à l'inclusion à la semaine 24 était de 1,2 % pour la dose de 30 mg et de 1,5 % pour la dose de 45 mg. La réduction moyenne par rapport à la ligne de base à la semaine 24 de la FPG était de 32 mg/dL pour la dose de 30 mg et de 46 mg/dL pour la dose de 45 mg (voir Tableau 25). La dose quotidienne moyenne d'insuline au départ dans les deux groupes de traitement était d'environ 70 unités. La majorité des patients (55 % dans l'ensemble, 58 % traités par ACTOS 30 mg et 52 % traités par ACTOS 45 mg) n'ont présenté aucun changement dans leur dose quotidienne d'insuline entre l'inclusion et la visite finale de l'étude. La variation moyenne par rapport à la valeur initiale de la dose quotidienne d'insuline (y compris les patients sans modification de la dose d'insuline) était de -5 unités chez les patients traités par ACTOS 30 mg et de -8 unités chez les patients traités par ACTOS 45 mg.
L'effet thérapeutique d'ACTOS en association avec l'insuline a été observé chez les patients quelle que soit la dose d'insuline.
INFORMATIONS PATIENTS
ACTO (ak-TOS) (pioglitazone) Comprimés
Lisez attentivement ce Guide des médicaments avant de commencer à prendre ACTOS 15 mg et chaque fois que vous recevez une recharge. Il peut y avoir de nouvelles informations. Ces informations ne remplacent pas une discussion avec votre médecin au sujet de votre état de santé ou de votre traitement. Si vous avez des questions sur ACTOS, interrogez votre médecin ou votre pharmacien.
Quelles sont les informations les plus importantes que je devrais connaître sur ACTOS ?
ACTOS peut provoquer des effets secondaires graves, notamment une insuffisance cardiaque nouvelle ou aggravée.
- ACTOS 15 mg peut amener votre corps à conserver un excès de liquide (rétention d'eau), ce qui entraîne un gonflement (œdème) et une prise de poids. Un surplus de liquide corporel peut aggraver certains problèmes cardiaques ou entraîner une insuffisance cardiaque. L'insuffisance cardiaque signifie que votre cœur ne pompe pas assez bien le sang
- Ne prenez pas ACTOS si vous souffrez d'insuffisance cardiaque sévère
- Si vous souffrez d'insuffisance cardiaque accompagnée de symptômes (comme un essoufflement ou un gonflement), même si ces symptômes ne sont pas graves, ACTOS peut ne pas vous convenir.
Appelez votre médecin immédiatement si vous avez l'un des éléments suivants :
- gonflement ou rétention d'eau, en particulier dans les chevilles ou les jambes
- essoufflement ou difficulté à respirer, surtout lorsque vous vous allongez
- une augmentation de poids inhabituellement rapide
- fatigue inhabituelle
ACTOS peut avoir d'autres effets secondaires graves. Voir « Quels sont les effets secondaires possibles d'ACTOS ? »
Qu'est-ce qu'ACTOS ?
ACTOS 15 mg est un médicament sur ordonnance utilisé avec un régime alimentaire et de l'exercice pour améliorer le contrôle de la glycémie (glucose) chez les adultes atteints de diabète de type 2. ACTOS est un médicament contre le diabète appelé pioglitazone qui peut être pris seul ou avec d'autres médicaments contre le diabète.
On ne sait pas si ACTOS est sûr et efficace chez les enfants de moins de 18 ans. ACTOS n'est pas recommandé chez les enfants.
ACTOS n'est pas destiné aux personnes atteintes de diabète de type 1.
ACTOS 30 mg n'est pas destiné aux personnes atteintes d'acidocétose diabétique (augmentation des corps cétoniques dans le sang ou l'urine).
Qui ne devrait pas prendre ACTOS ?
Voir « Quelles sont les informations les plus importantes que je devrais connaître sur ACTOS 15 mg ? »
Ne prenez pas ACTOS 15 mg si vous :
- avez une insuffisance cardiaque grave
- êtes allergique à l'un des ingrédients d'ACTOS. Voir la fin de ce guide des médicaments pour une liste complète des ingrédients d'ACTOS
Adressez-vous à votre médecin avant de prendre ACTOS si vous souffrez de l'une de ces conditions.
Que dois-je dire à mon médecin avant de prendre ACTOS 30 mg ?
Avant de prendre ACTOS, informez votre médecin si vous :
- avoir une insuffisance cardiaque
- avez un diabète de type 1 (« juvénile ») ou avez eu une acidocétose diabétique
- avez un type de maladie oculaire diabétique qui provoque un gonflement à l'arrière de l'œil (œdème maculaire)
- avoir des problèmes de foie
- avez ou avez eu un cancer de la vessie
- êtes enceinte ou envisagez de devenir enceinte. On ne sait pas si ACTOS 15 mg peut nuire à votre bébé à naître. Parlez à votre médecin si vous êtes enceinte ou envisagez de le devenir de la meilleure façon de contrôler votre glycémie pendant la grossesse
- êtes une femme préménopausée (avant le "changement de vie") qui n'a pas de règles régulièrement ou pas du tout. ACTOS 30 mg peut augmenter vos chances de tomber enceinte. Parlez à votre médecin des choix de contraception pendant que vous prenez ACTOS. Informez immédiatement votre médecin si vous tombez enceinte pendant que vous prenez ACTOS
- allaitez ou envisagez d'allaiter. On ne sait pas si ACTOS passe dans votre lait et s'il peut nuire à votre bébé. Discutez avec votre médecin de la meilleure façon de contrôler votre glycémie pendant l'allaitement
Informez votre médecin de tous les médicaments que vous prenez y compris les médicaments sur ordonnance et en vente libre, les vitamines et les suppléments à base de plantes.
ACTOS 30 mg et certains de vos autres médicaments peuvent s'influencer mutuellement. Vous devrez peut-être modifier votre dose d'ACTOS 15 mg ou de certains autres médicaments.
Connaissez les médicaments que vous prenez. Conservez une liste de vos médicaments et montrez-la à votre médecin et à votre pharmacien avant de commencer un nouveau médicament. Il vous dira si vous pouvez prendre ACTOS 15 mg avec d'autres médicaments.
Comment dois-je prendre ACTOS 15 mg ?
- Prenez ACTOS 15 mg exactement comme votre médecin vous l'a dit
- Votre médecin peut modifier votre dose d'ACTOS. Ne modifiez pas votre dose d'ACTOS à moins que votre médecin ne vous dise de
- ACTOS peut être prescrit seul ou avec d'autres médicaments contre le diabète. Cela dépendra de la façon dont votre glycémie est contrôlée
- Prenez ACTOS 15 mg une fois par jour, avec ou sans nourriture
- Si vous oubliez une dose d'ACTOS 15 mg, prenez la dose suivante telle que prescrite, sauf indication contraire de votre médecin. Ne prenez pas deux doses à la fois le lendemain
- Si vous avez pris trop d'ACTOS, appelez votre médecin ou rendez-vous immédiatement aux urgences de l'hôpital le plus proche.
- Si votre corps est soumis à un stress tel qu'une fièvre, une infection, un accident ou une intervention chirurgicale, la dose de vos médicaments contre le diabète devra peut-être être modifiée. Appelez immédiatement votre médecin
- Suivez votre régime alimentaire et vos programmes d'exercice et testez votre glycémie régulièrement pendant que vous prenez ACTOS
- Votre médecin doit effectuer certaines analyses de sang avant de commencer et pendant que vous prenez ACTOS
- Votre médecin doit également effectuer un test d'hémoglobine A1C pour vérifier dans quelle mesure votre glycémie est contrôlée avec ACTOS.
- Votre médecin doit vérifier vos yeux régulièrement pendant que vous prenez ACTOS
Quels sont les effets secondaires possibles d'ACTOS ?
ACTOS peut provoquer des effets secondaires graves, notamment :
- Voir « Quelles sont les informations les plus importantes que je devrais connaître sur ACTOS ? »
- faible taux de sucre dans le sang (hypoglycémie). Cela peut se produire si vous sautez des repas, si vous utilisez également un autre médicament qui abaisse la glycémie ou si vous avez certains problèmes médicaux. Des étourdissements, des étourdissements, des tremblements ou la faim peuvent survenir si votre glycémie est trop basse. Appelez votre médecin si l'hypoglycémie est un problème pour vous
- problèmes de foie. Appelez immédiatement votre médecin si vous avez :
- nausées ou vomissements
- Douleur d'estomac
- fatigue inhabituelle ou inexpliquée
- perte d'appétit
- urine foncée
- jaunissement de votre peau ou du blanc de vos yeux
- cancer de la vessie. Il peut y avoir un risque accru d'avoir un cancer de la vessie lorsque vous prenez ACTOS. Vous ne devez pas prendre ACTOS 15 mg si vous recevez un traitement pour un cancer de la vessie. Informez immédiatement votre médecin si vous présentez l'un des symptômes suivants du cancer de la vessie :
- du sang ou une couleur rouge dans votre urine
- un besoin accru d'uriner
- douleur pendant que vous urinez
- os brisés (fractures). Habituellement dans la main, le haut du bras ou le pied chez les femmes. Parlez à votre médecin pour obtenir des conseils sur la façon de garder vos os en bonne santé.
- maladie oculaire diabétique avec gonflement à l'arrière de l'œil (œdème maculaire). Informez immédiatement votre médecin si vous constatez des changements dans votre vision. Votre médecin doit vérifier vos yeux régulièrement
- libération d'un ovule par un ovaire chez une femme (ovulation) entraînant une grossesse. L'ovulation peut se produire lorsque les femmes préménopausées qui n'ont pas de menstruations régulières prennent ACTOS. Cela peut augmenter vos chances de tomber enceinte
- symptômes de type rhume (infection des voies respiratoires supérieures)
- mal de tête
- Infection des sinus
- douleur musculaire
- mal de gorge
Les effets secondaires les plus courants d'ACTOS comprennent :
Dites à votre médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires d'ACTOS. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
Comment dois-je conserver ACTOS 15 mg ?
- Conservez ACTOS 15 mg entre 68 °F et 77 °F (20 °C et 25 °C). Conserver ACTOS dans son emballage d'origine et à l'abri de la lumière
- Gardez le flacon d'ACTOS bien fermé et gardez les comprimés au sec
- Gardez ACTOS et tous les médicaments hors de la portée des enfants
Informations générales sur l'utilisation sûre et efficace d'ACTOS
Les médicaments sont parfois prescrits à des fins autres que celles énumérées dans un guide des médicaments. N'utilisez pas ACTOS pour une affection pour laquelle il n'a pas été prescrit. Ne donnez pas ACTOS à d'autres personnes, même si elles présentent les mêmes symptômes que vous. Cela peut leur nuire.
Ce Guide de Médication résume les informations les plus importantes sur ACTOS. Si vous souhaitez plus d'informations, parlez-en à votre médecin. Vous pouvez demander à votre médecin ou à votre pharmacien des informations sur ACTOS rédigées à l'intention des professionnels de la santé. Pour plus d'informations, rendez-vous sur www.actos.com ou appelez le 1-877-825-3327.
Quels sont les ingrédients d'ACTOS 15mg ?
Ingrédient actif : pioglitazone Ingrédients inactifs : lactos 15 mg monohydraté, hydroxypropylcellulose, carboxyméthylcellulose calcique et stéarate de magnésium
Ce guide de médication a été approuvé par la Food and Drug Administration des États-Unis.
