Precose 25mg, 50mg Acarbose Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Precose 50 mg et comment est-il utilisé ?
Precose (comprimés d'acarbose) est un inhibiteur oral de l'alpha-glucosidase utilisé pour traiter le diabète de type 2. Precose 50 mg est parfois utilisé en association avec de l'insuline ou d'autres médicaments contre le diabète que vous prenez par voie orale. Precose 25mg est disponible sous forme générique.
Quels sont les effets secondaires de Precose 25mg ?
Les effets secondaires courants de Precose comprennent :
- diarrhée,
- gaz,
- ballonnements,
- maux d'estomac, ou
- douleurs à l'estomac au cours des premières semaines de traitement à mesure que votre corps s'adapte à ce médicament, mais elles s'améliorent généralement avec le temps.
Les autres effets secondaires de Precose 50 mg comprennent des éruptions cutanées ou des démangeaisons. Informez votre médecin si vous avez des effets secondaires rares mais très graves de Precose 25 mg, notamment :
- fatigue inhabituelle,
- nausées ou vomissements persistants,
- fortes douleurs gastriques ou abdominales,
- saignement rectal,
- jaunissement des yeux ou de la peau, ou
- urine foncée.
LA DESCRIPTION
PRECOSE® (comprimés d'acarbose) est un inhibiteur oral de l'alpha-glucosidase utilisé dans la prise en charge du diabète sucré de type 2. L'acarbose est un oligosaccharide obtenu à partir des processus de fermentation d'un micro-organisme, Actinoplanes utahensis, et est chimiquement connu sous le nom de O-4,6-didésoxy4-[[(1S,4R,5S,6S)-4,5,6-trihydroxy- 3-(hydroxyméthyl)-2-cyclohexén-1-yl]amino]α-D-glucopyranosyl-(1 → 4)-O-α-D-glucopyranosyl-(1 → 4)-D-glucose. C'est une poudre blanche à blanc cassé avec un poids moléculaire de 645,6. L'acarbose est soluble dans l'eau et a un pKa de 5,1. Sa formule empirique est C25H43NO18 et sa structure chimique est la suivante :
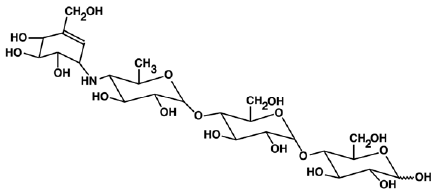
PRECOSE 50 mg est disponible sous forme de comprimés de 25 mg, 50 mg et 100 mg à usage oral. Les ingrédients inactifs sont l'amidon, la cellulose microcristalline, le stéarate de magnésium et le dioxyde de silicium colloïdal.
LES INDICATIONS
PRECOSE est indiqué en complément d'un régime alimentaire et d'exercices physiques pour améliorer le contrôle glycémique chez les adultes atteints de diabète sucré de type 2.
DOSAGE ET ADMINISTRATION
Il n'y a pas de schéma posologique fixe pour la prise en charge du diabète sucré avec PRECOSE ou tout autre agent pharmacologique. La posologie de PRECOSE 25 mg doit être individualisée sur la base de l'efficacité et de la tolérance sans dépasser la dose maximale recommandée de 100 mg tid PRECOSE doit être pris trois fois par jour au début (avec la première bouchée) de chaque repas principal.
PRECOSE doit être démarré à faible dose, avec une augmentation progressive de la dose comme décrit ci-dessous, à la fois pour réduire les effets secondaires gastro-intestinaux et pour permettre l'identification de la dose minimale requise pour un contrôle glycémique adéquat du patient. Si le régime prescrit n'est pas observé, les effets secondaires intestinaux peuvent être intensifiés. Si des symptômes très pénibles se développent malgré le respect du régime alimentaire prescrit pour diabétique, il faut consulter un médecin et réduire temporairement ou définitivement la dose.
Au cours de l'initiation du traitement et de la titration de la dose (voir ci-dessous), la glycémie postprandiale d'une heure peut être utilisée pour déterminer la réponse thérapeutique à PRECOSE et identifier la dose minimale efficace pour le patient. Par la suite, l'hémoglobine glycosylée doit être mesurée à des intervalles d'environ trois mois. L'objectif thérapeutique doit être de réduire à la fois la glycémie postprandiale et les taux d'hémoglobine glycosylée à la normale ou proche de la normale en utilisant la dose efficace la plus faible de PRECOSE, soit en monothérapie, soit en association avec des sulfonylurées, de l'insuline ou de la metformine.
Posologie initiale
La posologie initiale recommandée de PRECOSE 25 mg est de 25 mg administrés par voie orale trois fois par jour au début (avec la première bouchée) de chaque repas principal. Cependant, certains patients peuvent bénéficier d'une titration plus progressive de la dose pour minimiser les effets secondaires gastro-intestinaux. Ceci peut être réalisé en commençant le traitement à 25 mg une fois par jour et en augmentant ensuite la fréquence d'administration pour atteindre 25 mg tid
Posologie d'entretien
Une fois qu'un schéma posologique de 25 mg tid est atteint, la posologie de PRECOSE 50 mg doit être ajustée à des intervalles de 4 à 8 semaines en fonction des taux de glucose postprandial ou d'hémoglobine glycosylée sur une heure et de la tolérance. La posologie peut être augmentée de 25 mg tid à 50 mg tid Certains patients peuvent bénéficier d'une augmentation supplémentaire de la posologie à 100 mg tid La dose d'entretien varie de 50 mg tid à 100 mg tid Cependant, étant donné que les patients de faible poids risque d'élévation des transaminases sériques, seuls les patients pesant > 60 kg doivent être pris en compte pour une titration de dose supérieure à 50 mg tid (voir PRÉCAUTIONS ). Si aucune réduction supplémentaire des taux de glucose postprandial ou d'hémoglobine glycosylée n'est observée avec une titration à 100 mg tid, il faut envisager de réduire la dose. Une fois qu'une posologie efficace et tolérée est établie, elle doit être maintenue.
Posologie maximale
La dose maximale recommandée pour les patients ≤ 60 kg est de 50 mg tid La dose maximale recommandée pour les patients > 60 kg est de 100 mg tid
Patients recevant des sulfonylurées ou de l'insuline
Les sulfonylurées ou l'insuline peuvent provoquer une hypoglycémie. PRECOSE administré en association avec une sulfonylurée ou de l'insuline entraînera une baisse supplémentaire de la glycémie et peut augmenter le risque d'hypoglycémie. En cas d'hypoglycémie, des ajustements appropriés de la posologie de ces agents doivent être effectués.
COMMENT FOURNIE
PRECOSE est disponible sous forme de comprimés ronds non sécables de 25 mg, 50 mg ou 100 mg. Chaque force de comprimé est de couleur blanche à teintée de jaune. Le comprimé de 25 mg porte le code « PRECOSE » d'un côté et « 25 » de l'autre. Le comprimé de 50 mg porte le code « PRECOSE » et « 50 » sur la même face. Le comprimé de 100 mg est codé avec le mot « PRECOSE » et « 100 » sur le même côté. PRECOSE est disponible en flacons de 100 et 50 mg en doses unitaires de 100.
Ne pas stocker au dessus de 25°C (77°F). Protéger de l'humidité. Pour les bouteilles, garder le récipient bien fermé.
Bayer HealthCare Pharmaceuticals Inc. Wayne, NJ 07470. Fabriqué en Allemagne. 11/11
EFFETS SECONDAIRES
Tube digestif
Les symptômes gastro-intestinaux sont les réactions les plus fréquentes à PRECOSE. Dans des essais contrôlés par placebo aux États-Unis, les incidences de douleurs abdominales, de diarrhée et de flatulences étaient respectivement de 19 %, 31 % et 74 % chez 1 255 patients traités par PRECOSE 50 à 300 mg tid, alors que les incidences correspondantes étaient de 9 %, 12 % , et 29 % chez 999 patients traités par placebo.
Dans une étude d'innocuité d'un an, au cours de laquelle les patients tenaient un journal des symptômes gastro-intestinaux, les douleurs abdominales et la diarrhée avaient tendance à revenir aux niveaux d'avant le traitement au fil du temps, et la fréquence et l'intensité des flatulences avaient tendance à diminuer avec le temps. L'augmentation des symptômes gastro-intestinaux chez les patients traités par PRECOSE 50 mg est une manifestation du mécanisme d'action de PRECOSE et est liée à la présence de glucides non digérés dans le tractus gastro-intestinal inférieur.
Si le régime prescrit n'est pas observé, les effets secondaires intestinaux peuvent être intensifiés. Si des symptômes très pénibles se développent malgré le respect du régime alimentaire prescrit pour diabétique, il faut consulter un médecin et réduire temporairement ou définitivement la dose.
Niveaux élevés de transaminases sériques
Voir PRÉCAUTIONS .
Autres résultats de laboratoire anormaux
De petites réductions de l'hématocrite sont survenues plus souvent chez les patients traités par PRECOSE que chez les patients sous placebo, mais n'ont pas été associées à des réductions de l'hémoglobine. De faibles taux de calcium sérique et de faibles taux plasmatiques de vitamine B6 ont été associés au traitement par PRECOSE à 50 mg, mais on pense qu'ils sont soit faux, soit sans signification clinique.
Rapports d'événements indésirables post-commercialisation
D'autres événements indésirables signalés dans le monde après la commercialisation comprennent une hépatite fulminante avec issue fatale, des réactions cutanées d'hypersensibilité (par exemple, éruption cutanée, érythème, exanthème et uricaire), un œdème, un iléus/subiléus, une jaunisse et/ou une hépatite et des lésions hépatiques associées, une thrombocytopénie et une pneumatose. cystoides intestinalis (voir PRÉCAUTIONS ).
Pneumatose cystoïde intestinale
De rares cas de pneumatose cystoïde intestinale associés à l'utilisation d'inhibiteurs de l'alpha-glucosidase, y compris Precose, ont été signalés après commercialisation. La pneumatose cystoïde intestinale peut présenter des symptômes de diarrhée, d'écoulement de mucus, de saignement rectal et de constipation. Les complications peuvent inclure un pneumopéritoine, un volvulus, une occlusion intestinale, une intussusception, une hémorragie intestinale et une perforation intestinale. Si une pneumatose cystoïde intestinale est suspectée, arrêtez Precose 25 mg et effectuez l'imagerie diagnostique appropriée.
INTERACTIONS MÉDICAMENTEUSES
Certains médicaments ont tendance à produire une hyperglycémie et peuvent entraîner une perte de contrôle de la glycémie. Ces médicaments comprennent les thiazides et autres diurétiques, les corticostéroïdes, les phénothiazines, les produits thyroïdiens, les œstrogènes, les contraceptifs oraux, la phénytoïne, l'acide nicotinique, les sympathomimétiques, les inhibiteurs calciques et l'isoniazide. Lorsque de tels médicaments sont administrés à un patient recevant PRECOSE 25 mg, le patient doit être étroitement surveillé pour détecter toute perte de contrôle de la glycémie. Lorsque de tels médicaments sont retirés des patients recevant PRECOSE 50 mg en association avec des sulfonylurées ou de l'insuline, les patients doivent être surveillés de près pour tout signe d'hypoglycémie.
Patients recevant des sulfonylurées ou de l'insuline : les sulfonylurées ou l'insuline peuvent provoquer une hypoglycémie. PRECOSE 25 mg administré en association avec une sulfonylurée ou de l'insuline peut provoquer une baisse supplémentaire de la glycémie et peut augmenter le risque d'hypoglycémie. En cas d'hypoglycémie, des ajustements appropriés de la posologie de ces agents doivent être effectués. Très rarement, des cas individuels de choc hypoglycémique ont été rapportés chez des patients recevant un traitement par PRECOSE en association avec des sulfonylurées et/ou de l'insuline.
Les adsorbants intestinaux (par exemple, le charbon de bois) et les préparations d'enzymes digestives contenant des enzymes de fractionnement des glucides (par exemple, l'amylase, la pancréatine) peuvent réduire l'effet de PRECOSE et ne doivent pas être pris en concomitance.
Il a été démontré que PRECOSE 25 mg modifie la biodisponibilité de la digoxine lorsqu'ils sont co-administrés, ce qui peut nécessiter un ajustement de la dose de digoxine. (Voir PHARMACOLOGIE CLINIQUE , Interactions médicament-médicament .)
AVERTISSEMENTS
Aucune information fournie
PRÉCAUTIONS
Général
Résultats macrovasculaires
Il n'y a pas eu d'études cliniques établissant des preuves concluantes d'une réduction du risque macrovasculaire avec PRECOSE 25 mg ou tout autre médicament antidiabétique.
Hypoglycémie
En raison de son mécanisme d'action, PRECOSE administré seul ne doit pas provoquer d'hypoglycémie à jeun ou postprandiale. Les sulfonylurées ou l'insuline peuvent provoquer une hypoglycémie. Étant donné que PRECOSE 50 mg administré en association avec une sulfonylurée ou de l'insuline entraînera une baisse supplémentaire de la glycémie, il peut augmenter le risque d'hypoglycémie. L'hypoglycémie ne se produit pas chez les patients recevant de la metformine seule dans les circonstances habituelles d'utilisation, et aucune augmentation de l'incidence de l'hypoglycémie n'a été observée chez les patients lorsque PRECOSE 50 mg a été ajouté au traitement par la metformine.
Le glucose oral (dextrose), dont l'absorption n'est pas inhibée par PRECOSE, doit être utilisé à la place du saccharose (sucre de canne) dans le traitement de l'hypoglycémie légère à modérée. Le saccharose, dont l'hydrolyse en glucose et fructose est inhibée par PRECOSE, est inadapté à la correction rapide de l'hypoglycémie. Une hypoglycémie sévère peut nécessiter l'utilisation d'une perfusion intraveineuse de glucose ou d'une injection de glucagon.
Niveaux élevés de transaminases sériques
Dans des études à long terme (jusqu'à 12 mois, et incluant des doses de 25 mg de PRECOSE jusqu'à 300 mg tid) menées aux États-Unis, des élévations des transaminases sériques (AST et/ou ALT) au-dessus de la limite supérieure de la normale (LSN) liées au traitement ), supérieure à 1,8 fois la LSN et supérieure à 3 fois la LSN chez 14 %, 6 % et 3 %, respectivement, des patients traités par PRECOSE, contre 7 %, 2 % et 1 %, respectivement, des patients traités par placebo. Bien que ces différences entre les traitements aient été statistiquement significatives, ces élévations étaient asymptomatiques, réversibles, plus fréquentes chez les femmes et, en général, n'étaient pas associées à d'autres signes de dysfonctionnement hépatique. De plus, ces élévations des transaminases sériques semblaient être liées à la dose. Dans les études américaines incluant des doses de 50 mg de PRECOSE jusqu'à la dose maximale approuvée de 100 mg tid, les élévations d'AST et/ou d'ALT liées au traitement, quel que soit le niveau de gravité, étaient similaires entre les patients traités par PRECOSE et les patients traités par placebo (p ≥ 0,496) .
Dans environ 3 millions de patients-années d'expérience post-commercialisation internationale avec PRECOSE 50 mg, 62 cas d'élévations des transaminases sériques > 500 UI/L (dont 29 étaient associés à un ictère) ont été rapportés. Quarante et un de ces 62 patients ont reçu un traitement avec 100 mg tid ou plus et 33 des 45 patients pour lesquels le poids a été rapporté pesaient
Perte de contrôle de la glycémie
Lorsque les patients diabétiques sont exposés à un stress tel que de la fièvre, un traumatisme, une infection ou une intervention chirurgicale, une perte temporaire de contrôle de la glycémie peut survenir. Dans ces moments-là, une insulinothérapie temporaire peut être nécessaire.
Tests de laboratoire
La réponse thérapeutique à PRECOSE doit être surveillée par des tests de glycémie périodiques. La mesure des taux d'hémoglobine glycosylée est recommandée pour la surveillance du contrôle glycémique à long terme.
PRECOSE 25 mg, en particulier à des doses supérieures à 50 mg 3 fois par jour, peut entraîner une élévation des transaminases sériques et, dans de rares cas, une hyperbilirubinémie. Il est recommandé de vérifier les taux de transaminases sériques tous les 3 mois pendant la première année de traitement par PRECOSE et périodiquement par la suite. Si des taux élevés de transaminases sont observés, une réduction de la posologie ou l'arrêt du traitement peuvent être indiqués, en particulier si les élévations persistent.
Insuffisance rénale
Les concentrations plasmatiques de PRECOSE chez les volontaires atteints d'insuffisance rénale ont été proportionnellement augmentées par rapport au degré de dysfonctionnement rénal. Aucun essai clinique à long terme chez des patients diabétiques présentant un dysfonctionnement rénal significatif (créatinine sérique > 2,0 mg/dL) n'a été mené. Par conséquent, le traitement de ces patients par PRECOSE 50 mg n'est pas recommandé.
Carcinogenèse, mutagenèse et altération de la fertilité
Huit études de cancérogénicité ont été menées avec l'acarbose. Six études ont été réalisées chez le rat (deux souches, Sprague-Dawley et Wistar) et deux études ont été réalisées chez le hamster.
Dans la première étude chez le rat, des rats Sprague-Dawley ont reçu de l'acarbose dans leur alimentation à des doses élevées (jusqu'à environ 500 mg/kg de poids corporel) pendant 104 semaines. Le traitement à l'acarbose a entraîné une augmentation significative de l'incidence des tumeurs rénales (adénomes et adénocarcinomes) et des tumeurs bénignes à cellules de Leydig. Cette étude a été répétée avec un résultat similaire. D'autres études ont été réalisées pour séparer les effets cancérigènes directs de l'acarbose des effets indirects résultant de la malnutrition glucidique induite par les fortes doses d'acarbose employées dans les études. Dans une étude utilisant des rats Sprague-Dawley, l'acarbose a été mélangé à la nourriture, mais la privation de glucides a été empêchée par l'ajout de glucose au régime.

Dans une étude de 26 mois sur des rats Sprague-Dawley, l'acarbose a été administré par gavage postprandial quotidien afin d'éviter les effets pharmacologiques du médicament. Dans ces deux études, l'augmentation de l'incidence des tumeurs rénales constatée dans les études originales ne s'est pas produite. L'acarbose a également été administré dans les aliments et par gavage postprandial dans deux études distinctes chez des rats Wistar. Aucune augmentation de l'incidence des tumeurs rénales n'a été constatée dans l'une ou l'autre de ces études chez le rat Wistar. Dans deux études d'alimentation de hamsters, avec et sans supplémentation en glucose, il n'y avait également aucune preuve de cancérogénicité.
L'acarbose n'a induit aucun dommage à l'ADN in vitro dans le test d'aberration chromosomique CHO, le test de mutagenèse bactérienne (Ames) ou un test de liaison à l'ADN. In vivo, aucun dommage à l'ADN n'a été détecté lors du test de létalité dominante chez les souris mâles ou du test du micronoyau chez la souris.
Les études de fertilité menées chez le rat après administration orale n'ont produit aucun effet indésirable sur la fertilité ou sur la capacité globale de reproduction.
Grossesse
Effets tératogènes : Catégorie de grossesse B.
L'innocuité de PRECOSE chez la femme enceinte n'a pas été établie. Des études de reproduction ont été réalisées chez le rat à des doses allant jusqu'à 480 mg/kg (correspondant à 9 fois l'exposition chez l'homme, sur la base des concentrations sanguines du médicament) et n'ont révélé aucun signe d'altération de la fertilité ou de préjudice au fœtus dû à l'acarbose. Chez les lapins, la réduction du gain de poids corporel maternel, probablement le résultat de l'activité pharmacodynamique de fortes doses d'acarbose dans les intestins, peut avoir été responsable d'une légère augmentation du nombre de pertes embryonnaires. Cependant, des lapins ayant reçu 160 mg/kg d'acarbose (correspondant à 10 fois la dose chez l'homme, sur la base de la surface corporelle) n'ont montré aucun signe d'embryotoxicité et il n'y a eu aucun signe de tératogénicité à une dose 32 fois la dose chez l'homme (sur la base de la surface corporelle). superficie). Il n'existe cependant aucune étude adéquate et bien contrôlée de PRECOSE 25 mg chez la femme enceinte. Étant donné que les études sur la reproduction chez l'animal ne sont pas toujours prédictives de la réponse humaine, ce médicament ne doit être utilisé pendant la grossesse qu'en cas de nécessité absolue. Étant donné que les informations actuelles suggèrent fortement que des taux de glycémie anormaux pendant la grossesse sont associés à une incidence plus élevée d'anomalies congénitales ainsi qu'à une augmentation de la morbidité et de la mortalité néonatales, la plupart des experts recommandent que l'insuline soit utilisée pendant la grossesse pour maintenir les taux de glycémie aussi proches que possible de la normale. .
Mères allaitantes
Une petite quantité de radioactivité a été trouvée dans le lait de rats en lactation après administration d'acarbose radiomarqué. On ne sait pas si ce médicament est excrété dans le lait maternel. Étant donné que de nombreux médicaments sont excrétés dans le lait maternel, PRECOSE 25 mg ne doit pas être administré à une femme qui allaite.
Utilisation pédiatrique
La sécurité et l'efficacité de PRECOSE 25 mg chez les patients pédiatriques n'ont pas été établies.
Utilisation gériatrique
Sur le nombre total de sujets dans les études cliniques de PRECOSE 25 mg aux États-Unis, 27 % avaient 65 ans et plus, tandis que 4 % avaient 75 ans et plus. Aucune différence globale d'innocuité et d'efficacité n'a été observée entre ces sujets et les sujets plus jeunes. L'aire sous la courbe (ASC) moyenne à l'état d'équilibre et les concentrations maximales d'acarbose étaient environ 1,5 fois plus élevées chez les personnes âgées que chez les jeunes volontaires ; cependant, ces différences n'étaient pas statistiquement significatives.
SURDOSAGE
Contrairement aux sulfonylurées ou à l'insuline, un surdosage de PRECOSE n'entraînera pas d'hypoglycémie. Un surdosage peut entraîner une augmentation transitoire des flatulences, de la diarrhée et des malaises abdominaux qui disparaissent rapidement. En cas de surdosage, le patient ne doit pas recevoir de boissons ou de repas contenant des glucides (polysaccharides, oligosaccharides et disaccharides) pendant les 4 à 6 heures suivantes.
CONTRE-INDICATIONS
PRECOSE 25 mg est contre-indiqué chez les patients présentant une hypersensibilité connue au médicament. Precose 25 mg est contre-indiqué chez les patients atteints d'acidocétose diabétique ou de cirrhose. PRECOSE 25 mg est également contre-indiqué chez les patients présentant une maladie inflammatoire de l'intestin, une ulcération colique, une occlusion intestinale partielle ou chez les patients prédisposés à l'occlusion intestinale. De plus, PRECOSE est contre-indiqué chez les patients atteints de maladies intestinales chroniques associées à des troubles marqués de la digestion ou de l'absorption et chez les patients dont l'état peut s'aggraver en raison d'une augmentation de la formation de gaz dans l'intestin.
PHARMACOLOGIE CLINIQUE
L'acarbose est un oligosaccharide complexe qui retarde la digestion des glucides ingérés, entraînant ainsi une augmentation plus faible de la glycémie après les repas. En conséquence de la réduction de la glycémie, PRECOSE réduit les taux d'hémoglobine glycosylée chez les patients atteints de diabète sucré de type 2. La glycosylation systémique des protéines non enzymatiques, telle que reflétée par les niveaux d'hémoglobine glycosylée, est fonction de la concentration moyenne de glucose dans le sang au fil du temps.
Mécanisme d'action
Contrairement aux sulfamides hypoglycémiants, PRECOSE 50mg n'augmente pas la sécrétion d'insuline. L'action antihyperglycémiante de l'acarbose résulte d'une inhibition compétitive et réversible de l'alpha-amylase pancréatique et des enzymes alpha-glucoside hydrolases intestinales liées à la membrane. L'alpha-amylase pancréatique hydrolyse les amidons complexes en oligosaccharides dans la lumière de l'intestin grêle, tandis que les alpha-glucosidases intestinales liées à la membrane hydrolysent les oligosaccharides, les trisaccharides et les disaccharides en glucose et autres monosaccharides dans la bordure en brosse de l'intestin grêle. Chez les patients diabétiques, cette inhibition enzymatique se traduit par un retard de l'absorption du glucose et une diminution de l'hyperglycémie postprandiale.
Parce que son mécanisme d'action est différent, l'effet de PRECOSE pour améliorer le contrôle glycémique s'ajoute à celui des sulfonylurées, de l'insuline ou de la metformine lorsqu'ils sont utilisés en association. De plus, PRECOSE 50 mg diminue les effets insulinotropes et amaigrissants des sulfonylurées.
L'acarbose n'a pas d'activité inhibitrice contre la lactase et, par conséquent, on ne s'attend pas à ce qu'il induise une intolérance au lactose.
Pharmacocinétique
Absorption
Dans une étude portant sur 6 hommes en bonne santé, moins de 2 % d'une dose orale d'acarbose ont été absorbés en tant que médicament actif, tandis qu'environ 35 % de la radioactivité totale d'une dose orale marquée au 14C ont été absorbés. Une moyenne de 51 % d'une dose orale a été excrétée dans les fèces sous forme de radioactivité liée au médicament non absorbée dans les 96 heures suivant l'ingestion. Parce que l'acarbose agit localement dans le tractus gastro-intestinal, cette faible biodisponibilité systémique du composé parent est thérapeutiquement souhaitée. Après administration orale d'acarbose marqué au 14C à des volontaires sains, les concentrations plasmatiques maximales de radioactivité ont été atteintes 14 à 24 heures après l'administration, tandis que les concentrations plasmatiques maximales du médicament actif ont été atteintes après environ 1 heure. L'absorption retardée de la radioactivité liée à l'acarbose reflète l'absorption des métabolites qui peuvent être formés soit par les bactéries intestinales, soit par l'hydrolyse enzymatique intestinale.
Métabolisme
L'acarbose est métabolisé exclusivement dans le tractus gastro-intestinal, principalement par des bactéries intestinales, mais également par des enzymes digestives. Une fraction de ces métabolites (environ 34 % de la dose) a été absorbée puis excrétée dans l'urine. Au moins 13 métabolites ont été séparés par chromatographie des échantillons d'urine. Les principaux métabolites ont été identifiés comme étant des dérivés du 4-méthylpyrogallol (c'est-à-dire des conjugués de sulfate, de méthyle et de glucuronide). Un métabolite (formé par clivage d'une molécule de glucose à partir d'acarbose) a également une activité inhibitrice de l'alpha-glucosidase. Ce métabolite, avec le composé d'origine, récupéré dans l'urine, représente moins de 2 % de la dose totale administrée.
Excrétion
La fraction d'acarbose qui est absorbée sous forme de médicament intact est presque entièrement excrétée par les reins. Lorsque l'acarbose était administré par voie intraveineuse, 89 % de la dose était récupérée dans l'urine sous forme de médicament actif dans les 48 heures. En revanche, moins de 2 % d'une dose orale ont été retrouvés dans l'urine sous forme de médicament actif (c'est-à-dire composé d'origine et métabolite actif). Ceci est cohérent avec la faible biodisponibilité du médicament mère. La demi-vie d'élimination plasmatique de l'activité de l'acarbose est d'environ 2 heures chez des volontaires sains. Par conséquent, l'accumulation de médicament ne se produit pas avec une administration orale trois fois par jour (tid).
Populations particulières
L'aire sous la courbe (ASC) moyenne à l'état d'équilibre et les concentrations maximales d'acarbose étaient environ 1,5 fois plus élevées chez les personnes âgées que chez les jeunes volontaires ; cependant, ces différences n'étaient pas statistiquement significatives. Les patients atteints d'insuffisance rénale sévère (Clcr
Interactions médicament-médicament
Des études chez des volontaires sains ont montré que PRECOSE n'a aucun effet sur la pharmacocinétique ou la pharmacodynamique de la nifédipine, du propranolol ou de la ranitidine. PRECOSE n'a pas interféré avec l'absorption ou la disposition de la sulfonylurée glyburide chez les patients diabétiques. PRECOSE peut affecter la biodisponibilité de la digoxine et peut nécessiter un ajustement de la dose de digoxine de 16 % (intervalle de confiance à 90 % : 8-23 %), diminuer la Cmax moyenne de la digoxine de 26 % (intervalle de confiance à 90 % : 16-34 %) et diminuer le creux moyen concentrations de digoxine de 9 % (limite de confiance de 90 % : diminution de 19 % à augmentation de 2 %). (Voir PRÉCAUTIONS: INTERACTIONS MÉDICAMENTEUSES .)
La quantité de metformine absorbée lors de la prise de PRECOSE était bioéquivalente à la quantité absorbée lors de la prise du placebo, comme indiqué par les valeurs plasmatiques de l'ASC. Cependant, le niveau plasmatique maximal de metformine a été réduit d'environ 20 % lors de la prise de PRECOSE en raison d'un léger retard dans l'absorption de la metformine. Il y a peu ou pas d'interaction cliniquement significative entre PRECOSE et la metformine.
Essais cliniques
Expérience clinique des études de recherche de dose chez les patients atteints de diabète sucré de type 2 sous traitement diététique uniquement
Les résultats de six études contrôlées, à dose fixe, en monothérapie de PRECOSE dans le traitement du diabète sucré de type 2, impliquant 769 patients traités par PRECOSE, ont été combinés et une moyenne pondérée de la différence par rapport au placebo dans le changement moyen par rapport au départ de l'hémoglobine glycosylée ( HbA1c) a été calculée pour chaque niveau de dose comme présenté ci-dessous :
Bien que les études aient utilisé une dose maximale de 200 ou 300 mg tid, la dose maximale recommandée pour les patients 60 kg est de 100 mg tid
Les résultats de ces six études de monothérapie à dose fixe ont également été combinés pour dériver une moyenne pondérée de la différence par rapport au placebo en termes de variation moyenne par rapport au départ pour les taux de glucose plasmatique postprandiaux sur une heure, comme indiqué dans la figure suivante :
Figure 1 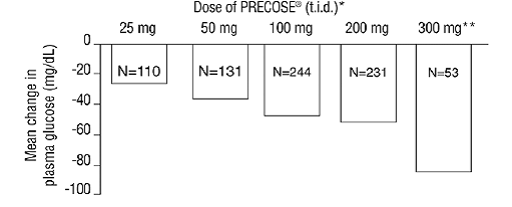
* PRECOSE 50 mg était statistiquement significativement différent du placebo à toutes les doses en ce qui concerne l'effet sur la glycémie postprandiale à une heure. **Le régime de 300 mg tid PRECOSE 50mg était supérieur aux doses plus faibles, mais il n'y avait pas de différences statistiquement significatives entre 50 et 200 mg tid
Expérience clinique chez les patients atteints de diabète sucré de type 2 en monothérapie ou en association avec des sulfonylurées, de la metformine ou de l'insuline
PRECOSE a été étudié en monothérapie et en association avec une sulfonylurée, la metformine ou un traitement à l'insuline. Les effets du traitement sur les taux d'HbA1c et les taux de glucose postprandiaux sur une heure sont résumés pour quatre études randomisées en double aveugle contrôlées par placebo menées aux États-Unis dans les tableaux 2 et 3, respectivement. Les différences de traitement soustraites au placebo, qui sont résumées ci-dessous, étaient statistiquement significatives pour les deux variables dans toutes ces études.
L'étude 1 (n = 109) impliquait des patients sous traitement de fond avec régime alimentaire uniquement. L'effet moyen de l'ajout de PRECOSE à la thérapie diététique était un changement de l'HbA1c de -0,78 % et une amélioration de la glycémie postprandiale à une heure de -74,4 mg/dL.
Dans l'étude 2 (n = 137), l'effet moyen de l'ajout de PRECOSE 25 mg au traitement maximal par sulfonylurée était un changement de l'HbA1c de -0,54 % et une amélioration de la glycémie postprandiale sur une heure de -33,5 mg/dL.
Dans l'étude 3 (n = 147), l'effet moyen de l'ajout de PRECOSE 50 mg au traitement maximal par la metformine était un changement de l'HbA1c de -0,65 % et une amélioration de la glycémie postprandiale sur une heure de -34,3 mg/dL.
L'étude 4 (n = 145) a démontré que PRECOSE ajouté aux patients sous traitement de fond par l'insuline entraînait une variation moyenne de l'HbA1c de -0,69 % et une amélioration de la glycémie postprandiale sur une heure de -36,0 mg/dL.
Une étude d'un an sur PRECOSE en monothérapie ou en association avec une sulfonylurée, de la metformine ou un traitement à l'insuline a été menée au Canada dans laquelle 316 patients ont été inclus dans l'analyse d'efficacité primaire (Figure 2). Dans les groupes régime, sulfamide hypoglycémiant et metformine, la diminution moyenne de l'HbA1c induite par l'ajout de PRECOSE 50 mg était statistiquement significative à six mois, et cet effet était persistant à un an. Chez les patients traités par PRECOSE sous insuline, il y avait une réduction statistiquement significative de l'HbA1c à six mois et une tendance à une réduction à un an.
Figure 2 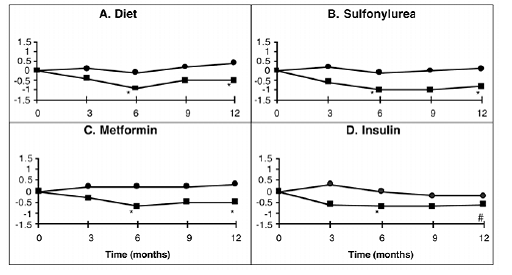
Figure 2: Effets de PRECOSE (III) et du placebo (III) sur la variation moyenne des taux d'HbA1c par rapport au départ tout au long d'une étude d'un an chez des patients atteints de diabète sucré de type 2 lorsqu'ils sont utilisés en association avec : (A) un régime seul ; (B) sulfonylurée; (C) metformine ; ou (D) insuline. Les différences de traitement à 6 et 12 mois ont été testées : * p
INFORMATIONS PATIENTS
Les patients doivent être informés de prendre PRECOSE 50 mg par voie orale trois fois par jour au début (avec la première bouchée) de chaque repas principal. Il est important que les patients continuent de respecter les instructions diététiques, un programme d'exercice régulier et des tests réguliers d'urine et/ou de glycémie.
PRECOSE lui-même ne provoque pas d'hypoglycémie même lorsqu'il est administré à des patients à jeun. Cependant, les sulfonylurées et l'insuline peuvent abaisser suffisamment la glycémie pour provoquer des symptômes ou parfois une hypoglycémie potentiellement mortelle. Étant donné que PRECOSE administré en association avec une sulfonylurée ou de l'insuline entraînera une baisse supplémentaire de la glycémie, il peut augmenter le potentiel hypoglycémiant de ces agents. L'hypoglycémie ne se produit pas chez les patients recevant de la metformine seule dans les circonstances habituelles d'utilisation, et aucune incidence accrue d'hypoglycémie n'a été observée chez les patients lorsque PRECOSE a été ajouté au traitement par la metformine. Le risque d'hypoglycémie, ses symptômes et son traitement, ainsi que les conditions qui prédisposent à son développement, doivent être bien compris par les patients et les membres responsables de la famille. Étant donné que PRECOSE 50 mg empêche la dégradation du sucre de table, les patients doivent disposer d'une source de glucose facilement disponible (dextrose, D-glucose) pour traiter les symptômes d'hypoglycémie lorsqu'ils prennent PRECOSE en association avec une sulfonylurée ou de l'insuline.
Si des effets secondaires surviennent avec PRECOSE, ils se développent généralement au cours des premières semaines de traitement. Il s'agit le plus souvent d'effets gastro-intestinaux légers à modérés, tels que flatulences, diarrhée ou gêne abdominale, et dont la fréquence et l'intensité diminuent généralement avec le temps.
