Amaryl 1mg, 2mg, 4mg Glimepiride Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce qu'Amaryl 1 mg et comment est-il utilisé ?
Amaryl 4 mg est un médicament délivré sur ordonnance utilisé pour traiter les symptômes du diabète sucré de type 2. Amaryl 4 mg peut être utilisé seul ou avec d'autres médicaments.
Amaryl 2 mg appartient à une classe de médicaments appelés antidiabétiques, sulfonylurées.
On ne sait pas si Amaryl est sûr et efficace chez les enfants.
Quels sont les effets secondaires possibles d'Amaryl?
Amaryl peut provoquer des effets secondaires graves, notamment :
- peau pâle ou jaunie,
- urine de couleur foncée,
- confusion,
- faiblesse, et
- fièvre
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants d'Amaryl comprennent:
- mal de tête,
- vertiges,
- la faiblesse,
- des nausées et
- hypoglycémie
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles d'Amaryl. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
LA DESCRIPTION
AMARYL est une sulfonylurée orale qui contient l'ingrédient actif glimépiride. Chimiquement, le glimépiride est identifié comme 1-[[p-[2-(3-éthyl-4-méthyl-2-oxo-3-pyrroline-1-carboxamido) éthyl]phényl]sulfonyl]-3-(trans-4- méthylcyclohexyl)urée (C24H34N4O5S) avec un poids moléculaire de 490,62. Le glimépiride est une poudre cristalline blanche à blanc jaunâtre, inodore à pratiquement inodore et pratiquement insoluble dans l'eau. La formule structurale est :
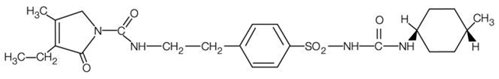
Les comprimés AMARYL contiennent l'ingrédient actif glimépiride et les ingrédients inactifs suivants : lactose (hydraté), glycolate d'amidon sodique, povidone, cellulose microcristalline et stéarate de magnésium. De plus, les comprimés AMARYL à 1 mg contiennent de l'oxyde de fer rouge, les comprimés AMARYL à 2 mg contiennent de l'oxyde de fer jaune et la laque d'aluminium FD&C bleu n°2, et les comprimés d'AMARYL à 4 mg contiennent la laque d'aluminium FD&C bleu n°2.
LES INDICATIONS
AMARYL 2 mg est indiqué en complément d'un régime alimentaire et d'exercices physiques pour améliorer le contrôle glycémique chez les adultes atteints de diabète sucré de type 2 [voir Etudes cliniques ].
Limites d'utilisation importantes
AMARYL ne doit pas être utilisé pour le traitement du diabète sucré de type 1 ou de l'acidocétose diabétique, car il ne serait pas efficace dans ces contextes.
DOSAGE ET ADMINISTRATION
Dosage recommandé
AMARYL 1 mg doit être administré au petit-déjeuner ou au premier repas principal de la journée.
La dose initiale recommandée d'AMARYL est de 1 mg ou 2 mg une fois par jour. Les patients à risque accru d'hypoglycémie (par exemple, les personnes âgées ou les patients atteints d'insuffisance rénale) doivent commencer par 1 mg une fois par jour [voir AVERTISSEMENTS ET PRECAUTIONS et Utilisation dans des populations spécifiques ].
Après avoir atteint une dose quotidienne de 2 mg, d'autres augmentations de dose peuvent être effectuées par incréments de 1 mg ou 2 mg en fonction de la réponse glycémique du patient. L'uptitration ne doit pas se produire plus fréquemment que toutes les 1 à 2 semaines. Un schéma de titration conservateur est recommandé pour les patients présentant un risque accru d'hypoglycémie [voir AVERTISSEMENTS ET PRECAUTIONS et Utilisation dans des populations spécifiques ].
La dose maximale recommandée est de 8 mg une fois par jour.
Les patients transférés à AMARYL 1 mg à partir de sulfonylurées à demi-vie plus longue (par exemple, le chlorpropamide) peuvent avoir un effet médicamenteux se chevauchant pendant 1 à 2 semaines et doivent être surveillés de manière appropriée pour détecter une hypoglycémie.
Lorsque le colesevelam est co-administré avec le glimépiride, la concentration plasmatique maximale et l'exposition totale au glimépiride sont réduites. Par conséquent, AMARYL 2 mg doit être administré au moins 4 heures avant le colesevelam.
COMMENT FOURNIE
Formes posologiques et points forts
AMARYL 4mg est formulé sous forme de comprimés de :
- 1 mg (rose, à face plate, oblongue avec des côtés entaillés à la double bissectrice, imprimé avec "AMA RYL" sur un côté)
- 2 mg (vert, à face plate, oblong avec des côtés entaillés à la double bissectrice, imprimé avec "AMA RYL" sur un côté)
- 4 mg (bleu, à face plate, oblong avec des côtés crantés à la double bissectrice, imprimé avec "AMA RYL" sur un côté)
Stockage et manutention
AMARYL les comprimés sont disponibles dans les dosages et tailles d'emballage suivants :
1mg (rose, à face plate, oblongue avec des côtés crantés à la double bissectrice, imprimé avec "AMA RYL" sur un côté) en bouteilles de 100 ( CDN 0039-0221-10)
2mg (vert, à face plate, oblong avec des côtés crantés à la double bissectrice, imprimé avec "AMA RYL" sur un côté) en bouteilles de 100 ( CDN 0039-0222-10)
4mg (bleu, à face plate, oblong avec des côtés crantés à la double bissectrice, imprimé avec "AMA RYL" sur un côté) en bouteilles de 100 ( CDN 0039-0223-10)
Conserver à 25 °C (77 °F); excursions autorisées jusqu'à 20 - 25°C (68 - 77°F) (voir Température ambiante contrôlée USP ).
Distribuer dans des récipients bien fermés avec des fermetures de sécurité.
sanofi-aventis US LLC, Bridgewater, NJ 08807, UNE SOCIÉTÉ SANOFI. Révisé en décembre 2016
EFFETS SECONDAIRES
Les effets indésirables graves suivants sont discutés plus en détail ci-dessous et ailleurs dans l'étiquetage :
- Hypoglycémie [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Anémie hémolytique [voir AVERTISSEMENTS ET PRECAUTIONS ]
Dans les essais cliniques, les effets indésirables les plus fréquents avec AMARYL 4 mg étaient l'hypoglycémie, les étourdissements, l'asthénie, les céphalées et les nausées.
Expérience des essais cliniques
Étant donné que les essais cliniques sont menés dans des conditions très variables, les taux d'effets indésirables observés dans les essais cliniques d'un médicament ne peuvent pas être directement comparés aux taux des essais cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique.
Environ 2 800 patients atteints de diabète de type 2 ont été traités par AMARYL 4 mg dans les essais cliniques contrôlés. Dans ces essais, environ 1 700 patients ont été traités par AMARYL pendant au moins 1 an.
Le tableau 1 résume les événements indésirables, autres que l'hypoglycémie, qui ont été signalés dans 11 essais contrôlés par placebo regroupés, qu'ils soient ou non considérés comme étant éventuellement ou probablement liés au médicament à l'étude. La durée du traitement variait de 13 semaines à 12 mois. Les termes rapportés représentent ceux survenus à une incidence ≥ 5 % chez les patients traités par AMARYL et plus fréquemment que chez les patients ayant reçu le placebo.
Hypoglycémie
Dans un essai randomisé, en double aveugle, contrôlé par placebo en monothérapie d'une durée de 14 semaines, les patients déjà sous sulfamide hypoglycémiant ont subi une période de sevrage de 3 semaines puis ont été randomisés pour recevoir AMARYL 1 mg, 4 mg, 8 mg ou un placebo. Les patients randomisés pour AMARYL 4 mg ou 8 mg ont subi une titration forcée d'une dose initiale de 1 mg à ces doses finales, selon la tolérance [voir Etudes cliniques ]. L'incidence globale d'hypoglycémie possible (définie par la présence d'au moins un symptôme qui, selon l'investigateur, pourrait être lié à l'hypoglycémie ; une mesure concomitante de la glycémie n'était pas nécessaire) était de 4 % pour AMARYL 1 mg, 17 % pour AMARYL 4 mg, 16 % pour AMARYL 8 mg et 0 % pour le placebo. Tous ces événements ont été auto-traités.
Dans un essai de monothérapie randomisé, en double aveugle et contrôlé par placebo d'une durée de 22 semaines, les patients ont reçu une dose initiale de 1 mg d'AMARYL ou de placebo par jour. La dose d'AMARYL 2 mg a été ajustée à une glycémie plasmatique à jeun cible de 90 à 150 mg/dL. Les doses quotidiennes finales d'AMARYL 2 mg étaient de 1, 2, 3, 4, 6 ou 8 mg [voir Etudes cliniques ]. L'incidence globale d'hypoglycémie possible (telle que définie ci-dessus pour l'essai de 14 semaines) pour AMARYL versus placebo était de 19,7 % versus 3,2 %. Tous ces événements ont été autotraités.
Gain de poids: AMARYL, comme toutes les sulfonylurées, peut entraîner une prise de poids [voir Etudes cliniques ].
Réactions allergiques : Dans les essais cliniques, des réactions allergiques telles que prurit, érythème, urticaire et éruptions morbilliformes ou maculopapuleuses sont survenues chez moins de 1 % des patients traités par AMARYL. Ceux-ci peuvent disparaître malgré la poursuite du traitement par AMARYL. Des rapports post-commercialisation font état de réactions allergiques plus graves (p. ex., dyspnée, hypotension, choc) [voir AVERTISSEMENTS ET PRECAUTIONS ].
Tests de laboratoire
Augmentation de l'alanine aminotransférase (ALT) sérique : Dans 11 procès contrôlés du placebo mis en commun d'AMARYL, 1.9 % de patients AMARYL-traités et 0.8 % de patients traités du placebo ont développé le sérum ALT plus grand que 2 fois la limite supérieure de la gamme de référence.
Expérience post-commercialisation
Les effets indésirables suivants ont été identifiés lors de l'utilisation post-approbation d'AMARYL. Étant donné que ces réactions sont signalées volontairement par une population de taille incertaine, il n'est pas toujours possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale avec l'exposition au médicament.
- Réactions d'hypersensibilité graves, y compris anaphylaxie, œdème de Quincke et syndrome de Stevens-Johnson [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Anémie hémolytique chez les patients avec et sans déficit en G6PD [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Altération de la fonction hépatique (par exemple avec cholestase et ictère), ainsi que l'hépatite, qui peut évoluer vers une insuffisance hépatique.
- Porphyrie cutanée tardive, réactions de photosensibilité et vascularite allergique
- Leucopénie, agranulocytose, anémie aplasique et pancytopénie
- Thrombocytopénie (y compris les cas graves avec une numération plaquettaire inférieure à 10 000/μL) et purpura thrombocytopénique
- Réactions de porphyrie hépatique et réactions de type disulfirame
- Hyponatrémie et syndrome de sécrétion inappropriée d'hormone antidiurétique (SIADH), le plus souvent chez les patients qui prennent d'autres médicaments ou qui ont des conditions médicales connues pour provoquer une hyponatrémie ou augmenter la libération d'hormone antidiurétique
- Dysgueusie
- Alopécie
INTERACTIONS MÉDICAMENTEUSES
Médicaments affectant le métabolisme du glucose
Un certain nombre de médicaments affectent le métabolisme du glucose et peuvent nécessiter un ajustement de la dose d'AMARYL 4 mg et une surveillance particulièrement étroite en cas d'hypoglycémie ou d'aggravation du contrôle glycémique.
Voici des exemples de médicaments susceptibles d'augmenter l'effet hypoglycémiant des sulfonylurées dont AMARYL 2mg, augmentant la susceptibilité et/ou l'intensité de l'hypoglycémie : antidiabétiques oraux, acétate de pramlintide, insuline, inhibiteurs de l'enzyme de conversion de l'angiotensine (ECA), Antagonistes des récepteurs H2, fibrates, propoxyphène, pentoxifylline, analogues de la somatostatine, stéroïdes anabolisants et androgènes, cyclophosphamide, phényramidol, guanéthidine, fluconazole, sulfinpyrazone, tétracyclines, clarithromycine, disopyramide, quinolones et les médicaments fortement liés aux protéines, tels que la fluoxétine, anti-inflammatoires non stéroïdiens, salicylates, sulfamides, chloramphénicol, coumarines, probénécide et inhibiteurs de la monoamine oxydase. Lorsque ces médicaments sont administrés à un patient recevant AMARYL, surveiller étroitement le patient pour détecter une hypoglycémie. Lorsque ces médicaments sont retirés à un patient recevant AMARYL 2 mg, surveiller étroitement le patient pour déceler une aggravation du contrôle glycémique.
Voici des exemples de médicaments susceptibles de réduire l'effet hypoglycémiant des sulfonylurées, y compris AMARYL, entraînant une détérioration du contrôle glycémique : danazol, glucagon, somatropine, inhibiteurs de la protéase, antipsychotiques atypiques (p. ex., olanzapine et clozapine), barbituriques, diazoxide, laxatifs , rifampine, thiazides et autres diurétiques, corticostéroïdes, phénothiazines, hormones thyroïdiennes, œstrogènes, contraceptifs oraux, phénytoïne, acide nicotinique, sympathomimétiques (p. ex., épinéphrine, albutérol, terbutaline) et isoniazide. Lorsque ces médicaments sont administrés à un patient recevant AMARYL 2 mg, surveiller étroitement le patient pour déceler une aggravation du contrôle glycémique. Lorsque ces médicaments sont retirés d'un patient recevant AMARYL 2 mg, surveiller étroitement le patient pour l'hypoglycémie.
Les bêta-bloquants, la clonidine et la réserpine peuvent entraîner une potentialisation ou un affaiblissement de l'effet hypoglycémiant d'AMARYL.
La consommation aiguë et chronique d'alcool peut potentialiser ou affaiblir l'action hypoglycémiante d'AMARYL 1 mg de manière imprévisible.
Les signes d'hypoglycémie peuvent être réduits ou absents chez les patients prenant des médicaments sympatholytiques tels que les bêta-bloquants, la clonidine, la guanéthidine et la réserpine.
Miconazole
Une interaction potentielle entre le miconazole oral et les sulfonylurées entraînant une hypoglycémie sévère a été rapportée. On ne sait pas si cette interaction se produit également avec d'autres formes posologiques de miconazole.
Interactions avec le cytochrome P450 2C9
Il peut y avoir une interaction entre le glimépiride et les inhibiteurs (par exemple, le fluconazole) et les inducteurs (par exemple, la rifampicine) du cytochrome P450 2C9. Le fluconazole peut inhiber le métabolisme du glimépiride, entraînant une augmentation des concentrations plasmatiques de glimépiride pouvant entraîner une hypoglycémie. La rifampicine peut induire le métabolisme du glimépiride, entraînant une diminution des concentrations plasmatiques de glimépiride pouvant entraîner une détérioration du contrôle glycémique.
Administration concomitante de Colesevelam
Le colesevelam peut réduire la concentration plasmatique maximale et l'exposition totale au glimépiride lorsque les deux sont co-administrés. Cependant, l'absorption n'est pas réduite lorsque le glimépiride est administré 4 heures avant le colesevelam. Par conséquent, AMARYL doit être administré au moins 4 heures avant le colesevelam.
AVERTISSEMENTS
Inclus dans le cadre du PRÉCAUTIONS section.
PRÉCAUTIONS
Hypoglycémie
Toutes les sulfonylurées, y compris AMARYL, peuvent provoquer une hypoglycémie sévère [voir EFFETS INDÉSIRABLES ]. La capacité du patient à se concentrer et à réagir peut être altérée à la suite d'une hypoglycémie. Ces déficiences peuvent présenter un risque dans des situations où ces capacités sont particulièrement importantes, comme la conduite automobile ou l'utilisation d'autres machines. Une hypoglycémie sévère peut entraîner une perte de conscience ou des convulsions et peut entraîner une altération temporaire ou permanente des fonctions cérébrales ou la mort.
Les patients doivent être éduqués pour reconnaître et gérer l'hypoglycémie. Soyez prudent lors de l'initiation et de l'augmentation des doses d'AMARYL 2 mg chez les patients qui peuvent être prédisposés à l'hypoglycémie (par exemple, les personnes âgées, les patients insuffisants rénaux, les patients prenant d'autres médicaments antidiabétiques). Les patients affaiblis ou souffrant de malnutrition et ceux souffrant d'insuffisance surrénalienne, hypophysaire ou hépatique sont particulièrement sensibles à l'action hypoglycémiante des médicaments hypoglycémiants. L'hypoglycémie est également plus susceptible de se produire lorsque l'apport calorique est insuffisant, après un exercice intense ou prolongé, ou lorsque l'alcool est ingéré.
Les symptômes d'alerte précoce de l'hypoglycémie peuvent être différents ou moins prononcés chez les patients atteints de neuropathie autonome, les personnes âgées et chez les patients qui prennent des médicaments bloquants bêta-adrénergiques ou d'autres agents sympatholytiques. Ces situations peuvent entraîner une hypoglycémie sévère avant que le patient ne soit conscient de l'hypoglycémie.
Réactions d'hypersensibilité
Des rapports post-commercialisation ont fait état de réactions d'hypersensibilité chez des patients traités par AMARYL, y compris des réactions graves telles que l'anaphylaxie, l'œdème de Quincke et le syndrome de Stevens-Johnson. Si une réaction d'hypersensibilité est suspectée, arrêtez rapidement AMARYL, évaluez les autres causes potentielles de la réaction et instituez un traitement alternatif pour le diabète.
L'anémie hémolytique
Les sulfonylurées peuvent provoquer une anémie hémolytique chez les patients présentant un déficit en glucose 6-phosphate déshydrogénase (G6PD). AMARYL 4mg étant une sulfamide hypoglycémiant, soyez prudent chez les patients présentant un déficit en G6PD et envisagez l'utilisation d'une alternative non sulfonylurée. Il existe également des rapports post-commercialisation d'anémie hémolytique chez des patients recevant AMARYL 1 mg qui n'avaient pas de déficit connu en G6PD [voir EFFETS INDÉSIRABLES ].
Risque accru de mortalité cardiovasculaire avec les sulfonylurées
Il a été rapporté que l'administration d'hypoglycémiants oraux était associée à une augmentation de la mortalité cardiovasculaire par rapport au traitement par régime seul ou régime plus insuline. Cette mise en garde est basée sur l'étude menée par l'University Group Diabetes Program (UGDP), un essai clinique prospectif à long terme visant à évaluer l'efficacité des médicaments hypoglycémiants pour prévenir ou retarder les complications vasculaires chez les patients non insulino-dépendants. Diabète. L'étude a impliqué 823 patients qui ont été assignés au hasard à l'un des quatre groupes de traitement. L'UGDP a rapporté que les patients traités pendant 5 à 8 ans avec un régime plus une dose fixe de tolbutamide (1,5 gramme par jour) avaient un taux de mortalité cardiovasculaire d'environ 2 à ½ fois celle des patients traités par régime seul. Une augmentation significative de la mortalité totale n'a pas été observée, mais l'utilisation du tolbutamide a été interrompue en raison de l'augmentation de la mortalité cardiovasculaire, limitant ainsi la possibilité pour l'étude de montrer une augmentation de la mortalité globale. Malgré la controverse concernant l'interprétation de ces résultats, les conclusions de l'étude de l'UGDP fournissent une base adéquate pour cet avertissement. Le patient doit être informé des risques et avantages potentiels d'AMARYL 4 mg et des modes de traitement alternatifs. Bien qu'un seul médicament de la classe des sulfonylurées (le tolbutamide) ait été inclus dans cette étude, il est prudent, du point de vue de la sécurité, de considérer que cette mise en garde peut également s'appliquer à d'autres hypoglycémiants oraux de cette classe, compte tenu de leurs étroites similitudes dans le mode d'administration. Action et structure chimique.
Résultats macrovasculaires
Il n'y a pas eu d'études cliniques établissant des preuves concluantes d'une réduction du risque macrovasculaire avec AMARYL ou tout autre médicament antidiabétique.
Toxicologie non clinique
Carcinogenèse, mutagenèse et altération de la fertilité
Des études chez le rat à des doses allant jusqu'à 5 000 parties par million (ppm) dans l'aliment complet (environ 340 fois la dose humaine maximale recommandée, basée sur la surface) pendant 30 mois n'ont montré aucun signe de carcinogenèse. Chez la souris, l'administration de glimépiride pendant 24 mois a entraîné une augmentation de la formation d'adénome pancréatique bénin qui était liée à la dose et que l'on pensait être le résultat d'une stimulation pancréatique chronique. Aucune formation d'adénome chez la souris n'a été observée à une dose de 320 ppm dans l'aliment complet, soit 46-54 mg/kg de poids corporel/jour. C'est environ 35 fois la dose maximale recommandée pour l'homme de 8 mg une fois par jour en fonction de la surface.
Le glimépiride s'est avéré non mutagène dans une batterie d'études de mutagénicité in vitro et in vivo (test d'Ames, mutation des cellules somatiques, aberration chromosomique, synthèse d'ADN non programmée et test du micronoyau chez la souris).
Il n'y a eu aucun effet du glimépiride sur la fertilité des souris mâles chez les animaux exposés jusqu'à 2 500 mg/kg de poids corporel (> 1 700 fois la dose maximale recommandée chez l'homme en fonction de la surface). Le glimépiride n'a eu aucun effet sur la fertilité des rats mâles et femelles ayant reçu jusqu'à 4 000 mg/kg de poids corporel (environ 4 000 fois la dose maximale recommandée chez l'homme en fonction de la surface).
Utilisation dans des populations spécifiques
Grossesse
Catégorie de grossesse C
Il n'y a pas d'études adéquates et bien contrôlées d'AMARYL 2 mg chez la femme enceinte. Dans les études animales, il n'y a pas eu d'augmentation des anomalies congénitales, mais une augmentation des décès fœtaux est survenue chez les rats et les lapins à des doses de glimépiride 50 fois (rats) et 0,1 fois (lapins) la dose humaine maximale recommandée (basée sur la surface corporelle). On pense que cette fœtotoxicité, observée uniquement à des doses induisant une hypoglycémie maternelle, est directement liée à l'action pharmacologique (hypoglycémiante) du glimépiride et a été constatée de manière similaire avec d'autres sulfonylurées. AMARYL ne doit être utilisé pendant la grossesse que si le bénéfice potentiel justifie le risque potentiel pour le fœtus. Étant donné que les données suggèrent qu'une glycémie anormale pendant la grossesse est associée à une incidence plus élevée d'anomalies congénitales, le traitement du diabète pendant la grossesse doit maintenir la glycémie aussi proche que possible de la normale.
Effets non tératogènes
Une hypoglycémie sévère prolongée (4 à 10 jours) a été rapportée chez des nouveau-nés nés de mères recevant une sulfonylurée au moment de l'accouchement.
Mères allaitantes
On ne sait pas si AMARYL 1 mg est excrété dans le lait maternel. Au cours des études prénatales et postnatales chez le rat, des concentrations significatives de glimépiride étaient présentes dans le lait maternel et le sérum des ratons. La progéniture de rats exposés à des niveaux élevés de glimépiride pendant la grossesse et l'allaitement a développé des malformations squelettiques consistant en un raccourcissement, un épaississement et une flexion de l'humérus pendant la période postnatale. Ces déformations squelettiques ont été déterminées comme étant le résultat de l'allaitement de mères exposées au glimépiride. Sur la base de ces données animales et du potentiel d'hypoglycémie chez un nourrisson, une décision doit être prise soit d'interrompre l'allaitement soit d'arrêter AMARYL 2 mg, en tenant compte de l'importance d'AMARYL pour la mère.
Utilisation pédiatrique
La pharmacocinétique, l'efficacité et la sécurité d'AMARYL 4 mg ont été évaluées chez des patients pédiatriques atteints de diabète de type 2 comme décrit ci-dessous. AMARYL 4 mg n'est pas recommandé chez les patients pédiatriques en raison de ses effets indésirables sur le poids corporel et l'hypoglycémie.
La pharmacocinétique d'une dose unique de 1 mg d'AMARYL a été évaluée chez 30 patients diabétiques de type 2 (homme = 7 ; femme = 23) âgés de 10 à 17 ans. L'ASC moyenne (± ET) (339±203 ng·h/mL), la Cmax (102±48 ng/mL) et la t½ (3,1±1,7 heures) du glimépiride étaient comparables aux données historiques des adultes (ASC(0-dernier ) 315±96 ng·h/mL, Cmax 103±34 ng/mL et t½ 5,3±4,1 heures).
L'innocuité et l'efficacité d'AMARYL chez les patients pédiatriques ont été évaluées dans un essai en simple aveugle de 24 semaines qui a randomisé 272 patients (8-17 ans) atteints de diabète de type 2 pour AMARYL (n = 135) ou la metformine (n = 137 ). Les patients naïfs de traitement (ceux traités uniquement avec un régime et de l'exercice pendant au moins 2 semaines avant la randomisation) et les patients précédemment traités (ceux précédemment traités ou actuellement traités avec d'autres médicaments antidiabétiques oraux pendant au moins 3 mois) étaient éligibles pour participer. Les patients qui recevaient des antidiabétiques oraux au moment de l'entrée dans l'étude ont arrêté ces médicaments avant la randomisation sans période de sevrage. AMARYL a été initié à 1 mg, puis titré jusqu'à 2, 4 ou 8 mg (dernière dose moyenne 4 mg) jusqu'à la semaine 12, ciblant une glycémie à jeun autosurveillée
Après 24 semaines, la différence moyenne globale de traitement de l'HbA1c entre AMARYL 4 mg et la metformine était de 0,2 %, en faveur de la metformine (intervalle de confiance à 95 % -0,3 % à +0,6 %). Sur la base de ces résultats, l'essai n'a pas atteint son objectif principal de montrer une réduction similaire de l'HbA1c avec AMARYL 4mg par rapport à la metformine.
Le profil des effets indésirables chez les patients pédiatriques traités par AMARYL 2 mg a été similaire à celui observé chez les adultes [voir EFFETS INDÉSIRABLES ].
Des événements hypoglycémiques documentés par des valeurs de glycémie
Utilisation gériatrique
Dans les essais cliniques d'AMARYL 2 mg, 1 053 des 3 491 patients (30 %) étaient âgés de > 65 ans. Aucune différence globale d'innocuité ou d'efficacité n'a été observée entre ces patients et les patients plus jeunes, mais une plus grande sensibilité chez certaines personnes plus âgées ne peut être exclue.
Il n'y avait pas de différences significatives dans la pharmacocinétique du glimépiride entre les patients atteints de diabète de type 2 ≤ 65 ans (n = 49) et ceux > 65 ans (n = 42) [voir PHARMACOLOGIE CLINIQUE ].
Le glimépiride est essentiellement excrété par les reins. Les patients âgés sont plus susceptibles d'avoir une insuffisance rénale. De plus, l'hypoglycémie peut être difficile à reconnaître chez les personnes âgées [voir DOSAGE ET ADMINISTRATION et AVERTISSEMENTS ET PRECAUTIONS ]. Soyez prudent lors de l'initiation d'AMARYL et de l'augmentation de la dose d'AMARYL 1 mg dans cette population de patients.
Insuffisance rénale
Pour minimiser le risque d'hypoglycémie, la dose initiale recommandée d'AMARYL est de 1 mg par jour pour tous les patients atteints de diabète de type 2 et d'insuffisance rénale [voir DOSAGE ET ADMINISTRATION et AVERTISSEMENTS ET PRECAUTIONS ].
Une étude de titration à doses multiples a été menée chez 16 patients atteints de diabète de type 2 et d'insuffisance rénale à l'aide de doses allant de 1 mg à 8 mg par jour pendant 3 mois. La clairance de la créatinine de base variait de 10 à 60 ml/min. La pharmacocinétique d'AMARYL a été évaluée dans l'étude de titration à doses multiples et les résultats étaient cohérents avec ceux observés chez les patients inclus dans une étude à dose unique. Dans les deux études, la clairance totale relative d'AMARYL a augmenté lorsque la fonction rénale était altérée. Les deux études ont également démontré que l'élimination des deux principaux métabolites était réduite chez les patients insuffisants rénaux [voir PHARMACOLOGIE CLINIQUE ].
SURDOSAGE
Un surdosage d'AMARYL 2mg, comme avec les autres sulfamides hypoglycémiants, peut entraîner une hypoglycémie sévère. Les épisodes légers d'hypoglycémie peuvent être traités avec du glucose par voie orale. Les réactions hypoglycémiques sévères constituent des urgences médicales nécessitant un traitement immédiat. Une hypoglycémie sévère avec coma, convulsions ou troubles neurologiques peut être traitée avec du glucagon ou du glucose intraveineux. Une observation continue et un apport supplémentaire en glucides peuvent être nécessaires car l'hypoglycémie peut réapparaître après une guérison clinique apparente [voir AVERTISSEMENTS ET PRECAUTIONS ].
CONTRE-INDICATIONS
AMARYL est contre-indiqué chez les patients ayant des antécédents de réaction d'hypersensibilité à :
- Glimépiride ou l'un des ingrédients du produit [voir AVERTISSEMENTS ET PRECAUTIONS ].
Dérivés de sulfamide : Les patients qui ont développé une réaction allergique aux dérivés de sulfamide peuvent développer une réaction allergique à AMARYL. Ne pas utiliser AMARYL 4 mg chez les patients ayant des antécédents de réaction allergique aux dérivés sulfamides.
Les réactions d'hypersensibilité rapportées comprennent des éruptions cutanées avec ou sans prurit ainsi que des réactions plus graves (par exemple, anaphylaxie, œdème de Quincke, syndrome de Stevens-Johnson, dyspnée) [voir AVERTISSEMENTS ET PRECAUTIONS et EFFETS INDÉSIRABLES ].
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
Le glimépiride abaisse principalement la glycémie en stimulant la libération d'insuline par les cellules bêta pancréatiques. Les sulfonylurées se lient au récepteur des sulfonylurées dans la membrane plasmique des cellules bêta pancréatiques, entraînant la fermeture du canal potassique sensible à l'ATP, stimulant ainsi la libération d'insuline.
Pharmacodynamie
Chez les sujets sains, le temps nécessaire pour atteindre l'effet maximal (concentrations minimales de glucose dans le sang) était d'environ 2 à 3 heures après des doses orales uniques d'AMARYL. Les effets d'AMARYL sur l'HbA1c, la glycémie à jeun et la glycémie post-prandiale ont été évalués dans des essais cliniques [voir Etudes cliniques ].
Pharmacocinétique
Absorption
Des études avec des doses orales uniques de glimépiride chez des sujets sains et avec des doses orales multiples chez des patients atteints de diabète de type 2 ont montré des concentrations maximales de médicament (Cmax) 2 à 3 heures après l'administration. Lorsque le glimépiride a été administré avec les repas, la Cmax et l'ASC (aire sous la courbe) moyennes ont diminué de 8 % et 9 %, respectivement.
Le glimépiride ne s'accumule pas dans le sérum après plusieurs doses. La pharmacocinétique du glimépiride ne diffère pas entre les sujets sains et les patients atteints de diabète de type 2. La clairance du glimépiride après administration orale ne change pas dans l'intervalle de doses de 1 mg à 8 mg, ce qui indique une pharmacocinétique linéaire.
Chez les sujets sains, les variabilités intra et interindividuelles des paramètres pharmacocinétiques du glimépiride étaient respectivement de 15-23 % et de 24-29 %.
Distribution
Après administration intraveineuse chez des sujets sains, le volume de distribution (Vd) était de 8,8 L (113 mL/kg) et la clairance corporelle totale (CL) était de 47,8 mL/min. La liaison aux protéines était supérieure à 99,5 %.
Métabolisme
Le glimépiride est complètement métabolisé par biotransformation oxydative après une dose intraveineuse ou orale. Les principaux métabolites sont le dérivé cyclohexyl hydroxy méthyle (M1) et le dérivé carboxyle (M2). Le cytochrome P450 2C9 est impliqué dans la biotransformation du glimépiride en M1. M1 est ensuite métabolisé en M2 par une ou plusieurs enzymes cytosoliques. M2 est inactif. Chez les animaux, M1 possède environ un tiers de l'activité pharmacologique du glimépiride, mais il n'est pas clair si M1 entraîne des effets cliniquement significatifs sur la glycémie chez l'homme.
Excrétion
Lorsque le 14C-glimépiride a été administré par voie orale à 3 sujets sains de sexe masculin, environ 60 % de la radioactivité totale a été récupérée dans les urines en 7 jours. M1 et M2 représentent 80 à 90 % de la radioactivité récupérée dans les urines. Le rapport de M1 à M2 dans l'urine était d'environ 3:2 chez deux sujets et de 4:1 chez un sujet. Environ 40 % de la radioactivité totale a été récupérée dans les matières fécales. M1 et M2 représentaient environ 70 % (le rapport de M1 à M2 était de 1:3) de la radioactivité récupérée dans les matières fécales. Aucune molécule mère n'a été retrouvée dans l'urine ou les matières fécales. Après administration intraveineuse chez les patients, aucune excrétion biliaire significative du glimépiride ou de son métabolite M1 n'a été observée.
Patients gériatriques
Une comparaison de la pharmacocinétique du glimépiride chez les patients diabétiques de type 2 ≤ 65 ans et ceux > 65 ans a été évaluée dans une étude à doses multiples utilisant AMARYL 6 mg par jour. Il n'y avait pas de différences significatives dans la pharmacocinétique du glimépiride entre les deux groupes d'âge. L'ASC moyenne à l'état d'équilibre pour les patients âgés était d'environ 13 % inférieure à celle des patients plus jeunes ; la clairance moyenne ajustée en fonction du poids pour les patients âgés était d'environ 11 % supérieure à celle des patients plus jeunes.
Le genre
Il n'y avait aucune différence entre les hommes et les femmes dans la pharmacocinétique du glimépiride lorsqu'un ajustement a été effectué pour les différences de poids corporel.
Course
Aucune étude n'a été menée pour évaluer les effets de la race sur la pharmacocinétique du glimépiride mais dans les essais contrôlés par placebo d'AMARYL 2 mg chez des patients atteints de diabète de type 2, la réduction de l'HbA était comparable chez les Caucasiens (n = 536), les Noirs (n = 63) , et Hispaniques (n = 63).
Insuffisance rénale
Une étude ouverte à dose unique AMARYL 3 mg a été administrée à des patients présentant une insuffisance rénale légère, modérée et sévère estimée par la clairance de la créatinine (CLcr) : le groupe I était composé de 5 patients présentant une insuffisance rénale légère (CLcr > 50 mL/min ), le groupe II comprenait 3 patients atteints d'insuffisance rénale modérée (CLcr = 20-50 mL/min) et le groupe III comprenait 7 patients atteints d'insuffisance rénale sévère (CLcr
Insuffisance hépatique
On ne sait pas s'il existe un effet de l'insuffisance hépatique sur la pharmacocinétique d'AMARYL 1 mg car la pharmacocinétique d'AMARYL 1 mg n'a pas été suffisamment évaluée chez les patients atteints d'insuffisance hépatique.
Patients obèses
La pharmacocinétique du glimépiride et de ses métabolites a été mesurée dans une étude à dose unique portant sur 28 patients atteints de diabète de type 2 qui avaient soit un poids corporel normal, soit une obésité morbide. Alors que le tmax, la clairance et le volume de distribution du glimépiride chez les patients obèses morbides étaient similaires à ceux du groupe de poids normal, les obèses morbides avaient une Cmax et une ASC inférieures à celles de poids corporel normal. Les valeurs moyennes de Cmax, AUC0-24, AUC0-∞ du glimépiride chez les patients normaux vs obèses morbides étaient de 547 ± 218 ng/mL vs 410 ± 124 ng/mL, 3210 ± 1030 heures·ng/mL vs 2820 ± 1110 heures·ng/mL et 4000 ± 1320 heures·ng/mL contre 3280 ± 1360 heures·ng/mL, respectivement.
Interactions médicamenteuses
Aspirine: Dans une étude croisée randomisée, en double aveugle, à deux périodes, des sujets sains ont reçu soit un placebo, soit de l'aspirine 1 gramme trois fois par jour pendant une période de traitement totale de 5 jours. Au jour 4 de chaque période d'étude, une dose unique de 1 mg d'AMARYL 4 mg a été administrée. Les doses d'AMARYL 4 mg ont été séparées par une période de sevrage de 14 jours. La co-administration d'aspirine et d'AMARYL 4 mg a entraîné une diminution de 34 % de l'ASC moyenne du glimépiride et une diminution de 4 % de la Cmax moyenne du glimépiride.
Colesevelam : L'administration concomitante de colesevelam et de glimépiride a entraîné des réductions de l'ASC0-∞ et de la Cmax du glimépiride de 18 % et 8 %, respectivement. Lorsque le glimépiride a été administré 4 heures avant le colesevelam, il n'y a eu aucun changement significatif de l'ASC0-∞ et de la Cmax du glimépiride, respectivement -6 % et 3 % [voir DOSAGE ET ADMINISTRATION et INTERACTIONS MÉDICAMENTEUSES ].
Cimétidine et Ranitidine : Dans une étude randomisée, ouverte et croisée à 3 voies, des sujets sains ont reçu soit une dose unique de 4 mg d'AMARYL seul, AMARYL avec ranitidine (150 mg deux fois par jour pendant 4 jours ; AMARYL 2 mg a été administré le jour 3), ou AMARYL 2 mg avec de la cimétidine (800 mg par jour pendant 4 jours ; AMARYL a été administré le jour 3). La co-administration de cimétidine ou de ranitidine avec une dose orale unique de 4 mg d'AMARYL 4 mg n'a pas modifié de manière significative l'absorption et l'élimination du glimépiride.
Propranolol : Dans une étude croisée randomisée, en double aveugle, à deux périodes, des sujets sains ont reçu soit un placebo, soit du propranolol 40 mg trois fois par jour pendant une période de traitement totale de 5 jours. Au jour 4 ou à chaque période d'étude, une dose unique de 2 mg d'AMARYL 4 mg a été administrée. Les doses d'AMARYL 4 mg ont été séparées par une période de sevrage de 14 jours. L'administration concomitante de propranolol et d'AMARYL 1 mg a significativement augmenté la Cmax, l'ASC et la T½ du glimépiride de 23 %, 22 % et 15 %, respectivement, et a diminué la CL/f du glimépiride de 18 %. La récupération de M1 et M2 à partir de l'urine n'a pas été modifiée.
Warfarine : Dans une étude ouverte, à double sens et croisée, des sujets sains ont reçu 4 mg d'AMARYL 2 mg par jour pendant 10 jours. Des doses uniques de 25 mg de warfarine ont été administrées 6 jours avant de commencer AMARYL et le jour 4 de l'administration d'AMARYL. L'administration concomitante d'AMARYL n'a pas modifié la pharmacocinétique des énantiomères R- et S-warfarine. Aucun changement n'a été observé dans la liaison aux protéines plasmatiques de la warfarine. AMARYL 1 mg a entraîné une diminution statistiquement significative de la réponse pharmacodynamique à la warfarine. Les réductions de l'aire moyenne sous la courbe du temps de prothrombine (PT) et des valeurs maximales du TP pendant le traitement par AMARYL étaient de 3,3 % et 9,9 %, respectivement, et il est peu probable qu'elles soient cliniquement pertinentes.
Etudes cliniques
Monothérapie
Au total, 304 patients atteints de diabète de type 2 déjà traités par sulfonylurée ont participé à un essai multicentrique, randomisé, en double aveugle, contrôlé par placebo, d'une durée de 14 semaines, évaluant l'innocuité et l'efficacité d'AMARYL 1 mg en monothérapie. Les patients ont arrêté leur traitement par sulfonylurée, puis sont entrés dans une période de sevrage placebo de 3 semaines, suivie d'une randomisation dans l'un des 4 groupes de traitement : placebo (n = 74), AMARYL 1 mg (n = 78), AMARYL 4 mg (n = 76) et AMARYL 8mg (n=76). Tous les patients randomisés pour AMARYL 4 mg ont commencé 1 mg par jour. Les patients randomisés pour AMARYL 4 mg ou 8 mg avaient une titration forcée en aveugle de la dose d'AMARYL 2 mg à intervalles hebdomadaires, d'abord à 4 mg puis à 8 mg, tant que la dose était tolérée, jusqu'à ce que la dose randomisée soit atteinte. Les patients randomisés à la dose de 4 mg ont atteint la dose assignée à la semaine 2. Les patients randomisés à la dose de 8 mg ont atteint la dose assignée à la semaine 3. Une fois le niveau de dose randomisé atteint, les patients devaient être maintenus à cette dose jusqu'à la semaine 14. Environ 66 % des patients traités par placebo ont terminé l'essai, contre 81 % des patients traités par glimépiride 1 mg et 92 % des patients traités par glimépiride 4 mg ou 8 mg. Comparativement au placebo, le traitement par AMARYL 1 mg, 4 mg et 8 mg par jour a apporté des améliorations statistiquement significatives de l'HbA1c par rapport au placebo (Tableau 3).
Un total de 249 patients naïfs de traitement ou ayant reçu un traitement antidiabétique limité dans le passé ont été randomisés pour recevoir 22 semaines de traitement soit par AMARYL (n=123) soit par placebo (n=126) dans une étude multicentrique, randomisée , essai en double aveugle, contrôlé par placebo, avec titration de dose. La dose initiale d'AMARYL était de 1 mg par jour et a été titrée vers le haut ou vers le bas à des intervalles de 2 semaines jusqu'à un objectif FPG de 90-150 mg/dL. Les niveaux de glucose sanguin pour le FPG et le PPG ont été analysés en laboratoire. Après 10 semaines d'ajustement posologique, les patients ont été maintenus à leur dose optimale (1, 2, 3, 4, 6 ou 8 mg) pendant les 12 semaines restantes de l'essai. Le traitement par AMARYL 2 mg a apporté des améliorations statistiquement significatives de l'HbA1c et du FPG par rapport au placebo (Tableau 4).
INFORMATIONS PATIENTS
Informez les patients de l'importance du respect des instructions diététiques, d'un programme d'exercice régulier et de tests réguliers de glycémie.
Informer les patients des effets secondaires potentiels d'AMARYL 1 mg, notamment l'hypoglycémie et la prise de poids.
Expliquer les symptômes et le traitement de l'hypoglycémie ainsi que les conditions qui prédisposent à l'hypoglycémie. Les patients doivent être informés que la capacité de concentration et de réaction peut être altérée à la suite d'une hypoglycémie. Cela peut présenter un risque dans les situations où ces capacités sont particulièrement importantes, comme la conduite ou l'utilisation d'autres machines.
Les patients atteints de diabète doivent être avisés d'informer leur fournisseur de soins de santé s'ils sont enceintes, envisagent une grossesse, allaitent ou envisagent d'allaiter.
