Zofran 4mg, 8mg Ondansetron Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Zofran et comment est-il utilisé ?
Zofran 4 mg est un médicament délivré sur ordonnance utilisé comme prophylaxie et pour traiter les symptômes de nausées et de vomissements dus à certains médicaments ou en postopératoire. Zofran 8 mg peut être utilisé seul ou avec d'autres médicaments.
Zofran appartient à une classe de médicaments appelés antiémétiques, antagonistes sélectifs 5-HT3.
On ne sait pas si Zofran 4 mg est sûr et efficace chez les enfants de moins de 1 mois.
Quels sont les effets secondaires possibles de Zofran ?
Zofran peut provoquer des effets secondaires graves, notamment :
- constipation sévère,
- Douleur d'estomac,
- ballonnements,
- maux de tête avec douleurs thoraciques et étourdissements sévères,
- évanouissement,
- battements de cœur rapides ou battants,
- jaunissement de la peau ou des yeux (jaunisse)
- Vision floue,
- perte de vision temporaire,
- agitation,
- hallucinations,
- fièvre,
- rythme cardiaque rapide,
- réflexes hyperactifs,
- nausée,
- vomissement,
- diarrhée,
- perte de coordination et
- évanouissement
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Zofran incluent :
- diarrhée,
- constipation,
- somnolence et
- sensation de fatigue
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Zofran. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
LA DESCRIPTION
L'ingrédient actif des comprimés ZOFRAN 4 mg et de la solution buvable ZOFRAN est le chlorhydrate d'ondansétron sous forme dihydratée, la forme racémique de l'ondansétron et un agent bloquant sélectif du type récepteur de la sérotonine 5-HT3. Chimiquement, il s'agit de (±) 1, 2, 3, 9-tétrahydro-9-méthyl-3-[(2-méthyl-1H-imidazol-1-yl)méthyl]-4H-carbazol-4-one, monochlorhydrate, dihydraté . Il a la formule structurale suivante :
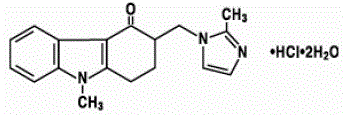
La formule empirique est C18H19N3O·HCl·2H2O, représentant un poids moléculaire de 365,9.
Le chlorhydrate d'ondansétron dihydraté est une poudre blanche à blanc cassé soluble dans l'eau et le sérum physiologique.
L'ingrédient actif des comprimés à dissolution orale ZOFRAN 4 mg ODT est l'ondansétron base, la forme racémique de l'ondansétron, et un agent bloquant sélectif du type récepteur de la sérotonine 5-HT3. Chimiquement, il s'agit de (±) 1, 2, 3, 9tétrahydro-9-méthyl-3-[(2-méthyl-1H-imidazol-1-yl)méthyl]-4H-carbazol-4-one. Il a la formule structurale suivante :
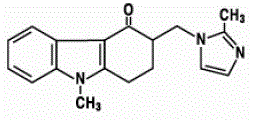
La formule empirique est C18H19N3O représentant un poids moléculaire de 293,4.
Chaque comprimé de ZOFRAN à 4 mg et à 8 mg pour administration orale contient du chlorhydrate d'ondansétron dihydraté équivalent à 4 mg d'ondansétron. Chaque comprimé ZOFRAN 8 mg pour administration orale contient du chlorhydrate d'ondansétron dihydraté équivalent à 8 mg d'ondansétron. Chaque comprimé contient également les ingrédients inactifs hypromellose, oxyde de fer jaune (comprimé de 8 mg uniquement), lactose, stéarate de magnésium, cellulose microcristalline, amidon prégélatinisé, triacétine et dioxyde de titane.
Chaque comprimé à dissolution orale ZOFRAN 8 mg ODT à 4 mg pour administration orale contient 4 mg d'ondansétron base. Chaque comprimé à dissolution orale ZOFRAN 4 mg ODT de 8 mg pour administration orale contient 8 mg d'ondansétron base. Chaque comprimé ZOFRAN ODT contient également les ingrédients inactifs aspartame, gélatine, mannitol, méthylparabène sodique, propylparabène sodique et arôme de fraise. Les comprimés ZOFRAN ODT sont une formulation d'ondansétron lyophilisée administrée par voie orale qui se désintègre sur la langue et ne nécessite pas d'eau pour faciliter la dissolution ou la déglutition.
Chaque 5 mL de solution buvable ZOFRAN contient 5 mg de chlorhydrate d'ondansétron dihydraté équivalent à 4 mg d'ondansétron. ZOFRAN 8mg solution buvable contient les ingrédients inactifs acide citrique anhydre, eau purifiée, benzoate de sodium, citrate de sodium, sorbitol et arôme fraise.
LES INDICATIONS
ZOFRAN est indiqué pour la prévention des nausées et vomissements associés à :
- chimiothérapie anticancéreuse hautement émétisante, dont cisplatine supérieure ou égale à 50 mg/m²
- cures initiales et répétées de chimiothérapie anticancéreuse modérément émétisante
- radiothérapie chez les patients recevant soit une irradiation corporelle totale, soit une fraction unique à haute dose à l'abdomen, soit des fractions quotidiennes à l'abdomen
ZOFRAN est également indiqué pour la prévention des nausées et/ou vomissements postopératoires.
DOSAGE ET ADMINISTRATION
Dosage
Les schémas posologiques recommandés pour les patients adultes et pédiatriques sont décrits respectivement dans les tableaux 1 et 2. Les doses correspondantes de comprimés ZOFRAN, de comprimés à dissolution orale ZOFRAN ODT® et de solution buvable ZOFRAN peuvent être utilisées de manière interchangeable.
Posologie en cas d'insuffisance hépatique
Chez les patients présentant une insuffisance hépatique sévère (score de Child-Pugh supérieur ou égal à 10), ne pas dépasser une dose quotidienne totale de 8 mg [voir Utilisation dans des populations spécifiques , PHARMACOLOGIE CLINIQUE ].
Instructions d'administration pour les comprimés à désintégration orale ZOFRAN ODT
N'essayez pas de pousser les comprimés à désintégration orale ZOFRAN ODT à travers le support en aluminium. Avec les mains sèches, RETIRER la feuille d'aluminium d'une ampoule et retirer DOUCEMENT le comprimé. Placer IMMÉDIATEMENT le comprimé à dissolution orale ZOFRAN 4mg ODT sur le dessus de la langue où il se dissoudra en quelques secondes, puis avaler avec de la salive. L'administration avec du liquide n'est pas nécessaire.
COMMENT FOURNIE
Formes posologiques et points forts
ZOFRAN comprimés sont des comprimés pelliculés ovales gravés « Zofran » sur une face et sont disponibles dans les dosages suivants :
- 4 mg - comprimé blanc avec « 4 » gravé sur l'autre face.
- 8 mg - comprimé jaune avec « 8 » gravé de l'autre côté.
ZOFRAN ODT les comprimés à désintégration orale sont des comprimés blancs, ronds et plan-convexes disponibles dans les dosages suivants :
- 4 mg - gravé « Z4 » sur un côté.
- 8 mg - gravé avec "Z8" sur un côté.
ZOFRAN 4mg solution buvable 4 mg/5 mL, est un liquide clair, incolore à jaune clair avec une odeur caractéristique de fraise disponible en flacon de 50 mL.
Stockage et manutention
ZOFRAN Comprimés
4 mg (chlorhydrate d'ondansétron dihydraté équivalent à 4 mg d'ondansétron), sont des comprimés blancs, ovales, pelliculés gravés avec "Zofran" sur un côté et "4" sur l'autre dans des flacons de 30 comprimés (NDC 0078-0675-15 ).
Conserver entre 2 °C et 30 °C (36 °F et 86 °F). Protéger de la lumière. Dispenser dans un récipient étanche et résistant à la lumière tel que défini dans l'USP.
8 mg (chlorhydrate d'ondansétron dihydraté équivalent à 8 mg d'ondansétron), sont des comprimés pelliculés jaunes, ovales, gravés "Zofran" d'un côté et "8" de l'autre dans des flacons de 30 comprimés (NDC 0078-0676-15 ).
Conserver entre 2 °C et 30 °C (36 °F et 86 °F). Protéger de la lumière. Dispenser dans un récipient étanche et résistant à la lumière tel que défini dans l'USP.
ZOFRAN 8 mg ODT comprimés à désintégration orale
4 mg (sous forme de base d'ondansétron à 4 mg) sont des comprimés blancs, ronds et plano-convexes gravés d'un "Z4" sur un côté dans des emballages à dose unitaire de 30 comprimés (NDC 0078-0679-19).
mg (sous forme de base d'ondansétron à 8 mg) sont des comprimés blancs, ronds et plano-convexes gravés d'un "Z8" sur un côté dans des emballages à dose unitaire de 30 comprimés (NDC 0078-0680-19).
Conserver entre 2 °C et 30 °C (36 °F et 86 °F).
ZOFRAN 4mg Solution buvable
un liquide clair, incolore à jaune clair avec une odeur caractéristique de fraise, contient 5 mg de chlorhydrate d'ondansétron dihydraté équivalent à 4 mg d'ondansétron par 5 ml dans des flacons en verre ambré de 50 ml avec des fermetures à l'épreuve des enfants (NDC 0078-0677-22) .
Conserver debout entre 15 °C et 30 °C (59 °F et 86 °F). Protéger de la lumière. Conserver les bouteilles debout dans des cartons.
Distribué par : Novartis Pharmaceuticals Corporation East Hanover, New Jersey 07936. Révisé : avril 2021
EFFETS SECONDAIRES
Les effets indésirables cliniquement significatifs suivants sont décrits ailleurs dans l'étiquetage :
- Réactions d'hypersensibilité [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Allongement de l'intervalle QT [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Syndrome sérotoninergique [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Masquage de l'iléus progressif et de la distension gastrique [voir AVERTISSEMENTS ET PRECAUTIONS ]
Expérience des essais cliniques
Étant donné que les essais cliniques sont menés dans des conditions très variables, les taux d'effets indésirables observés dans les essais cliniques d'un médicament ne peuvent pas être directement comparés aux taux des essais cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique.
Les effets indésirables suivants ont été signalés lors d'essais cliniques chez des patients traités par l'ondansétron, l'ingrédient actif de ZOFRAN. Une relation causale avec le traitement par ZOFRAN n'était pas claire dans de nombreux cas.
Prévention des nausées et des vomissements induits par la chimiothérapie
Les effets indésirables les plus fréquents signalés chez 4 % ou plus de 300 adultes recevant une dose unique de 24 mg de ZOFRAN 4 mg par voie orale dans 2 essais pour la prévention des nausées et des vomissements associés à une chimiothérapie hautement émétisante (cisplatine supérieur ou égal à 50 mg /m²) étaient : céphalées (11 %) et diarrhée (4 %).
Les effets indésirables les plus fréquemment rapportés dans 4 essais chez l'adulte pour la prévention des nausées et des vomissements associés à une chimiothérapie modérément émétisante (principalement des régimes à base de cyclophosphamide) sont présentés dans le tableau 3.
Effets indésirables moins courants
Système nerveux central
Réactions extrapyramidales (moins de 1 % des patients).
Hépatique
Les valeurs d'aspartate transaminase (AST) et/ou d'alanine transaminase (ALT) ont dépassé le double de la limite supérieure de la normale chez environ 1 à 2 % des 723 patients recevant ZOFRAN 8 mg et une chimiothérapie à base de cyclophosphamide dans les essais cliniques aux États-Unis. Les augmentations étaient transitoires et ne semblaient pas liées à la dose ou à la durée du traitement. Lors d'expositions répétées, des élévations transitoires similaires des valeurs des transaminases se sont produites dans certains cours, mais aucune maladie hépatique symptomatique ne s'est produite. Le rôle de la chimiothérapie anticancéreuse dans ces changements biochimiques n'est pas clair.
Une insuffisance hépatique et des décès ont été signalés chez des patients cancéreux recevant des médicaments concomitants, y compris une chimiothérapie cytotoxique potentiellement hépatotoxique et des antibiotiques. L'étiologie de l'insuffisance hépatique n'est pas claire.
Tégumentaire
Rash (environ 1% des patients).
Autre (moins de 2%)
Anaphylaxie, bronchospasme, tachycardie, angine de poitrine, hypokaliémie, altérations électrocardiographiques, événements occlusifs vasculaires et crises de grand mal. À l'exception du bronchospasme et de l'anaphylaxie, la relation avec ZOFRAN 4 mg n'est pas claire.
Prévention des nausées et des vomissements radio-induits
Les effets indésirables les plus fréquents (supérieurs ou égaux à 2 %) signalés chez les patients recevant ZOFRAN et une radiothérapie concomitante étaient similaires à ceux signalés chez les patients recevant ZOFRAN et une chimiothérapie concomitante et étaient les maux de tête, la constipation et la diarrhée.
Prévention des nausées et des vomissements postopératoires
Les effets indésirables les plus fréquemment rapportés chez les adultes dans le(s) essai(s) de prévention des nausées et vomissements postopératoires sont présentés dans le tableau 4. Dans ces essais, les patients recevaient plusieurs médicaments concomitants périopératoires et postopératoires dans les deux groupes de traitement.
Dans une étude croisée avec 25 sujets, des maux de tête ont été signalés chez 6 sujets ayant reçu ZOFRAN 8 mg ODT comprimé à désintégration orale avec de l'eau (24 %) par rapport à 2 sujets ayant reçu ZOFRAN 8 mg ODT comprimé à désintégration orale sans eau (8 %).
Expérience post-commercialisation
Les effets indésirables suivants ont été identifiés lors de l'utilisation post-approbation de l'ondansétron. Étant donné que ces réactions sont signalées volontairement par une population de taille incertaine, il n'est pas toujours possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale avec l'exposition au médicament.
Cardiovasculaire
Arythmies (y compris tachycardie ventriculaire et supraventriculaire, contractions ventriculaires prématurées et fibrillation auriculaire), bradycardie, altérations électrocardiographiques (y compris bloc cardiaque du deuxième degré, allongement de l'intervalle QT/QTc et sous-décalage du segment ST), palpitations et syncope. Rarement et principalement avec l'ondansétron intraveineux, des modifications transitoires de l'ECG, y compris un allongement de l'intervalle QT, ont été rapportées.
Général
Rinçage
De rares cas de réactions d'hypersensibilité, parfois sévères (par exemple, réactions anaphylactiques, œdème de Quincke, bronchospasme, essoufflement, hypotension, œdème laryngé, stridor) ont également été rapportés. Des laryngospasmes, des chocs et des arrêts cardiorespiratoires sont survenus lors de réactions allergiques chez des patients recevant de l'ondansétron injectable.
Hépatobiliaire
Anomalies des enzymes hépatiques.
Respiratoire inférieur
Hoquet.
Neurologie
Crise oculogyre, apparaissant seule, ainsi qu'avec d'autres réactions dystoniques.
Peau
Urticaire, syndrome de Stevens-Johnson et nécrolyse épidermique toxique.
Troubles oculaires
Des cas de cécité transitoire, principalement lors d'une administration intraveineuse, ont été rapportés. Ces cas de cécité transitoire ont été signalés à résoudre en quelques minutes jusqu'à 48 heures.
INTERACTIONS MÉDICAMENTEUSES
Médicaments sérotoninergiques
Un syndrome sérotoninergique (comprenant un état mental altéré, une instabilité autonome et des symptômes neuromusculaires) a été décrit suite à l'utilisation concomitante d'antagonistes des récepteurs 5-HT3 et d'autres médicaments sérotoninergiques, y compris les ISRS et les IRSN. Surveiller l'apparition d'un syndrome sérotoninergique. Si des symptômes apparaissent, arrêtez ZOFRAN 4 mg et initiez un traitement de soutien [voir AVERTISSEMENTS ET PRECAUTIONS ].
Médicaments affectant les enzymes du cytochrome P-450
L'ondansétron ne semble pas lui-même induire ou inhiber le système enzymatique métabolisant le médicament du cytochrome P-450 du foie [voir PHARMACOLOGIE CLINIQUE ]. Étant donné que l'ondansétron est métabolisé par les enzymes hépatiques métabolisant les médicaments du cytochrome P450 (CYP3A4, CYP2D6, CYP1A2), les inducteurs ou les inhibiteurs de ces enzymes peuvent modifier la clairance et, par conséquent, la demi-vie de l'ondansétron. Chez les patients traités avec des inducteurs puissants du CYP3A4 (c'est-à-dire la phénytoïne, la carbamazépine et la rifampicine), la clairance de l'ondansétron a été significativement augmentée et les concentrations sanguines d'ondansétron ont diminué. Cependant, sur la base des données disponibles, aucun ajustement posologique de ZOFRAN 8 mg n'est recommandé chez les patients prenant ces médicaments [voir PHARMACOLOGIE CLINIQUE ].
Tramadol
Bien qu'aucune interaction médicamenteuse pharmacocinétique entre l'ondansétron et le tramadol n'ait été observée, les données de 2 petits essais indiquent que, lorsqu'ils sont utilisés ensemble, ZOFRAN 8 mg peut augmenter l'administration de tramadol contrôlée par le patient. Surveiller les patients pour assurer un contrôle adéquat de la douleur lorsque l'ondansétron est administré avec le tramadol.
Chimiothérapie
La carmustine, l'étoposide et le cisplatine n'affectent pas la pharmacocinétique de l'ondansétron.
Dans un essai croisé mené auprès de 76 patients pédiatriques, l'ondansétron intraveineux n'a pas augmenté les concentrations systémiques de méthotrexate à forte dose.
Alfentanil Et Atracurium
ZOFRAN 4mg ne modifie pas les effets dépresseurs respiratoires produits par l'alfentanil ni le degré de blocage neuromusculaire produit par l'atracurium. Les interactions avec les anesthésiques généraux ou locaux n'ont pas été étudiées.
Toxicomanie et dépendance
Des études animales ont montré que l'ondansétron n'est pas considéré comme une benzodiazépine et qu'il ne remplace pas les benzodiazépines dans les études de dépendance directe.
AVERTISSEMENTS
Inclus dans le cadre du PRÉCAUTIONS section.
PRÉCAUTIONS
Réactions d'hypersensibilité
Des réactions d'hypersensibilité, y compris anaphylaxie et bronchospasme, ont été signalées chez des patients ayant présenté une hypersensibilité à d'autres antagonistes sélectifs des récepteurs 5-HT3. Si des réactions d'hypersensibilité se produisent, arrêtez l'utilisation de ZOFRAN ; traiter rapidement selon la norme de soins et surveiller jusqu'à ce que les signes et les symptômes disparaissent [voir CONTRE-INDICATIONS ].
Allongement de l'intervalle QT
Des modifications de l'électrocardiogramme (ECG), y compris un allongement de l'intervalle QT, ont été observées chez des patients recevant de l'ondansétron. De plus, des cas post-commercialisation de Torsade de Pointes ont été rapportés chez des patients utilisant ZOFRAN. Éviter ZOFRAN 8 mg chez les patients atteints du syndrome du QT long congénital. Une surveillance ECG est recommandée chez les patients présentant des anomalies électrolytiques (par exemple, hypokaliémie ou hypomagnésémie), une insuffisance cardiaque congestive, des bradyarythmies ou des patients prenant d'autres médicaments entraînant un allongement de l'intervalle QT [voir PHARMACOLOGIE CLINIQUE ].
Syndrome sérotoninergique
Le développement d'un syndrome sérotoninergique a été rapporté avec les antagonistes des récepteurs 5-HT3 seuls. La plupart des rapports ont été associés à l'utilisation concomitante de médicaments sérotoninergiques (p. ex., inhibiteurs sélectifs de la recapture de la sérotonine (ISRS), inhibiteurs de la recapture de la sérotonine et de la noradrénaline (IRSN), inhibiteurs de la monoamine oxydase, mirtazapine, fentanyl, lithium, tramadol et bleu de méthylène intraveineux). Certains des cas signalés ont été mortels. Un syndrome sérotoninergique survenant avec un surdosage de ZOFRAN 4 mg seul a également été rapporté. La majorité des déclarations de syndrome sérotoninergique lié à l'utilisation d'antagonistes des récepteurs 5-HT3 sont survenues dans une unité de soins post-anesthésiques ou un centre de perfusion.
Les symptômes associés au syndrome sérotoninergique peuvent inclure la combinaison suivante de signes et de symptômes : modifications de l'état mental (p. ex., agitation, hallucinations, délire et coma), instabilité autonome (p. ex., tachycardie, tension artérielle labile, étourdissements, diaphorèse, bouffées vasomotrices, hyperthermie) , symptômes neuromusculaires (p. ex., tremblements, rigidité, myoclonie, hyperréflexie, incoordination), convulsions, avec ou sans symptômes gastro-intestinaux (p. ex., nausées, vomissements, diarrhée). Les patients doivent être surveillés pour détecter l'apparition d'un syndrome sérotoninergique, en particulier en cas d'utilisation concomitante de ZOFRAN 4 mg et d'autres médicaments sérotoninergiques. Si des symptômes de syndrome sérotoninergique apparaissent, interrompez ZOFRAN et initiez un traitement de soutien. Les patients doivent être informés du risque accru de syndrome sérotoninergique, en particulier si ZOFRAN est utilisé en concomitance avec d'autres médicaments sérotoninergiques [voir INTERACTIONS MÉDICAMENTEUSES , SURDOSAGE ].
Masquage de l'iléus progressif et de la distension gastrique
L'utilisation de ZOFRAN chez les patients après une chirurgie abdominale ou chez les patients souffrant de nausées et de vomissements induits par la chimiothérapie peut masquer un iléus progressif et/ou une distension gastrique. Surveiller la diminution de l'activité intestinale, en particulier chez les patients présentant des facteurs de risque d'obstruction gastro-intestinale.
ZOFRAN 8mg n'est pas un médicament stimulant le péristaltisme gastrique ou intestinal. Il ne doit pas être utilisé à la place de l'aspiration nasogastrique.
Phénylcétonurie
Les patients phénylcétonuriques doivent être informés que les comprimés à dissolution orale ZOFRAN ODT contiennent de la phénylalanine (un composant de l'aspartame). Chaque comprimé à dissolution orale de 4 mg et 8 mg contient moins de 0,03 mg de phénylalanine.
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Aucun effet cancérigène n'a été observé dans les études de 2 ans chez le rat et la souris avec des doses orales d'ondansétron allant jusqu'à 10 mg/kg par jour et 30 mg/kg par jour, respectivement (environ 4 et 6 fois la dose orale humaine maximale recommandée de 24 mg par jour, en fonction de la surface corporelle).
L'ondansétron n'était pas mutagène dans les tests standard de mutagénicité.
L'administration orale d'ondansétron jusqu'à 15 mg/kg par jour (environ 6 fois la dose orale humaine maximale recommandée de 24 mg par jour, basée sur la surface corporelle) n'a pas affecté la fertilité ou la performance reproductive générale des rats mâles et femelles.
Utilisation dans des populations spécifiques
Grossesse
Résumé des risques
Les études épidémiologiques publiées sur l'association entre l'utilisation de l'ondansétron et les malformations congénitales majeures ont rapporté des résultats incohérents et ont d'importantes limites méthodologiques qui empêchent de tirer des conclusions sur la sécurité de l'utilisation de l'ondansétron pendant la grossesse (voir Données ). Les données post-commercialisation disponibles n'ont pas identifié de risque de fausse couche ou de résultats maternels indésirables associés au médicament. Les études de reproduction chez le rat et le lapin n'ont pas mis en évidence de danger pour le fœtus lorsque l'ondansétron a été administré pendant l'organogenèse à environ 6 et 24 fois la dose orale humaine maximale recommandée de 24 mg/jour, en fonction de la surface corporelle, respectivement (voir Données ).
Le risque de fond de malformations congénitales majeures et de fausse couche pour la population indiquée est inconnu. Toutes les grossesses ont un risque de fond de malformation congénitale, de fausses couches ou d'autres résultats indésirables. Dans la population générale des États-Unis, le risque de fond estimé de malformations congénitales majeures et de fausses couches dans les grossesses cliniquement reconnues est de 2 % à 4 % et de 15 % à 20 %, respectivement.
Données
Données humaines
Les données disponibles sur l'utilisation de l'ondansétron chez les femmes enceintes provenant de plusieurs études épidémiologiques publiées excluent une évaluation d'un risque associé au médicament d'issues fœtales indésirables en raison d'importantes limitations méthodologiques, y compris l'incertitude quant à savoir si les femmes qui ont rempli une ordonnance ont effectivement pris le médicament, l'utilisation concomitante d'autres médicaments ou traitements, biais de rappel et autres facteurs de confusion non ajustés.
L'exposition à l'ondansétron in utero n'a pas été associée à des malformations congénitales majeures globales dans les analyses globales. Une vaste étude de cohorte rétrospective a examiné 1 970 femmes ayant reçu une ordonnance d'ondansétron pendant la grossesse et n'a signalé aucune association entre l'exposition à l'ondansétron et les malformations congénitales majeures, les fausses couches, les mortinaissances, les accouchements prématurés, les nourrissons de faible poids à la naissance ou les nourrissons petits pour l'âge gestationnel.
Deux grandes études de cohorte rétrospectives et une étude cas-témoins ont évalué l'exposition à l'ondansétron au cours du premier trimestre et le risque de malformations cardiovasculaires avec des résultats incohérents. Les risques relatifs (RR) variaient de 0,97 (IC à 95 % 0,86 à 1,10) à 1,62 (IC à 95 % 1,04, 2,54). Une analyse de sous-ensemble dans l'une des études de cohorte a observé que l'ondansétron était spécifiquement associé à des malformations septales cardiaques (RR 2,05, IC à 95 % 1,19, 3,28) ; cependant, cette association n'a pas été confirmée dans d'autres études.
Plusieurs études ont évalué l'ondansétron et le risque de fentes buccales avec des résultats incohérents. Une étude de cohorte rétrospective de 1,8 million de grossesses dans la base de données Medicaid des États-Unis a montré un risque accru de fentes buccales parmi 88 467 grossesses au cours desquelles de l'ondansétron oral a été prescrit au cours du premier trimestre (RR 1,24, IC à 95 % 1,03, 1,48), mais aucune association de ce type n'a été observée. rapporté avec l'ondansétron intraveineux dans 23 866 grossesses (RR 0,95, IC à 95 % 0,63, 1,43). Dans le sous-groupe de femmes ayant reçu les deux formes d'administration, le RR était de 1,07 (IC à 95 % 0,59, 1,93). Deux études cas-témoins, utilisant des données de programmes de surveillance des malformations congénitales, ont rapporté des associations contradictoires entre l'utilisation maternelle de l'ondansétron et une fente palatine isolée (OR 1,6 [IC à 95 % 1,1, 2,3] et 0,5 [IC à 95 % 0,3, 1,0]). On ne sait pas si l'exposition à l'ondansétron in utero dans les cas de fente palatine s'est produite au moment de la formation du palais (le palais se forme entre la 6e et la 9e semaine de grossesse).
Données animales
Dans les études de développement embryo-fœtal chez le rat et le lapin, les femelles gravides ont reçu des doses orales d'ondansétron allant jusqu'à 15 mg/kg/jour et 30 mg/kg/jour, respectivement, pendant la période d'organogénèse. À l'exception d'une légère diminution du gain de poids maternel chez les lapins, il n'y a eu aucun effet significatif de l'ondansétron sur les mères ou sur le développement de la progéniture. À des doses de 15 mg/kg/jour chez le rat et de 30 mg/kg/jour chez le lapin, la marge d'exposition maternelle était d'environ 6 et 24 fois la dose orale humaine maximale recommandée de 24 mg/jour, respectivement, en fonction de la surface corporelle. .
Dans une étude de toxicité sur le développement pré et postnatal, des rats gravides ont reçu des doses orales d'ondansétron allant jusqu'à 15 mg/kg/jour du jour 17 de la grossesse au jour 21 de la portée. À l'exception d'une légère réduction du gain de poids corporel maternel, il y avait aucun effet sur les rates gravides et le développement prénatal et postnatal de leur progéniture, y compris les performances de reproduction de la génération F1 accouplée. À une dose de 15 mg/kg/jour chez le rat, la marge d'exposition maternelle était d'environ 6 fois la dose orale humaine maximale recommandée de 24 mg/jour, basée sur la surface corporelle.
Lactation
Résumé des risques
On ne sait pas si l'ondansétron est présent dans le lait maternel. Il n'y a pas de données sur les effets de ZOFRAN 8 mg sur le nourrisson allaité ou sur les effets sur la production de lait. Cependant, il a été démontré que l'ondansétron est présent dans le lait des rats. Lorsqu'un médicament est présent dans le lait animal, il est probable que le médicament sera présent dans le lait humain.
Les avantages de l'allaitement pour le développement et la santé doivent être pris en compte, ainsi que le besoin clinique de ZOFRAN 4 mg pour la mère et tout effet indésirable potentiel sur le nourrisson allaité de ZOFRAN ou de l'affection maternelle sous-jacente.
Utilisation pédiatrique
L'innocuité et l'efficacité de ZOFRAN administré par voie orale ont été établies chez les patients pédiatriques de 4 ans et plus pour la prévention des nausées et des vomissements associés à la chimiothérapie anticancéreuse modérément émétisante. L'utilisation de ZOFRAN 4 mg dans ces tranches d'âge est étayée par des preuves issues d'études adéquates et bien contrôlées de ZOFRAN chez des adultes avec des données supplémentaires provenant de 3 essais ouverts, non contrôlés et non américains chez 182 patients pédiatriques âgés de 4 à 18 ans atteints de cancer qui ont reçu une variété de régimes cisplatine ou non cisplatine [voir DOSAGE ET ADMINISTRATION , Etudes cliniques ].
Des informations supplémentaires sur l'utilisation de l'ondansétron chez les patients pédiatriques peuvent être trouvées dans les informations de prescription de ZOFRAN Injection.
L'innocuité et l'efficacité de ZOFRAN 4 mg administré par voie orale n'ont pas été établies chez les patients pédiatriques pour :
- prévention des nausées et vomissements associés à la chimiothérapie anticancéreuse hautement émétisante
- prévention des nausées et vomissements associés à la radiothérapie
- prévention des nausées et/ou vomissements postopératoires
Utilisation gériatrique
Sur le nombre total de sujets inscrits dans des essais cliniques contrôlés aux États-Unis et à l'étranger, pour lesquels des analyses de sous-groupes ont été effectuées, 938 (19 %) étaient âgés de 65 ans et plus.
Aucune différence globale d'innocuité ou d'efficacité n'a été observée entre les sujets de 65 ans et les sujets plus âgés et les sujets plus jeunes. Une réduction de la clairance et une augmentation de la demi-vie d'élimination ont été observées chez les patients âgés de plus de 75 ans par rapport aux sujets plus jeunes [voir PHARMACOLOGIE CLINIQUE ]. Le nombre de patients âgés de plus de 75 ans et plus dans les essais cliniques était insuffisant pour permettre de tirer des conclusions sur l'innocuité ou l'efficacité dans ce groupe d'âge. D'autres expériences cliniques rapportées n'ont pas identifié de différences dans les réponses entre les patients âgés et les patients plus jeunes, mais une plus grande sensibilité de certains individus plus âgés ne peut être exclue. Aucun ajustement posologique n'est nécessaire chez les patients âgés.
Insuffisance hépatique
Aucun ajustement posologique n'est nécessaire chez les patients présentant une insuffisance hépatique légère ou modérée.
Chez les patients atteints d'insuffisance hépatique sévère, la clairance est réduite et le volume apparent de distribution est augmenté, entraînant une augmentation significative de la demi-vie de l'ondansétron. Par conséquent, ne pas dépasser une dose quotidienne totale de 8 mg chez les patients présentant une insuffisance hépatique sévère (score de Child-Pugh de 10 ou plus) [voir DOSAGE ET ADMINISTRATION , PHARMACOLOGIE CLINIQUE ].
Insuffisance rénale
Aucun ajustement posologique n'est recommandé chez les patients présentant un degré quelconque d'insuffisance rénale (légère, modérée ou sévère). Il n'y a pas d'expérience au-delà de l'administration d'ondansétron le premier jour [voir PHARMACOLOGIE CLINIQUE ].
SURDOSAGE
Il n'existe pas d'antidote spécifique en cas de surdosage d'ondansétron. Les patients doivent être pris en charge avec une thérapie de soutien appropriée.
En plus des effets indésirables énumérés ci-dessus, les effets indésirables suivants ont été décrits dans le cadre d'un surdosage d'ondansétron : une « cécité soudaine » (amaurose) d'une durée de 2 à 3 minutes plus une constipation sévère est survenue chez un patient qui a reçu 72 mg d'ondansétron par voie intraveineuse en dose unique. Une hypotension (et des évanouissements) sont survenues chez un patient qui avait pris 48 mg de comprimés ZOFRAN. Après une perfusion de 32 mg sur une période de 4 minutes seulement, un épisode vasovagal avec bloc cardiaque transitoire du deuxième degré a été observé. Dans tous les cas, les effets indésirables ont complètement disparu.
Des cas pédiatriques compatibles avec le syndrome sérotoninergique ont été signalés après des surdoses orales accidentelles d'ondansétron (dépassant l'ingestion estimée de 5 mg par kg) chez de jeunes enfants. Les symptômes signalés comprenaient la somnolence, l'agitation, la tachycardie, la tachypnée, l'hypertension, les bouffées vasomotrices, la mydriase, la diaphorèse, les mouvements myocloniques, le nystagmus horizontal, l'hyperréflexie et les convulsions. Les patients ont nécessité des soins de support, y compris une intubation dans certains cas, avec une guérison complète sans séquelles en 1 à 2 jours.
CONTRE-INDICATIONS
ZOFRAN est contre-indiqué chez les patients :
- hypersensibilité connue (par exemple, anaphylaxie) à l'ondansétron ou à l'un des composants de la formulation [voir EFFETS INDÉSIRABLES ]
- recevant de l'apomorphine en concomitance en raison du risque d'hypotension profonde et de perte de conscience
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
L'ondansétron est un antagoniste sélectif des récepteurs 5-HT3. Bien que son mécanisme d'action n'ait pas été entièrement caractérisé, l'ondansétron n'est pas un antagoniste des récepteurs dopaminergiques. Les récepteurs de la sérotonine de type 5-HT3 sont présents à la fois périphériquement sur les terminaisons nerveuses vagales et centralement dans la zone de déclenchement des chimiorécepteurs de l'area postrema. Il n'est pas certain que l'action antiémétique de l'ondansétron soit médiée centralement, périphériquement ou dans les deux sites. Cependant, la chimiothérapie cytotoxique semble être associée à la libération de sérotonine par les cellules entérochromaffines de l'intestin grêle. Chez l'homme, l'excrétion urinaire d'acide 5-hydroxyindoleacétique (5-HIAA) augmente après l'administration de cisplatine parallèlement à l'apparition des vomissements. La sérotonine libérée peut stimuler les afférences vagales via les récepteurs 5-HT3 et initier le réflexe de vomissement.
Pharmacodynamie
Chez des sujets sains, des doses intraveineuses uniques de 0,15 mg/kg d'ondansétron n'ont eu aucun effet sur la motilité œsophagienne, la motilité gastrique, la pression du sphincter œsophagien inférieur ou le temps de transit de l'intestin grêle. Il a été démontré que l'administration d'ondansétron sur plusieurs jours ralentit le transit colique chez les sujets sains. L'ondansétron n'a aucun effet sur les concentrations plasmatiques de prolactine.
Électrophysiologie cardiaque
L'allongement de l'intervalle QTc a été étudié dans un essai croisé à double insu, à dose intraveineuse unique, contrôlé par placebo et positif, chez 58 sujets sains. La différence moyenne maximale (limite de confiance supérieure à 95 %) du QTcF par rapport au placebo après correction de la ligne de base était de 19,5 (21,8) millisecondes et de 5,6 (7,4) millisecondes après des perfusions intraveineuses de 15 minutes de 32 mg et 8 mg d'injection d'ondansétron, respectivement. Une relation exposition-réponse significative a été identifiée entre la concentration d'ondansétron et le ΔΔQTcF. En utilisant la relation exposition-réponse établie, 24 mg perfusés par voie intraveineuse sur 15 minutes avaient un ΔΔQTcF moyen prédit (intervalle de prédiction supérieur à 95 %) de 14,0 (16,3) millisecondes. En revanche, 16 mg perfusés par voie intraveineuse sur 15 minutes en utilisant le même modèle avaient un ΔΔQTcF prédit moyen (intervalle de prédiction supérieur à 95 %) de 9,1 (11,2) millisecondes. Dans cette étude, la dose de 8 mg perfusée pendant 15 minutes n'a pas prolongé l'intervalle QT de manière cliniquement pertinente.
Pharmacocinétique
Absorption
L'ondansétron est absorbé par le tractus gastro-intestinal et subit un certain métabolisme de premier passage. La biodisponibilité moyenne chez les sujets sains, après administration d'un seul comprimé de 8 mg, est d'environ 56 %.
L'exposition systémique à l'ondansétron n'augmente pas proportionnellement à la dose. L'aire sous la courbe (ASC) d'un comprimé de 16 mg était supérieure de 24 % à celle prévue à partir d'une dose de comprimé de 8 mg. Cela peut refléter une certaine réduction du métabolisme de premier passage à des doses orales plus élevées.
Effets alimentaires
La biodisponibilité est également légèrement améliorée par la présence de nourriture.
Distribution
La liaison de l'ondansétron aux protéines plasmatiques, mesurée in vitro, était de 70 % à 76 % sur la plage de concentration de 10 à 500 ng/mL. Le médicament circulant se distribue également dans les érythrocytes.
Élimination
Métabolisme et excrétion
L'ondansétron est largement métabolisé chez l'homme, environ 5 % d'une dose radiomarquée étant récupérée sous forme de composé d'origine dans l'urine. Les métabolites sont observés dans l'urine. La voie métabolique principale est l'hydroxylation sur le cycle indole suivie d'une conjugaison ultérieure de glucuronide ou de sulfate.
Des études de métabolisme in vitro ont montré que l'ondansétron est un substrat des enzymes du cytochrome hépatique humain P-450, y compris CYP1A2, CYP2D6 et CYP3A4. En termes de renouvellement global de l'ondansétron, le CYP3A4 a joué le rôle prédominant. En raison de la multiplicité des enzymes métaboliques capables de métaboliser l'ondansétron, il est probable que l'inhibition ou la perte d'une enzyme (par exemple, le déficit génétique en CYP2D6) soit compensée par d'autres et puisse entraîner peu de changement dans les taux globaux d'élimination de l'ondansétron.
Bien que certains métabolites non conjugués aient une activité pharmacologique, ceux-ci ne se retrouvent pas dans le plasma à des concentrations susceptibles de contribuer de manière significative à l'activité biologique de l'ondansétron.
Populations spécifiques
Âge : population gériatrique
Une réduction de la clairance et une augmentation de la demi-vie d'élimination sont observées chez les patients âgés de plus de 75 ans par rapport aux sujets plus jeunes [voir Utilisation dans des populations spécifiques ].
Sexe
Des différences entre les sexes ont été montrées dans la disposition de l'ondansétron administré en une seule dose. L'ampleur et le taux d'absorption sont plus élevés chez les femmes que chez les hommes. Une clairance plus lente chez les femmes, un volume de distribution apparent plus petit (ajusté en fonction du poids) et une biodisponibilité absolue plus élevée ont entraîné des concentrations plasmatiques d'ondansétron plus élevées. Ces concentrations plasmatiques plus élevées peuvent en partie s'expliquer par des différences de poids corporel entre les hommes et les femmes. On ne sait pas si ces différences liées au sexe étaient cliniquement importantes. Des informations pharmacocinétiques plus détaillées sont contenues dans les tableaux 5 et 6.
Insuffisance rénale
L'insuffisance rénale ne devrait pas influencer significativement la clairance totale de l'ondansétron car la clairance rénale ne représente que 5 % de la clairance globale. Cependant, la clairance plasmatique moyenne de l'ondansétron a été réduite d'environ 50 % chez les patients présentant une insuffisance rénale sévère (clairance de la créatinine inférieure à 30 mL/min). La réduction de la clairance était variable et non compatible avec une augmentation de la demi-vie [voir Utilisation dans des populations spécifiques ].
Insuffisance hépatique
Chez les patients atteints d'insuffisance hépatique légère à modérée, la clairance est réduite de 2 fois et la demi-vie moyenne est augmentée à 11,6 heures contre 5,7 heures chez les sujets sains. Chez les patients atteints d'insuffisance hépatique sévère (score de Child-Pugh supérieur ou égal à 10), la clairance est réduite de 2 à 3 fois et le volume apparent de distribution est augmenté, ce qui entraîne une augmentation de la demi-vie à 20 heures [voir DOSAGE ET ADMINISTRATION , Utilisation dans des populations spécifiques ].
Études sur les interactions médicamenteuses
Inducteurs du CYP 3A4
L'élimination de l'ondansétron peut être affectée par les inducteurs du cytochrome P-450. Dans un essai pharmacocinétique de 16 patients épileptiques maintenus chroniquement sous inducteurs du CYP3A4, carbamazépine ou phénytoïne, une réduction de l'ASC, de la Cmax et de la t½ de l'ondansétron a été observée. Cela a entraîné une augmentation significative de la clairance de l'ondansétron. Cependant, cette augmentation n'est pas considérée comme cliniquement pertinente [voir INTERACTIONS MÉDICAMENTEUSES ].
Agents chimiothérapeutiques
La carmustine, l'étoposide et le cisplatine n'affectent pas la pharmacocinétique de l'ondansétron [voir INTERACTIONS MÉDICAMENTEUSES ].
Antiacides
L'administration concomitante d'antiacides ne modifie pas l'absorption de l'ondansétron.
Etudes cliniques
Prévention des nausées et des vomissements induits par la chimiothérapie
Chimiothérapie hautement émétisante
Dans 2 essais randomisés, en double aveugle, en monothérapie, une dose orale unique de 24 mg de ZOFRAN était supérieure à un contrôle placebo historique pertinent dans la prévention des nausées et vomissements associés à une chimiothérapie anticancéreuse hautement émétisante, y compris le cisplatine supérieur ou égal à 50 mg/m². L'administration de stéroïdes a été exclue de ces essais cliniques. Plus de 90% des patients recevant une dose de cisplatine supérieure ou égale à 50 mg/m² dans le comparateur historique-placebo, ont présenté des vomissements en l'absence de traitement antiémétique.
Le premier essai a comparé des doses orales d'ondansétron de 24 mg en dose unique, 8 mg toutes les 8 heures pour 2 doses et 32 mg en dose unique chez 357 patients cancéreux adultes recevant des régimes de chimiothérapie contenant du cisplatine supérieur ou égal à 50 mg/m². . La première dose ou dose unique a été administrée 30 minutes avant la chimiothérapie. Au total, 66 % des patients du groupe ondansétron 24 mg une fois par jour, 55 % du groupe ondansétron 8 mg deux fois par jour et 55 % du groupe ondansétron 32 mg une fois par jour ont terminé la période d'essai de 24 heures avec 0 épisode émétique et aucun médicament antiémétique de secours, le principal critère d'évaluation de l'efficacité. Chacun des 3 groupes de traitement s'est avéré statistiquement significativement supérieur à un contrôle placebo historique.
Dans le même essai, 56 % des patients recevant une dose orale unique de 24 mg d'ondansétron n'ont ressenti aucune nausée au cours de la période d'essai de 24 heures, contre 36 % des patients du groupe recevant l'ondansétron par voie orale 8 mg deux fois par jour ( P = 0,001) et 50 % dans le groupe ondansétron oral 32 mg une fois par jour. Les schémas posologiques de ZOFRAN 8 mg deux fois par jour et 32 mg une fois par jour ne sont pas recommandés pour la prévention des nausées et des vomissements associés à une chimiothérapie hautement émétisante [voir DOSAGE ET ADMINISTRATION ].
Dans un deuxième essai, l'efficacité d'une dose orale unique de 24 mg de ZOFRAN 4 mg pour la prévention des nausées et vomissements associés à une chimiothérapie anticancéreuse hautement émétisante, y compris cisplatine supérieure ou égale à 50 mg/m², a été confirmée.
Chimiothérapie modérément émétisante
Un essai randomisé, contrôlé par placebo et en double aveugle a été mené aux États-Unis chez 67 patients recevant un régime de chimiothérapie à base de cyclophosphamide contenant de la doxorubicine. La première dose de 8 mg de ZOFRAN 8 mg a été administrée 30 minutes avant le début de la chimiothérapie, avec une dose suivante 8 heures après la première dose, suivie de 8 mg de ZOFRAN 8 mg deux fois par jour pendant 2 jours après la fin de la chimiothérapie.ZOFRAN était significativement plus efficace que le placebo pour prévenir les vomissements. La réponse au traitement était basée sur le nombre total d'épisodes émétiques au cours de la période d'essai de 3 jours. Les résultats de cet essai sont résumés dans le tableau 7.
Dans un essai américain en double aveugle chez 336 patients recevant une chimiothérapie à base de cyclophosphamide contenant soit du méthotrexate soit de la doxorubicine, ZOFRAN 8 mg administré deux fois par jour s'est avéré aussi efficace que ZOFRAN 8 mg administré 3 fois par jour pour prévenir les nausées et les vomissements. ZOFRAN 8 mg trois fois par jour n'est pas un schéma posologique recommandé pour le traitement d'une chimiothérapie modérément émétisante [voir DOSAGE ET ADMINISTRATION ].
La réponse au traitement était basée sur le nombre total d'épisodes émétiques au cours de la période d'essai de 3 jours. Voir le tableau 8 pour les détails des schémas posologiques étudiés et les résultats de cet essai.
Retraitement
Dans des essais à un seul bras, 148 patients recevant une chimiothérapie à base de cyclophosphamide ont été retraités par ZOFRAN 8 mg trois fois par jour au cours d'une chimiothérapie ultérieure pour un total de 396 cycles de retraitement. Aucun épisode émétique n'est survenu dans 314 (79 %) des cycles de retraitement, et seulement 1 à 2 épisodes émétiques sont survenus dans 43 (11 %) des cycles de retraitement.
Essais pédiatriques
Trois essais ouverts, à un seul bras, non américains ont été réalisés avec 182 patients pédiatriques âgés de 4 à 18 ans atteints d'un cancer qui ont reçu une variété de schémas posologiques cisplatine ou non cisplatine. La dose initiale de ZOFRAN 4 mg injectable variait de 0,04 à 0,87 mg par kg (dose totale de 2,16 mg à 12 mg) suivie de l'administration de doses orales de ZOFRAN 4 mg allant de 4 à 24 mg par jour pendant 3 jours. Dans ces essais, 58 % des 170 patients évaluables ont présenté une réponse complète (pas d'épisodes émétiques) au jour 1. Dans 2 essais, les taux de réponse à ZOFRAN 4 mg trois fois par jour chez les patients de moins de 12 ans étaient similaires à ceux de ZOFRAN 8 mg trois fois par jour chez les patients de 12 à 18 ans. La prévention des vomissements chez ces patients pédiatriques était essentiellement la même que chez les adultes.
Nausées et vomissements radio-induits
Irradiation corporelle totale
Dans un essai randomisé, contrôlé par placebo, en double aveugle chez 20 patients, 8 mg de ZOFRAN administrés 1,5 heure avant chaque fraction de radiothérapie pendant 4 jours ont été significativement plus efficaces que le placebo pour prévenir les vomissements induits par une irradiation corporelle totale. L'irradiation corporelle totale consistait en 11 fractions (120 cGy par fraction) sur 4 jours pour un total de 1 320 cGy. Les patients ont reçu 3 fractions pendant 3 jours, puis 2 fractions le jour 4.
Radiothérapie fractionnée à dose élevée unique
Dans un essai en double aveugle contre comparateur actif chez 105 patients recevant une radiothérapie unique à forte dose (800 à 1 000 cGy) sur un champ antérieur ou postérieur de taille supérieure ou égale à 80 cm² par rapport à l'abdomen, ZOFRAN 4 mg a été significativement plus efficace que le métoclopramide en ce qui concerne le contrôle complet des vomissements (0 épisode émétique). Les patients ont reçu la première dose de ZOFRAN (8 mg) ou de métoclopramide (10 mg) 1 à 2 heures avant la radiothérapie. Si la radiothérapie était administrée le matin, 8 mg de ZOFRAN 8 mg ou 10 mg de métoclopramide étaient administrés en fin d'après-midi et répétés avant le coucher. Si la radiothérapie était administrée l'après-midi, les patients prenaient 8 mg de ZOFRAN 4 mg ou 10 mg de métoclopramide une seule fois avant le coucher. Les patients ont continué les doses de médicaments par voie orale trois fois par jour pendant 3 jours.
Radiothérapie quotidienne fractionnée
Dans un essai en double aveugle contre comparateur actif chez 135 patients recevant un traitement de 1 à 4 semaines de radiothérapie fractionnée (doses de 180 cGy) sur une taille de champ supérieure ou égale à 100 cm² jusqu'à l'abdomen, ZOFRAN 4 mg a été significativement plus efficace que la prochlorpérazine en ce qui concerne le contrôle complet des vomissements (0 épisode émétique). Les patients ont reçu la première dose de ZOFRAN (8 mg) ou de prochlorpérazine (10 mg) 1 à 2 heures avant la première fraction de radiothérapie quotidienne, avec des doses ultérieures de 8 mg environ toutes les 8 heures chaque jour de radiothérapie.
Nausées et vomissements postopératoires
Dans 2 essais contrôlés par placebo en double aveugle (l'un mené aux États-Unis et l'autre en dehors des États-Unis) chez 865 femmes subissant des interventions chirurgicales en milieu hospitalier, ZOFRAN 16 mg en dose unique ou un placebo a été administré une heure avant l'induction d'un traitement général équilibré. sous anesthésie (barbiturique, opioïde, protoxyde d'azote, blocage neuromusculaire et isoflurane ou enflurane supplémentaire), les comprimés ZOFRAN ont été significativement plus efficaces que le placebo pour prévenir les nausées et les vomissements postopératoires.
Aucun essai n'a été réalisé chez les hommes.
INFORMATIONS PATIENTS
Allongement de l'intervalle QT
Informez les patients que ZOFRAN peut provoquer des arythmies cardiaques graves, telles qu'un allongement de l'intervalle QT. Demandez aux patients d'informer immédiatement leur fournisseur de soins de santé s'ils perçoivent un changement dans leur fréquence cardiaque, s'ils se sentent étourdis ou s'ils ont un épisode de syncope [voir AVERTISSEMENTS ET PRECAUTIONS ].
Réactions d'hypersensibilité
Informez les patients que ZOFRAN 4 mg peut provoquer des réactions d'hypersensibilité, certaines aussi graves que l'anaphylaxie et le bronchospasme. Demandez aux patients de signaler immédiatement à leur professionnel de la santé tout signe et symptôme de réaction d'hypersensibilité, y compris fièvre, frissons, éruption cutanée ou problèmes respiratoires [voir AVERTISSEMENTS ET PRECAUTIONS ].
Masquage de l'iléus progressif et de la distension gastrique
Informer les patients après une chirurgie abdominale ou ceux souffrant de nausées et de vomissements induits par la chimiothérapie que ZOFRAN 4 mg peut masquer les signes et symptômes d'occlusion intestinale. Demandez aux patients de signaler immédiatement tout signe ou symptôme compatible avec une occlusion intestinale potentielle à leur fournisseur de soins de santé [voir AVERTISSEMENTS ET PRECAUTIONS ].
Interactions médicamenteuses
- Demandez au patient de signaler l'utilisation de tous les médicaments, en particulier l'apomorphine, à son fournisseur de soins de santé. L'utilisation concomitante d'apomorphine et de ZOFRAN peut entraîner une baisse significative de la tension artérielle et une perte de conscience.
- Informer les patients de la possibilité d'un syndrome sérotoninergique lors de l'utilisation concomitante de ZOFRAN 8 mg et d'un autre agent sérotoninergique, tel que des médicaments pour traiter la dépression et les migraines. Conseillez aux patients de consulter immédiatement un médecin si les symptômes suivants apparaissent : modifications de l'état mental, instabilité autonome, symptômes neuromusculaires avec ou sans symptômes gastro-intestinaux [voir AVERTISSEMENTS ET PRECAUTIONS ].
Administration de comprimés à désintégration orale ZOFRAN 4mg ODT
Demandez aux patients de ne pas retirer les comprimés à dissolution orale de ZOFRAN 4 mg ODT de la plaquette jusqu'au moment de l'administration.
- N'essayez pas de pousser les comprimés à désintégration orale ZOFRAN 8 mg ODT à travers le support en aluminium.
- Avec les mains sèches, décollez la feuille d'aluminium de 1 blister et retirez délicatement le comprimé.
- Placez immédiatement le comprimé à dissolution orale ZOFRAN ODT sur le dessus de la langue où il se dissoudra en quelques secondes, puis avalez-le avec de la salive.
- L'administration avec du liquide n'est pas nécessaire.
- Des autocollants illustrés pelables sont apposés sur le carton du produit qui peut être fourni avec l'ordonnance pour garantir une utilisation et une manipulation correctes du produit.
