Hydrea 500mg Hydroxyurea Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce qu'Hydrea 500 mg et comment est-il utilisé ?
Hydrea (hydroxyurée) est un agent antinéoplasique (anticancéreux) utilisé pour traiter le mélanome, la leucémie myéloïde chronique résistante et le carcinome récurrent, métastatique ou inopérable de l'ovaire et les carcinomes épidermoïdes primitifs de la tête et du cou. Hydrea est disponible sous forme générique.
Quels sont les effets secondaires d'Hydrea ?
Les effets secondaires courants d'Hydrea comprennent :
- nausée,
- vomissement,
- maux d'estomac,
- diarrhée,
- constipation,
- changements cutanés tels que desquamation ou décoloration,
- symptômes pseudo-grippaux,
- chute de cheveux,
- éruption,
- mal de tête,
- vertiges,
- somnolence ou
- gain de poids.
Les effets secondaires graves d'Hydrea comprennent :
- anémie,
- la myélosuppression, et
- leucémie.
LA DESCRIPTION
HYDREA (capsules d'hydroxyurée, USP) est un antimétabolite disponible pour usage oral sous forme de capsules contenant 500 mg d'hydroxyurée. Les ingrédients inactifs comprennent l'acide citrique, les colorants (D&C Yellow No. 10, FD&C Blue No. 1, FD&C Red No. 40 et D&C Red No. 28), la gélatine, le lactose, le stéarate de magnésium, le phosphate de sodium et le dioxyde de titane.
L'hydroxyurée est une poudre cristalline blanche à blanc cassé. Il est hygroscopique et librement soluble dans l'eau, mais pratiquement insoluble dans l'alcool. La formule empirique est CH4N2O2 et il a un poids moléculaire de 76,05. Sa formule structurale est :
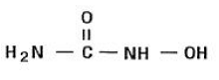
LES INDICATIONS
HYDREA 500mg est indiqué pour le traitement de :
- Leucémie myéloïde chronique résistante.
- Carcinomes épidermoïdes localement avancés de la tête et du cou (à l'exclusion de la lèvre) en association avec la chimioradiothérapie.
DOSAGE ET ADMINISTRATION
Informations sur le dosage
HYDREA est utilisé seul ou en association avec d'autres agents antitumoraux ou une radiothérapie pour traiter les maladies néoplasiques. Personnalisez le traitement en fonction du type de tumeur, de l'état de la maladie, de la réponse au traitement, des facteurs de risque du patient et des normes de pratique clinique actuelles.
Basez toutes les doses sur le poids réel ou idéal du patient, selon la valeur la moins élevée.
HYDREA est un médicament cytotoxique. Suivre les procédures spéciales applicables de manipulation et d'élimination [voir RÉFÉRENCES ].
Avalez les gélules d'HYDREA entières. NE PAS ouvrir, casser ou mâcher les gélules car HYDREA est un médicament cytotoxique.
L'administration prophylactique d'acide folique est recommandée [voir AVERTISSEMENTS ET PRECAUTIONS ].
Surveiller la numération globulaire au moins une fois par semaine pendant le traitement par HYDREA 500 mg. Une anémie sévère doit être corrigée avant de commencer le traitement par HYDREA.
Modifications de dose pour la toxicité
Surveillez les éléments suivants et réduisez la dose ou arrêtez HYDREA 500 mg en conséquence :
- Myélosuppression [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Vascularite cutanée [voir AVERTISSEMENTS ET PRECAUTIONS ]
Envisager des modifications de dose pour d'autres toxicités.
Modifications de dose pour l'insuffisance rénale
Réduire la dose d'HYDREA de 50 % chez les patients dont la clairance de la créatinine mesurée est inférieure à 60 mL/min ou qui présentent une insuffisance rénale terminale (IRT) [voir Utilisation dans des populations spécifiques et PHARMACOLOGIE CLINIQUE ].
Une surveillance étroite des paramètres hématologiques est conseillée chez ces patients.
COMMENT FOURNIE
Formes posologiques et points forts
Gélules
Capuchon vert opaque à 500 mg et corps rose opaque portant les inscriptions « HYDREA » et « 830 ».
Stockage et manutention
HYDREA® (capsules d'hydroxyurée, USP) est fourni sous forme de gélules de 500 mg dans des flacons en PEHD avec un bouchon à vis de sécurité en plastique. Chaque flacon contient 100 gélules.
Le chapeau est vert opaque et le corps est rose opaque. Les capsules sont imprimées sur les deux sections avec "HYDREA" et "830" à l'encre noire ( CDN 0003-0830-50).
Stockage
Conserver à 20-25°C (68-77°F); les excursions permises à 15°C-30°C (59°F-86°F) [voient USP la Température de Pièce Contrôlée]. Gardez bien fermé.
Manipulation et élimination
HYDREA 500mg est un médicament cytotoxique. Suivre les procédures spéciales applicables de manipulation et d'élimination [voir RÉFÉRENCES ].
Pour diminuer le risque de contact, conseiller au personnel soignant de porter des gants jetables lors de la manipulation d'HYDREA ou de flacons contenant de l'HYDREA. Se laver les mains à l'eau et au savon avant et après tout contact avec le flacon ou les gélules lors de la manipulation d'HYDREA. Ne pas ouvrir les gélules d'HYDREA 500mg. Éviter l'exposition aux gélules écrasées ou ouvertes. En cas de contact avec la peau de gélules écrasées ou ouvertes, laver immédiatement et abondamment la zone affectée avec de l'eau et du savon. En cas de contact avec des capsules écrasées ou ouvertes sur les yeux, la zone affectée doit être rincée abondamment avec de l'eau ou un collyre isotonique prévu à cet effet pendant au moins 15 minutes. Si la poudre de la gélule est renversée, essuyez-la immédiatement avec une serviette jetable humide et jetez-la dans un récipient fermé, tel qu'un sac en plastique ; tout comme les gélules vides. Les zones de déversement doivent ensuite être nettoyées trois fois à l'aide d'une solution détergente suivie d'eau propre. Gardez le médicament loin des enfants et des animaux domestiques. Contactez votre médecin pour savoir comment vous débarrasser des gélules périmées.
RÉFÉRENCES
OSHA. http://www.osha.gov/SLTC/hazardousdrugs/index.html.
Fabriqué pour : Bristol-Myers Squibb Company Princeton, New Jersey 08543 USA. Révisé : décembre 2020
EFFETS SECONDAIRES
Les effets indésirables cliniquement significatifs suivants sont décrits en détail dans d'autres sections de l'étiquetage :
- Myélosuppression [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Malignités [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Toxicités vasculitiques [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Risques liés à l'utilisation concomitante de médicaments antirétroviraux [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Rappel de rayonnement [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Macrocytose [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Toxicité pulmonaire [voir AVERTISSEMENTS ET PRECAUTIONS ]
Expérience post-commercialisation
Les effets indésirables suivants ont été identifiés lors de l'utilisation post-approbation d'HYDREA. Étant donné que ces réactions sont signalées volontairement par une population de taille incertaine, il n'est pas toujours possible d'estimer de manière fiable leur fréquence.
- Troubles de l'appareil reproducteur et des seins : azoospermie et oligospermie
- Problèmes gastro-intestinaux: stomatite, nausées, vomissements, diarrhée et constipation
- Troubles du métabolisme et de la nutrition : anorexie, syndrome de lyse tumorale
- Affections de la peau et du tissu sous-cutané : éruption maculopapuleuse, ulcération cutanée, lupus érythémateux cutané, modifications cutanées de type dermatomyosite, érythème périphérique et facial, hyperpigmentation, hyperpigmentation des ongles, atrophie de la peau et des ongles, desquamation, papules violettes et alopécie
- Troubles rénaux et urinaires : dysurie, élévations de l'acide sérique urique, de l'azote uréique sanguin (BUN) et des taux de créatinine
- Troubles du système nerveux : maux de tête, étourdissements, somnolence, désorientation, hallucinations et convulsions
- Troubles généraux : fièvre, frissons, malaise, œdème et asthénie
- Affections hépatobiliaires : élévation des enzymes hépatiques, cholestase et hépatite
- Troubles respiratoires : infiltrats pulmonaires diffus, dyspnée et fibrose pulmonaire, pneumopathie interstitielle, pneumonite, alvéolite, alvéolite allergique et toux
- Troubles immunitaires : le lupus érythémateux disséminé
- Hypersensibilité : Une fièvre d'origine médicamenteuse (pyrexie) (>39 °C, >102 °F) nécessitant une hospitalisation a été signalée en même temps que des manifestations gastro-intestinales, pulmonaires, musculosquelettiques, hépatobiliaires, dermatologiques ou cardiovasculaires. L'apparition s'est généralement produite dans les 6 semaines suivant l'initiation et s'est résolue à l'arrêt de l'hydroxyurée. Lors de la ré-administration, la fièvre est réapparue généralement dans les 24 heures.
Les effets indésirables observés avec l'hydroxyurée et la radiothérapie combinées sont similaires à ceux rapportés avec l'utilisation de l'hydroxyurée ou de la radiothérapie seule. Ces effets comprennent principalement une dépression de la moelle osseuse (anémie et leucopénie), une irritation gastrique et une mucosite. Presque tous les patients recevant une cure adéquate d'hydroxyurée et d'irradiation combinées présenteront une leucopénie concomitante. Une dépression plaquettaire (
INTERACTIONS MÉDICAMENTEUSES
Toxicité accrue avec l'utilisation concomitante de médicaments antirétroviraux
Pancréatite
Chez des patients infectés par le VIH au cours d'un traitement par hydroxyurée et didanosine, avec ou sans stavudine, des pancréatites mortelles et non mortelles sont survenues. L'hydroxyurée n'est pas indiquée pour le traitement de l'infection par le VIH ; cependant, si les patients infectés par le VIH sont traités par hydroxyurée, et en particulier en association avec la didanosine et/ou la stavudine, une surveillance étroite des signes et symptômes de pancréatite est recommandée. Interrompre définitivement le traitement par hydroxyurée chez les patients qui développent des signes et des symptômes de pancréatite.
Hépatotoxicité
Une hépatotoxicité et une insuffisance hépatique entraînant la mort ont été signalées au cours de la surveillance post-commercialisation chez des patients infectés par le VIH traités par l'hydroxyurée et d'autres médicaments antirétroviraux. Des événements hépatiques mortels ont été signalés le plus souvent chez des patients traités par l'association d'hydroxyurée, de didanosine et de stavudine. Évitez cette combinaison.
Neuropathie périphérique
Une neuropathie périphérique, sévère dans certains cas, a été rapportée chez des patients infectés par le VIH recevant de l'hydroxyurée en association avec des médicaments antirétroviraux, dont la didanosine, avec ou sans stavudine.
Interférence avec les tests de laboratoire
Interférence avec les dosages d'acide urique, d'urée ou d'acide lactique
Des études ont montré qu'il existe une interférence analytique de l'hydroxyurée avec les enzymes (uréase, uricase et lactate déshydrogénase) utilisées dans la détermination de l'urée, de l'acide urique et de l'acide lactique, ce qui donne des résultats faussement élevés chez les patients traités par hydroxyurée.
AVERTISSEMENTS
Inclus dans le cadre du "PRÉCAUTIONS" Section
PRÉCAUTIONS
Myélosuppression
L'hydroxyurée provoque une myélosuppression sévère. Le traitement par l'hydroxyurée ne doit pas être instauré si la fonction médullaire est fortement déprimée. Une suppression de la moelle osseuse peut survenir et la leucopénie est généralement sa première et la plus courante manifestation. La thrombocytopénie et l'anémie surviennent moins souvent et sont rarement observées sans leucopénie préalable. La dépression de la moelle osseuse est plus probable chez les patients qui ont déjà reçu une radiothérapie ou des agents chimiothérapeutiques anticancéreux cytotoxiques ; utiliser l'hydroxyurée avec prudence chez ces patients.
Évaluer l'état hématologique avant et pendant le traitement par HYDREA. Fournir des soins de soutien et modifier la dose ou arrêter HYDREA au besoin. La récupération de la myélosuppression est généralement rapide lorsque le traitement est interrompu.
Malignités
L'hydroxyurée est un cancérogène pour l'homme. Chez les patients recevant de l'hydroxyurée à long terme pour des troubles myéloprolifératifs, une leucémie secondaire a été rapportée. Un cancer de la peau a également été signalé chez des patients recevant de l'hydroxyurée à long terme. Conseillez la protection contre l'exposition au soleil et surveillez le développement de tumeurs malignes secondaires.
Toxicité embryo-fœtale
Sur la base du mécanisme d'action et des résultats chez l'animal, HYDREA 500 mg peut être nocif pour le fœtus lorsqu'il est administré à une femme enceinte. L'hydroxyurée s'est avérée embryotoxique et tératogène chez le rat et le lapin à des doses 0,8 fois et 0,3 fois, respectivement, la dose quotidienne maximale recommandée chez l'homme sur une base en mg/m2. Informez les femmes enceintes du risque potentiel pour le fœtus [voir Utilisation dans des populations spécifiques ].
Conseiller aux femmes en âge de procréer d'utiliser une contraception efficace pendant et après le traitement par HYDREA 500 mg pendant au moins 6 mois après le traitement. Conseiller aux hommes en âge de procréer d'utiliser une contraception efficace pendant et après le traitement par HYDREA 500 mg pendant au moins 1 an après le traitement [voir Utilisation dans des populations spécifiques ].
Toxicités vasculitiques
Des toxicités vasculitiques cutanées, y compris des ulcérations vasculitiques et une gangrène, sont survenues chez des patients atteints de troubles myéloprolifératifs au cours d'un traitement par l'hydroxyurée. Ces toxicités vasculaires ont été signalées le plus souvent chez des patients ayant des antécédents ou recevant actuellement un traitement par interféron. En cas d'ulcères vasculaires cutanés, instaurer un traitement et arrêter HYDREA.
Vaccins vivants
Éviter l'utilisation de vaccins vivants chez les patients prenant HYDREA. L'utilisation concomitante d'HYDREA avec un vaccin à virus vivant peut potentialiser la réplication du virus et/ou peut augmenter l'effet indésirable du vaccin car les mécanismes de défense normaux peuvent être supprimés par HYDREA. La vaccination avec des vaccins vivants chez un patient recevant HYDREA 500 mg peut entraîner une infection grave. La réponse immunitaire du patient aux vaccins peut être diminuée. Envisagez de consulter un spécialiste.
Risques liés à l'utilisation concomitante de médicaments antirétroviraux
Une pancréatite, une hépatotoxicité et une neuropathie périphérique sont survenues lors de l'administration concomitante d'hydroxyurée et de médicaments antirétroviraux, y compris la didanosine et la stavudine [voir INTERACTIONS MÉDICAMENTEUSES ].
Rappel de rayonnement
Les patients qui ont reçu une radiothérapie dans le passé peuvent présenter une exacerbation de l'érythème post-irradiation. Surveiller l'érythème cutané chez les patients qui ont déjà reçu une radiothérapie et gérer les symptômes.
Macrocytose
HYDREA 500 mg peut provoquer une macrocytose, qui est spontanément résolutive, et est souvent observée au début du traitement. Le changement morphologique ressemble à une anémie pernicieuse, mais n'est pas lié à une carence en vitamine B12 ou en acide folique. Cela peut masquer le diagnostic d'anémie pernicieuse. L'administration prophylactique d'acide folique est recommandée.
Toxicité pulmonaire
Des cas de pneumopathie interstitielle, notamment de fibrose pulmonaire, d'infiltration pulmonaire, de pneumonite et d'alvéolite/alvéolite allergique (y compris des cas mortels) ont été signalés chez des patients traités pour un néoplasme myéloprolifératif. Surveillez fréquemment les patients qui développent de la pyrexie, de la toux, de la dyspnée ou d'autres symptômes respiratoires, investiguez et traitez rapidement. Arrêter HYDREA 500 mg et traiter avec des corticostéroïdes [voir EFFETS INDÉSIRABLES ].
Interférence avec les tests de laboratoire
Une interférence avec les dosages d'acide urique, d'urée ou d'acide lactique est possible, rendant des résultats faussement élevés chez les patients traités par hydroxyurée [voir INTERACTIONS MÉDICAMENTEUSES ].
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Les études conventionnelles à long terme pour évaluer le potentiel carcinogène de l'hydroxyurée n'ont pas été réalisées. Cependant, l'administration intrapéritonéale de 125 à 250 mg/kg d'hydroxyurée (environ 0,6 à 1,2 fois la dose quotidienne orale maximale recommandée chez l'homme sur une base de mg/m2) trois fois par semaine pendant 6 mois à des rats femelles a augmenté l'incidence des tumeurs mammaires chez les rats survivant à 18 ans. mois par rapport au témoin. L'hydroxyurée est mutagène in vitro pour les bactéries, les champignons, les protozoaires et les cellules de mammifères. L'hydroxyurée est clastogène in vitro (cellules de hamster, lymphoblastes humains) et in vivo (test SCE chez le rongeur, test du micronoyau chez la souris). L'hydroxyurée provoque la transformation des cellules embryonnaires de rongeurs en un phénotype tumorigène.
L'hydroxyurée administrée à des rats mâles à raison de 60 mg/kg/jour (environ 0,3 fois la dose quotidienne maximale recommandée chez l'homme en mg/m2) a produit une atrophie testiculaire, une diminution de la spermatogenèse et une réduction significative de leur capacité à imprégner les femelles.
Utilisation dans des populations spécifiques
Grossesse
Résumé des risques
HYDREA peut causer des dommages au fœtus d'après les résultats d'études animales et le mécanisme d'action du médicament [voir PHARMACOLOGIE CLINIQUE ]. Il n'y a pas de données sur l'utilisation d'HYDREA chez la femme enceinte pour informer sur le risque associé au médicament. Dans les études de reproduction chez l'animal, l'administration d'hydroxyurée à des rats et des lapins gravides au cours de l'organogenèse a produit des effets embryotoxiques et tératogènes à des doses 0,8 fois et 0,3 fois, respectivement, la dose quotidienne maximale recommandée chez l'homme en mg/m2 (voir Données ). Informer les femmes du risque potentiel pour le fœtus et d'éviter de tomber enceinte pendant le traitement par HYDREA.
Dans la population générale des États-Unis, le risque de fond estimé de malformations congénitales majeures et de fausse couche dans les grossesses cliniquement reconnues est de 2 % à 4 % et de 15 % à 20 %, respectivement.
Données
Données animales
L'hydroxyurée s'est avérée être un puissant tératogène dans une grande variété de modèles animaux, y compris les souris, les hamsters, les chats, les porcs miniatures, les chiens et les singes à des doses inférieures à 1 fois la dose humaine administrée en mg/m2. L'hydroxyurée est embryotoxique et provoque des malformations fœtales (os crâniens partiellement ossifiés, absence d'orbites oculaires, hydrocéphalie, sternèbres bipartites, vertèbres lombaires manquantes) à 180 mg/kg/jour (environ 0,8 fois la dose quotidienne maximale recommandée chez l'homme en mg/m2) chez le rat et à 30 mg/kg/jour (environ 0,3 fois la dose quotidienne maximale recommandée chez l'homme en mg/m2) chez le lapin. L'embryotoxicité était caractérisée par une diminution de la viabilité fœtale, une réduction de la taille des portées vivantes et des retards de développement. L'hydroxyurée traverse le placenta. Des doses uniques de ≥375 mg/kg (environ 1,7 fois la dose quotidienne maximale recommandée chez l'homme sur une base en mg/m2) administrées à des rats ont provoqué un retard de croissance et une altération de la capacité d'apprentissage.
Lactation
Résumé des risques
L'hydroxyurée est excrétée dans le lait maternel. En raison du risque d'effets indésirables graves chez un nourrisson allaité par l'hydroxyurée, y compris la cancérogénicité, interrompre l'allaitement pendant le traitement par HYDREA.
Femelles et mâles de potentiel reproducteur
Test de grossesse
Vérifier l'état de grossesse des femelles en âge de procréer avant de commencer le traitement par HYDREA.
La contraception
Femelles
HYDREA peut nuire au fœtus lorsqu'il est administré à une femme enceinte [voir Grossesse ]. Conseillez aux femmes en âge de procréer d'utiliser une contraception efficace pendant et après le traitement par HYDREA pendant au moins 6 mois après le traitement. Conseillez aux femmes de signaler immédiatement leur grossesse.
Mâles
HYDREA 500 mg peut endommager les spermatozoïdes et le tissu testiculaire, entraînant d'éventuelles anomalies génétiques. Les hommes ayant des partenaires sexuelles féminines en âge de procréer doivent utiliser une contraception efficace pendant et après le traitement par HYDREA 500 mg pendant au moins 1 an après le traitement [voir Toxicologie non clinique ].
Infertilité
Mâles
D'après les découvertes chez les animaux et les humains, la fertilité masculine peut être compromise par le traitement par HYDREA. Une azoospermie ou oligospermie, parfois réversible, a été observée chez l'homme. Informer les patients de la possibilité de conservation du sperme avant le début du traitement [voir EFFETS INDÉSIRABLES et Toxicologie non clinique ].
Utilisation pédiatrique
L'innocuité et l'efficacité chez les patients pédiatriques n'ont pas été établies.
Utilisation gériatrique
Les patients âgés peuvent être plus sensibles aux effets de l'hydroxyurée et peuvent nécessiter un schéma posologique plus faible. L'hydroxyurée est excrétée par les reins et le risque de réactions indésirables à ce médicament peut être plus élevé chez les patients présentant une insuffisance rénale. Étant donné que les patients âgés sont plus susceptibles d'avoir une fonction rénale diminuée, des précautions doivent être prises lors du choix de la dose et il peut être utile de surveiller la fonction rénale [voir DOSAGE ET ADMINISTRATION ].
Insuffisance rénale
L'exposition à l'hydroxyurée est plus élevée chez les patients dont la clairance de la créatinine est inférieure à 60 mL/min ou chez les patients atteints d'insuffisance rénale terminale (IRT). Réduire la posologie et surveiller étroitement les paramètres hématologiques lorsqu'HYDREA 500 mg doit être administré à ces patients [voir DOSAGE ET ADMINISTRATION et PHARMACOLOGIE CLINIQUE ].
Insuffisance hépatique
Il n'y a pas de données qui soutiennent des recommandations spécifiques pour l'ajustement de la posologie chez les patients atteints d'insuffisance hépatique. Une surveillance étroite des paramètres hématologiques est conseillée chez ces patients.
SURDOSAGE
Une toxicité cutanéo-muqueuse aiguë a été rapportée chez des patients recevant de l'hydroxyurée à des doses plusieurs fois supérieures à la dose thérapeutique. Des douleurs, un érythème violet, un œdème sur les paumes et la plante des pieds suivi d'une desquamation des mains et des pieds, une hyperpigmentation généralisée sévère de la peau et une stomatite ont également été observés.
CONTRE-INDICATIONS
HYDREA 500 mg est contre-indiqué chez les patients ayant déjà présenté une hypersensibilité à l'hydroxyurée ou à tout autre composant de la formulation.
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
Le mécanisme précis par lequel l'hydroxyurée produit ses effets antinéoplasiques ne peut pas, à l'heure actuelle, être décrit. Cependant, les rapports de diverses études en culture tissulaire chez le rat et l'homme appuient l'hypothèse selon laquelle l'hydroxyurée provoque une inhibition immédiate de la synthèse d'ADN en agissant comme un inhibiteur de la ribonucléotide réductase, sans interférer avec la synthèse d'acide ribonucléique ou de protéine. Cette hypothèse explique pourquoi, dans certaines conditions, l'hydroxyurée peut induire des effets tératogènes.
Trois mécanismes d'action ont été postulés pour l'efficacité accrue de l'utilisation concomitante d'un traitement par hydroxyurée avec une irradiation sur les carcinomes épidermoïdes (épidermoïdes) de la tête et du cou. Des études in vitro utilisant des cellules de hamster chinois suggèrent que l'hydroxyurée (1) est létale pour les cellules normalement radiorésistantes au stade S, et (2) maintient d'autres cellules du cycle cellulaire au stade G1 ou pré-synthèse de l'ADN où elles sont les plus sensibles au effets de l'irradiation. Le troisième mécanisme d'action a été théorisé sur la base d'études in vitro de cellules HeLa. Il apparaît que l'hydroxyurée, par inhibition de la synthèse d'ADN, entrave le processus normal de réparation des cellules endommagées mais non tuées par l'irradiation, diminuant ainsi leur taux de survie ; Les synthèses d'ARN et de protéines n'ont montré aucune altération.
Pharmacocinétique
Absorption
Après administration orale d'HYDREA, l'hydroxyurée atteint des concentrations plasmatiques maximales en 1 à 4 heures. Les concentrations plasmatiques maximales moyennes et les ASC augmentent plus que proportionnellement avec l'augmentation de la dose.
Il n'y a pas de données sur l'effet de la nourriture sur l'absorption de l'hydroxyurée.
Distribution
L'hydroxyurée se distribue dans tout le corps avec un volume de distribution se rapprochant de l'eau corporelle totale.
L'hydroxyurée se concentre dans les leucocytes et les érythrocytes.
Métabolisme
Jusqu'à 60% d'une dose orale subit une conversion par métabolisme hépatique saturable et une voie mineure de dégradation par l'uréase présente dans les bactéries intestinales.
Excrétion
Chez les patients atteints d'anémie falciforme, la récupération urinaire cumulée moyenne de l'hydroxyurée était d'environ 40 % de la dose administrée.
Populations spécifiques
Insuffisance rénale
L'effet de l'insuffisance rénale sur la pharmacocinétique de l'hydroxyurée a été évalué chez des patients adultes atteints de drépanocytose et d'insuffisance rénale. Patients ayant une fonction rénale normale (clairance de la créatinine [ClCr] > 80 ml/min), légère (ClCr 50-80 ml/min), modérée (ClCr = 30- 60 mL/min). Réduire la dose d'HYDREA 500 mg lorsqu'il est administré à des patients dont la clairance de la créatinine est DOSAGE ET ADMINISTRATION et Utilisation dans des populations spécifiques ].
INFORMATIONS PATIENTS
- Il existe un risque de myélosuppression. La surveillance hebdomadaire de la formule sanguine pendant toute la durée du traitement doit être privilégiée chez les patients prenant HYDREA [voir AVERTISSEMENTS ET PRECAUTIONS ]. Conseillez aux patients de signaler immédiatement les signes et symptômes d'infection ou de saignement.
- Informez les patients qu'il existe un risque de toxicités vasculaires cutanées et de tumeurs malignes secondaires, y compris la leucémie et les cancers de la peau [voir AVERTISSEMENTS ET PRECAUTIONS ].
- Informez les femmes en âge de procréer du risque potentiel pour le fœtus et informez leur professionnel de la santé d'une grossesse connue ou suspectée. Conseiller aux femmes et aux hommes en âge de procréer d'utiliser une contraception pendant et après le traitement par HYDREA [voir AVERTISSEMENTS ET PRECAUTIONS et Utilisation dans des populations spécifiques ].
- Conseillez aux patients d'informer leur fournisseur de soins de santé s'ils ont reçu ou prévoient de recevoir des vaccins pendant qu'ils prennent HYDREA 500 mg, car cela peut entraîner une infection grave [voir AVERTISSEMENTS ET PRECAUTIONS ].
- Conseiller aux femmes d'interrompre l'allaitement pendant le traitement par HYDREA [voir Utilisation dans des populations spécifiques ].
- Les patients infectés par le VIH doivent contacter leur médecin en cas de signes et de symptômes de pancréatite, d'événements hépatiques et de neuropathie périphérique [voir AVERTISSEMENTS ET PRECAUTIONS ].
- Un érythème post-irradiation peut survenir chez les patients ayant déjà reçu une radiothérapie [voir AVERTISSEMENTS ET PRECAUTIONS ].
- Informez les patients des symptômes de toxicité pulmonaire potentielle et demandez-leur de consulter rapidement un médecin en cas de pyrexie, de toux, de dyspnée ou d'autres symptômes respiratoires [voir AVERTISSEMENTS ET PRECAUTIONS ].
