Leukeran 2mg, 5mg Chlorambucil Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Leukeran 5 mg et comment est-il utilisé ?
Leukeran 5 mg est un médicament d'ordonnance utilisé pour traiter les symptômes de la leucémie lymphatique chronique (lymphocytaire) et du lymphome de Hodgkin. Leukeran 5 mg peut être utilisé seul ou avec d'autres médicaments.
Leukeran 5 mg appartient à une classe de médicaments appelés antinéoplasiques, alkylants.
On ne sait pas si Leukeran est sûr et efficace chez les enfants.
Quels sont les effets secondaires possibles de Leukeran ?
Leukeran peut provoquer des effets secondaires graves, notamment :
- urticaire,
- difficulté à respirer,
- gonflement du visage, des lèvres, de la langue ou de la gorge,
- convulsions,
- masse ou masse inhabituelle,
- vomissements ou diarrhées sévères,
- toux nouvelle ou qui s'aggrave,
- ecchymoses faciles,
- saignements inhabituels (nez, bouche, vagin ou rectum),
- taches violettes ou rouges sous la peau,
- nausée,
- douleur dans le haut du ventre,
- démangeaison,
- fatigue,
- perte d'appétit,
- urine foncée,
- selles de couleur argile,
- jaunissement de la peau ou des yeux (jaunisse),
- fièvre,
- gencives enflées,
- plaies buccales douloureuses,
- douleur à la déglutition,
- plaies cutanées,
- symptômes de rhume ou de grippe,
- toux,
- difficulté à respirer,
- mal de gorge,
- douleurs cutanées et
- une éruption cutanée rouge ou violette qui se propage (en particulier sur le visage ou le haut du corps) et provoque des cloques et une desquamation
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Leukeran comprennent :
- fièvre,
- saignement, et
- symptômes de la grippe
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Leukeran. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
ATTENTION
LEUKERAN (chlorambucil) peut supprimer sévèrement la fonction de la moelle osseuse. Le chlorambucil est cancérigène chez l'homme. Le chlorambucil est probablement mutagène et tératogène chez l'homme. Le chlorambucil produit l'infertilité humaine (voir AVERTISSEMENTS ET PRECAUTIONS ).
LA DESCRIPTION
LEUKERAN (chlorambucil) a été synthétisé pour la première fois par Everett et al. C'est un agent alkylant bifonctionnel du type moutarde azotée qui s'est avéré actif contre certaines maladies néoplasiques humaines. Le chlorambucil est chimiquement connu sous le nom d'acide 4-[bis(2-chloroéthyl)amino]benzènebutanoïque et a la formule structurale suivante :
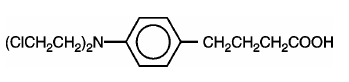
Le chlorambucil s'hydrolyse dans l'eau et a un pKa de 5,8.
LEUKERAN (chlorambucil) est offert sous forme de comprimés pour administration orale. Chaque comprimé pelliculé contient 2 mg de chlorambucil et les ingrédients inactifs dioxyde de silicium colloïdal, hypromellose, lactose (anhydre), macrogol/PEG 400, cellulose microcristalline, oxyde de fer rouge, acide stéarique, dioxyde de titane et oxyde de fer jaune.
LES INDICATIONS
LEUKERAN (chlorambucil) est indiqué dans le traitement de la leucémie lymphatique chronique (lymphocytaire), des lymphomes malins, y compris le lymphosarcome, du lymphome folliculaire géant et de la maladie de Hodgkin. Il n'est curatif dans aucun de ces troubles mais peut produire des soins palliatifs cliniquement utiles.
DOSAGE ET ADMINISTRATION
La posologie orale habituelle est de 0,1 à 0,2 mg/kg de poids corporel par jour pendant 3 à 6 semaines selon les besoins. Cela équivaut généralement à 4 à 10 mg par jour pour le patient moyen. La dose quotidienne entière peut être administrée en une seule fois. Ces posologies sont destinées à l'initiation du traitement ou à des traitements de courte durée. La posologie doit être soigneusement adaptée en fonction de la réponse du patient et doit être réduite dès qu'il y a une chute brutale du nombre de globules blancs. Les patients atteints de la maladie de Hodgkin ont généralement besoin de 0,2 mg/kg par jour, tandis que les patients atteints d'autres lymphomes ou de leucémie lymphoïde chronique n'ont généralement besoin que de 0,1 mg/kg par jour. En cas d'infiltration lymphocytaire de la moelle osseuse ou d'hypoplasie de la moelle osseuse, la dose quotidienne ne doit pas dépasser 0,1 mg/kg (environ 6 mg pour le patient moyen).
Des schémas alternatifs pour le traitement de la leucémie lymphoïde chronique employant des doses pulsées intermittentes, bihebdomadaires ou une fois par mois de chlorambucil ont été rapportés. Les programmes intermittents de chlorambucil commencent par une dose unique initiale de 0,4 mg/kg. Les doses sont généralement augmentées de 0,1 mg/kg jusqu'à ce qu'un contrôle de la lymphocytose ou de la toxicité soit observé. Les doses suivantes sont modifiées pour produire une légère toxicité hématologique. On estime que le taux de réponse de la leucémie lymphoïde chronique au schéma d'administration de chlorambucil toutes les deux semaines ou une fois par mois est similaire ou supérieur à celui précédemment rapporté avec l'administration quotidienne et que la toxicité hématologique était inférieure ou égale à celle rencontrée dans les études utilisant le chlorambucil quotidiennement. .
La radiothérapie et les médicaments cytotoxiques rendent la moelle osseuse plus vulnérable aux dommages, et le chlorambucil doit être utilisé avec une prudence particulière dans les 4 semaines suivant un cycle complet de radiothérapie ou de chimiothérapie. Cependant, de petites doses de rayonnement palliatif sur des foyers isolés éloignés de la moelle osseuse ne diminuent généralement pas le nombre de neutrophiles et de plaquettes. Dans ces cas, le chlorambucil peut être administré à la posologie habituelle.
On pense actuellement que des traitements de courte durée sont plus sûrs qu'un traitement d'entretien continu, bien que les deux méthodes aient été efficaces. Il faut reconnaître qu'un traitement continu peut donner l'apparence d'un « entretien » chez les patients qui sont réellement en rémission et qui n'ont pas besoin d'autres médicaments dans l'immédiat. Si la dose d'entretien est utilisée, elle ne doit pas dépasser 0,1 mg/kg par jour et peut être aussi faible que 0,03 mg/kg par jour. Une dose d'entretien typique est de 2 mg à 4 mg par jour, ou moins, selon l'état de la numération globulaire. Il peut donc être souhaitable d'arrêter le médicament après l'obtention d'un contrôle maximal, car un traitement intermittent réinstauré au moment de la rechute peut être aussi efficace qu'un traitement continu.
Les procédures de manipulation et d'élimination appropriées des médicaments anticancéreux doivent être suivies. Plusieurs lignes directrices à ce sujet ont été publiées.1-4 Il n'y a pas d'accord général sur le fait que toutes les procédures recommandées dans les lignes directrices sont nécessaires ou appropriées.
Populations particulières
Insuffisance hépatique
Les patients atteints d'insuffisance hépatique doivent être étroitement surveillés pour la toxicité. Le chlorambucil étant principalement métabolisé dans le foie, une réduction de la dose peut être envisagée chez les patients insuffisants hépatiques traités par LEUKERAN. Cependant, il n'y a pas suffisamment de données chez les patients atteints d'insuffisance hépatique pour fournir une recommandation posologique spécifique.
COMMENT FOURNIE
LEUKERAN est fourni sous forme de comprimés bruns, pelliculés, ronds, biconvexes contenant 2 mg de chlorambucil dans des flacons en verre ambré avec des fermetures de sécurité pour enfants. Un côté est gravé avec "GX EG3" et l'autre côté est gravé avec un "L".
Flacon de 25 ( CDN 76388-635-25)
Conserver au réfrigérateur, entre 2° et 8°C (36° et 46°F).
RÉFÉRENCES
1. Alerte NIOSH : Prévention des expositions professionnelles aux antinéoplasiques et autres médicaments dangereux dans les établissements de santé. 2004. Département américain de la santé et des services sociaux, Service de santé publique, Centers for Disease Control and Prevention, National Institute for Occupational Safety and Health, DHHS (NIOSH) Publication No. 2004-165.
2. Manuel technique OSHA, TED 1-0.15A, Section VI : Chapitre 2. Contrôle de l'exposition professionnelle aux médicaments dangereux. OSHA, 1999. http://www.osha.gov/dts/osta/otm/otm_vi/otm_vi_2.html
3. Société américaine des pharmaciens du système de santé. Directives de l'ASHP sur la manipulation des médicaments dangereux. Suis J Health-Syst Pharm. (2006) 63:1172-1193.
4. Polovich, M., White, JM et Kelleher, LO (eds.) 2005. Lignes directrices et recommandations pour la pratique de la chimiothérapie et de la biothérapie (2e éd.) Pittsburgh, PA : Oncology Nursing Society.
Fabriqué par : Excella GmbH & Co. KG, Feucht, Allemagne. Révisé : mars 2017
EFFETS SECONDAIRES
Pour signaler des RÉACTIONS INDÉSIRABLES SUSPECTÉES, contactez Aspen Global Inc. sans frais au 1-855-800-8165 ou la FDA au 1-800-FDA-1088 ou www.fda.gov/medwatch.
Hématologique
L'effet secondaire le plus courant est la suppression de la moelle osseuse, l'anémie, la leucopénie, la neutropénie, la thrombocytopénie ou la pancytopénie. Bien que la suppression de la moelle osseuse se produise fréquemment, elle est généralement réversible si le chlorambucil est retiré suffisamment tôt. Cependant, une insuffisance médullaire irréversible a été rapportée.
Gastro-intestinal
Des troubles gastro-intestinaux tels que nausées et vomissements, diarrhée et ulcération buccale surviennent rarement.
SNC
Les tremblements, les contractions musculaires, la myoclonie, la confusion, l'agitation, l'ataxie, la parésie flasque et les hallucinations ont été signalés comme des effets indésirables rares du chlorambucil qui disparaissent à l'arrêt du médicament. Des crises épileptiques rares, focales et/ou généralisées ont été signalées chez des enfants et des adultes aux doses thérapeutiques quotidiennes et aux schémas posologiques pulsés, ainsi qu'en cas de surdosage aigu (voir PRÉCAUTIONS : Général ).
Dermatologique
Des réactions allergiques telles que l'urticaire et l'œdème de Quincke ont été rapportées après l'administration initiale ou ultérieure. Une hypersensibilité cutanée (y compris de rares cas d'éruption cutanée évoluant vers un érythème polymorphe, une nécrolyse épidermique toxique et un syndrome de Stevens-Johnson) a été rapportée (voir AVERTISSEMENTS ).
Divers
Les autres effets indésirables rapportés incluent : fibrose pulmonaire, hépatotoxicité et ictère, fièvre médicamenteuse, neuropathie périphérique, pneumonie interstitielle, cystite stérile, infertilité, leucémie et tumeurs malignes secondaires (voir AVERTISSEMENTS ).

INTERACTIONS MÉDICAMENTEUSES
Il n'existe aucune interaction médicamenteuse connue avec le chlorambucil.
AVERTISSEMENTS
En raison de ses propriétés cancérigènes, le chlorambucil ne doit pas être administré à des patients atteints d'affections autres que la leucémie lymphatique chronique ou les lymphomes malins. Des convulsions, l'infertilité, la leucémie et des tumeurs malignes secondaires ont été observées lorsque le chlorambucil était utilisé dans le traitement de maladies malignes et non malignes.
Il existe de nombreux rapports de leucémie aiguë survenant chez des patients atteints de maladies malignes et non malignes après un traitement au chlorambucil. Dans de nombreux cas, ces patients ont également reçu d'autres agents chimiothérapeutiques ou une certaine forme de radiothérapie. La quantification du risque d'induction par le chlorambucil de leucémie ou de carcinome chez l'homme n'est pas possible. L'évaluation des rapports publiés sur le développement de leucémies chez des patients ayant reçu du chlorambucil (et d'autres agents alkylants) suggère que le risque de leucémogenèse augmente à la fois avec la chronicité du traitement et avec de fortes doses cumulées. Cependant, il s'est avéré impossible de définir une dose cumulée en dessous de laquelle il n'y a pas de risque d'induction de malignité secondaire. Les avantages potentiels du traitement par le chlorambucil doivent être évalués sur une base individuelle par rapport au risque possible d'induction d'une tumeur maligne secondaire.
Il a été démontré que le chlorambucil cause des dommages aux chromatides ou aux chromosomes chez l'homme. Des stérilités réversibles et permanentes ont été observées chez les deux sexes recevant du chlorambucil.
Une incidence élevée de stérilité a été documentée lorsque le chlorambucil est administré à des hommes prépubères et pubères. Une azoospermie prolongée ou permanente a également été observée chez les mâles adultes. Alors que la plupart des rapports de dysfonctionnement gonadique secondaire au chlorambucil concernaient des hommes, l'induction de l'aménorrhée chez les femmes avec des agents alkylants est bien documentée et le chlorambucil est capable de produire une aménorrhée. Des études d'autopsie des ovaires de femmes atteintes d'un lymphome malin traitées par une chimiothérapie combinée comprenant du chlorambucil ont montré divers degrés de fibrose, de vascularite et de déplétion des follicules primordiaux.
De rares cas d'éruption cutanée évoluant vers un érythème polymorphe, une nécrolyse épidermique toxique ou un syndrome de Stevens-Johnson ont été rapportés. Le chlorambucil doit être arrêté rapidement chez les patients qui développent des réactions cutanées.
Grossesse
Catégorie de grossesse D
Le chlorambucil peut nuire au fœtus lorsqu'il est administré à une femme enceinte. Une agénésie rénale unilatérale a été observée chez 2 descendants dont les mères ont reçu du chlorambucil au cours du premier trimestre. Des malformations urogénitales, y compris l'absence de rein, ont été observées chez les fœtus de rats ayant reçu du chlorambucil. Il n'y a pas d'études adéquates et bien contrôlées chez les femmes enceintes. Si ce médicament est utilisé pendant la grossesse, ou si la patiente tombe enceinte pendant qu'elle prend ce médicament, la patiente doit être informée du risque potentiel pour le fœtus. Les femmes en âge de procréer doivent être avisées d'éviter de devenir enceintes.
PRÉCAUTIONS
Général
De nombreux patients développent une lymphopénie lentement progressive pendant le traitement. Le nombre de lymphocytes revient généralement rapidement à des niveaux normaux à la fin du traitement médicamenteux. La plupart des patients présentent une certaine neutropénie après la troisième semaine de traitement et celle-ci peut persister jusqu'à 10 jours après la dernière dose. Par la suite, le nombre de neutrophiles revient généralement rapidement à la normale. La neutropénie sévère semble être liée à la posologie et ne survient généralement que chez les patients qui ont reçu une dose totale de 6,5 mg/kg ou plus en un seul cycle de traitement avec une dose continue. On peut s'attendre à ce qu'environ un quart de tous les patients recevant le schéma à dose continue et un tiers de ceux recevant cette dose en 8 semaines ou moins développent une neutropénie sévère.
Bien qu'il ne soit pas nécessaire d'arrêter le chlorambucil dès les premiers signes d'une chute du nombre de neutrophiles, il faut se rappeler que la chute peut se poursuivre pendant 10 jours après la dernière dose, et que lorsque la dose totale approche 6,5 mg/kg, il y a risque de causer des dommages irréversibles à la moelle osseuse. La dose de chlorambucil doit être diminuée si le nombre de leucocytes ou de plaquettes tombe en dessous des valeurs normales et doit être interrompue en cas de dépression plus sévère.
Le chlorambucil doit ne pas être administré à doses complètes avant 4 semaines après un cycle complet de radiothérapie ou de chimiothérapie en raison de la vulnérabilité de la moelle osseuse aux dommages dans ces conditions. Si le nombre de leucocytes ou de plaquettes préthérapeutique est déprimé par le processus de maladie de la moelle osseuse avant l'instauration du traitement, le traitement doit être institué à une dose réduite.
Un nombre de neutrophiles et de plaquettes constamment faible ou une lymphocytose périphérique suggèrent une infiltration de la moelle osseuse. Si elle est confirmée par un examen de la moelle osseuse, la dose quotidienne de chlorambucil ne doit pas dépasser 0,1 mg/kg. Le chlorambucil semble être relativement exempt d'effets secondaires gastro-intestinaux ou d'autres preuves de toxicité en dehors de l'action dépressive sur la moelle osseuse. Chez l'homme, des doses orales uniques de 20 mg ou plus peuvent provoquer des nausées et des vomissements.
Les enfants atteints du syndrome néphrotique et les patients recevant de fortes doses pulsées de chlorambucil peuvent présenter un risque accru de convulsions. Comme avec tout médicament potentiellement épileptogène, la prudence s'impose lors de l'administration de chlorambucil à des patients ayant des antécédents d'épilepsie ou de traumatisme crânien, ou qui reçoivent d'autres médicaments potentiellement épileptogènes.
L'administration de vaccins vivants à des patients immunodéprimés doit être évitée.
Tests de laboratoire
Les patients doivent être suivis attentivement afin d'éviter toute lésion potentiellement mortelle de la moelle osseuse pendant le traitement. Un examen hebdomadaire du sang doit être effectué pour déterminer les taux d'hémoglobine, le nombre total et différentiel de leucocytes et le nombre quantitatif de plaquettes. De plus, au cours des 3 à 6 premières semaines de traitement, il est recommandé d'effectuer une numération leucocytaire 3 ou 4 jours après chacune des numérations globulaires complètes hebdomadaires. Galton et al ont suggéré qu'en suivant les patients, il est utile de tracer les numérations globulaires sur un graphique en même temps que le poids corporel, la température, la taille de la rate, etc., sont enregistrés. Il est considéré comme dangereux de laisser un patient passer plus de 2 semaines sans examen hématologique et clinique pendant le traitement.
Carcinogenèse, mutagenèse, altération de la fertilité
Voir AVERTISSEMENTS section pour des informations sur la carcinogenèse, la mutagenèse et l'altération de la fertilité.
Grossesse
Effets tératogènes
Catégorie de grossesse D
Voir AVERTISSEMENTS section.
Mères allaitantes
On ne sait pas si ce médicament est excrété dans le lait maternel. Étant donné que de nombreux médicaments sont excrétés dans le lait maternel et en raison du risque d'effets indésirables graves du chlorambucil chez les nourrissons, une décision doit être prise d'interrompre l'allaitement ou d'arrêter le médicament, en tenant compte de l'importance du médicament pour la mère.
Utilisation pédiatrique
La sécurité et l'efficacité chez les patients pédiatriques n'ont pas été établies.
Utilisation gériatrique
Les études cliniques sur le chlorambucil n'ont pas inclus un nombre suffisant de sujets âgés de 65 ans et plus pour déterminer s'ils réagissent différemment des sujets plus jeunes. L'autre expérience clinique annoncée n'a pas identifié de différences dans les réponses entre les patients assez âgés et plus jeunes. En général, la sélection de la dose pour un patient âgé doit être prudente, en commençant généralement à l'extrémité inférieure de la plage posologique, reflétant la plus grande fréquence de diminution de la fonction hépatique, rénale ou cardiaque et de maladie concomitante ou d'un autre traitement médicamenteux.
Utilisation chez les patients atteints d'insuffisance rénale
L'impact de l'insuffisance rénale sur l'élimination du chlorambucil n'a pas été formellement étudié. L'élimination rénale du chlorambucil inchangé et de ses principaux métabolites actifs, la moutarde à l'acide phénylacétique, représente moins de 1 % de la dose administrée. De plus, aucun ajustement posologique n'a été nécessaire chez 2 patients dialysés sous chlorambucil. Par conséquent, l'insuffisance rénale ne devrait pas avoir d'impact significatif sur l'élimination du chlorambucil.
Utilisation chez les patients atteints d'insuffisance hépatique
Aucune étude formelle n'a été menée chez des patients atteints d'insuffisance hépatique. Comme le chlorambucil est principalement métabolisé dans le foie, les patients atteints d'insuffisance hépatique doivent être étroitement surveillés pour la toxicité et une réduction de la dose peut être envisagée chez les patients atteints d'insuffisance hépatique lorsqu'ils sont traités par LEUKERAN (voir DOSAGE ET ADMINISTRATION ).
SURDOSAGE
La pancytopénie réversible était la principale découverte de surdosages accidentels de chlorambucil. Une toxicité neurologique allant d'un comportement agité et de l'ataxie à de multiples crises de grand mal s'est également produite. Comme il n'y a pas d'antidote connu, la formule sanguine doit être étroitement surveillée et des mesures générales de soutien doivent être instituées, ainsi que des transfusions sanguines appropriées, si nécessaire. Le chlorambucil n'est pas dialysable.
Les doses uniques DL50 orales chez la souris sont de 123 mg/kg. Chez le rat, une dose intrapéritonéale unique de 12,5 mg/kg de chlorambucil produit des effets typiques de moutarde à l'azote; ceux-ci comprennent une atrophie de la muqueuse intestinale et des tissus lymphoïdes, une lymphopénie sévère atteignant son maximum en 4 jours, une anémie et une thrombocytopénie. Après cette dose, les animaux commencent à se rétablir dans les 3 jours et semblent normaux au bout d'environ une semaine, bien que la moelle osseuse puisse ne pas redevenir complètement normale avant environ 3 semaines. Une dose intrapéritonéale de 18,5 mg/kg tue environ 50 % des rats avec développement de convulsions. Jusqu'à 50 mg/kg ont été administrés par voie orale à des rats en une seule dose, avec récupération. Une telle dose provoque une bradycardie, une salivation excessive, une hématurie, des convulsions et un dysfonctionnement respiratoire.
CONTRE-INDICATIONS
Le chlorambucil doit ne pas être utilisé chez les patients dont la maladie a démontré une résistance antérieure à l'agent. Les patients qui ont démontré une hypersensibilité au chlorambucil ne doivent pas recevoir le médicament. Il peut y avoir une hypersensibilité croisée (éruption cutanée) entre le chlorambucil et d'autres agents alkylants.
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
Le chlorambucil, un dérivé aromatique de la moutarde azotée, est un agent alkylant. Le chlorambucil interfère avec la réplication de l'ADN et induit l'apoptose cellulaire via l'accumulation de p53 cytosolique et l'activation ultérieure de Bax, un promoteur de l'apoptose.
Pharmacocinétique
Dans une étude portant sur 12 patients ayant reçu des doses orales uniques de 0,2 mg/kg de LEUKERAN 5 mg, la Cmax plasmatique moyenne ajustée à la dose (±ET) du chlorambucil était de 492 ± 160 ng/mL, l'ASC était de 883 ± 329 ng.h/mL , la demi-vie d'élimination moyenne (t½) était de 1,3 ± 0,5 heures et le Tmax était de 0,83 ± 0,53 heures. Pour le principal métabolite, l'acide phénylacétique moutarde (PAAM), la Cmax plasmatique moyenne ajustée à la dose (± ET) était de 306 ± 73 ng/mL, l'ASC était de 1204 ± 285 ng.h/mL, la t½ moyenne était de 1,8 ± 0,4 heures , et le Tmax était de 1,9 ± 0,7 heures.
Après des doses orales uniques de 0,6 à 1,2 mg/kg, les concentrations plasmatiques maximales de chlorambucil (Cmax) sont atteintes en 1 heure et la demi-vie d'élimination terminale (t ) de la molécule mère est estimée à 1,5 heure.
Absorption
Le chlorambucil est rapidement et complètement (> 70 %) absorbé par le tractus gastro-intestinal. Conformément à l'absorption rapide et prévisible du chlorambucil, la variabilité interindividuelle de la pharmacocinétique plasmatique du chlorambucil s'est avérée relativement faible après des doses orales comprises entre 15 et 70 mg (variabilité intra-patient de 2 fois et 2 à 4 fois variabilité inter-patients de l'AUC). L'absorption du chlorambucil est réduite lorsqu'il est pris après les repas. Dans une étude portant sur dix patients, la prise de nourriture a augmenté de 2 fois le Tmax médian et réduit les valeurs de Cmax et d'ASC ajustées à la dose de 55 % et 20 %, respectivement.
Distribution
Le volume de distribution apparent était en moyenne de 0,31 L/kg après une dose orale unique de 0,2 mg/kg de chlorambucil chez 11 patients cancéreux atteints de leucémie lymphoïde chronique.
Le chlorambucil et ses métabolites sont fortement liés aux protéines plasmatiques et tissulaires. In vitro, le chlorambucil est lié à 99 % aux protéines plasmatiques, en particulier à l'albumine. Les taux de chlorambucil dans le liquide céphalo-rachidien n'ont pas été déterminés.
Métabolisme
Le chlorambucil est largement métabolisé dans le foie principalement en moutarde à l'acide phénylacétique, qui a une activité antinéoplasique. Le chlorambucil et son principal métabolite subissent une dégradation oxydative en dérivés monohydroxy et dihydroxy.
Excrétion
Après une dose unique de chlorambucil radiomarqué (14C), environ 20 à 60 % de la radioactivité apparaît dans les urines après 24 heures. Là encore, moins de 1 % de la radioactivité urinaire est sous forme de chlorambucil ou de moutarde à l'acide phénylacétique.
INFORMATIONS PATIENTS
Les patients doivent être informés que les principales toxicités du chlorambucil sont liées à l'hypersensibilité, à la fièvre médicamenteuse, à la myélosuppression, à l'hépatotoxicité, à l'infertilité, aux convulsions, à la toxicité gastro-intestinale et aux tumeurs malignes secondaires. Les patients ne doivent jamais être autorisés à prendre le médicament sans surveillance médicale et doivent consulter leur médecin s'ils présentent une éruption cutanée, des saignements, de la fièvre, une jaunisse, une toux persistante, des convulsions, des nausées, des vomissements, une aménorrhée ou des grumeaux/masses inhabituels. Les femmes en âge de procréer doivent être avisées d'éviter de devenir enceintes.
