Casodex 50mg Bicalutamide Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Casodex et comment est-il utilisé ?
Casodex est un médicament d'ordonnance utilisé pour traiter les symptômes du cancer de la prostate. Casodex 50 mg peut être utilisé seul ou avec d'autres médicaments.
Casodex 50 mg appartient à une classe de médicaments appelés antinéoplasiques, antiandrogènes ; Inhibiteur du CYP3A4, modéré.
On ne sait pas si Casodex est sûr et efficace chez les enfants.
Quels sont les effets secondaires possibles de Casodex ?
Casodex peut provoquer des effets secondaires graves, notamment :
- douleur ou gonflement des seins,
- du sang dans vos urines,
- fièvre,
- des frissons,
- douleur ou inconfort thoracique soudain,
- respiration sifflante,
- toux sèche,
- essoufflement,
- peau pâle,
- étourdissement,
- fréquence cardiaque rapide,
- difficulté à se concentrer,
- nausée,
- douleur dans le haut du ventre,
- se sentir fatigué,
- perte d'appétit,
- urine foncée,
- selles de couleur argile,
- jaunissement de la peau ou des yeux (jaunisse),
- augmentation de la soif,
- augmentation de la miction,
- faim,
- bouche sèche,
- odeur d'haleine fruitée,
- somnolence,
- peau sèche,
- vision floue et
- perte de poids
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Casodex 50 mg incluent :
- les bouffées de chaleur,
- mal au dos,
- douleur pelvienne,
- douleur abdominale,
- gonflement des mains, des chevilles ou des pieds,
- augmentation de la miction nocturne,
- la faiblesse,
- vertiges,
- nausée,
- diarrhée, et
- constipation
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Casodex. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
LA DESCRIPTION
Les comprimés CASODEX® (bicalutamide) contiennent 50 mg de bicalutamide, un inhibiteur non stéroïdien des récepteurs aux androgènes sans autre activité endocrinienne connue. Le nom chimique est propanamide, N [4 cyano-3- (trifluorométhyl)phényl]-3-[(4-fluorophényl)sulfonyl]-2-hydroxy-2-méthyl-,(+-). Les formules structurelles et empiriques sont :
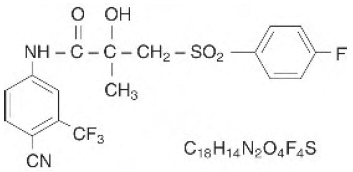
Le bicalutamide a un poids moléculaire de 430,37. Le pKa' est d'environ 12. Le bicalutamide est une fine poudre blanche à blanc cassé qui est pratiquement insoluble dans l'eau à 37°C (5 mg par 1000 mL), légèrement soluble dans le chloroforme et l'éthanol absolu, peu soluble dans le méthanol et soluble dans l'acétone et tétrahydrofuranne.
CASODEX est un racémate dont l'activité anti-androgène est presque exclusivement manifestée par l'énantiomère R du bicalutamide ; l'énantiomère S est essentiellement inactif.
Les ingrédients inactifs des comprimés CASODEX 50 mg sont le lactose, le stéarate de magnésium, l'hypromellose, le polyéthylène glycol, la polyvidone, le glycolate d'amidon sodique et le dioxyde de titane.
LES INDICATIONS
CASODEX 50 mg par jour est indiqué pour une utilisation en thérapie combinée avec un analogue de l'hormone de libération de l'hormone lutéinisante (LHRH) pour le traitement du carcinome métastatique de stade D2 de la prostate.
CASODEX 150 mg par jour n'est pas approuvé à utiliser seul ou avec d'autres traitements [voir Etudes cliniques ].
DOSAGE ET ADMINISTRATION
Dose et calendrier recommandés
La dose recommandée pour le traitement par CASODEX 50 mg en association avec un analogue de la LHRH est d'un comprimé de 50 mg une fois par jour (matin ou soir), avec ou sans nourriture. Il est recommandé de prendre CASODEX 50 mg à la même heure chaque jour. Le traitement par CASODEX doit être débuté en même temps que le traitement par un analogue de la LHRH. Si une dose de CASODEX 50 mg est oubliée, prenez la dose suivante à l'heure prévue. Ne prenez pas la dose oubliée et ne doublez pas la dose suivante.
Ajustement posologique en cas d'insuffisance rénale
Aucun ajustement posologique n'est nécessaire chez les patients insuffisants rénaux [voir Utilisation dans des populations spécifiques ].
Ajustement posologique en cas d'insuffisance hépatique
Aucun ajustement posologique n'est nécessaire chez les patients présentant une insuffisance hépatique légère à modérée. Chez les patients atteints d'insuffisance hépatique sévère (n = 4), bien qu'il y ait eu une augmentation de 76 % de la demi-vie (5,9 et 10,4 jours pour les patients normaux et atteints, respectivement) de l'énantiomère actif du bicalutamide, aucun ajustement posologique n'est nécessaire [ voir Utilisation dans des populations spécifiques ].
COMMENT FOURNIE
Formes posologiques et concentration
CASODEX® (bicalutamide) Comprimés de 50 mg pour administration orale.
Les comprimés pelliculés blancs (identifiés d'un côté par "CDX50" et de l'autre par le "logo CASODEX") sont fournis en flacons à dose unitaire de 30 comprimés (0310-0705-30).
Stockage et manutention
Conserver à température ambiante contrôlée, 20°-25°C (68°-77°F).
Fabriqué pour : AstraZeneca Pharmaceuticals LP, Wilmington, DE 19850. Révisé : mars 2017.
EFFETS SECONDAIRES
Étant donné que les essais cliniques sont menés dans des conditions très variables, les taux d'effets indésirables observés dans les essais cliniques d'un médicament ne peuvent pas être directement comparés aux taux des essais cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique.
Expérience des essais cliniques
Chez les patients atteints d'un cancer avancé de la prostate traités par CASODEX 50 mg en association avec un analogue de la LHRH, l'effet indésirable le plus fréquent était les bouffées de chaleur (53 %).
Dans l'essai clinique multicentrique, en double aveugle et contrôlé comparant CASODEX 50 mg une fois par jour au flutamide 250 mg trois fois par jour, chacun en association avec un analogue de la LHRH, les effets indésirables suivants avec une incidence de 5 % ou plus, quel que soit de causalité, ont été rapportés.
Les autres effets indésirables (supérieurs ou égaux à 2 %, mais inférieurs à 5 %) signalés dans le groupe de traitement par analogue de CASODEX-LHRH sont énumérés ci-dessous par système corporel et par ordre de fréquence décroissante dans chaque système corporel, quelle que soit la causalité.
Corps dans son ensemble : Néoplasme; La douleur du cou; Fièvre; Des frissons; État septique; Hernie; Kyste
Cardiovasculaire: Angine de poitrine; Insuffisance cardiaque congestive ; infarctus du myocarde ; arrêt cardiaque ; Trouble de l'artère coronaire ; Syncope
Digestif: Méléna ; hémorragie rectale ; Bouche sèche; Dysphagie ; trouble gastro-intestinal ; abcès parodontal ; Carcinome gastro-intestinal
Métabolique et Nutritionnel : Œdème; BUN augmenté ; Créatinine augmentée ; Déshydratation; Goutte; Hypercholestérolémie
Musculo-squelettique : myalgie ; Crampes dans les jambes
Nerveux: hypertonie ; Confusion; Somnolence; Diminution de la libido ; Neuropathie; Nervosité
Respiratoire: Trouble pulmonaire ; Asthme; Épistaxis; Sinusite
Peau et appendices : Peau sèche; Alopécie; Prurit; Zona; Carcinome cutané ; Troubles de la peau
Sens spéciaux : Cataracte spécifiée
Urogénital: Dysurie; Urgence urinaire; hydronéphrose; Trouble des voies urinaires
Valeurs anormales des tests de laboratoire :
Anomalies de laboratoire comprenant : AST, ALT, bilirubine, BUN et créatinine élevés ; et une diminution de l'hémoglobine et du nombre de globules blancs, ont été signalés chez les patients traités par un analogue de CASODEX-LHRH et par un analogue du flutamide-LHRH.
Expérience post-commercialisation
Les effets indésirables suivants ont été identifiés lors de l'utilisation post-approbation de CASODEX. Étant donné que ces réactions sont signalées volontairement par une population de taille incertaine, il n'est pas toujours possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale avec l'exposition au médicament.
Troubles respiratoires : Pneumopathie interstitielle (certaines mortelles), y compris pneumonite interstitielle et fibrose pulmonaire, le plus souvent à des doses supérieures à 50 mg.
Affections de la peau et du tissu sous-cutané : Photosensibilité
INTERACTIONS MÉDICAMENTEUSES
Les études cliniques n'ont pas montré d'interactions médicamenteuses entre le bicalutamide et les analogues de la LHRH (goséréline ou leuprolide). Il n'y a aucune preuve que le bicalutamide induit des enzymes hépatiques.
Des études in vitro ont montré que le R-bicalutamide est un inhibiteur du CYP 3A4 avec des effets inhibiteurs moindres sur l'activité des CYP 2C9, 2C19 et 2D6. Des études cliniques ont montré qu'avec la co-administration de CASODEX, les taux moyens de midazolam (un substrat du CYP 3A4) peuvent être augmentés de 1,5 fois (pour la Cmax) et de 1,9 fois (pour l'ASC). Par conséquent, la prudence s'impose lorsque CASODEX 50 mg est co-administré avec des substrats du CYP 3A4.
Des études in vitro sur la liaison aux protéines ont montré que le bicalutamide peut déplacer les anticoagulants coumariniques des sites de liaison. Les temps de prothrombine doivent être étroitement surveillés chez les patients recevant déjà des anticoagulants coumariniques qui débutent avec CASODEX 50 mg et un ajustement de la dose d'anticoagulant peut être nécessaire.
AVERTISSEMENTS
Inclus dans le cadre du "PRÉCAUTIONS" Section
PRÉCAUTIONS
Hépatite
Des cas de décès ou d'hospitalisation dus à une atteinte hépatique grave (insuffisance hépatique) ont été signalés après commercialisation en association avec l'utilisation de CASODEX. L'hépatotoxicité dans ces rapports s'est généralement produite au cours des trois à quatre premiers mois de traitement. Une hépatite ou des augmentations marquées des enzymes hépatiques entraînant l'arrêt du médicament sont survenues chez environ 1 % des patients CASODEX dans les essais cliniques contrôlés.
Les taux sériques de transaminases doivent être mesurés avant le début du traitement par CASODEX, à intervalles réguliers pendant les quatre premiers mois de traitement, puis périodiquement par la suite. Si des symptômes cliniques ou des signes évoquant un dysfonctionnement hépatique surviennent (p. ex., nausées, vomissements, douleurs abdominales, fatigue, anorexie, symptômes « pseudo-grippaux », urines foncées, jaunisse ou sensibilité du quadrant supérieur droit), les transaminases sériques, en particulier les ALT sérique, doit être mesuré immédiatement. Si, à tout moment, un patient présente une jaunisse ou si son ALT dépasse deux fois la limite supérieure de la normale, CASODEX doit être immédiatement arrêté avec un suivi étroit de la fonction hépatique.
Gynécomastie et douleurs mammaires
Dans les essais cliniques avec CASODEX 150 mg en monothérapie pour le cancer de la prostate, une gynécomastie et des douleurs mammaires ont été rapportées chez jusqu'à 38 % et 39 % des patientes, respectivement.
Tolérance au glucose
Une réduction de la tolérance au glucose a été observée chez les hommes recevant des agonistes de la LHRH. Cela peut se manifester par un diabète ou une perte de contrôle glycémique chez les personnes atteintes de diabète préexistant. Il faut donc envisager de surveiller la glycémie chez les patients recevant CASODEX 50 mg en association avec des agonistes de la LHRH.
Tests de laboratoire
Des évaluations régulières de l'antigène spécifique de la prostate (PSA) sérique peuvent être utiles pour surveiller la réponse du patient. Si les niveaux de PSA augmentent pendant le traitement par CASODEX 50 mg, le patient doit être évalué pour une progression clinique. Pour les patients qui ont une progression objective de la maladie avec un PSA élevé, une période sans traitement d'anti-androgène, tout en continuant l'analogue de la LHRH, peut être envisagée.
Informations sur les conseils aux patients
Conseillez au patient de lire l'étiquetage patient approuvé par la FDA ( INFORMATIONS PATIENTS ).
Dose et horaire
Informez les patients que le traitement par CASODEX 50 mg et l'analogue de la LHRH doit être démarré en même temps et qu'ils ne doivent pas interrompre ou arrêter de prendre ces médicaments sans consulter leur professionnel de la santé [voir DOSAGE ET ADMINISTRATION ].
Hépatite
Informez les patients que CASODEX peut provoquer une hépatite, qui peut entraîner une insuffisance hépatique et la mort. Informez les patients que les tests de la fonction hépatique doivent être surveillés régulièrement pendant le traitement et qu'ils doivent signaler les signes et symptômes d'hépatite [voir AVERTISSEMENTS ET PRECAUTIONS ].
Tolérance au glucose
Informez les patients que le diabète ou la perte de contrôle glycémique chez les patients atteints de diabète préexistant ont été rapportés pendant le traitement avec des agonistes de la LHRH. Il faut donc envisager de surveiller la glycémie chez les patients recevant CASODEX en association avec des agonistes de la LHRH [voir AVERTISSEMENTS ET PRECAUTIONS ].
Somnolence
Au cours du traitement par CASODEX, une somnolence a été rapportée. Conseillez aux patients qui présentent ce symptôme d'être prudents lorsqu'ils conduisent ou utilisent des machines [voir EFFETS INDÉSIRABLES ].
Photosensibilité
Informez les patients que des cas de photosensibilité ont été rapportés au cours du traitement par CASODEX et qu'ils doivent éviter une exposition directe à la lumière excessive du soleil ou à la lumière UV. Il faut envisager l'utilisation d'un écran solaire [voir EFFETS INDÉSIRABLES ].
Contraception et fertilité
Conseillez aux patients masculins ayant des partenaires féminines en âge de procréer d'utiliser une contraception efficace pendant le traitement et pendant 130 jours après la dernière dose de traitement par CASODEX 50 mg. Informez les hommes que CASODEX peut altérer la fertilité [voir Utilisation dans des populations spécifiques ].
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Des études de cancérogénicité orale de deux ans ont été menées chez des rats et des souris mâles et femelles à des doses de 5, 15 ou 75 mg/kg/jour de bicalutamide. Une variété d'effets tumoraux sur les organes cibles ont été identifiés et ont été attribués à l'anti-androgénicité du bicalutamide, à savoir, des tumeurs bénignes des cellules interstitielles testiculaires (Leydig) chez les rats mâles à toutes les doses (la concentration plasmatique à l'état d'équilibre avec la dose de 5 mg/kg/jour dose est d'environ 0,7 fois l'exposition humaine à la dose recommandée) et l'adénocarcinome utérin chez les rats femelles à 75 mg/kg/jour (environ 1,5 fois l'exposition humaine à la dose recommandée). Il n'y a aucune preuve d'hyperplasie des cellules de Leydig chez les patients; les tumeurs utérines ne sont pas pertinentes pour la population de patientes indiquée.
Une légère augmentation de l'incidence du carcinome hépatocellulaire chez les souris mâles ayant reçu 75 mg/kg/jour de bicalutamide (environ 4 fois l'exposition humaine à la dose recommandée) et une incidence accrue des adénomes bénins des cellules folliculaires thyroïdiennes chez les rats ayant reçu 5 mg/kg /jour (environ 0,7 fois l'exposition humaine à la dose recommandée) et plus ont été enregistrés. Ces modifications néoplasiques étaient des progressions de modifications non néoplasiques liées à l'induction d'enzymes hépatiques observées dans les études de toxicité chez l'animal. Aucune induction enzymatique n'a été observée après administration de bicalutamide chez l'homme. Il n'y a pas eu d'effets tumorigènes suggérant une carcinogenèse génotoxique.
Une batterie complète de tests de génotoxicité in vitro et in vivo (conversion de gènes de levure, Ames, E. coli, CHO/HGPRT, tests cytogénétiques de lymphocytes humains, micronoyaux de souris et cytogénétiques de moelle osseuse de rat) a démontré que le bicalutamide n'a pas d'activité génotoxique .
Dans les études de toxicologie à doses répétées, une atrophie des tubules séminifères des testicules a été observée pour toutes les espèces examinées, ce qui est un effet de classe prédit avec les antiandrogènes. Dans l'étude de 6 et 12 mois chez le rat, une atrophie testiculaire a été observée à environ 2 fois l'exposition humaine à la dose recommandée. Dans l'étude de 12 mois chez le chien, l'incidence de l'atrophie testiculaire a été observée à environ 7 fois l'exposition humaine à la dose recommandée. Chez les rats mâles ayant reçu 250 mg/kg/jour (environ 2 fois l'exposition humaine à la dose recommandée), l'intervalle précoïtal et le temps jusqu'à l'accouplement réussi ont été augmentés lors du premier appariement, mais aucun effet sur la fertilité après l'accouplement réussi n'a été observé. Ces effets ont été inversés 7 semaines après la fin d'une période d'administration de 11 semaines.
Les rats femelles dosés à 1, 10 et 250 mg/kg/jour (moins de 2 fois l'exposition humaine à la dose recommandée) ont présenté une augmentation de l'irrégularité du cycle œstral, mais il n'y a eu aucun effet sur la fertilité.
Dans une étude sur le développement périnatal et postnatal, la progéniture femelle de rats recevant des doses de 10 mg/kg/jour (environ 0,7 fois l'exposition humaine à la dose clinique recommandée) et plus a présenté des taux de grossesse réduits. L'administration de bicalutamide à des femelles gravides a entraîné une féminisation de la progéniture mâle entraînant un hypospadias à des doses de 10 mg/kg/jour (environ 0,7 fois l'exposition humaine à la dose recommandée) et plus. Les descendants mâles affectés étaient également impuissants.
Utilisation dans des populations spécifiques
Grossesse
Résumé des risques
CASODEX est contre-indiqué chez les femmes enceintes car il peut nuire au fœtus. CASODEX 50 mg n'est pas indiqué chez les femmes. Il n'y a pas de données humaines sur l'utilisation de CASODEX 50 mg chez la femme enceinte. Dans les études de reproduction chez l'animal, l'administration orale de bicalutamide à des rates gravides au cours de l'organogenèse a provoqué un développement anormal des organes reproducteurs chez les fœtus mâles à des expositions d'environ 0,7 à 2 fois l'exposition humaine à la dose recommandée (voir Données ).
Données
Données animales
Dans une étude sur le développement embryo-fœtal chez des rats gravides recevant des doses pendant la période d'organogenèse des jours de gestation 6 à 15, les fœtus mâles présentaient une distance anogénitale réduite à des doses de 10 mg/kg/jour et plus (environ 0,7 à 2 fois l'exposition humaine à la dose recommandée).
Dans une étude sur le développement prénatal et postnatal, des rats femelles ont reçu une dose du 7e au 16e jour de gestation et ont été autorisées à mettre bas et à élever leur progéniture jusqu'au sevrage. . On a observé que la progéniture mâle de rats recevant des doses de 10 mg/kg/jour (environ 0,7 fois l'exposition humaine à la dose recommandée) et plus avait une distance anogénitale réduite.
Dans une étude sur le développement périnatal et postnatal, des rats femelles ont reçu une dose du 16e jour de gestation au 22e jour de lactation et ont été autorisées à mettre bas et à élever leur progéniture jusqu'au sevrage. La survie et le poids de la progéniture pendant la lactation ont été réduits pour les portées de rats mères recevant des doses de 250 mg/kg/jour (environ 2 fois l'exposition humaine à la dose recommandée). On a observé que la progéniture mâle de rats recevant des doses de 10 mg/kg/jour (environ 0,7 fois l'exposition humaine à la dose recommandée) et plus présentait une distance anogénitale réduite, des organes sexuels secondaires plus petits, une cryptorchidie et un hypospadias entraînant une incapacité à s'accoupler et féconder leurs partenaires féminines. La progéniture femelle des rats recevant des doses de 10 mg/kg/jour (environ 0,7 fois l'exposition humaine à la dose recommandée) et au-dessus avait des taux de grossesse réduits.
Lactation
Résumé des risques
CASODEX 50mg n'est pas indiqué chez la femme enceinte. Aucune information n'est disponible sur la présence de bicalutamide dans le lait maternel, ni sur les effets sur le nourrisson allaité ou sur la production de lait. Le bicalutamide a été détecté dans le lait de rat.
Femelles et mâles de potentiel reproducteur
La contraception
Mâles
Le traitement anti-androgène peut entraîner des modifications morphologiques des spermatozoïdes [voir Toxicologie non clinique ]. Sur la base des résultats d'études sur la reproduction animale et de son mécanisme d'action, conseiller aux patients masculins ayant des partenaires féminines en âge de procréer d'utiliser une contraception efficace pendant le traitement et pendant 130 jours après la dernière dose de CASODEX [voir Grossesse et PHARMACOLOGIE CLINIQUE ].
Infertilité
Mâles

D'après des études animales, CASODEX 50 mg peut entraîner une inhibition de la spermatogenèse et peut altérer la fertilité chez les mâles en âge de procréer. Les effets à long terme de CASODEX 50 mg sur la fertilité masculine n'ont pas été étudiés [voir Toxicologie non clinique ].
Utilisation pédiatrique
La sécurité et l'efficacité de CASODEX 50 mg chez les patients pédiatriques n'ont pas été établies.
CASODEX (bicalutamide) comprimé orodispersible a été étudié en association avec ARIMIDEX (anastrozole) comprimé orodispersible dans une étude ouverte, non comparative, multicentrique qui a évalué l'efficacité et la tolérance de cette association sur 12 mois dans le traitement des gonadotrophines indépendantes. puberté précoce chez les garçons atteints de puberté précoce familiale limitée aux hommes, également connue sous le nom de testotoxicose. Les patients étaient inclus dans l'étude s'ils avaient un âge initial ≥ 2 ans et un diagnostic de testotoxicose basé sur les caractéristiques cliniques de la puberté précoce progressive, l'élargissement symétrique des testicules, l'âge osseux avancé, les niveaux pubertaires de testostérone sérique, le schéma prépubère de la sécrétion de gonadotrophines suite à une Test de stimulation à la GnRH, et absence d'autres causes cliniques et biochimiques d'excès de testostérone. Treize des 14 patients inscrits ont terminé 12 mois de traitement combiné (un patient a été perdu de vue). Si une puberté précoce centrale (PPC) se développait, un analogue de la LHRH devait être ajouté. Quatre patients ont reçu un diagnostic de CPP au cours de l'étude de 12 mois et ont reçu un traitement par analogue de la LHRH et 2 patients supplémentaires ont été diagnostiqués à la fin des 12 mois et ont reçu un traitement par la suite. Les caractéristiques moyennes ± SD à l'inclusion étaient les suivantes : âge chronologique : 3,9 ± 1,9 ans ; âge osseux 8,8±2,5 ; rapport âge osseux/âge chronologique : 2,06 ± 0,51 ; taux de croissance (cm/an) : 10,81 ± 4,22 ; score d'écart-type du taux de croissance (SDS) : 0,41 ± 1,36.
La dose initiale de CASODEX était de 12,5 mg. CASODEX a été titré chez chaque patient jusqu'à ce que la concentration plasmatique minimale à l'état d'équilibre du R-bicalutamide (l'isomère actif du bicalutamide) atteigne 5 à 15 mcg/mL, ce qui correspond à la plage de concentrations thérapeutiques atteintes chez les adultes atteints d'un cancer de la prostate après l'administration du dose CASODEX approuvée de 50 mg. La dose quotidienne initiale d'anastrozole était de 0,5 mg. L'anastrozole a été titré indépendamment chez chaque patient jusqu'à ce qu'il atteigne à l'état d'équilibre une concentration sérique d'estradiol
La principale analyse d'efficacité de l'étude consistait à évaluer la variation du taux de croissance après 12 mois de traitement, par rapport au taux de croissance au cours des ≥ 6 mois précédant l'entrée dans l'étude. Les taux de croissance pré-étude ont été obtenus rétrospectivement. Il n'y avait aucune preuve statistique que le taux de croissance a été réduit pendant le traitement. Pendant le traitement par CASODEX/ARIMIDEX, le taux de croissance moyen (cm/an) a diminué de 1,6 cm/an, IC à 95 % (-4,7 à 1,5) p = 0,28 ; le taux de croissance moyen SDS a diminué de 0,1 SD, IC à 95 % (–1,2 à 1,0) p = 0,88. Le tableau 2 présente les données descriptives des taux de croissance pour la population globale et pour les sous-groupes définis par des antécédents de traitement antérieur de la testotoxicose avec du kétoconazole, de la spironolactone, de l'anastrozole ou d'autres inhibiteurs de l'aromatase.
Les concentrations totales de testostérone ont augmenté en moyenne de 5 mmol/L au cours des 12 mois de traitement à partir d'une moyenne initiale de 10 mmol/L. Les concentrations d'œstradiol étaient égales ou inférieures au niveau de quantification (9,81 pmol/L) pour 11 des 12 patientes après 12 mois de traitement. Six des 12 patients ont commencé le traitement à une concentration d'œstradiol inférieure au niveau de quantification.
Il n'y a pas eu de décès, d'événements indésirables graves ou d'abandons dus à des événements indésirables au cours de l'étude. Sur les 14 patients exposés au traitement à l'étude, 13 (92,9 %) ont présenté au moins un événement indésirable. Les effets indésirables les plus fréquemment rapportés (>3 patients) étaient la gynécomastie (7/14, 50 %), la puberté centrale précoce (6/14, 43 %), les vomissements (5/14, 36 %), les céphalées (3/14, 21 %), pyrexie (3/14, 21 %) et infection des voies respiratoires supérieures (3/14, 21 %). Les effets indésirables considérés comme possiblement liés au bicalutamide par les investigateurs comprenaient la gynécomastie (6/14, 43 %), la puberté précoce centrale (2/14, 14 %), la sensibilité mammaire (2/14, 14 %), la douleur mammaire (1/14, 7 %), asthénie (1/14, 7 %), augmentation de l'alanine aminotransférase [ALT] (1/14, 7 %), augmentation de l'aspartate aminotransférase [AST] (1/14, 7 %) et douleurs thoraciques musculosquelettiques (1 /14, 7%). Les céphalées étaient le seul effet indésirable considéré comme possiblement lié à l'anastrozole par les investigateurs. Pour le patient qui a développé des taux élevés d'ALT et d'AST, l'élévation était
Utilisation gériatrique
Dans deux études chez des patients recevant 50 ou 150 mg par jour, aucune relation significative entre l'âge et les niveaux à l'état d'équilibre du bicalutamide total ou de l'énantiomère R actif n'a été démontrée.
Insuffisance hépatique
CASODEX doit être utilisé avec prudence chez les patients présentant une insuffisance hépatique modérée à sévère. CASODEX est largement métabolisé par le foie. Des données limitées chez des sujets atteints d'insuffisance hépatique sévère suggèrent que l'excrétion de CASODEX peut être retardée et pourrait entraîner une accumulation supplémentaire. Des tests périodiques de la fonction hépatique doivent être envisagés chez les patients insuffisants hépatiques sous traitement à long terme [voir AVERTISSEMENTS ET PRECAUTIONS ].
Aucune différence cliniquement significative dans la pharmacocinétique de l'un ou l'autre des énantiomères du bicalutamide n'a été notée chez les patients atteints d'une maladie hépatique légère à modérée par rapport aux témoins sains. Cependant, la demi-vie de l'énantiomère R a été augmentée d'environ 76 % (5,9 et 10,4 jours pour les patients normaux et altérés, respectivement) chez les patients atteints d'une maladie hépatique grave (n = 4).
Insuffisance rénale
L'insuffisance rénale (mesurée par la clairance de la créatinine) n'a eu aucun effet significatif sur l'élimination du bicalutamide total ou de l'énantiomère R actif.
SURDOSAGE
Des essais cliniques à long terme ont été menés avec des doses allant jusqu'à 200 mg de CASODEX 50 mg par jour et ces doses ont été bien tolérées. Une dose unique de CASODEX 50 mg entraînant des symptômes de surdosage considéré comme mettant la vie en danger n'a pas été établie.
Il n'y a pas d'antidote spécifique; le traitement d'un surdosage doit être symptomatique.
Dans la prise en charge d'un surdosage avec CASODEX 50 mg, des vomissements peuvent être provoqués si le patient est alerte. Il convient de rappeler que, dans cette population de patients, plusieurs médicaments peuvent avoir été pris. La dialyse n'est probablement pas utile car CASODEX est fortement lié aux protéines et est largement métabolisé. Des soins de soutien généraux, y compris une surveillance fréquente des signes vitaux et une observation étroite du patient, sont indiqués.
CONTRE-INDICATIONS
Casodex est contre-indiqué dans :
Hypersensibilité
CASODEX 50 mg est contre-indiqué chez tout patient ayant présenté une réaction d'hypersensibilité au médicament ou à l'un des composants du comprimé. Des réactions d'hypersensibilité, notamment des œdèmes de Quincke et de l'urticaire, ont été rapportées.
Femmes
CASODEX 50mg n'a pas d'indication chez la femme, et ne doit pas être utilisé dans cette population.
Grossesse
CASODEX 50 mg peut nuire au fœtus lorsqu'il est administré à une femme enceinte [voir Utilisation dans des populations spécifiques ].
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
CASODEX 50 mg est un inhibiteur non stéroïdien des récepteurs aux androgènes. Il inhibe de manière compétitive l'action des androgènes en se liant aux récepteurs androgènes du cytosol dans le tissu cible. Le carcinome prostatique est connu pour être sensible aux androgènes et répond à un traitement qui neutralise l'effet des androgènes et/ou supprime la source d'androgènes.
Lorsque CASODEX 50 mg est associé à un traitement par analogue de la LHRH, la suppression de la testostérone sérique induite par l'analogue de la LHRH n'est pas affectée. Cependant, lors d'essais cliniques avec CASODEX en tant qu'agent unique pour le cancer de la prostate, des augmentations de la testostérone sérique et de l'estradiol ont été notées.
Dans un sous-groupe de patients qui ont été traités par CASODEX et un agoniste de la LHRH, et qui arrêtent le traitement par CASODEX 50 mg en raison d'un cancer de la prostate avancé et progressif, une réduction de l'antigène spécifique de la prostate (PSA) et/ou une amélioration clinique (phénomène de sevrage des antiandrogènes) peuvent être observées. observé.
Pharmacocinétique
Absorption
Le bicalutamide est bien absorbé après administration orale, bien que sa biodisponibilité absolue soit inconnue. La co-administration de bicalutamide avec de la nourriture n'a aucun effet cliniquement significatif sur la vitesse ou le degré d'absorption.
Distribution
Le bicalutamide est fortement lié aux protéines (96 %) [voir INTERACTIONS MÉDICAMENTEUSES ].
Métabolisme/Élimination
Le bicalutamide subit un métabolisme stéréospécifique. L'isomère S (inactif) est métabolisé principalement par glucuronidation. L'isomère R (actif) subit également une glucuronidation mais est principalement oxydé en un métabolite inactif suivi d'une glucuronidation. Les glucuronides parent et métabolite sont éliminés dans l'urine et les fèces. L'énantiomère S est rapidement éliminé par rapport à l'énantiomère R, l'énantiomère R représentant environ 99 % des taux plasmatiques totaux à l'état d'équilibre.
La pharmacocinétique de l'énantiomère actif de CASODEX 50 mg chez les hommes normaux et les patients atteints d'un cancer de la prostate est présentée dans le tableau 3.
Etudes cliniques
CASODEX 50 mg par jour en association avec un LHRH-A
Dans un essai clinique contrôlé multicentrique, en double aveugle, 813 patients atteints d'un cancer de la prostate avancé non traité auparavant ont été randomisés pour recevoir CASODEX 50 mg une fois par jour (404 patients) ou du flutamide 250 mg (409 patients) trois fois par jour, chacun dans combinaison avec des analogues de la LHRH (implant d'acétate de goséréline ou dépôt d'acétate de leuprolide).
Dans une analyse menée après qu'un suivi médian de 160 semaines ait été atteint, 213 (52,7 %) patients traités par un analogue de CASODEX-LHRH et 235 (57,5 %) patients traités par un analogue du flutamide-LHRH étaient décédés. Il n'y avait pas de différence significative dans la survie entre les groupes de traitement (voir la figure 1). Le risque relatif pour le délai avant le décès (survie) était de 0,87 (intervalle de confiance à 95 % de 0,72 à 1,05).
Figure 1 - Probabilité de décès selon Kaplan-Meier pour les deux groupes de traitement antiandrogène. 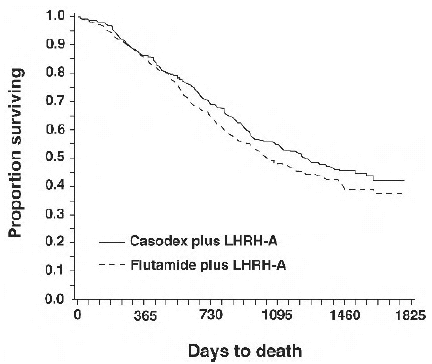
Il n'y avait pas de différence significative dans le temps jusqu'à la progression objective de la tumeur entre les groupes de traitement (voir Figure 2). La progression tumorale objective a été définie comme l'apparition de toute métastase osseuse ou l'aggravation de toute métastase osseuse existante à la scintigraphie osseuse attribuable à une maladie métastatique, ou une augmentation de 25 % ou plus de toute métastase extrasquelettique mesurable existante. Le rapport de risque pour le temps jusqu'à progression de CASODEX plus analogue de la LHRH par rapport à celui du flutamide plus analogue de la LHRH était de 0,93 (intervalle de confiance à 95 %, 0,79 à 1,10).
Figure 2 - Courbe de Kaplan-Meier pour le temps jusqu'à progression pour les deux groupes de traitement antiandrogène. 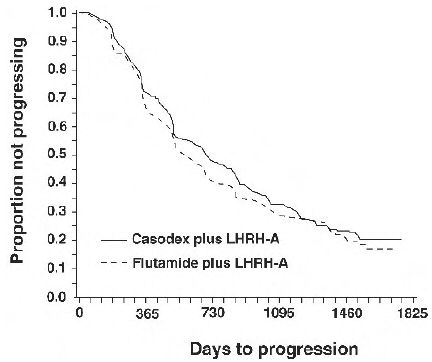
La qualité de vie a été évaluée à l'aide de questionnaires auto-administrés sur la douleur, le fonctionnement social, le bien-être émotionnel, la vitalité, la limitation des activités, l'alitement, la santé globale, la capacité physique, les symptômes généraux et les symptômes liés au traitement. L'évaluation des questionnaires de qualité de vie n'a pas indiqué de différences significatives cohérentes entre les deux groupes de traitement.
Données de sécurité issues d'études cliniques utilisant CASODEX 150 mg
CASODEX 150 mg n'est pas approuvé pour une utilisation seule ou avec d'autres traitements.
Deux essais multicentriques identiques, randomisés et ouverts comparant CASODEX 150 mg par jour en monothérapie à la castration ont été menés chez des patients atteints d'un cancer de la prostate localement avancé (T3-4, NX, M0) ou métastatique (M1).
Monothérapie – Groupe M1
CASODEX 150 mg par jour n'est pas approuvé pour une utilisation chez les patients atteints d'un cancer de la prostate M1. Sur la base d'une analyse intermédiaire des deux essais pour la survie, le comité de surveillance de l'innocuité des données a recommandé l'arrêt du traitement CASODEX chez les patients M1 car le risque de décès était de 25 % (HR 1,25, IC à 95 % 0,87 à 1,81) et de 31 % ( HR 1,31, IC à 95 % 0,97 à 1,77) plus élevé dans le groupe traité par CASODEX 50 mg par rapport à celui du groupe castré, respectivement.
Groupe localement avancé (T3-4, NX, M0)
CASODEX 150 mg par jour n'est pas approuvé pour une utilisation chez les patients atteints d'un cancer de la prostate localement avancé (T3-4, NX, M0). Après l'arrêt de tous les patients M1, les essais se sont poursuivis avec les patients T3-4, NX, M0 jusqu'à la fin de l'étude. Dans le plus grand essai (N = 352), le risque de décès était de 25 % (HR 1,25, IC à 95 % 0,92 à 1,71) plus élevé dans le groupe CASODEX et dans le plus petit essai (N = 140), le risque de décès était de 36 % (HR 0,64, IC à 95 %, 0,39 à 1,03) inférieur dans le groupe CASODEX 50 mg.
Outre les deux études ci-dessus, trois autres études cliniques en cours fournissent des informations supplémentaires sur l'innocuité de CASODEX 150 mg, une dose dont l'utilisation n'est pas approuvée. Il s'agit de trois essais multicentriques, randomisés, en double aveugle et en groupes parallèles comparant CASODEX 150 mg par jour en monothérapie (adjuvant à un traitement précédent ou sous surveillance) à un placebo, pour le décès ou le délai avant progression de la maladie, dans une population de 8 113 patients atteints de cancer de la prostate localisé ou localement avancé.
CASODEX 150 mg par jour n'est pas approuvé comme traitement chez les patients atteints d'un cancer localisé de la prostate qui sont candidats à l'attente sous surveillance. Les données d'une analyse planifiée de sous-groupes de deux de ces essais portant sur 1627 patients atteints d'un cancer localisé de la prostate qui étaient sous surveillance, ont révélé une tendance à la diminution de la survie dans le bras CASODEX après un suivi médian de 7,4 ans. Il y a eu 294 (37,7 %) décès chez les patients traités par CASODEX contre 279 (32,9 %) décès chez les patients traités par placebo (groupe d'attente sous surveillance localisée) pour un risque relatif de 1,16 (IC à 95 % 0,99 à 1,37).
INFORMATIONS PATIENTS
CASODEX® [cas–o–dex] (bicalutamide) Comprimé
Lisez ces informations patient avant de commencer à prendre CASODEX 50 mg et chaque fois que vous recevez une recharge. Il peut y avoir de nouvelles informations. Cette notice ne remplace pas une discussion avec votre fournisseur de soins de santé au sujet de votre état de santé ou de votre traitement.
Qu'est-ce que CASODEX 50mg ?
CASODEX est un médicament délivré sur ordonnance appelé inhibiteur des récepteurs aux androgènes, utilisé en association avec des médicaments contenant de l'hormone de libération de l'hormone lutéinisante (LHRH) pour traiter le cancer de la prostate métastatique de stade D2.
CASODEX n'est pas destiné aux femmes.
On ne sait pas si CASODEX est sûr et efficace chez les enfants.
Qui ne devrait pas prendre CASODEX 50mg ?
Ne prenez jamais CASODEX 50 mg si vous :
- êtes une femme.
- êtes enceinte ou susceptible de le devenir. CASODEX peut nuire à votre bébé à naître.
- êtes allergique à l'un des ingrédients de CASODEX. Voir la fin de cette notice pour une liste complète des ingrédients de CASODEX. Consultez immédiatement un médecin si vous présentez l'un des symptômes suivants d'une réaction allergique : démangeaisons, urticaire (bosses en relief), gonflement du visage, des lèvres ou de la langue, difficulté à respirer ou à avaler.
Que dois-je dire à mon fournisseur de soins de santé avant de prendre CASODEX ?
Avant de prendre CASODEX 50 mg, informez votre professionnel de la santé de toutes vos conditions médicales, y compris si vous :
- avoir des problèmes de foie.
- prendre un médicament pour fluidifier votre sang. Demandez à votre fournisseur de soins de santé ou à votre pharmacien si vous ne savez pas si votre médicament est un anticoagulant.
- souffrez de diabète (un mauvais contrôle de la glycémie a été signalé chez des personnes prenant CASODEX en association avec des médicaments contenant de la LHRH).
- avoir une partenaire enceinte ou susceptible de le devenir. Vous devez utiliser des méthodes contraceptives efficaces pendant que vous prenez CASODEX 50 mg et pendant 130 jours après l'arrêt de CASODEX. Parlez à votre médecin si vous avez des questions sur le contrôle des naissances.
Informez votre professionnel de la santé de tous les médicaments que vous prenez, y compris les médicaments sur ordonnance et en vente libre, les vitamines et les suppléments à base de plantes. CASODEX 50 mg et d'autres médicaments peuvent s'influencer mutuellement et provoquer des effets secondaires. CASODEX peut affecter le fonctionnement d'autres médicaments, et d'autres médicaments peuvent affecter le fonctionnement de CASODEX 50 mg.
Connaissez les médicaments que vous prenez. Conservez une liste de vos médicaments avec vous pour la montrer à vos professionnels de la santé lorsque vous recevez un nouveau médicament.
Comment dois-je prendre CASODEX 50mg ?
- Prenez CASODEX exactement comme votre professionnel de la santé vous l'a dit.
- Prenez CASODEX à la même heure chaque jour.
- Votre traitement par CASODEX 50 mg doit commencer en même temps que votre traitement par le médicament LHRH.
- Si vous oubliez une dose, ne prenez pas de dose supplémentaire, prenez la dose suivante à l'heure habituelle. Ne prenez pas 2 doses en même temps.
- CASODEX 50 mg peut être pris avec ou sans nourriture.
- Si vous avez pris trop de CASODEX, appelez votre fournisseur de soins de santé ou le centre antipoison ou rendez-vous immédiatement aux urgences de l'hôpital le plus proche.
- N'arrêtez pas de prendre CASODEX à moins que votre fournisseur de soins de santé ne vous le dise.
- Votre fournisseur de soins de santé peut effectuer des tests sanguins pendant que vous prenez CASODEX.
- Votre cancer de la prostate peut s'aggraver lors de la prise de CASODEX en association avec des médicaments LHRH.
Un suivi régulier de votre cancer de la prostate avec votre fournisseur de soins de santé est important pour déterminer si votre maladie s'est aggravée.
Que dois-je éviter en prenant CASODEX 50mg ?
Ne conduisez pas, n'utilisez pas de machines ou ne faites pas d'autres activités dangereuses jusqu'à ce que vous sachiez comment CASODEX vous affecte.
Certaines personnes ont eu une sensibilité cutanée à la lumière du soleil pendant qu'elles prenaient CASODEX. Vous devez éviter la lumière du soleil ou les lampes solaires et les lits de bronzage et envisager d'utiliser un écran solaire pendant le traitement avec CASODEX.
Quels sont les effets secondaires possibles de CASODEX 50mg ?
CASODEX peut provoquer des effets secondaires graves, notamment :
- Problèmes de foie, y compris une insuffisance hépatique pouvant nécessiter un traitement à l'hôpital ou pouvant entraîner la mort. Votre fournisseur de soins de santé devrait effectuer des tests sanguins pour vérifier votre fonction hépatique avant et pendant le traitement par CASODEX. Informez immédiatement votre fournisseur de soins de santé si vous présentez l'un de ces symptômes d'un problème de foie pendant le traitement :
- jaunissement de la peau et des yeux (jaunisse)
- urine foncée
- douleur ventre haut droit
- nausée
- vomissement
- fatigue
- perte d'appétit
- des frissons
- fièvre
- Difficulté à respirer avec ou sans toux ou fièvre. Certaines personnes prenant CASODEX 50 mg développent une inflammation des poumons appelée pneumopathie interstitielle.
- Une réaction allergique. Les symptômes d'une réaction allergique comprennent : démangeaisons de la peau, urticaire (bosses en relief), gonflement du visage, des lèvres, de la langue, de la gorge ou difficulté à avaler.
- Grossissement des seins (gynécomastie) et douleurs mammaires.
- Un mauvais contrôle de la glycémie peut survenir chez les personnes qui prennent CASODEX 50 mg en association avec des médicaments LHRH. Votre fournisseur de soins de santé peut vérifier votre glycémie pendant le traitement par CASODEX 50 mg.
Les effets secondaires les plus courants de CASODEX 50 mg incluent :
- bouffées de chaleur ou courtes périodes de sensation de chaleur et de transpiration
- douleur dans tout le corps dans le dos, le bassin, l'estomac
- se sentir faible
- constipation
- infection
- nausée
- gonflement des chevilles, des jambes ou des pieds
- diarrhée
- du sang dans vos urines
- se réveiller du sommeil pour uriner la nuit
- une diminution des globules rouges (anémie)
- avoir le vertige
Dites à votre fournisseur de soins de santé si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de CASODEX. Pour plus d'informations, demandez à votre fournisseur de soins de santé ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
Comment dois-je conserver CASODEX ?
Conservez CASODEX à température ambiante entre 68 °F et 77 °F (20 °C et 25 °C).
Gardez CASODEX 50 mg et tous les médicaments hors de la portée des enfants.
Informations générales sur l'utilisation sûre et efficace de CASODEX.
Les médicaments sont parfois prescrits à des fins autres que celles énumérées dans une notice d'information destinée aux patients. N'utilisez pas CASODEX pour une affection pour laquelle il n'a pas été prescrit. Ne donnez pas CASODEX 50 mg à d'autres personnes, même si elles présentent les mêmes symptômes que vous. Cela peut leur nuire.
Cette notice d'information destinée aux patients résume les informations les plus importantes sur CASODEX. Si vous souhaitez plus d'informations sur CASODEX, parlez-en à votre fournisseur de soins de santé. Vous pouvez demander à votre professionnel de la santé ou à votre pharmacien des informations sur CASODEX rédigées pour les professionnels de la santé. Pour plus d'informations, rendez-vous sur www.CASODEX.com ou appelez le 1-800-236-9933.
Quels sont les ingrédients de CASODEX 50mg ?
Ingrédient actif: bicalutamide.
Ingrédients inactifs: lactose, stéarate de magnésium, hypromellose, polyéthylèneglycol, polyvidone, glycolate d'amidon sodique, dioxyde de titane.
Ces informations destinées aux patients ont été approuvées par la Food and Drug Administration des États-Unis.
