Suprax 100mg, 200mg Cefixime Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Suprax 200 mg et comment est-il utilisé ?
Suprax (céfixime) pour suspension orale est un antibiotique céphalosporine utilisé pour traiter de nombreux types d'infections causées par des bactéries.
Quels sont les effets secondaires de Suprax ?
Les effets secondaires courants de Suprax 100 mg incluent :
- maux d'estomac/douleurs,
- diarrhée,
- nausée,
- constipation,
- perte d'appétit,
- gaz,
- mal de tête,
- vertiges,
- anxiété,
- somnolence,
- augmentation de la miction nocturne,
- nez qui coule,
- mal de gorge,
- toux, ou
- démangeaisons ou pertes vaginales.
Informez votre médecin si vous ressentez des effets secondaires rares mais très graves de Suprax 200 mg, notamment :
- fortes douleurs gastriques ou abdominales,
- nausées ou vomissements persistants,
- jaunissement des yeux ou de la peau,
- urine foncée,
- fatigue inhabituelle,
- nouveaux signes d'infection (p. ex., mal de gorge persistant, fièvre),
- ecchymoses ou saignements faciles,
- modification de la quantité d'urine, ou
- changements mentaux/d'humeur (comme la confusion).
LA DESCRIPTION
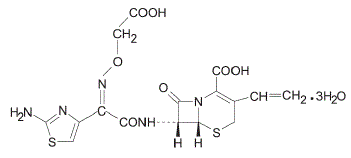
Le céfixime est un antibactérien semi-synthétique de type céphalosporine pour administration orale. Chimiquement, il s'agit du (6R,7R)-7-[2-(2-Amino-4-thiazolyl)glyoxylamido]-8-oxo-3-vinyl-5-thia-1-azabicyclo [4.2.0] oct-2 -ène-2-acide carboxylique, 72-(Z)-[O-(carboxy méthyl) oxime] trihydraté.
Poids moléculaire = 507,50 sous forme de trihydrate. La formule chimique est C16H15N5O7S2.3H2O
La formule structurelle du céfixime est :
- Les ingrédients inactifs contenus dans les comprimés SUPRAX® (céfixime) à 400 mg USP sont : phosphate de calcium dibasique, hypromellose, lactose monohydraté, stéarate de magnésium, cellulose microcristalline, polyéthylèneglycol, amidon prégélatinisé, dioxyde de titane et triacétine.
- Les ingrédients inactifs contenus dans les gélules de SUPRAX® (céfixime) à 400 mg sont : dioxyde de silice colloïdale, crospovidone, hydroxypropylcellulose faiblement substituée, stéarate de magnésium et mannitol. L'enveloppe de la gélule contient les ingrédients inactifs suivants : oxyde de fer noir, oxyde de fer rouge, gélatine, hydroxyde de potassium, propylène glycol, gomme laque, laurylsulfate de sodium et dioxyde de titane.
- Les ingrédients inactifs contenus dans SUPRAX® (céfixime) 100 mg ou 150 mg ou 200 mg comprimés à croquer sont : aspartame, dioxyde de silicium colloïdal, crospovidone, laque d'aluminium FD&C rouge n° 40, hydroxypropylcellulose faiblement substituée, stéarate de magnésium, mannitol, permaseal saveur fantaisie, et saveur tutti frutti.
- Les ingrédients inactifs contenus dans SUPRAX® (céfixime) en poudre pour suspension buvable USP sont : dioxyde de silice colloïdale, benzoate de sodium, arôme de fraise, sucralose (seulement en dosage de 500 mg/5 mL), saccharose et gomme de xanthane.
LES INDICATIONS
Infections urinaires non compliquées
SUPRAX est indiqué dans le traitement des adultes et des enfants âgés de six mois ou plus atteints d'infections urinaires non compliquées causées par des isolats sensibles d'Escherichia coli et de Proteus mirabilis.
Otite moyenne
SUPRAX est indiqué dans le traitement des adultes et des enfants âgés de six mois ou plus atteints d'otite moyenne causée par des isolats sensibles d'Haemophilus influenzae, de Moraxella catarrhalis et de Streptococcus pyogenes. (L'efficacité de Streptococcus pyogenes dans ce système organique a été étudiée dans moins de 10 infections.)
Noter
Pour les patients atteints d'otite moyenne causée par Streptococcus pneumoniae, la réponse globale était d'environ 10 % inférieure pour le céfixime que pour le comparateur [voir Etudes cliniques ].
Pharyngite et amygdalite
SUPRAX est indiqué dans le traitement des patients adultes et pédiatriques âgés de six mois ou plusavec pharyngite et amygdalite causées par des isolats sensibles de Streptococcus pyogenes. (Remarque : la pénicilline est le médicament de choix habituel dans le traitement des infections à Streptococcus pyogenes. SUPRAX est généralement efficace dans l'éradication de Streptococcus pyogenes du nasopharynx ; cependant, les données établissant l'efficacité de SUPRAX 100 mg dans la prévention ultérieure du rhumatisme articulaire aigu ne sont pas disponibles. disponible.)
Exacerbations aiguës de la bronchite chronique
SUPRAX 200 mg est indiqué dans le traitement des adultes et des patients pédiatriques âgés de six mois ou plus présentant des exacerbations aiguës de bronchite chronique causées par des isolats sensibles de Streptococcus pneumoniae et Haemophilus influenzae.
Gonorrhée non compliquée (cervicale/urétrale)
SUPRAX 100 mg est indiqué dans le traitement des adultes et des patients pédiatriques âgés de six mois ou plus atteints de gonorrhée non compliquée (cervicale/urétrale) causée par des isolats sensibles de Neisseria gonorrhoeae (isolats producteurs de pénicillinase et non pénicillinase).
Usage
Afin de réduire le développement de bactéries résistantes aux médicaments et de maintenir l'efficacité de SUPRAX 100 mg et d'autres médicaments antibactériens, SUPRAX 100 mg doit être utilisé uniquement pour traiter les infections dont il est prouvé ou fortement suspecté qu'elles sont causées par des bactéries sensibles. Lorsque des informations sur la culture et la sensibilité sont disponibles, elles doivent être prises en compte lors de la sélection ou de la modification de la thérapie antimicrobienne. En l'absence de telles données, l'épidémiologie locale et les schémas de sensibilité peuvent contribuer à la sélection empirique du traitement.
DOSAGE ET ADMINISTRATION
Adultes
La dose recommandée de céfixime est de 400 mg par jour. Celui-ci peut être administré sous forme de comprimé ou de capsule à 400 mg par jour ou le comprimé à 400 mg peut être fractionné et administré sous forme d'un demi-comprimé toutes les 12 heures. Pour le traitement des infections gonococciques cervicales/urétrales non compliquées, une dose orale unique de 400 mg est recommandée. La gélule et le comprimé peuvent être administrés sans égard aux aliments.
Dans le traitement des infections dues à Streptococcus pyogenes, une posologie thérapeutique de céfixime doit être administrée pendant au moins 10 jours.
Patients pédiatriques (6 mois ou plus)
La dose recommandée est de 8 mg/kg/jour de suspension. Celui-ci peut être administré en une dose quotidienne unique ou peut être administré en deux doses fractionnées, à raison de 4 mg/kg toutes les 12 heures.
Noter
Une dose suggérée a été déterminée pour chaque tranche de poids pédiatrique. Consultez le tableau 1. Assurez-vous que toutes les commandes qui spécifient une dose en millilitres incluent une concentration, car SUPRAX pour suspension buvable est disponible en trois concentrations différentes (100 mg/5 mL, 200 mg/5 mL et 500 mg/5 mL).
Les enfants pesant plus de 45 kg ou âgés de plus de 12 ans doivent être traités avec la dose adulte recommandée. Les comprimés à croquer SUPRAX (céfixime) doivent être mâchés ou écrasés avant d'être avalés.
L'otite moyenne doit être traitée avec les comprimés à croquer ou la suspension. Des essais cliniques sur l'otite moyenne ont été menés avec les comprimés à croquer ou la suspension, et les comprimés à croquer ou la suspension entraînent des concentrations sanguines maximales plus élevées que le comprimé lorsqu'il est administré à la même dose.
Par conséquent, le comprimé ou la gélule ne doit pas remplacer les comprimés à croquer ou la suspension dans le traitement de l'otite moyenne [voir PHARMACOLOGIE CLINIQUE ].
Dans le traitement des infections dues à Streptococcus pyogenes, une posologie thérapeutique de céfixime doit être administrée pendant au moins 10 jours.
Insuffisance rénale
SUPRAX 200 mg peut être administré en présence d'insuffisance rénale. La dose et le calendrier normaux peuvent être utilisés chez les patients dont la clairance de la créatinine est de 60 mL/min ou plus. Se référer au tableau 2 pour les ajustements posologiques chez les adultes atteints d'insuffisance rénale. Ni l'hémodialyse ni la dialyse péritonéale n'éliminent des quantités significatives de médicament du corps.
Instructions de reconstitution pour la suspension orale
Après reconstitution, la suspension peut être conservée pendant 14 jours soit à température ambiante, soit au réfrigérateur, sans perte significative d'activité. Gardez bien fermé. Bien agiter avant utilisation. Jeter la portion inutilisée après 14 jours.
COMMENT FOURNIE
Formes posologiques et points forts
SUPRAX est disponible pour administration orale dans les formes posologiques et dosages suivants :
- Les comprimés pelliculés apportent 400 mg de céfixime sous forme trihydratée. Ce sont des comprimés blancs à blanc cassé, pelliculés, en forme de gélule avec des bords biseautés et une ligne de cassure divisée de chaque côté. Le comprimé est gravé avec "SUPRAX" sur un côté et "LUPIN" sur l'autre côté.
- Les gélules fournissent 400 mg de céfixime sous forme de trihydrate. Ce sont des gélules de taille « 00EL » avec un capuchon rose opaque et un corps rose opaque avec « LU » sur le capuchon et « U43 » sur le corps à l'encre noire. Les gélules contiennent une poudre granuleuse blanche à blanc jaunâtre.
- Les comprimés à croquer fournissent soit 100 mg, soit 150 mg, soit 200 mg de céfixime sous forme de trihydrate. Le comprimé de 100 mg est rose, rond, portant l'inscription « SUPRAX 100 » gravée sur une face et « LUPIN » sur l'autre face. Le comprimé de 150 mg est rose, rond, portant l'inscription « SUPRAX 150 » gravée sur une face et « LUPIN » sur l'autre face. Le comprimé de 200 mg est rose, rond, portant l'inscription « SUPRAX 200 » gravée sur une face et « LUPIN » sur l'autre face.
- La poudre pour suspension buvable, une fois reconstituée, fournit soit 100 mg/5 ml, soit 200 mg/5 ml, soit 500 mg/5 ml de céfixime sous forme de trihydrate. Pour 100 mg/5 mL et 200 mg/5 mL, la poudre a une couleur blanc cassé à jaune pâle et est aromatisée à la fraise. Pour 500 mg/5 mL, la poudre a une couleur blanc cassé à crème et est aromatisée à la fraise.
Stockage et manutention
SUPRAX® est disponible pour administration orale dans les formes posologiques, dosages et conditionnements suivants, répertoriés dans le tableau ci-dessous :
Fabriqué par : Lupin Limited Mandideep 462 046 Inde. Révisé : mars 2018.
EFFETS SECONDAIRES
Expérience des essais cliniques
Étant donné que les essais cliniques sont menés dans des conditions très variables, les taux d'effets indésirables observés dans les essais cliniques d'un médicament ne peuvent pas être directement comparés aux taux des essais cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique.
Les effets indésirables les plus fréquemment observés dans les essais américains de la formulation en comprimés étaient des événements gastro-intestinaux, qui ont été signalés chez 30 % des patients adultes recevant le régime deux fois par jour ou une fois par jour. Cinq pour cent (5 %) des patients des essais cliniques américains ont interrompu le traitement en raison d'effets indésirables liés au médicament. Les effets indésirables individuels comprenaient la diarrhée 16 %, des selles molles ou fréquentes 6 %, des douleurs abdominales 3 %, des nausées 7 %, une dyspepsie 3 % et des flatulences 4 %. L'incidence des effets indésirables gastro-intestinaux, y compris la diarrhée et les selles molles, chez les patients pédiatriques recevant la suspension était comparable à l'incidence observée chez les patients adultes recevant des comprimés.
Expérience post-commercialisation
Les effets indésirables suivants ont été rapportés suite à l'utilisation post-approbation du céfixime. Les taux d'incidence étaient inférieurs à 1 sur 50 (moins de 2 %).
Gastro-intestinal
Plusieurs cas documentés de colite pseudomembraneuse ont été identifiés lors d'essais cliniques. L'apparition de symptômes de colite pseudomembraneuse peut survenir pendant ou après le traitement.
Réactions d'hypersensibilité
Réactions anaphylactiques/anaphylactoïdes (y compris choc et décès), éruptions cutanées, urticaire, fièvre médicamenteuse, prurit, œdème de Quincke et œdème facial. Un érythème polymorphe, un syndrome de Stevens-Johnson et des réactions de type maladie sérique ont été rapportés.
Hépatique
élévations transitoires du SGPT, du SGOT, de la phosphatase alcaline, de l'hépatite, de la jaunisse.
Rénal
Élévations transitoires de l'urée ou de la créatinine, insuffisance rénale aiguë.
Système nerveux central
Maux de tête, vertiges, convulsions.
Système sanguin et lymphatique
Thrombocytopénie transitoire, leucopénie, neutropénie, allongement du temps de prothrombine, LDH élevée, pancytopénie, agranulocytose et éosinophilie.
Tests de laboratoire anormaux
Hyperbilirubinémie.
Autres effets indésirables
Prurit génital, vaginite, candidose, nécrolyse épidermique toxique.
Effets indésirables signalés pour les médicaments de la classe des céphalosporines
Réactions allergiques, surinfection, dysfonctionnement rénal, néphropathie toxique, dysfonctionnement hépatique, y compris cholestase, anémie aplasique, anémie hémolytique, hémorragie et colite.
Plusieurs céphalosporines ont été impliquées dans le déclenchement des crises, en particulier chez les insuffisants rénaux lorsque la posologie n'a pas été réduite [voir DOSAGE ET ADMINISTRATION voir SURDOSAGE ]. Si des convulsions associées au traitement médicamenteux surviennent, le médicament doit être arrêté. Un traitement anticonvulsivant peut être administré si cliniquement indiqué.
INTERACTIONS MÉDICAMENTEUSES
Carbamazépine
Des taux élevés de carbamazépine ont été rapportés depuis la commercialisation lorsque le céfixime est administré de façon concomitante. La pharmacovigilance peut aider à détecter les modifications des concentrations plasmatiques de carbamazépine.
Warfarine et anticoagulants
Une augmentation du temps de prothrombine, avec ou sans saignement clinique, a été rapportée lors de l'administration concomitante de céfixime.
Interactions médicament/test de laboratoire
Une réaction faussement positive pour les cétones dans l'urine peut se produire avec des tests utilisant du nitroprussiate, mais pas avec ceux utilisant du nitroferricyanure.
L'administration de céfixime peut entraîner une réaction faussement positive pour le glucose dans l'urine en utilisant Clinitest®, la solution de Benedict ou la solution de Fehling. Il est recommandé d'utiliser des tests de glycémie basés sur des réactions enzymatiques de glucose oxydase (tels que Clinistix® ou TesTape®). Un test de Coombs direct faussement positif a été rapporté lors d'un traitement par d'autres céphalosporines ; par conséquent, il faut reconnaître qu'un test de Coombs positif peut être dû au médicament.
AVERTISSEMENTS
Inclus dans le cadre du PRÉCAUTIONS section.
PRÉCAUTIONS
Réactions d'hypersensibilité
Des réactions anaphylactiques/anaphylactoïdes (y compris des chocs et des décès) ont été rapportées avec l'utilisation de céfixime.
Avant que le traitement par SUPRAX ne soit institué, une enquête approfondie doit être effectuée pour déterminer si le patient a déjà eu des réactions d'hypersensibilité aux céphalosporines, aux pénicillines ou à d'autres médicaments. Si ce produit doit être administré à des patients sensibles à la pénicilline, la prudence s'impose car l'hypersensibilité croisée entre les médicaments antibactériens bêta-lactamines a été clairement documentée et peut survenir chez jusqu'à 10 % des patients ayant des antécédents d'allergie à la pénicilline. En cas de réaction allergique à SUPRAX 100 mg, arrêtez le médicament.
Diarrhée associée à Clostridium difficile
Des diarrhées associées à Clostridium difficile (DACD) ont été signalées avec l'utilisation de presque tous les agents antibactériens, y compris SUPRAX 200 mg, et leur gravité peut varier d'une diarrhée légère à une colite mortelle. Le traitement avec des agents antibactériens altère la flore normale du côlon, entraînant une prolifération de C. difficile.
C. difficile produit les toxines A et B qui contribuent au développement de CDAD. Les isolats de C. difficile produisant de l'hypertoxine entraînent une morbidité et une mortalité accrues, car ces infections peuvent être réfractaires au traitement antimicrobien et peuvent nécessiter une colectomie. La DACD doit être envisagée chez tous les patients qui présentent une diarrhée suite à l'utilisation de médicaments antibactériens. Des antécédents médicaux minutieux sont nécessaires car il a été rapporté que la DACD survient plus de deux mois après l'administration d'agents antibactériens.
Si la DACD est suspectée ou confirmée, l'utilisation continue de médicaments antibactériens non dirigés contre C. difficile peut devoir être interrompue. Une gestion appropriée des fluides et des électrolytes, une supplémentation en protéines, un traitement médicamenteux antibactérien de C. difficile et une évaluation chirurgicale doivent être institués selon les indications cliniques.
Ajustement posologique en cas d'insuffisance rénale
La dose de SUPRAX 100 mg doit être ajustée chez les patients atteints d'insuffisance rénale ainsi que chez ceux qui subissent une dialyse péritonéale continue ambulatoire (DPCA) et une hémodialyse (HD). Les patients sous dialyse doivent être surveillés attentivement [voir DOSAGE ET ADMINISTRATION ].
Effets de coagulation
Les céphalosporines, dont SUPRAX 200 mg, peuvent être associées à une baisse de l'activité de la prothrombine. Les personnes à risque comprennent les patients présentant une insuffisance rénale ou hépatique, ou un mauvais état nutritionnel, ainsi que les patients recevant un traitement antimicrobien prolongé et les patients précédemment stabilisés par un traitement anticoagulant. Le temps de prothrombine doit être surveillé chez les patients à risque et la vitamine K exogène doit être administrée selon les indications.
Développement de bactéries résistantes aux médicaments
Prescrire SUPRAX (céfixime) en l'absence d'infection bactérienne avérée ou fortement suspectée est peu susceptible d'apporter un bénéfice au patient et augmente le risque de développement de bactéries résistantes aux médicaments.
Risque chez les patients atteints de phénylcétonurie
La phénylalanine peut être nocive pour les patients atteints de phénylcétonurie (PCU). Les comprimés à croquer SUPRAX 200 mg contiennent de l'aspartame, une source de phénylalanine. Chaque dosage de 100 mg, 150 mg et 200 mg contient respectivement 3,3 mg, 5 mg et 6,7 mg de phénylalanine. Avant de prescrire des comprimés à croquer SUPRAX à un patient atteint de PCU, tenez compte de la quantité quotidienne combinée de phénylalanine provenant de toutes les sources, y compris les comprimés à croquer SUPRAX 200 mg.
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Aucune étude sur la durée de vie chez l'animal pour évaluer le potentiel carcinogène n'a été menée. Le céfixime n'a pas provoqué de mutations ponctuelles dans les bactéries ou les cellules de mammifères, ni de dommages à l'ADN ou aux chromosomes in vitro et n'a pas présenté de potentiel clastogène in vivo dans le test du micronoyau chez la souris. Chez le rat, la fertilité et les performances de reproduction n'ont pas été affectées par le céfixime à des doses allant jusqu'à 25 fois la dose thérapeutique chez l'adulte.
Utilisation dans des populations spécifiques
Grossesse
Catégorie de grossesse B
Des études de reproduction ont été réalisées chez des souris et des rats à des doses allant jusqu'à 40 fois la dose humaine et n'ont révélé aucun signe d'effet nocif sur le fœtus dû au céfixime. Il n'y a pas d'études adéquates et bien contrôlées chez les femmes enceintes. Étant donné que les études sur la reproduction chez l'animal ne sont pas toujours prédictives de la réponse humaine, ce médicament ne doit être utilisé pendant la grossesse qu'en cas de nécessité absolue.
Travail et accouchement
Cefixime n'a pas été étudié pour une utilisation pendant le travail et l'accouchement. Le traitement ne doit être administré que s'il est clairement nécessaire.
Mères allaitantes
On ne sait pas si le céfixime est excrété dans le lait maternel. Il faut envisager d'interrompre temporairement l'allaitement pendant le traitement par ce médicament.
Utilisation pédiatrique
La sécurité et l'efficacité du céfixime chez les enfants âgés de moins de six mois n'ont pas été établies. L'incidence des effets indésirables gastro-intestinaux, y compris la diarrhée et les selles molles, chez les patients pédiatriques recevant la suspension, était comparable à l'incidence observée chez les patients adultes recevant des comprimés.
Utilisation gériatrique
Les études cliniques n'ont pas inclus un nombre suffisant de sujets âgés de 65 ans et plus pour déterminer s'ils réagissent différemment des sujets plus jeunes. L'autre expérience clinique annoncée n'a pas identifié de différences dans les réponses entre les patients assez âgés et plus jeunes. Une étude pharmacocinétique chez les personnes âgées a détecté des différences dans les paramètres pharmacocinétiques [voir PHARMACOLOGIE CLINIQUE ]. Ces différences étaient faibles et n'indiquent pas la nécessité d'ajuster la posologie du médicament chez les personnes âgées.
Insuffisance rénale
La dose de céfixime doit être ajustée chez les patients atteints d'insuffisance rénale ainsi que chez ceux qui subissent une dialyse péritonéale continue ambulatoire (DPCA) et une hémodialyse (HD). Les patients sous dialyse doivent être surveillés attentivement [voir DOSAGE ET ADMINISTRATION ].
SURDOSAGE
Un lavage gastrique peut être indiqué; sinon, aucun antidote spécifique n'existe. Le céfixime n'est pas éliminé en quantités significatives de la circulation par hémodialyse ou dialyse péritonéale. Les effets indésirables observés chez un petit nombre de volontaires adultes sains recevant des doses uniques allant jusqu'à 2 g de céfixime n'ont pas différé du profil observé chez les patients traités aux doses recommandées.
CONTRE-INDICATIONS
Suprax (céfixime) est contre-indiqué chez les patients présentant une allergie connue au céfixime ou à d'autres céphalosporines.
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
Le céfixime est un médicament antibactérien de type céphalosporine semi-synthétique [voir Microbiologie ].
Pharmacocinétique
Les comprimés à croquer SUPRAX 200 mg sont bioéquivalents à la suspension buvable.
Les comprimés et la suspension de SUPRAX 200 mg, administrés par voie orale, sont absorbés à environ 40 % à 50 %, qu'ils soient administrés avec ou sans nourriture ; cependant, le temps d'absorption maximale est augmenté d'environ 0,8 heure lorsqu'il est administré avec de la nourriture. Un seul comprimé de 200 mg de céfixime produit une concentration sérique maximale moyenne d'environ 2 mcg/mL (gamme de 1 à 4 mcg/mL); un seul comprimé de 400 mg produit une concentration maximale moyenne d'environ 3,7 mcg/mL (plage de 1,3 à 7,7 mcg/mL). La suspension buvable produit des concentrations maximales moyennes d'environ 25 % à 50 % supérieures à celles des comprimés, lorsqu'elles sont testées sur des volontaires adultes normaux. Des doses de 200 et 400 mg de suspension buvable produisent des concentrations maximales moyennes de 3 mcg/mL (intervalle de 1 à 4,5 mcg/mL) et 4,6 mcg/mL (intervalle de 1,9 à 7,7 mcg/mL), respectivement, lorsqu'elles sont testées chez des volontaires adultes normaux . L'aire sous la courbe temps en fonction de la concentration (ASC) est supérieure d'environ 10 % à 25 % avec la suspension buvable qu'avec le comprimé après des doses de 100 à 400 mg, lorsqu'elles sont testées chez des volontaires adultes sains. Cette augmentation de l'absorption doit être prise en compte si la suspension buvable doit remplacer le comprimé. En raison de l'absence de bioéquivalence, les comprimés ne doivent pas remplacer la suspension buvable dans le traitement de l'otite moyenne [voir DOSAGE ET ADMINISTRATION ]. Aucune étude croisée comparant les comprimés à la suspension n'a été réalisée chez les enfants.
La gélule de 400 mg est bioéquivalente au comprimé de 400 mg à jeun. Cependant, la nourriture réduit l'absorption après l'administration de la gélule d'environ 15 % sur la base de l'ASC et de 25 % sur la base de la Cmax.
Les concentrations sériques maximales surviennent entre 2 et 6 heures après l'administration orale d'un seul comprimé de 200 mg, d'un seul comprimé de 400 mg ou de 400 mg de suspension de céfixime. Les concentrations sériques maximales surviennent entre 2 et 5 heures après une administration unique de 200 mg de suspension. Les concentrations sériques maximales surviennent entre 3 et 8 heures après l'administration orale d'une seule gélule de 400 mg.
Distribution
La liaison aux protéines sériques est indépendante de la concentration avec une fraction liée d'environ 65 %. Dans une étude à doses multiples menée avec une formulation de recherche qui est moins biodisponible que le comprimé ou la suspension, il y avait peu d'accumulation de médicament dans le sérum ou l'urine après administration pendant 14 jours. Des données adéquates sur les taux de céfixime dans le LCR ne sont pas disponibles.
Métabolisme et excrétion
Il n'y a aucune preuve de métabolisme du céfixime in vivo. Environ 50 % de la dose absorbée est excrétée sous forme inchangée dans l'urine en 24 heures. Dans les études animales, il a été noté que le céfixime est également excrété dans la bile à plus de 10 % de la dose administrée. La demi-vie sérique du céfixime chez les sujets sains est indépendante de la forme posologique et est en moyenne de 3 à 4 heures, mais peut aller jusqu'à 9 heures chez certains volontaires sains.
Populations particulières
Gériatrie
Les ASC moyennes à l'état d'équilibre chez les patients âgés sont environ 40 % plus élevées que les ASC moyennes chez les autres adultes en bonne santé. Les différences des paramètres pharmacocinétiques entre 12 sujets jeunes et 12 sujets âgés ayant reçu 400 mg de céfixime une fois par jour pendant 5 jours sont résumées comme suit :
Cependant, ces augmentations n'étaient pas cliniquement significatives [voir DOSAGE ET ADMINISTRATION ].
Insuffisance rénale
Chez les sujets présentant une insuffisance rénale modérée (clairance de la créatinine de 20 à 40 ml/min), la demi-vie sérique moyenne du céfixime est prolongée à 6,4 heures. En cas d'insuffisance rénale sévère (clairance de la créatinine de 5 à 20 mL/min), la demi-vie a augmenté jusqu'à une moyenne de 11,5 heures. Le médicament n'est pas éliminé de manière significative du sang par hémodialyse ou dialyse péritonéale. Cependant, une étude a indiqué qu'avec des doses de 400 mg, les patients sous hémodialyse ont des profils sanguins similaires à ceux des sujets ayant une clairance de la créatinine de 21 à 60 mL/min.
Microbiologie
Mécanisme d'action
Comme pour les autres céphalosporines, l'action bactéricide du céfixime résulte de l'inhibition de la synthèse de la paroi cellulaire. Le céfixime est stable en présence de certaines enzymes bêta-lactamases. Par conséquent, certains organismes résistants aux pénicillines et à certaines céphalosporines en raison de la présence de bêtalactamases peuvent être sensibles au céfixime.
La résistance
La résistance au céfixime dans les isolats d'Haemophilus influenzae et de Neisseria gonorrhoeae est le plus souvent associée à des altérations des protéines de liaison à la pénicilline (PBP). Le céfixime peut avoir une activité limitée contre les entérobactéries produisant des bêta-lactamases à spectre étendu (BLSE). Les espèces Pseudomonas, les espèces Enterococcus, les souches de streptocoques du groupe D, Listeria monocytogenes, la plupart des souches de staphylocoques (y compris les souches résistantes à la méthicilline), la plupart des souches des espèces Enterobacter, la plupart des souches de Bacteroides fragilis et la plupart des souches des espèces Clostridium sont résistantes au céfixime.
Activité anti-microbienne
Le céfixime s'est avéré actif contre la plupart des isolats des micro-organismes suivants, à la fois in vitro et dans les infections cliniques [voir LES INDICATIONS ].
Bactéries à Gram positif
Streptococcus pneumoniae Streptococcus pyogènes
Bactéries Gram-négatives
Escherichia coli Haemophilus influenzae Moraxella catarrhalis Neisseria gonorrhoeae Proteus mirabilis
Les données in vitro suivantes sont disponibles, mais leur signification clinique est inconnue. Au moins 90 % des bactéries suivantes présentent une concentration minimale inhibitrice (CMI) in vitro inférieure ou égale au seuil de sensibilité du céfixime contre des isolats de genre ou de groupe d'organismes similaires. Cependant, l'efficacité du céfixime dans le traitement des infections cliniques causées par ces bactéries n'a pas été établie dans des essais cliniques adéquats et bien contrôlés.
Bactéries à Gram positif
Streptococcus agalactie
Bactéries Gram-négatives
Citrobacter amalonaticus Citrobacter diversus Haemophilus parainfluenzae Klebsiella oxytoca Klebsiella pneumoniae Pasteurella multocida Proteus vulgaris Espèce Providencia Espèce Salmonella Serratia marcescens Espèce Shigella
Test de sensibilité
Pour des informations spécifiques concernant les critères d'interprétation des tests de sensibilité et les méthodes de test associées et les normes de contrôle qualité reconnues par la FDA pour ce médicament, veuillez consulter : https://www.fda.gov/STIC.
Etudes cliniques
Des essais cliniques comparatifs sur l'otite moyenne ont été menés chez près de 400 enfants âgés de 6 mois à 10 ans. Streptococcus pneumoniae a été isolé chez 47 % des patients, Haemophilus influenzae chez 34 %, Moraxella catarrhalis chez 15 % et S. pyogenes chez 4 %.
Le taux de réponse global de Streptococcus pneumoniae au céfixime était d'environ 10 % inférieur et celui d'Haemophilus influenzae ou de Moraxella catarrhalis d'environ 7 % supérieur (12 % lorsque les isolats positifs à la bêta-lactamase de H. influenzae sont inclus) que les taux de réponse de ces organismes à les médicaments de contrôle actif.
Dans ces études, les patients ont été randomisés et traités soit par céfixime à des schémas posologiques de 4 mg/kg deux fois par jour ou 8 mg/kg une fois par jour, soit avec un comparateur. Soixante-neuf à 70 % des patients de chaque groupe ont présenté une résolution des signes et symptômes de l'otite moyenne lors de l'évaluation 2 à 4 semaines après le traitement, mais un épanchement persistant a été observé chez 15 % des patients. Lors de l'évaluation à la fin du traitement, 17 % des patients recevant du céfixime et 14 % des patients recevant des médicaments comparatifs efficaces (18 % incluant les patients qui avaient un Haemophilus influenzae résistant au médicament témoin et qui ont reçu le médicament antibactérien témoin) ont été considérés comme échecs thérapeutiques. Lors du suivi de 2 à 4 semaines, un total de 30 à 31 % des patients présentaient des signes d'échec du traitement ou de récidive de la maladie.
Résultat bactériologique de l'otite moyenne deux à quatre semaines après le traitement basé sur l'oreille moyenne répétée
INFORMATIONS PATIENTS
Conseillez aux patients que les médicaments antibactériens, y compris le céfixime, ne doivent être utilisés que pour traiter les infections bactériennes. Ils ne traitent pas les infections virales (par exemple, le rhume). Lorsque la céfixime est prescrite pour traiter une infection bactérienne, les patients doivent être informés que même s'il est courant de se sentir mieux au début du traitement, le médicament doit être pris exactement comme indiqué. Sauter des doses ou ne pas terminer le traitement complet peut : (1) diminuer l'efficacité du traitement immédiat et (2) augmenter la probabilité que les bactéries développent une résistance et ne puissent pas être traitées par le céfixime pour suspension buvable ou les comprimés à croquer de céfixime ou d'autres médicaments antibactériens à l'avenir.
Informez les patients atteints de phénylcétonurie que les comprimés à croquer SUPRAX 200 mg contiennent de l'aspartame, une source de phénylalanine comme suit : chaque comprimé à croquer SUPRAX contient 3,3 mg, 5 mg et 6,7 mg de phénylalanine par dose de 100 mg, 150 mg et 200 mg, respectivement.
Informez les patients que la diarrhée est un problème courant causé par les médicaments antibactériens qui se termine généralement lorsque le médicament antibactérien est arrêté. Parfois, après le début du traitement avec des médicaments antibactériens, les patients peuvent développer des selles liquides et sanglantes (avec ou sans crampes d'estomac et fièvre) même deux mois ou plus après avoir pris la dernière dose du médicament antibactérien. Si cela se produit, les patients doivent contacter leur médecin dès que possible.
