Ceftin 250mg, 500mg, 125mg Cefuroxime Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Ceftin 500 mg et comment est-il utilisé ?
Ceftin 500mg est un médicament délivré sur ordonnance utilisé pour traiter les symptômes des infections bactériennes. Ceftin peut être utilisé seul ou avec d'autres médicaments.
Ceftin 250mg est un antibiotique céphalosporine.
On ne sait pas si Ceftin est sûr et efficace chez les enfants de moins de 3 mois.
Quels sont les effets secondaires possibles de Ceftin ?
Ceftin 250 mg peut provoquer des effets secondaires graves, notamment :
- fortes douleurs à l'estomac,
- diarrhée (avec ou sans sang),
- jaunissement de la peau ou des yeux,
- démangeaison de la peau,
- ecchymoses,
- picotements ou engourdissements sévères,
- saisie (convulsions),
- miction difficile ou douloureuse,
- gonflement des pieds, des chevilles, du visage ou de la langue,
- fatigue ,
- essoufflement,
- fièvre,
- mal de gorge,
- brûlant dans tes yeux,
- douleur cutanée avec une éruption rouge ou violette,
- ampoules et desquamation de la peau
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Ceftin incluent :
- diarrhée,
- nausée,
- vomissement,
- goût inhabituel ou désagréable dans la bouche,
- érythème fessier chez un nourrisson,
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Ceftin. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
LA DESCRIPTION
Les comprimés CEFTIN 500 mg et CEFTIN pour suspension buvable contiennent du céfuroxime sous forme de céfuroxime axétil. CEFTIN est un médicament antibactérien semi-synthétique de type céphalosporine pour administration orale.
Le nom chimique du céfuroxime axétil (ester 1-(acétyloxy)éthylique du céfuroxime) est (RS)-1- hydroxyéthyl (6R,7R)-7-[2-(2-furyl)glyoxyl-amido]-3-(hydroxyméthyl )-8-oxo-5-thia-1-azabicyclo[4.2.0]-oct-2-ène-2-carboxylate, 72-(Z)-(O-méthyl-oxime), 1-acétate 3-carbamate. Sa formule moléculaire est C20H22N4O10S et son poids moléculaire est de 510,48.
Le céfuroxime axétil est sous forme amorphe et a la formule structurale suivante :
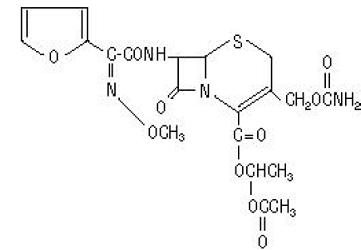
Les comprimés sont pelliculés et contiennent l'équivalent de 250 ou 500 mg de céfuroxime sous forme de céfuroxime axétil. Les comprimés contiennent les ingrédients inactifs dioxyde de silicium colloïdal, croscarmellose sodique, huile végétale hydrogénée, hypromellose, méthylparabène, cellulose microcristalline, propylène glycol, propylparabène, benzoate de sodium, laurylsulfate de sodium et dioxyde de titane.
La suspension buvable, lorsqu'elle est reconstituée avec de l'eau, fournit l'équivalent de 125 mg ou 250 mg de céfuroxime (sous forme de céfuroxime axétil) par 5 mL. La suspension buvable contient les ingrédients inactifs acésulfame potassique, aspartame, povidone K30, acide stéarique, saccharose, arôme tutti-frutti et gomme xanthane.
LES INDICATIONS
Pharyngite/amygdalite
Les comprimés CEFTIN 125 mg sont indiqués pour le traitement des patients adultes et des patients pédiatriques (13 ans et plus) atteints de pharyngite/amygdalite légère à modérée causée par des souches sensibles de Streptococcus pyogenes.
CEFTIN 500 mg pour suspension buvable est indiqué pour le traitement des patients pédiatriques âgés de 3 mois à 12 ans atteints de pharyngite/amygdalite légère à modérée causée par des souches sensibles de Streptococcus pyogenes.
Limites d'utilisation
- L'efficacité de CEFTIN dans la prévention du rhumatisme articulaire aigu n'a pas été établie dans les essais cliniques.
- L'efficacité de CEFTIN 125 mg dans le traitement des souches résistantes à la pénicilline de Streptococcus pyogenes n'a pas été démontrée dans les essais cliniques.
Otite moyenne bactérienne aiguë
Les comprimés CEFTIN 125 mg sont indiqués pour le traitement des patients pédiatriques (qui peuvent avaler des comprimés entiers) atteints d'otite moyenne bactérienne aiguë causée par des souches sensibles de Streptococcus pneumoniae, Haemophilus influenzae (y compris les souches productrices de β-lactamase), Moraxella catarrhalis (y compris les β-lactamase -productrices), ou Streptococcus pyogenes.
CEFTIN pour suspension buvable est indiqué pour le traitement des patients pédiatriques âgés de 3 mois à 12 ans présentant une otite moyenne bactérienne aiguë causée par des souches sensibles de Streptococcus pneumoniae, Haemophilus influenzae (y compris les souches productrices de β-lactamase), Moraxella catarrhalis (y compris les β-lactamase -productrices), ou Streptococcus pyogenes.
Sinusite maxillaire bactérienne aiguë
Les comprimés CEFTIN sont indiqués pour le traitement des patients adultes et pédiatriques (13 ans et plus) atteints de sinusite maxillaire bactérienne aiguë légère à modérée causée par des souches sensibles de Streptococcus pneumoniae ou Haemophilus influenzae (souches non productrices de β-lactamase uniquement).
CEFTIN 250 mg pour suspension buvable est indiqué pour le traitement des patients pédiatriques âgés de 3 mois à 12 ans atteints de sinusite maxillaire bactérienne aiguë légère à modérée causée par des souches sensibles de Streptococcus pneumoniae ou Haemophilus influenzae (souches non productrices de β-lactamase uniquement) .
Limites d'utilisation
L'efficacité de CEFTIN pour les infections des sinus causées par Haemophilus influenzae producteur de β-lactamases ou Moraxella catarrhalis chez les patients atteints de sinusite maxillaire bactérienne aiguë n'a pas été établie en raison du nombre insuffisant de ces isolats dans les essais cliniques [voir Etudes cliniques ].
Exacerbations bactériennes aiguës de la bronchite chronique
Les comprimés CEFTIN sont indiqués pour le traitement des patients adultes et des patients pédiatriques (âgés de 13 ans et plus) présentant des exacerbations bactériennes aiguës légères à modérées de bronchite chronique causées par des souches sensibles de Streptococcus pneumoniae, Haemophilus influenzae (souches β-lactamase négatives), ou Haemophilus para influenzae (souches β-lactamase-négatives).
Infections non compliquées de la peau et des structures cutanées
Les comprimés de CEFTIN 250 mg sont indiqués pour le traitement des patients adultes et des patients pédiatriques (âgés de 13 ans et plus) présentant des infections cutanées et des structures cutanées non compliquées causées par des souches sensibles de Staphylococcus aureus (y compris les souches productrices de β-lactamase) ou de Streptococcus pyogenes.
Infections urinaires non compliquées
Les comprimés CEFTIN 500 mg sont indiqués pour le traitement des patients adultes et des patients pédiatriques (âgés de 13 ans et plus) atteints d'infections des voies urinaires non compliquées causées par des souches sensibles d'Escherichia coli ou de Klebsiella pneumoniae.
Gonorrhée non compliquée
Les comprimés CEFTIN sont indiqués pour le traitement des patients adultes et des patients pédiatriques (âgés de 13 ans et plus) atteints de gonorrhée non compliquée, urétrale et endocervicale, causée par des souches sensibles productrices et non productrices de pénicillinase de Neisseria gonorrhoeae et de gonorrhée non compliquée, rectale, chez les femmes , causée par des souches sensibles de Neisseria gonorrhoeae ne produisant pas de pénicillinase.
Maladie de Lyme précoce (érythème migrant)
Les comprimés CEFTIN sont indiqués pour le traitement des patients adultes et des patients pédiatriques (âgés de 13 ans et plus) atteints de la maladie de Lyme au stade précoce (érythème migrant) causée par des souches sensibles de Borrelia burgdorferi.
Impétigo
CEFTIN 250 mg pour suspension buvable est indiqué pour le traitement des patients pédiatriques âgés de 3 mois à 12 ans présentant un impétigo causé par des souches sensibles de Staphylococcus aureus (y compris les souches productrices de plactamase) ou de Streptococcus pyogenes.
Usage
Pour réduire le développement de bactéries résistantes aux médicaments et maintenir l'efficacité de CEFTIN et d'autres médicaments antibactériens, CEFTIN 500 mg doit être utilisé uniquement pour traiter ou prévenir les infections dont il est prouvé ou fortement suspecté qu'elles sont causées par des bactéries sensibles. Lorsque des informations sur la culture et la sensibilité sont disponibles, elles doivent être prises en compte lors de la sélection ou de la modification du traitement antibactérien. En l'absence de telles données, l'épidémiologie locale et les schémas de sensibilité peuvent contribuer à la sélection empirique du traitement.
DOSAGE ET ADMINISTRATION
Instructions d'administration importantes
- Les comprimés CEFTIN et CEFTIN pour suspension buvable ne sont pas bioéquivalents et ne sont donc pas substituables sur une base milligramme par milligramme [voir PHARMACOLOGIE CLINIQUE ].
- Administrer les comprimés CEFTIN ou la suspension buvable comme décrit dans les directives posologiques appropriées [voir Posologie pour les comprimés CEFTIN 500 mg, posologie pour CEFTIN 250 mg pour suspension buvable et Préparation et administration de CEFTIN 125mg pour suspension buvable ].
- Administrer les comprimés CEFTIN 500 mg avec ou sans nourriture.
- Administrer CEFTIN 500 mg pour suspension buvable avec de la nourriture.
- Les patients pédiatriques (âgés de 13 ans et plus) qui ne peuvent pas avaler les comprimés de CEFTIN à 125 mg en entier doivent recevoir CEFTIN pour suspension buvable car le comprimé a un goût amer fort et persistant lorsqu'il est écrasé [voir Posologie pour les comprimés CEFTIN ].
Posologie pour les comprimés CEFTIN 500mg
Administrez les comprimés CEFTIN 250 mg comme décrit dans le tableau des recommandations posologiques ci-dessous avec ou sans nourriture.
Posologie de CEFTIN pour suspension orale
Administrez CEFTIN pour suspension buvable comme décrit dans le tableau des recommandations posologiques ci-dessous avec de la nourriture.
Préparation et administration de CEFTIN pour suspension orale
Préparer une suspension au moment de la distribution comme suit :
- Bien agiter la suspension buvable avant chaque utilisation.
- Bien remettre le capuchon après chaque ouverture.
- Conservez la suspension reconstituée au réfrigérateur entre 2° et 8°C (36° et 46°F).
- Jeter la suspension reconstituée après 10 jours.
Posologie chez les patients présentant une fonction rénale altérée
Un ajustement de l'intervalle posologique est nécessaire chez les patients dont la clairance de la créatinine est inférieure à 30 ml/min, comme indiqué dans le tableau 4 ci-dessous, car la céfuroxime est principalement éliminée par les reins [voir PHARMACOLOGIE CLINIQUE ].
COMMENT FOURNIE
Formes posologiques et points forts
Les comprimés CEFTIN sont des comprimés pelliculés blancs, en forme de capsule, disponibles dans les dosages suivants :
- 250 mg de céfuroxime (sous forme de céfuroxime axétil) avec « GX ES7 » gravé sur une face et vierge sur l'autre face.
- 500 mg de céfuroxime (sous forme de céfuroxime axétil) avec « GX EG2 » gravé sur une face et vierge sur l'autre face.
CEFTIN pour suspension buvable se présente sous forme de poudre sèche, blanche à blanc cassé, à saveur de tutti-frutti. Lorsqu'elle est reconstituée selon les instructions, la suspension fournit l'équivalent de 125 mg ou 250 mg de céfuroxime (sous forme de céfuroxime axétil) par 5 mL.
Stockage et manutention
Les comprimés CEFTIN, 250 mg de céfuroxime (sous forme de céfuroxime axétil), sont des comprimés pelliculés blancs, en forme de capsule, gravés « GX ES7 » sur un côté et vierges sur l'autre côté comme suit : 20 comprimés/flacon CDN 0173-0387-00
Les comprimés CEFTIN, 500 mg de céfuroxime (sous forme de céfuroxime axétil), sont des comprimés pelliculés blancs, en forme de capsule, gravés « GX EG2 » sur un côté et vierges sur l'autre côté comme suit : 20 comprimés/flacon CDN 0173-0394-00
Conservez les comprimés entre 15° et 30°C (59° et 86°F). Bien remettre le capuchon après chaque ouverture.
CEFTIN 500mg pour suspension buvable se présente sous forme de poudre sèche, blanche à blanc cassé, à saveur de tutti-frutti. Lorsqu'elle est reconstituée selon les instructions, la suspension fournit l'équivalent de 125 mg ou 250 mg de céfuroxime (sous forme de céfuroxime axétil) par 5 mL. Il est fourni dans des flacons en verre ambré comme suit :
125 mg/5 mL
suspension de 100 ml CDN 0173-0740-00
250 mg/5 mL
suspension de 50 ml CDN 0173-0741-10 Suspension de 100 ml CDN 0173-0741-00
Avant reconstitution, conserver la poudre sèche entre 2° et 30°C (36° et 86°F).
Après reconstitution, conserver immédiatement la suspension au réfrigérateur entre 2° et 8°C (36° et 46°F). JETER APRÈS 10 JOURS.
GlaxoSmithKline, Research Triangle Park, NC 27709. Révisé : octobre 2017
EFFETS SECONDAIRES
L'effet indésirable grave et par ailleurs important suivant est décrit plus en détail dans la section Avertissements et précautions de l'étiquette :
Réactions anaphylactiques [voir AVERTISSEMENTS ET PRECAUTIONS ]
Expérience des essais cliniques
Étant donné que les essais cliniques sont menés dans des conditions très variables, les taux d'effets indésirables observés dans les essais cliniques d'un médicament ne peuvent pas être directement comparés aux taux des essais cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique.
Comprimés
Schémas posologiques à doses multiples d'une durée de 7 à 10 jours
Dans des essais cliniques à doses multiples, 912 sujets ont été traités par CEFTIN (125 à 500 mg deux fois par jour). Il est à noter que 125 mg deux fois par jour n'est pas une posologie approuvée. Vingt (2,2 %) sujets ont arrêté le traitement en raison d'effets indésirables. Dix-sept (85 %) des 20 sujets qui ont interrompu le traitement l'ont fait en raison de troubles gastro-intestinaux, notamment de diarrhée, de nausées, de vomissements et de douleurs abdominales. Le pourcentage de sujets traités par CEFTIN qui ont arrêté le médicament à l'étude en raison d'effets indésirables était similaire aux doses quotidiennes de 1 000, 500 et 250 mg (2,3 %, 2,1 % et 2,2 %, respectivement). Cependant, l'incidence des effets indésirables gastro-intestinaux a augmenté avec les doses recommandées plus élevées.
Les effets indésirables du tableau 5 concernent les sujets (n = 912) traités par CEFTIN 250 mg dans des essais cliniques à doses multiples.
Les effets indésirables suivants sont survenus chez moins de 1 % mais plus de 0,1 % des sujets (n = 912) traités par CEFTIN dans des essais cliniques à doses multiples.
Troubles du système immunitaire Urticaire, langue enflée.
Troubles du métabolisme et de la nutrition : Anorexie.
Troubles du système nerveux : Mal de tête.
Troubles cardiaques : Douleur thoracique.
Troubles respiratoires : Essoufflement.
Problèmes gastro-intestinaux : Douleurs abdominales, crampes abdominales, flatulences, indigestion, aphtes.
Troubles de la peau et du tissu sous-cutané : éruption cutanée, démangeaison.
Troubles rénaux et urinaires : Dysurie.
Système reproducteur et troubles mammaires : Vaginite, démangeaison vulvaire.
Troubles généraux et conditions au site d'administration : Frissons, somnolence, soif.
Enquêtes : Test de Combs positif.
Maladie de Lyme précoce avec régime de 20 jours
Deux essais multicentriques ont évalué CEFTIN 500 mg deux fois par jour pendant 20 jours. Les événements indésirables liés au médicament les plus fréquents étaient la diarrhée (10,6 %), la réaction de Jarisch-Herxheimer (5,6 %) et la vaginite (5,4 %). D'autres effets indésirables sont survenus avec des fréquences comparables à celles rapportées avec une administration de 7 à 10 jours.
Régime à dose unique pour la gonorrhée non compliquée
Dans des essais cliniques utilisant une dose unique de 1 000 mg de CEFTIN 250 mg, 1 061 sujets ont été traités pour une gonorrhée non compliquée. Les réactions défavorables dans la Table 6 étaient pour les sujets ont traité avec une dose simple de 1 000 mgs CEFTIN dans les essais cliniques américains.
Les effets indésirables suivants sont survenus chez moins de 1 % mais plus de 0,1 % des sujets (n = 1 061) traités avec une dose unique de CEFTIN 1 000 mg pour la gonorrhée non compliquée dans les essais cliniques américains.
Infections et infestations : Candidose vaginale.
Troubles du système nerveux : Maux de tête, vertiges, somnolence.
Troubles cardiaques : Oppression/douleur dans la poitrine, tachycardie.
Problèmes gastro-intestinaux : Douleurs abdominales, dyspepsie.
Troubles de la peau et du tissu sous-cutané : Érythème, rash, prurit.
Troubles musculosquelettiques et du tissu conjonctif : Crampes musculaires, raideur musculaire, spasme musculaire du cou, réaction de type trismus.
Troubles rénaux et urinaires : Saignement/douleur dans l'urètre, douleur dans les reins.
Système reproducteur et troubles mammaires : Démangeaisons vaginales, pertes vaginales.
Suspension orale
Dans des essais cliniques utilisant des doses multiples de CEFTIN 250 mg, des sujets pédiatriques (96,7 % étaient âgés de moins de 12 ans) ont été traités avec CEFTIN (20 à 30 mg/kg/jour divisés deux fois par jour jusqu'à une dose maximale de 500 ou 1 000 mg/jour, respectivement). Onze (1,2 %) sujets américains ont arrêté le traitement en raison d'effets indésirables. Les arrêts étaient principalement dus à des troubles gastro-intestinaux, généralement des diarrhées ou des vomissements. Treize (1,4 %) sujets pédiatriques américains ont arrêté le traitement en raison du goût et/ou de problèmes d'administration du médicament.
Les réactions défavorables dans la Table 7 sont pour les sujets américains (n = 931) ont traité avec CEFTIN dans les essais cliniques de la dose multiple.
Les effets indésirables suivants sont survenus chez moins de 1 % mais plus de 0,1 % des sujets américains (n = 931) traités par CEFTIN pour suspension buvable dans des essais cliniques à doses multiples.
Infections et infestations : Infection gastro-intestinale, candidose, maladie virale, infection des voies respiratoires supérieures, sinusite, infection des voies urinaires.
Troubles du système sanguin et lymphatique : Eosinophilie.
Troubles psychiatriques : Hyperactivité, comportement irritable.
Problèmes gastro-intestinaux : Douleurs abdominales, flatulences, ptyalisme.
Troubles de la peau et du tissu sous-cutané : Éruption.
Troubles musculosquelettiques et du tissu conjonctif : Gonflement articulaire, arthralgie.
Système reproducteur et troubles mammaires : Irritation vaginale.
Troubles généraux et conditions au site d'administration : Toux, fièvre.
Enquêtes : Enzymes hépatiques élevées, test de Coombs positif.
Expérience post-commercialisation
Les effets indésirables suivants ont été identifiés lors de l'utilisation post-approbation de CEFTIN. Étant donné que ces réactions sont signalées volontairement par une population de taille incertaine, il n'est pas toujours possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale avec l'exposition au médicament.
Troubles du système sanguin et lymphatique
Anémie hémolytique, leucopénie, pancytopénie, thrombocytopénie.
Problèmes gastro-intestinaux
Colite pseudomembraneuse [voir AVERTISSEMENTS ET PRECAUTIONS ].
Troubles hépatobiliaires
Insuffisance hépatique, y compris hépatite et cholestase, ictère.
Troubles du système immunitaire
Anaphylaxie, réaction de type maladie sérique.
Enquêtes
Augmentation du temps de prothrombine.
Troubles du système nerveux
Convulsions, encéphalopathie.
Troubles rénaux et urinaires
Dysfonctionnement rénal.
Troubles de la peau et du tissu sous-cutané
Angiœdème, érythème polymorphe, syndrome de Stevens-Johnson, nécrolyse épidermique toxique, urticaire.
INTERACTIONS MÉDICAMENTEUSES
Contraceptifs oraux
Le céfuroxime axétil peut affecter la flore intestinale, entraînant une diminution de la réabsorption des œstrogènes et une réduction de l'efficacité des contraceptifs oraux combinés œstrogène/progestérone. Conseillez aux patientes d'envisager d'autres mesures contraceptives supplémentaires (non hormonales) pendant le traitement.
Médicaments qui réduisent l'acidité gastrique
Les médicaments qui réduisent l'acidité gastrique peuvent entraîner une biodisponibilité inférieure de CEFTIN par rapport à l'administration à jeun. L'administration de médicaments qui réduisent l'acidité gastrique peut annuler l'effet alimentaire d'une absorption accrue de CEFTIN 250 mg lorsqu'il est administré à l'état postprandial. Administrer CEFTIN au moins 1 heure avant ou 2 heures après l'administration d'antiacides à action brève. Les antagonistes de l'histamine-2 (H2) et les inhibiteurs de la pompe à protons doivent être évités.
Probénécide
L'administration concomitante de probénécide avec les comprimés de céfuroxime axétil augmente les concentrations sériques de céfuroxime [voir PHARMACOLOGIE CLINIQUE ]. L'administration concomitante de probénécide et de céfuroxime axétil n'est pas recommandée.
Interactions médicament/test de laboratoire
Une réaction faussement positive pour le glucose dans l'urine peut se produire avec les tests de réduction du cuivre (p. ex., la solution de Benedict ou de Fehling), mais pas avec les tests enzymatiques de glycosurie. Étant donné qu'un résultat faussement négatif peut se produire dans le test au ferricyanure, il est recommandé d'utiliser la méthode à la glucose oxydase ou à l'hexokinase pour déterminer les taux de glucose sanguin/plasmatique chez les patients recevant du céfuroxime axétil. La présence de céfuroxime n'interfère pas avec le dosage de la créatinine sérique et urinaire par la méthode au picrate alcalin.
AVERTISSEMENTS
Inclus dans le cadre du PRÉCAUTIONS section.
PRÉCAUTIONS
Réactions anaphylactiques
Des réactions d'hypersensibilité (anaphylactiques) graves et parfois mortelles ont été signalées chez des patients sous antibactériens β-lactamines. Ces réactions sont plus susceptibles de se produire chez les personnes ayant des antécédents d'hypersensibilité aux β-lactamines et/ou des antécédents de sensibilité à de multiples allergènes. Il y a eu des rapports d'individus ayant des antécédents d'hypersensibilité à la pénicilline qui ont présenté des réactions graves lorsqu'ils étaient traités avec des céphalosporines. CEFTIN 500 mg est contre-indiqué chez les patients présentant une hypersensibilité connue à CEFTIN ou à d'autres médicaments antibactériens β-lactamines [voir CONTRE-INDICATIONS ]. Avant de commencer le traitement par CEFTIN, renseignez-vous sur les réactions d'hypersensibilité antérieures aux pénicillines, aux céphalosporines ou à d'autres allergènes. En cas de réaction allergique, arrêtez CEFTIN et instituez un traitement approprié.
Diarrhée associée à Clostridium difficile
Des diarrhées associées à Clostridium difficile (DACD) ont été signalées avec l'utilisation de presque tous les agents antibactériens, y compris CEFTIN, et leur gravité peut varier d'une diarrhée légère à une colite mortelle. Le traitement avec des agents antibactériens altère la flore normale du côlon, entraînant une prolifération de C. difficile.
C. difficile produit les toxines A et B qui contribuent au développement de CDAD. Les souches de C. difficile productrices d'hypertoxines entraînent une morbidité et une mortalité accrues, car ces infections peuvent être réfractaires au traitement antimicrobien et nécessiter une colectomie. La DACD doit être envisagée chez tous les patients qui présentent une diarrhée suite à l'utilisation d'antibiotiques. Des antécédents médicaux minutieux sont nécessaires car il a été rapporté que la DACD survient plus de 2 mois après l'administration d'agents antibactériens.
Si la DACD est suspectée ou confirmée, l'utilisation continue d'antibiotiques non dirigés contre C. difficile peut devoir être interrompue. Une gestion appropriée des liquides et des électrolytes, une supplémentation en protéines, un traitement antibiotique de C. difficile et une évaluation chirurgicale doivent être institués selon les indications cliniques.
Potentiel de prolifération microbienne
La possibilité de surinfections par des agents pathogènes fongiques ou bactériens doit être envisagée pendant le traitement.
Développement de bactéries résistantes aux médicaments
La prescription de CEFTIN en l'absence d'infection bactérienne avérée ou fortement suspectée ou d'indication prophylactique est peu susceptible d'apporter un bénéfice au patient et augmente le risque de développement de bactéries résistantes aux médicaments.
Phénylcétonurie
CEFTIN 125 mg pour suspension buvable 125 mg/5 mL contient 11,8 mg de phénylalanine pour 5 mL (1 cuillère à café) de suspension reconstituée. CEFTIN 250 mg pour suspension buvable 250 mg/5 mL contient 25,2 mg de phénylalanine par 5 mL (1 cuillère à café) de suspension reconstituée.
Interférence avec les tests de glucose
Un résultat faussement positif pour le glucose dans l'urine peut survenir avec les tests de réduction du cuivre, et un résultat faussement négatif pour le glucose sanguin/plasmatique peut survenir avec les tests de ferricyanure chez les sujets recevant CEFTIN [voir INTERACTIONS MÉDICAMENTEUSES ].
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Bien qu'aucune étude sur la durée de vie chez l'animal n'ait été réalisée pour évaluer le potentiel carcinogène, aucune activité mutagène n'a été trouvée pour le céfuroxime axétil dans une batterie de tests de mutation bactérienne. Des résultats positifs ont été obtenus dans un test d'aberration chromosomique in vitro; cependant, des résultats négatifs ont été trouvés dans un test du micronoyau in vivo à des doses allant jusqu'à 1,5 g/kg. Des études de reproduction chez le rat à des doses allant jusqu'à 1 000 mg/kg/jour (9 fois la dose humaine maximale recommandée basée sur la surface corporelle) n'ont révélé aucune altération de la fertilité.
Utilisation dans des populations spécifiques
Grossesse
Catégorie de grossesse B. Il n'y a pas d'études adéquates et bien contrôlées chez les femmes enceintes. Étant donné que les études de reproduction chez l'animal ne sont pas toujours prédictives de la réponse humaine, CEFTIN ne doit être utilisé pendant la grossesse qu'en cas de nécessité absolue.
Des études de reproduction ont été réalisées chez la souris à des doses allant jusqu'à 3 200 mg/kg/jour (14 fois la dose maximale recommandée chez l'homme en fonction de la surface corporelle) et chez le rat à des doses allant jusqu'à 1 000 mg/kg/jour (9 fois la dose maximale recommandée dose humaine basée sur la surface corporelle) et n'ont révélé aucun signe d'altération de la fertilité ou d'atteinte au fœtus due au céfuroxime axétil.
Mères allaitantes
Le céfuroxime étant excrété dans le lait maternel, la prudence s'impose lorsque CEFTIN 500 mg est administré à une femme qui allaite.
Utilisation pédiatrique
L'innocuité et l'efficacité de CEFTIN 250 mg ont été établies pour les patients pédiatriques âgés de 3 mois à 12 ans atteints de sinusite maxillaire bactérienne aiguë sur la base de son approbation chez l'adulte. L'utilisation de CEFTIN chez les patients pédiatriques est étayée par des données pharmacocinétiques et de sécurité chez les adultes et les patients pédiatriques, et par des données cliniques et microbiologiques provenant d'essais adéquats et bien contrôlés du traitement de la sinusite maxillaire bactérienne aiguë chez l'adulte et de l'otite moyenne aiguë avec épanchement chez l'adulte. patients pédiatriques. Il est également soutenu par la surveillance des événements indésirables post-commercialisation. [Voir INDICATIONS ET USAGE , DOSAGE ET ADMINISTRATION , EFFETS INDÉSIRABLES , PHARMACOLOGIE CLINIQUE ]
Utilisation gériatrique
Sur le nombre total de sujets qui ont reçu CEFTIN 250 mg dans 20 essais cliniques, 375 étaient âgés de 65 ans et plus tandis que 151 étaient âgés de 75 ans et plus. Aucune différence globale d'innocuité ou d'efficacité n'a été observée entre ces sujets et les sujets adultes plus jeunes. L'expérience clinique rapportée n'a pas identifié de différences dans les réponses entre les patients adultes âgés et plus jeunes, mais une plus grande sensibilité de certaines personnes âgées ne peut être exclue.
Le céfuroxime est en grande partie excrété par les reins et le risque d'effets indésirables peut être plus élevé chez les patients présentant une insuffisance rénale. Étant donné que les patients âgés sont plus susceptibles d'avoir une fonction rénale diminuée, des précautions doivent être prises lors du choix de la dose et il peut être utile de surveiller la fonction rénale.
Insuffisance rénale
La réduction de la posologie de CEFTIN 125 mg est recommandée chez les patients adultes présentant une insuffisance rénale sévère (clairance de la créatinine DOSAGE ET ADMINISTRATION , PHARMACOLOGIE CLINIQUE ].
SURDOSAGE
Un surdosage de céphalosporines peut provoquer une irritation cérébrale entraînant des convulsions ou une encéphalopathie. Les taux sériques de céfuroxime peuvent être réduits par hémodialyse et dialyse péritonéale.
CONTRE-INDICATIONS
CEFTIN est contre-indiqué chez les patients présentant une hypersensibilité connue (p. ex., anaphylaxie) à CEFTIN ou à d'autres médicaments antibactériens β-lactamines (p. ex., pénicillines et céphalosporines).
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
CEFTIN 250 mg est un médicament antibactérien [voir Microbiologie ].
Pharmacocinétique
Absorption
Après administration orale, le céfuroxime axétil est absorbé par le tractus gastro-intestinal et rapidement hydrolysé par les estérases non spécifiques de la muqueuse intestinale et du sang en céfuroxime. Les paramètres pharmacocinétiques sériques du céfuroxime après l'administration de comprimés de CEFTIN à 250 mg à des adultes sont présentés dans le tableau 8.
Effet alimentaire
L'absorption du comprimé est plus importante lorsqu'il est pris après un repas (la biodisponibilité absolue passe de 37 % à 52 %). Malgré cette différence d'absorption, les réponses cliniques et bactériologiques des sujets étaient indépendantes de la prise alimentaire au moment de l'administration des comprimés dans 2 essais où cela a été évalué.
Tous les essais d'efficacité et d'innocuité pharmacocinétiques et cliniques chez des sujets pédiatriques utilisant la formulation en suspension ont été menés à jeun. Aucune donnée n'est disponible sur la cinétique d'absorption de la formulation en suspension lorsqu'elle est administrée à des sujets pédiatriques à jeun.
Manque de bioéquivalence
La suspension buvable n'était pas bioéquivalente aux comprimés lorsqu'elle a été testée chez des adultes en bonne santé. Les formulations de comprimés et de suspension buvable ne sont PAS substituables sur une base milligramme-permilligramme. L'aire sous la courbe de la suspension était en moyenne de 91 % de celle du comprimé, et la concentration plasmatique maximale de la suspension était en moyenne de 71 % de la concentration plasmatique maximale des comprimés. Par conséquent, l'innocuité et l'efficacité des formulations en comprimé et en suspension buvable ont été établies dans des essais cliniques distincts.
Distribution
Le céfuroxime est distribué dans tous les liquides extracellulaires. Environ 50 % de la céfuroxime sérique est liée aux protéines.
Métabolisme
Le groupement axétil est métabolisé en acétaldéhyde et en acide acétique.
Excrétion
Le céfuroxime est excrété sous forme inchangée dans l'urine; chez l'adulte, environ 50 % de la dose administrée est récupérée dans les urines dans les 12 heures. La pharmacocinétique du céfuroxime chez les sujets pédiatriques n'a pas été étudiée. Jusqu'à ce que de nouvelles données soient disponibles, l'élimination rénale du céfuroxime axétil établie chez l'adulte ne doit pas être extrapolée aux sujets pédiatriques.
Populations spécifiques
Insuffisance rénale
Dans un essai portant sur 28 adultes présentant une fonction rénale normale ou une insuffisance rénale sévère (clairance de la créatinine DOSAGE ET ADMINISTRATION ].
Patients pédiatriques
Les paramètres pharmacocinétiques sériques du céfuroxime chez les sujets pédiatriques ayant reçu CEFTIN pour suspension buvable sont présentés dans le tableau 9.
Patients gériatriques
Dans un essai portant sur 20 sujets âgés (âge moyen = 83,9 ans) ayant une clairance moyenne de la créatinine de 34,9 ml/min, la demi-vie d'élimination sérique moyenne a été prolongée à 3,5 heures ; cependant, malgré la plus faible élimination du céfuroxime chez les patients gériatriques, un ajustement posologique en fonction de l'âge n'est pas nécessaire [voir Utilisation dans des populations spécifiques ].
Interactions médicamenteuses
L'administration concomitante de probénécide avec des comprimés de céfuroxime axétil augmente la surface de céfuroxime sous la courbe de concentration sérique en fonction du temps et la concentration sérique maximale de 50 % et 21 %, respectivement.
Microbiologie
Mécanisme d'action
Le céfuroxime axétil est un agent bactéricide qui agit par inhibition de la synthèse de la paroi cellulaire bactérienne. Le céfuroxime axétil a une activité en présence de certaines β-lactamases, pénicillinases et céphalosporinases, de bactéries gram-négatives et gram-positives.
Mécanisme de résistance
La résistance au céfuroxime axétil est principalement due à l'hydrolyse par la β-lactamase, à l'altération des protéines de liaison à la pénicilline (PBP), à la diminution de la perméabilité et à la présence de pompes d'efflux bactériennes.
La sensibilité au céfuroxime axétil variera selon la géographie et le temps; les données de sensibilité locales doivent être consultées, si elles sont disponibles. Les isolats bêta-lactamase-négatifs et résistants à l'ampicilline (BLNAR) de H. influenzae doivent être considérés comme résistants au céfuroxime axétil.
Le céfuroxime axétil s'est avéré actif contre la plupart des isolats des bactéries suivantes, à la fois in vitro et dans les infections cliniques [voir INDICATIONS ET USAGE ] :
Bactéries Gram-positives
Staphylococcus aureus (isolats sensibles à la méthicilline uniquement) Streptococcus pneumoniae Streptococcus pyogenes
Bactéries Gram-négatives
Escherichia colia Klebsiella pneumoniaea Haemophilus influenzae Haemophilus parainfluenzae Moraxella catarrhalis Neisseria gonorrhoeae a La plupart des isolats producteurs de β-lactamases à spectre étendu (BLSE) et de carbapénèmases sont résistants au céfuroxime axétil. Spirochètes Borrelia Burgdorferi
Les données in vitro suivantes sont disponibles, mais leur signification clinique est inconnue. Au moins 90 % des micro-organismes suivants présentent une concentration minimale inhibitrice (CMI) in vitro inférieure ou égale au seuil de sensibilité du céfuroxime axétil de 1 mcg/mL. Cependant, l'efficacité du céfuroxime axétil dans le traitement des infections cliniques dues à ces micro-organismes n'a pas été établie dans des essais cliniques adéquats et bien contrôlés.
Bactéries Gram-positives
Staphylococcus epidermidis (isolats sensibles à la méthicilline uniquement) Staphylococcus saprophyticus (isolats sensibles à la méthicilline uniquement) Streptococcus agalactiae
Bactéries Gram-négatives
Morganella morganii Proteus inconstans Proteus mirabilis Providencia rettgeri Bactérie anaérobie Peptococcus niger
Méthodes de test de sensibilité
Lorsqu'ils sont disponibles, le laboratoire de microbiologie clinique doit fournir au médecin les résultats des tests de sensibilité in vitro pour les produits médicamenteux antimicrobiens utilisés dans les hôpitaux locaux et les domaines de pratique sous forme de rapports périodiques décrivant le profil de sensibilité des agents pathogènes nosocomiaux et d'origine communautaire. Ces rapports devraient aider le médecin à choisir un médicament antibactérien pour le traitement.
Techniques de dilution
Des méthodes quantitatives sont utilisées pour déterminer les CMI antimicrobiennes. Ces CMI fournissent des estimations reproductibles de la sensibilité des bactéries aux composés antimicrobiens. Les CMI doivent être déterminées à l'aide d'une méthode de test standardisée (bouillon ou gélose).1, 2 Les valeurs des CMI doivent être interprétées selon les critères fournis dans le tableau 10.2,3
Techniques de diffusion
Les méthodes quantitatives qui nécessitent la mesure des diamètres de zone fournissent également des estimations reproductibles de la sensibilité des bactéries aux composés antimicrobiens. La taille de la zone fournit une estimation de la sensibilité des bactéries aux composés antimicrobiens. La taille de la zone doit être déterminée à l'aide d'une méthode de test standardisée.4 Cette procédure utilise des disques de papier imprégnés de 30 mcg de céfuroxime axétil pour tester la sensibilité des micro-organismes au céfuroxime axétil. Les critères d'interprétation de la diffusion du disque sont fournis dans le tableau 10.3
La sensibilité des staphylocoques au céfuroxime peut être déduite en testant uniquement la pénicilline et soit la céfoxitine, soit l'oxacilline.
La sensibilité de Streptococcus pyogenes peut être déduite des tests de pénicilline.3
Un rapport de "Susceptible" indique que le médicament antimicrobien est susceptible d'inhiber la croissance de l'agent pathogène si le médicament antimicrobien atteint la concentration habituellement réalisable au site de l'infection. Un rapport "Intermédiaire" indique que le résultat doit être considéré comme équivoque, et si le micro-organisme n'est pas entièrement sensible aux médicaments alternatifs cliniquement réalisables, le test doit être répété. Cette catégorie implique une applicabilité clinique possible dans des sites corporels où le médicament est physiologiquement concentré ou dans des situations où une dose élevée de médicament peut être utilisée. Cette catégorie fournit également une zone tampon qui empêche les petits facteurs techniques incontrôlés de provoquer des divergences majeures dans l'interprétation. Un rapport de «résistant» indique que le médicament antimicrobien n'est pas susceptible d'inhiber la croissance de l'agent pathogène si le médicament antimicrobien atteint les concentrations habituellement réalisables au site de l'infection ; un autre traitement doit être choisi.
Contrôle de qualité
Les procédures de test de sensibilité standardisées nécessitent l'utilisation de contrôles de laboratoire pour surveiller et garantir l'exactitude et la précision des fournitures et des réactifs utilisés dans le test, ainsi que les techniques de la personne effectuant le test.1,2,4 Les plages de CQ pour la CMI et la diffusion sur disque les tests utilisant le disque de 30 mcg sont fournis dans le tableau 11.3
Etudes cliniques
Sinusite maxillaire bactérienne aiguë
Un essai adéquat et bien contrôlé a été réalisé chez des sujets atteints de sinusite maxillaire bactérienne aiguë. Dans cet essai, chaque sujet avait une aspiration du sinus maxillaire recueillie par ponction sinusale avant le début du traitement pour une sinusite bactérienne aiguë présumée. Tous les sujets présentaient des signes radiographiques et cliniques de sinusite maxillaire aiguë. Dans l'essai, l'efficacité clinique de CEFTIN dans le traitement de la sinusite maxillaire aiguë était comparable à celle d'un agent antimicrobien oral contenant un inhibiteur spécifique de la β-lactamase. Cependant, les données microbiologiques ont démontré que CEFTIN était efficace dans le traitement de la sinusite maxillaire bactérienne aiguë due uniquement à Streptococcus pneumoniae ou à Haemophilus influenzae non producteur de β-lactamase. Un nombre insuffisant d'isolats d'Haemophilus influenzae et de Moraxella catarrhalis producteurs de β-lactamases ont été obtenus dans cet essai pour évaluer de manière adéquate l'efficacité du CEFTIN dans le traitement de la sinusite maxillaire bactérienne aiguë due à ces 2 organismes.
Cet essai a randomisé 317 sujets adultes, 132 sujets aux États-Unis et 185 sujets en Amérique du Sud. Le tableau 12 montre les résultats de l'analyse en intention de traiter.
Dans cet essai et dans un essai complémentaire sur la ponction maxillaire, 15 sujets évaluables avaient Haemophilus influenzae non producteur de β-lactamase comme agent pathogène identifié. Parmi ceux-ci, 67 % (10/15) avaient ce pathogène éradiqué. Dix-huit (18) sujets évaluables avaient Streptococcus pneumoniae comme agent pathogène identifié. Parmi ceux-ci, 83 % (15/18) avaient ce pathogène éradiqué.
Maladie de Lyme précoce
Deux essais adéquats et bien contrôlés ont été réalisés chez des sujets atteints de la maladie de Lyme au stade précoce. Tous les sujets présentaient un érythème migrant documenté par un médecin, avec ou sans manifestations systémiques d'infection. Les sujets ont été évalués 1 mois après le traitement pour le succès du traitement de la maladie de Lyme précoce (Partie I) et 1 an après le traitement pour le succès de la prévention de la progression vers les séquelles de la maladie de Lyme tardive (Partie II).
Un total de 355 sujets adultes (181 traités par céfuroxime axétil et 174 traités par doxycycline) ont été randomisés dans les 2 essais, avec un diagnostic de maladie de Lyme précoce confirmé chez 79 % (281/355). Le diagnostic clinique de la maladie de Lyme précoce chez ces sujets a été validé par 1) une lecture experte en aveugle de photographies, lorsqu'elles sont disponibles, de la lésion cutanée d'érythème migrant avant le traitement, et 2) une confirmation sérologique (à l'aide d'un test immuno-enzymatique [ELISA] et d'un test immunoblot ["Western" blot]) de la présence d'anticorps spécifiques de Borrelia burgdorferi, l'agent étiologique de la maladie de Lyme. Les données d'efficacité du tableau 13 sont spécifiques à ce sous-ensemble de patients « validé », tandis que les données de sécurité ci-dessous reflètent l'ensemble de la population de patients pour les 2 essais. Les données cliniques des sujets évaluables dans le sous-ensemble de patients « validés » sont présentées dans le tableau 13.
Le CEFTIN et la doxycycline ont été efficaces dans la prévention du développement des séquelles de la maladie de Lyme tardive.
Alors que l'incidence des effets indésirables gastro-intestinaux liés au médicament était similaire dans les 2 groupes de traitement (céfuroxime axétil - 13 % ; doxycycline - 11 %), l'incidence de la diarrhée liée au médicament était plus élevée dans le bras céfuroxime axétil que dans le bras doxycycline (11 % contre 3 %, respectivement).
RÉFÉRENCES
1. Institut des normes cliniques et de laboratoire (CLSI). Méthodes de dilution des tests de sensibilité aux antimicrobiens pour les bactéries à croissance aérobie ; Norme approuvée - Dixième édition. 2015. Document CLSI M07-A10, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvanie 19087, États-Unis.
2. Institut des normes cliniques et de laboratoire (CLSI). Méthodes de dilution antimicrobienne et de test de sensibilité des disques pour les bactéries rarement isolées ou exigeantes : lignes directrices approuvées - deuxième édition. 2010. Document CLSI M45-A2, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvanie 19087, États-Unis.
3. Institut des normes cliniques et de laboratoire (CLSI). Normes de performance pour les tests de sensibilité aux antimicrobiens ; Vingt-cinquième supplément d'information. 2015. Document CLSI M100-S25, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvanie 19087, États-Unis.
4. Institut des normes cliniques et de laboratoire (CLSI). Normes de performance pour les tests de sensibilité à la diffusion de disques antimicrobiens ; Norme approuvée - Douzième édition. 2015. Document CLSI M02-A12, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvanie 19087, États-Unis.
INFORMATIONS PATIENTS
Réactions allergiques
Informez les patients que CEFTIN est une céphalosporine qui peut provoquer des réactions allergiques chez certaines personnes [voir AVERTISSEMENTS ET PRECAUTIONS ].
Diarrhée associée à Clostridium difficile
Informez les patients que la diarrhée est un problème courant causé par les antibactériens et qu'elle se termine généralement lorsque l'antibactérien est arrêté. Parfois, après le début du traitement avec des antibactériens, les patients peuvent développer des selles liquides et sanglantes (avec ou sans crampes d'estomac et fièvre) même jusqu'à 2 mois ou plus après avoir pris leur dernière dose d'antibactérien. Si cela se produit, conseillez aux patients de contacter leur médecin dès que possible.
Phénylcétonurie
Informez les patients et les soignants que CEFTIN 125 mg pour suspension buvable contient de la phénylalanine (un composant de l'aspartame) [voir AVERTISSEMENTS ET PRECAUTIONS ].
Écraser les comprimés
Demandez aux patients d'avaler le comprimé entier, sans l'écraser. Les patients qui ne peuvent pas avaler le comprimé en entier doivent recevoir la suspension buvable.
Suspension orale
Demandez aux patients de bien agiter la suspension buvable avant chaque utilisation, de la conserver au réfrigérateur et de la jeter après 10 jours. La suspension buvable doit être prise avec de la nourriture.
Résistance aux médicaments
Informez les patients que les médicaments antibactériens, y compris CEFTIN, ne doivent être utilisés que pour traiter les infections bactériennes. Ils ne traitent pas les infections virales (par exemple, le rhume). Lorsque CEFTIN 250 mg est prescrit pour traiter une infection bactérienne, informez les patients que même s'il est courant de se sentir mieux au début du traitement, le médicament doit être pris exactement comme indiqué. Sauter des doses ou ne pas terminer le traitement complet peut : (1) diminuer l'efficacité du traitement immédiat et (2) augmenter la probabilité que les bactéries développent une résistance et ne puissent pas être traitées par CEFTIN 500 mg ou d'autres médicaments antibactériens à l'avenir .
