Asacol 400mg Mesalamine Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce qu'Asacol 400 mg et comment est-il utilisé ?
Asacol est un médicament d'ordonnance utilisé pour traiter les symptômes de la colite ulcéreuse. Asacol 400 mg peut être utilisé seul ou avec d'autres médicaments.
Asacol appartient à une classe de médicaments appelés dérivés de l'acide 5-aminosalicylique.
On ne sait pas si Asacol 400 mg est sûr et efficace chez les enfants de moins de 5 ans.
Quels sont les effets secondaires possibles d'Asacol 400mg ?
Asacol peut provoquer des effets secondaires graves, notamment :
- fortes douleurs à l'estomac,
- crampes d'estomac,
- diarrhée sanglante,
- fièvre,
- mal de tête,
- démangeaison de la peau,
- selles sanglantes ou goudronneuses,
- tousser du sang,
- vomi qui ressemble à du marc de café,
- peu ou pas de miction,
- miction douloureuse ou difficile,
- gonflement des pieds ou des chevilles,
- se sentir fatigué,
- essoufflement,
- perte d'appétit,
- douleur dans le haut du ventre,
- ecchymoses ou saignements faciles,
- urine foncée,
- selles de couleur argile, et
- jaunissement de la peau ou des yeux (jaunisse)
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants d'Asacol comprennent :
- nausée,
- vomissement,
- Douleur d'estomac,
- diarrhée,
- indigestion,
- gaz,
- mal de tête,
- éruption cutanée, et
- tests de la fonction hépatique anormaux
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles d'Asacol. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
LA DESCRIPTION
Chaque comprimé à libération retardée Asacol (mésalamine) pour administration orale contient 400 mg de mésalamine, un aminosalicylate. Les comprimés à libération retardée Asacol (mésalamine) contiennent une résine à base d'acrylique, Eudragit S (copolymère d'acide méthacrylique de type B, NF), qui se dissout à pH 7 ou plus et libère de la mésalamine dans l'iléon terminal et au-delà pour une action anti-inflammatoire topique dans le côlon . La mésalamine (également appelée acide 5-aminosalicylique ou 5-ASA) porte le nom chimique d'acide 5-amino-2-hydroxybenzoïque. Sa formule structurale est :
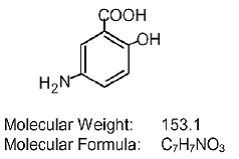
Ingrédients inactifs: Chaque comprimé contient du dioxyde de silicium colloïdal, du phtalate de dibutyle, de l'encre noire comestible, de l'oxyde de fer rouge, de l'oxyde de fer jaune, du lactose monohydraté, du stéarate de magnésium, un copolymère d'acide méthacrylique B (Eudragit S), du polyéthylèneglycol, de la povidone, du glycolate d'amidon sodique et du talc.
LES INDICATIONS
Traitement de la colite ulcéreuse légèrement à modérément active
Les comprimés à libération retardée Asacol® (mésalamine) sont indiqués pour le traitement de la colite ulcéreuse active légère à modérée chez les patients âgés de 5 ans et plus.
Maintien de la rémission de la colite ulcéreuse chez les adultes
Les comprimés à libération retardée d'Asacol (mésalamine) sont indiqués pour le maintien de la rémission de la colite ulcéreuse chez l'adulte. La sécurité et l'efficacité d'Asacol pour le maintien de la rémission de la rectocolite hémorragique chez les patients pédiatriques n'ont pas été établies.
DOSAGE ET ADMINISTRATION
Posologie pour le traitement de la colite ulcéreuse légèrement à modérément active
Adultes
Pour les adultes, la posologie recommandée d'Asacol 400 mg est de deux comprimés de 400 mg à prendre trois fois par jour avec ou sans nourriture (dose quotidienne totale de 2,4 grammes), pendant une durée de 6 semaines [voir Etudes cliniques ].
Pédiatrie
Pour les patients pédiatriques, la dose quotidienne totale recommandée d'Asacol est basée sur le poids (jusqu'à un maximum de 2,4 grammes/jour) (voir Tableau 1). Les comprimés d'Asacol 400 mg doivent être pris deux fois par jour avec ou sans nourriture pendant une durée de 6 semaines [voir Etudes cliniques ].
Posologie pour le maintien de la rémission de la colite ulcéreuse chez les adultes
Pour les adultes, la posologie recommandée d'Asacol est de 1,6 gramme par jour, en doses fractionnées, avec ou sans nourriture [voir Etudes cliniques ].
Instructions d'administration importantes
Avalez les comprimés d'Asacol entiers. Ne pas couper, casser ou mâcher les comprimés.
Il n'a pas été démontré que deux comprimés d'Asacol à 400 mg sont bioéquivalents à un comprimé à libération retardée d'Asacol® HD (mésalamine) à 800 mg et ne doivent pas être utilisés de manière interchangeable.
Test avant l'administration d'Asacol 400mg
Évaluer la fonction rénale avant l'initiation d'Asacol [voir AVERTISSEMENTS ET PRECAUTIONS ].
COMMENT FOURNIE
Formes posologiques et points forts
Comprimés à libération retardée Asacol (mésalamine) : 400 mg (rouge-brun, en forme de capsule et portant l'inscription « 0752 DR » en noir).
Stockage et manutention
Comprimés à libération retardée d'Asacol (mésalamine) sont disponibles sous forme de comprimés rouge-brun en forme de capsule contenant 400 mg de mésalamine et portant l'inscription « 0752 DR » en noir.
CDN 0430-0752-27 Flacon de 180 comprimés
Conserver à 20 ° à 25 ° C (68 ° à 77 ° F); excursions autorisées 15° à 30° C (59° à 86° F) [Voir Température ambiante contrôlée USP ].
Fabriqué par : Warner Chilcott Deutschland GmbH D-64331 Weiterstadt Allemagne. Commercialisé par : Warner Chilcott (États-Unis), LLC Rockaway, NJ 07866. Révisé : octobre 2013
EFFETS SECONDAIRES
Les effets indésirables les plus graves observés dans les essais cliniques d'Asacol ou avec d'autres produits contenant de la mésalamine ou métabolisés en mésalamine sont :
- Insuffisance rénale, y compris insuffisance rénale [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Syndrome d'intolérance aiguë [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Réactions d'hypersensibilité [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Insuffisance hépatique [voir AVERTISSEMENTS ET PRECAUTIONS ]
Expérience des essais cliniques
Étant donné que les essais cliniques sont menés dans des conditions très variables, les taux d'effets indésirables observés dans les essais cliniques d'un médicament ne peuvent pas être directement comparés aux taux des essais cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique.
Au total, les comprimés d'Asacol 400 mg ont été évalués chez 2 690 patients atteints de rectocolite hémorragique dans des essais contrôlés et en ouvert. Les effets indésirables présentés dans les rubriques suivantes peuvent survenir quelle que soit la durée du traitement et des effets similaires ont été rapportés dans des études à court et à long terme et dans le cadre post-commercialisation.
Les études cliniques à l'appui de l'utilisation d'Asacol 400 mg pour le traitement de la colite ulcéreuse légèrement à modérément active comprenaient deux études de 6 semaines, contrôlées par placebo, randomisées, en double aveugle chez des adultes atteints de colite ulcéreuse légèrement à modérément active (études 1 et 2), et une Étude de 6 semaines, randomisée, en double aveugle, de 2 niveaux de dose chez des enfants atteints de colite ulcéreuse légèrement à modérément active. Les études cliniques soutenant l'utilisation des comprimés d'Asacol 400 mg dans le maintien de la rémission de la colite ulcéreuse comprenaient une étude multicentrique de 6 mois, randomisée, en double aveugle, contrôlée par placebo et quatre essais d'entretien contrôlés par comparateur actif comparant les comprimés d'Asacol 400 mg à la sulfasalazine. . Asacol 400 mg a été évalué chez 427 adultes et 82 enfants atteints de rectocolite hémorragique dans ces études contrôlées.
Traitement de la colite ulcéreuse légèrement à modérément active chez les adultes
Dans deux études cliniques contrôlées contre placebo de 6 semaines (études 1 et 2) portant sur 245 patients, dont 155 ont été randomisés pour recevoir Asacol [voir Etudes cliniques ], 3,2 % des patients traités par Asacol ont interrompu le traitement en raison d'effets indésirables, contre 2,2 % des patients traités par placebo. L'âge moyen des patients de l'étude 1 était de 42 ans et 48 % des patients étaient des hommes. L'âge moyen des patients de l'étude 2 était de 42 ans et 59 % des patients étaient des hommes. Les effets indésirables entraînant le retrait d'Asacol comprenaient (chacun chez un patient) : diarrhée et poussée de colite ; étourdissements, nausées, douleurs articulaires et maux de tête; éruption cutanée, léthargie et constipation; sécheresse de la bouche, malaise, inconfort dans le bas du dos, légère désorientation, légère indigestion et crampes ; maux de tête, nausées, douleurs, vomissements, crampes musculaires, tête bouchée, oreilles bouchées et fièvre.
Les effets indésirables chez les patients traités par Asacol survenant à une fréquence d'au moins 2 % et à un taux supérieur à celui du placebo dans des essais contrôlés par placebo de 6 semaines, en double aveugle (études 1 et 2) sont répertoriés dans le tableau 2 ci-dessous.
Traitement de la colite ulcéreuse légèrement à modérément active chez les patients pédiatriques âgés de 5 à 17 ans
Une étude randomisée, en double aveugle, de 6 semaines portant sur 2 niveaux de dose d'Asacol (étude 3) a été menée chez 82 patients pédiatriques âgés de 5 à 17 ans atteints de colite ulcéreuse légèrement à modérément active. Tous les patients ont été divisés par catégorie de poids corporel (17 à moins de 33 kg, 33 à moins de 54 kg et 54 à 90 kg) et répartis au hasard pour recevoir une faible dose (1,2, 2,0 et 2,4 g/jour pour les catégorie de poids corporel) ou une dose élevée (2,0, 3,6 et 4,8 g/jour).
La dose élevée n'est pas une dose approuvée car elle ne s'est pas avérée plus efficace que la dose approuvée [voir DOSAGE ET ADMINISTRATION et Etudes cliniques ].
La durée d'exposition à la mésalamine parmi les 82 patients de l'étude variait de 12 à 50 jours (moyenne de 40 jours dans chaque groupe de dose). La majorité (88 %) des patients de chaque groupe ont été traités pendant plus de 5 semaines. Le tableau 3 présente un résumé des effets indésirables (EI) spécifiques rapportés.
Douze pour cent des patients du groupe à faible dose et 5 % des patients du groupe à forte dose ont présenté des effets indésirables graves (EI). La rectocolite hémorragique a été signalée comme EI grave chez un sujet de chaque groupe. Les autres effets indésirables graves comprenaient une sinusite, des douleurs abdominales, une diminution de l'indice de masse corporelle, une infection à adénovirus, une diarrhée sanglante, une cholangite sclérosante et une pancréatite chez un sujet chacun dans le groupe à faible dose et une anémie et une syncope chez un sujet chacun dans le groupe à dose élevée.
Sept patients ont été retirés de l'étude en raison d'EI : 5 (12 %) dans le groupe à faible dose (colite ulcéreuse, infection à adénovirus, cholangite sclérosante, pancréatite) et 2 (5 %) dans le groupe à dose élevée (augmentation de l'amylase et de la lipase , douleurs abdominales hautes).
En général, la nature et la sévérité des réactions dans la population pédiatrique étaient similaires à celles rapportées dans les populations adultes de patients atteints de rectocolite hémorragique.
Maintien de la rémission de la colite ulcéreuse chez les adultes
Dans un essai d'entretien contrôlé par placebo de 6 mois impliquant 264 patients (étude 4), dont 177 ont été randomisés pour recevoir Asacol, six (3,4 %) des patients utilisant Asacol ont interrompu le traitement en raison d'effets indésirables, contre quatre (4,6 %) des patients utilisant un placebo [voir Etudes cliniques ]. L'âge moyen des patients de l'étude 4 était de 42 ans et 55 % des patients étaient des hommes. Effets indésirables entraînant l'arrêt de l'étude chez les patients utilisant Asacol inclus (chacun chez un patient) : anxiété ; mal de tête; prurit; diminution de la libido; la polyarthrite rhumatoïde; et stomatite et asthénie.
Outre les réactions répertoriées dans le tableau 2, les réactions indésirables suivantes sont survenues chez des patients utilisant Asacol à une fréquence de 2 % ou plus dans l'étude 4 : hypertrophie abdominale, gastro-entérite, hémorragie gastro-intestinale, infection, trouble articulaire, migraine, nervosité, paresthésie, rectum trouble, hémorragie rectale, anomalies des selles, ténesme, pollakiurie, vasodilatation et anomalies de la vision.
Chez 3 342 patients participant à des études cliniques non contrôlées, les effets indésirables suivants sont survenus à une fréquence de 5 % ou plus et ont semblé augmenter en fréquence avec l'augmentation de la dose : asthénie, fièvre, syndrome grippal, douleur, douleur abdominale, dorsalgie, flatulence, saignement gastro-intestinal , arthralgie et rhinite.
Expérience post-commercialisation
En plus des effets indésirables signalés ci-dessus dans les essais cliniques impliquant Asacol, les effets indésirables énumérés ci-dessous ont été identifiés lors de l'utilisation post-approbation d'Asacol 400 mg et d'autres produits contenant de la mésalamine. Étant donné que ces réactions sont signalées volontairement par une population de taille incertaine, il n'est pas toujours possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale avec l'exposition au médicament.
Corps dans son ensemble : Cervicalgie, œdème facial, œdème, syndrome pseudo-lupique, fièvre médicamenteuse.
Cardiovasculaire: Péricardite, myocardite [voir AVERTISSEMENTS ET PRECAUTIONS ].
Gastro-intestinal : Anorexie, pancréatite, gastrite, augmentation de l'appétit, cholécystite, bouche sèche, ulcères buccaux, ulcère peptique perforé diarrhée sanglante.
Hématologique : Agranulocytose anémie aplasique, thrombocytopénie, éosinophilie, leucopénie, anémie, lymphadénopathie.
Musculo-squelettique : Goutte.
Nerveux: Dépression, somnolence, labilité émotionnelle, hyperesthésie, vertiges, confusion, tremblements, neuropathie périphérique, myélite transverse, syndrome de Guillain-Barré.
Rénal: Insuffisance rénale, néphrite interstitielle, néphropathie à changement minime [voir AVERTISSEMENTS ET PRECAUTIONS ].
Respiratoire/Pulmonaire : Pneumonie à éosinophiles, pneumonite interstitielle, exacerbation de l'asthme, pleurésie.
Peau: Alopécie, psoriasis, pyoderma gangrenosus, peau sèche, érythème noueux, urticaire.
Sens spéciaux : Douleur oculaire, altération du goût, vision floue, acouphènes.
Urogénital: Dysurie, urgence urinaire, hématurie, épididymite, ménorragie, oligospermie réversible.
Anomalies de laboratoire : AST élevé (SGOT) ou ALT (SGPT), phosphatase alcaline élevée, GGT élevé, LDH élevé, bilirubine élevée, créatinine sérique élevée et BUN.

INTERACTIONS MÉDICAMENTEUSES
Aucune étude formelle d'interaction médicamenteuse n'a été réalisée en utilisant Asacol 400 mg avec d'autres médicaments. Cependant, les interactions suivantes entre les produits contenant de la mésalamine et d'autres médicaments ont été signalées.
Agents néphrotoxiques, y compris les anti-inflammatoires non stéroïdiens
L'utilisation concomitante de mésalamine avec des agents néphrotoxiques connus, y compris des anti-inflammatoires non stéroïdiens (AINS) peut augmenter le risque de réactions rénales [voir AVERTISSEMENTS ET PRECAUTIONS ].
Azathioprine Ou 6-mercaptopurine
L'utilisation concomitante de mésalamine avec l'azathioprine ou la 6-mercaptopurine peut augmenter le risque de troubles sanguins.
AVERTISSEMENTS
Inclus dans le cadre du PRÉCAUTIONS section.
PRÉCAUTIONS
Insuffisance rénale
Une insuffisance rénale, y compris une néphropathie à changement minime, une néphrite interstitielle aiguë et chronique et une insuffisance rénale, a été signalée chez des patients prenant des produits tels que Asacol 400 mg contenant de la mésalamine ou convertis en mésalamine.
Il est recommandé que les patients aient une évaluation de la fonction rénale avant l'initiation d'Asacol 400 mg et périodiquement pendant le traitement.
Les prescripteurs doivent soigneusement évaluer les risques et les bénéfices de l'utilisation d'Asacol chez les patients présentant une insuffisance rénale connue ou des antécédents de maladie rénale [voir INTERACTIONS MÉDICAMENTEUSES et Toxicologie non clinique ].
Syndrome d'intolérance aiguë induite par la mésalamine
La mésalamine a été associée à un syndrome d'intolérance aiguë qui peut être difficile à distinguer d'une exacerbation de la colite ulcéreuse. Bien que la fréquence exacte de survenue n'ait pas été déterminée, elle s'est produite dans 3 % des essais cliniques contrôlés sur la mésalamine ou la sulfasalazine. Les symptômes comprennent des crampes, des douleurs abdominales, une diarrhée sanglante et parfois de la fièvre, des maux de tête et des éruptions cutanées. Observez attentivement les patients pour déceler une aggravation de ces symptômes pendant le traitement. Si un syndrome d'intolérance aiguë est suspecté, interrompre rapidement le traitement par Asacol.
Réactions d'hypersensibilité
Certains patients ayant présenté une réaction d'hypersensibilité à la sulfasalazine peuvent présenter une réaction similaire à Asacol 400 mg ou à d'autres composés contenant ou convertis en mésalamine.
Des réactions d'hypersensibilité cardiaque induites par la mésalamine (myocardite et péricardite) ont été signalées avec Asacol et d'autres médicaments à base de mésalamine. Des précautions doivent être prises lors de la prescription de ce médicament à des patients présentant des affections les prédisposant au développement d'une myocardite ou d'une péricardite.
Défaillance hépatique
Des cas d'insuffisance hépatique ont été signalés chez des patients atteints d'une maladie hépatique préexistante qui ont reçu de la mésalamine. La prudence s'impose lors de l'administration d'Asacol à des patients atteints d'une maladie du foie.
Rétention gastrique prolongée chez les patients présentant une obstruction gastro-intestinale supérieure
Une obstruction organique ou fonctionnelle dans le tractus gastro-intestinal supérieur peut entraîner une rétention gastrique prolongée d'Asacol 400 mg, ce qui retarderait la libération de mésalamine dans le côlon.
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Carcinogenèse
La mésalamine n'était pas cancérigène à des doses alimentaires allant jusqu'à 480 mg/kg/jour chez le rat et 2 000 mg/kg/jour chez la souris, soit environ 2,9 et 6,1 fois la dose d'entretien maximale recommandée d'Asacol 400 mg de 1,6 g/jour ou 26,7 mg/kg/jour, basé sur un poids corporel de 60 kg, respectivement, basé sur la surface corporelle.
Mutagenèse
La mésalamine était négative dans le test d'Ames pour la mutagenèse, négative pour l'induction d'échanges de chromatides soeurs (SCE) et d'aberrations chromosomiques dans les cellules ovariennes de hamster chinois in vitro, et négative pour l'induction de micronoyaux (MN) dans les érythrocytes polychromatiques de la moelle osseuse de souris.
Altération de la fertilité
La mésalamine, à des doses orales allant jusqu'à 480 mg/kg/jour (environ 1,9 fois la dose de traitement humaine recommandée sur la base de la surface corporelle), s'est avérée n'avoir aucun effet sur la fertilité ou les performances de reproduction des rats mâles et femelles.
Utilisation dans des populations spécifiques
Grossesse
Catégorie de grossesse C
Résumé des risques
Il n'y a pas d'études adéquates et bien contrôlées sur l'utilisation d'Asacol 400 mg chez les femmes enceintes. Des données humaines publiées limitées sur la mésalamine ne montrent aucune augmentation du taux global de malformations congénitales. Certaines données montrent un taux accru de naissances prématurées, de mortinaissances et de faible poids à la naissance ; cependant, ces issues défavorables de la grossesse sont également associées à une maladie intestinale inflammatoire active. De plus, toutes les grossesses, quelle que soit l'exposition aux médicaments, ont un taux de fond de 2 à 4 % pour les malformations majeures et de 15 à 20 % pour les pertes de grossesse. Aucune preuve d'effet nocif sur le fœtus n'a été observée dans les études de reproduction animale portant sur la mésalamine chez le rat et le lapin à des doses orales d'environ 1,9 fois (rat) et 3,9 fois (lapin) la dose recommandée chez l'homme. Cependant, le phtalate de dibutyle (DBP) est un ingrédient inactif de l'enrobage entérique d'Asacol, et dans des études animales chez le rat à des doses supérieures à 190 fois la dose humaine basée sur la surface corporelle, le DBP maternel a été associé à des malformations externes et squelettiques et à des effets indésirables sur le système reproducteur masculin. Asacol 400 mg ne doit être utilisé pendant la grossesse que si le bénéfice potentiel justifie le risque potentiel pour le fœtus.
Données humaines
La mésalamine traverse le placenta. Dans des études prospectives et rétrospectives portant sur plus de 600 femmes exposées à la mésalamine pendant la grossesse, le taux observé de malformations congénitales n'a pas augmenté au-delà du taux de fond dans la population générale. Certaines données montrent un taux accru de naissances prématurées, de mortinatalité et de faible poids à la naissance, mais il n'est pas clair si cela était dû à une maladie maternelle sous-jacente, à l'exposition aux médicaments ou aux deux, car la maladie intestinale inflammatoire active est également associée à des issues de grossesse défavorables.
Données animales
Des études de reproduction avec la mésalamine ont été réalisées au cours de l'organogenèse chez le rat et le lapin à des doses orales allant jusqu'à 480 mg/kg/jour. Il n'y avait aucune preuve d'altération de la fertilité ou de préjudice pour le fœtus. Ces doses de mésalamine étaient d'environ 1,9 fois (rat) et 3,9 fois (lapin) la dose humaine recommandée, en fonction de la surface corporelle.
Le phtalate de dibutyle (DBP) est un ingrédient inactif de l'enrobage entérique d'Asacol. L'apport quotidien humain de DBP à partir de la dose maximale recommandée de comprimés d'Asacol est d'environ 21 mg. Des rapports publiés chez le rat montrent que la progéniture de rat mâle exposée in utero au DBP (supérieure ou égale à 100 mg/kg/jour, environ 39 fois la dose humaine basée sur la surface corporelle), présente des aberrations du système reproducteur compatibles avec une perturbation de la dépendance androgénique. développement. La signification clinique de cette découverte chez le rat est inconnue. À des doses plus élevées (supérieures ou égales à 500 mg/kg/jour, soit environ 194 fois la dose humaine basée sur la surface corporelle), effets supplémentaires, y compris cryptorchidie, hypospadias, atrophie ou agénésie des organes sexuels accessoires, lésion testiculaire, réduction quotidienne la production de sperme, la rétention permanente des mamelons et une diminution de la distance anogénitale sont notées. La progéniture femelle n'est pas affectée. Des doses élevées de DBP, administrées à des rates gravides, ont été associées à une incidence accrue d'anomalies du développement, telles que la fente palatine (supérieure ou égale à 630 mg/kg/jour, environ 244 fois la dose humaine, basée sur la surface corporelle) et les troubles squelettiques. anomalies (supérieures ou égales à 750 mg/kg/jour, soit environ 290 fois la dose humaine basée sur la surface corporelle) chez la progéniture.
Mères allaitantes
La mésalamine et son métabolite N-acétyle sont présents dans le lait maternel. Dans des études publiées sur l'allaitement, les doses maternelles de mésalamine provenant de diverses formulations et produits oraux et rectaux variaient de 500 mg à 3 g par jour. La concentration de mésalamine dans le lait variait de non détectable à 0,11 mg/L. La concentration du métabolite acide N-acétyl-5-aminosalicylique variait de 5 à 18,1 mg/L. Sur la base de ces concentrations, les doses quotidiennes estimées pour un nourrisson exclusivement allaité sont de 0 à 0,017 mg/kg/jour de mésalamine et de 0,75 à 2,72 mg/kg/jour d'acide N-acétyl-5-aminosalicylique.
Le phtalate de dibutyle (DBP), un ingrédient inactif de l'enrobage entérique des comprimés d'Asacol 400 mg, et son principal métabolite, le phtalate de monobutyle (MBP), sont excrétés dans le lait maternel. La signification clinique de ceci n'a pas été déterminée.
Les avantages de l'allaitement pour le développement et la santé doivent être pris en compte, ainsi que le besoin clinique de la mère d'Asacol 400 mg et tout effet indésirable potentiel sur l'enfant allaité du médicament ou de l'affection maternelle sous-jacente. Soyez prudent lorsque Asacol 400 mg est administré à une femme qui allaite.
Utilisation pédiatrique
La sécurité et l'efficacité d'Asacol 400 mg chez les patients pédiatriques âgés de 5 à 17 ans pour le traitement de la rectocolite hémorragique active légère à modérée ont été établies sur une période de 6 semaines. L'utilisation d'Asacol dans ces tranches d'âge est étayée par des preuves issues d'études adéquates et bien contrôlées d'Asacol 400 mg chez des adultes et d'une seule étude chez des patients pédiatriques [voir EFFETS INDÉSIRABLES , PHARMACOLOGIE CLINIQUE et Etudes cliniques ].
Asacol 400 mg a été étudié dans une étude de traitement randomisée, en double aveugle, en groupes parallèles, de 6 semaines portant sur deux niveaux de dose d'Asacol 400 mg chez 82 patients pédiatriques âgés de 5 à 17 ans atteints de rectocolite hémorragique active légère à modérée. Tous les patients ont été divisés par catégorie de poids (17 à moins de 33 kg, 33 à moins de 54 kg et 54 à 90 kg) et répartis au hasard pour recevoir une faible dose (1,2, 2,0 et 2,4 g/jour pour le poids respectif catégorie) ou une dose élevée (2,0, 3,6 et 4,8 g/jour). Les visites de référence et de dépistage ont été suivies d'une période de traitement de 6 semaines [voir DOSAGE ET ADMINISTRATION ]. La dose élevée n'a pas été plus efficace que la faible dose et n'est pas une posologie approuvée [voir Etudes cliniques ].
La sécurité et l'efficacité d'Asacol chez les patients pédiatriques de moins de 5 ans n'ont pas été établies. La sécurité et l'efficacité d'Asacol dans le maintien de la rémission de la colite ulcéreuse chez les patients pédiatriques n'ont pas été établies.
Utilisation gériatrique
Les études cliniques d'Asacol n'ont pas inclus un nombre suffisant de sujets âgés de 65 ans et plus pour déterminer s'ils répondent différemment des sujets plus jeunes. D'autres expériences cliniques rapportées n'ont pas identifié de différences de réponse entre les patients âgés et les patients plus jeunes. En général, la plus grande fréquence de diminution de la fonction hépatique, rénale ou cardiaque et de maladie concomitante ou d'autres traitements médicamenteux chez les patients âgés doit être prise en compte lors de la prescription d'Asacol. Les rapports d'études cliniques non contrôlées et les systèmes de notification post-commercialisation suggèrent une incidence plus élevée de dyscrasies sanguines, c'est-à-dire d'agranulocytose, de neutropénie, de pancytopénie, chez les sujets recevant Asacol âgés de 65 ans ou plus. Des précautions doivent être prises pour surveiller étroitement la numération des cellules sanguines pendant le traitement par Asacol.
Insuffisance rénale
La mésalamine est connue pour être excrétée en grande partie par les reins, et le risque de réactions toxiques à ce médicament peut être plus élevé chez les patients présentant une insuffisance rénale. Étant donné que les patients âgés sont plus susceptibles d'avoir une fonction rénale diminuée, des précautions doivent être prises lors de la prescription de ce traitement médicamenteux. Il est recommandé que tous les patients aient une évaluation de la fonction rénale avant le début du traitement par Asacol et périodiquement pendant le traitement par Asacol [voir DOSAGE ET ADMINISTRATION , AVERTISSEMENTS ET PRECAUTIONS ].
SURDOSAGE
Il n'existe pas d'antidote spécifique en cas de surdosage de mésalamine et le traitement d'une suspicion de toxicité aiguë sévère par Asacol doit être symptomatique et de soutien. Cela peut inclure la prévention de l'absorption ultérieure du tractus gastro-intestinal, la correction du déséquilibre électrolytique liquide et le maintien d'une fonction rénale adéquate. Asacol 400 mg est un produit à libération retardée dépendant du pH et ce facteur doit être pris en compte lors du traitement d'un surdosage suspecté.
CONTRE-INDICATIONS
Asacol est contre-indiqué chez les patients présentant une hypersensibilité connue aux salicylates ou aux aminosalicylates ou à l'un des composants d'Asacol [voir AVERTISSEMENTS ET PRECAUTIONS , EFFETS INDÉSIRABLES , et LA DESCRIPTION ].
ASACOL (mésalamine) comprimés à libération retardée, à usage oral
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
Le mécanisme d'action de la mésalamine est inconnu, mais semble être topique plutôt que systémique. La production muqueuse de métabolites de l'acide arachidonique, à la fois par les voies de la cyclooxygénase, c'est-à-dire les prostanoïdes, et par les voies de la lipoxygénase, c'est-à-dire les leucotriènes et les acides hydroxyeicosatétraénoïques, est augmentée chez les patients atteints de colite ulcéreuse chronique, et il est possible que la mésalamine diminue l'inflammation en bloquant la cyclooxygénase et inhibant la production de prostaglandines dans le côlon.
Pharmacocinétique
Absorption
Environ 28 % de la mésalamine contenue dans les comprimés d'Asacol 400 mg sont absorbés après ingestion orale. L'absorption de la mésalamine est similaire chez les sujets à jeun et nourris. Le T max de la mésalamine et de son métabolite est généralement retardé, reflétant la libération retardée, et varie de 4 à 16 heures.
Métabolisme
La mésalamine absorbée est rapidement acétylée dans la paroi de la muqueuse intestinale et par le foie en acide N-acétyl-5aminosalicylique.
Excrétion
La mésalamine absorbée est principalement excrétée par les reins sous forme d'acide N-acétyl-5-aminosalicylique. La mésalamine non absorbée est excrétée dans les fèces.
Après administration intraveineuse, la demi-vie d'élimination de la mésalamine est d'environ 40 minutes. Après administration orale, les valeurs de t½ terminales pour la mésalamine et l'acide N-acétyl-5-aminosalicylique sont généralement d'environ 12 heures, mais sont variables, allant de 2 à 15 heures. Il existe une grande variabilité inter-individuelle et intra-individuelle des concentrations plasmatiques de mésalamine et d'acide N-acétyl-5-aminosalicylique et de leurs demi-vies d'élimination après administration d'Asacol.
Populations spécifiques
Patients pédiatriques
Dans une étude pharmacocinétique de dosage évaluant des doses de 30, 60 et 90 mg/kg/jour d'Asacol 400 mg administrées deux fois par jour pendant quatre semaines, les valeurs moyennes de Cavg de la mésalamine chez les patients pédiatriques atteints de rectocolite hémorragique variaient d'environ 400 ng/mL à 2100 ng /mL basé sur les données de tous les niveaux de dose.
Dans une étude chez des patients pédiatriques atteints de colite ulcéreuse (étude 3), les concentrations plasmatiques moyennes de mésalamine (sur la base d'un échantillonnage épars) étaient de 820 à 988 ng/mL à faible dose (c'est-à-dire 1,2, 2,0 ou 2,4 g/jour sur la base de strates de poids corporel de 17 à plus de 33 kg, de 33 à moins de 54 kg et de 54 à moins de 90 kg, respectivement).
Toxicologie animale et/ou pharmacologie
Dans les études animales (rats, souris, chiens), le rein était le principal organe de toxicité. (Dans ce qui suit, les comparaisons entre la posologie animale et la posologie humaine recommandée sont basées sur la surface corporelle et une dose de 2,4 g/jour pour une personne de 60 kg.)
La mésalamine provoque une nécrose papillaire rénale chez le rat à des doses uniques d'environ 750 mg/kg à 1000 mg/kg (environ 3 à 4 fois la dose humaine recommandée en fonction de la surface corporelle). Des doses de 170 et 360 mg/kg/jour (environ 0,7 et 1,5 fois la dose humaine recommandée en fonction de la surface corporelle) administrées à des rats pendant six mois ont produit une nécrose papillaire, un œdème papillaire, une dégénérescence tubulaire, une minéralisation tubulaire et une hyperplasie urothéliale.
Chez la souris, des doses orales de 4 000 mg/kg/jour de mésalamine (environ 8 fois la dose humaine recommandée en fonction de la surface corporelle) pendant trois mois ont produit une néphrose tubulaire, une inflammation tubulo-interstitielle multifocale/diffuse et une nécrose papillaire multifocale/diffuse.
Chez le chien, des doses uniques de 6000 mg (environ 8 fois la dose humaine recommandée en fonction de la surface corporelle) de comprimés de mésalamine à libération retardée ont entraîné une nécrose papillaire rénale, mais n'ont pas été fatales. Des modifications rénales sont survenues chez des chiens ayant reçu une administration chronique de mésalamine à des doses de 80 mg/kg/jour (1,1 fois la dose humaine recommandée en fonction de la surface corporelle).
Etudes cliniques
Traitement de la colite ulcéreuse légèrement à modérément active
Adultes
Deux études contrôlées versus placebo (Etudes 1 et 2) ont démontré l'efficacité des comprimés d'Asacol chez des patients atteints de rectocolite hémorragique active légère à modérée.
Dans un essai randomisé, en double aveugle et multicentrique de 158 patients (étude 1), des doses d'Asacol de 1,6 g/jour et 2,4 g/jour pendant 6 semaines ont été comparées à un placebo. Le système de notation pour la détermination de l'efficacité du traitement comprenait l'évaluation de la fréquence des selles, des saignements rectaux, des résultats sigmoïdoscopiques, de l'évaluation fonctionnelle du patient et de l'évaluation globale du médecin. À la dose de 2,4 g/jour, 21 patients sur 43 (49 %) utilisant des comprimés d'Asacol ont montré une amélioration de l'aspect sigmoïdoscopique de l'intestin par rapport à 12 patients sur 44 (27 %) utilisant un placebo (p = 0,048). En outre, un nombre significativement plus élevé de patients du groupe Asacol comprimés 2,4 g/jour ont présenté une amélioration des saignements rectaux et de la fréquence des selles. La dose de 1,6 g/jour n'a pas produit de preuves cohérentes d'efficacité.
Dans un deuxième essai clinique randomisé, en double aveugle, contrôlé par placebo d'une durée de 6 semaines chez 87 patients (étude 2), les comprimés d'Asacol, à une dose de 4,8 g/jour, pendant 6 semaines, ont entraîné une amélioration sigmoïdoscopique chez 28 des 38 patients. (74 %) patients par rapport à 10 des 38 (26 %) patients sous placebo (p inférieur à 0,001). En outre, plus de patients du groupe Asacol 400 mg comprimés 4,8 g/jour que du groupe placebo ont montré une amélioration des symptômes globaux.
La dose de 4,8 g/jour n'est pas une posologie approuvée pour le traitement de la colite ulcéreuse légèrement à modérément active.
Pédiatrie
L'innocuité et l'efficacité d'Asacol 400 mg chez les patients pédiatriques âgés de 5 à 17 ans pour le traitement de la rectocolite hémorragique active légère à modérée sont étayées par des preuves issues d'études adéquates et bien contrôlées d'Asacol 400 mg chez l'adulte et d'une seule étude chez des patients pédiatriques.
Une étude randomisée, en double aveugle, de 6 semaines portant sur 2 niveaux de dose d'Asacol (étude 3) a été menée chez 82 patients pédiatriques âgés de 5 à 17 ans atteints de rectocolite hémorragique légèrement ou modérément active. Tous les patients ont été divisés par catégorie de poids (17 à moins de 33 kg, 33 à moins de 54 kg et 54 à 90 kg) et répartis au hasard pour recevoir une faible dose (1,2, 2,0 et 2,4 g/jour pour le poids respectif catégorie) ou une dose élevée (2,0, 3,6 et 4,8 g/jour). Les doses ont été administrées toutes les 12 heures.
La proportion de patients qui ont réussi selon le score Mayo tronqué (TM-Mayo) (basé sur la fréquence des selles et les sous-scores de saignement rectal du score Mayo) et sur la base de l'indice d'activité de la colite ulcéreuse pédiatrique (PUCAI) (qui comprenait l'évaluation de douleurs abdominales, saignements rectaux, consistance et fréquence des selles, présence de selles nocturnes et niveau d'activité) ont été mesurés après 6 semaines de traitement. Le succès basé sur TM-Mayo a été défini comme une réponse partielle (amélioration par rapport au départ de la fréquence des selles ou des sous-scores des saignements rectaux sans aggravation de l'autre) ou une réponse complète (la fréquence des selles et les sous-scores des saignements rectaux sont égaux à 0). Le succès basé sur le PUCAI a été défini comme une réponse partielle (réduction du PUCAI supérieure ou égale à 20 points entre le départ et la semaine 6 avec un score à la semaine 6 supérieur ou égal à 10) ou une réponse complète (PUCAI inférieur à 10 à la semaine 6).
Il y avait 41 patients dans le groupe à faible dose et 41 patients dans le groupe à forte dose qui ont reçu au moins une dose d'Asacol ; 36 patients dans chaque groupe de dose ont terminé l'étude. Les patients étaient considérés comme des échecs thérapeutiques s'ils n'obtenaient pas de succès ou s'ils abandonnaient en raison d'effets indésirables ou d'un manque d'efficacité.
À la semaine 6, 73,2 % des patients du groupe à faible dose et 70,0 % des patients du groupe à forte dose ont obtenu du succès sur la base du TM-Mayo ; 34,1 % des patients du groupe à faible dose et 42,5 % des patients du groupe à forte dose ont obtenu une réponse complète. À la semaine 6, 56,1 % des patients du groupe à faible dose et 55,0 % des patients du groupe à dose élevée ont obtenu un succès basé sur le PUCAI ; 46,3 % des patients du groupe à faible dose et 42,5 % des patients du groupe à forte dose ont obtenu une réponse complète.
La dose élevée n'a pas été plus efficace que la faible dose et n'est pas une posologie approuvée [voir DOSAGE ET ADMINISTRATION ].
Maintien de la rémission de la colite ulcéreuse chez les adultes
Une étude multicentrique de 6 mois, randomisée, en double aveugle, contrôlée par placebo (étude 4) a impliqué 264 patients traités par Asacol 400 mg comprimés 0,8 g/jour (n = 90), 1,6 g/jour (n = 87) , ou un placebo (n = 87). Dans le bras 0,8 g/jour, les patients ont reçu une dose deux fois par jour ; dans le bras 1,6 g/jour, les patients ont reçu la dose quatre fois par jour. La proportion de patients traités avec 0,8 g/jour qui ont maintenu une rémission endoscopique n'était pas statistiquement significative par rapport au placebo. La proportion de patients utilisant des comprimés d'Asacol 1,6 g/jour qui ont maintenu la rémission endoscopique de la rectocolite hémorragique était de 61 sur 87 (70,1 %) contre 42 sur 87 (48,3 %) des patients sous placebo (p = 0,005).
Une analyse d'efficacité groupée de 4 essais d'entretien a comparé les comprimés d'Asacol 400 mg, à des doses de 0,8 g/jour à 2,8 g/jour, en doses fractionnées allant de deux fois par jour à quatre fois par jour, avec la sulfasalazine, à des doses de 2 g/jour à 4 g/jour. Le succès du traitement a été observé chez 59 des 98 (59 %) patients utilisant des comprimés d'Asacol et 70 des 102 (69 %) patients utilisant de la sulfasalazine, une différence non significative.
INFORMATIONS PATIENTS
- Demandez aux patients d'avaler les comprimés d'Asacol entiers, en prenant soin de ne pas casser, couper ou mâcher les comprimés, car l'enrobage est une partie importante de la formulation à libération retardée.
- Informez les patients que s'ils passent d'un précédent traitement oral à la mésalamine à Asacol, ils doivent interrompre leur précédent traitement oral à la mésalamine et suivre les instructions de dosage d'Asacol. Informez les patients qu'ils ne doivent pas remplacer deux comprimés d'Asacol 400 mg par un comprimé d'Asacol 400 mg HD 800 mg [voir DOSAGE ET ADMINISTRATION ].
- Informez les patients que des coques intactes, partiellement intactes et/ou des comprimés ont été rapportées dans les selles. Demandez aux patients de contacter leur médecin si cela se produit à plusieurs reprises.
- Demandez aux patients de protéger les comprimés d'Asacol 400 mg de l'humidité. Demandez aux patients de fermer hermétiquement le récipient et de laisser les sachets déshydratants présents dans le flacon avec les comprimés.
- Informez les femmes enceintes, allaitantes ou en âge de procréer qu'Asacol 400 mg contient du phtalate de dibutyle, qui a été associé à des malformations et à des effets indésirables sur le système reproducteur masculin dans les études animales. Le phtalate de dibutyle est excrété dans le lait maternel.
