Traitement contre le cancer: Nolvadex 10mg, 20mg Tamoxifen Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Nolvadex et comment est-il utilisé ?
Nolvadex 10 mg est un médicament sur ordonnance utilisé pour traiter les symptômes du cancer du sein. Nolvadex peut être utilisé seul ou avec d'autres médicaments.
Nolvadex 20 mg appartient à une classe de médicaments appelés antinéoplasiques, antagonistes des récepteurs aux œstrogènes.
On ne sait pas si Nolvadex 20 mg est sûr et efficace chez les enfants.
Quels sont les effets secondaires possibles de Nolvadex 20mg ?
Nolvadex peut provoquer des effets secondaires graves, notamment :
- changements de vision,
- douleur oculaire,
- ecchymoses ou saignements faciles,
- des changements d'humeur,
- gonflement des chevilles ou des pieds, et
- fatigue inhabituelle
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Nolvadex incluent :
- les bouffées de chaleur,
- rinçage,
- changements dans les périodes menstruelles,
- nausée,
- crampes dans les jambes,
- crampes abdominales,
- douleur osseuse,
- douleur musculaire,
- toux,
- gonflement,
- fatigue,
- amincissement des cheveux,
- mal de tête,
- dépression, et
- perte de capacité/d'intérêt sexuel (chez les hommes)
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Nolvadex. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
ATTENTION
Pour les femmes atteintes d'un carcinome canalaire in situ (CCIS) et les femmes à haut risque de cancer du sein : Les événements graves et potentiellement mortels associés à NOLVADEX (citrate de tamoxifène) dans le cadre de la réduction des risques (femmes à risque élevé de cancer et femmes atteintes de CCIS) comprennent les tumeurs malignes de l'utérus, les accidents vasculaires cérébraux et les embolies pulmonaires. Les taux d'incidence de ces événements ont été estimés à partir de l'essai NSABP P-1 (voir PHARMACOLOGIE CLINIQUE - Études cliniques - Réduction de l'incidence du cancer du sein chez les femmes à haut risque ). Les tumeurs malignes de l'utérus comprennent à la fois l'adénocarcinome de l'endomètre (taux d'incidence pour 1 000 femmes-années de 2,20 pour NOLVADEX (citrate de tamoxifène) vs 0,71 pour le placebo) et le sarcome utérin (taux d'incidence pour 1 000 femmes-années de 0,17 pour NOLVADEX (citrate de tamoxifène) vs 0,4 pour placebo)*. Pour les accidents vasculaires cérébraux, le taux d'incidence pour 1 000 femmes-années était de 1,43 pour NOLVADEX (citrate de tamoxifène) contre 1,00 pour le placebo**. Pour l'embolie pulmonaire, le taux d'incidence pour 1 000 années-femmes était de 0,75 pour NOLVADEX (citrate de tamoxifène) contre 0,25 pour le placebo**.
Certains des accidents vasculaires cérébraux, des embolies pulmonaires et des tumeurs malignes de l'utérus ont été mortels.
Les fournisseurs de soins de santé devraient discuter des avantages potentiels par rapport aux risques potentiels de ces événements graves avec les femmes à risque élevé de cancer du sein et les femmes atteintes de CCIS qui envisagent NOLVADEX (citrate de tamoxifène) pour réduire leur risque de développer un cancer du sein.
Les avantages de NOLVADEX (citrate de tamoxifène) l'emportent sur ses risques chez les femmes déjà diagnostiquées avec un cancer du sein.
RÉFÉRENCES
* Données de suivi à long terme mises à jour (la durée médiane de suivi est de 6,9 ans) de l'étude NSABP P-1. Voir MISES EN GARDE : Effets sur le cancer de l'utérus et de l'endomètre et sur le sarcome utérin .
**Voir tableau 3 sous PHARMACOLOGIE CLINIQUE-Études cliniques .
LA DESCRIPTION
Les comprimés NOLVADEX® (citrate de tamoxifène), un anti-œstrogène non stéroïdien, doivent être administrés par voie orale. Les comprimés NOLVADEX (citrate de tamoxifène) sont disponibles sous les formes suivantes :
Comprimés de 10 mg
Chaque comprimé contient 15,2 mg de citrate de tamoxifène, ce qui équivaut à 10 mg de tamoxifène.
Comprimés de 20 mg
Chaque comprimé contient 30,4 mg de citrate de tamoxifène, ce qui équivaut à 20 mg de tamoxifène.
Ingrédients inactifs : carboxyméthylcellulose calcique, stéarate de magnésium, mannitol et amidon.
Chimiquement, NOLVADEX (citrate de tamoxifène) est l'isomère trans d'un dérivé de triphényléthylène. Le nom chimique est (Z)2-[4-(1,2-diphényl-1-butényl)phénoxy]-N,N-diméthyléthanamine 2 hydroxy-1,2,3-propanetricarboxylate (1:1). Les formules structurelles et empiriques sont :
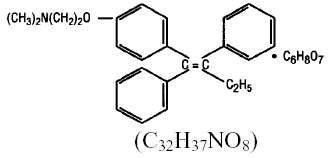
Le citrate de tamoxifène a un poids moléculaire de 563,62, le pKa' est de 8,85, la solubilité à l'équilibre dans l'eau à 37°C est de 0,5 mg/mL et dans HCl 0,02 N à 37°C, elle est de 0,2 mg/mL.
LES INDICATIONS
Cancer du sein métastatique
NOLVADEX (citrate de tamoxifène) est efficace dans le traitement du cancer du sein métastatique chez les femmes et les hommes. Chez les femmes préménopausées atteintes d'un cancer du sein métastatique, NOLVADEX (citrate de tamoxifène) est une alternative à l'ovariectomie ou à l'irradiation ovarienne. Les preuves disponibles indiquent que les patientes dont les tumeurs sont positives pour les récepteurs aux œstrogènes sont plus susceptibles de bénéficier du traitement par NOLVADEX (citrate de tamoxifène).
Traitement adjuvant du cancer du sein
NOLVADEX (citrate de tamoxifène) est indiqué pour le traitement du cancer du sein avec envahissement ganglionnaire chez les femmes après une mastectomie totale ou une mastectomie segmentaire, une dissection axillaire et une irradiation du sein. Dans certaines études adjuvantes NOLVADEX (citrate de tamoxifène), la plupart des avantages à ce jour ont été observés dans le sous-groupe avec quatre ganglions axillaires positifs ou plus.
NOLVADEX (citrate de tamoxifène) est indiqué pour le traitement du cancer du sein sans ganglion axillaire chez les femmes après une mastectomie totale ou une mastectomie segmentaire, une dissection axillaire et une irradiation du sein.
Les valeurs des récepteurs aux œstrogènes et à la progestérone peuvent aider à prédire si le traitement adjuvant par NOLVADEX (citrate de tamoxifène) est susceptible d'être bénéfique.
NOLVADEX (citrate de tamoxifène) réduit l'incidence du cancer du sein controlatéral chez les patientes recevant un traitement adjuvant par NOLVADEX (citrate de tamoxifène) pour le cancer du sein.
Carcinome canalaire in situ (CCIS)
Chez les femmes atteintes de CCIS, après une chirurgie mammaire et une radiothérapie, NOLVADEX (citrate de tamoxifène) est indiqué pour réduire le risque de cancer du sein invasif (voir AVERTISSEMENT ENCADRÉ au début de l'étiquette). La décision concernant le traitement par NOLVADEX (citrate de tamoxifène) pour la réduction de l'incidence du cancer du sein doit être basée sur une évaluation individuelle des bénéfices et des risques du traitement par NOLVADEX (citrate de tamoxifène).
Les données actuelles des essais cliniques soutiennent cinq ans de traitement adjuvant par NOLVADEX (citrate de tamoxifène) pour les patientes atteintes d'un cancer du sein.
Réduction de l'incidence du cancer du sein chez les femmes à haut risque
NOLVADEX (citrate de tamoxifène) est indiqué pour réduire l'incidence du cancer du sein chez les femmes à risque élevé de cancer du sein. Cet effet a été démontré dans une étude d'une durée prévue de 5 ans avec un suivi médian de 4,2 ans. Vingt-cinq pour cent des participants ont reçu des médicaments pendant 5 ans. Les effets à plus long terme ne sont pas connus. Dans cette étude, il n'y a pas eu d'impact du tamoxifène sur la mortalité globale ou liée au cancer du sein (voir AVERTISSEMENT ENCADRÉ au début de l'étiquette).
NOLVADEX (citrate de tamoxifène) est indiqué uniquement pour les femmes à haut risque. « Risque élevé » est défini comme les femmes âgées d'au moins 35 ans avec un risque prévu sur 5 ans de cancer du sein ≥ 1,67 %, tel que calculé par le modèle de Gail.
Voici des exemples de combinaisons de facteurs prédisant un risque à 5 ans ≥ 1,67 % :
35 ans ou plus et l'une des combinaisons de facteurs suivantes :
- Un parent au premier degré avec des antécédents de cancer du sein, 2 biopsies bénignes ou plus et des antécédents de biopsie mammaire montrant une hyperplasie atypique ; ou
- Au moins 2 parents au premier degré ayant des antécédents de cancer du sein et des antécédents personnels d'au moins une biopsie mammaire ; ou
- CLIS
40 ans ou plus et l'une des combinaisons de facteurs suivantes :
- Un parent au premier degré avec des antécédents de cancer du sein, 2 biopsies bénignes ou plus, un âge à la première naissance vivante de 25 ans ou plus et un âge à la ménarche de 11 ans ou moins ; ou
- Au moins 2 parents au premier degré ayant des antécédents de cancer du sein et un âge à la première naissance vivante de 19 ans ou moins ; ou
- Un parent au premier degré avec des antécédents de cancer du sein et des antécédents personnels de biopsie mammaire montrant une hyperplasie atypique.
45 ans ou plus et l'une des combinaisons de facteurs suivantes :
- Au moins 2 parents au premier degré ayant des antécédents de cancer du sein et un âge à la première naissance vivante de 24 ans ou moins ; ou
- Un parent au premier degré avec des antécédents de cancer du sein avec des antécédents personnels de biopsie mammaire bénigne, un âge à la ménarche de 11 ans ou moins et un âge à la première naissance vivante de 20 ans ou plus.
50 ans ou plus et l'une des combinaisons de facteurs suivantes :
- Au moins 2 parents au premier degré ayant des antécédents de cancer du sein ; ou
- Antécédents d'une biopsie mammaire montrant une hyperplasie atypique, et âge à la première naissance vivante de 30 ans ou plus et âge à la ménarche de 11 ans ou moins ; ou
- Antécédents d'au moins deux biopsies mammaires avec antécédents d'hyperplasie atypique et âge à la première naissance vivante de 30 ans ou plus.
55 ans ou plus et l'une des combinaisons de facteurs suivantes :
- Un parent au premier degré avec des antécédents de cancer du sein avec des antécédents personnels de biopsie mammaire bénigne et un âge à la ménarche de 11 ans ou moins ; ou
- Antécédents d'au moins 2 biopsies mammaires avec antécédents d'hyperplasie atypique et âge à la première naissance vivante de 20 ans ou plus.
60 ans ou plus et :
- Risque prédit sur 5 ans de cancer du sein ≥ 1,67 %, tel que calculé par le modèle de Gail.
Pour les femmes dont les facteurs de risque ne sont pas décrits dans les exemples ci-dessus, le modèle de Gail est nécessaire pour estimer le risque absolu de cancer du sein. Les professionnels de la santé peuvent obtenir un outil d'évaluation des risques du modèle Gail en composant le 1-800-544-2007.
Les données disponibles concernant l'effet de NOLVADEX (citrate de tamoxifène) sur l'incidence du cancer du sein chez les femmes présentant des mutations héréditaires (BRCA1, BRCA2) sont insuffisantes pour pouvoir formuler des recommandations spécifiques sur l'efficacité de NOLVADEX (citrate de tamoxifène) chez ces patientes.
Après une évaluation du risque de développer un cancer du sein, la décision concernant le traitement par NOLVADEX (citrate de tamoxifène) pour la réduction de l'incidence du cancer du sein doit être basée sur une évaluation individuelle des bénéfices et des risques du traitement par NOLVADEX (citrate de tamoxifène). Dans l'essai NSABP P-1, le traitement par NOLVADEX (citrate de tamoxifène) a réduit le risque de développer un cancer du sein pendant la période de suivi de l'essai, mais n'a pas éliminé le risque de cancer du sein (voir tableau 3 dans PHARMACOLOGIE CLINIQUE ).
DOSAGE ET ADMINISTRATION
Pour les patientes atteintes d'un cancer du sein, la dose quotidienne recommandée est de 20 à 40 mg. Les doses supérieures à 20 mg par jour doivent être administrées en doses fractionnées (matin et soir).
Dans trois études adjuvantes en monothérapie chez des femmes, un comprimé de 10 mg de NOLVADEX (citrate de tamoxifène) a été administré deux (ECOG et OTAN) ou trois (Toronto) fois par jour pendant deux ans. Dans l'étude adjuvante NSABP B-14 menée chez des femmes atteintes d'un cancer du sein sans envahissement ganglionnaire, un comprimé de 10 mg de NOLVADEX (citrate de tamoxifène) a été administré deux fois par jour pendant au moins 5 ans. Les résultats de l'étude B-14 suggèrent que la poursuite du traitement au-delà de cinq ans n'apporte pas de bénéfice supplémentaire (voir PHARMACOLOGIE CLINIQUE ). Dans l'aperçu de l'EBCTCG de 1995, la réduction de la récidive et de la mortalité était plus importante dans les études qui utilisaient le tamoxifène pendant environ 5 ans que dans celles qui utilisaient le tamoxifène pendant une période de traitement plus courte. Rien n'indiquait que des doses supérieures à 20 mg par jour étaient plus efficaces. Les données actuelles des essais cliniques soutiennent 5 ans de traitement adjuvant par NOLVADEX (citrate de tamoxifène) pour les patientes atteintes d'un cancer du sein.
Carcinome canalaire in situ (CCIS)
La dose recommandée est NOLVADEX (citrate de tamoxifène) 20 mg par jour pendant 5 ans.
Réduction de l'incidence du cancer du sein chez les femmes à haut risque
La dose recommandée est NOLVADEX (citrate de tamoxifène) 20 mg par jour pendant 5 ans. Il n'y a pas de données pour soutenir l'utilisation de NOLVADEX (citrate de tamoxifène) autre que pendant 5 ans (voir PHARMACOLOGIE CLINIQUE - Études cliniques - Réduction de l'incidence du cancer du sein chez les femmes à haut risque ).
COMMENT FOURNIE
Comprimés de 10 mg contenant du tamoxifène sous forme de citrate en une quantité équivalente à 10 mg de tamoxifène (comprimé rond, biconvexe, non enrobé, blanc identifié NOLVADEX (citrate de tamoxifène) 600 gravé sur un côté et un camée gravé sur l'autre côté) sont fournis en flacons de 60 comprimés. NDC 0310-0600-60.
Comprimés de 20 mg contenant du tamoxifène sous forme de citrate en une quantité équivalente à 20 mg de tamoxifène (comprimé rond, biconvexe, non enrobé, blanc identifié NOLVADEX (citrate de tamoxifène) 604 gravé sur un côté et un camée gravé sur l'autre côté) sont fournis en flacons de 30 comprimés. NDC 0310-0604-30.
Le magasin à la température de pièce contrôlée, 20-25°C (68-77°F) [voit USP]. Distribuer dans un récipient bien fermé et résistant à la lumière.
*Coumadin® est une marque déposée de Bristol-Myers Squibb Pharmaceuticals. Toutes les autres marques sont la propriété du groupe AstraZeneca, AstraZeneca Pharmaceuticals LP Wilmington, Delaware 19850-5437. Rév. 09-27-05. Date de révision FDA : 09/03/2006
EFFETS SECONDAIRES
Les effets indésirables de NOLVADEX (citrate de tamoxifène) sont relativement légers et rarement suffisamment graves pour nécessiter l'arrêt du traitement chez les patientes atteintes d'un cancer du sein.
Des études cliniques continues ont abouti à des informations supplémentaires qui indiquent mieux l'incidence des effets indésirables avec NOLVADEX (citrate de tamoxifène) par rapport au placebo.
Cancer du sein métastatique
Une augmentation des douleurs osseuses et tumorales et, également, une poussée locale de la maladie se sont produites, qui sont parfois associées à une bonne réponse tumorale. Les patients souffrant de douleurs osseuses accrues peuvent avoir besoin d'analgésiques supplémentaires. Les patients atteints d'une maladie des tissus mous peuvent présenter une augmentation soudaine de la taille des lésions préexistantes, parfois associée à un érythème marqué à l'intérieur et autour des lésions et/ou au développement de nouvelles lésions. Lorsqu'elles surviennent, la douleur osseuse ou la poussée de la maladie sont observées peu de temps après le début de NOLVADEX (citrate de tamoxifène) et disparaissent généralement rapidement.
Chez les patientes traitées par NOLVADEX (citrate de tamoxifène) pour un cancer du sein métastatique, la réaction indésirable la plus fréquente à NOLVADEX (citrate de tamoxifène) est les bouffées de chaleur.
D'autres effets indésirables peu fréquents sont l'hypercalcémie, l'œdème périphérique, le dégoût pour la nourriture, le prurit vulvaire, la dépression, les étourdissements, les étourdissements, les maux de tête, l'amincissement et/ou la chute partielle des cheveux et la sécheresse vaginale.
Femmes préménopausées
Le tableau suivant résume l'incidence des effets indésirables rapportés à une fréquence de 2 % ou plus dans les essais cliniques (Ingle, Pritchard, Buchanan) qui ont comparé le traitement par NOLVADEX (citrate de tamoxifène) à l'ablation des ovaires chez les patientes préménopausées atteintes d'un cancer du sein métastatique.
Cancer du sein masculin
NOLVADEX (citrate de tamoxifène) est bien toléré chez les hommes atteints d'un cancer du sein. Les rapports de la littérature et les rapports de cas suggèrent que le profil d'innocuité de NOLVADEX (citrate de tamoxifène) chez les hommes est similaire à celui observé chez les femmes. La perte de libido et l'impuissance ont entraîné l'arrêt du traitement par le tamoxifène chez les patients de sexe masculin. De plus, chez les mâles oligospermiques traités au tamoxifène, les taux de LH, de FSH, de testostérone et d'œstrogènes étaient élevés. Aucun changement clinique significatif n'a été rapporté.
Cancer du sein adjuvant
Dans l'étude NSABP B-14, des femmes atteintes d'un cancer du sein sans ganglion axillaire ont été randomisées pour recevoir pendant 5 ans NOLVADEX (citrate de tamoxifène) 20 mg/jour ou un placebo après une chirurgie primaire. Les effets indésirables rapportés sont tabulés ci-dessous (suivi moyen d'environ 6,8 ans) montrant des événements indésirables plus fréquents sous NOLVADEX (citrate de tamoxifène) que sous placebo. L'incidence des bouffées de chaleur (64 % contre 48 %), des pertes vaginales (30 % contre 15 %) et des règles irrégulières (25 % contre 19 %) était plus élevée avec NOLVADEX (citrate de tamoxifène) qu'avec le placebo. Tous les autres effets indésirables sont survenus avec une fréquence similaire dans les 2 groupes de traitement, à l'exception des événements thrombotiques ; une incidence plus élevée a été observée chez les patientes traitées par NOLVADEX (citrate de tamoxifène) (sur 5 ans, 1,7 % contre 0,4 %). Deux des patients traités par NOLVADEX (citrate de tamoxifène) qui ont eu des événements thrombotiques sont décédés.
Dans l'essai sur le cancer du sein adjuvant de l'Eastern Cooperative Oncology Group (ECOG), NOLVADEX (citrate de tamoxifène) ou un placebo a été administré pendant 2 ans à des femmes après une mastectomie. Par rapport au placebo, NOLVADEX (citrate de tamoxifène) a montré une incidence significativement plus élevée de bouffées de chaleur (19 % contre 8 % pour le placebo). L'incidence de tous les autres effets indésirables était similaire dans les 2 groupes de traitement à l'exception de la thrombocytopénie où l'incidence pour NOLVADEX (citrate de tamoxifène) était de 10 % contre 3 % pour le placebo, une observation à la limite de la signification statistique.
Dans d'autres études adjuvantes, Toronto et NOLVADEX (citrate de tamoxifène) Adjuvant Trial Organization (NATO), les femmes ont reçu NOLVADEX (citrate de tamoxifène) ou aucun traitement. Dans l'étude de Toronto, des bouffées de chaleur ont été observées chez 29 % des patients sous NOLVADEX (citrate de tamoxifène) contre 1 % dans le groupe non traité. Dans l'essai de l'OTAN, des bouffées de chaleur et des saignements vaginaux ont été signalés chez 2,8 % et 2,0 % des femmes, respectivement, pour NOLVADEX (citrate de tamoxifène) contre 0,2 % pour chacun dans le groupe non traité.
Essai sur l'anastrozole adjuvant - Étude de l'anastrozole par rapport à NOLVADEX (citrate de tamoxifène) pour le traitement adjuvant du cancer du sein précoce (voir PHARMACOLOGIE CLINIQUE - Etudes cliniques).
Lors d'un suivi médian de 33 mois, l'association d'anastrozole et de NOLVADEX (citrate de tamoxifène) n'a démontré aucun avantage en termes d'efficacité par rapport au traitement par NOLVADEX (citrate de tamoxifène) administré seul chez tous les patients ainsi que dans la sous-population positive aux récepteurs hormonaux. Ce bras de traitement a été retiré de l'essai. La durée médiane du traitement adjuvant pour l'évaluation de l'innocuité était de 59,8 mois et de 59,6 mois pour les patientes recevant respectivement 1 mg d'anastrozole et 20 mg de NOLVADEX (citrate de tamoxifène).
Les événements indésirables survenus avec une incidence d'au moins 5 % dans l'un ou l'autre des groupes de traitement pendant le traitement ou dans les 14 jours suivant la fin du traitement sont présentés dans le tableau suivant.
Événements indésirables survenant avec une incidence d'au moins 5 % dans l'un ou l'autre des groupes de traitement pendant le traitement ou dans les 14 jours suivant la fin du traitement
Certains événements indésirables et combinaisons d'événements indésirables ont été spécifiés de manière prospective pour analyse, sur la base des propriétés pharmacologiques connues et des profils d'effets secondaires des deux médicaments (voir le tableau suivant).
Nombre (%) de patients présentant un événement indésirable pré-spécifié dans l'essai sur l'adjuvant anastrozole1
Les patients recevant de l'anastrozole ont présenté une augmentation des troubles articulaires (y compris l'arthrite, l'arthrose et l'arthralgie) par rapport aux patients recevant NOLVADEX (citrate de tamoxifène). Les patients recevant de l'anastrozole ont présenté une augmentation de l'incidence de toutes les fractures (en particulier les fractures de la colonne vertébrale, de la hanche et du poignet) [315 (10 %)] par rapport aux patients recevant NOLVADEX (citrate de tamoxifène) [209 (7 %)]. Les patientes recevant de l'anastrozole ont présenté une diminution des bouffées de chaleur, des saignements vaginaux, des pertes vaginales, du cancer de l'endomètre, des événements thromboemboliques veineux et des événements cérébrovasculaires ischémiques par rapport aux patientes recevant NOLVADEX (citrate de tamoxifène) .
Les patients recevant NOLVADEX (citrate de tamoxifène) ont présenté une diminution de l'hypercholestérolémie (108 [3,5 %]) par rapport aux patients recevant de l'anastrozole (278 [9 %]). Une angine de poitrine a été signalée chez 71 [2,3 %] patientes du bras anastrozole et 51 [1,6 %] patientes du bras NOLVADEX (citrate de tamoxifène) ; un infarctus du myocarde a été signalé chez 37 [1,2 %] patients du bras anastrozole et chez 34 [1,1 %] patients du bras NOLVADEX (citrate de tamoxifène).
Les résultats de la sous-étude osseuse de l'essai adjuvant, à 12 et 24 mois, ont démontré que les patients recevant de l'anastrozole présentaient une diminution moyenne de la densité minérale osseuse (DMO) de la colonne lombaire et de la hanche totale par rapport à la valeur initiale. Les patients recevant NOLVADEX (citrate de tamoxifène) ont présenté une augmentation moyenne de la DMO de la colonne lombaire et de la hanche totale par rapport au départ.
Carcinome canalaire in situ (CCIS)
Le type et la fréquence des effets indésirables dans l'essai NSABP B-24 correspondaient à ceux observés dans les autres essais adjuvants menés avec NOLVADEX (citrate de tamoxifène) .
Réduction de l'incidence du cancer du sein chez les femmes à haut risque
Dans l'essai NSABP P-1, il y a eu une augmentation de cinq effets indésirables graves dans le groupe NOLVADEX (citrate de tamoxifène) : cancer de l'endomètre (33 cas dans le groupe NOLVADEX (citrate de tamoxifène) contre 14 dans le groupe placebo) ; embolie pulmonaire (18 cas dans le groupe NOLVADEX (citrate de tamoxifène) vs 6 dans le groupe placebo) ; thrombose veineuse profonde (30 cas dans le groupe NOLVADEX (citrate de tamoxifène) vs 19 dans le groupe placebo) ; accident vasculaire cérébral (34 cas dans le groupe NOLVADEX (citrate de tamoxifène) vs 24 dans le groupe placebo) ; formation de cataracte (540 cas dans le groupe NOLVADEX (citrate de tamoxifène) vs 483 dans le groupe placebo) et chirurgie de la cataracte (101 cas dans le groupe NOLVADEX (citrate de tamoxifène) vs 63 dans le groupe placebo) (Voir AVERTISSEMENTS et le tableau 3 dans PHARMACOLOGIE CLINIQUE ).
Le tableau suivant présente les événements indésirables observés dans le NSABP P-1 par bras de traitement. Seuls les événements indésirables plus fréquents sous NOLVADEX (citrate de tamoxifène) que sous placebo sont présentés.
Dans l'essai NSABP P-1, 15,0 % et 9,7 % des participants recevant NOLVADEX (citrate de tamoxifène) et un placebo, respectivement, se sont retirés de l'essai pour des raisons médicales. Les raisons médicales suivantes expliquent l'abandon du NOLVADEX (citrate de tamoxifène) et du placebo, respectivement : bouffées de chaleur (3,1 % contre 1,5 %) et pertes vaginales (0,5 % contre 0,1 %).
Dans l'essai NSABP P-1, 8,7 % et 9,6 % des participants recevant NOLVADEX (citrate de tamoxifène) et un placebo, respectivement, se sont retirés pour des raisons non médicales.
Lors de l'essai NSABP P-1, des bouffées de chaleur de toute gravité sont survenues chez 68 % des femmes sous placebo et chez 80 % des femmes sous NOLVADEX (citrate de tamoxifène) . Des bouffées de chaleur sévères sont survenues chez 28 % des femmes sous placebo et 45 % des femmes sous NOLVADEX (citrate de tamoxifène). Des pertes vaginales sont survenues chez 35 % et 55 % des femmes sous placebo et NOLVADEX (citrate de tamoxifène) respectivement ; et était sévère chez 4,5% et 12,3% respectivement. Il n'y avait aucune différence dans l'incidence des saignements vaginaux entre les bras de traitement.
Patients pédiatriques - Syndrome de McCune-Albright
Le volume utérin moyen a augmenté après 6 mois de traitement et a doublé à la fin de l'étude d'un an. Une relation causale n'a pas été établie; cependant, comme une augmentation de l'incidence des adénocarcinomes de l'endomètre et des sarcomes utérins a été observée chez les adultes traités par NOLVADEX (voir AVERTISSEMENT ENCADRÉ ), une surveillance continue des patients McCune-Albright traités par NOLVADEX (citrate de tamoxifène) pour les effets à long terme est recommandée. L'innocuité et l'efficacité de NOLVADEX (citrate de tamoxifène) chez les filles âgées de deux à 10 ans atteintes du syndrome de McCune-Albright et de puberté précoce n'ont pas été étudiées au-delà d'un an de traitement. Les effets à long terme du traitement par NOLVADEX (citrate de tamoxifène) chez les filles n'ont pas été établis.
Expérience post-commercialisation
Les effets indésirables moins fréquemment signalés sont les saignements vaginaux, les pertes vaginales, les irrégularités menstruelles, les éruptions cutanées et les maux de tête. Habituellement, ceux-ci n'ont pas été suffisamment graves pour nécessiter une réduction de la posologie ou l'arrêt du traitement. De très rares cas d'érythème polymorphe, de syndrome de Stevens-Johnson, de pemphigoïde bulleuse, de pneumonite interstitielle et de rares cas de réactions d'hypersensibilité, notamment d'œdème de Quincke, ont été signalés avec le traitement par NOLVADEX (citrate de tamoxifène). Dans certains de ces cas, le délai d'apparition était supérieur à un an. Rarement, une élévation des taux sériques de triglycérides, dans certains cas avec une pancréatite, peut être associée à l'utilisation de NOLVADEX (citrate de tamoxifène) (voir PRÉCAUTIONS - Interactions entre les médicaments et les tests de laboratoire section).
INTERACTIONS MÉDICAMENTEUSES
Lorsque NOLVADEX (citrate de tamoxifène) est utilisé en association avec des anticoagulants de type coumarine, une augmentation significative de l'effet anticoagulant peut survenir. Lorsqu'une telle co-administration existe, une surveillance attentive du temps de prothrombine du patient est recommandée.
Dans l'essai NSABP P-1, les femmes qui avaient besoin d'anticoagulants de type coumarine pour une raison quelconque n'étaient pas éligibles pour participer à l'essai (voir CONTRE-INDICATIONS ).
Il existe un risque accru d'événements thromboemboliques survenant lorsque des agents cytotoxiques sont utilisés en association avec NOLVADEX (citrate de tamoxifène).
Le tamoxifène a réduit les concentrations plasmatiques de létrozole de 37 %. L'effet du tamoxifène sur le métabolisme et l'excrétion d'autres médicaments antinéoplasiques, tels que le cyclophosphamide et d'autres médicaments qui nécessitent des oxydases à fonction mixte pour l'activation, n'est pas connu. Il a été démontré que les concentrations plasmatiques de tamoxifène et de N-desméthyl tamoxifène sont réduites lorsqu'ils sont co-administrés avec de la rifampicine ou de l'aminoglutéthimide. L'induction du métabolisme médié par le CYP3A4 est considérée comme le mécanisme par lequel ces réductions se produisent ; d'autres agents inducteurs du CYP3A4 n'ont pas été étudiés pour confirmer cet effet.
Un patient recevant NOLVADEX (citrate de tamoxifène) avec du phénobarbital concomitant a présenté un taux sérique de tamoxifène à l'état d'équilibre inférieur à celui observé chez les autres patients (c'est-à-dire 26 ng/mL contre une valeur moyenne de 122 ng/mL). Cependant, la signification clinique de cette découverte n'est pas connue. La rifampicine a induit le métabolisme du tamoxifène et réduit significativement les concentrations plasmatiques de tamoxifène chez 10 patients. L'aminoglutéthimide réduit les concentrations plasmatiques de tamoxifène et de N-desméthyl tamoxifène. La médroxyprogestérone réduit les concentrations plasmatiques de N-desméthyl, mais pas de tamoxifène.
Il a été démontré qu'un traitement concomitant par la bromocriptine élève le taux sérique de tamoxifène et de N-desméthyl tamoxifène.
D'après les résultats cliniques et pharmacocinétiques de l'essai adjuvant sur l'anastrozole, NOLVADEX (citrate de tamoxifène) ne doit pas être administré avec l'anastrozole (voir PHARMACOLOGIE CLINIQUE - Interactions médicament-médicament section).
Interactions entre les médicaments et les tests de laboratoire
Au cours de la surveillance post-commercialisation, des élévations de T4 ont été rapportées chez quelques patientes ménopausées, ce qui peut s'expliquer par des augmentations de la globuline liant la thyroïde. Ces élévations n'étaient pas accompagnées d'hyperthyroïdie clinique.
Des variations de l'indice caryopycnotique sur les frottis vaginaux et divers degrés d'effet des œstrogènes sur les frottis vaginaux ont été rarement observés chez les patientes ménopausées recevant NOLVADEX (citrate de tamoxifène) .
Depuis la commercialisation de NOLVADEX (citrate de tamoxifène), de rares cas d'hyperlipidémie ont été signalés. Une surveillance périodique des triglycérides plasmatiques et du cholestérol peut être indiquée chez les patients présentant des hyperlipidémies préexistantes (voir RÉACTIONS INDÉSIRABLES - Expérience post-commercialisation section).
AVERTISSEMENTS
Effets chez les patientes atteintes d'un cancer du sein métastatique
Comme avec d'autres thérapies hormonales additives (œstrogènes et androgènes), une hypercalcémie a été signalée chez certaines patientes atteintes d'un cancer du sein présentant des métastases osseuses dans les semaines suivant le début du traitement par NOLVADEX (citrate de tamoxifène) . En cas d'hypercalcémie, des mesures appropriées doivent être prises et, si elle est grave, NOLVADEX (citrate de tamoxifène) doit être arrêté.
Effets sur le cancer de l'utérus et de l'endomètre et le sarcome utérin
Une incidence accrue de tumeurs malignes de l'utérus a été signalée en association avec le traitement par NOLVADEX (citrate de tamoxifène). Le mécanisme sous-jacent est inconnu, mais peut être lié à l'effet de type œstrogène de NOLVADEX (citrate de tamoxifène) . La plupart des tumeurs malignes utérines observées en association avec NOLVADEX (citrate de tamoxifène) sont classées comme adénocarcinome de l'endomètre. Cependant, de rares sarcomes utérins, y compris des tumeurs müllériennes mixtes malignes (MMMT), ont également été signalés. Le sarcome utérin est généralement associé à un stade FIGO plus élevé (III/IV) au moment du diagnostic, à un pronostic plus sombre et à une survie plus courte. Le sarcome utérin a été signalé comme étant plus fréquent chez les utilisatrices à long terme (≥ 2 ans) de NOLVADEX (citrate de tamoxifène) que chez les non-utilisatrices. Certaines des tumeurs malignes de l'utérus (carcinome de l'endomètre ou sarcome utérin) ont été mortelles.
Dans l'essai NSABP P-1, parmi les participants randomisés dans le groupe NOLVADEX (citrate de tamoxifène), il y a eu une augmentation statistiquement significative de l'incidence du cancer de l'endomètre (33 cas de cancer invasif de l'endomètre, contre 14 cas parmi les participants randomisés dans le groupe placebo (RR=2,48 , IC à 95 % : 1,27-4,92). Les 33 cas chez les participants recevant NOLVADEX (citrate de tamoxifène) étaient de stade I de la FIGO, dont 20 IA, 12 IB et 1 IC d'adénocarcinomes de l'endomètre. Chez les participants randomisés pour recevoir un placebo, 13 étaient des adénocarcinomes de stade I de la FIGO. (8 IA et 5 IB) et 1 était stade FIGO IV. Cinq femmes sous NOLVADEX (citrate de tamoxifène) et 1 sous placebo ont reçu une radiothérapie postopératoire en plus de la chirurgie. Cette augmentation a été principalement observée chez les femmes âgées d'au moins 50 ans à la moment de la randomisation (26 cas de cancer invasif de l'endomètre, contre 6 cas chez les participantes randomisées au placebo (RR = 4,50, IC à 95 % : 1,78-13,16). Parmi les femmes âgées de ≤ 49 ans au moment de la randomisation, il y avait 7 cas de moi cancer invasif de l'endomètre, contre 8 cas parmi les participantes randomisées au placebo (RR = 0,94, IC à 95 % : 0,28-2,89). Si l'âge au moment du diagnostic est pris en compte, il y a eu 4 cas de cancer de l'endomètre parmi les participants ≤ 49 randomisés pour NOLVADEX (citrate de tamoxifène) contre 2 parmi les participants randomisés pour le placebo (RR = 2,21, IC à 95 % : 0,4-12,0). Pour les femmes ≥ 50 ans au moment du diagnostic, il y avait 29 cas parmi les participantes randomisées pour NOLVADEX (citrate de tamoxifène) contre 12 parmi les femmes sous placebo (RR = 2,5, IC à 95 % : 1,3-4,9). Les risques relatifs étaient similaires dans les deux groupes, bien que moins d'événements se soient produits chez les femmes plus jeunes. La plupart des cancers de l'endomètre (29 sur 33 cas dans le groupe NOLVADEX (citrate de tamoxifène)) ont été diagnostiqués chez des femmes symptomatiques, bien que 5 des 33 cas dans le groupe NOLVADEX (citrate de tamoxifène) soient survenus chez des femmes asymptomatiques. Chez les femmes recevant NOLVADEX (citrate de tamoxifène), les événements sont apparus entre 1 et 61 mois (moyenne = 32 mois) après le début du traitement.
Dans une revue mise à jour des données à long terme (la durée médiane du suivi total est de 6,9 ans, y compris le suivi en aveugle) sur 8 306 femmes avec un utérus intact lors de la randomisation dans l'essai de réduction du risque NSABP P-1, l'incidence des deux les adénocarcinomes et les sarcomes utérins rares ont augmenté chez les femmes prenant NOLVADEX (citrate de tamoxifène) . Au cours du suivi en aveugle, il y a eu 36 cas d'adénocarcinome de l'endomètre de stade FIGO I (22 étaient de stade FIGO IA, 13 IB et 1 IC) chez des femmes recevant NOLVADEX (citrate de tamoxifène) et 15 cas chez des femmes recevant un placebo [14 étaient de stade FIGO I (9 IA et 5 IB), et 1 cas était stade FIGO IV]. Parmi les patientes recevant NOLVADEX (citrate de tamoxifène) qui ont développé un cancer de l'endomètre, une avec un cancer de stade IA et 4 avec un cancer de stade IB ont reçu une radiothérapie. Dans le groupe placebo, un patient atteint d'un cancer de stade FIGO 1B a reçu une radiothérapie et le patient atteint d'un cancer de stade FIGO IVB a reçu une chimiothérapie et une hormonothérapie. Au cours du suivi total, un adénocarcinome de l'endomètre a été signalé chez 53 femmes randomisées pour NOLVADEX (citrate de tamoxifène) (30 cas de stade IA FIGO, 20 de stade IB, 1 de stade IC et 2 de stade IIIC), et 17 femmes randomisées pour recevoir placebo (9 cas étaient au stade IA FIGO, 6 au stade IB, 1 au stade IIIC et 1 au stade IVB) (incidence pour 1 000 femmes-années de 2,20 et 0,71, respectivement). Certains patients ont reçu une radiothérapie postopératoire en plus de la chirurgie. Des sarcomes utérins ont été rapportés chez 4 femmes randomisées pour NOLVADEX (citrate de tamoxifène) (1 était FIGO IA, 1 était FIGO IB, 1 était FIGO IIA et 1 était FIGO IIIC) et une patiente randomisée dans le groupe placebo (FIGO 1A) ; incidence pour 1 000 femmes-années de 0,17 et 0,04, respectivement. Parmi les patients randomisés pour NOLVADEX (citrate de tamoxifène), les cas FIGO IA et IB étaient respectivement un MMMT et un sarcome ; le FIGO II était un MMMT ; et le FIGO III était un sarcome ; et le seul patient randomisé dans le groupe placebo avait un MMMT. Une augmentation similaire de l'incidence des adénocarcinomes de l'endomètre et des sarcomes utérins a été observée chez les femmes recevant NOLVADEX (citrate de tamoxifène) dans cinq autres essais cliniques du NSABP.
Toute patiente recevant ou ayant déjà reçu NOLVADEX (citrate de tamoxifène) qui signale des saignements vaginaux anormaux doit être rapidement évaluée. Les patientes recevant ou ayant déjà reçu NOLVADEX (citrate de tamoxifène) doivent subir des examens gynécologiques annuels et informer rapidement leur médecin si elles présentent des symptômes gynécologiques anormaux, par exemple des irrégularités menstruelles, des saignements vaginaux anormaux, des modifications des pertes vaginales ou des douleurs pelviennes ou pression.
Dans l'essai P-1, le prélèvement de l'endomètre n'a pas modifié le taux de détection du cancer de l'endomètre par rapport aux femmes n'ayant pas subi de prélèvement de l'endomètre (0,6 % avec prélèvement, 0,5 % sans prélèvement) pour les femmes ayant un utérus intact. Aucune donnée ne suggère qu'un prélèvement systématique de l'endomètre chez les femmes asymptomatiques prenant NOLVADEX (citrate de tamoxifène) pour réduire l'incidence du cancer du sein serait bénéfique.
Effets non malins sur l'utérus
Une incidence accrue de modifications de l'endomètre, notamment d'hyperplasie et de polypes, a été signalée en association avec le traitement par NOLVADEX (citrate de tamoxifène). L'incidence et le schéma de cette augmentation suggèrent que le mécanisme sous-jacent est lié aux propriétés œstrogéniques de NOLVADEX (citrate de tamoxifène) .
Quelques cas d'endométriose et de fibromes utérins ont été signalés chez des femmes recevant NOLVADEX (citrate de tamoxifène) . Le mécanisme sous-jacent peut être dû à l'effet œstrogénique partiel de NOLVADEX (citrate de tamoxifène). Des kystes ovariens ont également été observés chez un petit nombre de patientes préménopausées atteintes d'un cancer du sein avancé qui ont été traitées par NOLVADEX (citrate de tamoxifène) .
Il a été rapporté que NOLVADEX (citrate de tamoxifène) provoque des irrégularités menstruelles ou une aménorrhée.
Effets thromboemboliques de NOLVADEX (citrate de tamoxifène)
Il existe des preuves d'une incidence accrue d'événements thromboemboliques, y compris la thrombose veineuse profonde et l'embolie pulmonaire, pendant le traitement par NOLVADEX (citrate de tamoxifène). Lorsque NOLVADEX (citrate de tamoxifène) est administré en association avec une chimiothérapie, il peut y avoir une augmentation supplémentaire de l'incidence des effets thromboemboliques. Pour le traitement du cancer du sein, les risques et les avantages de NOLVADEX (citrate de tamoxifène) doivent être soigneusement évalués chez les femmes ayant des antécédents d'événements thromboemboliques. Dans une petite sous-étude (N = 81) de l'essai NSABP P-1, il semble qu'il n'y ait aucun avantage à dépister les mutations du facteur V Leiden et de la prothrombine G20210A chez les femmes comme moyen d'identifier celles qui pourraient ne pas être des candidates appropriées pour NOLVADEX (tamoxifène citrate).
Les données de l'essai NSABP P-1 montrent que les participants recevant NOLVADEX (citrate de tamoxifène) sans antécédents d'embolie pulmonaire (EP) ont présenté une augmentation statistiquement significative des embolies pulmonaires (18-NOLVADEX (citrate de tamoxifène), 6-placebo, RR = 3,01 , IC 95 % : 1,15-9,27). Trois des embolies pulmonaires, toutes dans le bras NOLVADEX (citrate de tamoxifène), ont été fatales. Quatre-vingt-sept pour cent des cas d'embolie pulmonaire sont survenus chez des femmes âgées d'au moins 50 ans au moment de la randomisation. Chez les femmes recevant NOLVADEX (citrate de tamoxifène), les événements sont apparus entre 2 et 60 mois (moyenne = 27 mois) après le début du traitement.
Dans cette même population, une augmentation non statistiquement significative des thromboses veineuses profondes (TVP) a été observée dans le groupe NOLVADEX (citrate de tamoxifène) (30-NOLVADEX (citrate de tamoxifène), 19-placebo ; RR = 1,59, IC à 95 % : 0,86 -2,98). La même augmentation du risque relatif a été observée chez les femmes de ≤ 49 ans et chez les femmes de ≥ 50 ans, bien que moins d'événements se soient produits chez les femmes plus jeunes. Les femmes présentant des événements thromboemboliques étaient à risque d'un deuxième événement connexe (7 femmes sur 25 sous placebo, 5 femmes sur 48 sous NOLVADEX (citrate de tamoxifène)) et étaient à risque de complications de l'événement et de son traitement (0/25 sous placebo, 4/48 sous NOLVADEX (citrate de tamoxifène)). Chez les femmes recevant NOLVADEX (citrate de tamoxifène), des événements de thrombose veineuse profonde sont survenus entre 2 et 57 mois (moyenne = 19 mois) après le début du traitement.
Il y a eu une augmentation non statistiquement significative des accidents vasculaires cérébraux chez les patients randomisés pour NOLVADEX (citrate de tamoxifène) (24-placebo ; 34-NOLVADEX (citrate de tamoxifène) ; RR = 1,42 ; IC à 95 % 0,82-2,51). Six des 24 AVC du groupe placebo ont été considérés comme d'origine hémorragique et 10 des 34 AVC du groupe NOLVADEX (citrate de tamoxifène) ont été classés comme hémorragiques. Dix-sept des 34 AVC dans le groupe NOLVADEX (citrate de tamoxifène) ont été considérés comme occlusifs et 7 ont été considérés comme étant d'étiologie inconnue. Quatorze des 24 AVC du groupe placebo ont été signalés comme étant occlusifs et 4 d'étiologie inconnue. Parmi ces AVC, 3 AVC dans le groupe placebo et 4 AVC dans le groupe NOLVADEX (citrate de tamoxifène) ont été mortels. Quatre-vingt-huit pour cent des AVC sont survenus chez des femmes âgées d'au moins 50 ans au moment de la randomisation. Chez les femmes recevant NOLVADEX (citrate de tamoxifène), les événements sont survenus entre 1 et 63 mois (moyenne = 30 mois) après le début du traitement.
Effets sur le foie : cancer du foie
Dans l'essai suédois utilisant l'adjuvant NOLVADEX (citrate de tamoxifène) 40 mg/jour pendant 2 à 5 ans, 3 cas de cancer du foie ont été rapportés dans le groupe traité par NOLVADEX (citrate de tamoxifène) contre 1 cas dans le groupe d'observation (voir PRÉCAUTIONS- Carcinogenèse ). Dans d'autres essais cliniques évaluant NOLVADEX (citrate de tamoxifène), aucun cas de cancer du foie n'a été signalé à ce jour.
Un cas de cancer du foie a été signalé dans le NSABP P-1 chez un participant randomisé pour NOLVADEX (citrate de tamoxifène) .
Effets sur le foie : Effets non malins
NOLVADEX (citrate de tamoxifène) a été associé à des modifications des taux d'enzymes hépatiques et, à de rares occasions, à un éventail d'anomalies hépatiques plus graves, notamment la stéatose hépatique, la cholestase, l'hépatite et la nécrose hépatique. Quelques-uns de ces cas graves ont entraîné des décès. Dans la plupart des cas signalés, la relation avec NOLVADEX (citrate de tamoxifène) est incertaine. Cependant, quelques remises en cause et remises en cause positives ont été signalées.
Dans l'essai NSABP P-1, peu de modifications de grade 3-4 de la fonction hépatique (SGOT, SGPT, bilirubine, phosphatase alcaline) ont été observées (10 sous placebo et 6 sous NOLVADEX (citrate de tamoxifène)). Les lipides sériques n'ont pas été systématiquement collectés.
Autres cancers
Un certain nombre de deuxièmes tumeurs primitives, survenant à des sites autres que l'endomètre, ont été signalées à la suite du traitement du cancer du sein par NOLVADEX (citrate de tamoxifène) dans des essais cliniques. Les données des études NSABP B-14 et P-1 ne montrent aucune augmentation des autres cancers (non utérins) chez les patientes recevant NOLVADEX (citrate de tamoxifène) . Le fait qu'un risque accru d'autres cancers (non utérins) soit associé à NOLVADEX (citrate de tamoxifène) est encore incertain et continue d'être évalué.
Effets sur les yeux
Des troubles oculaires, y compris des changements cornéens, une diminution de la perception de la vision des couleurs, une thrombose veineuse rétinienne et une rétinopathie ont été signalés chez des patients recevant NOLVADEX (citrate de tamoxifène) . Une incidence accrue de cataractes et la nécessité d'une chirurgie de la cataracte ont été signalées chez des patients recevant NOLVADEX (citrate de tamoxifène) .
Dans l'essai NSABP P-1, un risque accru de signification limite de développer des cataractes chez les femmes sans cataracte au départ (540-NOLVADEX (citrate de tamoxifène) ; 483-placebo ; RR = 1,13, IC à 95 % : 1,00-1,28) était observé. Chez ces mêmes femmes, NOLVADEX (citrate de tamoxifène) était associé à un risque accru de subir une chirurgie de la cataracte (101-NOLVADEX (citrate de tamoxifène) ; 63-placebo ; RR=1,62, IC à 95 % 1,18-2,22) (voir le tableau 3 de PHARMACOLOGIE CLINIQUE ). Parmi toutes les femmes participant à l'essai (avec ou sans cataracte au départ), NOLVADEX (citrate de tamoxifène) était associé à un risque accru de subir une chirurgie de la cataracte (201-NOLVADEX (citrate de tamoxifène) ; 129-placebo ; RR = 1,58, IC à 95 % 1.26-1.97). Aucun examen de la vue n'était requis pendant l'étude. Aucune autre conclusion concernant les événements ophtalmiques autres que la cataracte ne peut être tirée.
Catégorie de grossesse D
NOLVADEX (citrate de tamoxifène) peut nuire au fœtus lorsqu'il est administré à une femme enceinte. Les femmes doivent être avisées de ne pas devenir enceintes pendant qu'elles prennent NOLVADEX (citrate de tamoxifène) ou dans les 2 mois suivant l'arrêt de NOLVADEX (citrate de tamoxifène) et doivent utiliser des mesures contraceptives barrières ou non hormonales si elles sont sexuellement actives. Le tamoxifène ne provoque pas d'infertilité, même en présence d'irrégularités menstruelles. Des effets sur les fonctions de reproduction sont attendus des propriétés anti-œstrogéniques du médicament. Dans les études de reproduction chez le rat à des doses égales ou inférieures à la dose humaine, des modifications squelettiques non tératogènes du développement ont été observées et se sont avérées réversibles. De plus, dans les études de fertilité chez le rat et dans les études de tératologie chez le lapin utilisant des doses égales ou inférieures à celles utilisées chez l'homme, une incidence plus faible d'implantation d'embryons et une incidence plus élevée de mort fœtale ou de retard de croissance in utero ont été observées, avec un comportement d'apprentissage plus lent chez les certains ratons par rapport aux témoins historiques. Plusieurs ouistitis gravides ont reçu une dose de 10 mg/kg/jour (environ 2 fois la dose humaine quotidienne maximale recommandée sur une base en mg/m²) pendant l'organogenèse ou dans la dernière moitié de la grossesse. Aucune déformation n'a été observée et, bien que la dose ait été suffisamment élevée pour interrompre la grossesse chez certains animaux, ceux qui ont maintenu la grossesse n'ont montré aucun signe de malformations tératogènes.
Dans des modèles de développement de l'appareil reproducteur fœtal chez des rongeurs, le tamoxifène (à des doses comprises entre 0,002 et 2,4 fois la dose humaine quotidienne maximale recommandée sur une base en mg/m²) a provoqué chez les deux sexes des modifications similaires à celles provoquées par l'estradiol, l'éthynylestradiol et le diéthylstilbestrol. Bien que la pertinence clinique de ces changements soit inconnue, certains de ces changements, en particulier l'adénose vaginale, sont similaires à ceux observés chez les jeunes femmes qui ont été exposées au diéthylstilbestrol in utero et qui ont un risque de 1 sur 1000 de développer un adénocarcinome à cellules claires du vagin ou col de l'utérus. À ce jour, il n'a pas été démontré que l'exposition in utero au tamoxifène provoque une adénose vaginale ou un adénocarcinome à cellules claires du vagin ou du col de l'utérus chez les jeunes femmes. Cependant, seul un petit nombre de jeunes femmes ont été exposées au tamoxifène in utero, et un plus petit nombre a été suivie suffisamment longtemps (jusqu'à 15-20 ans) pour déterminer si une néoplasie vaginale ou cervicale pourrait survenir à la suite de cette exposition.
Il n'y a pas d'essais adéquats et bien contrôlés du tamoxifène chez les femmes enceintes. Il y a eu un petit nombre de rapports de saignements vaginaux, d'avortements spontanés, de malformations congénitales et de décès fœtaux chez les femmes enceintes. Si ce médicament est utilisé pendant la grossesse, ou si la patiente tombe enceinte pendant qu'elle prend ce médicament, ou dans les deux mois environ suivant l'arrêt du traitement, la patiente doit être informée des risques potentiels pour le fœtus, y compris le risque potentiel à long terme d'un DES- comme un syndrome.
Réduction de l'incidence du cancer du sein chez les femmes à haut risque - Catégorie de grossesse D
Pour les femmes sexuellement actives en âge de procréer, le traitement par NOLVADEX (citrate de tamoxifène) doit être initié pendant la menstruation. Chez les femmes présentant des irrégularités menstruelles, un B-HCG négatif immédiatement avant le début du traitement est suffisant (voir PRÉCAUTIONS-INFORMATION POUR LES PATIENTS - Réduction de l'incidence du cancer du sein chez les femmes à haut risque ).
PRÉCAUTIONS
Général
Des diminutions du nombre de plaquettes, généralement à 50 000-100 000/mm³, rarement inférieures, ont été occasionnellement rapportées chez des patientes prenant NOLVADEX (citrate de tamoxifène) pour un cancer du sein. Chez les patients présentant une thrombocytopénie importante, de rares épisodes hémorragiques sont survenus, mais il n'est pas certain que ces épisodes soient dus au traitement par NOLVADEX (citrate de tamoxifène). Une leucopénie a été observée, parfois associée à une anémie et/ou une thrombocytopénie. De rares cas de neutropénie et de pancytopénie ont été signalés chez des patientes recevant NOLVADEX (citrate de tamoxifène) ; cela peut parfois être grave.
Dans l'essai NSABP P-1, 6 femmes sous NOLVADEX (citrate de tamoxifène) et 2 sous placebo ont présenté des baisses de grade 3-4 du nombre de plaquettes (≤ 50 000/mm³).
Informations pour les patients
Les patients doivent être informés de la lecture des Guide des médicaments fourni comme l'exige la loi lorsque NOLVADEX 10 mg est délivré. Le texte complet de la Guide des médicaments est reproduit à la fin de ce document.
Réduction du cancer du sein invasif et du CCIS chez les femmes atteintes de CCIS
Les femmes atteintes de CCIS traitées par tumorectomie et radiothérapie qui envisagent NOLVADEX (citrate de tamoxifène) pour réduire l'incidence d'un deuxième événement de cancer du sein doivent évaluer les risques et les avantages du traitement, car le traitement par NOLVADEX (citrate de tamoxifène) a diminué l'incidence des cancers du sein invasifs. cancer, mais il n'a pas été démontré qu'il affecte la survie (voir le tableau 1 dans PHARMACOLOGIE CLINIQUE ).
Réduction de l'incidence du cancer du sein chez les femmes à haut risque
Les femmes qui présentent un risque élevé de cancer du sein peuvent envisager de prendre un traitement par NOLVADEX (citrate de tamoxifène) pour réduire l'incidence du cancer du sein. La question de savoir si les avantages du traitement sont considérés comme supérieurs aux risques dépend des antécédents médicaux personnels de la femme et de la façon dont elle évalue les avantages et les risques. Le traitement par NOLVADEX (citrate de tamoxifène) pour réduire l'incidence du cancer du sein peut donc ne pas convenir à toutes les femmes à haut risque de cancer du sein. Les femmes qui envisagent un traitement par NOLVADEX (citrate de tamoxifène) doivent consulter leur professionnel de la santé pour une évaluation des avantages et des risques potentiels avant de commencer un traitement visant à réduire l'incidence du cancer du sein (voir le tableau 3 de PHARMACOLOGIE CLINIQUE ). Les femmes doivent comprendre que NOLVADEX (citrate de tamoxifène) réduit l'incidence du cancer du sein, mais peut ne pas éliminer le risque. NOLVADEX (citrate de tamoxifène) a diminué l'incidence des petites tumeurs positives aux récepteurs des œstrogènes, mais n'a pas modifié l'incidence des tumeurs négatives aux récepteurs des œstrogènes ou des tumeurs plus grosses. Chez les femmes atteintes d'un cancer du sein qui présentent un risque élevé de développer un deuxième cancer du sein, un traitement avec environ 5 ans de NOLVADEX (citrate de tamoxifène) a réduit le taux d'incidence annuel d'un deuxième cancer du sein d'environ 50 %.
Les femmes enceintes ou qui envisagent de devenir enceintes ne doivent pas prendre NOLVADEX (citrate de tamoxifène) pour réduire leur risque de cancer du sein. Une contraception non hormonale efficace doit être utilisée par toutes les femmes préménopausées prenant NOLVADEX (citrate de tamoxifène) et pendant environ deux mois après l'arrêt du traitement si elles sont sexuellement actives. Le tamoxifène ne provoque pas d'infertilité, même en présence d'irrégularités menstruelles. Pour les femmes sexuellement actives en âge de procréer, le traitement par NOLVADEX (citrate de tamoxifène) doit être initié pendant la menstruation. Chez les femmes présentant des irrégularités menstruelles, un B-HCG négatif immédiatement avant le début du traitement est suffisant (voir AVERTISSEMENTS-Catégorie de grossesse D ).
Deux essais européens sur le tamoxifène pour réduire le risque de cancer du sein ont été menés et n'ont montré aucune différence dans le nombre de cas de cancer du sein entre les bras tamoxifène et placebo. Ces études avaient des conceptions d'essais différentes de celles du NSABP P-1, étaient plus petites que celles du NSABP P-1 et recrutaient des femmes présentant un risque de cancer du sein plus faible que celles du P-1.
Surveillance pendant le traitement par NOLVADEX (citrate de tamoxifène)
Les femmes qui prennent ou ont déjà pris NOLVADEX (citrate de tamoxifène) doivent être avisées de consulter rapidement un médecin en cas de nodules mammaires, de saignements vaginaux, de symptômes gynécologiques (irrégularités menstruelles, changements dans les pertes vaginales ou douleur ou pression pelvienne), de symptômes de gonflement des jambes ou sensibilité, essoufflement inexpliqué ou changements dans la vision. Les femmes doivent informer tous les prestataires de soins, quelle que soit la raison de l'évaluation, qu'elles prennent NOLVADEX (citrate de tamoxifène) .
Les femmes prenant NOLVADEX (citrate de tamoxifène) pour réduire l'incidence du cancer du sein doivent subir un examen des seins, une mammographie et un examen gynécologique avant le début du traitement. Ces études doivent être répétées à intervalles réguliers pendant le traitement, conformément aux bonnes pratiques médicales. Les femmes prenant NOLVADEX (citrate de tamoxifène) comme traitement adjuvant du cancer du sein doivent suivre les mêmes procédures de surveillance que pour les femmes prenant NOLVADEX (citrate de tamoxifène) pour la réduction de l'incidence du cancer du sein. Les femmes prenant NOLVADEX (citrate de tamoxifène) comme traitement du cancer du sein métastatique doivent revoir ce plan de surveillance avec leur fournisseur de soins et sélectionner les modalités et le calendrier d'évaluation appropriés.
Tests de laboratoire
Des numérations globulaires complètes périodiques, y compris des numérations plaquettaires, et des tests périodiques de la fonction hépatique doivent être obtenus.
Au cours de l'essai ATAC, un plus grand nombre de patients recevant de l'anastrozole ont présenté un taux de cholestérol sérique élevé par rapport aux patients recevant NOLVADEX (citrate de tamoxifène) (9 % contre 3,5 %, respectivement).
Carcinogenèse
Une étude de carcinogenèse conventionnelle chez le rat à des doses de 5, 20 et 35 mg/kg/jour (environ une, trois et sept fois la dose humaine quotidienne maximale recommandée sur une base en mg/m²) administrée par gavage oral pendant jusqu'à 2 ans ) a révélé une augmentation significative du carcinome hépatocellulaire à toutes les doses. L'incidence de ces tumeurs était significativement plus élevée chez les rats ayant reçu 20 ou 35 mg/kg/jour (69 %) par rapport à ceux ayant reçu 5 mg/kg/jour (14 %). Dans une étude distincte, des rats ont reçu du tamoxifène à raison de 45 mg/kg/jour (environ neuf fois la dose humaine quotidienne maximale recommandée sur une base en mg/m²) ; néoplasie hépatocellulaire a été exposée à 3 à 6 mois.
Des tumeurs ovariennes à cellules de la granulosa et des tumeurs testiculaires à cellules interstitielles ont été observées dans deux études distinctes chez la souris. Les souris ont reçu les formes trans et racémiques de tamoxifène pendant 13 à 15 mois à des doses de 5, 20 et 50 mg/kg/jour (environ la moitié, le double et le quintuple de la dose humaine quotidienne recommandée sur un mg/m² base).
Mutagenèse
Aucun potentiel génotoxique n'a été trouvé dans une batterie conventionnelle de tests in vivo et in vitro avec des systèmes de test pro- et eucaryotes avec des systèmes de métabolisation des médicaments. Cependant, des niveaux accrus d'adduits à l'ADN ont été observés par post-marquage au 32P dans l'ADN de foie de rat et de lymphocytes humains en culture. Le tamoxifène s'est également avéré augmenter les niveaux de formation de micronoyaux in vitro dans la lignée cellulaire lymphoblastoïde humaine (MCL-5). Sur la base de ces résultats, le tamoxifène est génotoxique dans les cellules MCL-5 de rongeurs et humaines.
Altération de la fertilité
Le tamoxifène a produit une altération de la fertilité et de la conception chez les rats femelles à des doses de 0,04 mg/kg/jour (environ 0,01 fois la dose quotidienne maximale recommandée chez l'homme sur une base en mg/m²) lorsqu'il a été administré pendant deux semaines avant l'accouplement jusqu'au jour 7 de la grossesse . À cette dose, les indices de fertilité et de reproduction ont été nettement réduits avec la mortalité fœtale totale. La mortalité fœtale a également augmenté à des doses de 0,16 mg/kg/jour (environ 0,03 fois la dose quotidienne maximale recommandée chez l'homme sur une base en mg/m²) lorsque des rats femelles ont reçu une dose du 7e au 17e jour de grossesse. Le tamoxifène a provoqué des avortements, des accouchements prématurés et la mort fœtale chez des lapins ayant reçu des doses égales ou supérieures à 0,125 mg/kg/jour (environ 0,05 fois la dose quotidienne maximale recommandée chez l'homme sur une base en mg/m²). Il n'y a eu aucun changement tératogène chez les rats ou les lapins.
Catégorie de grossesse D
Voir AVERTISSEMENTS .
Mères allaitantes
Il a été rapporté que le tamoxifène inhibe la lactation. Deux études contrôlées par placebo portant sur plus de 150 femmes ont montré que le tamoxifène inhibe de manière significative la production de lait post-partum précoce. Dans les deux études, le tamoxifène a été administré dans les 24 heures suivant l'accouchement pendant 5 à 18 jours. L'effet du tamoxifène sur la production laitière établie n'est pas connu.
Il n'y a pas de données indiquant si le tamoxifène est excrété dans le lait maternel. S'il est excrété, il n'existe aucune donnée concernant les effets du tamoxifène dans le lait maternel sur le nourrisson allaité ou les animaux allaités. Cependant, l'exposition néonatale directe au tamoxifène chez les souris et les rats (non via le lait maternel) a produit 1) des lésions de l'appareil reproducteur chez les rongeurs femelles (similaires à celles observées chez l'homme après une exposition intra-utérine au diéthylstilbestrol) et 2) des anomalies fonctionnelles de l'appareil reproducteur chez les mâles. rongeurs tels que l'atrophie testiculaire et l'arrêt de la spermatogenèse.
On ne sait pas si NOLVADEX (citrate de tamoxifène) est excrété dans le lait maternel. En raison du risque d'effets indésirables graves chez les nourrissons de NOLVADEX (citrate de tamoxifène), les femmes prenant NOLVADEX (citrate de tamoxifène) ne doivent pas allaiter.
Réduction de l'incidence du cancer du sein chez les femmes à haut risque atteintes de CCIS
On ne sait pas si NOLVADEX (citrate de tamoxifène) est excrété dans le lait maternel. En raison du risque d'effets indésirables graves chez les nourrissons de NOLVADEX (citrate de tamoxifène), les femmes prenant NOLVADEX (citrate de tamoxifène) ne doivent pas allaiter.
Utilisation pédiatrique
L'innocuité et l'efficacité de NOLVADEX (citrate de tamoxifène) chez les filles âgées de deux à 10 ans atteintes du syndrome de McCune-Albright et de puberté précoce n'ont pas été étudiées au-delà d'un an de traitement. Les effets à long terme du traitement par NOLVADEX (citrate de tamoxifène) chez les filles n'ont pas été établis. Chez les adultes traités par NOLVADEX (citrate de tamoxifène), une augmentation de l'incidence des tumeurs malignes de l'utérus, des accidents vasculaires cérébraux et des embolies pulmonaires a été observée (voir AVERTISSEMENT ENCADRÉ , et PHARMACOLOGIE CLINIQUE-Études cliniques-Syndrome de McCune-Albright sous-section).
Utilisation gériatrique
Dans l'essai NSABP P-1, le pourcentage de femmes âgées d'au moins 65 ans était de 16 %. Les femmes âgées d'au moins 70 ans représentaient 6 % des participants. Une réduction de l'incidence du cancer du sein a été observée chez les participantes de chacun des sous-groupes : un total de 28 et 10 cancers du sein invasifs ont été observés chez les participantes de 65 ans et plus dans les groupes placebo et NOLVADEX (citrate de tamoxifène), respectivement. Dans tous les autres critères de jugement, les résultats de ce sous-ensemble reflètent les résultats observés dans le sous-ensemble de femmes âgées d'au moins 50 ans. Aucune différence globale de tolérance n'a été observée entre les patients plus âgés et plus jeunes (voir PHARMACOLOGIE CLINIQUE - Études cliniques - Réduction de l'incidence du cancer du sein chez les femmes à haut risque section).
Dans l'essai NSABP B-24, le pourcentage de femmes âgées d'au moins 65 ans était de 23 %. Les femmes âgées d'au moins 70 ans représentaient 10 % des participants. Un total de 14 et 12 cancers du sein invasifs ont été observés chez les participants de 65 ans et plus dans les groupes placebo et NOLVADEX (citrate de tamoxifène), respectivement. Ce sous-ensemble est trop petit pour tirer des conclusions sur l'efficacité. Pour tous les autres critères d'évaluation, les résultats de ce sous-ensemble étaient comparables à ceux des femmes plus jeunes inscrites à cet essai. Aucune différence globale de tolérance n'a été observée entre les patients plus âgés et plus jeunes.
SURDOSAGE
Les signes observés aux doses les plus élevées à la suite d'études visant à déterminer la DL50 chez l'animal étaient des difficultés respiratoires et des convulsions.
Aucun surdosage aigu chez l'homme n'a été rapporté. Dans une étude portant sur des patients atteints d'un cancer métastatique avancé qui a spécifiquement déterminé la dose maximale tolérée de NOLVADEX (citrate de tamoxifène) en évaluant l'utilisation de doses très élevées pour inverser la multirésistance, une neurotoxicité aiguë se manifestant par des tremblements, une hyperréflexie, une démarche instable et des étourdissements a été notée. Ces symptômes sont apparus dans les 3 à 5 jours suivant le début de NOLVADEX (citrate de tamoxifène) et ont disparu dans les 2 à 5 jours suivant l'arrêt du traitement. Aucune toxicité neurologique permanente n'a été notée. Un patient a eu une crise plusieurs jours après l'arrêt de NOLVADEX (citrate de tamoxifène) et la disparition des symptômes neurotoxiques. La relation causale entre la crise et le traitement par NOLVADEX (citrate de tamoxifène) est inconnue. Les doses administrées à ces patients étaient toutes supérieures à la dose de charge de 400 mg/m², suivies de doses d'entretien de 150 mg/m² de NOLVADEX (citrate de tamoxifène) administrées deux fois par jour.
Dans la même étude, un allongement de l'intervalle QT sur l'électrocardiogramme a été noté lorsque les patients recevaient des doses supérieures à 250 mg/m² de dose de charge, suivies de doses d'entretien de 80 mg/m² de NOLVADEX (citrate de tamoxifène) administrées deux fois par jour. Pour une femme ayant une surface corporelle de 1,5 m², la dose de charge minimale et les doses d'entretien administrées au cours desquelles des symptômes neurologiques et des modifications de l'intervalle QT sont apparus étaient au moins 6 fois plus élevées par rapport à la dose maximale recommandée.
Aucun traitement spécifique du surdosage n'est connu ; le traitement doit être symptomatique.
CONTRE-INDICATIONS
NOLVADEX (citrate de tamoxifène) est contre-indiqué chez les patients présentant une hypersensibilité connue au médicament ou à l'un de ses ingrédients.
Réduction de l'incidence du cancer du sein chez les femmes à haut risque et les femmes atteintes de CCIS
NOLVADEX (citrate de tamoxifène) est contre-indiqué chez les femmes qui nécessitent un traitement anticoagulant coumarinique concomitant ou chez les femmes ayant des antécédents de thrombose veineuse profonde ou d'embolie pulmonaire.
PHARMACOLOGIE CLINIQUE
NOLVADEX (citrate de tamoxifène) est un agent non stéroïdien qui a démontré de puissantes propriétés anti-œstrogéniques dans des systèmes d'expérimentation animale. Les effets anti-œstrogéniques peuvent être liés à sa capacité à entrer en compétition avec les œstrogènes pour les sites de liaison dans les tissus cibles tels que le sein. Le tamoxifène inhibe l'induction du carcinome mammaire du rat induit par le diméthylbenzanthracène (DMBA) et provoque la régression des tumeurs induites par le DMBA déjà établies. Dans ce modèle de rat, le tamoxifène semble exercer ses effets antitumoraux en se liant aux récepteurs des œstrogènes.
Dans les cytosols dérivés d'adénocarcinomes mammaires humains, le tamoxifène entre en compétition avec l'estradiol pour la protéine réceptrice des œstrogènes.
Absorption et distribution
Après une dose orale unique de 20 mg de tamoxifène, une concentration plasmatique maximale moyenne de 40 ng/mL (plage de 35 à 45 ng/mL) s'est produite environ 5 heures après l'administration. La diminution des concentrations plasmatiques du tamoxifène est biphasique avec une demi-vie d'élimination terminale d'environ 5 à 7 jours. La concentration plasmatique maximale moyenne de N-desméthyl tamoxifène est de 15 ng/mL (intervalle de 10 à 20 ng/mL). L'administration chronique de 10 mg de tamoxifène administré deux fois par jour pendant 3 mois à des patients entraîne des concentrations plasmatiques moyennes à l'état d'équilibre de 120 ng/mL (intervalle de 67 à 183 ng/mL) pour le tamoxifène et de 336 ng/mL (intervalle de 148 à 654 ng/ mL) pour le N-desméthyl tamoxifène. Les concentrations plasmatiques moyennes à l'état d'équilibre du tamoxifène et du N-desméthyl tamoxifène après administration de 20 mg de tamoxifène une fois par jour pendant 3 mois sont de 122 ng/mL (intervalle 71-183 ng/mL) et de 353 ng/mL (intervalle 152-706 ng /mL), respectivement. Après le début du traitement, les concentrations à l'état d'équilibre du tamoxifène sont atteintes en environ 4 semaines et les concentrations à l'état d'équilibre du N-desméthyl tamoxifène sont atteintes en environ 8 semaines, suggérant une demi-vie d'environ 14 jours pour ce métabolite. Dans une étude croisée à l'état d'équilibre portant sur des comprimés de 10 mg de NOLVADEX (citrate de tamoxifène) administrés deux fois par jour par rapport à un comprimé de 20 mg de NOLVADEX (citrate de tamoxifène) administré une fois par jour, le comprimé de 20 mg de NOLVADEX (citrate de tamoxifène) était bioéquivalent au 10 comprimés NOLVADEX (citrate de tamoxifène).
Métabolisme
Le tamoxifène est largement métabolisé après administration orale. Le N-desméthyl tamoxifène est le principal métabolite trouvé dans le plasma des patients. L'activité biologique du N-desméthyl tamoxifène semble être similaire à celle du tamoxifène. Le 4-hydroxytamoxifène et un dérivé d'alcool primaire à chaîne latérale du tamoxifène ont été identifiés comme des métabolites mineurs dans le plasma. Le tamoxifène est un substrat du cytochrome P-450 3A, 2C9 et 2D6 et un inhibiteur de la glycoprotéine P.
Excrétion
Des études menées chez des femmes recevant 20 mg de tamoxifène marqué au 14C ont montré qu'environ 65 % de la dose administrée était excrétée par l'organisme sur une période de 2 semaines, l'excrétion fécale étant la principale voie d'élimination. Le médicament est excrété principalement sous forme de conjugués polaires, le médicament inchangé et les métabolites non conjugués représentant moins de 30 % de la radioactivité fécale totale.
Populations particulières
Les effets de l'âge, du sexe et de la race sur la pharmacocinétique du tamoxifène n'ont pas été déterminés. Les effets d'une fonction hépatique réduite sur le métabolisme et la pharmacocinétique du tamoxifène n'ont pas été déterminés.
Patients pédiatriques
La pharmacocinétique du tamoxifène et du N-desméthyl tamoxifène a été caractérisée à l'aide d'une analyse pharmacocinétique de population avec des échantillons clairsemés par patient obtenus à partir de 27 patientes pédiatriques âgées de 2 à 10 ans inscrites à une étude conçue pour évaluer l'innocuité, l'efficacité et la pharmacocinétique de NOLVADEX (tamoxifène citrate) dans le traitement du syndrome de McCune-Albright. Des données riches provenant de deux essais pharmacocinétiques sur le citrate de tamoxifène dans lesquels 59 femmes ménopausées atteintes d'un cancer du sein ont terminé les études ont été incluses dans l'analyse pour déterminer le modèle pharmacocinétique structurel du tamoxifène. Un modèle à un compartiment a fourni le meilleur ajustement aux données.
Chez les patients pédiatriques, une concentration plasmatique maximale à l'état d'équilibre (Css, max) et une ASC moyennes étaient de 187 ng/mL et 4110 ng h/mL, respectivement, et la Css, max s'est produite environ 8 heures après l'administration. La clairance (CL/F) après ajustement du poids corporel chez les patientes pédiatriques était environ 2,3 fois plus élevée que chez les patientes atteintes d'un cancer du sein. Dans la plus jeune cohorte de patientes pédiatriques (2 à 6 ans), le CL/F était 2,6 fois plus élevé ; dans la cohorte la plus âgée (7-10,9 ans), le CL/F était environ 1,9 fois plus élevé. L'exposition au N-desméthyl tamoxifène était comparable entre les patients pédiatriques et adultes. L'innocuité et l'efficacité de NOLVADEX (citrate de tamoxifène) chez les filles âgées de deux à 10 ans atteintes du syndrome de McCune-Albright et de puberté précoce n'ont pas été étudiées au-delà d'un an de traitement. Les effets à long terme du traitement par NOLVADEX (citrate de tamoxifène) chez les filles n'ont pas été établis. Chez les adultes traités par NOLVADEX (citrate de tamoxifène), une augmentation de l'incidence des tumeurs malignes de l'utérus, des accidents vasculaires cérébraux et des embolies pulmonaires a été observée (voir AVERTISSEMENT ENCADRÉ ).
Interactions médicament-médicament
Des études in vitro ont montré que l'érythromycine, la cyclosporine, la nifédipine et le diltiazem inhibaient de manière compétitive la formation de N-desméthyl tamoxifène avec un K1 apparent de 20, 1, 45 et 30 µM, respectivement. La signification clinique de ces études in vitro est inconnue.
Le tamoxifène a réduit la concentration plasmatique de létrozole de 37 % lorsque ces médicaments ont été co-administrés. La rifampicine, un inducteur du cytochrome P-450 3A4, a réduit l'ASC et la Cmax du tamoxifène de 86 % et 55 %, respectivement. L'aminoglutéthimide réduit les concentrations plasmatiques de tamoxifène et de N-desméthyl tamoxifène. La médroxyprogestérone réduit les concentrations plasmatiques de N-desméthyl, mais pas de tamoxifène.
Dans l'essai adjuvant sur l'anastrozole, la co-administration d'anastrozole et de NOLVADEX (citrate de tamoxifène) chez des patientes atteintes d'un cancer du sein a réduit la concentration plasmatique d'anastrozole de 27 % par rapport à celle obtenue avec l'anastrozole seul ; cependant, la co-administration n'a pas affecté la pharmacocinétique du tamoxifène ou du N-desméthyltamoxifène (voir PRÉCAUTIONS - INTERACTIONS MÉDICAMENTEUSES ). NOLVADEX (citrate de tamoxifène) ne doit pas être co-administré avec l'anastrozole.
Etudes cliniques
Cancer du sein métastatique
Femmes préménopausées (NOLVADEX (citrate de tamoxifène) vs Ablation)
Trois études prospectives randomisées (Ingle, Pritchard, Buchanan) ont comparé NOLVADEX (citrate de tamoxifène) à l'ablation ovarienne (ovariectomie ou irradiation ovarienne) chez des femmes préménopausées atteintes d'un cancer du sein avancé. Bien que le taux de réponse objective, le délai avant l'échec du traitement et la survie aient été similaires avec les deux traitements, le nombre limité de patients a empêché la démonstration de l'équivalence. Dans une analyse globale des données de survie des 3 études, le risque relatif de décès (NOLVADEX (citrate de tamoxifène)/ablation ovarienne) était de 1,00 avec des intervalles de confiance bilatéraux à 95 % de 0,73 à 1,37. Des taux élevés d'œstrogènes sériques et plasmatiques ont été observés chez des femmes préménopausées recevant NOLVADEX (citrate de tamoxifène), mais les données des études randomisées ne suggèrent pas d'effet indésirable de cette augmentation. Un nombre limité de patientes préménopausées présentant une progression de la maladie pendant le traitement par NOLVADEX (citrate de tamoxifène) ont répondu à l'ablation ovarienne ultérieure.
Cancer du sein masculin
Les résultats publiés de 122 patients (119 évaluables) et les rapports de cas de 16 patients (13 évaluables) traités par NOLVADEX (citrate de tamoxifène) ont montré que NOLVADEX (citrate de tamoxifène) est efficace pour le traitement palliatif du cancer du sein chez l'homme. Soixante-six de ces 132 patients évaluables ont répondu à NOLVADEX (citrate de tamoxifène), ce qui constitue un taux de réponse objective de 50 %.
Cancer du sein adjuvant
Aperçu
L'Early Breast Cancer Trialists' Collaborative Group (EBCTCG) a réalisé des aperçus mondiaux du traitement adjuvant systémique pour le cancer du sein précoce en 1985, 1990 et de nouveau en 1995. En 1998, des données sur les résultats à 10 ans ont été rapportées pour 36 689 femmes dans 55 essais randomisés NOLVADEX adjuvant (citrate de tamoxifène) à des doses de 20 à 40 mg/jour pendant 1 à 5 ans et plus. Vingt-cinq pour cent des patients ont reçu 1 an ou moins de traitement d'essai, 52 % ont reçu 2 ans et 23 % ont reçu environ 5 ans. Quarante-huit pour cent des tumeurs étaient positives pour les récepteurs des œstrogènes (ER) (> 10 fmol/mg), 21 % étaient pauvres en ER (
Parmi les femmes avec un cancer du sein ER positif ou inconnu et des ganglions positifs qui ont reçu environ 5 ans de traitement, la survie globale à 10 ans était de 61,4 % pour NOLVADEX (citrate de tamoxifène) contre 50,5 % pour le contrôle (logrank 2p
L'effet de la durée programmée du tamoxifène peut être décrit comme suit. Chez les femmes atteintes d'un cancer du sein ER positif ou inconnu recevant 1 an ou moins, 2 ans ou environ 5 ans de NOLVADEX (citrate de tamoxifène), les réductions proportionnelles de la mortalité étaient de 12 %, 17 % et 26 %, respectivement (tendance significative à 2p
Le bénéfice est moins clair pour les femmes atteintes d'un cancer du sein à faible ER chez qui la réduction proportionnelle de la récidive était de 10 % (2p = 0,007) pour toutes les durées confondues, ou de 9 % (2p = 0,02) si les cancers du sein controlatéral sont exclus. La réduction correspondante de la mortalité était de 6 % (NS). Les effets d'environ 5 ans de NOLVADEX (citrate de tamoxifène) sur la récidive et la mortalité étaient similaires quel que soit l'âge et la chimiothérapie concomitante. Rien n'indiquait que des doses supérieures à 20 mg par jour étaient plus efficaces.
Anastrozole Adjuvant ATAC Trial - Étude de l'anastrozole par rapport à NOLVADEX (citrate de tamoxifène) pour le traitement adjuvant du cancer du sein précoce - Un essai adjuvant sur l'anastrozole a été mené chez 9366 femmes ménopausées atteintes d'un cancer du sein opérable qui ont été randomisées pour recevoir un traitement adjuvant avec soit de l'anastrozole 1 mg par jour, NOLVADEX (citrate de tamoxifène) 20 mg par jour, soit une combinaison de ces deux traitements pendant cinq ans ou jusqu'à la récidive de la maladie. Lors d'un suivi médian de 33 mois, l'association d'anastrozole et de NOLVADEX (citrate de tamoxifène) n'a pas démontré de bénéfice d'efficacité par rapport au traitement par NOLVADEX (citrate de tamoxifène) seul chez tous les patients ainsi que dans la sous-population positive aux récepteurs hormonaux. Ce bras de traitement a été retiré de l'essai. Prière de se référer à PHARMACOLOGIE CLINIQUE-Populations particulières-Interactions médicament-médicament , PRÉCAUTIONS-Tests de laboratoire , PRÉCAUTIONS-Interactions médicamenteuses et EFFETS INDÉSIRABLES sections pour les informations de sécurité de cet essai. Veuillez consulter les renseignements thérapeutiques complets sur les comprimés ARIMIDEX® (anastrozole) à 1 mg pour obtenir des renseignements supplémentaires sur cet essai.
Les patients des deux bras de monothérapie de l'essai ATAC ont été traités pendant une durée médiane de 60 mois (5 ans) et suivis pendant une durée médiane de 68 mois. La survie sans maladie dans la population en intention de traiter a été statistiquement significativement améliorée [Hazard Ratio (HR) = 0,87, IC à 95 % : 0,78, 0,97, p = 0,0127] dans le bras anastrazole par rapport au bras NOLVADEX (citrate de tamoxifène) .
Noeud Positif - Études Individuelles
Deux études (Hubay et NSABP B-09) ont démontré une amélioration de la survie sans maladie après une mastectomie radicale ou radicale modifiée chez les femmes ménopausées ou les femmes de 50 ans ou plus atteintes d'un cancer du sein curable chirurgicalement avec des ganglions axillaires positifs lorsque NOLVADEX (citrate de tamoxifène) était ajoutée à la chimiothérapie cytotoxique adjuvante. Dans l'étude Hubay, NOLVADEX (citrate de tamoxifène) a été ajouté au CMF "à faible dose" (cyclophosphamide, méthotrexate et fluorouracile). Dans l'étude NSABP B-09, NOLVADEX (citrate de tamoxifène) a été ajouté au melphalan [moutarde à la L-phénylalanine (P)] et au fluorouracile (F).
Dans l'étude Hubay, les patients avec un récepteur d'oestrogène positif (plus de 3 fmol) étaient plus susceptibles d'en bénéficier. Dans l'étude NSABP B-09 chez les femmes âgées de 50 à 59 ans, seules les femmes ayant à la fois des niveaux de récepteurs d'œstrogènes et de progestérone de 10 fmol ou plus en ont clairement bénéficié, alors qu'il y avait une tendance non statistiquement significative vers des effets indésirables chez les femmes ayant à la fois des niveaux de récepteurs d'œstrogènes et de progestérone moins de 10 fmol. Chez les femmes âgées de 60 à 70 ans, il y avait une tendance vers un effet bénéfique de NOLVADEX (citrate de tamoxifène) sans aucune relation claire avec le statut des récepteurs aux œstrogènes ou à la progestérone.
Trois études prospectives (ECOG-1178, Toronto, OTAN) utilisant NOLVADEX (citrate de tamoxifène) en tant qu'agent unique ont démontré une amélioration de la survie sans maladie après une mastectomie totale et une dissection axillaire pour les femmes ménopausées avec des ganglions axillaires positifs par rapport au placebo/aucun contrôle de traitement . L'étude de l'OTAN a également démontré un avantage global pour la survie.
Noeud Négatif - Études Individuelles
NSABP B-14, une étude prospective, à double insu et randomisée, a comparé NOLVADEX (citrate de tamoxifène) à un placebo chez des femmes atteintes d'un cancer du sein sans ganglions axillaires, avec récepteurs aux œstrogènes positifs (≥ 10 fmol/mg de protéine du cytosol) (en tant que traitement adjuvant , après mastectomie totale et curage axillaire, ou résection segmentaire
INFORMATIONS PATIENTS
GUIDE DES MÉDICAMENTS
NOLVADEX (citrate de tamoxifène) ® (NOLE-vah-dex) Comprimés Nom générique : tamoxifène (ta-MOX-I-fen)
Écrit pour les femmes qui utilisent NOLVADEX (citrate de tamoxifène) pour réduire leur risque élevé de cancer du sein ou qui ont un carcinome canalaire in situ (CCIS)
Ce guide des médicaments ne traite que de l'utilisation de NOLVADEX (citrate de tamoxifène) pour réduire le risque de cancer du sein chez les femmes à haut risque et chez les femmes traitées pour un CCIS.
Personnes prenant NOLVADEX (citrate de tamoxifène) traiter cancer du sein ont des avantages différents et des décisions différentes à prendre que les femmes à haut risque ou les femmes atteintes d'un carcinome canalaire in situ (CCIS) prenant NOLVADEX (citrate de tamoxifène) pour réduire le risque de cancer du sein. Si vous avez déjà un cancer du sein, discutez avec votre médecin de la façon dont les avantages du traitement du cancer du sein avec NOLVADEX (citrate de tamoxifène) se comparent aux risques décrits dans ce document.
Pourquoi devrais-je lire ce Guide des médicaments ?
Ce guide contient des informations pour vous aider à décider d'utiliser NOLVADEX (citrate de tamoxifène) pour réduire votre risque de cancer du sein.
Vous et votre médecin devriez discuter pour savoir si le bénéfice possible de NOLVADEX (citrate de tamoxifène) pour réduire votre risque élevé de cancer du sein est supérieur à ses risques possibles. Votre médecin dispose d'un programme informatique spécial ou d'une calculatrice portable pour savoir si vous faites partie du groupe à haut risque. Si vous avez un CCIS et avez été traité par chirurgie et radiothérapie, votre médecin peut vous prescrire NOLVADEX (citrate de tamoxifène) pour diminuer votre risque de développer un cancer du sein invasif (en propagation).
Lisez attentivement ce guide avant de commencer NOLVADEX (citrate de tamoxifène) . Il est important de lire les informations que vous obtenez chaque fois que vous recevez plus de médicaments. Il y a peut-être quelque chose de nouveau. Ce guide ne vous dit pas tout sur NOLVADEX (citrate de tamoxifène) et ne ne pas au lieu de parler avec votre médecin.
Seuls vous et votre médecin pouvez déterminer si NOLVADEX (citrate de tamoxifène) vous convient.
Quelle est l'information la plus importante que je devrais connaître sur l'utilisation de NOLVADEX (citrate de tamoxifène) pour réduire le risque de cancer du sein ?
NOLVADEX (citrate de tamoxifène) est un médicament sur ordonnance qui ressemble à l'œstrogène (hormone féminine) à certains égards et différent à d'autres. Dans le sein, NOLVADEX (citrate de tamoxifène) peut bloquer les effets des œstrogènes. Parce qu'il fait cela, NOLVADEX (citrate de tamoxifène) peut bloquer la croissance des cancers du sein qui ont besoin d'œstrogènes pour se développer (cancers positifs aux récepteurs d'œstrogène ou de progestérone).
NOLVADEX (citrate de tamoxifène) peut réduire le risque de cancer du sein chez les femmes présentant un risque supérieur à la normale de développer un cancer du sein au cours des cinq prochaines années (femmes à haut risque) et chez les femmes atteintes de CCIS.
Étant donné que les femmes à haut risque n'ont pas encore de cancer, il est important de bien réfléchir pour savoir si le bénéfice possible de NOLVADEX (citrate de tamoxifène) pour réduire le risque de cancer du sein est supérieur à ses risques possibles.
Ce guide des médicaments passe en revue les risques et les avantages de l'utilisation de NOLVADEX (citrate de tamoxifène) pour réduire le risque de cancer du sein chez les femmes à haut risque et les femmes atteintes de CCIS. Ce guide fait ne pas discuter des avantages spéciaux et des décisions pour les personnes qui ont déjà un cancer du sein.
Pourquoi les femmes et les hommes utilisent NOLVADEX (citrate de tamoxifène) ?
NOLVADEX (citrate de tamoxifène) a plus d'un usage. NOLVADEX (citrate de tamoxifène) est utilisé :
pour réduire les chances d'avoir un cancer du sein chez les femmes ayant un risque plus élevé que la normale d'avoir un cancer du sein au cours des 5 prochaines années (femmes à haut risque)
pour réduire les chances de contracter un cancer du sein invasif (en propagation) chez les femmes qui ont subi une intervention chirurgicale et une radiothérapie pour un carcinome canalaire in situ (CCIS). DCIS signifie que le cancer est seulement à l'intérieur des conduits de lait.
traiter cancer du sein chez les femmes après avoir terminé un traitement précoce. Le traitement précoce peut inclure la chirurgie, la radiothérapie et la chimiothérapie. NOLVADEX (citrate de tamoxifène) peut empêcher le cancer de se propager à d'autres parties du corps. Cela peut également réduire le risque pour la femme de contracter un nouveau cancer du sein. chez les femmes et les hommes,
traiter cancer du sein qui s'est propagé à d'autres parties du corps (cancer du sein métastatique).
Ce guide ne parle que de l'utilisation de NOLVADEX (citrate de tamoxifène) pour réduire le risque de cancer du sein (#1 et #2 ci-dessus).
Quels sont les avantages de NOLVADEX (citrate de tamoxifène) pour réduire le risque de cancer du sein chez les femmes à haut risque et chez les femmes traitées pour un CCIS ?
Une grande étude américaine a examiné femmes à haut risque et comparé ceux qui ont pris NOLVADEX (citrate de tamoxifène) pendant 5 ans avec d'autres qui ont pris une pilule sans NOLVADEX (citrate de tamoxifène) (placebo). Les femmes à haut risque ont été définies comme des femmes qui ont 1,7 % ou plus de chance d'avoir un cancer du sein au cours des 5 prochaines années, selon un programme informatique spécial. Dans cette étude:
- Sur 1 000 femmes à haut risque qui a pris un placebo , chaque année environ 7 ont un cancer du sein.
- Sur 1 000 femmes à haut risque qui a pris NOLVADEX (citrate de tamoxifène) , chaque année environ 4 ont un cancer du sein.
L'étude a montré qu'en moyenne, les femmes à haut risque qui prenaient NOLVADEX (citrate de tamoxifène) réduisaient leurs risques de cancer du sein de 44 %, passant de 7 sur 1 000 à 4 sur 1 000.
Une autre étude américaine a examiné femmes atteintes de CCIS et ont comparé ceux qui ont pris NOLVADEX (citrate de tamoxifène) pendant 5 ans avec d'autres qui ont pris un placebo. Dans cette étude:
- Sur 1 000 femmes atteintes de CCIS qui a pris un placebo chaque année, environ 17 personnes ont un cancer du sein.
- Sur 1 000 femmes atteintes de CCIS qui a pris NOLVADEX (citrate de tamoxifène) , chaque année environ 10 ont un cancer du sein.
L'étude a montré qu'en moyenne, les femmes atteintes de CCIS qui prenaient NOLVADEX (citrate de tamoxifène) réduisaient leurs risques de développer un cancer du sein invasif (propagation) de 43 %, passant de 17 sur 1 000 à 10 sur 1 000.
Ces études ne signifient pas que la prise de NOLVADEX (citrate de tamoxifène) réduira votre risque personnel de développer un cancer du sein. Nous ne savons pas quels seront les avantages pour une femme qui prend NOLVADEX (citrate de tamoxifène) pour réduire son risque de cancer du sein.
Quels sont les risques de NOLVADEX (citrate de tamoxifène) ?
Dans les études décrites sous "Quels sont les avantages de NOLVADEX (citrate de tamoxifène) ?", les femmes à haut risque qui ont pris NOLVADEX (citrate de tamoxifène) ont présenté certains effets secondaires à un taux plus élevé que celles qui ont pris un placebo.
Certains de ces effets secondaires peuvent entraîner la mort.
Dans une étude, chez des femmes qui avaient encore leur utérus
- Sur 1 000 femmes qui ont pris un placebo, chaque année, 1 a eu un cancer de l'endomètre (cancer de la muqueuse de l'utérus) et aucune n'a eu de sarcome utérin (cancer du corps de l'utérus).
- Sur 1 000 femmes qui ont pris NOLVADEX (citrate de tamoxifène), chaque année, 2 ont un cancer de l'endomètre et moins d'une un sarcome utérin.
Ces résultats montrent qu'en moyenne, chez les femmes à haut risque qui avaient encore leur utérus , NOLVADEX (citrate de tamoxifène) a doublé le risque de contracter un cancer de l'endomètre de 1 sur 1 000 à 2 sur 1 000, et il a augmenté le risque de contracter un sarcome utérin. Cela ne signifie pas que la prise de NOLVADEX (citrate de tamoxifène) doublera votre risque personnel de développer un cancer de l'endomètre ou augmentera votre risque de développer un sarcome utérin. Nous ne savons pas quel sera ce risque pour une femme en particulier. Le risque est différent pour les femmes qui n'ont plus d'utérus.
Pour toutes les femmes de cette étude, la prise de NOLVADEX (citrate de tamoxifène) a augmenté le risque d'avoir un caillot sanguin dans les poumons ou les veines, ou d'avoir un accident vasculaire cérébral. Dans certains cas, des femmes sont mortes de ces effets.
NOLVADEX (citrate de tamoxifène) a augmenté le risque de cataracte (opacification du cristallin) ou de nécessité d'une chirurgie de la cataracte. (Voir "Quels sont les effets secondaires possibles de NOLVADEX (citrate de tamoxifène) ?" pour plus de détails sur les effets secondaires.)
Que ne savons-nous pas sur la prise de NOLVADEX (citrate de tamoxifène) pour réduire le risque de cancer du sein ?
Nous ne savons pas
- si NOLVADEX (citrate de tamoxifène) réduit le risque de cancer du sein chez les femmes qui ont des gènes de cancer du sein anormaux (BRCA1 et BRCA2)
- si la prise de NOLVADEX (citrate de tamoxifène) pendant 5 ans réduit le nombre de cancers du sein qu'une femme aura au cours de sa vie ou s'il ne fait que retarder certains cancers du sein
- si NOLVADEX (citrate de tamoxifène) aide une femme à vivre plus longtemps
- les effets de la prise de NOLVADEX (citrate de tamoxifène) avec un traitement hormonal substitutif (THS), des pilules contraceptives ou des androgènes (hormones mâles)
- les avantages de prendre NOLVADEX (citrate de tamoxifène) si vous avez moins de 35 ans
Des études sont en cours pour en savoir plus sur les avantages et les risques à long terme de l'utilisation de NOLVADEX (citrate de tamoxifène) pour réduire le risque de cancer du sein.
Quels sont les effets secondaires possibles de NOLVADEX (citrate de tamoxifène) ?
L'effet secondaire le plus courant de NOLVADEX (citrate de tamoxifène) est les bouffées de chaleur. Ce n'est pas le signe d'un problème sérieux.
Le deuxième effet secondaire le plus courant est les pertes vaginales. Si la décharge est sanglante, cela pourrait être le signe d'un problème grave. [Voir « Modifications de la muqueuse (endomètre) ou du corps de votre utérus » ci-dessous.]
Les effets secondaires moins courants mais graves de NOLVADEX (citrate de tamoxifène) sont énumérés ci-dessous. Celles-ci peuvent survenir à tout moment. Appelez immédiatement votre médecin si vous présentez des signes d'effets secondaires énumérés ci-dessous :
- Changements dans la muqueuse (endomètre) ou le corps de votre utérus. Ces changements peuvent signifier que de graves problèmes commencent, y compris le cancer de l'utérus. Les signes de changements dans l'utérus sont:
- Saignement vaginal ou écoulement sanglant pouvant être de couleur rouille ou brune. Vous devez appeler votre médecin même si seulement une petite quantité de saignement se produit.
- Modification de vos saignements mensuels, comme la quantité ou le moment des saignements ou une augmentation de la coagulation.
- Douleur ou pression dans votre bassin (sous votre nombril).
- Caillots sanguins dans vos veines ou vos poumons. Ceux-ci peuvent causer de graves problèmes, y compris la mort. Vous pouvez avoir des caillots jusqu'à 2 à 3 mois après avoir cessé de prendre NOLVADEX (citrate de tamoxifène). Les signes de caillots sanguins sont :
- douleur thoracique soudaine, essoufflement, crachats de sang
- douleur, sensibilité ou gonflement dans une ou les deux jambes
- Accident vasculaire cérébral. Un AVC peut causer de graves problèmes médicaux, y compris la mort. Les signes d'AVC sont :
- une faiblesse soudaine, des picotements ou un engourdissement du visage, du bras ou de la jambe, en particulier d'un côté du corps
- confusion soudaine, difficulté à parler ou à comprendre
- difficulté soudaine à voir dans un ou les deux yeux
- difficulté soudaine à marcher, étourdissements, perte d'équilibre ou de coordination
- maux de tête intenses et soudains sans cause connue
- Cataractes ou risque accru d'avoir besoin d'une chirurgie de la cataracte. Le signe de ces problèmes est un flou lent de votre vision.
- Problèmes de foie, y compris la jaunisse. Les signes de problèmes de foie comprennent le manque d'appétit et le jaunissement de la peau ou du blanc des yeux.
Ce ne sont pas tous les effets secondaires possibles de NOLVADEX (citrate de tamoxifène). Pour une liste complète, demandez à votre médecin ou à votre pharmacien.
Qui ne devrait pas prendre NOLVADEX (citrate de tamoxifène) ?
Ne prenez en aucun cas NOLVADEX (citrate de tamoxifène) si vous
- êtes enceinte ou prévoyez le devenir pendant que vous prenez NOLVADEX (citrate de tamoxifène) ou pendant les 2 mois suivant l'arrêt de la prise de NOLVADEX (citrate de tamoxifène). NOLVADEX (citrate de tamoxifène) peut nuire à votre bébé à naître. Il faut environ 2 mois pour éliminer NOLVADEX (citrate de tamoxifène) de votre corps. Pour être sûre que vous n'êtes pas enceinte, vous pouvez commencer à prendre NOLVADEX (citrate de tamoxifène) pendant vos règles. Ou, vous pouvez faire un test de grossesse pour vous assurer que vous n'êtes pas enceinte avant de commencer.
- Allaitez. Nous ne savons pas si NOLVADEX (citrate de tamoxifène) peut passer dans votre lait et nuire à votre bébé.
- Vous avez eu une réaction allergique au NOLVADEX (citrate de tamoxifène) ou au tamoxifène (l'autre nom de NOLVADEX (citrate de tamoxifène)), ou à l'un de ses ingrédients inactifs.
Si vous tombez enceinte pendant que vous prenez NOLVADEX (citrate de tamoxifène), arrêtez immédiatement de le prendre et contactez votre médecin. NOLVADEX (citrate de tamoxifène) peut nuire à votre bébé à naître. Ne prenez pas NOLVADEX (citrate de tamoxifène) pour réduire votre risque de cancer du sein si
- Vous avez déjà eu un caillot de sang nécessitant un traitement médical.
- Vous prenez des médicaments pour fluidifier votre sang, comme la warfarine (également appelée Coumadin®*).
- Votre capacité à vous déplacer est limitée pendant la plupart de vos heures d'éveil.
- Vous êtes à risque de caillots sanguins. Votre médecin peut vous dire si vous présentez un risque élevé de caillots sanguins.
- Vous n'avez pas un risque supérieur à la normale d'avoir un cancer du sein. Votre médecin peut vous dire si vous êtes une femme à haut risque.
Comment dois-je prendre NOLVADEX (citrate de tamoxifène) ?
- Avalez le(s) comprimé(s) entier(s), avec de l'eau ou un autre liquide non alcoolisé. Vous pouvez prendre NOLVADEX (citrate de tamoxifène) avec ou sans nourriture. Prenez votre médicament tous les jours. Il peut être plus facile de s'en souvenir si vous le prenez à la même heure chaque jour.
- Si vous oubliez une dose, prenez-la lorsque vous vous en souvenez, puis prenez la dose suivante comme d'habitude. S'il est presque l'heure de votre prochaine dose ou si vous vous en souvenez lors de votre prochaine dose, ne prenez pas de comprimés supplémentaires pour compenser la dose oubliée.
- Prenez NOLVADEX (citrate de tamoxifène) pendant 5 ans, sauf indication contraire de votre médecin.
Que dois-je éviter en prenant NOLVADEX (citrate de tamoxifène) ?
- Ne tombez pas enceinte pendant que vous prenez NOLVADEX (citrate de tamoxifène) ou pendant 2 mois après l'arrêt. NOLVADEX (citrate de tamoxifène) peut empêcher les méthodes hormonales de contraception de fonctionner. Les méthodes hormonales comprennent les pilules contraceptives, les patchs, les injections, les anneaux et les implants. Par conséquent, tout en prenant NOLVADEX (citrate de tamoxifène), utiliser des méthodes de contraception qui n'utilisent pas d'hormones, tels que des préservatifs, des diaphragmes avec spermicide ou des DIU simples. Si vous tombez enceinte, arrêtez immédiatement de prendre NOLVADEX (citrate de tamoxifène) et appelez votre médecin.
- Ne pas allaiter. Nous ne savons pas si NOLVADEX (citrate de tamoxifène) peut passer dans votre lait et s'il peut nuire au bébé.
Que dois-je faire pendant que je prends NOLVADEX (citrate de tamoxifène) ?
- Passez régulièrement des examens gynécologiques ("examens féminins"), des examens mammaires et des mammographies. Votre médecin vous dira à quelle fréquence. Ceux-ci vérifieront les signes de cancer du sein et de cancer de l'endomètre (paroi de l'utérus). Étant donné que NOLVADEX (citrate de tamoxifène) ne prévient pas tous les cancers du sein et que vous pouvez développer d'autres types de cancers, vous avez besoin de ces examens pour détecter tout cancer le plus tôt possible.
- Étant donné que NOLVADEX (citrate de tamoxifène) peut provoquer des effets secondaires graves, portez une attention particulière à votre corps. Les signes que vous devez rechercher sont répertoriés dans "Quels sont les effets secondaires possibles de NOLVADEX (citrate de tamoxifène) ?"
- Dites à tous les médecins que vous consultez que vous prenez NOLVADEX (citrate de tamoxifène).
- Informez immédiatement votre médecin si vous avez de nouvelles masses mammaires.
Informations générales sur l'utilisation sûre et efficace de NOLVADEX (citrate de tamoxifène)
Les médicaments sont parfois prescrits à des fins autres que celles énumérées dans un guide des médicaments. Votre médecin vous a prescrit NOLVADEX (citrate de tamoxifène) uniquement pour vous. Ne le donnez pas à d'autres personnes, même si elles ont une condition similaire, car cela pourrait leur nuire. Ne l'utilisez pas pour une condition pour laquelle il n'a pas été prescrit.
Ce guide des médicaments est un résumé des informations sur NOLVADEX (citrate de tamoxifène) pour les femmes qui utilisent NOLVADEX (citrate de tamoxifène) pour réduire leur risque élevé de cancer du sein ou de CCIS. Si vous souhaitez plus d'informations sur NOLVADEX (citrate de tamoxifène), demandez à votre médecin ou à votre pharmacien. Ils peuvent vous donner des informations sur NOLVADEX (citrate de tamoxifène) qui sont écrites pour les professionnels de la santé. Pour plus d'informations sur NOLVADEX (citrate de tamoxifène) ou le cancer du sein, veuillez visiter www.NOLVADEX (citrate de tamoxifène) .com ou appeler le 1-800-236-9933.
Ingrédients : citrate de tamoxifène, carboxyméthylcellulose calcique, stéarate de magnésium, mannitol et amidon.
Ce guide des médicaments a été approuvé par la Food and Drug Administration des États-Unis
