Neoral 25mg, 100mg Cyclosporine Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Neoral 25 mg et comment est-il utilisé ?
Neoral 25 mg est un médicament sur ordonnance utilisé comme prophylaxie pour prévenir le rejet d'organe après une greffe et pour traiter les symptômes de la polyarthrite rhumatoïde et du psoriasis. Neoral peut être utilisé seul ou avec d'autres médicaments.
Neoral appartient à une classe de médicaments appelés DMARD, immunomodulateurs ; immunosuppresseurs ; Inhibiteurs de la calcineurine.
On ne sait pas si Neoral 25 mg est sûr et efficace chez les enfants.
Quels sont les effets secondaires possibles de Neoral ?
Neoral peut provoquer des effets secondaires graves, notamment :
- urticaire,
- difficulté à respirer,
- gonflement du visage, des lèvres, de la langue ou de la gorge,
- problèmes d'élocution, de pensée, de vision ou de mouvement musculaire,
- saisie,
- Maux de tête sévères,
- Vision floue,
- battant dans votre cou ou vos oreilles,
- peau pâle,
- ecchymoses faciles,
- saignement inhabituel,
- nausée,
- la faiblesse,
- sensation de picotement,
- douleur thoracique,
- battements cardiaques irréguliers,
- perte de mouvement,
- peu ou pas de miction,
- gonflement des pieds ou des chevilles,
- se sentir fatigué,
- essoufflement,
- perte d'appétit,
- douleur à l'estomac (côté supérieur droit),
- jaunissement de la peau ou des yeux,
- fièvre,
- des frissons,
- symptômes de la grippe,
- plaies buccales,
- plaies cutanées,
- mal de gorge, et
- toux
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Neoral incluent :
- tremblements ou secousses,
- acné,
- augmentation de la croissance des poils du visage ou du corps,
- augmentation de la pression artérielle,
- nausée,
- diarrhée, et
- gencives enflées ou douloureuses
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Neoral. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
ATTENTION
Seuls les médecins expérimentés dans la prise en charge d'un traitement immunosuppresseur systémique pour la maladie indiquée doivent prescrire Neoral®. Aux doses utilisées dans la transplantation d'organes solides, seuls les médecins expérimentés dans le traitement immunosuppresseur et la prise en charge des receveurs de transplantation d'organes doivent prescrire Neoral®. Les patients recevant le médicament doivent être pris en charge dans des établissements équipés et dotés d'un laboratoire adéquat et de ressources médicales de soutien. Le médecin responsable du traitement d'entretien doit disposer des informations complètes nécessaires au suivi du patient. Neoral®, un immunosuppresseur systémique, peut augmenter la sensibilité aux infections et le développement de néoplasies. Chez les patients transplantés rénaux, hépatiques et cardiaques, Neoral® peut être administré avec d'autres agents immunosuppresseurs. Une sensibilité accrue aux infections et le développement possible de lymphomes et d'autres néoplasmes peuvent résulter de l'augmentation du degré d'immunosuppression chez les patients transplantés.
Les capsules de gélatine molle Neoral® (capsules de cyclosporine, USP) MODIFIÉES et la solution orale Neoral® (solution orale de cyclosporine, USP) MODIFIÉES ont une biodisponibilité accrue par rapport aux capsules de gélatine molle Sandimmune® (capsules de cyclosporine, USP) et à la solution orale Sandimmune® (solution orale de cyclosporine). solution, USP). Neoral® et Sandimmune® ne sont pas bioéquivalents et ne peuvent pas être utilisés de manière interchangeable sans la supervision d'un médecin. Pour une concentration minimale donnée, l'exposition à la cyclosporine sera plus importante avec Neoral® qu'avec Sandimmune®. Si un patient qui reçoit des doses exceptionnellement élevées de Sandimmune® est converti à Neoral®, une prudence particulière doit être exercée. Les concentrations sanguines de cyclosporine doivent être surveillées chez les greffés et les patients atteints de polyarthrite rhumatoïde prenant Neoral® afin d'éviter toute toxicité due à des concentrations élevées. Des ajustements de dose doivent être effectués chez les patients transplantés afin de minimiser le rejet d'organe possible en raison de faibles concentrations. La comparaison des concentrations sanguines dans la littérature publiée avec les concentrations sanguines obtenues à l'aide des dosages actuels doit être effectuée avec une connaissance détaillée des méthodes de dosage employées.
Pour les patients atteints de psoriasis (voir également les AVERTISSEMENTS ENCADRÉS ci-dessus)
Les patients atteints de psoriasis précédemment traités par PUVA et, dans une moindre mesure, par le méthotrexate ou d'autres agents immunosuppresseurs, les UVB, le goudron de houille ou la radiothérapie, courent un risque accru de développer des tumeurs malignes de la peau lors de la prise de Neoral®.
La cyclosporine, l'ingrédient actif de Neoral®, aux doses recommandées, peut provoquer une hypertension systémique et une néphrotoxicité. Le risque augmente avec l'augmentation de la dose et de la durée du traitement par la cyclosporine. Le dysfonctionnement rénal, y compris les lésions rénales structurelles, est une conséquence potentielle de la cyclosporine et, par conséquent, la fonction rénale doit être surveillée pendant le traitement.
LA DESCRIPTION
Neoral® est une formulation orale de cyclosporine qui forme immédiatement une microémulsion en milieu aqueux.
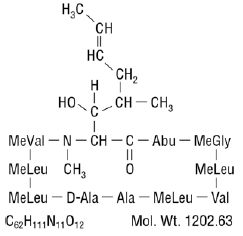
La ciclosporine, principe actif de Neoral®, est un agent immunosuppresseur polypeptidique cyclique composé de 11 acides aminés. Il est produit sous forme de métabolite par l'espèce de champignon Beauveria nivea.
Chimiquement, la cyclosporine est désignée par [R-[R*,R*-(E)]]-cyclique-(L-alanyl-D-alanyl-N-méthyl-L-leucylN-méthyl-L-leucyl-N-méthyl -L-valyl-3-hydroxy-N,4-diméthyl-L-2-amino-6-octénoyl-L-α-aminobutyryl-N-méthylglycyl-N-méthyl-L-leucyl-L-valyl-N-méthyl -L-leucyle).
Les capsules de gélatine molle Neoral® (capsules de cyclosporine, USP) MODIFIÉES sont disponibles en dosages de 25 mg et 100 mg.
Chaque gélule de 25 mg contient :
cyclosporine………………………………25 mg d'alcool, USP déshydraté............................11,9% v/v (9,5 % poids/volume)
Chaque gélule de 100 mg contient :
cyclosporine……………………………...100 mg d'alcool, USP déshydraté............................11.9 % v/v (9,5 % poids/volume)
Ingrédients inactifs: Huile de maïs-mono-di-triglycérides, huile de ricin hydrogénée polyoxyl 40 NF, DL-αtocophérol USP, gélatine NF, glycérol, oxyde de fer noir, propylène glycol USP, dioxyde de titane USP, carmin et autres ingrédients.
La solution orale Neoral® (solution orale de cyclosporine, USP) MODIFIÉE est offerte en flacons de 50 mL.
Chaque mL contient :
cyclosporine…………………..................100 mg/mL alcool, USP déshydraté................ ...........11,9 % v/v (9,5 % poids/volume)
Ingrédients inactifs: Huile de maïs-mono-di-triglycérides, huile de ricin hydrogénée polyoxyl 40 NF, tocophérol DL-α USP, propylène glycol USP.
La structure chimique de la cyclosporine (également connue sous le nom de cyclosporine A) est :
LES INDICATIONS
Transplantation rénale, hépatique et cardiaque
Neoral 25 mg est indiqué pour la prophylaxie du rejet d'organe dans les transplantations allogéniques rénales, hépatiques et cardiaques. Neoral 100 mg a été utilisé en association avec l'azathioprine et des corticostéroïdes.
La polyarthrite rhumatoïde
Neoral est indiqué pour le traitement des patients atteints de polyarthrite rhumatoïde active sévère lorsque la maladie n'a pas répondu de manière adéquate au méthotrexate. Neoral peut être utilisé en association avec le méthotrexate chez les patients atteints de polyarthrite rhumatoïde qui ne répondent pas de manière adéquate au méthotrexate seul.
Psoriasis
Neoral est indiqué pour le traitement des patients adultes non immunodéprimés atteints de psoriasis en plaques sévère (c'est-à-dire étendu et/ou invalidant), récalcitrant, qui n'ont pas répondu à au moins un traitement systémique (par exemple, PUVA, rétinoïdes ou méthotrexate) ou les patients pour lesquels d'autres thérapies systémiques sont contre-indiquées ou ne peuvent être tolérées.
Bien qu'un rebond se produise rarement, la plupart des patients connaîtront une rechute avec Neoral 100 mg comme avec d'autres thérapies à l'arrêt du traitement.
DOSAGE ET ADMINISTRATION
Capsules de gélatine molle de Neoral 25 mg (capsules de cyclosporine, USP) MODIFIÉES et solution orale de Neoral (solution orale de cyclosporine, USP) MODIFIÉES ré
Neoral a une biodisponibilité accrue par rapport à Sandimmune. Neoral 25 mg et Sandimmune ne sont pas bioéquivalents et ne peuvent pas être utilisés de manière interchangeable sans la supervision d'un médecin.
La dose quotidienne de Neoral 100 mg doit toujours être administrée en deux doses fractionnées (BID). Il est recommandé d'administrer Neoral selon un calendrier cohérent en ce qui concerne l'heure de la journée et la relation avec les repas. Le pamplemousse et le jus de pamplemousse affectent le métabolisme, augmentant la concentration sanguine de cyclosporine, et doivent donc être évités.
Populations spécifiques
Insuffisance rénale lors d'une transplantation rénale, hépatique et cardiaque
La ciclosporine subit une élimination rénale minimale et sa pharmacocinétique ne semble pas significativement altérée chez les patients atteints d'insuffisance rénale terminale qui reçoivent des traitements d'hémodialyse de routine (voir PHARMACOLOGIE CLINIQUE ). Cependant, en raison de son potentiel néphrotoxique (voir AVERTISSEMENTS ), une surveillance attentive de la fonction rénale est recommandée ; la dose de cyclosporine doit être réduite si indiqué (voir AVERTISSEMENTS et PRÉCAUTIONS ).
Insuffisance rénale dans la polyarthrite rhumatoïde et le psoriasis
Les patients insuffisants rénaux ne doivent pas recevoir de ciclosporine (voir CONTRE-INDICATIONS , AVERTISSEMENTS et PRÉCAUTIONS ).
Insuffisance hépatique
La clairance de la cyclosporine peut être significativement réduite chez les patients atteints d'une maladie hépatique sévère (voir PHARMACOLOGIE CLINIQUE ). Une réduction de la dose peut être nécessaire chez les patients présentant une insuffisance hépatique sévère afin de maintenir les concentrations sanguines dans la plage cible recommandée (voir AVERTISSEMENTS et PRÉCAUTIONS ).
Patients nouvellement transplantés
La dose orale initiale de Neoral 25 mg peut être administrée 4 à 12 heures avant la transplantation ou être administrée après l'opération. La dose initiale de Neoral 25 mg varie en fonction de l'organe greffé et des autres agents immunosuppresseurs inclus dans le protocole immunosuppresseur. Chez les patients nouvellement transplantés, la dose orale initiale de Neoral est la même que la dose orale initiale de Sandimmune. Les doses initiales suggérées sont disponibles à partir des résultats d'une enquête de 1994 sur l'utilisation de Sandimmune dans les centres de transplantation américains. Les doses initiales moyennes ± ET étaient de 9 ± 3 mg/kg/jour pour les patients transplantés rénaux (75 centres), de 8 ± 4 mg/kg/jour pour les patients transplantés hépatiques (30 centres) et de 7 ± 3 mg/kg/jour pour les patients transplantés cardiaques (24 centres). Les doses quotidiennes totales ont été divisées en deux doses quotidiennes égales. La dose de Neoral est ensuite ajustée pour atteindre une concentration sanguine de cyclosporine prédéfinie (voir Surveillance de la concentration sanguine chez les patients transplantés dessous). Si les concentrations sanguines minimales de cyclosporine sont utilisées, la plage cible est la même pour Neoral 100 mg que pour Sandimmune. L'utilisation de la même plage cible de concentration minimale pour Neoral 100 mg que pour Sandimmune entraîne une plus grande exposition à la cyclosporine lorsque Neoral est administré (voir Pharmacocinétique, Absorption ). La posologie doit être ajustée en fonction des évaluations cliniques du rejet et de la tolérabilité. Des doses plus faibles de Neoral 100 mg peuvent être suffisantes comme traitement d'entretien.
Un traitement d'appoint avec des corticostéroïdes surrénaliens est recommandé dans un premier temps. Différents schémas posologiques dégressifs de prednisone semblent donner des résultats similaires. Un schéma posologique représentatif basé sur le poids du patient a commencé avec 2,0 mg/kg/jour pendant les 4 premiers jours puis 1,0 mg/kg/jour après 1 semaine, 0,6 mg/kg/jour après 2 semaines, 0,3 mg/kg/jour à 1 mois et 0,15 mg/kg/jour à 2 mois et au-delà comme dose d'entretien. Les doses de stéroïdes peuvent être encore réduites sur une base individualisée en fonction de l'état du patient et de la fonction du greffon. Des ajustements de la posologie de la prednisone doivent être effectués en fonction de la situation clinique.
Conversion de Sandimmune à Neoral 25 mg chez les patients transplantés
Chez les patients transplantés dont la conversion à Neoral à partir de Sandimmune est envisagée, Neoral doit être démarré avec la même dose quotidienne que celle précédemment utilisée avec Sandimmune (conversion de dose 1:1). La dose de Neoral doit ensuite être ajustée pour atteindre la concentration sanguine minimale de cyclosporine avant la conversion. L'utilisation de la même plage cible de concentration minimale pour Neoral 100 mg que pour Sandimmune entraîne une plus grande exposition à la cyclosporine lorsque Neoral est administré (voir Pharmacocinétique, Absorption ). Les patients chez qui on suspecte une mauvaise absorption de Sandimmune nécessitent des stratégies posologiques différentes (voir Patients transplantés présentant une mauvaise absorption de Sandimmune, dessous). Chez certains patients, l'augmentation de la concentration sanguine résiduelle est plus prononcée et peut avoir une signification clinique.
Jusqu'à ce que la concentration sanguine minimale atteigne la valeur de pré-conversion, il est fortement recommandé de surveiller la concentration sanguine minimale de cyclosporine tous les 4 à 7 jours après la conversion en Neoral. De plus, les paramètres de sécurité clinique, tels que la créatinine sérique et la tension artérielle, doivent être surveillés toutes les deux semaines pendant les deux premiers mois suivant la conversion. Si les concentrations sanguines résiduelles sont en dehors de la plage souhaitée et/ou si les paramètres de sécurité clinique se détériorent, la posologie de Neoral 100 mg doit être ajustée en conséquence.
Patients transplantés présentant une mauvaise absorption de Sandimmune
Les patients dont les concentrations sanguines résiduelles de cyclosporine sont inférieures aux attentes par rapport à la dose orale de Sandimmune peuvent présenter une absorption médiocre ou irrégulière de la cyclosporine de Sandimmune. Après la conversion à Neoral, les patients ont tendance à avoir des concentrations de cyclosporine plus élevées. En raison de l'augmentation de la biodisponibilité de la cyclosporine après conversion en Neoral, la concentration sanguine minimale de cyclosporine peut dépasser la plage cible. Des précautions particulières doivent être prises lors de la conversion des patients à Neoral 100 mg à des doses supérieures à 10 mg/kg/jour. La dose de Neoral doit être ajustée individuellement en fonction des concentrations minimales de cyclosporine, de la tolérance et de la réponse clinique. Dans cette population, la concentration sanguine minimale de cyclosporine doit être mesurée plus fréquemment, au moins deux fois par semaine (quotidiennement, si la dose initiale dépasse 10 mg/kg/jour) jusqu'à ce que la concentration se stabilise dans l'intervalle souhaité.
La polyarthrite rhumatoïde
La dose initiale de Neoral est de 2,5 mg/kg/jour, prise deux fois par jour en une dose orale fractionnée (BID). Les salicylates, les AINS et les corticostéroïdes oraux peuvent être poursuivis (voir AVERTISSEMENTS et PRÉCAUTIONS , INTERACTIONS MÉDICAMENTEUSES ). Le début d'action se produit généralement entre 4 et 8 semaines. Si le bénéfice clinique est insuffisant et que la tolérance est bonne (y compris créatinine sérique inférieure à 30 % au-dessus de la valeur initiale), la dose peut être augmentée de 0,5 à 0,75 mg/kg/jour après 8 semaines, puis de nouveau après 12 semaines jusqu'à un maximum de 4 mg. /kg/jour. Si aucun bénéfice n'est observé après 16 semaines de traitement, le traitement par Neoral 25 mg doit être interrompu.
Des diminutions de dose de 25 % à 50 % doivent être effectuées à tout moment pour contrôler les événements indésirables, par exemple, l'hypertension, les élévations de la créatinine sérique (30 % au-dessus du niveau de prétraitement du patient) ou des anomalies de laboratoire cliniquement significatives (voir AVERTISSEMENTS et PRÉCAUTIONS ).
Si la réduction de dose n'est pas efficace pour contrôler les anomalies ou si l'événement indésirable ou l'anomalie est sévère, Neoral 25 mg doit être arrêté. La même dose initiale et la même gamme posologique doivent être utilisées si Neoral 25 mg est associé à la dose recommandée de méthotrexate. La plupart des patients peuvent être traités avec Neoral 25 mg à des doses de 3 mg/kg/jour ou moins lorsqu'il est associé à des doses de méthotrexate allant jusqu'à 15 mg/semaine (voir PHARMACOLOGIE CLINIQUE , Essais cliniques ).
Les données sur le traitement à long terme sont limitées. La récidive de l'activité de la polyarthrite rhumatoïde est généralement apparente dans les 4 semaines suivant l'arrêt de la cyclosporine.
Psoriasis
La dose initiale de Neoral 100 mg doit être de 2,5 mg/kg/jour. Neoral doit être pris deux fois par jour, en une dose orale fractionnée (1,25 mg/kg deux fois par jour). Les patients doivent être maintenus à cette dose pendant au moins 4 semaines, sauf événement indésirable. Si une amélioration clinique significative ne s'est pas produite chez les patients à ce moment-là, la posologie du patient doit être augmentée toutes les 2 semaines. En fonction de la réponse du patient, des augmentations de dose d'environ 0,5 mg/kg/jour doivent être effectuées jusqu'à un maximum de 4,0 mg/kg/jour.
Des diminutions de dose de 25 % à 50 % doivent être effectuées à tout moment pour contrôler les événements indésirables, par exemple, l'hypertension, les élévations de la créatinine sérique (≥ 25 % au-dessus du niveau de prétraitement du patient) ou des anomalies de laboratoire cliniquement significatives. Si la réduction de dose n'est pas efficace pour contrôler les anomalies, ou si l'événement indésirable ou l'anomalie est sévère, Neoral 25 mg doit être arrêté (voir Suivi particulier des patients atteints de psoriasis ).
Les patients présentent généralement une certaine amélioration des manifestations cliniques du psoriasis en 2 semaines. Un contrôle satisfaisant et une stabilisation de la maladie peuvent prendre 12 à 16 semaines. Les résultats d'un essai clinique de titration de dose avec Neoral 25 mg indiquent qu'une amélioration du psoriasis de 75 % ou plus (sur la base du PASI) a été obtenue chez 51 % des patients après 8 semaines et chez 79 % des patients après 16 semaines. Le traitement doit être interrompu si une réponse satisfaisante ne peut être obtenue après 6 semaines à 4 mg/kg/jour ou à la dose maximale tolérée par le patient. Une fois qu'un patient est suffisamment contrôlé et semble stable, la dose de Neoral 25 mg doit être réduite et le patient doit être traité avec la dose la plus faible qui maintient une réponse adéquate (cela ne doit pas nécessairement être une guérison totale du patient). Dans les essais cliniques, les doses de cyclosporine à l'extrémité inférieure de la gamme posologique recommandée ont été efficaces pour maintenir une réponse satisfaisante chez 60 % des patients. Des doses inférieures à 2,5 mg/kg/jour peuvent également être tout aussi efficaces.
À l'arrêt du traitement par la ciclosporine, une rechute surviendra dans environ 6 semaines (50 % des patients) à 16 semaines (75 % des patients). Chez la majorité des patients, le rebond ne se produit pas après l'arrêt du traitement par la ciclosporine. Treize cas de transformation de psoriasis en plaques chronique en formes plus sévères de psoriasis ont été rapportés. Il y avait 9 cas de psoriasis pustuleux et 4 cas de psoriasis érythrodermique. L'expérience à long terme avec Neoral chez les patients atteints de psoriasis est limitée et un traitement continu pendant des périodes prolongées supérieures à un an n'est pas recommandé. L'alternance avec d'autres formes de traitement doit être envisagée dans la prise en charge à long terme des patients atteints de cette maladie qui dure toute la vie.
Neoral 25mg Solution Orale (solution buvable de cyclosporine, USP) MODIFIÉ - Recommandations pour l'administration
Pour rendre la solution buvable de Neoral 25 mg (solution buvable de cyclosporine, USP) MODIFIÉE plus agréable au goût, elle doit être diluée avec du jus d'orange ou de pomme à température ambiante. Les patients doivent éviter de changer fréquemment de diluant. Le jus de pamplemousse affecte le métabolisme de la cyclosporine et doit être évité. La combinaison de la solution Neoral avec du lait peut être désagréable au goût. L'effet du lait sur la biodisponibilité de la cyclosporine administrée sous forme de solution buvable de Neoral 100 mg n'a pas été évalué.
Prélevez la quantité prescrite de Neoral 25mg Solution Buvable (solution buvable de cyclosporine, USP) MODIFIÉE du récipient à l'aide de la seringue doseuse fournie, après avoir retiré l'opercule de protection, et transférez la solution dans un verre de jus d'orange ou de pomme. Bien mélanger et boire aussitôt. Ne pas laisser reposer la solution buvable diluée avant de la boire. Utilisez un récipient en verre (pas en plastique). Rincez le verre avec plus de diluant pour vous assurer que la dose totale est consommée. Après utilisation, essuyez l'extérieur de la seringue doseuse avec une serviette propre et replacez la housse de protection. Ne rincez pas la seringue doseuse avec de l'eau ou d'autres produits de nettoyage. Si la seringue doit être nettoyée, elle doit être complètement sèche avant de pouvoir être réutilisée.
Surveillance de la concentration sanguine chez les patients transplantés
Les centres de transplantation ont constaté que la surveillance de la concentration sanguine de cyclosporine était un élément essentiel de la prise en charge des patients. Le type de test utilisé, l'organe transplanté et les autres agents immunosuppresseurs administrés sont importants pour l'analyse de la concentration sanguine. Bien qu'aucune relation fixe n'ait été établie, la surveillance de la concentration sanguine peut aider à l'évaluation clinique du rejet et de la toxicité, aux ajustements de dose et à l'évaluation de l'observance.
Divers dosages ont été utilisés pour mesurer les concentrations sanguines de cyclosporine. Des études plus anciennes utilisant un test non spécifique citaient souvent des concentrations qui étaient environ le double de celles des tests spécifiques. Par conséquent, la comparaison entre les concentrations dans la littérature publiée et la concentration d'un patient individuel à l'aide des dosages actuels doit être faite avec une connaissance détaillée des méthodes de dosage employées. Les résultats des tests actuels ne sont pas non plus interchangeables et leur utilisation doit être guidée par leur étiquetage approuvé. Une discussion des différentes méthodes de dosage est contenue dans Annals of Clinical Biochemistry 1994; 31 : 420-446. Bien que plusieurs tests et matrices de test soient disponibles, il existe un consensus sur le fait que les tests spécifiques au composé parent sont les mieux corrélés aux événements cliniques. Parmi ceux-ci, HPLC est la référence standard, mais les RIA d'anticorps monoclonaux et l'anticorps monoclonal FPIA offrent sensibilité, reproductibilité et commodité. La plupart des cliniciens fondent leur surveillance sur les concentrations minimales de cyclosporine. Applied Pharmacokinetics, Principles of Therapeutic Drug Monitoring (1992) contient une large discussion sur la pharmacocinétique de la cyclosporine et les techniques de surveillance des médicaments. La surveillance de la concentration sanguine ne remplace pas la surveillance de la fonction rénale ou les biopsies tissulaires.
COMMENT FOURNIE
Capsules de gélatine molle Neoral® (Gélules de cyclosporine, USP) MODIFIÉ
25mg
Ovale, bleu-gris imprimé en rouge, « Neoral » sur « 25 mg ».
Boîtes de 30 plaquettes thermoformées unidoses ( CDN 0078-0246-15).
100mg
Oblong, bleu-gris imprimé en rouge, « NEORAL » au-dessus de « 100 mg ».
Boîtes de 30 plaquettes thermoformées unidoses ( CDN 0078-0248-15).
Stocker et distribuer
Dans le récipient à dose unitaire d'origine à température ambiante contrôlée de 68 °F à 77 °F (20 °C à 25 °C).
Solution orale Neoral® (solution orale de cyclosporine, USP) MODIFIÉE
Un liquide clair et jaune fourni en flacons de 50 mL contenant 100 mg/mL ( CDN 0078-0274-22).
Stocker et distribuer
Dans le contenant d'origine à température ambiante contrôlée de 68 °F à 77 °F (20 ° à 25 °C). Ne pas conserver au réfrigérateur. Une fois ouvert, le contenu doit être utilisé dans les deux mois. À des températures inférieures à 20 °C (68 °F), la solution peut gélifier ; une légère floculation ou la formation d'un léger sédiment peut également se produire. Il n'y a aucun impact sur les performances du produit ou sur le dosage à l'aide de la seringue fournie. Laisser réchauffer à température ambiante 77°F (25°C) pour inverser ces changements.
Capsules de gélatine molle Neoral® (capsules de cyclosporine, USP) MODIFIÉ
Solution orale Neoral® (solution orale de cyclosporine, USP) MODIFIÉE
Distribué par : Novartis Pharmaceuticals Corporation, East Hanover, New Jersey 07936. Révisé en juin 2021.
EFFETS SECONDAIRES
Transplantation rénale, hépatique et cardiaque
Les principaux effets indésirables du traitement par la cyclosporine sont la dysfonction rénale, les tremblements, l'hirsutisme, l'hypertension et l'hyperplasie gingivale.
Hypertension
L'hypertension, qui est généralement légère à modérée, peut survenir chez environ 50 % des patients après une transplantation rénale et chez la plupart des patients transplantés cardiaques.
Thrombose capillaire glomérulaire
Une thrombose capillaire glomérulaire a été observée chez des patients traités par la ciclosporine et peut évoluer vers un échec de la greffe. Les changements pathologiques ressemblaient à ceux observés dans le syndrome hémolytique et urémique et incluaient une thrombose de la microvascularisation rénale, avec des thrombus plaquettaires-fibrineux obstruant les capillaires glomérulaires et les artérioles afférentes, une anémie hémolytique microangiopathique, une thrombocytopénie et une diminution de la fonction rénale. Des résultats similaires ont été observés lorsque d'autres immunosuppresseurs ont été utilisés après la transplantation.
Hypomagnésémie
Une hypomagnésémie a été rapportée chez certains patients, mais pas chez tous, présentant des convulsions pendant le traitement par la cyclosporine. Bien que des études sur la déplétion en magnésium chez des sujets normaux suggèrent que l'hypomagnésémie est associée à des troubles neurologiques, plusieurs facteurs, notamment l'hypertension, la méthylprednisolone à forte dose, l'hypocholestérolémie et la néphrotoxicité associée à des concentrations plasmatiques élevées de cyclosporine, semblent être liés aux manifestations neurologiques de la toxicité de la cyclosporine.
INTERACTIONS MÉDICAMENTEUSES
Effet des médicaments et autres agents sur la pharmacocinétique et/ou l'innocuité de la cyclosporine
Il est bien établi que tous les médicaments individuels cités ci-dessous interagissent avec la cyclosporine. De plus, l'utilisation concomitante d'AINS avec la cyclosporine, en particulier dans le cadre d'une déshydratation, peut potentialiser la dysfonction rénale. La prudence s'impose lors de l'utilisation d'autres médicaments connus pour altérer la fonction rénale (voir AVERTISSEMENTS , Néphrotoxicité ).
Médicaments pouvant potentialiser la dysfonction rénale
Lors de l'utilisation concomitante d'un médicament pouvant présenter une insuffisance rénale additive ou synergique avec la ciclosporine, une surveillance étroite de la fonction rénale (en particulier de la créatininémie) doit être effectuée. Si une altération significative de la fonction rénale survient, la posologie du médicament co-administré doit être réduite ou un traitement alternatif doit être envisagé.
La cyclosporine est largement métabolisée par les isoenzymes CYP 3A, en particulier le CYP3A4, et est un substrat de la glycoprotéine P du transporteur d'efflux multidrogue. Divers agents sont connus pour augmenter ou diminuer les concentrations plasmatiques ou sanguines de cyclosporine, généralement par inhibition ou induction du transporteur CYP3A4 ou de la glycoprotéine P ou les deux. Les composés qui diminuent l'absorption de la cyclosporine, tels que l'orlistat, doivent être évités. Un ajustement posologique approprié de Neoral 100 mg pour atteindre les concentrations de cyclosporine souhaitées est essentiel lorsque des médicaments qui modifient de manière significative les concentrations de cyclosporine sont utilisés simultanément (voir B Surveillance de la concentration de sang ).
1. Médicaments qui augmentent les concentrations de cyclosporine
Inhibiteurs de la protéase du VIH
Les inhibiteurs de la protéase du VIH (p. ex., indinavir, nelfinavir, ritonavir et saquinavir) sont connus pour inhiber le cytochrome P-450 3A et pourraient donc potentiellement augmenter les concentrations de cyclosporine, mais aucune étude formelle de l'interaction n'est disponible. La prudence s'impose lorsque ces médicaments sont administrés simultanément.
Jus de pamplemousse
Le pamplemousse et le jus de pamplemousse affectent le métabolisme, augmentant les concentrations sanguines de cyclosporine et doivent donc être évités.
2. Médicaments/compléments alimentaires qui diminuent les concentrations de cyclosporine
Bosentane
L'administration concomitante de bosentan (250 à 1 000 mg toutes les 12 heures selon la tolérance) et de cyclosporine (300 mg toutes les 12 heures pendant 2 jours puis dosage pour atteindre une Cmax de 200 à 250 ng/mL) pendant 7 jours chez des sujets sains a entraîné une diminution de l'ASC, la Cmax et la concentration minimale normalisées à la dose moyenne de la cyclosporine d'environ 50 %, 30 % et 60 %, respectivement, par rapport à l'administration de la cyclosporine seule (voir Effet de la ciclosporine sur la pharmacocinétique et/ou l'innocuité d'autres médicaments ou agents ). L'administration concomitante de cyclosporine et de bosentan doit être évitée.
Bocéprévir
L'administration concomitante de bocéprévir (800 mg trois fois par jour pendant 7 jours) et de cyclosporine (dose unique de 100 mg) chez des sujets sains a entraîné une augmentation de l'ASC et de la Cmax moyennes de la cyclosporine d'environ 2,7 fois et 2 fois, respectivement, par rapport à la cyclosporine. a été donné seul.
Télaprévir
L'administration concomitante de télaprévir (750 mg toutes les 8 heures pendant 11 jours) avec de la cyclosporine (10 mg au jour 8) chez des sujets sains a entraîné une augmentation de l'ASC et de la Cmax moyennes normalisées en fonction de la dose de la cyclosporine d'environ 4,5 fois et 1,3 fois, respectivement, par rapport à la ciclosporine (dose unique de 100 mg) administrée seule.
Millepertuis
Il y a eu des rapports d'interaction médicamenteuse grave entre la cyclosporine et le complément alimentaire à base de plantes, le millepertuis. Il a été rapporté que cette interaction produit une réduction marquée des concentrations sanguines de cyclosporine, entraînant des niveaux sous-thérapeutiques, le rejet des organes transplantés et la perte du greffon.
Rifabutine
La rifabutine est connue pour augmenter le métabolisme d'autres médicaments métabolisés par le système du cytochrome P-450. L'interaction entre la rifabutine et la cyclosporine n'a pas été étudiée. La prudence s'impose lorsque ces deux médicaments sont administrés simultanément.
Effet de la ciclosporine sur la pharmacocinétique et/ou l'innocuité d'autres médicaments ou agents
La cyclosporine est un inhibiteur du CYP3A4 et de plusieurs transporteurs d'efflux de médicaments (p. ex., la glycoprotéine P) et peut augmenter les concentrations plasmatiques des co-médicaments qui sont des substrats du CYP3A4, de la glycoprotéine P ou des protéines transporteurs d'anions organiques.
La cyclosporine peut réduire la clairance de la digoxine, de la colchicine, de la prednisolone, des inhibiteurs de l'HMG-CoA réductase (statines) et de l'aliskirène, du bosentan, du dabigatran, du répaglinide, des AINS, du sirolimus, de l'étoposide et d'autres médicaments.
Voir les informations de prescription complètes de l'autre médicament pour plus d'informations et des recommandations spécifiques. La décision de co-administrer la cyclosporine avec d'autres médicaments ou agents doit être prise par le professionnel de la santé après une évaluation minutieuse des avantages et des risques.
Digoxine
Une toxicité digitale sévère a été observée dans les jours suivant le début de la cyclosporine chez plusieurs patients prenant de la digoxine. Si la digoxine est utilisée en même temps que la cyclosporine, les concentrations sériques de digoxine doivent être surveillées.
Colchicine
Il existe des rapports sur le potentiel de la cyclosporine pour augmenter les effets toxiques de la colchicine tels que la myopathie et la neuropathie, en particulier chez les patients atteints de dysfonctionnement rénal. L'administration concomitante de cyclosporine et de colchicine entraîne une augmentation significative des concentrations plasmatiques de colchicine. Si la colchicine est utilisée en même temps que la cyclosporine, une réduction de la posologie de la colchicine est recommandée.
Inhibiteurs de l'HMG-CoA réductase (statines)
Des cas de myotoxicité dans la littérature et après la commercialisation, y compris des douleurs et faiblesses musculaires, une myosite et une rhabdomyolyse, ont été signalés lors de l'administration concomitante de cyclosporine avec la lovastatine, la simvastatine, l'atorvastatine, la pravastatine et, rarement, la fluvastatine. Lorsqu'elles sont administrées en même temps que la cyclosporine, la posologie de ces statines doit être réduite conformément aux recommandations de l'étiquette. Le traitement par statine doit être temporairement suspendu ou interrompu chez les patients présentant des signes et symptômes de myopathie ou chez ceux présentant des facteurs de risque prédisposant à une atteinte rénale grave, y compris une insuffisance rénale, secondaire à une rhabdomyolyse.
Répaglinide
La ciclosporine peut augmenter les concentrations plasmatiques de répaglinide et ainsi augmenter le risque d'hypoglycémie. Chez 12 sujets sains de sexe masculin qui ont reçu deux doses de 100 mg de cyclosporine en capsule par voie orale à 12 heures d'intervalle avec une dose unique de 0,25 mg de comprimé de répaglinide (la moitié d'un comprimé de 0,5 mg) par voie orale 13 heures après la dose initiale de cyclosporine, la Cmax moyenne du répaglinide et l'ASC ont été augmentées de 1,8 fois (plage : 0,6 à 3,7 fois) et de 2,4 fois (plage : 1,2 à 5,3 fois), respectivement. Une surveillance étroite de la glycémie est recommandée chez un patient prenant simultanément de la cyclosporine et du répaglinide.
Ambrisentan
L'administration concomitante d'ambrisentan (5 mg par jour) et de cyclosporine (100 à 150 mg deux fois par jour initialement, puis dosage pour atteindre une Cmax de 150 à 200 ng/mL) pendant 8 jours chez des sujets sains a entraîné des augmentations moyennes de l'ASC et de la Cmax de l'ambrisentan d'environ 2- fois et 1,5 fois, respectivement, par rapport à l'ambrisentan seul. En cas d'administration concomitante d'ambrisentan et de ciclosporine, la dose d'ambrisentan ne doit pas être ajustée à la dose quotidienne maximale recommandée.
Antibiotiques anthracyclines
Des doses élevées de cyclosporine (p. ex., à la dose intraveineuse initiale de 16 mg/kg/jour) peuvent augmenter l'exposition aux antibiotiques anthracyclines (p. ex., doxorubicine, mitoxantrone, daunorubicine) chez les patients cancéreux.
Aliskiren
La cyclosporine modifie la pharmacocinétique de l'aliskirène, un substrat de la glycoprotéine P et du CYP3A4. Chez 14 sujets sains qui ont reçu simultanément des doses uniques de cyclosporine (200 mg) et d'aliskirène à dose réduite (75 mg), la Cmax moyenne de l'aliskirène a été augmentée d'environ 2,5 fois (IC à 90 % : 1,96 à 3,17) et l'ASC moyenne de environ 4,3 fois (IC à 90 % : 3,52 à 5,21), par rapport au moment où ces sujets recevaient de l'aliskirène seul. L'administration concomitante d'aliskiren avec la cyclosporine a prolongé la demi-vie médiane d'élimination de l'aliskirène (26 heures contre 43 à 45 heures) et le T (0,5 heure contre 1,5 à 2,0 heures). L'ASC et la Cmax moyennes de la cyclosporine étaient comparables aux valeurs publiées dans la littérature. L'administration concomitante de cyclosporine et d'aliskirène chez ces sujets a également entraîné une augmentation du nombre et/ou de l'intensité des événements indésirables, principalement des maux de tête, des bouffées vasomotrices, des nausées, des vomissements et de la somnolence. L'administration concomitante de ciclosporine et d'aliskirène n'est pas recommandée.
Bosentane
Chez des sujets sains, l'administration concomitante de bosentan et de cyclosporine a entraîné des augmentations moyennes en fonction du temps de la dose normalisée
concentrations minimales de bosentan (c'est-à-dire environ 21 fois le jour 1 et 2 fois le jour 8 (état d'équilibre)) par rapport à celles observées lorsque le bosentan était administré seul en dose unique le jour 1 (voir Effet des médicaments et autres agents sur la pharmacocinétique et/ou l'innocuité de la cyclosporine ). L'administration concomitante de cyclosporine et de bosentan doit être évitée.
Dabigatran
L'effet de la cyclosporine sur les concentrations de dabigatran n'a pas été formellement étudié. L'administration concomitante de dabigatran et de cyclosporine peut entraîner une augmentation des concentrations plasmatiques de dabigatran en raison de l'activité inhibitrice de la P-gp de la cyclosporine. L'administration concomitante de ciclosporine et de dabigatran doit être évitée.
Diurétiques épargneurs de potassium
La ciclosporine ne doit pas être utilisée avec des diurétiques épargneurs de potassium car une hyperkaliémie peut survenir. La prudence est également requise lorsque la ciclosporine est co-administrée avec des médicaments d'épargne potassique (p. ex., inhibiteurs de l'enzyme de conversion de l'angiotensine, antagonistes des récepteurs de l'angiotensine II), des médicaments contenant du potassium ainsi que chez les patients suivant un régime riche en potassium. Le contrôle des niveaux de potassium dans ces situations est conseillé.
Interactions avec les anti-inflammatoires non stéroïdiens (AINS)
L'état clinique et la créatinine sérique doivent être étroitement surveillés lorsque la ciclosporine est utilisée avec des AINS chez des patients atteints de polyarthrite rhumatoïde (voir AVERTISSEMENTS ).
Des interactions pharmacodynamiques ont été rapportées entre la cyclosporine et le naproxène et le sulindac, dans la mesure où l'utilisation concomitante est associée à des diminutions additives de la fonction rénale, telles que déterminées par les clairances de l'acide 99mTc-diéthylènetriaminepentaacétique (DTPA) et (acide p-aminohippurique) des HAP. Bien que l'administration concomitante de diclofénac n'affecte pas les concentrations sanguines de cyclosporine, elle a été associée à un doublement approximatif des concentrations sanguines de diclofénac et à des rapports occasionnels de diminutions réversibles de la fonction rénale. Par conséquent, la dose de diclofénac doit se situer dans la partie inférieure de l'intervalle thérapeutique.
Interaction avec le méthotrexate
Les données préliminaires indiquent que lorsque le méthotrexate et la cyclosporine ont été co-administrés à des patients atteints de polyarthrite rhumatoïde (N = 20), les concentrations de méthotrexate (ASC) ont augmenté d'environ 30 % et les concentrations (ASC) de son métabolite, le 7-hydroxyméthotrexate, ont diminué d'environ 80 %. %. La signification clinique de cette interaction n'est pas connue. Les concentrations de cyclosporine ne semblent pas avoir été modifiées (N = 6).
sirolimus
Des élévations de la créatinine sérique ont été observées dans des études utilisant du sirolimus en association avec de la cyclosporine à dose complète. Cet effet est souvent réversible avec la réduction de la dose de cyclosporine. La co-administration simultanée de cyclosporine augmente significativement les taux sanguins de sirolimus. Pour minimiser les augmentations des concentrations de sirolimus, il est recommandé que le sirolimus soit administré 4 heures après l'administration de la cyclosporine.
Nifédipine
Une hyperplasie gingivale fréquente lorsque la nifédipine est administrée en même temps que la cyclosporine a été signalée. L'utilisation concomitante de nifédipine doit être évitée chez les patients chez qui une hyperplasie gingivale se développe comme effet secondaire de la cyclosporine.
Méthylprednisolone
Des convulsions lors de l'administration concomitante de fortes doses de méthylprednisolone et de cyclosporine ont été rapportées.
Autres médicaments et agents immunosuppresseurs
Les patients atteints de psoriasis recevant d'autres agents immunosuppresseurs ou une radiothérapie (y compris PUVA et UVB) ne doivent pas recevoir de cyclosporine en concomitance en raison de la possibilité d'une immunosuppression excessive.
Effet de la cyclosporine sur l'efficacité des vaccins vivants
Pendant le traitement par la ciclosporine, la vaccination peut être moins efficace. L'utilisation de vaccins vivants doit être évitée.
Pour plus d'informations sur les interactions médicamenteuses de la cyclosporine, veuillez contacter le service des affaires médicales de Novartis au 1-888-NOW-NOVA [1-888-669-6682].
AVERTISSEMENTS
(Voir également AVERTISSEMENT ENCADRÉ )
Tous les patients
La cyclosporine, principe actif de Neoral 25 mg, peut provoquer une néphrotoxicité et une hépatotoxicité. Le risque augmente avec l'augmentation des doses de cyclosporine. Un dysfonctionnement rénal, y compris des lésions rénales structurelles, est une conséquence potentielle de Neoral 100 mg et, par conséquent, la fonction rénale doit être surveillée pendant le traitement. Des précautions doivent être prises lors de l'utilisation de la cyclosporine avec des médicaments néphrotoxiques (voir PRÉCAUTIONS ).
Les patients recevant Neoral nécessitent une surveillance fréquente de la créatinine sérique (voir Surveillance spéciale en dessous de DOSAGE ET ADMINISTRATION ). Les patients âgés doivent être surveillés avec une attention particulière, car une diminution de la fonction rénale se produit également avec l'âge. Si les patients ne sont pas correctement surveillés et que les doses ne sont pas correctement ajustées, le traitement par la cyclosporine peut être associé à la survenue de lésions rénales structurelles et d'un dysfonctionnement rénal persistant.
Une augmentation de la créatinine sérique et de l'urée sérique peut survenir pendant le traitement par Neoral et refléter une réduction du taux de filtration glomérulaire. Une fonction rénale altérée nécessite à tout moment une surveillance étroite et un ajustement fréquent de la posologie peut être indiqué. La fréquence et la gravité des élévations de la créatinine sérique augmentent avec la dose et la durée du traitement par la cyclosporine. Ces élévations sont susceptibles de devenir plus prononcées sans réduction de dose ou arrêt.
Étant donné que Neoral 100 mg n'est pas bioéquivalent à Sandimmune, la conversion de Neoral en Sandimmune en utilisant un rapport de 1:1 (mg/kg/jour) peut entraîner une diminution des concentrations sanguines de cyclosporine. La conversion de Neoral à Sandimmune doit être effectuée avec une surveillance accrue pour éviter le risque de sous-dosage.
Greffe de rein, de foie et de cœur
Néphrotoxicité
La cyclosporine, l'ingrédient actif de Neoral, peut provoquer une néphrotoxicité et une hépatotoxicité lorsqu'elle est utilisée à fortes doses. Il n'est pas rare que les taux sériques de créatinine et d'azote uréique soient élevés pendant le traitement par la cyclosporine. Ces élévations chez les patients transplantés rénaux n'indiquent pas nécessairement un rejet, et chaque patient doit être complètement évalué avant que l'ajustement posologique ne soit initié.
Sur la base de l'expérience historique de Sandimmune avec la solution buvable, une néphrotoxicité associée à la cyclosporine a été notée dans 25 % des cas de transplantation rénale, 38 % des cas de transplantation cardiaque et 37 % des cas de transplantation hépatique. Une néphrotoxicité légère a généralement été notée 2 à 3 mois après la transplantation rénale et consistait en un arrêt à la chute des élévations préopératoires de l'urée et de la créatinine à une plage de 35 à 45 mg/dL et de 2,0 à 2,5 mg/dL, respectivement. Ces élévations étaient souvent sensibles à la réduction de la dose de cyclosporine.
Une néphrotoxicité plus manifeste a été observée tôt après la transplantation et a été caractérisée par une augmentation rapide de l'urée et de la créatinine. Étant donné que ces événements sont similaires aux épisodes de rejet rénal, il faut veiller à les différencier. Cette forme de néphrotoxicité est généralement sensible à la réduction de la dose de cyclosporine.
Bien qu'aucun critère diagnostique spécifique qui différencie de manière fiable le rejet de greffon rénal de la toxicité médicamenteuse n'ait été trouvé, un certain nombre de paramètres ont été significativement associés à l'un ou à l'autre. Il convient de noter cependant que jusqu'à 20 % des patients peuvent avoir une néphrotoxicité et un rejet simultanés.
Une forme de néphropathie associée à la cyclosporine est caractérisée par une détérioration en série de la fonction rénale et des modifications morphologiques des reins. De 5 % à 15 % des greffés qui ont reçu de la cyclosporine ne présenteront pas de réduction de l'augmentation de la créatinine sérique malgré une diminution ou l'arrêt du traitement par la cyclosporine. Les biopsies rénales de ces patients mettront en évidence une ou plusieurs des altérations suivantes : vacuolisation tubulaire, microcalcifications tubulaires, congestion capillaire péritubulaire, artériolopathie et forme striée de fibrose interstitielle avec atrophie tubulaire. Bien qu'aucun de ces changements morphologiques ne soit entièrement spécifique, un diagnostic de néphrotoxicité structurelle associée à la cyclosporine nécessite la preuve de ces résultats.
Lors de l'examen du développement de la néphropathie associée à la cyclosporine, il convient de noter que plusieurs auteurs ont rapporté une association entre l'apparition de la fibrose interstitielle et des doses cumulatives plus élevées ou des concentrations résiduelles circulantes élevées et persistantes de cyclosporine. Ceci est particulièrement vrai pendant les 6 premiers mois post-transplantation où la posologie a tendance à être la plus élevée et où, chez les receveurs rénaux, l'organe apparaît le plus vulnérable aux effets toxiques de la cyclosporine. Parmi les autres facteurs contribuant au développement de la fibrose interstitielle chez ces patients, il y a un temps de perfusion prolongé, un temps d'ischémie chaude, ainsi que des épisodes de toxicité aiguë et un rejet aigu et chronique. La réversibilité de la fibrose interstitielle et sa corrélation avec la fonction rénale n'ont pas encore été déterminées. La réversibilité de l'artériolopathie a été rapportée après l'arrêt de la ciclosporine ou la diminution de la posologie.
Une fonction rénale altérée nécessite à tout moment une surveillance étroite et un ajustement fréquent de la posologie peut être indiqué.
En cas de rejet sévère et persistant, lorsqu'un traitement de secours avec des stéroïdes pulsés et des anticorps monoclonaux ne parvient pas à inverser l'épisode de rejet, il peut être préférable de passer à un traitement immunosuppresseur alternatif plutôt que d'augmenter la dose de Neoral jusqu'à des concentrations sanguines excessives.
En raison du risque d'altération additive ou synergique de la fonction rénale, la prudence s'impose lors de l'administration concomitante de Neoral avec d'autres médicaments susceptibles d'altérer la fonction rénale (voir PRÉCAUTIONS , INTERACTIONS MÉDICAMENTEUSES ).
Microangiopathie thrombotique
Parfois, des patients ont développé un syndrome de thrombocytopénie et d'anémie hémolytique microangiopathique pouvant entraîner un échec du greffon. La vasculopathie peut survenir en l'absence de rejet et s'accompagne d'une consommation avide de plaquettes dans le greffon, comme le démontrent les études sur les plaquettes marquées à l'indium 111. Ni la pathogenèse ni la prise en charge de ce syndrome ne sont claires. Bien que la résolution se soit produite après la réduction ou l'arrêt de la cyclosporine et 1) l'administration de streptokinase et d'héparine ou 2) la plasmaphérèse, cela semble dépendre d'une détection précoce avec des scintigraphies plaquettaires marquées à l'indium 111 (voir EFFETS INDÉSIRABLES ).
Hyperkaliémie
Une hyperkaliémie importante (parfois associée à une acidose métabolique hyperchlorémique) et une hyperuricémie ont été occasionnellement observées chez certains patients.
Hépatotoxicité
Des cas d'hépatotoxicité et de lésions hépatiques, notamment de cholestase, d'ictère, d'hépatite et d'insuffisance hépatique, ont été signalés chez des patients traités par la cyclosporine. La plupart des rapports incluaient des patients présentant des comorbidités importantes, des affections sous-jacentes et d'autres facteurs de confusion, notamment des complications infectieuses et des comédicaments à potentiel hépatotoxique. Dans certains cas, principalement chez des patients transplantés, des issues fatales ont été rapportées (voir EFFETS INDÉSIRABLES , Expérience post-commercialisation, transplantation rénale, hépatique et cardiaque ).
Une hépatotoxicité, se manifestant généralement par des élévations des enzymes hépatiques et de la bilirubine, a été rapportée chez des patients traités par la ciclosporine dans les essais cliniques : 4 % en transplantation rénale, 7 % en transplantation cardiaque et 4 % en transplantation hépatique. Cela a été généralement noté au cours du premier mois de traitement lorsque de fortes doses de cyclosporine ont été utilisées. Les élévations de la chimie ont généralement diminué avec une réduction de la posologie.
Malignités
Comme chez les patients recevant d'autres immunosuppresseurs, les patients recevant de la cyclosporine présentent un risque accru de développer des lymphomes et d'autres tumeurs malignes, en particulier celles de la peau. Les patients prenant de la cyclosporine doivent être avertis d'éviter une exposition excessive à la lumière ultraviolette. Le risque accru semble lié à l'intensité et à la durée de l'immunosuppression plutôt qu'à l'utilisation d'agents spécifiques. En raison du danger de sursuppression du système immunitaire entraînant un risque accru d'infection ou de malignité, un schéma thérapeutique contenant plusieurs immunosuppresseurs doit être utilisé avec prudence. Certaines tumeurs malignes peuvent être mortelles. Les patients transplantés recevant de la cyclosporine courent un risque accru d'infection grave avec une issue fatale.
Infections graves
Les patients recevant des immunosuppresseurs, y compris Neoral 100 mg, présentent un risque accru de développer des infections bactériennes, virales, fongiques et protozoaires, y compris des infections opportunistes. Ces infections peuvent avoir des conséquences graves, voire mortelles (voir AVERTISSEMENT ENCADRÉ , et EFFETS INDÉSIRABLES ).
Infections par le virus du polyome
Les patients recevant des immunosuppresseurs, y compris Neoral 100 mg, présentent un risque accru d'infections opportunistes, y compris les infections par le virus du polyome. Les infections par le virus du polyome chez les patients transplantés peuvent avoir des conséquences graves et parfois mortelles. Ceux-ci comprennent des cas de leucoencéphalopathie multifocale progressive (LEMP) associée au virus JC et de néphropathie associée au virus du polyome (PVAN), en particulier due à une infection par le virus BK, qui ont été observés chez des patients recevant de la cyclosporine. Le PVAN est associé à des conséquences graves, notamment une détérioration de la fonction rénale et la perte du greffon rénal (voir EFFETS INDÉSIRABLES , Expérience post-commercialisation, transplantation rénale, hépatique et cardiaque ). La surveillance des patients peut aider à détecter les patients à risque de PVAN.
Des cas de LEMP ont été rapportés chez des patients traités par Neoral. La LMP, qui est parfois mortelle, se présente généralement avec une hémiparésie, une apathie, une confusion, des déficiences cognitives et une ataxie. Les facteurs de risque de LEMP comprennent le traitement par des thérapies immunosuppressives et une altération de la fonction immunitaire. Chez les patients immunodéprimés, les médecins doivent considérer la LEMP dans le diagnostic différentiel chez les patients signalant des symptômes neurologiques et la consultation d'un neurologue doit être considérée comme cliniquement indiquée.
Il faut envisager de réduire l'immunosuppression totale chez les patients transplantés qui développent une LMP ou une PVAN. Cependant, une immunosuppression réduite peut mettre la greffe en danger.
Neurotoxicité
Des cas de convulsions ont été rapportés chez des patients adultes et pédiatriques recevant de la cyclosporine, en particulier en association avec de fortes doses de méthylprednisolone.
L'encéphalopathie, y compris le syndrome d'encéphalopathie postérieure réversible (SEPR), a été décrite à la fois dans des rapports post-commercialisation et dans la littérature. Les manifestations comprennent des troubles de la conscience, des convulsions, des troubles visuels (y compris la cécité), une perte de la fonction motrice, des troubles du mouvement et des troubles psychiatriques. Dans de nombreux cas, des modifications de la substance blanche ont été détectées à l'aide de techniques d'imagerie et d'échantillons pathologiques. Des facteurs prédisposants, tels que l'hypertension, l'hypomagnésémie, l'hypocholestérolémie, les corticostéroïdes à forte dose, les concentrations sanguines élevées de cyclosporine et la réaction du greffon contre l'hôte, ont été observés dans de nombreux cas signalés, mais pas dans tous. Dans la plupart des cas, les changements ont été réversibles à l'arrêt de la ciclosporine et, dans certains cas, une amélioration a été notée après réduction de la dose. Il semble que les patients recevant une greffe de foie soient plus sensibles à l'encéphalopathie que ceux recevant une greffe de rein. Une autre manifestation rare de la neurotoxicité induite par la cyclosporine, survenant chez les patients transplantés plus fréquemment que dans d'autres indications, est l'œdème de la papille optique, y compris l'œdème papillaire, avec une possible déficience visuelle, secondaire à une hypertension intracrânienne bénigne.
Des précautions doivent être prises lors de l'utilisation de la cyclosporine avec des médicaments néphrotoxiques (voir PRÉCAUTIONS ).
La polyarthrite rhumatoïde
La néphropathie à la cyclosporine a été détectée dans les biopsies rénales de 6 patients sur 60 (10 %) atteints de polyarthrite rhumatoïde après une durée moyenne de traitement de 19 mois. Un seul patient, sur ces 6 patients, a été traité avec une dose ≤ 4 mg/kg/jour. La créatininémie s'est améliorée chez tous les patients sauf un après l'arrêt de la ciclosporine. « L'augmentation maximale de la créatinine » semble être un facteur prédictif de la néphropathie à la cyclosporine.
Il existe un potentiel, comme avec d'autres agents immunosuppresseurs, pour une augmentation de la survenue de lymphomes malins avec la cyclosporine. Il n'est pas clair si le risque avec la ciclosporine est supérieur à celui chez les patients atteints de polyarthrite rhumatoïde ou chez les patients atteints de polyarthrite rhumatoïde sous traitement cytotoxique pour cette indication. Cinq cas de lymphome ont été détectés : quatre dans une enquête auprès d'environ 2 300 patients traités par la cyclosporine pour la polyarthrite rhumatoïde, et un autre cas de lymphome a été signalé dans un essai clinique. Bien que d'autres tumeurs (12 cancers de la peau, 24 tumeurs solides de divers types et 1 myélome multiple) aient également été signalées dans cette enquête, les analyses épidémiologiques n'ont pas soutenu une relation avec la cyclosporine autre que pour les lymphomes malins.
Les patients doivent être soigneusement évalués avant et pendant le traitement par Neoral 25 mg pour le développement de tumeurs malignes. De plus, l'utilisation du traitement par Neoral 25 mg avec d'autres agents immunosuppresseurs peut induire une immunosuppression excessive qui est connue pour augmenter le risque de malignité.
Psoriasis
(Voir également AVERTISSEMENT BOXÉ pour le psoriasis )
Étant donné que la cyclosporine est un agent immunosuppresseur puissant avec un certain nombre d'effets secondaires potentiellement graves, les risques et les avantages de l'utilisation de Neoral 100 mg doivent être pris en compte avant le traitement des patients atteints de psoriasis. La cyclosporine, le principe actif de Neoral, peut provoquer une néphrotoxicité et une hypertension (voir PRÉCAUTIONS ) et le risque augmente avec l'augmentation de la dose et de la durée du traitement. Les patients qui peuvent présenter un risque accru, tels que ceux présentant une fonction rénale anormale, une hypertension non contrôlée ou des tumeurs malignes, ne doivent pas recevoir Neoral.
Le dysfonctionnement rénal est une conséquence potentielle de Neoral. Par conséquent, la fonction rénale doit être surveillée pendant le traitement.
Les patients recevant Neoral 100 mg nécessitent une surveillance fréquente de la créatinine sérique (voir Surveillance spéciale en dessous de DOSAGE ET ADMINISTRATION ). Les patients âgés doivent être surveillés avec une attention particulière, car une diminution de la fonction rénale se produit également avec l'âge. Si les patients ne sont pas correctement surveillés et que les doses ne sont pas correctement ajustées, le traitement par la cyclosporine peut provoquer des lésions rénales structurelles et un dysfonctionnement rénal persistant.
Une augmentation de la créatinine sérique et de l'urée sérique peut survenir pendant le traitement par Neoral 25 mg et reflète une réduction du taux de filtration glomérulaire.
Les biopsies rénales de 86 patients atteints de psoriasis traités pendant une durée moyenne de 23 mois avec 1,2 à 7,6 mg/kg/jour de cyclosporine ont mis en évidence une néphropathie à la cyclosporine chez 18/86 (21 %) des patients. La pathologie consistait en une atrophie tubulaire rénale et une fibrose interstitielle. Lors d'une biopsie répétée de 13 de ces patients maintenus sous diverses doses de cyclosporine pendant une moyenne de 2 années supplémentaires, le nombre de néphropathies induites par la cyclosporine est passé à 26/86 (30 %). La majorité des patients (19/26) recevaient une dose ≥ 5,0 mg/kg/jour (la dose maximale recommandée est de 4 mg/kg/jour). Les patients étaient également sous cyclosporine depuis plus de 15 mois (18/26) et/ou avaient une augmentation cliniquement significative de la créatinine sérique depuis plus d'un mois (21/26). Les taux de créatinine sont revenus à la normale chez 7 des 11 patients chez qui le traitement par la cyclosporine a été interrompu.
Il existe un risque accru de développement de tumeurs malignes cutanées et lymphoprolifératives chez les patients atteints de psoriasis traités à la cyclosporine. Le risque relatif de tumeurs malignes est comparable à celui observé chez les patients atteints de psoriasis traités avec d'autres agents immunosuppresseurs.
Des tumeurs ont été signalées chez 32 (2,2 %) des 1 439 patients atteints de psoriasis traités par la cyclosporine dans le monde dans le cadre d'essais cliniques. Des tumeurs supplémentaires ont été signalées chez 7 patients après la commercialisation de la cyclosporine. Des affections malignes de la peau ont été signalées chez 16 (1,1 %) de ces patients ; tous sauf 2 avaient déjà reçu une thérapie PUVA. Le méthotrexate a été reçu par 7 patients.
Les UVB et le goudron de houille avaient été utilisés respectivement par 2 et 3 patients. Sept patients avaient soit des antécédents de cancer de la peau, soit une lésion potentiellement prédisposante était présente avant l'exposition à la cyclosporine. Sur les 16 patients atteints de cancer de la peau, 11 patients avaient 18 carcinomes épidermoïdes et 7 patients avaient 10 carcinomes basocellulaires.
Il y avait deux tumeurs malignes lymphoprolifératives ; un cas de lymphome non hodgkinien qui a nécessité une chimiothérapie et un cas de mycosis fongoïde qui a régressé spontanément à l'arrêt de la ciclosporine. Il y a eu quatre cas d'infiltration lymphocytaire bénigne : 3 ont régressé spontanément à l'arrêt de la ciclosporine, tandis que le quatrième a régressé malgré la poursuite du médicament. Le reste des tumeurs malignes, 13 cas (0,9 %), impliquait divers organes.
Les patients ne doivent pas être traités en même temps que la cyclosporine et la PUVA ou les UVB, d'autres radiothérapies ou d'autres agents immunosuppresseurs, en raison de la possibilité d'une immunosuppression excessive et du risque ultérieur de tumeurs malignes. (voir CONTRE-INDICATIONS ). Les patients doivent également être avertis de se protéger de manière appropriée lorsqu'ils sont exposés au soleil et d'éviter une exposition excessive au soleil. Les patients doivent être soigneusement évalués avant et pendant le traitement pour la présence de tumeurs malignes en se rappelant que les lésions malignes peuvent être cachées par des plaques psoriasiques. Les lésions cutanées non typiques du psoriasis doivent être biopsiées avant de commencer le traitement. Les patients ne doivent être traités par Neoral qu'après résolution complète des lésions suspectes, et seulement s'il n'y a pas d'autres options de traitement (voir Surveillance spéciale pour les patients atteints de psoriasis ).
Excipients spéciaux
Alcool (éthanol)
La teneur en alcool (voir LA DESCRIPTION de Neoral 100 mg doit être pris en compte lorsqu'il est administré à des patients chez qui la consommation d'alcool doit être évitée ou minimisée, par exemple les femmes enceintes ou allaitantes, les patients présentant une maladie du foie ou l'épilepsie, les patients alcooliques ou les patients pédiatriques. Pour un adulte pesant 70 kg, la dose orale quotidienne maximale fournirait environ 1 gramme d'alcool, soit environ 6 % de la quantité d'alcool contenue dans une boisson standard.
PRÉCAUTIONS
Général
Hypertension
La ciclosporine est l'ingrédient actif de Neoral. L'hypertension est un effet indésirable courant du traitement par la cyclosporine qui peut persister (voir EFFETS INDÉSIRABLES et DOSAGE ET ADMINISTRATION pour le suivi des recommandations). L'hypertension légère ou modérée est plus fréquente que l'hypertension sévère et son incidence diminue avec le temps. Chez les receveurs d'allogreffes rénales, hépatiques et cardiaques traités par la ciclosporine, un traitement antihypertenseur peut être nécessaire (voir Surveillance particulière de la polyarthrite rhumatoïde et Patients atteints de psoriasis ). Cependant, étant donné que la cyclosporine peut provoquer une hyperkaliémie, les diurétiques épargneurs de potassium ne doivent pas être utilisés. Alors que les antagonistes du calcium peuvent être des agents efficaces dans le traitement de l'hypertension associée à la cyclosporine, ils peuvent interférer avec le métabolisme de la cyclosporine (voir INTERACTIONS MÉDICAMENTEUSES ).
Vaccination
Pendant le traitement par la ciclosporine, la vaccination peut être moins efficace ; et l'utilisation de vaccins vivants atténués doit être évitée.
Surveillance spéciale des patients atteints de polyarthrite rhumatoïde
Avant de commencer le traitement, un examen physique minutieux, comprenant des mesures de la pression artérielle (au moins à deux reprises) et deux taux de créatinine pour estimer la ligne de base doit être effectué. La tension artérielle et la créatinine sérique doivent être évaluées toutes les 2 semaines pendant les 3 premiers mois, puis une fois par mois si le patient est stable. Il est conseillé de surveiller la créatinine sérique et la pression artérielle toujours après une augmentation de la dose d'anti-inflammatoires non stéroïdiens (AINS) et après l'initiation d'un nouveau traitement par AINS pendant le traitement par Neoral 25 mg. En cas de co-administration avec le méthotrexate, il est recommandé de surveiller mensuellement la formule sanguine complète et les tests de la fonction hépatique (voir PRÉCAUTIONS , Général, Hypertension ).
Chez les patients recevant de la cyclosporine, la dose de Neoral doit être diminuée de 25 % à 50 % en cas d'hypertension. Si l'hypertension persiste, la dose de Neoral 100 mg doit être encore réduite ou la pression artérielle doit être contrôlée avec des agents antihypertenseurs. Dans la plupart des cas, la pression artérielle est revenue à la ligne de base lorsque la cyclosporine a été arrêtée.
Dans des essais contrôlés par placebo menés auprès de patients atteints de polyarthrite rhumatoïde, une hypertension systolique (définie comme la survenue de deux lectures de tension artérielle systolique > 140 mmHg) et une hypertension diastolique (définie comme deux lectures de tension artérielle diastolique > 90 mmHg) sont survenues chez 33 % et 19 % des patients traités par la cyclosporine, respectivement. Les taux de placebo correspondants étaient de 22 % et 8 %.
Surveillance spéciale pour les patients atteints de psoriasis
Avant d'initier le traitement, un examen dermatologique et physique minutieux, comprenant des mesures de la pression artérielle (au moins à deux reprises) doit être effectué. Étant donné que Neoral est un agent immunosuppresseur, les patients doivent être évalués pour la présence d'une infection occulte lors de leur premier examen physique et pour la présence de tumeurs initialement et tout au long du traitement par Neoral. Les lésions cutanées non typiques du psoriasis doivent être biopsiées avant de commencer Neoral. Les patients présentant des modifications cutanées malignes ou précancéreuses ne doivent être traités par Neoral 100 mg qu'après un traitement approprié de ces lésions et s'il n'existe aucune autre option thérapeutique.
Les laboratoires de base doivent inclure la créatinine sérique (à deux reprises), l'azote uréique sanguin, le CBC, le magnésium sérique, le potassium, l'acide urique et les lipides.
Le risque de néphropathie à la cyclosporine est réduit lorsque la dose initiale est faible (2,5 mg/kg/jour), la dose maximale ne dépasse pas 4,0 mg/kg/jour, la créatinine sérique est surveillée régulièrement pendant l'administration de la cyclosporine et la dose de Neoral 25 mg est diminué lorsque l'augmentation de la créatinine est supérieure ou égale à 25 % au-dessus du niveau de prétraitement du patient. L'augmentation de la créatinine est généralement réversible lors de la diminution opportune de la dose de Neoral ou de son arrêt.
La créatinine sérique et l'urée sérique doivent être évaluées toutes les 2 semaines pendant les 3 premiers mois de traitement, puis une fois par mois si le patient est stable. Si la créatinine sérique est supérieure ou égale à 25 % au-dessus du niveau de prétraitement du patient, la créatinine sérique doit être répétée dans les deux semaines. Si la variation de la créatinine sérique reste supérieure ou égale à 25 % au-dessus de la valeur initiale, Neoral 25 mg doit être réduit de 25 % à 50 %. Si à à toute heure la créatinine sérique augmente de 50 % ou plus au-dessus du niveau de prétraitement, Neoral 25 mg doit être réduit de 25 % à 50 %. Néoral doit être arrêté si la réversibilité (dans les 25 % de la valeur initiale) de la créatinine sérique n'est pas réalisable après deux modifications posologiques. Il est conseillé de surveiller la créatininémie après une augmentation de la dose d'anti-inflammatoire non stéroïdien et après l'instauration d'un nouveau traitement anti-inflammatoire non stéroïdien pendant le traitement par Neoral 25 mg.
La pression artérielle doit être évaluée toutes les 2 semaines pendant les 3 premiers mois de traitement, puis une fois par mois si le patient est stable, ou plus fréquemment lorsque des ajustements posologiques sont effectués. Chez les patients sans antécédent d'hypertension avant le début du traitement par Neoral, le médicament doit être réduit de 25 % à 50 % s'il s'avère qu'ils ont une hypertension soutenue. Si le patient continue à être hypertendu malgré de multiples réductions de Neoral 25 mg, alors Neoral doit être arrêté. Pour les patients souffrant d'hypertension traitée, avant le début du traitement par Neoral 100 mg, leur médication doit être ajustée pour contrôler l'hypertension pendant le traitement par Neoral. Néoral 100 mg doit être arrêté si une modification de la prise en charge de l'hypertension n'est pas efficace ou tolérable.
Le CBC, l'acide urique, le potassium, les lipides et le magnésium doivent également être surveillés toutes les 2 semaines pendant les 3 premiers mois de traitement, puis une fois par mois si le patient est stable ou plus fréquemment lorsque des ajustements posologiques sont effectués. La posologie de Neoral 25 mg doit être réduite de 25 % à 50 % pour toute anomalie clinique préoccupante.
Dans des essais contrôlés de cyclosporine chez des patients atteints de psoriasis, les concentrations sanguines de cyclosporine n'étaient pas bien corrélées avec une amélioration ou avec des effets secondaires tels qu'un dysfonctionnement rénal.
Tests de laboratoire
Chez tous les patients traités par la cyclosporine, les fonctions rénale et hépatique doivent être évaluées à plusieurs reprises en mesurant la créatinine sérique, l'urée, la bilirubine sérique et les enzymes hépatiques. Les lipides sériques, le magnésium et le potassium doivent également être surveillés.
Les concentrations sanguines de ciclosporine doivent être systématiquement surveillées chez les patients transplantés (voir DOSAGE ET ADMINISTRATION , Surveillance de la concentration sanguine chez les patients transplantés ), et surveillés périodiquement chez les patients atteints de polyarthrite rhumatoïde.
Carcinogenèse, mutagenèse et altération de la fertilité
Des études de cancérogénicité ont été menées chez des rats et des souris mâles et femelles. Dans l'étude de 78 semaines chez la souris, des preuves d'une tendance statistiquement significative ont été trouvées pour les lymphomes lymphocytaires chez les femelles, et l'incidence des carcinomes hépatocellulaires chez les mâles recevant la dose moyenne dépassait considérablement la valeur témoin. Dans l'étude de 24 mois chez le rat, les adénomes des cellules des îlots pancréatiques ont significativement dépassé le taux de contrôle à faible dose. Les doses utilisées dans les études sur la souris et le rat étaient de 0,01 à 0,16 fois la dose d'entretien clinique (6 mg/kg). Les carcinomes hépatocellulaires et les adénomes des îlots pancréatiques n'étaient pas liés à la dose. Des rapports publiés indiquent que le co-traitement de souris sans poils avec une irradiation UV et de la cyclosporine ou d'autres agents immunosuppresseurs raccourcit le temps de formation de tumeurs cutanées par rapport à l'irradiation UV seule.
La cyclosporine n'était pas mutagène dans les systèmes de test appropriés. La cyclosporine ne s'est pas avérée mutagène/génotoxique dans le test d'Ames, le test V79-HGPRT, le test du micronoyau chez la souris et le hamster chinois, les tests d'aberration chromosomique dans la moelle osseuse du hamster chinois, le test de létalité dominante chez la souris et le Test de réparation de l'ADN dans le sperme des souris traitées. Une étude récente analysant l'induction de l'échange de chromatides sœurs (SCE) par la cyclosporine en utilisant des lymphocytes humains in vitro a indiqué un effet positif (c'est-à-dire l'induction de SCE), à des concentrations élevées dans ce système. Dans deux études de recherche publiées, des lapins exposés à la cyclosporine in utero (10 mg/kg/jour par voie sous-cutanée) ont présenté un nombre réduit de néphrons, une hypertrophie rénale, une hypertension systémique et une insuffisance rénale progressive jusqu'à l'âge de 35 semaines. Des rats gravides qui ont reçu 12 mg/kg/jour de cyclosporine par voie intraveineuse (deux fois la dose intraveineuse recommandée chez l'humain) ont eu des fœtus avec une incidence accrue de communication interventriculaire. Ces résultats n'ont pas été démontrés chez d'autres espèces et leur pertinence pour l'homme est inconnue.
Aucune altération de la fertilité n'a été démontrée dans les études chez les rats mâles et femelles.
Une papillomatose cutanée largement distribuée a été observée après un traitement chronique de chiens avec de la cyclosporine à 9 fois la dose initiale de traitement du psoriasis humain de 2,5 mg/kg, où les doses sont exprimées sur la base de la surface corporelle. Cette papillomatose a régressé spontanément à l'arrêt de la ciclosporine.
Une incidence accrue de malignité est une complication reconnue de l'immunosuppression chez les receveurs de greffes d'organes et les patients atteints de polyarthrite rhumatoïde et de psoriasis. Les formes les plus courantes de néoplasmes sont les lymphomes non hodgkiniens et les carcinomes de la peau. Le risque de tumeurs malignes chez les receveurs de cyclosporine est plus élevé que dans la population normale en bonne santé, mais similaire à celui des patients recevant d'autres thérapies immunosuppressives. La réduction ou l'arrêt de l'immunosuppression peut faire régresser les lésions.
Chez les patients atteints de psoriasis sous cyclosporine, le développement de tumeurs malignes, en particulier celles de la peau, a été rapporté (voir AVERTISSEMENTS ). Les lésions cutanées non typiques du psoriasis doivent être biopsiées avant de commencer le traitement par la ciclosporine. Les patients présentant des modifications cutanées malignes ou précancéreuses ne doivent être traités par la ciclosporine qu'après un traitement approprié de ces lésions et s'il n'existe aucune autre option thérapeutique.
Grossesse
Des études animales ont montré une toxicité reproductive chez les rats et les lapins. La cyclosporine n'a donné aucune preuve d'effets mutagènes ou tératogènes dans les systèmes de test standard avec application orale (rats jusqu'à 17 mg/kg et lapins jusqu'à 30 mg/kg par jour par voie orale). Ce n'est qu'à des doses toxiques pour les mères que des effets indésirables ont été observés dans les études de reproduction chez le rat. La cyclosporine s'est révélée embryotoxique et fœtotoxique chez le rat et le lapin après administration orale à des doses toxiques pour la mère. Une toxicité fœtale a été notée chez les rats à 0,8 et les lapins à 5,4 fois les doses de transplantation chez l'homme de 6,0 mg/kg, où les corrections de dose sont basées sur la surface corporelle. La cyclosporine était embryotoxique et fœtotoxique, comme l'indiquent l'augmentation de la mortalité prénatale et postnatale et la réduction du poids fœtal ainsi que l'arriération squelettique connexe.
Il n'y a pas d'études adéquates et bien contrôlées chez les femmes enceintes. Par conséquent, Neoral ne doit pas être utilisé pendant la grossesse à moins que le bénéfice potentiel pour la mère ne justifie le risque potentiel pour le fœtus.
Chez les greffées enceintes qui sont traitées avec des immunosuppresseurs, le risque d'accouchement prématuré est accru. Les données suivantes représentent les résultats rapportés de 116 grossesses chez les femmes recevant de la cyclosporine pendant la grossesse, dont 90 % étaient des patientes transplantées et dont la plupart ont reçu de la cyclosporine tout au long de la période de gestation. Les seuls modèles constants d'anomalies étaient la naissance prématurée (période de gestation de 28 à 36 semaines) et le faible poids à la naissance pour l'âge gestationnel. Seize pertes fœtales sont survenues. La plupart des grossesses (85 sur 100) se sont compliquées de troubles ; y compris la prééclampsie, l'éclampsie, le travail prématuré, le décollement placentaire, l'oligohydramnios, l'incompatibilité Rh et le dysfonctionnement fœtoplacentaire. L'accouchement avant terme a eu lieu dans 47 % des cas. Sept malformations ont été rapportées chez 5 nourrissons viables et dans 2 cas de perte fœtale. Vingt-huit pour cent des nourrissons étaient petits pour l'âge gestationnel. Des complications néonatales sont survenues dans 27 %. Par conséquent, les risques et les avantages de l'utilisation de Neoral pendant la grossesse doivent être soigneusement pesés.
Un nombre limité d'observations chez les enfants exposés à la ciclosporine in utero sont disponibles, jusqu'à un âge d'environ 7 ans. La fonction rénale et la tension artérielle de ces enfants étaient normales.
En raison de la perturbation possible de l'interaction materno-fœtale, le rapport risque/bénéfice de l'utilisation de Neoral chez les patientes atteintes de psoriasis pendant la grossesse doit être soigneusement pesé en envisageant sérieusement l'arrêt de Neoral.
La teneur en alcool des formulations de Neoral 100 mg doit également être prise en compte chez la femme enceinte (voir AVERTISSEMENTS , Excipients spéciaux ).
Mères allaitantes
La ciclosporine est présente dans le lait maternel. En raison du risque d'effets indésirables graves chez les nourrissons à partir de Neoral 100 mg, une décision doit être prise d'interrompre l'allaitement ou d'arrêter le médicament, en tenant compte de l'importance du médicament pour la mère. Néoral contient de l'éthanol. L'éthanol sera présent dans le lait maternel à des niveaux similaires à ceux trouvés dans le sérum maternel et, s'il est présent dans le lait maternel, il sera absorbé par voie orale par un nourrisson (voir AVERTISSEMENTS ).
Utilisation pédiatrique
Bien qu'aucune étude adéquate et bien contrôlée n'ait été réalisée chez des enfants, des receveurs de greffe dès l'âge d'un an ont reçu Neoral sans effets indésirables inhabituels. La sécurité et l'efficacité du traitement par Neoral chez les enfants de moins de 18 ans atteints de polyarthrite rhumatoïde juvénile ou de psoriasis n'ont pas été établies.
Utilisation gériatrique
Dans les essais cliniques sur la polyarthrite rhumatoïde avec la cyclosporine, 17,5 % des patients étaient âgés de 65 ans ou plus. Ces patients étaient plus susceptibles de développer une hypertension systolique pendant le traitement et plus susceptibles de présenter des augmentations de la créatinine sérique ≥ 50 % au-dessus de la ligne de base après 3 à 4 mois de traitement.
Les études cliniques de Neoral 100 mg chez des patients transplantés et atteints de psoriasis n'ont pas inclus un nombre suffisant de sujets âgés de 65 ans et plus pour déterminer s'ils répondent différemment des sujets plus jeunes. D'autres expériences cliniques rapportées n'ont pas identifié de différences de réponse entre les patients âgés et les patients plus jeunes. En général, la sélection de la dose pour un patient âgé doit être prudente, en commençant généralement à l'extrémité inférieure de la plage posologique, reflétant la plus grande fréquence de diminution de la fonction hépatique, rénale ou cardiaque et de maladie concomitante ou d'un autre traitement médicamenteux.
SURDOSAGE
Il y a une expérience minimale avec le surdosage de cyclosporine. Les vomissements forcés et le lavage gastrique peuvent être utiles jusqu'à 2 heures après l'administration de Neoral. Une hépatotoxicité et une néphrotoxicité transitoires peuvent survenir et devraient disparaître après l'arrêt du médicament. Des doses orales de cyclosporine allant jusqu'à 10 g (environ 150 mg/kg) ont été tolérées avec des conséquences cliniques relativement mineures, telles que vomissements, somnolence, céphalées, tachycardie et, chez quelques patients, altération modérément sévère et réversible de la fonction rénale. Cependant, des symptômes graves d'intoxication ont été rapportés à la suite d'un surdosage parentéral accidentel de cyclosporine chez des nouveau-nés prématurés. Des mesures générales de soutien et un traitement symptomatique doivent être suivis dans tous les cas de surdosage. La cyclosporine n'est pas dialysable dans une grande mesure, et elle n'est pas non plus bien éliminée par l'hémoperfusion au charbon. La dose orale à laquelle on estime que la moitié des animaux de laboratoire meurent est 31 fois, 39 fois et > 54 fois la dose d'entretien humaine pour les patients transplantés (6 mg/kg ; corrections basées sur la surface corporelle) chez les souris, les rats et les lapins .
CONTRE-INDICATIONS
Général
Neoral 100 mg est contre-indiqué chez les patients présentant une hypersensibilité à la cyclosporine ou à l'un des ingrédients de la formulation.
La polyarthrite rhumatoïde
Les patients atteints de polyarthrite rhumatoïde présentant une fonction rénale anormale, une hypertension non contrôlée ou des tumeurs malignes ne doivent pas recevoir Neoral.
Psoriasis
Les patients atteints de psoriasis qui sont traités par Neoral 100 mg ne doivent pas recevoir de thérapie PUVA ou UVB concomitante, de méthotrexate ou d'autres agents immunosuppresseurs, de goudron de houille ou de radiothérapie. Les patients atteints de psoriasis présentant une fonction rénale anormale, une hypertension non contrôlée ou des tumeurs malignes ne doivent pas recevoir Neoral.
PHARMACOLOGIE CLINIQUE
La cyclosporine est un puissant agent immunosuppresseur qui, chez les animaux, prolonge la survie des greffes allogéniques impliquant la peau, les reins, le foie, le cœur, le pancréas, la moelle osseuse, l'intestin grêle et les poumons. Il a été démontré que la cyclosporine supprime une partie de l'immunité humorale et, dans une plus grande mesure, des réactions immunitaires à médiation cellulaire telles que le rejet d'allogreffe, l'hypersensibilité retardée, l'encéphalomyélite allergique expérimentale, l'arthrite adjuvante de Freund et la maladie du greffon contre l'hôte chez de nombreuses espèces animales pour une variété d'organes. .
L'efficacité de la cyclosporine résulte d'une inhibition spécifique et réversible des lymphocytes immunocompétents dans les phases G0 et G1 du cycle cellulaire. Les lymphocytes T sont préférentiellement inhibés. La cellule T-helper est la cible principale, bien que la cellule Tsuppressor puisse également être supprimée. La cyclosporine inhibe également la production et la libération de lymphokines, y compris l'interleukine-2.
Aucun effet sur la fonction phagocytaire (modifications des sécrétions enzymatiques, migration chimiotactique des granulocytes, migration des macrophages, clairance du carbone in vivo) n'a été détecté chez l'animal. La cyclosporine ne provoque pas de suppression de la moelle osseuse chez les modèles animaux ou chez l'homme.
Pharmacocinétique
L'activité immunosuppressive de la cyclosporine est principalement due à la molécule mère. Après administration orale, l'absorption de la cyclosporine est incomplète. Le degré d'absorption de la cyclosporine dépend de chaque patient, de la population de patients et de la formulation. L'élimination de la cyclosporine est principalement biliaire avec seulement 6 % de la dose (médicament mère et métabolites) excrétée dans l'urine. L'élimination de la cyclosporine à partir du sang est généralement biphasique, avec une demi-vie terminale d'environ 8,4 heures (plage de 5 à 18 heures). Après administration intraveineuse, la clairance sanguine de la cyclosporine (dosage : CLHP) est d'environ 5 à 7 mL/min/kg chez les receveurs adultes d'allogreffes rénales ou hépatiques. La clairance sanguine de la cyclosporine semble être légèrement plus lente chez les patients transplantés cardiaques.
Les capsules de gélatine molle de Neoral (capsules de cyclosporine, USP) MODIFIÉES et la solution orale de Neoral (solution orale de cyclosporine, USP) MODIFIÉES sont bioéquivalentes. Néoral 25 mg en solution buvable dilué avec du jus d'orange ou de pomme est bioéquivalent à Néoral en solution buvable dilué avec de l'eau. L'effet du lait sur la biodisponibilité de la cyclosporine administrée sous forme de solution buvable de Neoral n'a pas été évalué.
La relation entre la dose administrée et l'exposition (aire sous la courbe de concentration en fonction du temps, ASC) est linéaire dans l'intervalle de dose thérapeutique. La variabilité interindividuelle (totale, % CV) de l'exposition à la cyclosporine (AUC) lorsque Neoral ou Sandimmune est administré varie d'environ 20 % à 50 % chez les patients transplantés rénaux. Cette variabilité interindividuelle contribue au besoin d'individualisation du schéma posologique pour un traitement optimal (voir DOSAGE ET ADMINISTRATION ).
La variabilité intra-sujet de l'ASC chez les receveurs de greffe rénale (% CV) était de 9 % à 21 % pour Neoral et de 19 % à 26 % pour Sandimmune. Dans les mêmes études, la variabilité intra-sujet des concentrations minimales (% CV) était de 17 % à 30 % pour Neoral et de 16 % à 38 % pour Sandimmune.
Absorption
Neoral a une biodisponibilité accrue par rapport à Sandimmune. La biodisponibilité absolue de la cyclosporine administrée sous forme de Sandimmune dépend de la population de patients, estimée à moins de 10 % chez les patients transplantés hépatiques et pouvant atteindre 89 % chez certains patients transplantés rénaux. La biodisponibilité absolue de la cyclosporine administrée sous forme de Neoral n'a pas été déterminée chez l'adulte. Dans les études portant sur des patients transplantés rénaux, atteints de polyarthrite rhumatoïde et de psoriasis, l'ASC moyenne de la cyclosporine était supérieure d'environ 20 % à 50 % et la concentration sanguine maximale de cyclosporine Cmax était supérieure d'environ 40 % à 106 % après l'administration de Neoral 100 mg par rapport à l'administration suivante de Sandimmune. . L'ASC normalisée à la dose chez les patients transplantés hépatiques de novo ayant reçu Neoral 28 jours après la transplantation était supérieure de 50 % et la Cmax supérieure de 90 % à celles des patients ayant reçu Sandimmune. L'ASC et la Cmax sont également augmentées (Neoral par rapport à Sandimmune) chez les patients transplantés cardiaques, mais les données sont très limitées. Bien que les valeurs d'ASC et de Cmax soient plus élevées avec Neoral 100 mg par rapport à Sandimmune, les concentrations minimales prédose (normalisées en fonction de la dose) sont similaires pour les deux formulations.
Après administration orale de Neoral, le temps nécessaire pour atteindre le pic des concentrations sanguines de cyclosporine (Tmax) variait de 1,5 à 2,0 heures. L'administration de nourriture avec Neoral 25mg diminue l'AUC et la Cmax de la cyclosporine. Un repas riche en graisses (669 kcal, 45 grammes de matières grasses) consommé dans la demi-heure précédant l'administration de Neoral 25 mg a diminué l'ASC de 13 % et la Cmax de 33 %. Les effets d'un repas faible en gras (667 kcal, 15 grammes de matières grasses) étaient similaires.
L'effet du détournement de la bile par le tube en T sur l'absorption de la cyclosporine de Neoral 25 mg a été étudié chez onze patients transplantés hépatiques de novo. Lorsque les patients ont reçu Neoral avec et sans dérivation de la bile par tube en T, très peu de différence d'absorption a été observée, telle que mesurée par le changement des concentrations sanguines maximales de cyclosporine à partir des valeurs pré-dose avec le tube en T fermé par rapport au moment où il a été ouvert : 6,9 ± 41 % (plage de 55 % à 68 %).
Population de patientsDistribution
La ciclosporine est largement distribuée en dehors du volume sanguin. Le volume de distribution à l'état d'équilibre pendant l'administration intraveineuse a été rapporté comme étant de 3 à 5 L/kg chez les receveurs d'organes solides. Dans le sang, la distribution dépend de la concentration. Environ 33 % à 47 % se trouvent dans le plasma, 4 % à 9 % dans les lymphocytes, 5 % à 12 % dans les granulocytes et 41 % à 58 % dans les érythrocytes. A des concentrations élevées, la capacité de liaison des leucocytes et des érythrocytes devient saturée. Dans le plasma, environ 90 % sont liés à des protéines, principalement des lipoprotéines. La ciclosporine est excrétée dans le lait maternel (voir PRÉCAUTIONS , Mères allaitantes ).
Métabolisme
La cyclosporine est largement métabolisée par le système enzymatique du cytochrome P-450 3A dans le foie et, à un degré moindre, dans le tractus gastro-intestinal et les reins. Le métabolisme de la cyclosporine peut être altéré par l'administration concomitante de divers agents (voir PRÉCAUTIONS , INTERACTIONS MÉDICAMENTEUSES ). Au moins 25 métabolites ont été identifiés dans la bile, les matières fécales, le sang et l'urine humains. L'activité biologique des métabolites et leurs contributions à la toxicité sont considérablement inférieures à celles du composé parent. Les principaux métabolites (M1, M9 et M4N) résultent de l'oxydation aux positions 1-bêta, 9-gamma et 4-N-déméthylées, respectivement. À l'état d'équilibre après l'administration orale de Sandimmune, les ASC moyennes des concentrations sanguines de M1, M9 et M4N sont respectivement d'environ 70 %, 21 % et 7,5 % de l'ASC des concentrations sanguines de cyclosporine. Sur la base des données de concentration sanguine de patients transplantés rénaux stables (13 patients ayant reçu Neoral et Sandimmune dans une étude croisée) et des données de concentration biliaire de patients transplantés hépatiques de novo (4 patients ayant reçu Neoral 100 mg, 3 ayant reçu Sandimmune), le pourcentage de la dose présente sous forme Les métabolites M1, M9 et M4N sont similaires lorsque Neoral 25 mg ou Sandimmune est administré.
Excrétion
Seulement 0,1 % d'une dose de cyclosporine est excrété sous forme inchangée dans l'urine. L'élimination est principalement biliaire avec seulement 6 % de la dose (médicament mère et métabolites) excrétée dans les urines. Ni la dialyse ni l'insuffisance rénale ne modifient significativement la clairance de la cyclosporine.
Interactions médicamenteuses
(Voir PRÉCAUTIONS , INTERACTIONS MÉDICAMENTEUSES ) Lorsque le diclofénac ou le méthotrexate ont été co-administrés avec la cyclosporine chez des patients atteints de polyarthrite rhumatoïde, l'ASC du diclofénac et du méthotrexate a été significativement augmentée (voir PRÉCAUTIONS , INTERACTIONS MÉDICAMENTEUSES ). Aucune interaction pharmacocinétique cliniquement significative ne s'est produite entre la cyclosporine et l'aspirine, le kétoprofène, le piroxicam ou l'indométhacine.
Populations spécifiques
Insuffisance rénale
Dans une étude réalisée chez 4 sujets atteints d'insuffisance rénale terminale (clairance de la créatinine
Insuffisance hépatique
La ciclosporine est largement métabolisée par le foie. Étant donné qu'une insuffisance hépatique sévère peut entraîner une augmentation significative de l'exposition à la cyclosporine, il peut être nécessaire de réduire la posologie de la cyclosporine chez ces patients.
Population pédiatrique
Les données pharmacocinétiques des patients pédiatriques ayant reçu Neoral ou Sandimmune sont très limitées. Chez 15 patients transplantés rénaux âgés de 3 à 16 ans, la clairance sanguine totale de la cyclosporine après administration IV de Sandimmune était de 10,6 ± 3,7 mL/min/kg (dosage : RIA spécifique de Cyclo-trac). Dans une étude portant sur 7 transplantés rénaux âgés de 2 à 16 ans, la clairance de la cyclosporine variait de 9,8 à 15,5 mL/min/kg. Chez 9 patients transplantés hépatiques âgés de 0,6 à 5,6 ans, la clairance était de 9,3 ± 5,4 mL/min/kg (dosage : HPLC).
Dans la population pédiatrique, Neoral démontre également une biodisponibilité accrue par rapport à Sandimmune. Chez 7 patients transplantés hépatiques de novo âgés de 1,4 à 10 ans, la biodisponibilité absolue de Neoral était de 43 % (intervalle de 30 % à 68 %) et pour Sandimmune chez les mêmes individus, la biodisponibilité absolue était de 28 % (intervalle de 17 % à 42 %).
Population gériatrique
Comparaison des données de dose unique provenant de volontaires âgés normaux (N = 18, âge moyen 69 ans) et de patients âgés atteints de polyarthrite rhumatoïde (N = 16, âge moyen 68 ans) aux données de dose unique chez de jeunes volontaires adultes (N = 16, âge moyen 26 ans) n'ont montré aucune différence significative dans les paramètres pharmacocinétiques.
Essais cliniques
La polyarthrite rhumatoïde
L'efficacité de Sandimmune et Neoral 100 mg dans le traitement de la polyarthrite rhumatoïde sévère a été évaluée dans 5 études cliniques portant sur un total de 728 patients traités par cyclosporine et 273 patients traités par placebo.
Un résumé des résultats est présenté pour les taux de « répondeurs » par groupe de traitement, un répondeur étant défini comme un patient ayant terminé l'essai avec une amélioration de 20 % du nombre d'articulations douloureuses et enflées et une amélioration de 20 % de 2 des 4 de l'investigateur global, du patient global, de l'invalidité et des taux de sédimentation érythrocytaire (ESR) pour les études 651 et 652 et 3 sur 5 de l'investigateur global, du patient global, de l'invalidité, de la douleur visuelle analogique et de l'ESR pour les études 2008, 654 et 302.
L'étude 651 a recruté 264 patients atteints de polyarthrite rhumatoïde active avec au moins 20 articulations atteintes, qui avaient échoué à au moins un médicament majeur contre la PR, en utilisant une randomisation 3:3:2 dans l'un des trois groupes suivants : (1) cyclosporine dosée à 2,5 pour 5 mg/kg/jour, (2) méthotrexate à raison de 7,5 à 15 mg/semaine, ou (3) placebo. La durée du traitement était de 24 semaines. La dose moyenne de ciclosporine lors de la dernière visite était de 3,1 mg/kg/jour. Voir le graphique ci-dessous.
L'étude 652 a recruté 250 patients atteints de PR active avec > 6 articulations actives douloureuses ou douloureuses qui avaient échoué à au moins un médicament majeur contre la PR. Les patients ont été randomisés en utilisant une randomisation 3:3:2 dans 1 des 3 bras de traitement : (1) 1,5 à 5 mg/kg/jour de cyclosporine, (2) 2,5 à 5 mg/kg/jour de cyclosporine, et (3) placebo. La durée du traitement était de 16 semaines. La dose moyenne de cyclosporine pour le groupe 2 lors de la dernière visite était de 2,92 mg/kg/jour. Voir le graphique ci-dessous.
L'étude 2008 a recruté 144 patients atteints de PR active et > 6 articulations actives qui ont eu des traitements infructueux d'aspirine et d'or ou de pénicillamine. Les patients ont été randomisés dans 1 des 2 groupes de traitement (1) cyclosporine 2,5 à 5 mg/kg/jour avec des ajustements après le premier mois pour atteindre un niveau cible et (2) placebo. La durée du traitement était de 24 semaines. La dose moyenne de ciclosporine lors de la dernière visite était de 3,63 mg/kg/jour. Voir le graphique ci-dessous.
L'étude 654 a recruté 148 patients qui sont restés avec un nombre d'articulations actives de 6 ou plus malgré un traitement avec des doses de méthotrexate maximales tolérées pendant au moins trois mois. Les patients ont continué à prendre leur dose actuelle de méthotrexate et ont été randomisés pour recevoir, en plus, l'un des médicaments suivants : (1) cyclosporine 2,5 mg/kg/jour avec des augmentations de dose de 0,5 mg/kg/jour aux semaines 2 et 4 si il n'y avait aucun signe de toxicité et des augmentations supplémentaires de 0,5 mg/kg/jour aux semaines 8 et 16 si une diminution
L'étude 302 a recruté 299 patients atteints de PR active sévère, dont 99 % ne répondaient pas ou étaient intolérants à au moins un médicament majeur contre la PR. Les patients ont été randomisés dans 1 des 2 groupes de traitement (1) Neoral 25 mg et (2) cyclosporine, tous deux ayant débuté à 2,5 mg/kg/jour et augmentés après 4 semaines pour inefficacité par paliers de 0,5 mg/kg/jour jusqu'à un maximum de 5 mg/kg/jour et diminué à tout moment en cas de toxicité. La durée du traitement était de 24 semaines. La dose moyenne de ciclosporine lors de la dernière visite était de 2,91 mg/kg/jour (intervalle : 0,72 à 5,17) pour Néoral et de 3,27 mg/kg/jour (intervalle : 0,73 à 5,68) pour la ciclosporine. Voir le graphique ci-dessous.
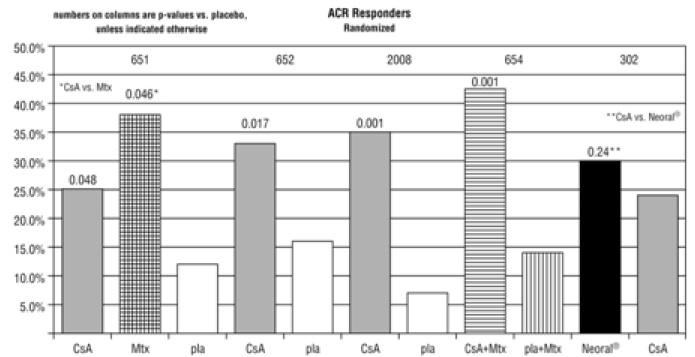
Etudes cliniques
Dans des études contrôlées, la nature, la sévérité et l'incidence des événements indésirables observés chez 493 patients transplantés traités par Neoral étaient comparables à celles observées chez 208 patients transplantés ayant reçu Sandimmune dans ces mêmes études lorsque la posologie des deux médicaments a été ajustée. pour atteindre les mêmes concentrations sanguines minimales de cyclosporine.
Sur la base de l'expérience historique avec Sandimmune, les réactions suivantes sont survenues chez 3 % ou plus des 892 patients impliqués dans des essais cliniques de transplantations rénales, cardiaques et hépatiques.
Parmi 705 patients transplantés rénaux traités avec la solution buvable de cyclosporine (Sandimmune) dans les essais cliniques, la raison de l'arrêt du traitement était une toxicité rénale chez 5,4 %, une infection chez 0,9 %, un manque d'efficacité chez 1,4 %, une nécrose tubulaire aiguë chez 1,0 %, des troubles lymphoprolifératifs chez 0,3 %, l'hypertension chez 0,3 % et d'autres raisons chez 0,7 % des patients.
Les réactions suivantes sont survenues chez 2 % ou moins des patients traités par la cyclosporine : réactions allergiques, anémie, anorexie, confusion, conjonctivite, œdème, fièvre, ongles cassants, gastrite, perte auditive, hoquet, hyperglycémie, migraine (Neoral), douleurs musculaires, ulcère peptique, thrombocytopénie, acouphènes.
Les réactions suivantes sont survenues rarement : anxiété, douleur thoracique, constipation, dépression, cheveux cassants, hématurie, douleurs articulaires, léthargie, plaies buccales, infarctus du myocarde, sueurs nocturnes, pancréatite, prurit, difficulté à avaler, picotements, saignement gastro-intestinal supérieur, troubles visuels, faiblesse, perte de poids.
Les patients recevant des thérapies immunosuppressives, y compris la cyclosporine et les régimes contenant de la cyclosporine, présentent un risque accru d'infections (virales, bactériennes, fongiques, parasitaires). Des infections généralisées et localisées peuvent survenir. Les infections préexistantes peuvent également être aggravées. Des issues fatales ont été rapportées (voir AVERTISSEMENTS ).
Expérience post-commercialisation, transplantation rénale, hépatique et cardiaque
Hépatotoxicité
Cas d'hépatotoxicité et de lésions hépatiques, y compris cholestase, jaunisse, hépatite et insuffisance hépatique ; des issues graves et/ou fatales ont été rapportées (voir AVERTISSEMENTS , Hépatotoxicité ).
Risque accru d'infections
Cas de leucoencéphalopathie multifocale progressive (LEMP) associée au virus JC, parfois mortelle ; et la néphropathie associée au virus du polyome (PVAN), en particulier le virus BK entraînant la perte du greffon ont été rapportés (voir AVERTISSEMENTS , Infection par le virus du polyome ).
Maux de tête, y compris migraine
Des cas de migraine ont été rapportés. Dans certains cas, les patients n'ont pas pu continuer la ciclosporine, cependant, la décision finale d'arrêter le traitement doit être prise par le médecin traitant après une évaluation minutieuse des bénéfices par rapport aux risques.
Douleur des membres inférieurs
Des cas isolés de douleur des membres inférieurs ont été rapportés en association avec la ciclosporine. La douleur des membres inférieurs a également été notée dans le cadre du syndrome de la douleur induite par les inhibiteurs de la calcineurine (CIPS) tel que décrit dans la littérature.
La polyarthrite rhumatoïde
Les principaux effets indésirables associés à l'utilisation de la ciclosporine dans la polyarthrite rhumatoïde sont l'insuffisance rénale (voir AVERTISSEMENTS ), hypertension (voir PRÉCAUTIONS ), céphalées, troubles gastro-intestinaux et hirsutisme/hypertrichose.
Chez les patients atteints de polyarthrite rhumatoïde traités dans les essais cliniques dans l'intervalle posologique recommandé, le traitement par la ciclosporine a été interrompu chez 5,3 % des patients en raison d'une hypertension et chez 7 % des patients en raison d'une augmentation de la créatinine. Ces changements sont généralement réversibles avec une diminution opportune de la dose ou l'arrêt du médicament. La fréquence et la gravité des élévations de la créatinine sérique augmentent avec la dose et la durée du traitement par la cyclosporine. Ces élévations sont susceptibles de devenir plus prononcées sans réduction de dose ou arrêt.
Les événements indésirables suivants sont survenus lors d'essais cliniques contrôlés :
De plus, les événements indésirables suivants ont été signalés chez 1 % à
Système nerveux autonome: bouche sèche, transpiration accrue
Corps dans son ensemble : allergie, asthénie, bouffées de chaleur, malaise, surdosage, intervention SAI*, tumeur SAI*, perte de poids, prise de poids
Cardiovasculaire: bruits cardiaques anormaux, insuffisance cardiaque, infarctus du myocarde, ischémie périphérique
Système nerveux central et périphérique : hypoesthésie, neuropathie, vertige
Endocrine: goitre
Gastro-intestinal : constipation, dysphagie, énanthème, éructation, œsophagite, ulcère gastrique, gastrite, gastro-entérite, saignement gingival, glossite, ulcère peptique, hypertrophie des glandes salivaires, trouble de la langue, trouble dentaire
Infection: abcès, infection bactérienne, cellulite, folliculite, infection fongique, herpès simplex, zona, abcès rénal, candidose, amygdalite, infection virale
Hématologique : anémie, épistaxis, leucopénie, lymphadénopathie
Système hépatique et biliaire : bilirubinémie
Métabolique et Nutritionnel : diabète sucré, hyperkaliémie, hyperuricémie, hypoglycémie
Système musculo-squelettique: arthralgie, fracture osseuse, bursite, luxation articulaire, myalgie, raideur, kyste synovial, trouble tendineux
Tumeurs : fibroadénose mammaire, carcinome
Psychiatrique: anxiété, confusion, diminution de la libido, labilité émotionnelle, troubles de la concentration, augmentation de la libido, nervosité, paronirie, somnolence
Reproducteur (femelle): douleur mammaire, hémorragie utérine
Système respiratoire: bruits thoraciques anormaux, bronchospasme
Peau et appendices : pigmentation anormale, œdème de Quincke, dermatite, peau sèche, eczéma, trouble des ongles, prurit, trouble cutané, urticaire
Sens spéciaux : vision anormale, cataracte, conjonctivite, surdité, douleur oculaire, altération du goût, acouphènes, trouble vestibulaire
Système urinaire: urine anormale, hématurie, augmentation de l'urée, urgence mictionnelle, nycturie, polyurie, pyélonéphrite, incontinence urinaire
*NOS = Non spécifié autrement
Psoriasis
Les principaux effets indésirables associés à l'utilisation de la cyclosporine chez les patients atteints de psoriasis sont la dysfonction rénale, les céphalées, l'hypertension, l'hypertriglycéridémie, l'hirsutisme/hypertrichose, la paresthésie ou l'hyperesthésie, les symptômes pseudo-grippaux, les nausées/vomissements, la diarrhée, l'inconfort abdominal, la léthargie et les troubles musculosquelettiques. ou des douleurs articulaires.
Chez les patients atteints de psoriasis traités dans des études cliniques contrôlées aux États-Unis dans l'intervalle posologique recommandé, le traitement par la cyclosporine a été interrompu chez 1,0 % des patients en raison d'une hypertension et chez 5,4 % des patients en raison d'une augmentation de la créatinine. Dans la majorité des cas, ces modifications étaient réversibles après réduction de la dose ou arrêt de la ciclosporine.
Il y a eu un décès associé à l'utilisation de la cyclosporine dans le psoriasis. Un homme de 27 ans a développé une détérioration rénale et a été poursuivi sous cyclosporine. Il souffrait d'une insuffisance rénale progressive entraînant la mort.
La fréquence et la sévérité de la créatinine sérique augmentent avec la dose et la durée du traitement par la cyclosporine. Ces élévations sont susceptibles de devenir plus prononcées et peuvent entraîner des lésions rénales irréversibles sans réduction de dose ou arrêt.
Les événements suivants sont survenus chez 1 % à moins de 3 % des patients atteints de psoriasis traités par la cyclosporine :
Corps dans son ensemble : fièvre, bouffées vasomotrices, bouffées de chaleur
Cardiovasculaire: douleur thoracique
Système nerveux central et périphérique : augmentation de l'appétit, insomnie, étourdissements, nervosité, vertiges
Gastro-intestinal : distension abdominale, constipation, saignement gingival
Système hépatique et biliaire : hyperbilirubinémie
Tumeurs : tumeurs malignes de la peau [carcinomes épidermoïdes (0,9 %) et basocellulaires (0,4 %)]
Réticuloendothélial : troubles des plaquettes, des saignements et de la coagulation, trouble des globules rouges
Respiratoire: infection, infection virale et autre
Peau et appendices : acné, folliculite, kératose, prurit, rash, peau sèche
Système urinaire: fréquence de miction
Vision: vision anormale
Une hypomagnésémie et une hyperkaliémie légères peuvent survenir mais sont asymptomatiques. Des augmentations de l'acide urique peuvent survenir et des crises de goutte ont été rarement rapportées. Une hyperbilirubinémie mineure et liée à la dose a été observée en l'absence de lésions hépatocellulaires. Le traitement par la cyclosporine peut être associé à une légère augmentation des triglycérides sériques ou du cholestérol. Des élévations des triglycérides (> 750 mg/dL) surviennent chez environ 15 % des patients atteints de psoriasis ; des élévations du cholestérol (> 300 mg/dL) sont observées chez moins de 3 % des patients atteints de psoriasis. Généralement, ces anomalies de laboratoire sont réversibles lors de la réduction de la dose ou de l'arrêt de la cyclosporine.
Expérience post-commercialisation, Psoriasis
Des cas de transformation en psoriasis érythrodermique ou en psoriasis pustuleux généralisé lors de l'arrêt ou de la réduction de la cyclosporine chez des patients atteints de psoriasis en plaques chronique ont été rapportés.
INFORMATIONS PATIENTS
Les patients doivent être informés que toute modification de la formulation de la cyclosporine doit être effectuée avec prudence et uniquement sous la surveillance d'un médecin, car elle peut nécessiter une modification de la posologie.
Les patients doivent être informés de la nécessité de tests de laboratoire répétés pendant qu'ils reçoivent de la cyclosporine. Les patientes doivent être averties des risques potentiels pendant la grossesse et informées du risque accru de néoplasie. Les patients doivent également être informés du risque d'hypertension et de dysfonctionnement rénal.
Les patients doivent être informés que pendant le traitement par la ciclosporine, la vaccination peut être moins efficace et l'utilisation de vaccins vivants atténués doit être évitée.
Les patients doivent recevoir des instructions de dosage précises. La solution orale de Neoral (solution orale de cyclosporine, USP) MODIFIÉE doit être diluée, de préférence avec du jus d'orange ou de pomme à température ambiante. La combinaison de Neoral Solution Orale (solution buvable de cyclosporine, USP) MODIFIÉE avec du lait peut être désagréable au goût.
Il doit être conseillé aux patients de prendre Neoral 100 mg selon un horaire cohérent en ce qui concerne l'heure de la journée et la relation avec les repas. Le pamplemousse et le jus de pamplemousse affectent le métabolisme, augmentant la concentration sanguine de cyclosporine, et doivent donc être évités.
