Naprosyn 250mg, 500mg Naproxen Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Naprosyn 500 mg et comment est-il utilisé ?
Naprosyn 250 mg est un médicament délivré sur ordonnance utilisé pour traiter les symptômes de douleur ou d'inflammation causés par l'arthrite, la spondylarthrite ankylosante, la tendinite, la bursite, la goutte ou les crampes menstruelles. Naprosyn peut être utilisé seul ou avec d'autres médicaments.
Naprosyn 250 mg est un médicament anti-inflammatoire non stéroïdien (AINS).
On ne sait pas si Naprosyn est sûr et efficace chez les enfants de moins de 2 ans.
Quels sont les effets secondaires possibles de Naprosyn ?
Naprosyn peut provoquer des effets secondaires graves, notamment :
- essoufflement,
- gonflement ou prise de poids rapide,
- éruption cutanée ou cloques,
- selles sanglantes ou goudronneuses,
- crachats de sang ou de vomi ressemblant à du marc de café,
- nausée,
- douleurs dans le haut du ventre,
- perte d'appétit,
- urine foncée,
- selles de couleur argile,
- jaunissement de la peau ou des yeux (jaunisse),
- peu ou pas de miction,
- miction douloureuse,
- gonflement des pieds ou des chevilles,
- anémie (faible nombre de globules rouges),
- peau pâle,
- fatigue ,
- se sentir étourdi, et
- mains ou pieds froids
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Naprosyn comprennent :
- mal de tête,
- indigestion,
- brûlures d'estomac, et
- symptômes de la grippe
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Naprosyn. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
ATTENTION
RISQUE D'ÉVÉNEMENTS CARDIO-VASCULAIRES ET GASTRO-INTESTINAUX GRAVES
Événements thrombotiques cardiovasculaires
- Les anti-inflammatoires non stéroïdiens (AINS) entraînent un risque accru d'événements thrombotiques cardiovasculaires graves, notamment d'infarctus du myocarde et d'accident vasculaire cérébral, qui peuvent être mortels. Ce risque peut survenir au début du traitement et peut augmenter avec la durée d'utilisation [voir MISES EN GARDE ET PRÉCAUTIONS].
- Les comprimés NAPROSYN, EC-NAPROSYN et ANAPROX DS sont contre-indiqués dans le cadre d'un pontage aortocoronarien (PAC) [voir CONTRE-INDICATIONS, MISES EN GARDE ET PRÉCAUTIONS].
Saignement gastro-intestinal, ulcération et perforation
- Les AINS entraînent un risque accru d'effets indésirables gastro-intestinaux (GI) graves, notamment des saignements, des ulcérations et des perforations de l'estomac ou des intestins, qui peuvent être fatals. Ces événements peuvent survenir à tout moment pendant l'utilisation et sans symptômes d'avertissement. Les patients âgés et les patients ayant des antécédents d'ulcère peptique et/ou d'hémorragie gastro-intestinale sont plus à risque d'événements gastro-intestinaux graves [voir MISES EN GARDE ET PRÉCAUTIONS].
LA DESCRIPTION
Les comprimés NAPROSYN (naproxène), les comprimés à libération retardée EC-NAPROSYN (naproxène) et les comprimés ANAPROX DS (naproxène sodique) sont des anti-inflammatoires non stéroïdiens disponibles comme suit : les comprimés NAPROSYN à 250 mg sont disponibles sous forme de comprimés jaunes contenant 500 mg de naproxène pour administration orale. .
Les comprimés à libération retardée EC-NAPROSYN sont disponibles sous forme de comprimés blancs à enrobage entérique contenant 375 mg de naproxène ou 500 mg de naproxène pour administration orale.
Les comprimés ANAPROX DS sont disponibles sous forme de comprimés bleu foncé contenant 550 mg de naproxène sodique pour administration orale.
Le naproxène est un dérivé de l'acide propionique apparenté au groupe des acides arylacétiques des anti-inflammatoires non stéroïdiens. Les noms chimiques du naproxène et du naproxène sodique sont l'acide (S)-6-méthoxy-α-méthyl-2-naphtalèneacétique et l'acide (S)-6méthoxy-α-méthyl-2-naphtalèneacétique, sel de sodium, respectivement. Le naproxène a un poids moléculaire de 230,26 et une formule moléculaire de C14H14O3. Le naproxène sodique a un poids moléculaire de 252,23 et une formule moléculaire de C14H13NaO3. Le naproxène et le naproxène sodique ont respectivement les structures suivantes :
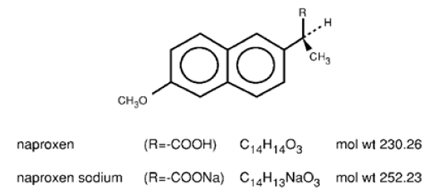
Le naproxène est une substance cristalline inodore, blanche à blanc cassé. Il est liposoluble, pratiquement insoluble dans l'eau à faible pH et librement soluble dans l'eau à pH élevé. Le coefficient de partage octanol/eau du naproxène à pH 7,4 est de 1,6 à 1,8. Le naproxène sodique est un solide cristallin blanc à blanc crème, facilement soluble dans l'eau à pH neutre.
Les ingrédients inactifs contenus dans les comprimés NAPROSYN 250 mg comprennent : la croscarmellose sodique, les oxydes de fer, la povidone et le stéarate de magnésium.
Les ingrédients inactifs contenus dans les comprimés à libération retardée EC-NAPROSYN comprennent : la croscarmellose sodique, la povidone et le stéarate de magnésium. La dispersion d'enrobage entérique contient un copolymère d'acide méthacrylique, du talc, du citrate de triéthyle, de l'hydroxyde de sodium et de l'eau purifiée. L'impression sur les comprimés est à l'encre noire. La dissolution de ce comprimé de naproxène à enrobage entérique dépend du pH avec une dissolution rapide au-dessus de pH 6. Il n'y a pas de dissolution en dessous de pH 4.
Les ingrédients inactifs des comprimés ANAPROX DS comprennent : stéarate de magnésium, cellulose microcristalline, povidone et talc. La suspension de revêtement peut contenir de l'hydroxypropylméthylcellulose 2910, de l'Opaspray K-1-4227, du polyéthylène glycol 8000 ou de l'Opadry YS-1-4216.
LES INDICATIONS
Les comprimés NAPROSYN 500 mg, EC-NAPROSYN 250 mg et ANAPROX DS sont indiqués pour :
le soulagement des signes et symptômes de :
- la polyarthrite rhumatoïde
- arthrose
- spondylarthrite ankylosante
- Arthrite juvénile idiopathique polyarticulaire
Les comprimés NAPROSYN et ANAPROX DS sont également indiqués pour :
le soulagement des signes et symptômes de :
- tendinite
- bursite
- goutte aiguë
la gestion de :
- la douleur
- dysménorrhée primaire
DOSAGE ET ADMINISTRATION
Instructions générales de dosage
Examinez attentivement les avantages et les risques potentiels des comprimés NAPROSYN, EC-NAPROSYN et ANAPROX DS et des autres options de traitement avant de décider d'utiliser les comprimés NAPROSYN 250 mg, EC-NAPROSYN 500 mg et ANAPROX DS. Utiliser la dose efficace la plus faible pendant la durée la plus courte compatible avec les objectifs de traitement individuels du patient [voir AVERTISSEMENTS ET PRECAUTIONS ].
Après avoir observé la réponse au traitement initial avec les comprimés NAPROSYN 250 mg, EC-NAPROSYN 500 mg ou ANAPROX DS, la dose et la fréquence doivent être ajustées en fonction des besoins individuels du patient.
Pour maintenir l'intégrité de l'enrobage entérique, le comprimé EC-NAPPROSYN ne doit pas être cassé, écrasé ou mâché pendant l'ingestion.
Les produits contenant du naproxène tels que NAPROSYN 500 mg, EC-NAPROSYN 250 mg et ANAPROX DS, et d'autres produits à base de naproxène ne doivent pas être utilisés simultanément car ils circulent tous dans le plasma sous forme d'anion naproxène.
Polyarthrite rhumatoïde, arthrose et spondylarthrite ankylosante
Les doses recommandées de comprimés NAPROSYN 500 mg, ANAPROX DS et EC-NAPROSYN 250 mg sont indiquées dans le tableau 1.
Lors d'une administration à long terme, la dose de naproxène peut être ajustée à la hausse ou à la baisse en fonction de la réponse clinique du patient. Une dose quotidienne plus faible peut suffire pour une administration à long terme.
Les doses du matin et du soir ne doivent pas nécessairement être égales en taille et l'administration du médicament plus fréquemment que deux fois par jour ne fait généralement pas de différence dans la réponse.
Chez les patients qui tolèrent bien des doses plus faibles, la dose peut être augmentée à 1500 mg/jour de naproxène pendant des périodes limitées allant jusqu'à 6 mois lorsqu'un niveau plus élevé d'activité anti-inflammatoire/analgésique est requis. Lors du traitement de tels patients avec du naproxène 1500 mg/jour, le médecin doit observer une augmentation suffisante des bénéfices cliniques pour compenser le risque accru potentiel.
Arthrite juvénile idiopathique polyarticulaire
Les formes posologiques orales solides de naproxen peuvent ne pas permettre la titration de dose flexible nécessaire chez les patients pédiatriques atteints d'arthrite juvénile idiopathique polyarticulaire. Une formulation liquide peut être plus appropriée pour un dosage basé sur le poids et en raison du besoin de flexibilité de dose chez les enfants.
Chez les patients pédiatriques, des doses de 5 mg/kg/jour ont produit des taux plasmatiques de naproxène similaires à ceux observés chez les adultes prenant 500 mg de naproxène [voir PHARMACOLOGIE CLINIQUE ]. La dose quotidienne totale recommandée de naproxène est d'environ 10 mg/kg administrée en 2 doses fractionnées. L'administration de comprimés NAPROSYN n'est pas appropriée pour les enfants pesant moins de 50 kilogrammes.
Prise en charge de la douleur, de la dysménorrhée primaire, de la tendinite aiguë et de la bursite
La dose initiale recommandée de comprimés ANAPROX DS (naproxène sodique) est de 550 mg, suivie de 550 mg toutes les 12 heures ou de 275 mg (la moitié d'un comprimé de 550 mg) toutes les 6 à 8 heures, au besoin. La dose quotidienne totale initiale ne doit pas dépasser 1375 mg (deux comprimés et demi) de naproxène sodique. Par la suite, la dose quotidienne totale ne doit pas dépasser 1100 mg de naproxène sodique. Étant donné que le sel de sodium du naproxène est absorbé plus rapidement, ANAPROX DS est recommandé pour la prise en charge des affections douloureuses aiguës lorsqu'un soulagement rapide de la douleur est souhaité. Les comprimés NAPROSYN peuvent également être utilisés. La dose initiale recommandée de comprimés NAPROSYN est de 500 mg suivie de 250 mg (la moitié d'un comprimé de NAPROSYN à 500 mg) toutes les 6 à 8 heures selon les besoins. La dose quotidienne totale ne doit pas dépasser 1250 mg de naproxène.
EC-NAPROSYN 250 mg n'est pas recommandé pour le traitement initial de la douleur aiguë car l'absorption du naproxène est retardée par rapport aux autres produits contenant du naproxène [voir PHARMACOLOGIE CLINIQUE ].
Goutte aiguë
La dose initiale recommandée est de 750 mg (un comprimé et demi) de comprimés NAPROSYN 250 mg suivis de 250 mg (un demi-comprimé) toutes les 8 heures jusqu'à ce que la crise se soit calmée. ANAPROX DS peut également être utilisé à une dose initiale de 825 mg (un comprimé et demi) suivie de 275 mg (un demi-comprimé) toutes les 8 heures. EC-NAPROSYN n'est pas recommandé en raison du retard d'absorption.
Non-interchangeabilité avec d'autres formulations de naproxen
Les différents dosages et formulations (p. ex., comprimés, suspension) de naproxène ne sont pas interchangeables. Cette différence doit être prise en compte lors du changement de concentration ou de formulation.
COMMENT FOURNIE
Formes posologiques et points forts
Comprimés NAPROSYN® (naproxène) : 500 mg : jaune, en forme de capsule, gravé NPR LE 500 sur une face et sécable sur l'autre.
EC-NAPROSYN® (naproxène) comprimés à libération retardée : 375 mg : comprimés enrobés blancs, ovales et biconvexes portant l'inscription NPR EC 375 sur une face.
Comprimés à libération retardée EC-NAPROSYN® (naproxène) : 500 mg : comprimés pelliculés blancs et oblongs portant l'inscription NPR EC 500 sur une face.
Comprimés ANAPROX® DS (naproxène sodique) : 550 mg : bleu foncé, de forme oblongue, gravé NPS 550 sur une face et sécable sur les deux faces.
Stockage et manutention
NAPROSYN (naproxène) comprimés 500 mg : comprimés jaunes en forme de capsule, gravés NPR LE 500 sur une face et sécables sur l'autre. Conditionné en flacons résistants à la lumière de 100. Fourni en :
CDN 69437-316-01 100 (bouteille)
Conserver entre 15 °C et 30 °C (59 °F et 86 °F) dans des contenants bien fermés ; distribuer dans des récipients résistants à la lumière.
EC-NAPROSYN (naproxène) comprimés à libération retardée 375 mg : comprimés enrobés blancs, ovales, biconvexes, portant l'inscription NPR EC 375 sur une face. Conditionné en flacons résistants à la lumière de 100. Fourni en :
CDN 69437-415-01 100 (bouteille)
500mg comprimés enrobés blancs, oblongs, portant l'inscription NPR EC 500 sur une face. Conditionné en flacons résistants à la lumière de 100. Fourni en :
CDN 69437-416-01 100 (bouteille)
Conserver entre 15 °C et 30 °C (59 °F et 86 °F) dans des contenants bien fermés ; distribuer dans des récipients résistants à la lumière.
ANAPROX DS (naproxène sodique) Comprimés 550 mg : comprimés bleu foncé, de forme oblongue, gravés NPS 550 sur une face et sécables sur les deux faces. Conditionné en flacons de 100. Fourni en :
CDN 69437-203-01 100 (bouteille)
Conserver à 15° à 30°C (59° à 86°F) dans des récipients bien fermés.
Fabriqué pour : Atnahs Pharma, Miles Gray Road, Basildon, Essex, SS14 3FR, Royaume-Uni. Distribué par : Canton Laboratories, LLC., Alpharetta, GA 30004-5945, États-Unis. Révisé : avril 2021
EFFETS SECONDAIRES
Les effets indésirables suivants sont discutés plus en détail dans d'autres sections de l'étiquetage :
- Événements thrombotiques cardiovasculaires [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Saignement gastro-intestinal, ulcération et perforation [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Hépatotoxicité [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Hypertension [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Insuffisance cardiaque et œdème [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Toxicité rénale et hyperkaliémie [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Réactions anaphylactiques [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Réactions cutanées graves [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Toxicité hématologique [voir AVERTISSEMENTS ET PRECAUTIONS ]
Expérience des essais cliniques
Étant donné que les essais cliniques sont menés dans des conditions très variables, les taux d'effets indésirables observés dans les essais cliniques d'un médicament ne peuvent pas être directement comparés aux taux des essais cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique.
Les effets indésirables signalés dans les essais cliniques contrôlés chez 960 patients traités pour une polyarthrite rhumatoïde ou une arthrose sont énumérés ci-dessous. En général, les réactions chez les patients traités de manière chronique ont été signalées 2 à 10 fois plus fréquemment que dans les études à court terme chez les 962 patients traités pour des douleurs légères à modérées ou pour une dysménorrhée. Les plaintes les plus fréquemment rapportées concernaient le tractus gastro-intestinal.
Une étude clinique a révélé que les réactions gastro-intestinales étaient plus fréquentes et plus graves chez les patients atteints de polyarthrite rhumatoïde prenant des doses quotidiennes de 1500 mg de naproxène par rapport à ceux prenant 750 mg de naproxène.
Lors d'essais cliniques contrôlés menés auprès d'environ 80 patients pédiatriques et d'études ouvertes bien contrôlées menées auprès d'environ 400 patients pédiatriques atteints d'arthrite juvénile idiopathique polyarticulaire traités par naproxène, l'incidence des éruptions cutanées et des temps de saignement prolongés était plus élevée, l'incidence des affections gastro-intestinales et centrales les réactions du système nerveux étaient à peu près les mêmes et l'incidence des autres réactions était plus faible chez les patients pédiatriques que chez les adultes.
Chez les patients prenant du naproxène dans les essais cliniques, les effets indésirables les plus fréquemment rapportés chez environ 1 % à 10 % des patients étaient :
Expériences gastro-intestinales (GI), y compris : brûlures d'estomac*, douleurs abdominales*, nausées*, constipation*, diarrhée, dyspepsie, stomatite
Système nerveux central: maux de tête*, étourdissements*, somnolence*, étourdissements, vertiges
Dermatologique : prurit (démangeaisons)*, éruptions cutanées*, ecchymoses*, sudation, purpura
Sens spéciaux : acouphènes*, troubles visuels, troubles auditifs
Cardiovasculaire: œdème*, palpitations
Général: dyspnée*, soif
*Incidence des réactions rapportées entre 3 % et 9 %. Les réactions survenant chez moins de 3 % des patients ne sont pas marquées.
Chez les patients prenant des AINS, les effets indésirables suivants ont également été signalés chez environ 1 % à 10 % des patients.
Expériences gastro-intestinales (GI), y compris : flatulences, saignement/perforation macroscopique, ulcères gastro-intestinaux (gastriques/duodénaux), vomissements
Général: fonction rénale anormale, anémie, élévation des enzymes hépatiques, augmentation du temps de saignement, éruptions cutanées
Les éléments suivants sont des effets indésirables supplémentaires rapportés chez
Gastro-intestinal : pancréatite, vomissements
Hépatobiliaire : jaunisse
Hémique et Lymphatique : méléna, thrombocytopénie, agranulocytose
Système nerveux: incapacité à se concentrer
Dermatologique : éruptions cutanées
Expérience post-commercialisation
Les effets indésirables suivants ont été identifiés lors de l'utilisation post-approbation du naproxène. Étant donné que ces réactions sont signalées volontairement par une population de taille incertaine, il n'est pas toujours possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale avec l'exposition au médicament.
Les éléments suivants sont des effets indésirables supplémentaires rapportés chez
Corps dans son ensemble : réactions anaphylactoïdes, œdème de Quincke, troubles menstruels, pyrexie (frissons et fièvre)
Cardiovasculaire: insuffisance cardiaque congestive, vascularite, hypertension, œdème pulmonaire
Gastro-intestinal : inflammation, saignement (parfois mortel, en particulier chez les personnes âgées), ulcération, perforation et obstruction du tractus gastro-intestinal supérieur ou inférieur. Oesophagite, stomatite, hématémèse, colite, exacerbation de maladies inflammatoires de l'intestin (colite ulcéreuse, maladie de Crohn).
Hépatobiliaire : anomalies des tests de la fonction hépatique, hépatite (certains cas ont été mortels)
Hémique et Lymphatique : éosinophilie, leucopénie, granulocytopénie, anémie hémolytique, anémie aplasique
Métabolique et Nutritionnel : hyperglycémie, hypoglycémie
Système nerveux: dépression, troubles des rêves, insomnie, malaise, myalgie, faiblesse musculaire, méningite aseptique, dysfonctionnement cognitif, convulsions
Respiratoire: pneumonie à éosinophiles, asthme
Dermatologique : alopécie, urticaire, nécrolyse épidermique toxique, érythème polymorphe, érythème noueux, éruption médicamenteuse fixe, lichen plan, réaction pustuleuse, lupus érythémateux disséminé, réactions bulleuses, y compris syndrome de Stevens-Johnson, dermatite photosensible, réactions de photosensibilité, y compris de rares cas ressemblant à la porphyrie cutanée tardive (pseudoporphyrie) ou épidermolyse bulleuse. En cas de fragilité cutanée, de cloques ou d'autres symptômes évoquant une pseudoporphyrie, le traitement doit être interrompu et le patient surveillé.
Sens spéciaux : déficience auditive, opacité cornéenne, papillite, névrite optique rétrobulbaire, œdème papillaire
Urogénital: néphrite glomérulaire, hématurie, hyperkaliémie, néphrite interstitielle, syndrome néphrotique, maladie rénale, insuffisance rénale, nécrose papillaire rénale, élévation de la créatinine sérique
Reproduction (femelle): infertilité
Chez les patients prenant des AINS, les effets indésirables suivants ont également été rapportés chez
Corps dans son ensemble : fièvre, infection, septicémie, réactions anaphylactiques, changements d'appétit, décès
Cardiovasculaire: hypertension, tachycardie, syncope, arythmie, hypotension, infarctus du myocarde
Gastro-intestinal : bouche sèche, œsophagite, ulcères gastriques/peptiques, gastrite, glossite, éructation
Hépatobiliaire : hépatite, insuffisance hépatique
Hémique et Lymphatique : saignement rectal, lymphadénopathie, pancytopénie
Métabolique et Nutritionnel : changements de poids
Système nerveux: anxiété, asthénie, confusion, nervosité, paresthésie, somnolence, tremblements, convulsions, coma, hallucinations
Respiratoire: asthme, dépression respiratoire, pneumonie
Dermatologique : dermatite exfoliative
Sens spéciaux : vision floue, conjonctivite
Urogénital: cystite, dysurie, oligurie/polyurie, protéinurie
INTERACTIONS MÉDICAMENTEUSES
Voir le tableau 1 pour les interactions médicamenteuses cliniquement significatives avec le naproxène.
Interactions médicament/test de laboratoire
AVERTISSEMENTS
Inclus dans le cadre du PRÉCAUTIONS section.
PRÉCAUTIONS
Événements thrombotiques cardiovasculaires
Des essais cliniques portant sur plusieurs AINS sélectifs et non sélectifs de la COX-2 d'une durée pouvant aller jusqu'à trois ans ont montré un risque accru d'événements thrombotiques cardiovasculaires (CV) graves, notamment d'infarctus du myocarde (IM) et d'accident vasculaire cérébral, qui peuvent être mortels. Sur la base des données disponibles, il n'est pas clair que le risque d'événements thrombotiques CV soit similaire pour tous les AINS. L'augmentation relative des événements thrombotiques CV graves par rapport au niveau de référence conférée par l'utilisation d'AINS semble être similaire chez les personnes avec et sans maladie CV connue ou facteurs de risque de maladie CV. Cependant, les patients présentant une maladie CV ou des facteurs de risque connus présentaient une incidence absolue plus élevée d'événements thrombotiques CV graves en excès, en raison de leur taux de base plus élevé. Certaines études observationnelles ont montré que ce risque accru d'événements thrombotiques CV graves commençait dès les premières semaines de traitement. L'augmentation du risque thrombotique CV a été observée le plus systématiquement à des doses plus élevées.
Pour minimiser le risque potentiel d'événement CV indésirable chez les patients traités par AINS, utiliser la dose efficace la plus faible pendant la durée la plus courte possible. Les médecins et les patients doivent rester attentifs à l'apparition de tels événements, tout au long du traitement, même en l'absence de symptômes CV antérieurs. Les patients doivent être informés des symptômes des événements CV graves et des mesures à prendre s'ils surviennent.
Il n'existe aucune preuve cohérente que l'utilisation concomitante d'aspirine atténue le risque accru d'événements thrombotiques CV graves associés à l'utilisation d'AINS. L'utilisation concomitante d'aspirine et d'un AINS, tel que le naproxène, augmente le risque d'événements gastro-intestinaux (GI) graves.
Chirurgie post pontage aortocoronarien (CABG)
Deux grands essais cliniques contrôlés d'un AINS sélectif de la COX-2 pour le traitement de la douleur au cours des 10 à 14 premiers jours suivant la chirurgie CABG ont révélé une incidence accrue d'infarctus du myocarde et d'accident vasculaire cérébral. Les AINS sont contre-indiqués dans le cadre d'un PAC [voir CONTRE-INDICATIONS ].
Patients post-IM
Des études observationnelles menées dans le registre national danois ont démontré que les patients traités par AINS dans la période post-IM présentaient un risque accru de récidive d'infarctus, de décès d'origine CV et de mortalité toutes causes confondues dès la première semaine de traitement. Dans cette même cohorte, l'incidence des décès au cours de la première année suivant l'IM était de 20 pour 100 années-personnes chez les patients traités par AINS contre 12 pour 100 années-personnes chez les patients non exposés aux AINS. Bien que le taux absolu de décès ait quelque peu diminué après la première année après l'infarctus du myocarde, le risque relatif accru de décès chez les utilisateurs d'AINS a persisté pendant au moins les quatre années de suivi suivantes.
Éviter l'utilisation des comprimés NAPROSYN, EC-NAPROSYN et ANAPROX DS chez les patients ayant récemment subi un IM, à moins que les avantages ne l'emportent sur le risque d'événements thrombotiques CV récurrents. Si les comprimés NAPROSYN 250 mg, EC-NAPROSYN et ANAPROX DS sont utilisés chez des patients ayant récemment subi un IDM, surveiller les patients pour détecter tout signe d'ischémie cardiaque.
Saignement gastro-intestinal, ulcération et perforation
Les AINS, y compris le naproxène, provoquent des effets indésirables gastro-intestinaux (GI) graves, notamment une inflammation, des saignements, une ulcération et une perforation de l'œsophage, de l'estomac, de l'intestin grêle ou du gros intestin, qui peuvent être fatals. Ces événements indésirables graves peuvent survenir à tout moment, avec ou sans symptômes précurseurs, chez les patients traités par AINS.
Seul un patient sur cinq qui développe un événement indésirable gastro-intestinal supérieur grave sous traitement par AINS est symptomatique. Des ulcères gastro-intestinaux supérieurs, des saignements macroscopiques ou des perforations causés par les AINS sont survenus chez environ 1 % des patients traités pendant 3 à 6 mois et chez environ 2 % à 4 % des patients traités pendant un an. Cependant, même un traitement à court terme par AINS n'est pas sans risque.
Facteurs de risque de saignement gastro-intestinal, d'ulcération et de perforation
Les patients ayant des antécédents d'ulcère peptique et/ou d'hémorragie gastro-intestinale qui utilisaient des AINS avaient un risque plus de 10 fois plus élevé de développer une hémorragie gastro-intestinale par rapport aux patients sans ces facteurs de risque. D'autres facteurs qui augmentent le risque d'hémorragie gastro-intestinale chez les patients traités avec des AINS comprennent une durée plus longue du traitement par AINS ; utilisation concomitante de corticostéroïdes oraux, d'aspirine, d'anticoagulants ou d'inhibiteurs sélectifs de la recapture de la sérotonine (ISRS) ; fumeur; Utilisation d'alcool; âge avancé; et un mauvais état de santé général. La plupart des rapports post-commercialisation d'événements gastro-intestinaux mortels sont survenus chez des patients âgés ou affaiblis. De plus, les patients atteints d'une maladie hépatique avancée et/ou d'une coagulopathie présentent un risque accru d'hémorragie gastro-intestinale.
Stratégies pour minimiser les risques gastro-intestinaux chez les patients traités par AINS
- Utilisez la dose efficace la plus faible pendant la durée la plus courte possible.
- Évitez l'administration de plus d'un AINS à la fois.
- Éviter l'utilisation chez les patients à risque plus élevé à moins que les bénéfices attendus ne l'emportent sur le risque accru de saignement. Pour ces patients, ainsi que ceux présentant des saignements gastro-intestinaux actifs, envisagez des thérapies alternatives autres que les AINS.
- Restez attentif aux signes et symptômes d'ulcération et de saignement gastro-intestinaux pendant le traitement par AINS.
- Si un événement indésirable gastro-intestinal grave est suspecté, initier rapidement une évaluation et un traitement, et interrompre les comprimés NAPROSYN, EC-NAPROSYN ou ANAPROX DS jusqu'à ce qu'un événement indésirable gastro-intestinal grave soit exclu.
- Dans le cadre de l'utilisation concomitante d'aspirine à faible dose pour la prophylaxie cardiaque, surveiller de plus près les patients afin de déceler tout signe d'hémorragie gastro-intestinale [voir INTERACTIONS MÉDICAMENTEUSES ].
Hépatotoxicité
Des élévations de l'ALT ou de l'AST (trois fois ou plus la limite supérieure de la normale [LSN]) ont été signalées chez environ 1 % des patients traités par AINS dans les essais cliniques. De plus, des cas rares, parfois mortels, d'atteinte hépatique grave, y compris une hépatite fulminante, une nécrose hépatique et une insuffisance hépatique, ont été signalés.
Des élévations de l'ALT ou de l'AST (moins de trois fois la LSN) peuvent survenir chez jusqu'à 15 % des patients traités par des AINS, y compris le naproxène.
Informer les patients des signes avant-coureurs et des symptômes d'hépatotoxicité (p. ex., nausées, fatigue, léthargie, diarrhée, prurit, jaunisse, sensibilité du quadrant supérieur droit et symptômes « pseudo-grippaux »). Si des signes cliniques et des symptômes compatibles avec une maladie du foie se développent ou si des manifestations systémiques surviennent (par exemple, éosinophilie, éruption cutanée, etc.), arrêtez immédiatement NAPROSYN 500 mg comprimés, EC-NAPROSYN 250 mg ou ANAPROX DS et effectuez une évaluation clinique du patient. .
Hypertension
Les AINS, y compris les comprimés NAPROSYN 250 mg, EC-NAPROSYN et ANAPROX DS, peuvent entraîner une nouvelle apparition d'hypertension ou une aggravation d'une hypertension préexistante, l'un ou l'autre pouvant contribuer à l'augmentation de l'incidence des événements CV. Les patients prenant des inhibiteurs de l'enzyme de conversion de l'angiotensine (ECA), des diurétiques thiazidiques ou des diurétiques de l'anse peuvent présenter une réponse altérée à ces traitements lorsqu'ils prennent des AINS [voir INTERACTIONS MÉDICAMENTEUSES ].
Surveiller la tension artérielle (TA) au début du traitement par AINS et tout au long du traitement.
Insuffisance cardiaque et œdème
La méta-analyse Coxib and traditional NSAID Trialists' Collaboration d'essais contrôlés randomisés a démontré une augmentation d'environ deux fois des hospitalisations pour insuffisance cardiaque chez les patients traités sélectivement par COX-2 et les patients traités par AINS non sélectifs par rapport aux patients traités par placebo. Dans une étude du registre national danois sur des patients souffrant d'insuffisance cardiaque, l'utilisation d'AINS a augmenté le risque d'infarctus du myocarde, d'hospitalisation pour insuffisance cardiaque et de décès.
De plus, une rétention hydrique et un œdème ont été observés chez certains patients traités par AINS. L'utilisation de naproxène peut atténuer les effets CV de plusieurs agents thérapeutiques utilisés pour traiter ces affections médicales (par exemple, les diurétiques, les inhibiteurs de l'ECA ou les antagonistes des récepteurs de l'angiotensine [ARA]) [voir INTERACTIONS MÉDICAMENTEUSES ].
Éviter l'utilisation des comprimés NAPROSYN 250 mg, EC-NAPROSYN ou ANAPROX DS chez les patients souffrant d'insuffisance cardiaque grave, à moins que les avantages ne l'emportent sur le risque d'aggravation de l'insuffisance cardiaque. Si les comprimés NAPROSYN 250 mg, EC-NAPROSYN 250 mg ou ANAPROX DS sont utilisés chez des patients souffrant d'insuffisance cardiaque sévère, surveiller les patients pour détecter tout signe d'aggravation de l'insuffisance cardiaque.
Étant donné que chaque comprimé ANAPROX DS contient 50 mg de sodium (environ 2 mEq pour chaque 500 mg de naproxène), cela doit être pris en compte chez les patients dont l'apport global en sodium doit être sévèrement restreint.
Toxicité rénale et hyperkaliémie
Toxicité rénale
L'administration à long terme d'AINS a entraîné une nécrose papillaire rénale et d'autres lésions rénales.
Une toxicité rénale a également été observée chez des patients chez qui les prostaglandines rénales ont un rôle compensateur dans le maintien de la perfusion rénale. Chez ces patients, l'administration d'un AINS peut entraîner une réduction dose-dépendante de la formation des prostaglandines et, accessoirement, du débit sanguin rénal, ce qui peut précipiter une décompensation rénale manifeste. Les patients les plus à risque de cette réaction sont ceux qui présentent une fonction rénale altérée, une déshydratation, une hypovolémie, une insuffisance cardiaque, un dysfonctionnement hépatique, ceux qui prennent des diurétiques et des inhibiteurs de l'ECA ou des ARA, et les personnes âgées. L'arrêt du traitement par AINS est généralement suivi d'un retour à l'état antérieur au traitement.
Aucune information n'est disponible à partir d'études cliniques contrôlées concernant l'utilisation des comprimés NAPROSYN 500 mg, EC-NAPROSYN ou ANAPROX DS chez les patients atteints d'insuffisance rénale avancée. Les effets rénaux des comprimés NAPROSYN 500 mg, EC-NAPROSYN ou ANAPROX DS peuvent accélérer la progression de la dysfonction rénale chez les patients atteints d'insuffisance rénale préexistante.
Corriger l'état volémique chez les patients déshydratés ou hypovolémiques avant de commencer l'administration des comprimés NAPROSYN, EC-NAPROSYN 250 mg ou ANAPROX DS. Surveiller la fonction rénale chez les patients atteints d'insuffisance rénale ou hépatique, d'insuffisance cardiaque, de déshydratation ou d'hypovolémie pendant l'utilisation des comprimés NAPROSYN 500 mg, EC-NAPROSYN et ANAPROX DS [voir INTERACTIONS MÉDICAMENTEUSES ]. Éviter l'utilisation des comprimés NAPROSYN 250 mg, EC-NAPROSYN 500 mg et ANAPROX DS chez les patients atteints d'insuffisance rénale avancée, à moins que les avantages ne l'emportent sur le risque d'aggravation de la fonction rénale. Si NAPROSYN 500 mg comprimés, EC-NAPROSYN 500 mg ou ANAPROX DS est utilisé chez des patients atteints d'insuffisance rénale avancée, surveiller les patients pour détecter tout signe d'aggravation de la fonction rénale.
Hyperkaliémie
Des augmentations de la concentration sérique de potassium, y compris une hyperkaliémie, ont été rapportées avec l'utilisation d'AINS, même chez certains patients sans insuffisance rénale. Chez les patients ayant une fonction rénale normale, ces effets ont été attribués à un état d'hyporénine et d'hypoaldostéronisme.
Réactions anaphylactiques
Le naproxène a été associé à des réactions anaphylactiques chez les patients avec ou sans hypersensibilité connue au naproxène et chez les patients souffrant d'asthme sensible à l'aspirine [voir CONTRE-INDICATIONS et AVERTISSEMENTS ET PRECAUTIONS ].
Cherchez de l'aide d'urgence si une réaction anaphylactique se produit.
Exacerbation de l'asthme lié à la sensibilité à l'aspirine
Une sous-population de patients asthmatiques peut avoir un asthme sensible à l'aspirine qui peut inclure une rhinosinusite chronique compliquée par des polypes nasaux ; bronchospasme sévère, potentiellement mortel ; et/ou intolérance à l'aspirine et aux autres AINS.
Étant donné qu'une réactivité croisée entre l'aspirine et d'autres AINS a été rapportée chez ces patients sensibles à l'aspirine, les comprimés NAPROSYN 250 mg, EC-NAPROSYN 500 mg et ANAPROX DS sont contre-indiqués chez les patients présentant cette forme de sensibilité à l'aspirine [voir CONTRE-INDICATIONS ]. Lorsque les comprimés NAPROSYN 250 mg, EC-NAPROSYN 250 mg ou ANAPROX DS sont utilisés chez des patients souffrant d'asthme préexistant (sans sensibilité connue à l'aspirine), surveiller les patients pour détecter tout changement dans les signes et symptômes de l'asthme.
Réactions cutanées graves
Les AINS, y compris le naproxène, peuvent provoquer des effets indésirables cutanés graves tels que la dermatite exfoliative, le syndrome de Stevens-Johnson (SJS) et la nécrolyse épidermique toxique (TEN), qui peuvent être fatals. Ces événements graves peuvent survenir sans avertissement. Informer les patients des signes et symptômes de réactions cutanées graves et d'arrêter l'utilisation des comprimés NAPROSYN 250 mg, EC-NAPROSYN 500 mg ou ANAPROX DS dès la première apparition d'une éruption cutanée ou de tout autre signe d'hypersensibilité. Les comprimés NAPROSYN, EC-NAPROSYN et ANAPROX DS sont contre-indiqués chez les patients ayant déjà présenté des réactions cutanées graves aux AINS [voir CONTRE-INDICATIONS ].
Réaction médicamenteuse avec éosinophilie et symptômes systémiques (DRESS)
Une réaction médicamenteuse avec éosinophilie et symptômes systémiques (DRESS) a été signalée chez des patients prenant des AINS tels que les comprimés NAPROSYN, EC-NAPROSYN 500 mg et ANAPROX DS. Certains de ces événements ont été mortels ou potentiellement mortels. Le syndrome DRESS se manifeste généralement, mais pas exclusivement, par de la fièvre, une éruption cutanée, une lymphadénopathie et/ou un gonflement du visage. D'autres manifestations cliniques peuvent inclure une hépatite, une néphrite, des anomalies hématologiques, une myocardite ou une myosite. Parfois, les symptômes du DRESS peuvent ressembler à une infection virale aiguë. L'éosinophilie est souvent présente. Parce que ce trouble est variable dans sa présentation, d'autres systèmes d'organes non notés ici peuvent être impliqués. Il est important de noter que des manifestations précoces d'hypersensibilité, comme de la fièvre ou une adénopathie, peuvent être présentes même si l'éruption cutanée n'est pas évidente. Si de tels signes ou symptômes sont présents, arrêtez les comprimés NAPROSYN 500 mg, EC-NAPROSYN et ANAPROX DS et évaluez le patient immédiatement.
Toxicité fœtale
Fermeture prématurée du canal artériel fœtal
Évitez l'utilisation d'AINS, y compris les comprimés NAPROSYN 500 mg, EC-NAPROSYN et ANAPROX DS, chez les femmes enceintes à environ 30 semaines de gestation et plus tard. Les AINS, y compris les comprimés NAPROSYN 500 mg, EC-NAPROSYN et ANAPROX DS, augmentent le risque de fermeture prématurée du canal artériel fœtal à environ cet âge gestationnel.
Oligohydramnios/Insuffisance rénale néonatale
L'utilisation d'AINS, y compris les comprimés NAPROSYN, EC-NAPROSYN 250 mg et ANAPROX DS, à environ 20 semaines de gestation ou plus tard pendant la grossesse peut provoquer un dysfonctionnement rénal fœtal entraînant un oligohydramnios et, dans certains cas, une insuffisance rénale néonatale. Ces résultats indésirables sont observés, en moyenne, après des jours à des semaines de traitement, bien que l'oligohydramnios ait été rarement signalé dès 48 heures après le début des AINS. L'oligohydramnios est souvent, mais pas toujours, réversible à l'arrêt du traitement. Les complications d'un oligohydramnios prolongé peuvent, par exemple, inclure des contractures des membres et un retard de maturation pulmonaire. Dans certains cas post-commercialisation d'insuffisance rénale néonatale, des procédures invasives telles que l'exsanguinotransfusion ou la dialyse ont été nécessaires.
Si un traitement par AINS est nécessaire entre environ 20 semaines et 30 semaines de gestation, limiter l'utilisation des comprimés NAPROSYN 250 mg, EC-NAPROSYN 250 mg ou ANAPROX DS à la dose efficace la plus faible et à la durée la plus courte possible. Envisager une surveillance échographique du liquide amniotique si le traitement par les comprimés NAPROSYN, EC-NAPROSYN ou ANAPROX DS se prolonge au-delà de 48 heures. Arrêtez NAPROSYN 500 mg comprimés, EC-NAPROSYN et ANAPROX DS en cas d'oligohydramnios et effectuez un suivi conformément à la pratique clinique [voir Utilisation dans des populations spécifiques ].
Toxicité hématologique
Une anémie est survenue chez des patients traités par AINS. Cela peut être dû à une perte de sang occulte ou importante, à une rétention d'eau ou à un effet incomplètement décrit sur l'érythropoïèse. Si un patient traité avec les comprimés NAPROSYN, EC-NAPROSYN 500 mg ou ANAPROX DS présente des signes ou des symptômes d'anémie, surveiller l'hémoglobine ou l'hématocrite.
Les AINS, y compris les comprimés NAPROSYN, EC-NAPROSYN et ANAPROX DS, peuvent augmenter le risque d'événements hémorragiques. Les affections comorbides telles que les troubles de la coagulation ou l'utilisation concomitante de warfarine et d'autres anticoagulants, d'agents antiplaquettaires (p. ex., aspirine), d'inhibiteurs de la recapture de la sérotonine (ISRS) et d'inhibiteurs de la recapture de la sérotonine et de la noradrénaline (IRSN) peuvent augmenter ce risque. Surveiller ces patients pour des signes de saignement [voir INTERACTIONS MÉDICAMENTEUSES ].
Masquage de l'inflammation et de la fièvre
L'activité pharmacologique des comprimés NAPROSYN, EC-NAPROSYN 500 mg et ANAPROX DS dans la réduction de l'inflammation, et éventuellement de la fièvre, peut diminuer l'utilité des signes diagnostiques dans la détection des infections.
Utilisation à long terme et surveillance en laboratoire
Étant donné que des saignements gastro-intestinaux graves, une hépatotoxicité et des lésions rénales peuvent survenir sans symptômes ou signes avant-coureurs, envisagez de surveiller périodiquement les patients sous traitement AINS à long terme avec un CBC et un profil chimique [voir AVERTISSEMENTS ET PRECAUTIONS ].
Les patients avec des valeurs d'hémoglobine initiales de 10 g ou moins qui doivent recevoir un traitement à long terme doivent avoir des valeurs d'hémoglobine déterminées périodiquement.
En raison de résultats oculaires indésirables dans les études animales avec des médicaments de cette classe, il est recommandé d'effectuer des études ophtalmiques en cas de changement ou de perturbation de la vision.
Informations sur les conseils aux patients
Conseillez au patient de lire l'étiquetage patient approuvé par la FDA (Guide des médicaments) qui accompagne chaque ordonnance délivrée. Informez les patients, les familles ou leurs soignants des informations suivantes avant de commencer le traitement avec les comprimés NAPROSYN, EC-NAPPROSYN ou ANAPROX DS et périodiquement au cours du traitement en cours.
Événements thrombotiques cardiovasculaires
Conseillez aux patients d'être attentifs aux symptômes d'événements thrombotiques cardiovasculaires, y compris les douleurs thoraciques, l'essoufflement, la faiblesse ou les troubles de l'élocution, et de signaler immédiatement tout symptôme à leur fournisseur de soins de santé [voir AVERTISSEMENTS ET PRECAUTIONS ].
Saignement gastro-intestinal, ulcération et perforation
Conseillez aux patients de signaler les symptômes d'ulcérations et de saignements, y compris les douleurs épigastriques, la dyspepsie, le méléna et l'hématémèse à leur fournisseur de soins de santé. En cas d'utilisation concomitante d'aspirine à faible dose pour la prophylaxie cardiaque, informer les patients du risque accru et des signes et symptômes d'hémorragie gastro-intestinale [voir AVERTISSEMENTS ET PRECAUTIONS ].
Hépatotoxicité
Informer les patients des signes avant-coureurs et des symptômes d'hépatotoxicité (p. ex., nausées, fatigue, léthargie, prurit, diarrhée, jaunisse, sensibilité du quadrant supérieur droit et symptômes « pseudo-grippaux »). Si cela se produit, demandez aux patients d'arrêter NAPROSYN 500 mg comprimés, EC-NAPROSYN 250 mg ou ANAPROX DS et de consulter immédiatement un médecin [voir AVERTISSEMENTS ET PRECAUTIONS ].
Insuffisance cardiaque et œdème
Conseillez aux patients d'être attentifs aux symptômes d'insuffisance cardiaque congestive, y compris l'essoufflement, la prise de poids inexpliquée ou l'œdème, et de contacter leur fournisseur de soins de santé si de tels symptômes surviennent [voir AVERTISSEMENTS ET PRECAUTIONS ].
Réactions anaphylactiques
Informer les patients des signes d'une réaction anaphylactique (par exemple, difficulté à respirer, gonflement du visage ou de la gorge). Demandez aux patients de demander de l'aide d'urgence immédiate si ceux-ci se produisent [voir CONTRE-INDICATIONS et AVERTISSEMENTS ET PRECAUTIONS ].
Réactions cutanées graves, y compris DRESS
Conseillez aux patients d'arrêter de prendre NAPROSYN 250 mg comprimés, EC-NAPROSYN 500 mg ou ANAPROX DS immédiatement s'ils développent tout type d'éruption cutanée ou de fièvre et de contacter leur fournisseur de soins de santé dès que possible [voir AVERTISSEMENTS ET PRECAUTIONS ].
Fertilité féminine
Informez les femmes en âge de procréer qui désirent une grossesse que les AINS, y compris les comprimés NAPROSYN, ECNAPROSYN 250 mg et ANAPROX DS, peuvent être associés à un retard réversible de l'ovulation (voir Utilisation dans des populations spécifiques .]
Toxicité fœtale
Informez les femmes enceintes qu'elles doivent éviter d'utiliser les comprimés NAPROSYN 250 mg, EC-NAPROSYN ou ANAPROX DS et d'autres AINS à partir de 30 semaines de gestation en raison du risque de fermeture prématurée du canal artériel fœtal. Si un traitement avec NAPROSYN Comprimés, EC-NAPROSYN 500 mg ou ANAPROX DS est nécessaire pour une femme enceinte entre environ 20 et 30 semaines de gestation, informez-la qu'elle devra peut-être être surveillée pour l'oligohydramnios, si le traitement se poursuit pendant plus de 48 heures [voir AVERTISSEMENTS ET PRECAUTIONS et Utilisation dans des populations spécifiques ].
Éviter l'utilisation concomitante d'AINS
Informer les patients que l'utilisation concomitante de comprimés NAPROSYN, EC-NAPROSYN 500 mg et ANAPROX DS avec d'autres AINS ou salicylates (par exemple, diflunisal, salsalate) n'est pas recommandée en raison du risque accru de toxicité gastro-intestinale et de l'augmentation faible ou nulle de l'efficacité [voir AVERTISSEMENTS ET PRECAUTIONS et INTERACTIONS MÉDICAMENTEUSES ]. Alerter les patients que des AINS peuvent être présents dans des médicaments « en vente libre » pour le traitement du rhume, de la fièvre ou de l'insomnie.
Utilisation d'AINS et d'aspirine à faible dose
Informez les patients de ne pas utiliser d'aspirine à faible dose en concomitance avec NAPROSYN 500 mg comprimés, EC-NAPROSYN et ANAPROX DS jusqu'à ce qu'ils en parlent à leur professionnel de la santé [voir INTERACTIONS MÉDICAMENTEUSES ].
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Carcinogenèse
Une étude de 2 ans a été réalisée chez le rat pour évaluer le potentiel carcinogène du naproxène à des doses de rat de 8, 16 et 24 mg/kg/jour (0,05, 0,1 et 0,16 fois la dose quotidienne humaine recommandée maximale [MRHD] de 1500 mg/jour sur la base d'une comparaison de la surface corporelle). Aucune preuve de tumorigénicité n'a été trouvée.
Mutagenèse
Le naproxène a été testé positif dans le test d'échange de chromatides sœurs in vivo, mais n'a pas été mutagène dans le test de mutation inverse bactérienne in vitro (test d'Ames).
Altération de la fertilité
Les rats mâles ont été traités avec 2, 5, 10 et 20 mg/kg de naproxène par gavage oral pendant 60 jours avant l'accouplement et les rats femelles ont été traités avec les mêmes doses pendant 14 jours avant l'accouplement et pendant les 7 premiers jours de gestation. Aucun effet indésirable sur la fertilité n'a été noté (jusqu'à 0,13 fois la MRDH basée sur la surface corporelle).
Utilisation dans des populations spécifiques
Grossesse
Résumé des risques
L'utilisation d'AINS, y compris les comprimés NAPROSYN 250 mg, EC-NAPROSYN et ANAPROX DS, peut entraîner une fermeture prématurée du canal artériel fœtal et un dysfonctionnement rénal fœtal entraînant un oligohydramnios et, dans certains cas, une insuffisance rénale néonatale. En raison de ces risques, limitez la dose et la durée d'utilisation des comprimés NAPROSYN, EC-NAPROSYN 500 mg ou ANAPROX DS entre environ 20 et 30 semaines de gestation, et évitez l'utilisation des comprimés NAPROSYN 500 mg, EC-NAPROSYN et ANAPROX DS à environ 30 semaines de gestation. gestation et plus tard au cours de la grossesse (voir Considérations cliniques , Données ).
Fermeture prématurée du canal artériel fœtal
L'utilisation d'AINS, y compris les comprimés NAPROSYN, EC-NAPROSYN et ANAPROX DS, à environ 30 semaines de gestation ou plus tard pendant la grossesse augmente le risque de fermeture prématurée du canal artériel fœtal.
Oligohydramnios/Insuffisance rénale néonatale
L'utilisation d'AINS à environ 20 semaines de gestation ou plus tard pendant la grossesse a été associée à des cas de dysfonctionnement rénal fœtal entraînant un oligohydramnios et, dans certains cas, une insuffisance rénale néonatale.
Les données d'études observationnelles concernant d'autres risques embryofœtaux potentiels de l'utilisation d'AINS chez les femmes au cours du premier ou du deuxième trimestre de la grossesse ne sont pas concluantes. Dans les études de reproduction chez l'animal chez le rat, le lapin et la souris, aucune preuve de tératogénicité ou d'effet nocif sur le fœtus lorsque le naproxène a été administré pendant la période d'organogenèse à des doses de 0,13, 0,26 et 0,6 fois la dose quotidienne maximale recommandée chez l'homme de 1500 mg/jour, respectivement [ voir Données ]. Sur la base de données animales, il a été démontré que les prostaglandines jouent un rôle important dans la perméabilité vasculaire de l'endomètre, l'implantation de blastocystes et la décidualisation. Dans les études animales, l'administration d'inhibiteurs de la synthèse des prostaglandines tels que le naproxène a entraîné une augmentation des pertes avant et après l'implantation. Il a également été démontré que les prostaglandines jouent un rôle important dans le développement du rein fœtal. Dans des études animales publiées, il a été rapporté que les inhibiteurs de la synthèse des prostaglandines altèrent le développement des reins lorsqu'ils sont administrés à des doses cliniquement pertinentes.
Le risque de fond estimé de malformations congénitales majeures et de fausses couches pour la ou les populations indiquées est inconnu. Toutes les grossesses ont un risque de fond de malformation congénitale, de perte ou d'autres résultats indésirables. Dans la population générale des États-Unis, le risque de fond estimé de malformations congénitales majeures et de fausse couche dans les grossesses cliniquement reconnues est de 2 % à 4 % et de 15 % à 20 %, respectivement.
Considérations cliniques
Effets indésirables fœtaux/néonatals
Fermeture prématurée du canal artériel fœtal
Évitez l'utilisation d'AINS chez les femmes à environ 30 semaines de gestation et plus tard au cours de la grossesse, car les AINS, y compris NAPROSYN 500 mg comprimés, EC-NAPROSYN 250 mg et ANAPROX DS, peuvent provoquer une fermeture prématurée du canal artériel fœtal (voir Données ).
Oligohydramnios/Insuffisance rénale néonatale
Si un AINS est nécessaire à environ 20 semaines de gestation ou plus tard au cours de la grossesse, limitez l'utilisation à la dose efficace la plus faible et à la durée la plus courte possible. Si le traitement par NAPROSYN Comprimés, EC-NAPROSYN ou ANAPROX DS se prolonge au-delà de 48 heures, envisager une surveillance par ultrasons pour un oligohydramnios. En cas d'oligohydramnios, arrêtez NAPROSYN 250 mg comprimés, ECNAPROSYN 250 mg et ANAPROX DS, et effectuez un suivi conformément à la pratique clinique (voir Données ).
Travail ou accouchement
Il n'y a pas d'études sur les effets des comprimés NAPROSYN, EC-NAPROSYN ou ANAPROX DS pendant le travail ou l'accouchement. Dans les études animales, les AINS, y compris le naproxène, inhibent la synthèse des prostaglandines, retardent la parturition et augmentent l'incidence des mortinaissances.
Données
Données humaines
Certaines preuves suggèrent que lorsque des inhibiteurs de la synthèse des prostaglandines sont utilisés pour retarder le travail prématuré, il existe un risque accru de complications néonatales telles que l'entérocolite nécrosante, la persistance du canal artériel et l'hémorragie intracrânienne. Le traitement au naproxène administré en fin de grossesse pour retarder la parturition a été associé à une hypertension pulmonaire persistante, à un dysfonctionnement rénal et à des taux anormaux de prostaglandine E chez les prématurés. En raison des effets connus des anti-inflammatoires non stéroïdiens sur le système cardiovasculaire fœtal (fermeture du canal artériel), l'utilisation pendant la grossesse (en particulier à partir de 30 semaines de gestation ou du troisième trimestre) doit être évitée.
Fermeture prématurée du canal artériel fœtal
La littérature publiée rapporte que l'utilisation d'AINS à environ 30 semaines de gestation et plus tard au cours de la grossesse peut entraîner une fermeture prématurée du canal artériel fœtal.
Oligohydramnios/Insuffisance rénale néonatale
Des études publiées et des rapports post-commercialisation décrivent l'utilisation maternelle d'AINS à environ 20 semaines de gestation ou plus tard pendant la grossesse associée à un dysfonctionnement rénal fœtal entraînant un oligohydramnios et, dans certains cas, une insuffisance rénale néonatale. Ces résultats indésirables sont observés, en moyenne, après des jours à des semaines de traitement, bien que l'oligohydramnios ait été rarement signalé dès 48 heures après le début des AINS. Dans de nombreux cas, mais pas tous, la diminution du liquide amniotique était transitoire et réversible avec l'arrêt du médicament. Il y a eu un nombre limité de rapports de cas d'utilisation maternelle d'AINS et de dysfonctionnement rénal néonatal sans oligohydramnios, dont certains étaient irréversibles. Certains cas de dysfonctionnement rénal néonatal ont nécessité un traitement par des procédures invasives, telles que l'exsanguinotransfusion ou la dialyse.
Les limites méthodologiques de ces études et rapports post-commercialisation comprennent l'absence de groupe témoin ; informations limitées concernant la dose, la durée et le moment de l'exposition au médicament ; et l'utilisation concomitante d'autres médicaments. Ces limitations empêchent d'établir une estimation fiable du risque d'issues fœtales et néonatales indésirables avec l'utilisation maternelle d'AINS. Étant donné que les données publiées sur l'innocuité des issues néonatales impliquaient principalement des prématurés, la généralisation de certains risques signalés au nourrisson né à terme exposé aux AINS par l'utilisation maternelle est incertaine.
Données animales
Des études de reproduction ont été réalisées chez des rats à 20 mg/kg/jour (0,13 fois la dose quotidienne maximale recommandée chez l'homme de 1 500 mg/jour sur la base d'une comparaison de la surface corporelle), des lapins à 20 mg/kg/jour (0,26 fois la dose maximale recommandée chez l'homme dose quotidienne humaine, basée sur la comparaison de la surface corporelle) et souris à 170 mg/kg/jour (0,6 fois la dose quotidienne maximale recommandée chez l'homme basée sur la comparaison de la surface corporelle) sans signe d'altération de la fertilité ou de mal au fœtus dû à la drogue.
Lactation
Résumé des risques
L'anion naproxène a été trouvé dans le lait de femmes allaitantes à une concentration équivalente à environ 1 % de la concentration maximale de naproxène dans le plasma. Les avantages de l'allaitement pour le développement et la santé doivent être pris en compte, ainsi que le besoin clinique de la mère pour les comprimés NAPROSYN, EC-NAPROSYN 500 mg ou ANAPROX DS et tout effet indésirable potentiel sur le nourrisson allaité des comprimés NAPROSYN, EC-NAPPROSYN ou ANAPROX DS ou de l'affection maternelle sous-jacente.
Femelles et mâles de potentiel reproducteur
Infertilité
Femelles
Sur la base du mécanisme d'action, l'utilisation d'AINS médiés par les prostaglandines, y compris les comprimés NAPROSYN, ECNAPROSYN et ANAPROX DS, peut retarder ou prévenir la rupture des follicules ovariens, qui a été associée à une infertilité réversible chez certaines femmes. Des études animales publiées ont montré que l'administration d'inhibiteurs de la synthèse des prostaglandines a le potentiel de perturber la rupture folliculaire médiée par les prostaglandines nécessaire à l'ovulation. De petites études chez des femmes traitées avec des AINS ont également montré un retard réversible de l'ovulation. Envisager le retrait des AINS, y compris les comprimés NAPROSYN, EC-NAPROSYN et ANAPROX DS, chez les femmes qui ont des difficultés à concevoir ou qui font l'objet d'un examen d'infertilité.
Utilisation pédiatrique
La sécurité et l'efficacité chez les patients pédiatriques âgés de moins de 2 ans n'ont pas été établies. Les recommandations posologiques pédiatriques pour l'arthrite juvénile idiopathique polyarticulaire sont basées sur des études bien contrôlées [voir DOSAGE ET ADMINISTRATION ]. Il n'y a pas de données adéquates sur l'efficacité ou la dose-réponse pour d'autres affections pédiatriques, mais l'expérience dans l'arthrite juvénile idiopathique polyarticulaire et d'autres expériences d'utilisation ont établi que des doses uniques de 2,5 à 5 mg/kg sous forme de suspension de naproxène, avec une dose quotidienne totale ne dépassant pas 15 mg/kg/jour, sont bien tolérés chez les patients pédiatriques de plus de 2 ans.
Utilisation gériatrique
La tolérance hépatique et rénale de l'administration à long terme de naproxène a été étudiée dans deux essais cliniques en double aveugle impliquant 586 patients. Parmi les patients étudiés, 98 patients étaient âgés de 65 ans et plus et 10 des 98 patients étaient âgés de 75 ans et plus. NAPROXEN a été administré à des doses de 375 mg deux fois par jour ou de 750 mg deux fois par jour pendant une période allant jusqu'à 6 mois. Des anomalies transitoires des tests de laboratoire évaluant la fonction hépatique et rénale ont été notées chez certains patients, bien qu'aucune différence n'ait été notée dans la survenue de valeurs anormales entre les différents groupes d'âge.
Les patients âgés, comparés aux patients plus jeunes, sont plus à risque d'effets indésirables cardiovasculaires, gastro-intestinaux et/ou rénaux graves associés aux AINS. Si le bénéfice attendu pour le patient âgé l'emporte sur ces risques potentiels, commencez le dosage à l'extrémité inférieure de la plage de dosage et surveillez les patients pour détecter tout effet indésirable [voir AVERTISSEMENTS ET PRECAUTIONS ].
Des études indiquent que bien que la concentration plasmatique totale de naproxène soit inchangée, la fraction plasmatique non liée du naproxène est augmentée chez les personnes âgées. La signification clinique de ce résultat n'est pas claire, bien qu'il soit possible que l'augmentation de la concentration de naproxène libre soit associée à une augmentation du taux d'événements indésirables pour une dose donnée chez certains patients âgés. La prudence est recommandée lorsque des doses élevées sont nécessaires et un ajustement de la posologie peut être nécessaire chez les patients âgés. Comme pour les autres médicaments utilisés chez les personnes âgées, il est prudent d'utiliser la dose efficace la plus faible.
L'expérience montre que les patients gériatriques peuvent être particulièrement sensibles à certains effets indésirables des anti-inflammatoires non stéroïdiens. Les patients âgés ou affaiblis semblent moins bien tolérer les ulcères peptiques ou les saignements lorsque ces événements se produisent. La plupart des rapports spontanés d'événements gastro-intestinaux mortels concernent la population gériatrique [voir AVERTISSEMENTS ET PRECAUTIONS ].
Le naproxène est connu pour être en grande partie excrété par les reins, et le risque de réactions toxiques à ce médicament peut être plus élevé chez les patients présentant une insuffisance rénale. Étant donné que les patients âgés sont plus susceptibles d'avoir une fonction rénale diminuée, des précautions doivent être prises lors du choix de la dose et il peut être utile de surveiller la fonction rénale [voir PHARMACOLOGIE CLINIQUE ]. Les patients gériatriques peuvent être plus à risque de développer une forme de toxicité rénale précipitée par une réduction de la formation de prostaglandines lors de l'administration d'anti-inflammatoires non stéroïdiens [voir AVERTISSEMENTS ET PRECAUTIONS ].
Insuffisance hépatique
La prudence est recommandée lorsque des doses élevées sont nécessaires et un ajustement de la posologie peut être nécessaire chez ces patients. Il est prudent d'utiliser la dose efficace la plus faible [voir PHARMACOLOGIE CLINIQUE ].
Insuffisance rénale
Les produits contenant du naproxène ne sont pas recommandés chez les patients présentant une insuffisance rénale modérée à sévère et sévère (clairance de la créatinine AVERTISSEMENTS ET PRECAUTIONS , PHARMACOLOGIE CLINIQUE ].
SURDOSAGE
Les symptômes consécutifs à des surdosages aigus d'AINS se sont généralement limités à une léthargie, une somnolence, des nausées, des vomissements et des douleurs épigastriques, qui ont généralement été réversibles avec des soins de soutien. Des saignements gastro-intestinaux se sont produits. Une hypertension, une insuffisance rénale aiguë, une dépression respiratoire et un coma sont survenus, mais étaient rares [voir AVERTISSEMENTS ET PRECAUTIONS ].Parce que le naproxène sodique peut être rapidement absorbé, des taux sanguins élevés et précoces doivent être anticipés.
Quelques patients ont eu des convulsions, mais il n'est pas clair si elles étaient liées au médicament ou non. On ne sait pas quelle dose de médicament mettrait la vie en danger. [voir AVERTISSEMENTS ET PRECAUTIONS ].
Gérer les patients avec des soins symptomatiques et de soutien suite à un surdosage d'AINS. Il n'y a pas d'antidote spécifique.
Envisager des vomissements et/ou du charbon activé (60 à 100 grammes chez l'adulte, 1 à 2 grammes par kg de poids corporel chez les patients pédiatriques) et/ou cathartique osmotique chez les patients symptomatiques observés dans les quatre heures suivant l'ingestion ou chez les patients présentant un surdosage important ( 5 à 10 fois la dose recommandée). La diurèse forcée, l'alcalinisation de l'urine, l'hémodialyse ou l'hémoperfusion peuvent ne pas être utiles en raison d'une forte liaison aux protéines.
Pour plus d'informations sur le traitement du surdosage, contactez un centre antipoison (1-800-222-1222).
CONTRE-INDICATIONS
Les comprimés NAPROSYN à 500 mg, EC-NAPROSYN et ANAPROX DS sont contre-indiqués chez les patients suivants :
- Hypersensibilité connue (p. ex., réactions anaphylactiques et réactions cutanées graves) au naproxène ou à l'un des composants du produit médicamenteux [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Antécédents d'asthme, d'urticaire ou d'autres réactions de type allergique après la prise d'aspirine ou d'autres AINS. Des réactions anaphylactiques sévères, parfois fatales, aux AINS ont été rapportées chez ces patients [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Dans le cadre d'un pontage aortocoronarien (PAC) [voir AVERTISSEMENTS ET PRECAUTIONS ]
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
Le naproxène a des propriétés analgésiques, anti-inflammatoires et antipyrétiques. ANAPROX DS (naproxène sodique) a été développé comme une formulation de naproxène à absorption plus rapide pour une utilisation comme analgésique.
Le mécanisme d'action du naproxène, comme celui des autres AINS, n'est pas totalement élucidé mais implique l'inhibition de la cyclooxygénase (COX-1 et COX-2).
Le naproxène est un puissant inhibiteur de la synthèse des prostaglandines in vitro. Les concentrations de naproxène atteintes pendant le traitement ont produit des effets in vivo. Les prostaglandines sensibilisent les nerfs afférents et potentialisent l'action de la bradykinine dans l'induction de la douleur chez les modèles animaux. Les prostaglandines sont des médiateurs de l'inflammation. Le naproxène étant un inhibiteur de la synthèse des prostaglandines, son mode d'action peut être dû à une diminution des prostaglandines dans les tissus périphériques.
Pharmacodynamie
Dans une étude sur des volontaires sains, 10 jours d'administration concomitante de naproxène 220 mg une fois par jour avec de l'aspirine à libération immédiate à faible dose (81 mg) ont montré une interaction avec l'activité antiplaquettaire de l'aspirine mesurée par le % d'inhibition sérique du thromboxane B2 à 24 heures. après la dose du jour 10 [98,7 % (aspirine seule) contre 93,1 % (naproxène et aspirine)]. L'interaction a été observée même après l'arrêt du naproxène au jour 11 (alors que la dose d'aspirine était poursuivie) mais s'est normalisée au jour 13. Dans la même étude, l'interaction était plus importante lorsque le naproxène était administré 30 minutes avant l'aspirine [98,7 % contre 87,7 %] et minime lorsque l'aspirine a été administrée 30 minutes avant le naproxène [98,7 % contre 95,4 %].
Suite à l'administration de 220 mg de naproxène deux fois par jour avec de l'aspirine à libération immédiate à faible dose (première dose de naproxène administrée 30 minutes avant l'aspirine), l'interaction était minime 24 h après la dose du jour 10 [98,7 % vs 95,7 %]. Cependant, l'interaction était plus importante après l'arrêt du naproxène (élimination) au jour 11 [98,7 % contre 84,3 %] et ne s'est pas complètement normalisée au jour 13 [98,5 % contre 90,7 %]. [voir INTERACTIONS MÉDICAMENTEUSES ].
Pharmacocinétique
Le naproxène et le naproxène sodique sont rapidement et complètement absorbés par le tractus gastro-intestinal avec une biodisponibilité in vivo de 95 %. Les différentes formes posologiques de NAPROSYN 250 mg sont bioéquivalentes en termes de degré d'absorption (AUC) et de concentration maximale (Cmax) ; cependant, les produits diffèrent dans leur schéma d'absorption. Ces différences entre les produits à base de naproxène sont liées à la fois à la forme chimique du naproxène utilisé et à sa formulation. Même avec les différences observées dans le schéma d'absorption, la demi-vie d'élimination du naproxène est inchangée entre les produits allant de 12 à 17 heures. Les niveaux de naproxène à l'état d'équilibre sont atteints en 4 à 5 jours, et le degré d'accumulation de naproxène est compatible avec cette demi-vie. Cela suggère que les différences dans le schéma de libération ne jouent qu'un rôle négligeable dans l'atteinte des niveaux plasmatiques à l'état d'équilibre.
Absorption
Comprimés NAPROSYN/ANAPROX DS
Après l'administration de NAPROSYN 500 mg comprimés, les concentrations plasmatiques maximales sont atteintes en 2 à 4 heures. Après administration orale d'ANAPROX DS, les concentrations plasmatiques maximales sont atteintes en 1 à 2 heures. La différence de taux entre les deux produits est due à l'augmentation de la solubilité aqueuse du sel de sodium du naproxène utilisé dans ANAPROX DS.
EC-NAPROSYN
EC-NAPROSYN est conçu avec un revêtement sensible au pH pour fournir une barrière à la désintégration dans l'environnement acide de l'estomac et pour perdre son intégrité dans l'environnement plus neutre de l'intestin grêle. L'enrobage polymère entérique sélectionné pour EC-NAPROSYN 250 mg se dissout au-dessus de pH 6. Lorsque EC-NAPROSYN a été administré à des sujets à jeun, les concentrations plasmatiques maximales ont été atteintes environ 4 à 6 heures après la première dose (intervalle : 2 à 12 heures). Une étude in vivo chez l'homme utilisant des comprimés radiomarqués d'EC-NAPROSYN 250 mg a démontré qu'EC-NAPROSYN se dissout principalement dans l'intestin grêle plutôt que dans l'estomac, de sorte que l'absorption du médicament est retardée jusqu'à ce que l'estomac soit vidé.
Lorsque EC-NAPROSYN et NAPROSYN 500 mg comprimés ont été administrés à des sujets à jeun (n = 24) dans une étude croisée après 1 semaine d'administration, des différences de temps jusqu'au pic plasmatique (Tmax) ont été observées, mais il n'y avait aucune différence dans l'absorption totale comme mesuré par Cmax et AUC :
Effets antiacides
Lorsque EC-NAPROSYN 250 mg a été administré en une seule dose avec un antiacide (capacité tampon de 54 mEq), les concentrations plasmatiques maximales de naproxène sont restées inchangées, mais le temps jusqu'au pic a été réduit (Tmax moyen à jeun 5,6 heures, Tmax moyen avec antiacide 5 heures) , mais pas de manière significative [voir INTERACTIONS MÉDICAMENTEUSES ].
Effets alimentaires
Lorsque EC-NAPROSYN 500 mg a été administré en une seule dose avec de la nourriture, les concentrations plasmatiques maximales chez la plupart des sujets ont été atteintes en 12 heures environ (intervalle : 4 à 24 heures). Le temps de séjour dans l'intestin grêle jusqu'à la désintégration était indépendant de la prise alimentaire. La présence de nourriture a prolongé le temps pendant lequel les comprimés sont restés dans l'estomac, le temps jusqu'aux premiers niveaux détectables de naproxène sérique et le temps jusqu'aux niveaux maximaux de naproxène (Tmax), mais n'a pas affecté les niveaux maximaux de naproxène (Cmax).
Distribution
Le naproxène a un volume de distribution de 0,16 L/kg. Aux niveaux thérapeutiques, le naproxène est lié à plus de 99 % d'albumine. À des doses de naproxène supérieures à 500 mg/jour, il y a une augmentation moins que proportionnelle des concentrations plasmatiques en raison d'une augmentation de la clairance causée par la saturation de la liaison aux protéines plasmatiques à des doses plus élevées (Css moyen de 36,5, 49,2 et 56,4 mg/L avec 500, 1000 et 1500 mg de doses quotidiennes de naproxène, respectivement). L'anion naproxène a été trouvé dans le lait des femmes allaitantes à une concentration équivalente à environ 1 % de la concentration maximale de naproxène dans le plasma [voir Utilisation dans des populations spécifiques ].
Élimination
Métabolisme
Le naproxène est largement métabolisé dans le foie en 6-0-desméthyl naproxène, et le parent et les métabolites n'induisent pas d'enzymes métabolisantes. Le naproxène et le 6-0-desméthyl naproxène sont ensuite métabolisés en leurs métabolites respectifs conjugués à l'acylglucuronide.
Excrétion
La clairance du naproxène est de 0,13 mL/min/kg. Environ 95 % du naproxène de toute dose est excrété dans l'urine, principalement sous forme de naproxène ( AVERTISSEMENTS ET PRECAUTIONS ].
Populations spécifiques
Pédiatrique
Chez les patients pédiatriques âgés de 5 à 16 ans souffrant d'arthrite, les taux plasmatiques de naproxène après une dose unique de 5 mg/kg de suspension de naproxène [voir DOSAGE ET ADMINISTRATION se sont avérés similaires à ceux trouvés chez les adultes normaux après une dose de 500 mg. La demi-vie terminale semble être similaire chez les patients pédiatriques et adultes. Aucune étude pharmacocinétique du naproxène n'a été réalisée chez des patients pédiatriques de moins de 5 ans. Les paramètres pharmacocinétiques semblent être similaires après l'administration de suspension ou de comprimés de naproxène chez les patients pédiatriques.
Gériatrique
Des études indiquent que bien que la concentration plasmatique totale de naproxène soit inchangée, la fraction plasmatique non liée du naproxène est augmentée chez les personnes âgées, bien que la fraction non liée soit inférieure à 1 % de la concentration totale de naproxène. Il a été rapporté que les concentrations résiduelles de naproxène non lié chez les sujets âgés variaient de 0,12 % à 0,19 % de la concentration totale de naproxène, contre 0,05 % à 0,075 % chez les sujets plus jeunes.
Insuffisance hépatique
La pharmacocinétique du naproxène n'a pas été déterminée chez les insuffisants hépatiques.
L'hépatopathie alcoolique chronique et probablement d'autres maladies avec des protéines plasmatiques réduites ou anormales (albumine) réduisent la concentration plasmatique totale de naproxène, mais la concentration plasmatique de naproxène non lié est augmentée.
Insuffisance rénale
La pharmacocinétique du naproxène n'a pas été déterminée chez les insuffisants rénaux. Étant donné que le naproxène, ses métabolites et ses conjugués sont principalement excrétés par les reins, il est possible que les métabolites du naproxène s'accumulent en présence d'insuffisance rénale. L'élimination du naproxène est diminuée chez les patients atteints d'insuffisance rénale sévère.
Études sur les interactions médicamenteuses
Aspirine
Lorsque les AINS ont été administrés avec de l'aspirine, la liaison aux protéines des AINS a été réduite, bien que la clairance des AINS libres n'ait pas été modifiée. La signification clinique de cette interaction n'est pas connue. Voir le tableau 1 pour les interactions médicamenteuses cliniquement significatives des AINS avec l'aspirine [voir INTERACTIONS MÉDICAMENTEUSES ].
Etudes cliniques
Le naproxène a été étudié chez des patients atteints de polyarthrite rhumatoïde, d'arthrose, d'arthrite juvénile idiopathique polyarticulaire, de spondylarthrite ankylosante, de tendinite et de bursite, et de goutte aiguë. L'amélioration chez les patients traités pour la polyarthrite rhumatoïde a été démontrée par une réduction du gonflement des articulations, une réduction de la durée de la raideur matinale, une réduction de l'activité de la maladie telle qu'évaluée à la fois par l'investigateur et le patient, et par une mobilité accrue démontrée par une réduction du temps de marche . Généralement, la réponse au naproxène ne dépend pas de l'âge, du sexe, de la gravité ou de la durée de la polyarthrite rhumatoïde.
Chez les patients souffrant d'arthrose, l'action thérapeutique du naproxène a été démontrée par une réduction de la douleur ou de la sensibilité articulaire, une augmentation de l'amplitude des mouvements des articulations du genou, une mobilité accrue démontrée par une réduction du temps de marche et une amélioration de la capacité à effectuer des activités. de la vie quotidienne altérée par la maladie.
Dans un essai clinique comparant des formulations standard de naproxène 375 mg deux fois par jour (750 mg par jour) vs 750 mg deux fois par jour (1500 mg/jour), 9 patients du groupe 750 mg ont arrêté prématurément en raison d'événements indésirables. Dix-neuf patients du groupe 1500 mg ont arrêté prématurément en raison d'événements indésirables. La plupart de ces événements indésirables étaient des événements gastro-intestinaux.
Dans des études cliniques chez des patients atteints de polyarthrite rhumatoïde, d'arthrose et d'arthrite juvénile idiopathique polyarticulaire, le naproxène s'est avéré comparable à l'aspirine et à l'indométhacine pour contrôler les mesures susmentionnées de l'activité de la maladie, mais la fréquence et la gravité des effets indésirables gastro-intestinaux plus légers (nausées , dyspepsie, brûlures d'estomac) et les effets indésirables sur le système nerveux (acouphènes, étourdissements, étourdissements) étaient moindres chez les patients traités par naproxène que chez ceux traités par aspirine ou indométhacine.
Chez les patients atteints de spondylarthrite ankylosante, il a été démontré que le naproxène diminue la douleur nocturne, la raideur matinale et la douleur au repos. Dans des études en double aveugle, le médicament s'est avéré aussi efficace que l'aspirine, mais avec moins d'effets secondaires.
Chez les patients atteints de goutte aiguë, une réponse favorable au naproxène a été démontrée par une élimination significative des changements inflammatoires (p. ex., diminution de l'enflure, chaleur) dans les 24 à 48 heures, ainsi que par un soulagement de la douleur et de la sensibilité.
Le naproxène a été étudié chez des patientes souffrant de douleurs légères à modérées consécutives à une épisiotomie postopératoire, orthopédique, post-partum et à des contractions utérines douloureuses et à une dysménorrhée. Le soulagement de la douleur peut commencer en 1 heure chez les patients prenant du naproxène et en 30 minutes chez les patients prenant du naproxène sodique. L'effet analgésique a été démontré par des mesures telles que la réduction des scores d'intensité de la douleur, l'augmentation des scores de soulagement de la douleur, la diminution du nombre de patients nécessitant des médicaments analgésiques supplémentaires et le délai avant la remédication. L'effet analgésique dure jusqu'à 12 heures.
Le naproxène peut être utilisé en toute sécurité en association avec des sels d'or et/ou des corticostéroïdes ; cependant, dans les essais cliniques contrôlés, lorsqu'il est ajouté au régime des patients recevant des corticostéroïdes, il n'a pas semblé entraîner une plus grande amélioration par rapport à celle observée avec les corticostéroïdes seuls. La question de savoir si le naproxène a un effet «d'épargne des stéroïdes» n'a pas été suffisamment étudiée. Lorsqu'il a été ajouté au régime des patients recevant des sels d'or, le naproxène a entraîné une plus grande amélioration. Son utilisation en association avec des salicylates n'est pas recommandée car il existe des preuves que l'aspirine augmente le taux d'excrétion du naproxène et les données sont insuffisantes pour démontrer que le naproxène et l'aspirine produisent une amélioration supérieure à celle obtenue avec l'aspirine seule. De plus, comme avec d'autres AINS, l'association peut entraîner une fréquence plus élevée d'événements indésirables que celle démontrée pour l'un ou l'autre des produits seuls.
Dans des études sur la perte de sang et la gastroscopie du 51Cr chez des volontaires sains, il a été démontré que l'administration quotidienne de 1 000 mg de naproxène sous forme de 1 000 mg de NAPROSYN (naproxène) ou de 1 100 mg d'ANAPROX DS (naproxène sodique) provoque moins de saignements et d'érosion gastriques que 3 250 mg d'aspirine.
Trois études multicentriques à double insu de 6 semaines avec EC-NAPROSYN (naproxène) (375 ou 500 mg deux fois par jour, n = 385) et NAPROSYN (375 ou 500 mg deux fois par jour, n = 279) ont été menées pour comparer l'EC -NAPROSYN avec NAPROSYN, incluant 355 patients atteints de polyarthrite rhumatoïde et d'arthrose qui avaient des antécédents récents de symptômes gastro-intestinaux liés aux AINS. Ces études ont indiqué qu'EC-NAPROSYN et NAPROSYN 500 mg n'ont montré aucune différence significative en termes d'efficacité ou d'innocuité et avaient une prévalence similaire de troubles gastro-intestinaux mineurs. Les patients individuels, cependant, peuvent trouver une formulation préférable à l'autre.
Cinq cent cinquante-trois patients ont reçu EC-NAPROSYN au cours d'essais ouverts à long terme (la durée moyenne du traitement était de 159 jours). Les taux d'ulcères peptiques et d'hémorragies gastro-intestinales diagnostiqués cliniquement étaient similaires à ce qui a été rapporté historiquement pour l'utilisation à long terme d'AINS.
INFORMATIONS PATIENTS
Guide des médicaments pour les anti-inflammatoires non stéroïdiens (AINS)
Quelles sont les informations les plus importantes que je devrais connaître sur les médicaments appelés anti-inflammatoires non stéroïdiens (AINS) ?
Les AINS peuvent provoquer des effets secondaires graves, notamment :
- Risque accru de crise cardiaque ou d'accident vasculaire cérébral pouvant entraîner la mort. Ce risque peut survenir au début du traitement et peut augmenter :
- avec des doses croissantes d'AINS
- avec une utilisation plus longue des AINS
Ne prenez pas d'AINS juste avant ou après une chirurgie cardiaque appelée « greffe de pontage coronarien (PAC) ».
Évitez de prendre des AINS après une crise cardiaque récente, à moins que votre fournisseur de soins de santé ne vous le dise. Vous pouvez avoir un risque accru d'avoir une autre crise cardiaque si vous prenez des AINS après une récente crise cardiaque.
- Risque accru de saignement, d'ulcères et de déchirures (perforation) de l'œsophage (tube menant de la bouche à l'estomac), de l'estomac et des intestins :
- à tout moment pendant l'utilisation
- sans symptômes précurseurs
- qui peut causer la mort
Le risque de développer un ulcère ou des saignements augmente avec :
- antécédents d'ulcères de l'estomac ou de saignements de l'estomac ou de l'intestin avec l'utilisation d'AINS
- prendre des médicaments appelés « corticostéroïdes », « anticoagulants », « ISRS » ou « SNRI »
- augmentation des doses d'AINS
- utilisation plus longue des AINS
- fumeur
- buvant de l'alcool
- âge avancé
- mauvaise santé
- maladie hépatique avancée
- problèmes de saignement
Les AINS ne doivent être utilisés que :
- exactement comme prescrit
- à la dose la plus faible possible pour votre traitement
- pour le temps le plus court nécessaire
Que sont les AINS ?
Les AINS sont utilisés pour traiter la douleur et les rougeurs, l'enflure et la chaleur (inflammation) causées par des conditions médicales telles que différents types d'arthrite, les crampes menstruelles et d'autres types de douleur à court terme.
Qui ne devrait pas prendre d'AINS ?
Ne prenez pas d'AINS :
- si vous avez eu une crise d'asthme, de l'urticaire ou une autre réaction allergique à l'aspirine ou à tout autre AINS.
- juste avant ou après un pontage coronarien.
Avant de prendre des AINS, informez votre fournisseur de soins de santé de toutes vos conditions médicales, y compris si vous :
- avez des problèmes de foie ou de rein
- avoir une pression artérielle élevée
- avoir de l'asthme
- êtes enceinte ou envisagez de devenir enceinte. La prise d'AINS à environ 20 semaines de grossesse ou plus tard peut nuire à votre bébé à naître. Si vous devez prendre des AINS pendant plus de 2 jours lorsque vous êtes entre 20 et 30 semaines de grossesse, votre fournisseur de soins de santé devra peut-être surveiller la quantité de liquide dans votre utérus autour de votre bébé. Vous ne devez pas prendre d'AINS après environ 30 semaines de grossesse.
- allaitez ou envisagez d'allaiter.
Informez votre fournisseur de soins de santé de tous les médicaments que vous prenez, y compris les médicaments sur ordonnance ou en vente libre, les vitamines ou les suppléments à base de plantes. Les AINS et certains autres médicaments peuvent interagir entre eux et provoquer des effets secondaires graves. Ne commencez pas à prendre un nouveau médicament sans en parler d'abord à votre fournisseur de soins de santé.
Quels sont les effets secondaires possibles des AINS ?
Les AINS peuvent provoquer des effets secondaires graves, notamment :
Voir "Quelles sont les informations les plus importantes que je devrais connaître sur les médicaments appelés anti-inflammatoires non stéroïdiens (AINS) ?"
- hypertension artérielle nouvelle ou aggravée
- insuffisance cardiaque
- problèmes de foie, y compris insuffisance hépatique
- problèmes rénaux, y compris insuffisance rénale
- faible taux de globules rouges (anémie)
- réactions cutanées potentiellement mortelles
- réactions allergiques potentiellement mortelles
Les autres effets secondaires des AINS comprennent : douleurs à l'estomac, constipation, diarrhée, gaz, brûlures d'estomac, nausées, vomissements et étourdissements. Obtenez immédiatement de l'aide d'urgence si vous présentez l'un des symptômes suivants :
- essoufflement ou difficulté à respirer
- douleur thoracique
- faiblesse dans une partie ou un côté de votre corps
- troubles de l'élocution
- gonflement du visage ou de la gorge
Arrêtez de prendre votre AINS et appelez immédiatement votre fournisseur de soins de santé si vous présentez l'un des symptômes suivants :
- nausée
- plus fatigué ou plus faible que d'habitude
- diarrhée
- démangeaison
- votre peau ou vos yeux sont jaunes
- indigestion ou douleur à l'estomac
- symptômes pseudo-grippaux
- Vomir du sang
- il y a du sang dans vos selles ou elles sont noires et collantes comme du goudron
- prise de poids inhabituelle
- éruption cutanée ou cloques avec fièvre
- gonflement des bras, des jambes, des mains et des pieds
Si vous prenez trop de votre AINS, appelez votre fournisseur de soins de santé ou obtenez une aide médicale immédiatement.
Ce ne sont pas tous les effets secondaires possibles des AINS. Pour plus d'informations, renseignez-vous auprès de votre professionnel de la santé ou de votre pharmacien sur les AINS.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
Autres informations sur les AINS
- L'aspirine est un AINS, mais il n'augmente pas le risque de crise cardiaque. L'aspirine peut provoquer des saignements dans le cerveau, l'estomac et les intestins. L'aspirine peut également provoquer des ulcères dans l'estomac et les intestins.
- Certains AINS sont vendus à des doses plus faibles sans ordonnance (en vente libre). Parlez à votre fournisseur de soins de santé avant d'utiliser des AINS en vente libre pendant plus de 10 jours.
Informations générales sur l'utilisation sûre et efficace des AINS
Les médicaments sont parfois prescrits à des fins autres que celles énumérées dans un guide des médicaments. N'utilisez pas d'AINS pour une condition pour laquelle il n'a pas été prescrit. Ne donnez pas d'AINS à d'autres personnes, même si elles présentent les mêmes symptômes que vous. Cela peut leur nuire.
Si vous souhaitez plus d'informations sur les AINS, parlez-en à votre fournisseur de soins de santé. Vous pouvez demander à votre pharmacien ou à votre professionnel de la santé des informations sur les AINS destinées aux professionnels de la santé.
Ce guide de médication a été approuvé par la Food and Drug Administration des États-Unis.
