Traitement antibactérien: Bactrim 400/80mg, 800/160mg Trimethoprim Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Nom de marque: Bactrim
Nom générique : Injection de sulfaméthoxazole et de triméthoprime pour perfusion intraveineuse
Qu'est-ce que Bactrim 800mg ?
Bactrim (sulfaméthoxazole et triméthoprime) DS est une combinaison de deux antibiotiques utilisés pour traiter les infections des voies urinaires, l'otite moyenne aiguë, la bronchite, la shigellose, la pneumonie à Pneumocystis, la diarrhée du voyageur, le Staphylococcus aureus résistant à la méthicilline (SARM) et d'autres infections bactériennes. infections sensibles à cet antibiotique.
Quels sont les effets secondaires de Bactrim ?
Les effets secondaires courants de Bactrim comprennent :
- perte d'appétit,
- nausée,
- vomissement,
- langue douloureuse ou enflée,
- vertiges,
- sensation de rotation,
- résonne dans tes oreilles,
- fatigue ou
- troubles du sommeil (insomnie).
Informez votre médecin si vous ressentez des effets indésirables graves avec Bactrim 800 mg, notamment :
- ecchymoses ou saignements,
- anémie aplastique,
- jaunisse,
- nécrose hépatique,
- plaies buccales,
- douleurs articulaires,
- éruptions cutanées sévères,
- démangeaisons et
- mal de gorge.
LA DESCRIPTION
BACTRIM™ (triméthoprime et sulfaméthoxazole) injectable, une solution stérile pour perfusion intraveineuse uniquement, est une combinaison de sulfaméthoxazole, un antimicrobien sulfamide, et de triméthoprime, un antibactérien inhibiteur de la dihydrofolate réductase. Chaque 5 mL contient 80 mg de triméthoprime (16 mg/mL) et 400 mg de sulfaméthoxazole (80 mg/mL) composés de 40 % de propylène glycol, 10 % d'alcool éthylique et 0,3 % de diéthanolamine ; 1 % d'alcool benzylique et 0,1 % de métabisulfite de sodium ajoutés comme conservateurs, eau pour injection et pH ajusté à environ 10 avec de l'hydroxyde de sodium.
Le triméthoprime est la 2,4-diamino-5-(3,4,5-triméthoxybenzyl)pyrimidine. C'est un composé blanc à jaune clair, inodore et amer avec un poids moléculaire de 290,3 et la formule développée suivante :
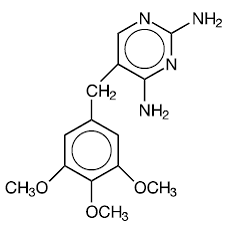
C14H18N4O3 PM 290,3
Le sulfaméthoxazole est le N1-(5-méthyl-3-isoxazolyl) sulfanilamide. C'est un composé presque blanc, inodore et insipide avec un poids moléculaire de 253,28 et la formule développée suivante :
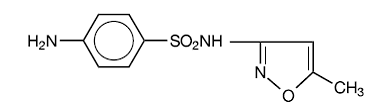
C10H11N3O3S PM 253,28
LES INDICATIONS
Pneumocystis jirovecii Pneumonie
BACTRIM est indiqué dans le traitement de la pneumonie à Pneumocystis jirovecii chez les adultes et les patients pédiatriques âgés de deux mois et plus.
Shigellose
BACTRIM 400 mg est indiqué dans le traitement de l'entérite causée par des souches sensibles de Shigella flexneri et Shigella sonnei chez les adultes et les patients pédiatriques âgés de deux mois et plus.
Infections des voies urinaires
BACTRIM est indiqué dans le traitement des infections des voies urinaires graves ou compliquées chez les adultes et les patients pédiatriques âgés de deux mois et plus en raison de souches sensibles d'Escherichia coli, des espèces de Klebsiella, des espèces d'Enterobacter, de Morganella morganii, de Proteus mirabilis et de Proteus vulgaris lors de l'administration orale de BACTRIM n'est pas réalisable et lorsque l'organisme n'est pas sensible aux agents antibactériens en monothérapie efficaces dans les voies urinaires.
Usage
Pour réduire le développement de bactéries résistantes aux médicaments et maintenir l'efficacité de BACTRIM et d'autres médicaments antibactériens, BACTRIM ne doit être utilisé que pour traiter ou prévenir les infections dont il est prouvé ou fortement suspecté qu'elles sont causées par des bactéries sensibles. Lorsque des informations sur la culture et la sensibilité sont disponibles, elles doivent être prises en compte lors de la sélection ou de la modification du traitement antibactérien. En l'absence de telles données, l'épidémiologie locale et les schémas de sensibilité peuvent contribuer à la sélection empirique du traitement.
Bien que des études de culture et de sensibilité appropriées doivent être réalisées, le traitement peut être débuté en attendant les résultats de ces études.
DOSAGE ET ADMINISTRATION
Posologie chez les adultes et les patients pédiatriques (deux mois et plus)
La dose quotidienne maximale recommandée est de 60 mL (960 mg de triméthoprime) par jour.
Modifications posologiques chez les patients présentant une fonction rénale altérée
Lorsque la fonction rénale est altérée, une posologie réduite doit être utilisée, comme indiqué dans le tableau 2.
Instructions d'administration importantes
Administrer la solution par perfusion intraveineuse sur une durée de 60 à 90 minutes. Éviter l'administration par perfusion rapide ou injection bolus. Ne PAS administrer BACTRIM 400 mg par voie intramusculaire.
Inspectez visuellement les produits médicamenteux parentéraux pour déceler les particules et la décoloration avant l'administration, chaque fois que la solution et le contenant le permettent.
Méthode de préparation
Dilution de flacons à dose unique et à doses multiples
BACTRIM doit être dilué. Chaque 5 ml doit être ajouté à 125 ml de dextrose à 5 % dans l'eau. Après dilution avec 5 % de dextrose dans l'eau, la solution ne doit pas être réfrigérée et doit être utilisée dans les 6 heures.
Si une dilution de 5 ml pour 100 ml de dextrose à 5 % dans l'eau est souhaitée, elle doit être utilisée dans les 4 heures. Dans les cas où une restriction hydrique est souhaitable, chaque 5 ml peut être ajouté à 75 ml de dextrose à 5 % dans l'eau. Dans ces circonstances, la solution doit être mélangée juste avant utilisation et doit être administrée dans les 2 heures.
Si, lors de l'inspection visuelle, il y a un trouble ou des signes de cristallisation après le mélange, la solution doit être jetée et une nouvelle solution préparée.
Fais NE PAS mélanger Bactrim dans du dextrose à 5% dans de l'eau avec des médicaments ou des solutions dans le même récipient.
Flacons à doses multiples (manipulation)
Après l'entrée initiale dans le flacon, le contenu restant doit être utilisé dans les 48 heures.
Systèmes de perfusion pour administration intraveineuse
Les systèmes de perfusion suivants ont été testés et jugés satisfaisants : récipients en verre à dose unitaire ; récipients unidoses en chlorure de polyvinyle et en polyoléfine. Aucun autre système n'a été testé et par conséquent aucun autre ne peut être recommandé.
COMMENT FOURNIE
Formes posologiques et points forts
BACTRIM est disponible sous forme d'injection contenant 80 mg/mL de sulfaméthoxazole et 16 mg/mL de triméthoprime dans des flacons à dose unique de 10 mL et à doses multiples de 30 mL.
Stockage et manutention
Injection de BACTRIM™ (sulfaméthoxazole et triméthoprime) est fourni comme suit :
Flacons de 10 ml contenant 160 mg de triméthoprime (16 mg/mL) et 800 mg de sulfaméthoxazole (80 mg/mL) pour perfusion avec 5 % de dextrose dans l'eau.
Flacon de 10 ml : CDN 49708-001-4210 mL Flacon (boîte de 10) : CDN 49708-001-45
Fioles multidoses de 30 ml , chacun 5 mL contenant 80 mg de triméthoprime (16 mg/mL) et 400 mg de sulfaméthoxazole (80 mg/mL) pour perfusion avec 5 % de dextrose dans l'eau.
Flacon de 30 ml (boîte de 1) : CDN 49708-002-47
Conserver à température ambiante (15°C - 30°C ou 59°F - 86°F). NE PAS RÉFRIGÉRER.
RÉFÉRENCES
1. Winston DJ, Lau WK, Gale RP, Young LS. Triméthoprime-sulfaméthoxazole pour le traitement de la pneumonie à Pneumocystis carinii. Ann Stagiaire Med. juin 1980;92:762-769.
Distribué par : Sun Pharmaceutical Industries, Inc. Cranbury, NJ 08512. Révisé : juillet 2020
EFFETS SECONDAIRES
Les effets indésirables graves suivants sont décrits ailleurs dans l'étiquetage :
- Toxicité embryo-fœtale [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Hypersensibilité et autres réactions mortelles [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Thrombocytopénie [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Diarrhée associée à Clostridioides difficile [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Sensibilité aux sulfites [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Risque associé à l'utilisation concomitante de leucovorine pour la pneumonie à Pneumocystis jirovecii [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Toxicité du propylène glycol [voir AVERTISSEMENTS ET PRECAUTIONS , EFFETS INDÉSIRABLES ]
- Réactions à la perfusion [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Hypoglycémie [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Anomalies électrolytiques [voir AVERTISSEMENTS ET PRECAUTIONS ]
Expérience des essais cliniques
Étant donné que les essais cliniques sont menés dans des conditions très variables, les taux d'effets indésirables observés dans les essais cliniques d'un médicament ne peuvent pas être directement comparés aux taux des essais cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique.
Les effets indésirables les plus courants sont les troubles gastro-intestinaux (nausées, vomissements et anorexie) et les réactions cutanées allergiques (telles que les éruptions cutanées et l'urticaire).
Une réaction locale, une douleur et une légère irritation lors de l'administration intraveineuse (IV) sont peu fréquentes. Une thrombophlébite a été observée.
Expérience post-commercialisation
Les effets indésirables suivants ont été identifiés lors de l'utilisation post-approbation de BACTRIM. Étant donné que ces réactions ont été signalées volontairement par une population de taille incertaine, il n'est pas possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale avec l'exposition au médicament :
- Purpura thrombocytopénique thrombotique
- Purpura thrombocytopénique idiopathique
- Allongement de l'intervalle QT entraînant une tachycardie ventriculaire et une torsade de pointes
- Acidose métabolique
INTERACTIONS MÉDICAMENTEUSES
Potentiel pour BACTRIM 400 mg d'affecter d'autres médicaments
Le triméthoprime est un inhibiteur du CYP2C8 ainsi que du transporteur OCT2. Le sulfaméthoxazole est un inhibiteur du CYP2C9. Éviter la co-administration de BACTRIM 80 mg avec des médicaments qui sont des substrats du CYP2C8 et du 2C9 ou de l'OCT2.
Interactions avec les tests de laboratoire ou de diagnostic
BACTRIM, en particulier le composant triméthoprime, peut interférer avec un dosage sérique du méthotrexate tel que déterminé par la technique de la protéine de liaison compétitive (CBPA) lorsqu'une dihydrofolate réductase bactérienne est utilisée comme protéine de liaison. Aucune interférence ne se produit, cependant, si le méthotrexate est mesuré par un dosage radio-immunologique (RIA).
La présence de BACTRIM peut également interférer avec le test de réaction alcaline au picrate de Jaffe pour la créatinine, entraînant des surestimations d'environ 10 % dans la plage des valeurs normales.
RÉFÉRENCES
2. Al-Khatib SM, LaPointe N, Kramer JM, Califf RM. Ce que les cliniciens doivent savoir sur l'intervalle QT. JAMA. 2003;289(16):2120-2127.
3. Boyer EW, Stork C, Wang RY. Revue : La pharmacologie et la toxicologie du dofétilide. Int J Med Toxicol. 2001;4(2):16.
5. Londres NJ, Garg SJ, Moorthy RS, Cunningham ET. Uvéite d'origine médicamenteuse. J Inflammation ophtalmique Infect. 2013;3:43.
6. Marinella MA. Hyperkaliémie induite par le triméthoprime : une analyse des cas signalés. Gérontol. 1999;45:209-212.
7. Margassery S, Bastani B. Hyperkaliémie potentiellement mortelle et acidose secondaire au traitement au triméthoprime sulfaméthoxazole. J. Néphrol. 2001;14(5):410-414.
8. Moh R, et al. Changements hématologiques chez les adultes recevant un régime HAART contenant de la zidovudine en association avec le cotrimoxazole en Côte d'Ivoire. Antivir Ther. 2005;10(5):615-24.
9. Kosoglou T, Rocci ML Jr, Vlasses PH. Le triméthoprime modifie la disposition du procaïnamide et du nacétylprocaïnamide. Clin Pharmacol Ther. octobre 1988;44(4):467-77.
AVERTISSEMENTS
Inclus dans le cadre du PRÉCAUTIONS section.
PRÉCAUTIONS
Toxicité embryo-fœtale
Certaines études épidémiologiques suggèrent que l'exposition à BACTRIM pendant la grossesse peut être associée à un risque accru de malformations congénitales, en particulier d'anomalies du tube neural, de malformations cardiovasculaires, d'anomalies des voies urinaires, de fentes buccales et de pied bot. Si BACTRIM 400 mg est utilisé pendant la grossesse, ou si la patiente devient enceinte pendant la prise de ce médicament, la patiente doit être informée des risques potentiels pour le fœtus [voir Utilisation dans des populations spécifiques ].
Hypersensibilité et autres réactions mortelles
Des décès associés à l'administration de sulfamides sont survenus en raison de réactions graves, notamment le syndrome de Stevens-Johnson, la nécrolyse épidermique toxique, la nécrose hépatique fulminante, l'agranulocytose, l'anémie aplasique et d'autres dyscrasies sanguines.
Les sulfamides, y compris les produits contenant des sulfamides tels que BACTRIM, doivent être arrêtés dès la première apparition d'une éruption cutanée ou de tout signe d'effet indésirable. Des signes cliniques tels qu'éruption cutanée, mal de gorge, fièvre, arthralgie, toux, essoufflement, pâleur, purpura ou ictère peuvent être des signes précoces de réactions graves. Une éruption cutanée peut être suivie de réactions plus graves, telles qu'un syndrome de Stevens-Johnson, une nécrolyse épidermique toxique, une nécrose hépatique ou un trouble sanguin grave. Des numérations globulaires complètes doivent être effectuées fréquemment chez les patients recevant des sulfamides. La toux, l'essoufflement et les infiltrats pulmonaires sont des réactions d'hypersensibilité des voies respiratoires qui ont été rapportées en association avec un traitement aux sulfamides.
Thrombocytopénie
La thrombocytopénie induite par BACTRIM peut être un trouble à médiation immunitaire. Des cas graves de thrombocytopénie fatals ou menaçant le pronostic vital ont été rapportés. Surveiller les patients pour une toxicité hématologique. La thrombocytopénie se résout généralement en une semaine après l'arrêt de BACTRIM.
Infections streptococciques et fièvre rhumatismale
Éviter l'utilisation de BACTRIM dans le traitement de la pharyngite streptococcique. Des études cliniques ont documenté que les patients atteints d'amygdalite streptococcique β-hémolytique du groupe A ont une plus grande incidence d'échec bactériologique lorsqu'ils sont traités avec BACTRIM 800 mg que les patients traités avec de la pénicilline, comme en témoigne l'incapacité à éradiquer cet organisme de la région amygdalienne. Par conséquent, BACTRIM ne préviendra pas les séquelles telles que le rhumatisme articulaire aigu.
Diarrhée associée à Clostridioides Difficile
Des diarrhées associées à Clostridioides difficile (DACD) ont été signalées avec l'utilisation de presque tous les agents antibactériens, y compris BACTRIM 80 mg, et leur gravité peut varier d'une diarrhée légère à une colite mortelle. Le traitement avec des agents antibactériens altère la flore normale du côlon, entraînant une prolifération de C. difficile.
C. difficile produit les toxines A et B qui contribuent au développement de CDAD. Les souches de C. difficile productrices d'hypertoxines entraînent une morbidité et une mortalité accrues, car ces infections peuvent être réfractaires au traitement antimicrobien et nécessiter une colectomie. La DACD doit être envisagée chez tous les patients qui présentent une diarrhée suite à l'utilisation d'antibactériens. Des antécédents médicaux minutieux sont nécessaires car il a été rapporté que la DACD survient plus de deux mois après l'administration d'agents antibactériens.
Si la CDAD est suspectée ou confirmée, l'utilisation continue d'antibactériens non dirigés contre C. difficile peut devoir être interrompue. Gestion appropriée des liquides et des électrolytes, supplémentation en protéines, traitement antibactérien des
C. difficile, et une évaluation chirurgicale doit être instituée selon les indications cliniques.
Sensibilité aux sulfites
BACTRIM 400 mg contient du métabisulfite de sodium, un sulfite qui peut provoquer des réactions de type allergique, notamment des symptômes anaphylactiques et des épisodes asthmatiques potentiellement mortels ou moins graves chez certaines personnes sensibles. La prévalence globale de la sensibilité aux sulfites dans la population générale est inconnue. La sensibilité aux sulfites est plus fréquente chez les asthmatiques que chez les non-asthmatiques.
Toxicité de l'alcool benzylique chez les patients pédiatriques ("syndrome de halètement")
BACTRIM 160 mg contient de l'alcool benzylique comme conservateur. Des effets indésirables graves et mortels, y compris le «syndrome de halètement», peuvent survenir chez les nouveau-nés et les nourrissons de faible poids à la naissance traités avec des formulations conservées dans de l'alcool benzylique dans des solutions pour perfusion, y compris BACTRIM. Le « syndrome du halètement » est caractérisé par une dépression du système nerveux central, une acidose métabolique et une respiration haletante. BACTRIM 160 mg est contre-indiqué chez les patients pédiatriques de moins de deux mois [voir CONTRE-INDICATIONS ].
Lors de la prescription de BACTRIM 400 mg chez des patients pédiatriques (âgés de deux mois et plus), tenez compte de la charge métabolique quotidienne combinée d'alcool benzylique de toutes les sources, y compris BACTRIM (contient 10 mg d'alcool benzylique par mL) et d'autres médicaments contenant de l'alcool benzylique. La quantité minimale d'alcool benzylique à laquelle des effets indésirables graves peuvent survenir n'est pas connue [voir Utilisation dans des populations spécifiques ].
Risque associé à l'utilisation concomitante de leucovorine pour la pneumonie à Pneumocystis jirovecii
Un échec du traitement et une surmortalité ont été observés lorsque BACTRIM a été utilisé en concomitance avec la leucovorine pour le traitement de patients séropositifs atteints de pneumonie à Pneumocystis jirovecii dans un essai randomisé contrôlé par placebo.4 Éviter l'administration concomitante de BACTRIM et de leucovorine pendant le traitement de la pneumonie à Pneumocystis jirovecii.
Toxicité du propylène glycol
BACTRIM contient du propylène glycol comme solvant (40 % v/v). Lorsqu'il est administré à des doses élevées comme pour le traitement de la pneumonie à P. jirovecii et en concomitance avec d'autres produits contenant du propylène glycol, une hyperosmolarité avec acidose métabolique à trou anionique, y compris une acidose lactique, peut survenir. La toxicité du propylène glycol peut entraîner des lésions rénales aiguës, une toxicité du système nerveux central et une défaillance multiviscérale. Surveillez l'apport quotidien total de propylène glycol de toutes les sources et les perturbations acido-basiques. Arrêtez BACTRIM 400 mg si une toxicité du propylène glycol est suspectée [voir EFFETS INDÉSIRABLES ].
Carence en folate
Éviter l'utilisation de BACTRIM 160 mg chez les patients présentant une insuffisance rénale ou hépatique, chez ceux présentant une éventuelle carence en folate (par exemple, les personnes âgées, les alcooliques chroniques, les patients recevant un traitement anticonvulsivant, les patients atteints du syndrome de malabsorption et les patients en état de malnutrition sévère) et chez ceux souffrant de allergies ou asthme bronchique.
Des modifications hématologiques indiquant une carence en acide folique peuvent survenir chez les patients âgés ou chez les patients présentant une carence en acide folique préexistante ou une insuffisance rénale. Ces effets sont réversibles par un traitement à l'acide folinique [voir Utilisation dans des populations spécifiques ].
Hémolyse
Chez les individus déficients en glucose-6-phosphate déshydrogénase, une hémolyse peut survenir. Cette réaction est souvent liée à la dose.
Réactions à la perfusion
Une irritation et une inflammation locales dues à une infiltration extravasculaire de la perfusion ont été observées avec BACTRIM. Si cela se produit, la perfusion doit être interrompue et reprise sur un autre site.
Hypoglycémie
Des cas d'hypoglycémie chez des patients non diabétiques traités par BACTRIM 400 mg ont été observés, survenant généralement après quelques jours de traitement. Les patients présentant un dysfonctionnement rénal, une maladie du foie, une dénutrition ou ceux recevant de fortes doses de BACTRIM 800mg sont particulièrement à risque.
Altération du métabolisme de la phénylalanine
Il a été noté que le triméthoprime, composant de BACTRIM, altère le métabolisme de la phénylalanine, mais cela n'a aucune importance chez les patients phénylcétonuriques soumis à une restriction alimentaire appropriée.
Porphyrie et hypothyroïdie
Comme d'autres médicaments contenant des sulfamides, BACTRIM peut précipiter la crise de porphyrie et l'hypothyroïdie. Évitez d'utiliser BACTRIM chez les patients atteints de porphyrie ou de dysfonctionnement thyroïdien.
Risque potentiel dans le traitement de la pneumonie à Pneumocystis jirovecii chez les patients atteints du syndrome d'immunodéficience acquise (SIDA)
Les patients atteints du SIDA peuvent ne pas tolérer ou répondre à BACTRIM de la même manière que les patients non atteints du SIDA. L'incidence des effets indésirables, en particulier les éruptions cutanées, la fièvre, la leucopénie et les valeurs élevées d'aminotransférases (transaminases), avec le traitement par BACTRIM chez les patients atteints du SIDA qui sont traités pour une pneumonie à Pneumocystis jirovecii, a été signalée comme étant considérablement augmentée par rapport à l'incidence normalement associée à la utilisation de BACTRIM 800 mg chez des patients non atteints du SIDA. Si un patient développe une éruption cutanée ou tout signe d'effet indésirable, réévaluer le traitement par BACTRIM [voir AVERTISSEMENTS ET PRECAUTIONS ].
Éviter la co-administration de BACTRIM 80 mg et de leucovorine pendant le traitement de la pneumonie à Pneumocystis jirovecii [voir AVERTISSEMENTS ET PRECAUTIONS ].
Anomalies électrolytiques
Une dose élevée de triméthoprime, telle qu'utilisée chez les patients atteints de pneumonie à P. jirovecii, induit une augmentation progressive mais réversible des concentrations sériques de potassium chez un nombre important de patients. Même un traitement aux doses recommandées peut provoquer une hyperkaliémie lorsque le triméthoprime est administré à des patients présentant des troubles sous-jacents du métabolisme du potassium, une insuffisance rénale ou si des médicaments connus pour induire une hyperkaliémie sont administrés en concomitance. Une surveillance étroite du potassium sérique est justifiée chez ces patients.
Une hyponatrémie sévère et symptomatique peut survenir chez les patients recevant BACTRIM 800 mg, en particulier pour le traitement de la pneumonie à P. jirovecii. L'évaluation de l'hyponatrémie et la correction appropriée sont nécessaires chez les patients symptomatiques pour prévenir les complications potentiellement mortelles.
Pendant le traitement, assurez-vous d'un apport hydrique et d'un débit urinaire adéquats pour prévenir la cristallurie. Les patients qui sont des « acétyleurs lents » peuvent être plus sujets aux réactions idiosyncratiques aux sulfamides.
Surveillance des tests de laboratoire
Des numérations globulaires complètes doivent être effectuées fréquemment chez les patients recevant BACTRIM. Arrêtez BACTRIM 800 mg si une réduction significative du nombre de tout élément sanguin formé est constatée. Effectuez des analyses d'urine avec un examen microscopique minutieux et des tests de la fonction rénale pendant le traitement, en particulier pour les patients présentant une insuffisance rénale.
Développement de bactéries résistantes aux médicaments
Prescrire BACTRIM en l'absence d'infection bactérienne avérée ou fortement suspectée ou d'indication prophylactique est peu susceptible d'apporter un bénéfice au patient et augmente le risque de développement de bactéries résistantes aux médicaments.
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Carcinogenèse
Le sulfaméthoxazole n'était pas cancérigène lorsqu'il a été évalué dans une étude tumorigène de 26 semaines chez la souris (Tg-rasH2) à des doses allant jusqu'à 400 mg/kg/jour de sulfaméthoxazole ; équivalent à 2 fois l'exposition systémique humaine (à une dose quotidienne de 800 mg de sulfaméthoxazole bid (deux fois par jour).
Mutagenèse
Les tests bactériens de mutation inverse in vitro selon le protocole standard n'ont pas été réalisés avec le sulfaméthoxazole et le triméthoprime en association. Un test d'aberration chromosomique in vitro sur des lymphocytes humains avec le sulfaméthoxazole/triméthoprime s'est révélé négatif. Dans des tests in vitro et in vivo sur des espèces animales, le sulfaméthoxazole/triméthoprime n'a pas endommagé les chromosomes. Les tests in vivo du micronoyau se sont révélés positifs après l'administration orale de sulfaméthoxazole/triméthoprime. Les observations de leucocytes obtenus chez des patients traités par le sulfaméthoxazole et le triméthoprime n'ont révélé aucune anomalie chromosomique.
Le sulfaméthoxazole seul était positif dans un test bactérien de mutation inverse in vitro et dans des tests de micronoyau in vitro utilisant des lymphocytes humains en culture.
Le triméthoprime seul s'est avéré négatif dans les tests bactériens de mutation inverse in vitro et dans les tests d'aberration chromosomique in vitro avec des cellules ovariennes ou pulmonaires de hamster chinois avec ou sans activation S9. Dans les tests in vitro de comète, de micronoyau et de dommages chromosomiques utilisant des lymphocytes humains en culture, le triméthoprime était positif. Chez les souris après administration orale de triméthoprime, aucun dommage à l'ADN n'a été enregistré dans les tests Comet du foie, des reins, des poumons, de la rate ou de la moelle osseuse.
Altération de la fertilité
Aucun effet indésirable sur la fertilité ou la performance reproductive générale n'a été observé chez les rats ayant reçu des doses orales aussi élevées que 350 mg/kg/jour de sulfaméthoxazole plus 70 mg/kg/jour de triméthoprime, à des doses environ deux fois supérieures à la dose quotidienne recommandée chez l'homme sur la base de la surface corporelle. .
Utilisation dans des populations spécifiques
Grossesse
Résumé des risques
BACTRIM peut nuire au fœtus s'il est administré à une femme enceinte. Certaines études épidémiologiques suggèrent que l'exposition à BACTRIM 400 mg pendant la grossesse peut être associée à un risque accru de malformations congénitales, en particulier d'anomalies du tube neural, d'anomalies cardiovasculaires, d'anomalies des voies urinaires, de fentes buccales et de pied bot (voir Données humaines ).
Une des 3 études chez le rat a montré une fente palatine à des doses d'environ 5 fois la dose humaine recommandée sur la base de la surface corporelle ; les 2 autres études n'ont pas montré de tératogénicité à des doses similaires. Des études chez des lapines gestantes ont montré une augmentation des pertes fœtales à environ 6 fois la dose humaine sur la base de la surface corporelle (voir Données animales ).
Le risque de fond estimé de malformations congénitales majeures et de fausses couches pour la population indiquée est inconnu. Dans la population générale des États-Unis, le risque de fond estimé de malformations congénitales majeures et de fausse couche dans les grossesses cliniquement reconnues est de 2 % à 4 % et de 15 % à 20 %, respectivement. Informer les femmes enceintes des effets nocifs potentiels de BACTRIM 400 mg sur le fœtus (voir Considérations cliniques ).
Considérations cliniques
Risque maternel et/ou embryonnaire/fœtal associé à la maladie
L'infection des voies urinaires pendant la grossesse est associée à des issues périnatales indésirables telles qu'une naissance prématurée, un faible poids à la naissance et une pré-éclampsie, ainsi qu'à une mortalité accrue chez la femme enceinte. La pneumonie à P. jirovecii pendant la grossesse est associée à une naissance prématurée et à une morbidité et une mortalité accrues chez la femme enceinte. BACTRIM ne doit être utilisé pendant la grossesse que si le bénéfice potentiel justifie le risque potentiel pour le fœtus.
Données
Données humaines
Bien qu'il n'y ait pas d'études prospectives de grande envergure et bien contrôlées chez les femmes enceintes et leurs bébés, certaines études épidémiologiques rétrospectives suggèrent une association entre l'exposition du premier trimestre à BACTRIM 80 mg avec un risque accru de malformations congénitales, en particulier des anomalies du tube neural, des anomalies cardiovasculaires, des troubles urinaires. malformations des voies respiratoires, fentes buccales et pied bot. Ces études, cependant, étaient limitées par le petit nombre de cas exposés et le manque d'ajustement pour de multiples comparaisons statistiques et facteurs de confusion. Ces études sont en outre limitées par des biais de rappel, de sélection et d'information, et par une généralisabilité limitée de leurs résultats. Enfin, les mesures des résultats variaient d'une étude à l'autre, limitant les comparaisons entre études. Alternativement, d'autres études épidémiologiques n'ont pas détecté d'associations statistiquement significatives entre l'exposition à BACTRIM 160 mg et des malformations spécifiques. Brumfitt et Pursell,10 dans une étude rétrospective, ont rapporté l'issue de 186 grossesses au cours desquelles la mère a reçu soit un placebo, soit du triméthoprime et du sulfaméthoxazole par voie orale. L'incidence des anomalies congénitales était de 4,5 % (3 sur 66) chez ceux qui ont reçu le placebo et de 3,3 % (4 sur 120) chez ceux qui ont reçu du triméthoprime et du sulfaméthoxazole. Il n'y avait aucune anomalie chez les 10 enfants dont les mères ont reçu le médicament au cours du premier trimestre. Dans une enquête distincte, Brumfitt et Pursell n'ont également trouvé aucune anomalie congénitale chez 35 enfants dont les mères avaient reçu du triméthoprime et du sulfaméthoxazole par voie orale au moment de la conception ou peu de temps après.
Données animales
Chez le rat, des doses orales de 533 mg/kg de sulfaméthoxazole ou de 200 mg/kg de triméthoprime ont produit des effets tératologiques se manifestant principalement par des fentes palatines. Ces doses sont environ 5 et 6 fois la dose quotidienne totale recommandée chez l'homme sur la base de la surface corporelle. Dans deux études chez le rat, aucune tératologie n'a été observée lorsque 512 mg/kg de sulfaméthoxazole ont été utilisés en association avec 128 mg/kg de triméthoprime. Dans certaines études sur le lapin, une augmentation globale des pertes fœtales (conceptus morts et résorbés) a été associée à des doses de triméthoprime 6 fois supérieures à la dose thérapeutique humaine basée sur la surface corporelle.
Lactation
Résumé des risques
Les niveaux de BACTRIM dans le lait maternel sont d'environ 2 à 5 % de la dose quotidienne recommandée pour les patients pédiatriques de plus de deux mois. Il n'y a aucune information concernant l'effet de BACTRIM sur le nourrisson allaité ou l'effet sur la production de lait. En raison du risque potentiel de déplacement de la bilirubine et d'ictère nucléaire chez l'enfant allaité [voir CONTRE-INDICATIONS ], conseillent aux femmes d'éviter d'allaiter pendant le traitement par BACTRIM.
Utilisation pédiatrique
BACTRIM est contre-indiqué chez les patients pédiatriques de moins de deux mois en raison du risque potentiel de déplacement de la bilirubine et d'ictère nucléaire [voir CONTRE-INDICATIONS ].
Des effets indésirables graves, y compris des réactions mortelles et le «syndrome de halètement», sont survenus chez des nouveau-nés prématurés et des nourrissons de faible poids à la naissance dans l'unité de soins intensifs néonatals qui ont reçu de l'alcool benzylique comme conservateur dans des solutions de perfusion. Dans ces cas, des doses d'alcool benzylique de 99 à 234 mg/kg/jour ont produit des taux élevés d'alcool benzylique et de ses métabolites dans le sang et l'urine (les taux sanguins d'alcool benzylique étaient de 0,61 à 1,378 mmol/L). Les autres effets indésirables comprenaient une détérioration neurologique progressive, des convulsions, une hémorragie intracrânienne, des anomalies hématologiques, une dégradation de la peau, une insuffisance hépatique et rénale, une hypotension, une bradycardie et un collapsus cardiovasculaire. Les nourrissons prématurés et de faible poids à la naissance peuvent être plus susceptibles de développer ces réactions car ils peuvent être moins capables de métaboliser l'alcool benzylique.
Lors de la prescription de BACTRIM 800 mg chez des patients pédiatriques, tenez compte de la charge métabolique quotidienne combinée d'alcool benzylique de toutes les sources, y compris BACTRIM (BACTRIM 160 mg contient 10 mg d'alcool benzylique par mL) et d'autres médicaments contenant de l'alcool benzylique. La quantité minimale d'alcool benzylique à laquelle des effets indésirables graves peuvent survenir n'est pas connue [voir AVERTISSEMENTS ET PRECAUTIONS ].
Utilisation gériatrique
Les études cliniques de BACTRIM n'ont pas inclus un nombre suffisant de sujets âgés de 65 ans et plus pour déterminer s'ils répondent différemment des sujets plus jeunes.
Il peut y avoir un risque accru d'effets indésirables graves chez les patients âgés, en particulier lorsqu'il existe des complications telles qu'une insuffisance rénale et/ou hépatique, ou l'utilisation concomitante d'autres médicaments. Réactions cutanées sévères, aplasie médullaire généralisée [voir AVERTISSEMENTS ET PRECAUTIONS , EFFETS INDÉSIRABLES ], une diminution spécifique des plaquettes (avec ou sans purpura) et l'hyperkaliémie sont les effets indésirables sévères les plus fréquemment rapportés chez les patients âgés.
Chez les personnes recevant simultanément certains diurétiques, principalement des thiazidiques, une incidence accrue de thrombocytopénie avec purpura a été rapportée. Une augmentation des taux sanguins de digoxine peut survenir avec un traitement concomitant par BACTRIM 80 mg, en particulier chez les patients âgés. Les taux sériques de digoxine doivent être surveillés [voir INTERACTIONS MÉDICAMENTEUSES ].
Des modifications hématologiques indiquant une carence en acide folique peuvent survenir chez les patients âgés. Ces effets sont réversibles par la thérapie à l'acide folinique. Des ajustements posologiques appropriés doivent être effectués chez les patients présentant une insuffisance rénale et la durée d'utilisation doit être aussi courte que possible afin de minimiser les risques de réactions indésirables [voir DOSAGE ET ADMINISTRATION ].
Le composant triméthoprime de BACTRIM peut provoquer une hyperkaliémie lorsqu'il est administré à des patients présentant des troubles sous-jacents du métabolisme du potassium, une insuffisance rénale ou lorsqu'il est administré en concomitance avec des médicaments connus pour induire une hyperkaliémie, tels que les inhibiteurs de l'enzyme de conversion de l'angiotensine. Une surveillance étroite du potassium sérique est justifiée chez ces patients. L'arrêt du traitement par BACTRIM 160 mg est recommandé pour aider à faire baisser les taux sériques de potassium.
Les paramètres pharmacocinétiques du sulfaméthoxazole étaient similaires pour les sujets gériatriques et les sujets adultes plus jeunes. La concentration sérique maximale moyenne de triméthoprime était plus élevée et la clairance rénale moyenne du triméthoprime était plus faible chez les sujets gériatriques que chez les sujets plus jeunes [voir PHARMACOLOGIE CLINIQUE ].
RÉFÉRENCES
4. Safrin S, Lee BL, Sande MA. L'acide folinique adjuvant avec le triméthoprime-sulfaméthoxazole pour la pneumonie à Pneumocystis carinii chez les patients atteints du SIDA est associé à un risque accru d'échec thérapeutique et de décès. J Infect Dis. octobre 1994;170(4):912-7.
10. Brumfitt W, Pursell R. Triméthoprime/sulfaméthoxazole dans le traitement de la bactériurie chez la femme. J Infect Dis. novembre 1973 ; 128 (Suppl.) : S657-S663.
SURDOSAGE
Aigu
Puisqu'il n'y a pas eu d'expérience approfondie chez l'homme avec des doses uniques de BACTRIM 160 mg supérieures à 25 ml (400 mg de triméthoprime et 2000 mg de sulfaméthoxazole), la dose maximale tolérée chez l'homme est inconnue.
Les signes et symptômes de surdosage signalés avec les sulfamides comprennent l'anorexie, les coliques, les nausées, les vomissements, les étourdissements, les maux de tête, la somnolence et l'inconscience. Une pyrexie, une hématurie et une cristallurie peuvent être notées. Les dyscrasies sanguines et la jaunisse sont des manifestations tardives potentielles de surdosage.
Les signes de surdosage aigu avec le triméthoprime comprennent des nausées, des vomissements, des étourdissements, des maux de tête, une dépression mentale, une confusion et une dépression de la moelle osseuse.
Les principes généraux du traitement comprennent l'administration de liquides intraveineux si le débit urinaire est faible et la fonction rénale est normale. L'acidification des urines va augmenter l'élimination rénale du triméthoprime. Le patient doit être surveillé avec des numérations globulaires et des chimies sanguines appropriées, y compris les électrolytes. Si une dyscrasie sanguine importante ou un ictère survient, un traitement spécifique doit être institué pour ces complications. La dialyse péritonéale n'est pas efficace et l'hémodialyse n'est que modérément efficace pour éliminer le triméthoprime et le sulfaméthoxazole.
Chronique
L'utilisation de BACTRIM 800 mg à des doses élevées et/ou pendant des périodes prolongées peut provoquer une dépression de la moelle osseuse se manifestant par une thrombocytopénie, une leucopénie et/ou une anémie mégaloblastique. Si des signes d'aplasie médullaire apparaissent, le patient doit recevoir de la leucovorine 5 à 15 mg par jour jusqu'à ce que l'hématopoïèse normale soit rétablie.
CONTRE-INDICATIONS
BACTRIM est contre-indiqué dans les cas suivants :
- Hypersensibilité connue au triméthoprime ou aux sulfamides [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Antécédents de thrombocytopénie immunitaire d'origine médicamenteuse avec utilisation de triméthoprime et/ou de sulfamides [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Patients présentant une anémie mégaloblastique documentée due à une carence en folate [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Patients pédiatriques âgés de moins de deux mois [voir Utilisation dans des populations spécifiques ]
- Lésions hépatiques marquées [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Insuffisance rénale sévère lorsque l'état de la fonction rénale ne peut être surveillé [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Administration concomitante avec le dofétilide2,3 [voir INTERACTIONS MÉDICAMENTEUSES ]
RÉFÉRENCES
2. Al-Khatib SM, LaPointe N, Kramer JM, Califf RM. Ce que les cliniciens doivent savoir sur l'intervalle QT. JAMA. 2003;289(16):2120-2127.
3. Boyer EW, Stork C, Wang RY. Revue : La pharmacologie et la toxicologie du dofétilide. Int J Med Toxicol. 2001;4(2):16.
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
BACTRIM est un médicament antimicrobien [voir Microbiologie ].
Pharmacocinétique
Après une perfusion intraveineuse d'une heure d'une dose unique de 160 mg de triméthoprime et de 800 mg de sulfaméthoxazole chez 11 patients dont le poids variait de 105 lb à 165 lb (en moyenne, 143 lb), les concentrations plasmatiques maximales de triméthoprime et de sulfaméthoxazole étaient de 3,4 ± 0,3 μg/mL et 46,3 ± 2,7 μg/mL, respectivement. Après administration intraveineuse répétée de la même dose à intervalles de 8 heures, les concentrations plasmatiques moyennes juste avant et immédiatement après chaque perfusion à l'état d'équilibre étaient de 5,6 ± 0,6 μg/mL et de 8,8 ± 0,9 μg/mL pour le triméthoprime et de 70,6 ± 7,3 μg /mL et 105,6 ± 10,9 μg/mL pour le sulfaméthoxazole. La demi-vie plasmatique moyenne était de 11,3 ± 0,7 heures pour le triméthoprime et de 12,8 ± 1,8 heures pour le sulfaméthoxazole. Tous ces 11 patients avaient une fonction rénale normale et leur âge variait de 17 à 78 ans (médiane, 60 ans)11.
Les études pharmacocinétiques chez les enfants et les adultes suggèrent une demi-vie dépendante de l'âge du triméthoprime, comme indiqué dans le tableau 5.12
Les patients atteints d'insuffisance rénale sévère présentent une augmentation des demi-vies des deux composants, nécessitant un ajustement de la posologie [voir DOSAGE ET ADMINISTRATION ].
Distribution
Le triméthoprime et le sulfaméthoxazole existent dans le sang sous des formes non liées, liées aux protéines et métabolisées; le sulfaméthoxazole existe également sous forme conjuguée.
Environ 44 % du triméthoprime et 70 % du sulfaméthoxazole sont liés aux protéines plasmatiques. La présence de 10 mg pour cent de sulfaméthoxazole dans le plasma diminue la liaison protéique du triméthoprime à un degré insignifiant; le triméthoprime n'influence pas la liaison protéique du sulfaméthoxazole.
Le triméthoprime et le sulfaméthoxazole se distribuent dans les expectorations et les sécrétions vaginales ; le triméthoprime se distribue également dans les sécrétions bronchiques, et tous deux traversent la barrière placentaire et sont excrétés dans le lait maternel.
Élimination
Métabolisme
Le sulfaméthoxazole est métabolisé chez l'homme en au moins 5 métabolites : les métabolites N4-acétyl-, N4-hydroxy-, 5-méthylhydroxy-, N4-acétyl-5-méthylhydroxy-sulfaméthoxazole et un conjugué N-glucuronide. La formation du métabolite N4-hydroxy est médiée par le CYP2C9.
Le triméthoprime est métabolisé in vitro en 11 métabolites différents, dont cinq sont des adduits du glutathion et six sont des métabolites oxydatifs, y compris les principaux métabolites, les 1- et 3-oxydes et les dérivés 3- et 4-hydroxy.
Les formes libres du triméthoprime et du sulfaméthoxazole sont considérées comme les formes thérapeutiquement actives. Des études in vitro suggèrent que le triméthoprime est un substrat de la glycoprotéine P, OCT1 et OCT2, et que le sulfaméthoxazole n'est pas un substrat de la glycoprotéine P.
Excrétion
L'excrétion du triméthoprime et du sulfaméthoxazole se fait principalement par les reins par filtration glomérulaire et sécrétion tubulaire. Les concentrations urinaires de triméthoprime et de sulfaméthoxazole sont considérablement plus élevées que les concentrations dans le sang. Le pourcentage de dose excrétée dans l'urine sur une période de 12 heures suivant l'administration intraveineuse de la première dose de 240 mg de triméthoprime et de 1200 mg de sulfaméthoxazole le jour 1 variait de 17 % à 42,4 % sous forme de triméthoprime libre ; 7 % à 12,7 % sous forme de sulfaméthoxazole libre ; et 36,7 % à 56 % sous forme de sulfaméthoxazole total (libre plus le métabolite N4-acétylé). Lorsqu'ils sont administrés ensemble sous forme de BACTRIM 400 mg, ni le triméthoprime ni le sulfaméthoxazole n'affectent le schéma d'excrétion urinaire de l'autre.
Populations spécifiques
Patients gériatriques
La pharmacocinétique du sulfaméthoxazole 800 mg et du triméthoprime 160 mg a été étudiée chez six sujets gériatriques (âge moyen : 78,6 ans) et six jeunes sujets sains (âge moyen : 29,3 ans) en utilisant une formulation non approuvée aux États-Unis. Les valeurs pharmacocinétiques du sulfaméthoxazole chez les sujets gériatriques étaient similaires à celles observées chez les jeunes adultes. La clairance rénale moyenne du triméthoprime était significativement plus faible chez les sujets gériatriques que chez les jeunes adultes (19 mL/h/kg contre 55 mL/h/kg). Cependant, après normalisation en fonction du poids corporel, la clairance corporelle totale apparente du triméthoprime était en moyenne inférieure de 19 % chez les sujets gériatriques par rapport aux jeunes adultes.
Microbiologie
Mécanisme d'action
Le sulfaméthoxazole inhibe la synthèse bactérienne de l'acide dihydrofolique en entrant en compétition avec l'acide para-aminobenzoïque (PABA). Le triméthoprime bloque la production d'acide tétrahydrofolique à partir d'acide dihydrofolique en se liant à et en inhibant de manière réversible l'enzyme requise, la dihydrofolate réductase. Ainsi, le sulfaméthoxazole et le triméthoprime bloquent deux étapes consécutives de la biosynthèse des acides nucléiques et des protéines indispensables à de nombreuses bactéries.
La résistance
Des études in vitro ont montré que la résistance bactérienne se développe plus lentement avec le sulfaméthoxazole et le triméthoprime en association qu'avec le sulfaméthoxazole ou le triméthoprime seuls.
Activité anti-microbienne
BACTRIM s'est avéré actif contre la plupart des isolats des micro-organismes suivants, à la fois in vitro et dans les infections cliniques [voir INDICATIONS ET USAGE ].
Bactéries aérobies à Gram négatif
Escherichia coliKlebsiella espècesEnterobacter espècesMorganella morganiiProteus mirabilisProteus vulgarisShigella flexneriShigella sonnei
Autres micro-organismes
Pneumocystis jirovecii
Les données in vitro suivantes sont disponibles, mais leur signification clinique est inconnue. Au moins 90 % des bactéries suivantes présentent une concentration minimale inhibitrice (CMI) in vitro inférieure ou égale au seuil de sensibilité de BACTRIM 160 mg contre des isolats de genre ou de groupe d'organismes similaires. Cependant, l'efficacité de BACTRIM 400 mg dans le traitement des infections cliniques causées par ces bactéries n'a pas été établie dans des essais cliniques adéquats et bien contrôlés.
Bactéries aérobies à Gram positif
Streptococcus pneumoniae
Bactéries aérobies à Gram négatif
Haemophilus influenzae
Test de sensibilité
Pour des informations spécifiques concernant les critères d'interprétation des tests de sensibilité, les méthodes de test associées et les normes de contrôle qualité reconnues par la FDA pour ce médicament, veuillez consulter https://www.fda.gov/STIC.
RÉFÉRENCES
11. Grose WE, Bodey GP, Loo TL. Pharmacologie clinique du triméthoprime-sulfaméthoxazole administré par voie intraveineuse. Agents antimicrobiens Chemother. mars 1979;15:447-451.
12. Siber GR, Gorham C, Durbin W, Lesko L, Levin MJ. Pharmacologie du triméthoprime-sulfaméthoxazole intraveineux chez les enfants et les adultes. Chimiothérapie et maladies infectieuses actuelles. Société américaine de microbiologie, Washington, DC 1980 ; Vol. 1, p. 691-692.
INFORMATIONS PATIENTS
Toxicité embryonnaire et fœtale
Informez les patientes en âge de procréer que BACTRIM peut nuire au fœtus et informez leur fournisseur de soins de santé d'une grossesse connue ou soupçonnée [voir Utilisation dans des populations spécifiques ].
Lactation
Conseillez aux femmes qui allaitent d'éviter d'allaiter pendant le traitement par BACTRIM.
Résistance antibactérienne
Conseillez aux patients que les médicaments antibactériens, y compris BACTRIM, ne doivent être utilisés que pour traiter les infections bactériennes. Il ne traite pas les infections virales (par exemple, le rhume).
Demandez aux patients de maintenir un apport hydrique adéquat afin de prévenir la cristallurie et la formation de calculs.
Diarrhée
Informez les patients que la diarrhée est un problème courant causé par les antibiotiques qui se termine généralement lorsque l'antibiotique est arrêté. Parfois, après le début du traitement aux antibiotiques, les patients peuvent développer des selles liquides et sanglantes (avec ou sans crampes d'estomac et fièvre) même deux mois ou plus après avoir pris la dernière dose de l'antibiotique. Si cela se produit, les patients doivent contacter leur médecin dès que possible.
