Zocor 5mg, 10mg, 20mg, 40mg Simvastatin Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Zocor et comment est-il utilisé ?
Zocor (simvastatine) est un médicament délivré sur ordonnance utilisé pour abaisser les niveaux de « mauvais » cholestérol (lipoprotéines de basse densité ou LDL) et pour augmenter les niveaux de « bon » cholestérol (lipoprotéines de haute densité ou HDL) et pour abaisser la triglycérine ainsi que pour réduire le risque d'accident vasculaire cérébral et de crise cardiaque. Zocor peut être utilisé seul ou avec d'autres médicaments.
Zocor appartient à une classe de médicaments appelés agents hypolipémiants, statines, inhibiteurs de l'HMG-CoA réductase.
On ne sait pas si Zocor est sûr et efficace chez les enfants de moins de 10 ans.
Quels sont les effets secondaires possibles de Zocor?
Zocor 20 mg peut provoquer des effets secondaires graves, notamment :
- perte d'appétit,
- douleur à l'estomac en haut à droite,
- fatigue,
- démangeaison,
- urine foncée,
- selles de couleur argile, et
- jaunissement de la peau ou des yeux
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Zocor comprennent :
- mal de tête,
- nausée,
- Douleur d'estomac,
- la constipation et
- symptômes du rhume (nez bouché, éternuements ou mal de gorge)
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Zocor. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
LA DESCRIPTION
ZOCOR (simvastatine) est un agent hypolipidémiant dérivé synthétiquement d'un produit de fermentation d'Aspergillus terreus. Après ingestion orale, la simvastatine, qui est une lactone inactive, est hydrolysée en la forme β-hydroxyacide correspondante. Il s'agit d'un inhibiteur de la 3-hydroxy-3-méthylglutaryl-coenzyme A (HMG-CoA) réductase. Cette enzyme catalyse la conversion de HMG-CoA en mévalonate, qui est une étape précoce et limitante dans la biosynthèse du cholestérol.
La simvastatine est l'acide butanoïque, 2,2-diméthyl-,1,2,3,7,8,8a-hexahydro-3,7-diméthyl-8-[2-(tétrahydro-4hydroxy-6-oxo-2H-pyran- Ester de 2-yl)-éthyl]-1-naphtalényle, [1S-[1α,3α,7β,8β(2S*,4S*),-8aβ]]. La formule empirique de la simvastatine est C25H38O5 et son poids moléculaire est de 418,57. Sa formule structurale est :
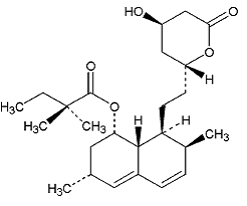
La simvastatine est une poudre cristalline blanche à blanc cassé, non hygroscopique, pratiquement insoluble dans l'eau et librement soluble dans le chloroforme, le méthanol et l'éthanol.
Les comprimés ZOCOR pour administration orale contiennent soit 5 mg, 10 mg, 20 mg, 40 mg ou 80 mg de simvastatine et les ingrédients inactifs suivants : acide ascorbique, acide citrique, hydroxypropylcellulose, hypromellose, oxydes de fer, lactose, stéarate de magnésium, cellulose microcristalline. , amidon, talc et dioxyde de titane. L'hydroxyanisole butylé est ajouté comme conservateur.
LES INDICATIONS
La thérapie avec des agents altérant les lipides ne devrait être qu'un élément de l'intervention sur les facteurs de risque multiples chez les personnes présentant un risque significativement accru de maladie vasculaire athéroscléreuse due à l'hypercholestérolémie. Le traitement médicamenteux est indiqué en complément d'un régime alimentaire lorsque la réponse à un régime restreint en graisses saturées et en cholestérol et à d'autres mesures non pharmacologiques seules a été inadéquate. Chez les patients atteints de maladie coronarienne (CHD) ou à haut risque de maladie coronarienne, ZOCOR® peut être démarré en même temps qu'un régime alimentaire.
Réductions du risque de mortalité coronarienne et d'événements cardiovasculaires
Chez les patients à haut risque d'événements coronariens en raison d'une maladie coronarienne existante, d'un diabète, d'une maladie des vaisseaux périphériques, d'antécédents d'accident vasculaire cérébral ou d'une autre maladie cérébrovasculaire, ZOCOR 5 mg est indiqué pour :
- Réduire le risque de mortalité totale en réduisant les décès coronariens.
- Réduire le risque d'infarctus du myocarde non mortel et d'accident vasculaire cérébral.
- Réduire le besoin de procédures de revascularisation coronarienne et non coronarienne.
Hyperlipidémie
ZOCOR est indiqué pour :
- Réduire le cholestérol total élevé (C total), le cholestérol des lipoprotéines de basse densité (LDL-C), l'apolipoprotéine B (Apo B) et les triglycérides (TG), et augmenter le cholestérol des lipoprotéines de haute densité (HDL-C) chez les patients atteints hyperlipidémie primaire (type IIa de Fredrickson, famille hétérozygote et non familiale) ou dyslipidémie mixte (type IIb de Fredrickson).
- Réduire les taux élevés de TG chez les patients atteints d'hypertriglycéridémie (hyperlipidémie de type IV de Fredrickson).
- Réduire les taux élevés de TG et de VLDL-C chez les patients atteints de dysbêtalipoprotéinémie primaire (hyperlipidémie de Fredrickson de type lll).
- Réduire le C total et le LDL-C chez les patients atteints d'hypercholestérolémie familiale homozygote (HoFH) en complément d'autres traitements hypolipidémiants (p. ex. aphérèse des LDL) ou si ces traitements ne sont pas disponibles.
Patients adolescents atteints d'hypercholestérolémie familiale hétérozygote (HeFH)
ZOCOR est indiqué en complément d'un régime alimentaire pour réduire les taux de C total, de LDL-C et d'Apo B chez les garçons et les filles adolescents âgés d'au moins un an après la ménarche, âgés de 10 à 17 ans, atteints d'HeFH, si après une essai adéquat de thérapie diététique, les résultats suivants sont présents :
- Il y a des antécédents familiaux positifs de maladie cardiovasculaire prématurée (MCV) ou
- Deux ou plusieurs autres facteurs de risque de MCV sont présents chez le patient adolescent.
L'objectif minimum du traitement chez les patients pédiatriques et adolescents est d'atteindre un LDL-C moyen
Limites d'utilisation
ZOCOR 20 mg n'a pas été étudié dans des conditions où l'anomalie majeure est l'élévation des chylomicrons (c'est-à-dire l'hyperlipidémie Fredrickson de types I et V).
DOSAGE ET ADMINISTRATION
Dosage recommandé
La gamme posologique habituelle est de 5 à 40 mg/jour. Chez les patients atteints de coronaropathie ou à haut risque de coronaropathie, ZOCOR peut être démarré en même temps qu'un régime alimentaire. La dose initiale habituelle recommandée est de 10 ou 20 mg une fois par jour le soir. Pour les patients présentant un risque élevé d'événement coronarien en raison d'une coronaropathie existante, d'un diabète, d'une maladie des vaisseaux périphériques, d'antécédents d'accident vasculaire cérébral ou d'une autre maladie cérébrovasculaire, la dose initiale recommandée est de 40 mg/jour. Les dosages lipidiques doivent être effectués après 4 semaines de traitement et périodiquement par la suite.
Dosage restreint pour 80 mg
En raison du risque accru de myopathie, y compris de rhabdomyolyse, en particulier pendant la première année de traitement, l'utilisation de la dose de 80 mg de ZOCOR doit être limitée aux patients qui prennent de la simvastatine 80 mg de façon chronique (par exemple, depuis 12 mois ou plus) sans signe de toxicité musculaire [voir AVERTISSEMENTS ET PRECAUTIONS ].
Les patients qui tolèrent actuellement la dose de 80 mg de ZOCOR et qui doivent être initiés à un médicament interagissant contre-indiqué ou associé à un plafond de dose pour la simvastatine doivent être remplacés par une autre statine présentant moins de potentiel d'interaction médicamenteuse.
En raison du risque accru de myopathie, y compris de rhabdomyolyse, associé à la dose de 80 mg de ZOCOR 40 mg, les patients incapables d'atteindre leur objectif de C-LDL en utilisant la dose de 40 mg de ZOCOR 5 mg ne doivent pas être titrés à la dose de 80 mg , mais doit être placé sous un ou des traitements alternatifs de réduction du LDL-C qui permettent une plus grande réduction du LDL-C.
Co-administration avec d'autres médicaments
Patients prenant du vérapamil, du diltiazem ou de la dronédarone
- La dose de ZOCOR ne doit pas dépasser 10 mg/jour [voir AVERTISSEMENTS ET PRECAUTIONS , INTERACTIONS MÉDICAMENTEUSES , et PHARMACOLOGIE CLINIQUE ].
Patients prenant de l'amiodarone, de l'amlodipine ou de la ranolazine
- La dose de ZOCOR 10 mg ne doit pas dépasser 20 mg/jour [voir AVERTISSEMENTS ET PRECAUTIONS , INTERACTIONS MÉDICAMENTEUSES , et PHARMACOLOGIE CLINIQUE ].
Patients atteints d'hypercholestérolémie familiale homozygote
La posologie recommandée est de 40 mg/jour le soir [Voir DOSAGE ET ADMINISTRATION , Dosage restreint pour 80 mg ]. ZOCOR 5 mg doit être utilisé en complément d'autres traitements hypolipémiants (par exemple aphérèse des LDL) chez ces patients ou si ces traitements ne sont pas disponibles.
L'exposition à la simvastatine est approximativement doublée en cas d'utilisation concomitante de lomitapide ; par conséquent, la dose de ZOCOR doit être réduite de 50 % en cas d'initiation du lomitapide. La posologie de ZOCOR 5 mg ne doit pas dépasser 20 mg/jour (ou 40 mg/jour pour les patients qui ont déjà pris ZOCOR 80 mg/jour de manière chronique, par exemple pendant 12 mois ou plus, sans signe de toxicité musculaire) pendant la prise de lomitapide.
Adolescents (âgés de 10 à 17 ans) atteints d'hypercholestérolémie familiale hétérozygote
La dose initiale habituelle recommandée est de 10 mg une fois par jour le soir. La plage posologique recommandée est de 10 à 40 mg/jour ; la dose maximale recommandée est de 40 mg/jour. Les doses doivent être individualisées en fonction de l'objectif thérapeutique recommandé [voir Lignes directrices du comité pédiatrique du NCEP1 et Etudes cliniques ]. Les ajustements doivent être effectués à des intervalles de 4 semaines ou plus.
Patients atteints d'insuffisance rénale
Étant donné que ZOCOR 5 mg ne subit pas d'excrétion rénale significative, une modification de la posologie ne devrait pas être nécessaire chez les patients présentant une insuffisance rénale légère à modérée. Cependant, la prudence s'impose lorsque ZOCOR 20 mg est administré à des patients présentant une insuffisance rénale sévère ; ces patients doivent commencer à 5 mg/jour et être étroitement surveillés [voir AVERTISSEMENTS ET PRECAUTIONS et PHARMACOLOGIE CLINIQUE ].
COMMENT FOURNIE
Formes posologiques et points forts
- Les comprimés ZOCOR 5 mg sont des comprimés chamois, ovales, pelliculés, portant le code MSD 726 sur une face et ZOCOR 5 sur l'autre.
- Les comprimés ZOCOR 10 mg sont des comprimés pêche, ovales, pelliculés, portant le code MSD 735 sur une face et lisses sur l'autre.
- Les comprimés ZOCOR 20 mg sont des comprimés pelliculés de couleur beige, ovales, portant le code MSD 740 sur une face et lisses sur l'autre.
- Les comprimés ZOCOR 40 mg sont des comprimés pelliculés rouge brique, ovales, portant le code MSD 749 sur une face et lisses sur l'autre.
- Les comprimés de ZOCOR 80 mg sont des comprimés pelliculés rouge brique, en forme de gélule, codés 543 sur une face et 80 sur l'autre.
Stockage et manutention
N° 8146 - Comprimés ZOCOR 10 mg sont des comprimés pêche, ovales, pelliculés, portant le code MSD 735 sur une face et lisses sur l'autre. Ils sont fournis comme suit :
CDN 0006-0735-31 unité d'utilisation flacons de 30 CDN 0006-0735-54 unité d'utilisation flacons de 90.
N° 8147 - Comprimés ZOCOR 20 mg sont des comprimés pelliculés de couleur beige, ovales, portant le code MSD 740 sur une face et lisses sur l'autre. Ils sont fournis comme suit :
CDN 0006-0740-31 unité d'utilisation flacons de 30 CDN 0006-0740-54 unité d'utilisation flacons de 90.
N° 8148 - Comprimés ZOCOR 40 mg sont des comprimés pelliculés rouge brique, ovales, portant le code MSD 749 sur une face et lisses sur l'autre. Ils sont fournis comme suit :
CDN 0006-0749-31 unité d'utilisation flacons de 30 CDN 0006-0749-54 unité d'utilisation flacons de 90.
N° 6577 - Comprimés ZOCOR 80 mg sont des comprimés pelliculés de couleur rouge brique, en forme de gélule, codés 543 sur une face et 80 sur l'autre. Ils sont fournis comme suit :
CDN 0006-0543-31 unité d'utilisation flacons de 30 CDN 0006-0543-54 unité d'utilisation flacons de 90.
Stockage
Conserver entre 5 et 30 °C (41 et 86 °F).
1Programme national d'éducation sur le cholestérol (NCEP) : Faits saillants du rapport du groupe d'experts sur les taux de cholestérol sanguin chez les enfants et les adolescents. Pédiatrie. 89(3):495-501. 1992.
Fabriqué par : Merck Sharp & Dohme Ltd. Cramlington, Northumberland, Royaume-Uni NE23 3JU. Révisé : septembre 2020
EFFETS SECONDAIRES
Expérience des essais cliniques
Étant donné que les essais cliniques sont menés dans des conditions très variables, les taux d'effets indésirables observés dans les essais cliniques d'un médicament ne peuvent pas être directement comparés aux taux des essais cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique.
Dans les études cliniques contrôlées de pré-commercialisation et leurs extensions ouvertes (2 423 patients avec une durée médiane de suivi d'environ 18 mois), 1,4 % des patients ont été arrêtés en raison d'effets indésirables. Les effets indésirables les plus fréquents ayant conduit à l'arrêt du traitement ont été : troubles gastro-intestinaux (0,5 %), myalgies (0,1 %) et arthralgies (0,1 %). Les effets indésirables les plus fréquemment rapportés (incidence ≥ 5 %) dans les essais cliniques contrôlés sur la simvastatine étaient : infections des voies respiratoires supérieures (9,0 %), céphalées (7,4 %), douleurs abdominales (7,3 %), constipation (6,6 %) et nausées (5,4 %). %).
Étude scandinave sur la survie de la simvastatine
Dans 4S impliquant 4 444 (tranche d'âge 35-71 ans, 19 % de femmes, 100 % de Caucasiens) traités avec 20-40 mg/jour de ZOCOR (n = 2 221) ou un placebo (n = 2 223) sur une durée médiane de 5,4 ans, des effets indésirables les réactions rapportées chez ≥ 2 % des patients et à un taux supérieur à celui du placebo sont présentées dans le tableau 2.
Étude sur la protection cardiaque
Dans l'étude de protection cardiaque (HPS), impliquant 20 536 patients (tranche d'âge de 40 à 80 ans, 25 % de femmes, 97 % de race blanche, 3 % d'autres races) traités par ZOCOR 40 mg/jour (n = 10 269) ou un placebo (n = 10 267) sur une moyenne de 5 ans, seuls les effets indésirables graves et les arrêts dus à des effets indésirables ont été enregistrés. Les taux d'abandon en raison d'effets indésirables étaient de 4,8 % chez les patients traités par ZOCOR 10 mg, contre 5,1 % chez les patients traités par placebo. L'incidence de myopathie/rhabdomyolyse était
Autres études cliniques
Dans un essai clinique au cours duquel 12 064 patients ayant des antécédents d'infarctus du myocarde ont été traités par ZOCOR (suivi moyen de 6,7 ans), l'incidence de la myopathie (définie comme une faiblesse ou une douleur musculaire inexpliquée avec une créatine kinase [CK] sérique > 10 fois limite supérieure de la normale [LSN]) chez les patients sous 80 mg/jour était d'environ 0,9 % contre 0,02 % chez les patients sous 20 mg/jour. L'incidence de la rhabdomyolyse (définie comme une myopathie avec une CK > 40 fois la LSN) chez les patients sous 80 mg/jour était d'environ 0,4 % contre 0 % chez les patients sous 20 mg/jour. L'incidence de la myopathie, y compris la rhabdomyolyse, était la plus élevée au cours de la première année, puis a considérablement diminué au cours des années de traitement suivantes. Dans cet essai, les patients ont été étroitement surveillés et certains médicaments interagissant ont été exclus.
Les autres effets indésirables signalés dans les essais cliniques étaient les suivants : diarrhée, éruption cutanée, dyspepsie, flatulence et asthénie.
Tests de laboratoire
Des augmentations persistantes marquées des transaminases hépatiques ont été notées [voir AVERTISSEMENTS ET PRECAUTIONS ]. Des taux élevés de phosphatase alcaline et de γ-glutamyl transpeptidase ont également été signalés. Environ 5 % des patients ont présenté des élévations des taux de CK de 3 fois ou plus la valeur normale à une ou plusieurs occasions. Cela était attribuable à la fraction non cardiaque de la CK. [voir AVERTISSEMENTS ET PRECAUTIONS ]
Patients adolescents (âgés de 10 à 17 ans)
Dans une étude contrôlée de 48 semaines chez des adolescents, garçons et filles, âgés d'au moins 1 an après la ménarche, âgés de 10 à 17 ans (43,4 % de femmes, 97,7 % de Caucasiens, 1,7 % d'Hispaniques, 0,6 % de Multiraciale) atteints d'hypercholestérolémie familiale hétérozygote (n = 175), traités par placebo ou ZOCOR (10 à 40 mg par jour), les effets indésirables les plus fréquemment observés dans les deux groupes étaient les infections des voies respiratoires supérieures, les maux de tête, les douleurs abdominales et les nausées [voir Utilisation dans des populations spécifiques et Etudes cliniques ].
Expérience post-commercialisation
Étant donné que les réactions ci-dessous sont signalées volontairement par une population de taille incertaine, il n'est généralement pas possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale avec l'exposition au médicament. Les effets indésirables supplémentaires suivants ont été identifiés au cours de l'utilisation post-approbation de la simvastatine : prurit, alopécie, divers changements cutanés (par exemple, nodules, décoloration, sécheresse de la peau/des muqueuses, changements des cheveux/des ongles), étourdissements, crampes musculaires, myalgie , pancréatite, paresthésie, neuropathie périphérique, vomissements, anémie, dysfonction érectile, maladie pulmonaire interstitielle, rhabdomyolyse, hépatite/jaunisse, insuffisance hépatique mortelle et non mortelle et dépression.
De rares cas de myopathie nécrosante à médiation immunitaire associés à l'utilisation de statines ont été signalés [voir AVERTISSEMENTS ET PRECAUTIONS ].
Un syndrome d'hypersensibilité apparente a rarement été rapporté, incluant certaines des caractéristiques suivantes : anaphylaxie, œdème de Quincke, syndrome de type lupus érythémateux, polymyalgie rhumatismale, dermatomyosite, vascularite, purpura, thrombocytopénie, leucopénie, anémie hémolytique, ANA positifs, augmentation de la VS, éosinophilie , arthrite, arthralgie, urticaire, asthénie, photosensibilité, fièvre, frissons, bouffées vasomotrices, malaise, dyspnée, nécrolyse épidermique toxique, érythème polymorphe, y compris syndrome de Stevens-Johnson.
Il y a eu de rares rapports post-commercialisation de troubles cognitifs (par exemple, perte de mémoire, oubli, amnésie, troubles de la mémoire, confusion) associés à l'utilisation de statines. Ces problèmes cognitifs ont été signalés pour toutes les statines. Les rapports sont généralement non graves et réversibles à l'arrêt des statines, avec des délais variables d'apparition des symptômes (1 jour à plusieurs années) et de résolution des symptômes (médiane de 3 semaines).
INTERACTIONS MÉDICAMENTEUSES
Inhibiteurs puissants du CYP3A4, cyclosporine ou danazol
Inhibiteurs puissants du CYP3A4 : la simvastatine, comme plusieurs autres inhibiteurs de l'HMG-CoA réductase, est un substrat du CYP3A4. La simvastatine est métabolisée par le CYP3A4 mais n'a pas d'activité inhibitrice du CYP3A4 ; par conséquent, on ne s'attend pas à ce qu'il affecte les concentrations plasmatiques d'autres médicaments métabolisés par le CYP3A4.
Des taux plasmatiques élevés d'activité inhibitrice de l'HMG-CoA réductase augmentent le risque de myopathie et de rhabdomyolyse, en particulier avec des doses plus élevées de simvastatine. [voir AVERTISSEMENTS ET PRECAUTIONS et PHARMACOLOGIE CLINIQUE ] L'utilisation concomitante de médicaments étiquetés comme ayant un fort effet inhibiteur sur le CYP3A4 est contre-indiquée [voir CONTRE-INDICATIONS ]. Si un traitement par l'itraconazole, le kétoconazole, le posaconazole, le voriconazole, l'érythromycine, la clarithromycine ou la télithromycine est inévitable, le traitement par la simvastatine doit être suspendu pendant la durée du traitement.
Ciclosporine ou Danazol : Le risque de myopathie, y compris de rhabdomyolyse, est accru par l'administration concomitante de ciclosporine ou de danazol. Par conséquent, l'utilisation concomitante de ces médicaments est contre-indiquée [voir CONTRE-INDICATIONS , AVERTISSEMENTS ET PRECAUTIONS et PHARMACOLOGIE CLINIQUE ].
Médicaments hypolipidémiants pouvant causer une myopathie lorsqu'ils sont administrés seuls
Gemfibrozil
Contre-indiqué avec la simvastatine [voir CONTRE-INDICATIONS et AVERTISSEMENTS ET PRECAUTIONS ].
Autres fibrates
La prudence s'impose lors de la prescription de simvastatine [voir AVERTISSEMENTS ET PRECAUTIONS ].
Amiodarone, dronédarone, ranolazine ou inhibiteurs calciques
Le risque de myopathie, y compris de rhabdomyolyse, est accru par l'administration concomitante d'amiodarone, de dronédarone, de ranolazine ou d'inhibiteurs calciques tels que le vérapamil, le diltiazem ou l'amlodipine [voir DOSAGE ET ADMINISTRATION et AVERTISSEMENTS ET PRECAUTIONS , et le tableau 3 dans PHARMACOLOGIE CLINIQUE ].
Niacine
Des cas de myopathie/rhabdomyolyse ont été observés avec la simvastatine co-administrée avec des doses modificatrices des lipides (≥ 1 g/jour de niacine) de produits contenant de la niacine. Le risque de myopathie est plus élevé chez les patients chinois. Dans un essai clinique (suivi médian de 3,9 ans) impliquant des patients à haut risque de maladie cardiovasculaire et avec des taux de LDL-C bien contrôlés sous simvastatine 40 mg/jour avec ou sans ézétimibe 10 mg/jour, il n'y a pas eu de bénéfice supplémentaire sur résultats cardiovasculaires avec l'ajout de doses modificateurs des lipides (≥1 g/jour) de niacine. L'administration concomitante de ZOCOR avec des doses modificatrices des lipides (≥ 1 g/jour) de niacine n'est pas recommandée chez les patients chinois. On ne sait pas si ce risque s'applique à d'autres patients asiatiques [voir AVERTISSEMENTS ET PRECAUTIONS et Utilisation dans des populations spécifiques ].
Digoxine
Dans une étude, l'administration concomitante de digoxine et de simvastatine a entraîné une légère élévation des concentrations de digoxine dans le plasma. Les patients prenant de la digoxine doivent être surveillés de manière appropriée lors de l'instauration de la simvastatine [voir PHARMACOLOGIE CLINIQUE ].
Anticoagulants coumariniques
Dans deux études cliniques, l'une chez des volontaires sains et l'autre chez des patients hypercholestérolémiques, la simvastatine 20-40 mg/jour a modérément potentialisé l'effet des anticoagulants coumariniques : le temps de prothrombine, rapporté en International Normalized Ratio (INR), a augmenté à partir d'une ligne de base de 1,7 à 1,8 et de 2,6 à 3,4 dans les études sur les volontaires et les patients, respectivement. Avec d'autres statines, des saignements cliniquement évidents et/ou une augmentation du temps de prothrombine ont été rapportés chez quelques patients prenant simultanément des anticoagulants coumariniques. Chez ces patients, le temps de prothrombine doit être déterminé avant de commencer la simvastatine et suffisamment fréquemment au début du traitement pour s'assurer qu'aucune modification significative du temps de prothrombine ne se produit. Une fois qu'un temps de prothrombine stable a été documenté, les temps de prothrombine peuvent être surveillés aux intervalles habituellement recommandés pour les patients sous anticoagulants coumariniques. Si la dose de simvastatine est modifiée ou interrompue, la même procédure doit être répétée. Le traitement par la simvastatine n'a pas été associé à des saignements ou à des modifications du temps de prothrombine chez les patients ne prenant pas d'anticoagulants.
Colchicine
Des cas de myopathie, y compris de rhabdomyolyse, ont été rapportés avec la simvastatine co-administrée avec la colchicine, et la prudence s'impose lors de la prescription de simvastatine avec la colchicine.
Daptomycine
Des cas de rhabdomyolyse ont été rapportés avec la simvastatine administrée avec la daptomycine. La simvastatine et la daptomycine peuvent provoquer une myopathie et une rhabdomyolyse lorsqu'elles sont administrées seules et le risque de myopathie et de rhabdomyolyse peut être augmenté en cas d'administration concomitante. Interrompre temporairement ZOCOR chez les patients prenant de la daptomycine [voir AVERTISSEMENTS ET PRECAUTIONS ].
AVERTISSEMENTS
Inclus dans le cadre du "PRÉCAUTIONS" Section
PRÉCAUTIONS
Myopathie/Rhabdomyolyse
La simvastatine provoque occasionnellement une myopathie se manifestant par des douleurs musculaires, une sensibilité ou une faiblesse avec une créatine kinase (CK) supérieure à dix fois la limite supérieure de la normale (LSN). La myopathie prend parfois la forme d'une rhabdomyolyse avec ou sans insuffisance rénale aiguë secondaire à une myoglobinurie, et de rares décès sont survenus. Le risque de myopathie est accru par des taux plasmatiques élevés de simvastatine et d'acide de simvastatine. Les facteurs prédisposant à la myopathie comprennent l'âge avancé (≥ 65 ans), le sexe féminin, l'hypothyroïdie non contrôlée et l'insuffisance rénale. Les patients chinois peuvent présenter un risque accru de myopathie [voir Utilisation dans des populations spécifiques ].
Le risque de myopathie, y compris de rhabdomyolyse, est lié à la dose. Dans une base de données d'essais cliniques dans laquelle 41 413 patients ont été traités par ZOCOR 10 mg, dont 24 747 (environ 60 %) ont participé à des études avec un suivi médian d'au moins 4 ans, l'incidence de la myopathie était d'environ 0,03 % et 0,08 % à 20 et 40 mg/jour, respectivement. L'incidence de myopathie avec 80 mg (0,61 %) était disproportionnellement plus élevée que celle observée aux doses plus faibles. Dans ces essais, les patients ont été étroitement surveillés et certains médicaments interagissant ont été exclus.
Dans un essai clinique au cours duquel 12 064 patients ayant des antécédents d'infarctus du myocarde ont été traités par ZOCOR (suivi moyen de 6,7 ans), l'incidence de la myopathie (définie comme une faiblesse ou une douleur musculaire inexpliquée avec une créatine kinase [CK] sérique > 10 fois limite supérieure de la normale [LSN]) chez les patients sous 80 mg/jour était d'environ 0,9 % contre 0,02 % chez les patients sous 20 mg/jour. L'incidence de la rhabdomyolyse (définie comme une myopathie avec une CK > 40 fois la LSN) chez les patients sous 80 mg/jour était d'environ 0,4 % contre 0 % chez les patients sous 20 mg/jour. L'incidence de la myopathie, y compris la rhabdomyolyse, était la plus élevée au cours de la première année, puis a considérablement diminué au cours des années de traitement suivantes. Dans cet essai, les patients ont été étroitement surveillés et certains médicaments interagissant ont été exclus.
Le risque de myopathie, y compris de rhabdomyolyse, est plus élevé chez les patients sous simvastatine 80 mg par rapport à d'autres traitements par statine ayant une efficacité similaire ou supérieure sur la réduction du LDL-C et par rapport à des doses plus faibles de simvastatine. Par conséquent, la dose de 80 mg de ZOCOR ne doit être utilisée que chez les patients hospitalisés qui ont pris de la simvastatine 80 mg de manière chronique (par exemple, pendant 12 mois ou plus) sans preuve de toxicité musculaire. [Voir DOSAGE ET ADMINISTRATION , Dosage restreint pour 80 mg ]. Si, toutefois, un patient qui tolère actuellement la dose de 80 mg de ZOCOR doit être initié à un médicament interagissant qui est contre-indiqué ou est associé à un plafond de dose pour la simvastatine, ce patient doit être remplacé par une statine alternative avec moins de potentiel pour le interaction médicament-médicament. Les patients doivent être informés du risque accru de myopathie, y compris de rhabdomyolyse, et doivent signaler rapidement toute douleur, sensibilité ou faiblesse musculaire inexpliquée. Si des symptômes apparaissent, le traitement doit être interrompu immédiatement. [voir Myopathie nécrosante à médiation immunitaire ]
Tous les patients commençant un traitement par ZOCOR 20 mg, ou dont la dose de ZOCOR est augmentée, doivent être informés du risque de myopathie, y compris de rhabdomyolyse, et doivent signaler rapidement toute douleur, sensibilité ou faiblesse musculaire inexpliquée, en particulier si elle est accompagnée de malaise ou de fièvre ou si des signes musculaires et les symptômes persistent après l'arrêt de ZOCOR. Le traitement par ZOCOR doit être interrompu immédiatement si une myopathie est diagnostiquée ou suspectée. Dans la plupart des cas, les symptômes musculaires et les augmentations de CK ont disparu lorsque le traitement a été rapidement interrompu. Des déterminations périodiques de la CK peuvent être envisagées chez les patients commençant un traitement par ZOCOR 5 mg ou dont la dose est augmentée, mais rien ne garantit qu'une telle surveillance empêchera la myopathie.
De nombreux patients qui ont développé une rhabdomyolyse sous traitement par la simvastatine ont eu des antécédents médicaux compliqués, y compris une insuffisance rénale généralement consécutive à un diabète sucré de longue date. Ces patients méritent une surveillance plus étroite. Le traitement par ZOCOR doit être interrompu si des taux de CPK nettement élevés se produisent ou si une myopathie est diagnostiquée ou suspectée. Le traitement par ZOCOR doit également être temporairement suspendu chez tout patient présentant une affection aiguë ou grave prédisposant au développement d'une insuffisance rénale secondaire à une rhabdomyolyse, par exemple une septicémie ; hypotonie; une intervention chirurgicale majeure; traumatisme; troubles métaboliques, endocriniens ou électrolytiques graves ; ou épilepsie non contrôlée.
Interactions médicamenteuses
Le risque de myopathie et de rhabdomyolyse est augmenté par des taux plasmatiques élevés de simvastatine et d'acide de simvastatine. La simvastatine est métabolisée par l'isoforme 3A4 du cytochrome P450. Certains médicaments qui inhibent cette voie métabolique peuvent augmenter les taux plasmatiques de simvastatine et augmenter le risque de myopathie. Ceux-ci comprennent l'itraconazole, le kétoconazole, le posaconazole, le voriconazole, les antibiotiques macrolides érythromycine et clarithromycine, et l'antibiotique kétolide télithromycine, les inhibiteurs de la protéase du VIH, le bocéprévir, le télaprévir, l'antidépresseur néfazodone, les produits contenant du cobicistat ou le jus de pamplemousse [voir PHARMACOLOGIE CLINIQUE ]. L'association de ces médicaments avec la simvastatine est contre-indiquée. Si un traitement à court terme avec des inhibiteurs puissants du CYP3A4 est inévitable, le traitement par la simvastatine doit être suspendu pendant la durée du traitement [voir CONTRE-INDICATIONS et INTERACTIONS MÉDICAMENTEUSES ].
L'utilisation combinée de la simvastatine avec le gemfibrozil, la cyclosporine ou le danazol est contre-indiquée [voir CONTRE-INDICATIONS et INTERACTIONS MÉDICAMENTEUSES ].
La prudence s'impose lors de la prescription d'autres fibrates avec la simvastatine, car ces agents peuvent provoquer une myopathie lorsqu'ils sont administrés seuls et le risque est accru lorsqu'ils sont co-administrés [voir INTERACTIONS MÉDICAMENTEUSES ].
Des cas de myopathie, y compris de rhabdomyolyse, ont été rapportés avec la simvastatine co-administrée avec la colchicine, et la prudence s'impose lors de la prescription de simvastatine avec la colchicine [voir INTERACTIONS MÉDICAMENTEUSES ].
Les bénéfices de l'utilisation combinée de la simvastatine avec les médicaments suivants doivent être soigneusement pesés par rapport aux risques potentiels des associations : autres médicaments hypolipidémiants (fibrates ou, pour les patients atteints d'HFHo, lomitapide), amiodarone, dronédarone, vérapamil, diltiazem, amlodipine, ou la ranolazine [Voir DOSAGE ET ADMINISTRATION , INTERACTIONS MÉDICAMENTEUSES ].
Des cas de myopathie, y compris de rhabdomyolyse, ont été observés avec la simvastatine co-administrée avec des doses modificatrices des lipides (≥ 1 g/jour de niacine) de produits contenant de la niacine [voir INTERACTIONS MÉDICAMENTEUSES ].
Des cas de rhabdomyolyse ont été rapportés avec la simvastatine administrée avec la daptomycine. Interrompre temporairement ZOCOR chez les patients prenant de la daptomycine [voir INTERACTIONS MÉDICAMENTEUSES ].
Les recommandations de prescription pour les agents interagissants sont résumées dans le tableau 1 [voir aussi DOSAGE ET ADMINISTRATION , INTERACTIONS MÉDICAMENTEUSES , PHARMACOLOGIE CLINIQUE ].
Myopathie nécrosante à médiation immunitaire
De rares cas de myopathie nécrosante à médiation immunitaire (IMNM), une myopathie auto-immune, associée à l'utilisation de statines ont été signalés. L'IMNM se caractérise par : une faiblesse musculaire proximale et une élévation de la créatine kinase sérique, qui persistent malgré l'arrêt du traitement par statine ; anticorps anti-HMG CoA réductase positif; biopsie musculaire montrant une myopathie nécrosante ; et amélioration avec des agents immunosuppresseurs. Des tests neuromusculaires et sérologiques supplémentaires peuvent être nécessaires. Un traitement avec des agents immunosuppresseurs peut être nécessaire. Envisagez attentivement le risque d'IMNM avant d'initier une autre statine. Si le traitement est initié avec une statine différente, surveiller les signes et symptômes de l'IMNM.
Dysfonctionnement du foie
Des augmentations persistantes (jusqu'à plus de 3 fois la LSN) des transaminases sériques se sont produites chez environ 1 % des patients qui ont reçu de la simvastatine dans les études cliniques. Lorsque le traitement médicamenteux était interrompu ou interrompu chez ces patients, les taux de transaminases chutaient habituellement lentement aux taux préthérapeutiques. Les augmentations n'étaient pas associées à la jaunisse ou à d'autres signes ou symptômes cliniques. Il n'y avait aucun signe d'hypersensibilité.
Dans l'étude scandinave sur la survie de la simvastatine (4S) [voir Etudes cliniques ], le nombre de patients avec plus d'une élévation des transaminases à > 3X LSN, au cours de l'étude, n'était pas significativement différent entre les groupes simvastatine et placebo (14 [0,7 %] contre 12 [0,6 %]). Des transaminases élevées ont entraîné l'arrêt du traitement chez 8 patients du groupe simvastatine (n = 2 221) et 5 dans le groupe placebo (n = 2 223). Sur les 1 986 patients traités par la simvastatine en 4S avec des tests de la fonction hépatique (LFT) normaux au départ, 8 (0,4 %) ont développé des élévations consécutives du LFT à > 3 X ULN et/ou ont été arrêtés en raison d'élévations des transaminases au cours des 5,4 ans (suivi médian ) de l'étude. Parmi ces 8 patients, 5 ont initialement développé ces anomalies au cours de la première année. Tous les patients de cette étude ont reçu une dose initiale de 20 mg de simvastatine ; 37 % ont été titrés à 40 mg.
Dans 2 études cliniques contrôlées chez 1 105 patients, l'incidence sur 12 mois de l'élévation persistante des transaminases hépatiques sans égard à la relation médicamenteuse était de 0,9 % et de 2,1 % aux doses de 40 et 80 mg, respectivement. Aucun patient n'a développé d'anomalies persistantes de la fonction hépatique après les 6 premiers mois de traitement à une dose donnée.
Il est recommandé d'effectuer des tests de la fonction hépatique avant le début du traitement, puis par la suite lorsque cela est cliniquement indiqué. De rares cas d'insuffisance hépatique mortelle et non mortelle ont été rapportés après commercialisation chez des patients prenant des statines, y compris la simvastatine. Si une atteinte hépatique grave accompagnée de symptômes cliniques et/ou d'hyperbilirubinémie ou d'ictère survient pendant le traitement par ZOCOR 5 mg, interrompez rapidement le traitement. Si une autre étiologie n'est pas trouvée, ne pas redémarrer ZOCOR. Notez que l'ALT peut émaner du muscle, donc une augmentation de l'ALT avec la CK peut indiquer une myopathie [voir Myopathie/Rhabdomyolyse ].
Le médicament doit être utilisé avec prudence chez les patients qui consomment des quantités importantes d'alcool et/ou qui ont des antécédents de maladie du foie. Les maladies hépatiques actives ou les élévations inexpliquées des transaminases sont des contre-indications à l'utilisation de la simvastatine.
Des élévations modérées (moins de 3 fois la LSN) des transaminases sériques ont été rapportées après un traitement par la simvastatine. Ces modifications sont apparues peu après le début du traitement par la simvastatine, étaient souvent transitoires, ne s'accompagnaient d'aucun symptôme et n'ont pas nécessité l'interruption du traitement.
Fonction endocrinienne
Des augmentations de l'HbA1c et de la glycémie à jeun ont été rapportées avec les inhibiteurs de l'HMG-CoA réductase, y compris ZOCOR.
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Dans une étude de cancérogénicité de 72 semaines, des souris ont reçu des doses quotidiennes de simvastatine de 25, 100 et 400 mg/kg de poids corporel, ce qui a entraîné des taux plasmatiques moyens de médicament environ 1, 4 et 8 fois plus élevés que le médicament plasmatique humain moyen. niveau, respectivement (en tant qu'activité inhibitrice totale basée sur l'ASC) après une dose orale de 80 mg. Les carcinomes du foie ont augmenté de façon significative chez les femelles à dose élevée et les mâles à dose moyenne et élevée avec une incidence maximale de 90 % chez les mâles. L'incidence des adénomes du foie a augmenté de façon significative chez les femelles recevant les doses moyenne et élevée. Le traitement médicamenteux a également augmenté de manière significative l'incidence des adénomes pulmonaires chez les mâles et les femelles recevant des doses moyennes et élevées. Les adénomes de la glande de Harder (une glande de l'œil des rongeurs) étaient significativement plus nombreux chez les souris recevant la dose élevée que chez les témoins. Aucun signe d'effet tumorigène n'a été observé à 25 mg/kg/jour.
Dans une étude distincte de cancérogénicité de 92 semaines chez la souris à des doses allant jusqu'à 25 mg/kg/jour, aucun signe d'effet tumorigène n'a été observé (les taux plasmatiques moyens de médicament étaient 1 fois plus élevés que chez l'homme ayant reçu 80 mg de simvastatine, mesurés par l'ASC).
Dans une étude de deux ans chez le rat à 25 mg/kg/jour, il y a eu une augmentation statistiquement significative de l'incidence des adénomes folliculaires thyroïdiens chez les rats femelles exposés à des niveaux environ 11 fois plus élevés de simvastatine que chez les humains ayant reçu 80 mg de simvastatine (sous forme mesurée par l'ASC).
Une deuxième étude de cancérogénicité de deux ans chez le rat avec des doses de 50 et 100 mg/kg/jour a produit des adénomes et des carcinomes hépatocellulaires (chez les rats femelles aux deux doses et chez les mâles à 100 mg/kg/jour). Les adénomes des cellules folliculaires thyroïdiennes ont augmenté chez les mâles et les femelles aux deux doses; les carcinomes des cellules folliculaires thyroïdiennes ont augmenté chez les femelles à 100 mg/kg/jour. L'incidence accrue de néoplasmes thyroïdiens semble être cohérente avec les résultats d'autres statines. Ces niveaux de traitement représentaient des concentrations plasmatiques de médicament (AUC) d'environ 7 et 15 fois (hommes) et 22 et 25 fois (femmes) l'exposition plasmatique humaine moyenne au médicament après une dose quotidienne de 80 milligrammes.
Aucun signe de mutagénicité n'a été observé dans un test de mutagénicité microbienne (Ames) avec ou sans activation métabolique du foie de rat ou de souris. De plus, aucune preuve de dommage au matériel génétique n'a été notée dans un test d'élution alcaline in vitro utilisant des hépatocytes de rat, une étude de mutation directe de cellules de mammifères V-79, une étude d'aberration chromosomique in vitro dans des cellules CHO ou un test d'aberration chromosomique in vivo. dans la moelle osseuse de souris.
Il y avait une diminution de la fertilité chez les rats mâles traités par la simvastatine pendant 34 semaines à 25 mg/kg de poids corporel (4 fois le niveau d'exposition humaine maximale, basé sur l'ASC, chez les patients recevant 80 mg/jour) ; cependant, cet effet n'a pas été observé lors d'une étude de fertilité ultérieure dans laquelle la simvastatine a été administrée à ce même niveau de dose à des rats mâles pendant 11 semaines (le cycle complet de la spermatogenèse, y compris la maturation épididymaire). Aucun changement microscopique n'a été observé dans les testicules des rats de l'une ou l'autre des études. À 180 mg/kg/jour (ce qui produit des niveaux d'exposition 22 fois supérieurs à ceux des humains prenant 80 mg/jour en fonction de la surface, mg/m2), une dégénérescence des tubules séminifères (nécrose et perte d'épithélium spermatogène) a été observée. Chez les chiens, il y a eu une atrophie testiculaire liée au médicament, une diminution de la spermatogenèse, une dégénérescence spermatocytaire et une formation de cellules géantes à 10 mg/kg/jour (environ 2 fois l'exposition humaine, basée sur l'ASC, à 80 mg/jour). La signification clinique de ces résultats n'est pas claire.
Utilisation dans des populations spécifiques
Grossesse
Catégorie de grossesse X [Voir CONTRE-INDICATIONS ]
ZOCOR est contre-indiqué chez les femmes enceintes ou susceptibles de l'être. Les médicaments hypolipidémiants n'offrent aucun avantage pendant la grossesse, car le cholestérol et les dérivés du cholestérol sont nécessaires au développement normal du fœtus. L'athérosclérose est un processus chronique et l'arrêt des médicaments hypolipidémiants pendant la grossesse devrait avoir peu d'impact sur les résultats à long terme du traitement primaire de l'hypercholestérolémie. Il n'y a pas d'études adéquates et bien contrôlées sur l'utilisation de ZOCOR pendant la grossesse ; cependant, de rares cas d'anomalies congénitales ont été signalés chez des nourrissons exposés aux statines in utero. Les études de reproduction animale de la simvastatine chez le rat et le lapin n'ont montré aucun signe de tératogénicité. Le cholestérol sérique et les triglycérides augmentent pendant la grossesse normale, et le cholestérol ou les dérivés du cholestérol sont essentiels au développement du fœtus. Étant donné que les statines diminuent la synthèse du cholestérol et éventuellement la synthèse d'autres substances biologiquement actives dérivées du cholestérol, ZOCOR peut être nocif pour le fœtus lorsqu'il est administré à une femme enceinte. Si ZOCOR 5 mg est utilisé pendant la grossesse ou si la patiente devient enceinte pendant la prise de ce médicament, la patiente doit être informée du danger potentiel pour le fœtus.
De rares cas d'anomalies congénitales ont été signalés à la suite d'une exposition intra-utérine aux statines. Dans une revue2 d'environ 100 grossesses suivies de manière prospective chez des femmes exposées à la simvastatine ou à une autre statine structurellement apparentée, les incidences d'anomalies congénitales, d'avortements spontanés et de morts fœtales/mortinaissances n'ont pas dépassé celles attendues dans la population générale. Cependant, l'étude n'a pu exclure qu'un risque accru de 3 à 4 fois d'anomalies congénitales par rapport au taux de base. Dans 89 % de ces cas, le traitement médicamenteux a été instauré avant la grossesse et a été interrompu au cours du premier trimestre lorsque la grossesse a été identifiée.
La simvastatine n'a pas été tératogène chez le rat ou le lapin à des doses (25, 10 mg/kg/jour, respectivement) qui ont entraîné 3 fois l'exposition humaine sur la base de la surface en mg/m2. Cependant, dans des études avec une autre statine structurellement apparentée, des malformations squelettiques ont été observées chez les rats et les souris.
Manson, JM, Freyssinges, C., Ducrocq, MB, Stephenson, WP, Surveillance post-commercialisation de l'exposition à la lovastatine et à la simvastatine pendant la grossesse, Toxicologie de la reproduction, 10(6):439-446, 1996.
Il doit être conseillé aux femmes en âge de procréer nécessitant un traitement par ZOCOR 5 mg pour un trouble lipidique d'utiliser une contraception efficace. Pour les femmes essayant de concevoir, l'arrêt de ZOCOR doit être envisagé. En cas de grossesse, ZOCOR doit être immédiatement arrêté.
Mères allaitantes
On ne sait pas si la simvastatine est excrétée dans le lait maternel. Étant donné qu'une petite quantité d'un autre médicament de cette classe est excrétée dans le lait maternel et en raison du risque d'effets indésirables graves chez les nourrissons, les femmes prenant de la simvastatine ne doivent pas allaiter leurs nourrissons. Une décision doit être prise d'interrompre l'allaitement ou d'arrêter le médicament, en tenant compte de l'importance du médicament pour la mère [voir CONTRE-INDICATIONS ].
Utilisation pédiatrique
L'innocuité et l'efficacité de la simvastatine chez les patients âgés de 10 à 17 ans atteints d'hypercholestérolémie familiale hétérozygote ont été évaluées dans un essai clinique contrôlé chez des garçons adolescents et chez des filles qui avaient au moins 1 an après la ménarche. Les patients traités par la simvastatine avaient un profil d'effets indésirables similaire à celui des patients traités par placebo. Les doses supérieures à 40 mg n'ont pas été étudiées dans cette population. Dans cette étude contrôlée limitée, il n'y avait aucun effet significatif sur la croissance ou la maturation sexuelle chez les adolescents ou les adolescentes, ou sur la durée du cycle menstruel chez les filles. [Voir DOSAGE ET ADMINISTRATION , EFFETS INDÉSIRABLES , Etudes cliniques ] Les adolescentes doivent être conseillées sur les méthodes contraceptives appropriées pendant le traitement par la simvastatine [voir CONTRE-INDICATIONS et Grossesse ]. La simvastatine n'a pas été étudiée chez les patientes de moins de 10 ans, ni chez les filles préménarchées.
Utilisation gériatrique
Sur les 2 423 patients qui ont reçu ZOCOR 5 mg dans les études cliniques de phase III et les 10 269 patients de l'étude sur la protection cardiaque qui ont reçu ZOCOR 40 mg, 363 (15 %) et 5 366 (52 %), respectivement, étaient âgés de ≥ 65 ans. Dans HPS, 615 (6 %) avaient ≥ 75 ans. Aucune différence globale d'innocuité ou d'efficacité n'a été observée entre ces sujets et les sujets plus jeunes, et d'autres expériences cliniques rapportées n'ont pas identifié de différences dans les réponses entre les patients âgés et les patients plus jeunes, mais une plus grande sensibilité de certains individus plus âgés ne peut être exclue. L'âge avancé (≥ 65 ans) étant un facteur prédisposant à la myopathie, ZOCOR doit être prescrit avec prudence chez les personnes âgées. [Voir PHARMACOLOGIE CLINIQUE ]
Une étude pharmacocinétique avec la simvastatine a montré que le niveau plasmatique moyen d'activité des statines était environ 45 % plus élevé chez les patients âgés de 70 à 78 ans par rapport aux patients âgés de 18 à 30 ans. Dans 4S, 1 021 (23 %) des 4 444 patients avaient 65 ans ou plus. L'efficacité hypolipidémiante était au moins aussi élevée chez les patients âgés que chez les patients plus jeunes, et ZOCOR a significativement réduit la mortalité totale et la mortalité coronarienne chez les patients âgés ayant des antécédents de coronaropathie. Dans le SHP, 52 % des patients étaient âgés (4 891 patients de 65 à 69 ans et 5 806 patients de 70 ans ou plus). Les réductions relatives du risque de décès par coronaropathie, d'IM non mortel, de procédures de revascularisation coronarienne et non coronarienne et d'accident vasculaire cérébral étaient similaires chez les patients plus âgés et plus jeunes [voir Etudes cliniques ]. Dans le SHP, parmi 32 145 patients entrant dans la période de rodage active, il y a eu 2 cas de myopathie/rhabdomyolyse ; ces patients étaient âgés de 67 et 73 ans. Sur les 7 cas de myopathie/rhabdomyolyse parmi 10 269 patients affectés à la simvastatine, 4 étaient âgés de 65 ans ou plus (au départ), dont un de plus de 75 ans. et les patients plus jeunes en 4S ou HPS.
L'âge avancé (≥ 65 ans) étant un facteur prédisposant à la myopathie, y compris la rhabdomyolyse, ZOCOR 40 mg doit être prescrit avec prudence chez la personne âgée. Dans un essai clinique mené chez des patients traités par la simvastatine 80 mg/jour, les patients âgés de ≥ 65 ans présentaient un risque accru de myopathie, y compris de rhabdomyolyse, par rapport aux patients âgés de moins de 65 ans. [voir AVERTISSEMENTS ET PRECAUTIONS et PHARMACOLOGIE CLINIQUE ]
Insuffisance rénale
La prudence s'impose lorsque ZOCOR 20 mg est administré à des patients présentant une insuffisance rénale sévère.[Voir DOSAGE ET ADMINISTRATION ]
Insuffisance hépatique
ZOCOR 10 mg est contre-indiqué chez les patients atteints d'une maladie hépatique active pouvant inclure des élévations persistantes inexpliquées des taux de transaminases hépatiques [voir CONTRE-INDICATIONS et AVERTISSEMENTS ET PRECAUTIONS ].
Patients chinois
Dans un essai clinique au cours duquel des patients à haut risque de maladie cardiovasculaire étaient traités par la simvastatine 40 mg/jour (suivi médian de 3,9 ans), l'incidence de la myopathie était d'environ 0,05 % chez les patients non chinois (n = 7 367) par rapport à 0,24 % pour les patients chinois (n=5468). L'incidence de la myopathie chez les patients chinois sous simvastatine 40 mg/jour ou ézétimibe/simvastatine 10/40 mg/jour co-administrés avec la niacine à libération prolongée 2 g/jour était de 1,24 %.
Les patients chinois peuvent être plus à risque de myopathie, surveillez les patients de manière appropriée. L'administration concomitante de ZOCOR 10 mg avec des doses modificatrices des lipides (≥ 1 g/jour de niacine) de produits contenant de la niacine n'est pas recommandée chez les patients chinois [voir AVERTISSEMENTS ET PRECAUTIONS , INTERACTIONS MÉDICAMENTEUSES ].
SURDOSAGE
Une létalité significative a été observée chez la souris après une dose orale unique de 9 g/m2. Aucun signe de létalité n'a été observé chez les rats ou les chiens traités avec des doses de 30 et 100 g/m2, respectivement. Aucun signe diagnostique spécifique n'a été observé chez les rongeurs. À ces doses, les seuls signes observés chez le chien étaient des vomissements et des selles mucoïdes.
Quelques cas de surdosage avec ZOCOR ont été rapportés ; la dose maximale prise était de 3,6 g. Tous les patients se sont rétablis sans séquelles. Des mesures de soutien doivent être prises en cas de surdosage. La dialysabilité de la simvastatine et de ses métabolites chez l'homme n'est pas connue à l'heure actuelle.
CONTRE-INDICATIONS
ZOCOR 40mg est contre-indiqué dans les conditions suivantes :
- Administration concomitante d'inhibiteurs puissants du CYP3A4 (p. ex., itraconazole, kétoconazole, posaconazole, voriconazole, inhibiteurs de la protéase du VIH, bocéprévir, télaprévir, érythromycine, clarithromycine, télithromycine, néfazodone et produits contenant du cobicistat) [voir AVERTISSEMENTS ET PRECAUTIONS ].
- Administration concomitante de gemfibrozil, de cyclosporine ou de danazol [voir AVERTISSEMENTS ET PRECAUTIONS ].
- Hypersensibilité à l'un des composants de ce médicament [voir EFFETS INDÉSIRABLES ].
- Maladie hépatique active, pouvant inclure des élévations persistantes inexpliquées des taux de transaminases hépatiques [voir AVERTISSEMENTS ET PRECAUTIONS ].
- Les femmes enceintes ou susceptibles de le devenir. Le cholestérol sérique et les triglycérides augmentent pendant la grossesse normale, et le cholestérol ou les dérivés du cholestérol sont essentiels au développement du fœtus. Étant donné que les inhibiteurs de l'HMG-CoA réductase (statines) diminuent la synthèse du cholestérol et éventuellement la synthèse d'autres substances biologiquement actives dérivées du cholestérol, ZOCOR 40 mg peut être nocif pour le fœtus lorsqu'il est administré à une femme enceinte. L'athérosclérose est un processus chronique et l'arrêt des médicaments hypolipidémiants pendant la grossesse devrait avoir peu d'impact sur les résultats d'un traitement à long terme de l'hypercholestérolémie primaire. Il n'y a pas d'études adéquates et bien contrôlées sur l'utilisation de ZOCOR pendant la grossesse ; cependant, dans de rares cas, des anomalies congénitales ont été observées après une exposition intra-utérine aux statines. Dans les études de reproduction chez le rat et le lapin, la simvastatine n'a révélé aucun signe de tératogénicité. ZOCOR ne doit être administré aux femmes en âge de procréer que lorsqu'il est très peu probable que ces patientes deviennent enceintes. Si la patiente devient enceinte pendant la prise de ce médicament, ZOCOR doit être arrêté immédiatement et la patiente doit être informée du risque potentiel pour le fœtus [voir Utilisation dans des populations spécifiques ].
- Les mères allaitantes. On ne sait pas si la simvastatine est excrétée dans le lait maternel ; cependant, une petite quantité d'un autre médicament de cette classe passe dans le lait maternel. Étant donné que les statines peuvent entraîner des effets indésirables graves chez les nourrissons, les femmes qui nécessitent un traitement par ZOCOR ne doivent pas allaiter leurs nourrissons [voir Utilisation dans des populations spécifiques ].
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
La simvastatine est une prodrogue et est hydrolysée en sa forme β-hydroxyacide active, l'acide simvastatine, après administration. La simvastatine est un inhibiteur spécifique de la 3-hydroxy-3-méthylglutaryl-coenzyme A (HMG-CoA) réductase, l'enzyme qui catalyse la conversion de l'HMG-CoA en mévalonate, une étape précoce et limitante de la voie de biosynthèse du cholestérol. De plus, la simvastatine réduit les VLDL et les TG et augmente le HDL-C.
Pharmacodynamie
Des études épidémiologiques ont démontré que des niveaux élevés de C total, de LDL-C, ainsi que des niveaux réduits de HDL-C sont associés au développement de l'athérosclérose et à un risque cardiovasculaire accru. L'abaissement du LDL-C diminue ce risque. Cependant, l'effet indépendant de l'augmentation du HDL-C ou de la diminution des TG sur le risque de morbidité et de mortalité coronariennes et cardiovasculaires n'a pas été déterminé.
Pharmacocinétique
La simvastatine est une lactone facilement hydrolysée in vivo en β-hydroxyacide correspondant, un puissant inhibiteur de l'HMG-CoA réductase. L'inhibition de l'HMG-CoA réductase est la base d'un dosage dans les études pharmacocinétiques des métabolites β-hydroxyacides (inhibiteurs actifs) et, après hydrolyse basique, des inhibiteurs actifs et latents (inhibiteurs totaux) dans le plasma suite à l'administration de simvastatine.
Après une dose orale de simvastatine marquée au 14C chez l'homme, 13 % de la dose a été excrétée dans l'urine et 60 % dans les fèces. Les concentrations plasmatiques de la radioactivité totale (simvastatine plus métabolites 14C) ont culminé à 4 heures et ont diminué rapidement jusqu'à environ 10 % du pic 12 heures après l'administration. Étant donné que la simvastatine subit une extraction extensive de premier passage dans le foie, la disponibilité du médicament dans la circulation générale est faible (
La simvastatine et son métabolite β-hydroxyacide sont fortement liés (environ 95 %) aux protéines plasmatiques humaines. Des études chez le rat indiquent que lorsque la simvastatine radiomarquée a été administrée, la radioactivité dérivée de la simvastatine a traversé la barrière hémato-encéphalique.
Les principaux métabolites actifs de la simvastatine présents dans le plasma humain sont le β-hydroxyacide de la simvastatine et ses dérivés 6′-hydroxy, 6′-hydroxyméthyle et 6′-exométhylène. Les concentrations plasmatiques maximales des inhibiteurs actifs et totaux ont été atteintes dans les 1,3 à 2,4 heures suivant l'administration. Alors que la gamme de doses thérapeutiques recommandées est de 5 à 40 mg/jour, il n'y a pas eu d'écart substantiel par rapport à la linéarité de l'ASC des inhibiteurs dans la circulation générale avec une augmentation de la dose jusqu'à 120 mg. Par rapport à l'état de jeûne, le profil plasmatique des inhibiteurs n'a pas été affecté lorsque la simvastatine a été administrée immédiatement avant un repas faible en gras recommandé par l'American Heart Association.
Dans une étude incluant 16 patients âgés entre 70 et 78 ans ayant reçu ZOCOR 40 mg/jour, le taux plasmatique moyen d'activité inhibitrice de l'HMG-CoA réductase a augmenté d'environ 45 % par rapport à 18 patients âgés de 18 à 30 ans. L'expérience des études cliniques chez les personnes âgées (n = 1522) suggère qu'il n'y avait pas de différences globales de sécurité entre les patients âgés et les patients plus jeunes [voir Utilisation dans des populations spécifiques ].
Des études cinétiques avec une autre statine, ayant une voie principale d'élimination similaire, ont suggéré que pour une dose donnée, une exposition systémique plus élevée peut être obtenue chez les patients présentant une insuffisance rénale sévère (mesurée par la clairance de la créatinine).
L'acide simvastatine est un substrat de la protéine de transport OATP1B1. L'administration concomitante de médicaments inhibiteurs de la protéine de transport OATP1B1 peut entraîner une augmentation des concentrations plasmatiques de simvastatine acide et un risque accru de myopathie. Par exemple, il a été démontré que la cyclosporine augmente l'ASC des statines ; bien que le mécanisme ne soit pas entièrement compris, l'augmentation de l'ASC de la simvastatine acide est vraisemblablement due, en partie, à l'inhibition du CYP3A4 et/ou de l'OATP1B1.
Le risque de myopathie est augmenté par des niveaux élevés d'activité inhibitrice de l'HMG-CoA réductase dans le plasma. Les inhibiteurs du CYP3A4 peuvent augmenter les taux plasmatiques de l'activité inhibitrice de l'HMG-CoA réductase et augmenter le risque de myopathie [voir AVERTISSEMENTS ET PRECAUTIONS et INTERACTIONS MÉDICAMENTEUSES ].
Dans une étude portant sur 12 volontaires sains, la simvastatine à la dose de 80 mg n'a eu aucun effet sur le métabolisme des substrats sondes de l'isoforme 3A4 du cytochrome P450 (CYP3A4), le midazolam et l'érythromycine. Cela indique que la simvastatine n'est pas un inhibiteur du CYP3A4 et, par conséquent, on ne s'attend pas à ce qu'elle affecte les taux plasmatiques d'autres médicaments métabolisés par le CYP3A4.
L'administration concomitante de simvastatine (40 mg une fois par jour pendant 10 jours) a entraîné une augmentation des taux moyens maximaux de digoxine cardioactive (administrée en une dose unique de 0,4 mg au jour 10) d'environ 0,3 ng/mL.
Toxicologie animale et/ou pharmacologie
Toxicité du SNC
Une dégénérescence du nerf optique a été observée chez des chiens cliniquement normaux traités par la simvastatine pendant 14 semaines à 180 mg/kg/jour, une dose qui a produit des taux plasmatiques moyens de médicament environ 12 fois plus élevés que le taux plasmatique moyen de médicament chez les humains prenant 80 mg/jour.
Un médicament chimiquement similaire de cette classe a également produit une dégénérescence du nerf optique (dégénérescence wallérienne des fibres rétinogéniques) chez des chiens cliniquement normaux de manière dose-dépendante à partir de 60 mg/kg/jour, une dose qui a produit des taux plasmatiques moyens de médicament environ 30 fois plus élevés. que la concentration plasmatique moyenne du médicament chez les humains prenant la dose recommandée la plus élevée (telle que mesurée par l'activité inhibitrice enzymatique totale). Ce même médicament a également produit une dégénérescence vestibulocochléaire de type Wallerian et une chromatolyse des cellules ganglionnaires rétiniennes chez des chiens traités pendant 14 semaines à 180 mg/kg/jour, une dose qui a entraîné une concentration plasmatique moyenne de médicament similaire à celle observée avec le médicament à 60 mg/kg/jour. dose journalière.
Des lésions vasculaires du SNC, caractérisées par une hémorragie et un œdème périvasculaires, une infiltration de cellules mononucléaires dans les espaces périvasculaires, des dépôts périvasculaires de fibrine et une nécrose des petits vaisseaux ont été observées chez des chiens traités par la simvastatine à une dose de 360 mg/kg/jour, une dose qui a produit du plasma moyen. des niveaux de médicament qui étaient environ 14 fois plus élevés que les niveaux plasmatiques moyens de médicament chez les humains prenant 80 mg/jour. Des lésions vasculaires similaires du SNC ont été observées avec plusieurs autres médicaments de cette classe.
Il y a eu des cataractes chez les rats femelles après deux ans de traitement avec 50 et 100 mg/kg/jour (22 et 25 fois l'ASC humaine à 80 mg/jour, respectivement) et chez les chiens après trois mois à 90 mg/kg/jour ( 19 fois) et à deux ans à 50 mg/kg/jour (5 fois).
Etudes cliniques
Études cliniques chez l'adulte
Réductions du risque de mortalité coronarienne et d'événements cardiovasculaires
Dans 4S, l'effet du traitement par ZOCOR 20 mg sur la mortalité totale a été évalué chez 4 444 patients atteints de coronaropathie et de cholestérol total initial de 212 à 309 mg/dL (5,5 à 8,0 mmol/L). Dans cette étude multicentrique, randomisée, en double aveugle et contrôlée par placebo, les patients ont été traités avec les soins standard, y compris un régime alimentaire, et soit ZOCOR 20-40 mg/jour (n = 2 221) soit un placebo (n = 2 223) pendant une durée médiane de 5,4 ans. Au cours de l'étude, le traitement par ZOCOR a entraîné des réductions moyennes du C total, du LDL-C et des TG de 25 %, 35 % et 10 %, respectivement, et une augmentation moyenne du HDL-C de 8 %. ZOCOR a significativement réduit le risque de mortalité de 30 % (p=0,0003, 182 décès dans le groupe ZOCOR 40 mg contre 256 décès dans le groupe placebo). Le risque de mortalité coronarienne a été significativement réduit de 42 % (p = 0,00001, 111 vs 189 décès). Il n'y avait pas de différence statistiquement significative entre les groupes en termes de mortalité non cardiovasculaire. ZOCOR a significativement réduit le risque d'événements coronariens majeurs (mortalité coronarienne plus infarctus du myocarde non mortel [IM] confirmé à l'hôpital et silencieux) de 34 % (p
L'étude HPS (Heart Protection Study) était une vaste étude multicentrique, contrôlée contre placebo, en double aveugle d'une durée moyenne de 5 ans menée chez 20 536 patients (10 269 sous ZOCOR 40 mg et 10 267 sous placebo). Les patients ont été affectés au traitement à l'aide d'une méthode adaptative covariable3 qui a pris en compte la distribution de 10 caractéristiques de base importantes des patients déjà inscrits et a minimisé le déséquilibre de ces caractéristiques entre les groupes. Les patients avaient un âge moyen de 64 ans (intervalle de 40 à 80 ans), étaient à 97 % de race blanche et présentaient un risque élevé de développer un événement coronarien majeur en raison d'une maladie coronarienne existante (65 %), du diabète (type 2, 26 % ; type 1 , 3 %), antécédents d'accident vasculaire cérébral ou autre maladie cérébrovasculaire (16 %), maladie des vaisseaux périphériques (33 %) ou hypertension chez les hommes ≥ 65 ans (6 %). Au départ, 3 421 patients (17 %) avaient des taux de LDL-C inférieurs à 100 mg/dL, dont 953 (5 %) avaient des taux de LDL-C inférieurs à 80 mg/dL ; 7 068 patients (34 %) avaient des niveaux entre 100 et 130 mg/dL ; et 10 047 patients (49 %) avaient des taux supérieurs à 130 mg/dL.
DR Taves, Minimisation : une nouvelle méthode d'affectation des patients aux groupes de traitement et de contrôle. Clin. Pharmacol. Là. 15 (1974), pages 443-453
Les résultats HPS ont montré que ZOCOR 40 mg/jour réduisait significativement : la mortalité totale et coronarienne ; IDM non mortels, AVC et interventions de revascularisation (coronaires et non coronariennes) (voir tableau 4).
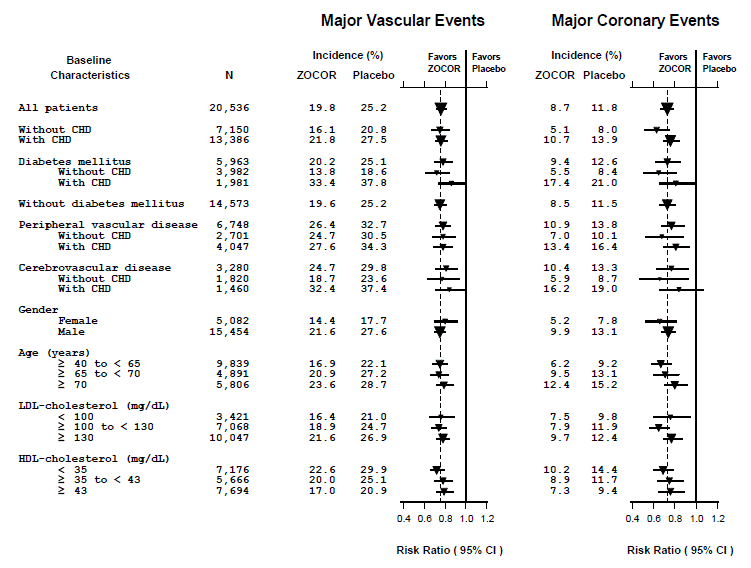
Deux critères d'évaluation composites ont été définis afin d'avoir suffisamment d'événements pour évaluer les réductions de risque relatives sur une gamme de caractéristiques de base (voir Figure 1). Un composite d'événements coronariens majeurs (ECM) comprenait la mortalité coronarienne et l'IM non mortel (analysé par le délai avant le premier événement ; 898 patients traités avec ZOCOR 5 mg ont eu des événements et 1 212 patients sous placebo ont eu des événements). Un composite d'événements vasculaires majeurs (EMV) était composé d'ECM, d'accident vasculaire cérébral et de procédures de revascularisation, y compris les procédures coronariennes, périphériques et autres non coronariennes (analysées par le délai avant le premier événement ; 2 033 patients traités par ZOCOR 10 mg ont eu des événements et 2 585 patients sous placebo a eu des événements). Des réductions significatives du risque relatif ont été observées pour les deux paramètres composites (27 % pour MCE et 24 % pour MVE, p
Figure 1 Les effets du traitement par ZOCOR 5 mg sur les événements vasculaires majeurs et les événements coronariens majeurs dans le SHP
Études angiographiques
Dans l'étude multicentrique anti-athérome, l'effet de la simvastatine sur l'athérosclérose a été évalué par angiographie coronarienne quantitative chez des patients hypercholestérolémiques atteints de coronaropathie. Dans cette étude randomisée, en double aveugle et contrôlée, les patients ont été traités par la simvastatine 20 mg/jour ou un placebo. Les angiographies ont été évaluées au départ, à deux et quatre ans. Les critères d'évaluation co-primaires de l'étude étaient le changement moyen par patient des diamètres minimum et moyen de la lumière, indiquant respectivement une maladie focale et diffuse. ZOCOR a significativement ralenti la progression des lésions mesurée dans l'angiographie de l'année 4 par les deux paramètres, ainsi que par la variation du pourcentage de sténose du diamètre. De plus, la simvastatine a significativement diminué la proportion de patients avec de nouvelles lésions et avec de nouvelles occlusions totales.
Modifications des profils lipidiques
Hyperlipidémie primaire (Fredrickson type lla et llb)
ZOCOR s'est avéré efficace pour réduire le C total et le C-LDL dans les formes familiales et non familiales hétérozygotes d'hyperlipidémie et dans l'hyperlipidémie mixte. La réponse maximale à presque maximale est généralement obtenue en 4 à 6 semaines et maintenue pendant le traitement chronique. ZOCOR a significativement diminué le C total, le C-LDL, le rapport C-total/C-HDL et le rapport C-LDL/C-HDL ; ZOCOR a également diminué les TG et augmenté le HDL-C (voir tableau 5).
Hypertriglycéridémie (Fredrickson Type lV)
Les résultats d'une analyse de sous-groupe chez 74 patients atteints d'hyperlipidémie de type lV dans le cadre d'une étude croisée de 130 patients, en double aveugle, contrôlée par placebo et à 3 périodes sont présentés dans le tableau 6.
Dysbêtalipoprotéinémie (Fredrickson Type lll)
Les résultats d'une analyse de sous-groupe chez 7 patients atteints d'hyperlipidémie de type III (dysbêtalipoprotéinémie) (apo E2/2) (VLDL-C/TG>0,25) d'une étude croisée de 130 patients, en double aveugle, contrôlée par placebo, en 3 périodes sont présentés dans le tableau 7.
Hypercholestérolémie familiale homozygote
Dans une étude clinique contrôlée, 12 patients âgés de 15 à 39 ans atteints d'hypercholestérolémie familiale homozygote ont reçu de la simvastatine 40 mg/jour en une prise unique ou en 3 prises fractionnées, ou 80 mg/jour en 3 prises fractionnées. Chez 11 patients présentant des réductions du LDL-C, les variations moyennes du LDL-C pour les doses de 40 et 80 mg étaient de 14 % (intervalle de 8 % à 23 %, médiane de 12 %) et de 30 % (intervalle de 14 % à 46 % , médiane 29 %), respectivement. Un patient a eu une augmentation de 15% du LDL-C. Un autre patient avec une fonction de récepteur LDL-C absente a présenté une réduction de 41 % du LDL-C avec la dose de 80 mg.
Fonction endocrinienne
Dans les études cliniques, la simvastatine n'a pas altéré la réserve surrénalienne ni réduit significativement la concentration basale de cortisol plasmatique. De petites réductions par rapport aux valeurs initiales de la testostérone plasmatique basale chez les hommes ont été observées dans les études cliniques avec la simvastatine, un effet également observé avec d'autres statines et la cholestyramine séquestrante des acides biliaires. Il n'y a eu aucun effet sur les taux plasmatiques de gonadotrophines. Dans une étude de 12 semaines contrôlée contre placebo, la simvastatine 80 mg n'a pas eu d'effet significatif sur la réponse plasmatique de la testostérone à la gonadotrophine chorionique humaine. Dans une autre étude de 24 semaines, la simvastatine 20-40 mg n'a eu aucun effet détectable sur la spermatogenèse. Dans l'étude 4S, au cours de laquelle 4 444 patients ont été randomisés pour recevoir de la simvastatine 20-40 mg/jour ou un placebo pendant une durée médiane de 5,4 ans, l'incidence des événements indésirables sexuels masculins dans les deux groupes de traitement n'était pas significativement différente. En raison de ces facteurs, il est peu probable que les petites modifications de la testostérone plasmatique soient cliniquement significatives. Les effets, le cas échéant, sur l'axe hypophyso-gonadique chez les femmes pré-ménopausées sont inconnus.
Études cliniques chez les adolescents
Dans une étude en double aveugle contrôlée par placebo, 175 patients (99 garçons adolescents et 76 filles post-ménarchiques) âgés de 10 à 17 ans (âge moyen : 14,1 ans) atteints d'hypercholestérolémie familiale hétérozygote (HeFH) ont été randomisés pour recevoir de la simvastatine (n= 106) ou un placebo (n = 67) pendant 24 semaines (étude de base). L'inclusion dans l'étude nécessitait un niveau de base de LDL-C entre 160 et 400 mg/dL et au moins un parent avec un niveau de LDL-C > 189 mg/dL. La dose de simvastatine (une fois par jour le soir) était de 10 mg pendant les 8 premières semaines, de 20 mg pendant les 8 semaines suivantes et de 40 mg par la suite. Dans une prolongation de 24 semaines, 144 patients ont choisi de poursuivre le traitement par la simvastatine 40 mg ou un placebo.
ZOCOR 20 mg a diminué de manière significative les taux plasmatiques de C total, de LDL-C et d'Apo B (voir tableau 8). Les résultats de l'extension à 48 semaines étaient comparables à ceux observés dans l'étude de base.
Après 24 semaines de traitement, la valeur moyenne de LDL-C atteinte était de 124,9 mg/dL (intervalle : 64,0289,0 mg/dL) dans le groupe ZOCOR 40 mg par rapport à 207,8 mg/dL (intervalle : 128,0-334,0 mg/dL) dans le groupe placebo.
L'innocuité et l'efficacité de doses supérieures à 40 mg par jour n'ont pas été étudiées chez les enfants atteints d'HFHe. L'efficacité à long terme du traitement par la simvastatine chez l'enfant pour réduire la morbidité et la mortalité à l'âge adulte n'a pas été établie.
INFORMATIONS PATIENTS
Les patients doivent être informés qu'ils doivent respecter le régime alimentaire recommandé par le programme national d'éducation sur le cholestérol (NCEP), un programme d'exercices réguliers et des tests périodiques d'un panel de lipides à jeun.
Les patients doivent être informés des substances qu'ils ne doivent pas prendre en concomitance avec la simvastatine. [voir CONTRE-INDICATIONS et AVERTISSEMENTS ET PRECAUTIONS ]. Il faut également conseiller aux patients d'informer les autres professionnels de la santé prescrivant un nouveau médicament ou augmentant la dose d'un médicament existant qu'ils prennent ZOCOR.
Douleur musculaire
Tous les patients commençant un traitement par ZOCOR doivent être informés du risque de myopathie, y compris de rhabdomyolyse, et doivent signaler rapidement toute douleur, sensibilité ou faiblesse musculaire inexpliquée, en particulier si elles s'accompagnent de malaises ou de fièvre ou si ces signes ou symptômes musculaires persistent après l'arrêt de ZOCOR. Les patients utilisant la dose de 80 mg doivent être informés que le risque de myopathie, y compris la rhabdomyolyse, est augmenté avec l'utilisation de la dose de 80 mg. Le risque de myopathie, y compris de rhabdomyolyse, survenant avec l'utilisation de ZOCOR 40 mg est augmenté lors de la prise de certains types de médicaments ou de la consommation de jus de pamplemousse. Les patients doivent discuter de tous les médicaments, qu'ils soient sur ordonnance ou en vente libre, avec leur professionnel de la santé.
Des enzymes hépatiques
Il est recommandé que des tests de la fonction hépatique soient effectués avant le début de ZOCOR 20 mg, et par la suite lorsque cela est cliniquement indiqué. Tous les patients traités par ZOCOR doivent être informés de signaler rapidement tout symptôme pouvant indiquer une atteinte hépatique, notamment fatigue, anorexie, gêne abdominale supérieure droite, urine foncée ou jaunisse.
Grossesse
Il convient de conseiller aux femmes en âge de procréer d'utiliser une méthode de contraception efficace pour prévenir une grossesse lors de l'utilisation de ZOCOR. Discutez de vos futurs projets de grossesse avec vos patientes et discutez du moment où elles doivent arrêter de prendre ZOCOR 40 mg si elles essaient de concevoir. Les patientes doivent être informées qu'en cas de grossesse, elles doivent arrêter de prendre ZOCOR et appeler leur professionnel de la santé.
Allaitement maternel
Les femmes qui allaitent ne doivent pas utiliser ZOCOR. Les patientes qui ont un trouble lipidique et qui allaitent doivent être avisées de discuter des options avec leur professionnel de la santé.
