Tricor 160mg, 200mg Fenofibrate Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Tricor et comment est-il utilisé ?
Tricor est un médicament d'ordonnance utilisé pour traiter les symptômes de cholestérol et de triglycérides (acides gras) dans le sang. Tricor peut être utilisé seul ou avec d'autres médicaments.
- Tricor appartient à une classe de médicaments appelés agents d'acide fibrique.
- On ne sait pas si Tricor 200mg est sûr et efficace chez les enfants
Quels sont les effets secondaires possibles de Tricor ?
Tricor 200 mg peut provoquer des effets secondaires graves, notamment :
- douleur aiguë à l'estomac se propageant au dos ou à l'omoplate,
- perte d'appétit,
- douleurs à l'estomac juste après un repas,
- jaunissement de la peau ou des yeux (jaunisse),
- fièvre,
- des frissons,
- la faiblesse,
- mal de gorge,
- plaies buccales,
- ecchymoses ou saignements inhabituels,
- douleur thoracique,
- toux soudaine,
- respiration sifflante,
- Respiration rapide,
- cracher du sang, et
- gonflement, chaleur ou rougeur dans un bras ou une jambe
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Tricor incluent :
- nez qui coule,
- éternuements, et
- tests de laboratoire anormaux
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Tricor. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
LA DESCRIPTION
TRICOR (comprimés de fénofibrate) est un agent régulateur des lipides disponible sous forme de comprimés pour administration orale. Chaque comprimé contient 54 mg ou 160 mg de fénofibrate. Le nom chimique du fénofibrate est l'acide 2-[4-(4-chlorobenzoyl)phénoxy]-2-méthyl-propanoïque, ester 1-méthyléthylique avec la formule structurale suivante :
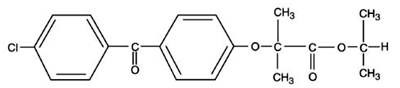
La formule empirique est C20H21O4Cl et le poids moléculaire est de 360,83 ; le fénofibrate est insoluble dans l'eau. Le point de fusion est de 79-82°C. Le fénofibrate est un solide blanc stable dans les conditions ordinaires.
ingrédients inactifs
Chaque comprimé contient du dioxyde de silicium colloïdal, de la crospovidone, du lactose monohydraté, de la lécithine, de la cellulose microcristalline, de l'alcool polyvinylique, de la povidone, du laurylsulfate de sodium, du stéarylfumarate de sodium, du talc, du dioxyde de titane et de la gomme de xanthane. De plus, les comprimés individuels de 54 mg contiennent D&C Yellow No. 10, FD&C Yellow No. 6, FD&C Blue No. 2.
LES INDICATIONS
Hypercholestérolémie primaire ou dyslipidémie mixte
TRICOR est indiqué comme traitement d'appoint à un régime alimentaire pour réduire le cholestérol à lipoprotéines de basse densité (LDL-C), le cholestérol total (C-total), les triglycérides et l'apolipoprotéine B (Apo B) et pour augmenter le cholestérol à lipoprotéines de haute densité (HDL- C) chez les patients adultes atteints d'hypercholestérolémie primaire ou de dyslipidémie mixte.
Hypertriglycéridémie sévère
TRICOR 200 mg est également indiqué comme traitement d'appoint au régime pour le traitement des patients adultes atteints d'hypertriglycéridémie sévère. L'amélioration du contrôle glycémique chez les patients diabétiques présentant une chylomicronémie à jeun évite généralement la nécessité d'une intervention pharmacologique.
Des taux nettement élevés de triglycérides sériques (par exemple > 2 000 mg/dL) peuvent augmenter le risque de développer une pancréatite. L'effet du fénofibrate sur la réduction de ce risque n'a pas été suffisamment étudié.
Limites d'utilisation importantes
Il n'a pas été démontré que le fénofibrate à une dose équivalente à 145 mg de TRICOR réduisait la morbidité et la mortalité par maladie coronarienne dans un vaste essai contrôlé randomisé de patients atteints de diabète de type 2 [voir AVERTISSEMENTS ET PRECAUTIONS ].
DOSAGE ET ADMINISTRATION
considérations générales
Les patients doivent suivre un régime hypolipidémiant approprié avant de recevoir TRICOR 160 mg et doivent poursuivre ce régime pendant le traitement par TRICOR. Les comprimés TRICOR peuvent être administrés sans tenir compte des repas.
Le traitement initial de la dyslipidémie est une thérapie diététique spécifique au type d'anomalie des lipoprotéines. L'excès de poids corporel et la consommation excessive d'alcool peuvent être des facteurs importants de l'hypertriglycéridémie et doivent être pris en compte avant tout traitement médicamenteux. L'exercice physique peut être une mesure d'appoint importante. Les maladies contribuant à l'hyperlipidémie, telles que l'hypothyroïdie ou le diabète sucré, doivent être recherchées et traitées de manière adéquate. L'oestrogénothérapie, les diurétiques thiazidiques et les bêta-bloquants sont parfois associés à des augmentations massives des triglycérides plasmatiques, en particulier chez les sujets atteints d'hypertriglycéridémie familiale. Dans de tels cas, l'arrêt de l'agent étiologique spécifique peut éviter la nécessité d'un traitement médicamenteux spécifique de l'hypertriglycéridémie.
Les taux de lipides doivent être surveillés périodiquement et il faut envisager de réduire la posologie de TRICOR si les taux de lipides chutent de manière significative en dessous de la plage ciblée.
Le traitement doit être arrêté chez les patients qui n'ont pas de réponse adéquate après deux mois de traitement avec la dose maximale recommandée de 145 mg une fois par jour.
Hypercholestérolémie primaire ou dyslipidémie mixte
La dose initiale de TRICOR 200 mg est de 145 mg une fois par jour.
Hypertriglycéridémie sévère
La dose initiale est de 48 à 145 mg par jour. La posologie doit être individualisée en fonction de la réponse du patient et doit être ajustée si nécessaire après des déterminations répétées des lipides à des intervalles de 4 à 8 semaines. La dose maximale est de 145 mg une fois par jour.
Fonction rénale altérée
Le traitement par TRICOR 200 mg doit être initié à la dose de 48 mg par jour chez les patients présentant une insuffisance rénale légère à modérée, et augmenté uniquement après évaluation des effets sur la fonction rénale et les taux de lipides à cette dose. L'utilisation de TRICOR doit être évitée chez les patients présentant une insuffisance rénale sévère [voir Utilisation dans des populations spécifiques et PHARMACOLOGIE CLINIQUE ].
Patients gériatriques
La sélection de dose pour les personnes âgées doit être faite sur la base de la fonction rénale [voir Utilisation dans des populations spécifiques ].
COMMENT FOURNIE
Formes posologiques et points forts
- Comprimés jaunes à 48 mg, portant les lettres d'identification du code « FI ».
- Comprimés jaunes à 48 mg, portant le logo « a » et les lettres d'identification du code « FI ».
- Comprimés blancs de 145 mg, portant les lettres d'identification du code « FO ».
- Comprimés blancs de 145 mg, imprimés du logo « a » et des lettres d'identification du code « FO ».
Stockage et manutention
TRICOR® (comprimés de fénofibrate) est disponible en deux dosages :
48mg
Comprimés jaunes, imprimés avec les lettres d'identification du code "FI", disponibles en flacons de 90 ( CDN 0074-3173-90).
Comprimés jaunes, imprimés du logo "a" et des lettres d'identification du code "FI", disponibles en flacons de 90 ( CDN 0074-6122-90).
145mg
Comprimés blancs, imprimés des lettres d'identification du code "FO", disponibles en flacons de 90 ( CDN 0074-3189-90).
Comprimés blancs, imprimés du logo "a" et des lettres d'identification du code "FO", disponibles en flacons de 90 ( CDN 0074-6123-90).
Stockage
Conserver à 25 °C (77 °F); excursions autorisées jusqu'à 15-30°C (59-86°F).
[Voir USP Température ambiante contrôlée]. Garder hors de la portée des enfants. Protéger de l'humidité.
Fabriqué pour AbbVie Inc., North Chicago, IL 60064, États-Unis par Fournier Laboratories Ireland Limited, Anngrove, Carrigtwohill Co. Cork, Irlande. Révisé : mars 2021
EFFETS SECONDAIRES
Les effets indésirables graves suivants sont décrits ci-dessous et ailleurs dans l'étiquetage :
- Mortalité et morbidité coronarienne [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Hépatotoxicité [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Pancréatite [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Réactions d'hypersensibilité [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Maladie veinothromboembolique [voir AVERTISSEMENTS ET PRECAUTIONS ]
Expérience des essais cliniques
Étant donné que les études cliniques sont menées dans des conditions très variables, les taux d'effets indésirables observés dans les études cliniques d'un médicament ne peuvent pas être directement comparés aux taux des études cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique.
Les événements indésirables rapportés par 2 % ou plus des patients traités par le fénofibrate (et plus que le placebo) au cours des essais en double aveugle contrôlés par placebo, quelle que soit la causalité, sont répertoriés dans le tableau 1 ci-dessous. Les événements indésirables ont conduit à l'arrêt du traitement chez 5,0% des patients traités par le fénofibrate et chez 3,0% des patients traités par le placebo. Les augmentations des tests de la fonction hépatique ont été les événements les plus fréquents, entraînant l'arrêt du traitement par le fénofibrate chez 1,6 % des patients dans les essais en double aveugle.
L'urticaire a été observée chez 1,1 % contre 0 % et les éruptions cutanées chez 1,4 % contre 0,8 % des patients sous fénofibrate et sous placebo, respectivement, dans des essais contrôlés.
Augmentation des enzymes hépatiques
Dans une analyse groupée de 10 essais contrôlés par placebo, des augmentations > 3 fois la limite supérieure de la normale des ALAT sont survenues chez 5,3 % des patients prenant du fénofibrate à des doses équivalentes à 96 mg à 145 mg de TRICOR par jour contre 1,1 % des patients traités par placebo. [voir AVERTISSEMENTS ET PRECAUTIONS ]. Dans une étude de 8 semaines, l'incidence des élévations d'ALT ou d'AST ≥ 3 fois la limite supérieure de la normale était de 13 % chez les patients recevant des doses équivalentes à 96 mg à 145 mg de TRICOR par jour et était de 0 % chez ceux recevant des doses équivalentes à 48 mg. ou moins de TRICOR par jour ou un placebo.
Expérience post-commercialisation
Les effets indésirables suivants ont été identifiés lors de l'utilisation post-approbation du fénofibrate. Comme ces réactions sont signalées volontairement à partir d'une population de taille incertaine, il n'est pas toujours possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale avec l'exposition au médicament : myalgies, rhabdomyolyse, pancréatite, insuffisance rénale aiguë, spasmes musculaires, hépatite, cirrhose, augmentation bilirubine totale, anémie, arthralgie, diminution de l'hémoglobine, diminution de l'hématocrite, diminution des globules blancs, asthénie, taux de cholestérol HDL fortement déprimé et maladie pulmonaire interstitielle. Des réactions de photosensibilité se sont produites des jours à des mois après le début; dans certains de ces cas, les patients ont signalé une réaction antérieure de photosensibilité au kétoprofène.
INTERACTIONS MÉDICAMENTEUSES
Anticoagulants coumariniques
Une potentialisation des effets anticoagulants de type coumarine a été observée avec l'allongement du TP/INR.
La prudence s'impose lorsque des anticoagulants coumariniques sont administrés en même temps que TRICOR. La posologie des anticoagulants doit être réduite pour maintenir le TQ/INR au niveau souhaité afin de prévenir les complications hémorragiques. Des déterminations fréquentes du PT/INR sont recommandées jusqu'à ce qu'il soit définitivement déterminé que le PT/INR s'est stabilisé [voir AVERTISSEMENTS ET PRECAUTIONS ].
Immunosuppresseurs
Les immunosuppresseurs tels que la cyclosporine et le tacrolimus peuvent produire une néphrotoxicité avec des diminutions de la clairance de la créatinine et des augmentations de la créatinine sérique, et comme l'excrétion rénale est la principale voie d'élimination des fibrates, y compris TRICOR, il existe un risque qu'une interaction entraîne une détérioration de la fonction rénale. Les avantages et les risques de l'utilisation de TRICOR (comprimés de fénofibrate) avec des immunosuppresseurs et d'autres agents potentiellement néphrotoxiques doivent être soigneusement pris en compte, et la dose efficace la plus faible utilisée et la fonction rénale doivent être surveillées.
Résines de liaison des acides biliaires
Étant donné que les résines de liaison aux acides biliaires peuvent lier d'autres médicaments administrés simultanément, les patients doivent prendre TRICOR 200 mg au moins 1 heure avant ou 4 à 6 heures après une résine de liaison aux acides biliaires pour éviter d'entraver son absorption.
Colchicine
Des cas de myopathie, y compris de rhabdomyolyse, ont été rapportés avec les fénofibrates co-administrés avec la colchicine, et la prudence s'impose lors de la prescription de fénofibrate avec la colchicine.
AVERTISSEMENTS
Inclus dans le cadre du PRÉCAUTIONS section.
PRÉCAUTIONS
Mortalité et morbidité coronarienne
L'effet de TRICOR 160 mg sur la morbi-mortalité coronarienne et la mortalité non cardiovasculaire n'a pas été établi.
L'essai Action to Control Cardiovascular Risk in Diabetes Lipid (ACCORD Lipid) était une étude randomisée contrôlée par placebo portant sur 5518 patients atteints de diabète de type 2 sous traitement de fond par statine traité par fénofibrate. La durée moyenne de suivi était de 4,7 ans. L'association fénofibrate plus statine a montré une réduction non significative du risque relatif de 8 % dans le critère de jugement principal des événements cardiovasculaires indésirables majeurs (MACE), un composite d'infarctus du myocarde non mortel, d'accident vasculaire cérébral non mortel et de décès par maladie cardiovasculaire (risque relatif [ HR] 0,92, IC à 95 % 0,79-1,08) (p = 0,32) par rapport à la monothérapie par statine. Dans une analyse de sous-groupes selon le sexe, le risque relatif de MACE chez les hommes recevant une thérapie combinée par rapport à une monothérapie par statine était de 0,82 (IC à 95 % 0,69-0,99), et le rapport de risque pour MACE chez les femmes recevant une thérapie combinée par rapport à une monothérapie par statine était de 1,38 (IC à 95 % 0,98-1,94) (interaction p=0,01). La signification clinique de ce résultat de sous-groupe n'est pas claire.
L'étude Fenofibrate Intervention and Event Lowering in Diabetes (FIELD) était une étude randomisée et contrôlée par placebo d'une durée de 5 ans portant sur 9 795 patients atteints de diabète sucré de type 2 traités par fénofibrate. Le fénofibrate a démontré une réduction relative non significative de 11 % du critère de jugement principal des événements de maladie coronarienne (risque relatif [HR] 0,89, IC à 95 % 0,75-1,05, p = 0,16) et une réduction significative de 11 % du critère de jugement secondaire de la événements cardiovasculaires (HR 0,89 [0,80-0,99], p=0,04). Il y a eu une augmentation non significative de 11 % (HR 1,11 [0,95, 1,29], p=0,18) et de 19 % (HR 1,19 [0,90, 1,57], p=0,22) de la mortalité totale et coronarienne, respectivement, avec le fénofibrate par rapport au placebo.
En raison des similitudes chimiques, pharmacologiques et cliniques entre TRICOR (comprimés de fénofibrate), le clofibrate et le gemfibrozil, les résultats indésirables de 4 grandes études cliniques randomisées contrôlées par placebo avec ces autres fibrates peuvent également s'appliquer à TRICOR.
Dans le Coronary Drug Project, une vaste étude post-infarctus du myocarde de patients traités pendant 5 ans avec du clofibrate, aucune différence de mortalité n'a été observée entre le groupe clofibrate et le groupe placebo. Il y avait cependant une différence dans le taux de lithiase biliaire et de cholécystite nécessitant une intervention chirurgicale entre les deux groupes (3,0 % contre 1,8 %).
Dans une étude menée par l'Organisation mondiale de la santé (OMS), 5000 sujets sans maladie coronarienne connue ont été traités avec un placebo ou du clofibrate pendant 5 ans et suivis pendant un an supplémentaire. Il y avait une mortalité toutes causes confondues ajustée selon l'âge, statistiquement significative et plus élevée dans le groupe clofibrate par rapport au groupe placebo (5,70 % contre 3,96 %, p =
L'étude cardiaque d'Helsinki était une vaste étude (n = 4081) portant sur des hommes d'âge moyen sans antécédents de maladie coronarienne. Les sujets ont reçu soit un placebo, soit du gemfibrozil pendant 5 ans, avec une prolongation ouverte de 3,5 ans par la suite. La mortalité totale était numériquement plus élevée dans le groupe de randomisation gemfibrozil mais n'a pas atteint la signification statistique (p = 0,19, intervalle de confiance à 95 % pour le risque relatif G:P = 0,91-1,64). Bien que les décès par cancer aient eu une tendance plus élevée dans le groupe gemfibrozil (p = 0,11), les cancers (à l'exclusion du carcinome basocellulaire) ont été diagnostiqués avec une fréquence égale dans les deux groupes d'étude. En raison de la taille limitée de l'étude, le risque relatif de décès, quelle qu'en soit la cause, ne s'est pas avéré différent de celui observé dans les données de suivi de 9 ans de l'étude de l'Organisation mondiale de la santé (RR = 1,29).
Une composante de prévention secondaire de l'étude cardiaque d'Helsinki a recruté des hommes d'âge moyen exclus de l'étude de prévention primaire en raison d'une maladie coronarienne connue ou suspectée. Les sujets ont reçu du gemfibrozil ou un placebo pendant 5 ans. Bien que les décès cardiaques aient eu tendance à être plus élevés dans le groupe gemfibrozil, cela n'était pas statistiquement significatif (risque relatif 2,2, intervalle de confiance à 95 % : 0,94-5,05). Le taux de chirurgie de la vésicule biliaire n'était pas statistiquement significatif entre les groupes d'étude, mais avait tendance à augmenter dans le groupe gemfibrozil (1,9 % contre 0,3 %, p = 0,07).
Hépatotoxicité
Des lésions hépatiques graves d'origine médicamenteuse (DILI), y compris une transplantation hépatique et la mort, ont été signalées après la commercialisation de TRICOR. DILI a été signalé au cours des premières semaines de traitement ou après plusieurs mois de traitement et, dans certains cas, s'est inversé avec l'arrêt du traitement par TRICOR 200 mg. Les patients atteints de DILI ont présenté des signes et des symptômes, notamment des urines foncées, des selles anormales, une jaunisse, des malaises, des douleurs abdominales, des myalgies, une perte de poids, du prurit et des nausées. De nombreux patients présentaient des élévations concomitantes de la bilirubine totale, de l'alanine transaminase sérique (ALT) et de l'aspartate transaminase (AST). Le DILI a été caractérisé comme une hépatite hépatocellulaire, chronique active et cholestatique, et une cirrhose est survenue en association avec une hépatite chronique active.
Dans les essais cliniques, le fénofibrate à des doses équivalentes à 96 mg à 145 mg de TRICOR 160 mg par jour a été associé à des augmentations des taux sériques d'AST ou d'ALT. L'incidence des augmentations des transaminases peut être liée à la dose [voir EFFETS INDÉSIRABLES ].
TRICOR 160 mg est contre-indiqué chez les patients atteints d'une maladie hépatique active, y compris ceux atteints de cirrhose biliaire primitive et d'anomalies persistantes inexpliquées de la fonction hépatique [voir CONTRE-INDICATIONS ]. Surveillez la fonction hépatique du patient, y compris l'ALT sérique, l'AST et la bilirubine totale, au départ et périodiquement pendant la durée du traitement par TRICOR. Arrêtez TRICOR 200 mg si des signes ou des symptômes d'atteinte hépatique se développent ou si des taux d'enzymes élevés persistent (ALT ou AST > 3 fois la limite supérieure de la normale, ou s'ils s'accompagnent d'une élévation de la bilirubine). Ne recommencez pas TRICOR 160 mg chez ces patients s'il n'y a pas d'autre explication à l'atteinte hépatique.
Myopathie et rhabdomyolyse
Les fibrates augmentent le risque de myopathie et ont été associés à la rhabdomyolyse. Le risque de toxicité musculaire grave semble être accru chez les patients âgés et chez les patients atteints de diabète, d'insuffisance rénale ou d'hypothyroïdie.
Une myopathie doit être envisagée chez tout patient présentant des myalgies diffuses, une sensibilité ou une faiblesse musculaire et/ou des élévations marquées des taux de créatine phosphokinase (CPK).
Il faut conseiller aux patients de signaler rapidement toute douleur, sensibilité ou faiblesse musculaire inexpliquée, en particulier si elle s'accompagne de malaise ou de fièvre. Les taux de CPK doivent être évalués chez les patients signalant ces symptômes, et le traitement par TRICOR 200 mg doit être interrompu si des taux de CPK nettement élevés se produisent ou si une myopathie/myosite est suspectée ou diagnostiquée.
Les données des études observationnelles indiquent que le risque de rhabdomyolyse est augmenté lorsque les fibrates, en particulier le gemfibrozil, sont co-administrés avec une statine. L'association doit être évitée à moins que le bénéfice de modifications supplémentaires des taux de lipides ne soit susceptible de l'emporter sur le risque accru de cette association médicamenteuse [voir PHARMACOLOGIE CLINIQUE ].
Des cas de myopathie, y compris de rhabdomyolyse, ont été rapportés avec les fénofibrates co-administrés avec la colchicine, et la prudence s'impose lors de la prescription de fénofibrate avec la colchicine [voir INTERACTIONS MÉDICAMENTEUSES ].
Créatinine sérique
Des élévations de la créatinine sérique ont été rapportées chez des patients sous fénofibrate. Ces élévations ont tendance à revenir aux valeurs initiales après l'arrêt du fénofibrate. La signification clinique de ces observations est inconnue. Surveiller la fonction rénale chez les patients atteints d'insuffisance rénale prenant TRICOR. La surveillance rénale doit également être envisagée pour les patients prenant TRICOR à risque d'insuffisance rénale tels que les personnes âgées et les patients atteints de diabète.
Lithiase biliaire
Le fénofibrate, comme le clofibrate et le gemfibrozil, peut augmenter l'excrétion de cholestérol dans la bile, entraînant une lithiase biliaire. Si une lithiase biliaire est suspectée, des études de la vésicule biliaire sont indiquées. Le traitement par TRICOR 160 mg doit être interrompu si des calculs biliaires sont détectés.

Anticoagulants coumariniques
La prudence s'impose lorsque des anticoagulants coumariniques sont administrés en association avec TRICOR 160 mg en raison de la potentialisation des effets anticoagulants de type coumarine en prolongeant le temps de prothrombine/rapport normalisé international (PT/INR). Pour prévenir les complications hémorragiques, une surveillance fréquente du PT/INR et un ajustement de la dose de l'anticoagulant sont recommandés jusqu'à ce que le PT/INR se soit stabilisé [voir INTERACTIONS MÉDICAMENTEUSES ].
Pancréatite
Une pancréatite a été rapportée chez des patients prenant du fénofibrate, du gemfibrozil et du clofibrate. Cet événement peut représenter un manque d'efficacité chez les patients atteints d'hypertriglycéridémie sévère, un effet médicamenteux direct ou un phénomène secondaire médié par la formation de calculs ou de boues des voies biliaires avec obstruction du canal cholédoque.
Changements hématologiques
Des diminutions légères à modérées de l'hémoglobine, de l'hématocrite et des globules blancs ont été observées chez des patients après l'initiation du traitement par le fénofibrate. Cependant, ces niveaux se stabilisent pendant l'administration à long terme. Une thrombocytopénie et une agranulocytose ont été signalées chez des personnes traitées par le fénofibrate. Une surveillance périodique du nombre de globules rouges et blancs est recommandée pendant les 12 premiers mois d'administration de TRICOR.
Réactions d'hypersensibilité
Hypersensibilité aiguë
Des cas d'anaphylaxie et d'œdème de Quincke ont été signalés après la commercialisation du fénofibrate. Dans certains cas, les réactions mettaient la vie en danger et nécessitaient un traitement d'urgence. Si un patient développe des signes ou des symptômes d'une réaction d'hypersensibilité aiguë, conseillez-lui de consulter immédiatement un médecin et d'arrêter le fénofibrate.
Hypersensibilité retardée
Des effets indésirables cutanés graves au médicament (SCAR), y compris le syndrome de Stevens-Johnson, la nécrolyse épidermique toxique et la réaction médicamenteuse avec éosinophilie et symptômes systémiques (DRESS), ont été signalés après la commercialisation, survenant de quelques jours à quelques semaines après le début du fénofibrate. Les cas de DRESS étaient associés à des réactions cutanées (telles qu'une éruption cutanée ou une dermatite exfoliative) et à une combinaison d'éosinophilie, de fièvre, d'atteinte systémique d'organes (rénaux, hépatiques ou respiratoires). Arrêtez le fénofibrate et traitez les patients de manière appropriée en cas de suspicion de cicatrice.
Maladie veinothromboembolique
Dans l'essai FIELD, l'embolie pulmonaire (EP) et la thrombose veineuse profonde (TVP) ont été observées à des taux plus élevés dans le groupe fénofibrate que dans le groupe traité par placebo. Sur 9 795 patients inscrits au FIELD, il y en avait 4 900 dans le groupe placebo et 4 895 dans le groupe fénofibrate. Pour la TVP, il y a eu 48 événements (1 %) dans le groupe placebo et 67 (1 %) dans le groupe fénofibrate (p = 0,074) ; et pour l'EP, il y a eu 32 (0,7 %) événements dans le groupe placebo et 53 (1 %) dans le groupe fénofibrate (p = 0,022).
Dans le cadre du Coronary Drug Project, une proportion plus élevée du groupe clofibrate a présenté une embolie pulmonaire ou une thrombophlébite avérée ou suspectée mortelle ou non mortelle que le groupe placebo (5,2 % contre 3,3 % à cinq ans ; p
Diminution paradoxale des niveaux de cholestérol HDL
Des rapports de post-commercialisation et d'essais cliniques ont fait état de diminutions sévères des taux de cholestérol HDL (aussi bas que 2 mg/dL) chez des patients diabétiques et non diabétiques ayant commencé un traitement par fibrate. La diminution du HDL-C est reflétée par une diminution de l'apolipoprotéine A1. Il a été rapporté que cette diminution se produisait dans les 2 semaines à des années suivant le début du traitement par les fibrates. Les taux de HDL-C restent déprimés jusqu'à l'arrêt du traitement par fibrate ; la réponse à l'arrêt du fibrate est rapide et soutenue. La signification clinique de cette diminution du HDL-C est inconnue. Il est recommandé de vérifier les taux de HDL-C dans les premiers mois suivant le début du traitement par les fibrates. Si un taux de HDL-C sévèrement déprimé est détecté, le traitement au fibrate doit être interrompu et le taux de HDL-C doit être surveillé jusqu'à ce qu'il revienne à la ligne de base, et le traitement au fibrate ne doit pas être réinitialisé.
Toxicologie non clinique
Carcinogenèse et mutagenèse et altération de la fertilité
Deux études de cancérogénicité alimentaire ont été menées chez le rat avec le fénofibrate. Dans la première étude de 24 mois, des rats Wistar ont reçu des doses de fénofibrate de 10, 45 et 200 mg/kg/jour, soit environ 0,3, 1 et 6 fois la dose humaine maximale recommandée (MRHD) de 300 mg de fénofibrate par jour, équivalant à 145 mg TRICOR 160 mg par jour, basé sur des comparaisons de surface corporelle. À une dose de 200 mgs/kg/jours (à 6 fois le MRHD), l'incidence de carcinomes de foie a été de façon significative augmentée dans les deux sexes. Une augmentation statistiquement significative des carcinomes pancréatiques a été observée chez les hommes à 1 et 6 fois la MRHD ; une augmentation des adénomes pancréatiques et des tumeurs bénignes des cellules interstitielles testiculaires a été observée à 6 fois la MRHD chez les mâles. Dans une deuxième étude de cancérogénicité de 24 mois chez le rat dans une souche différente de rats (Sprague-Dawley), des doses de 10 et 60 mg/kg/jour (0,3 et 2 fois la MRHD) ont produit des augmentations significatives de l'incidence des adénomes acineux pancréatiques chez les deux sexes et augmentation des tumeurs des cellules interstitielles testiculaires chez les mâles à 2 fois la MRHD.
Une étude de cancérogénicité de 117 semaines a été menée chez des rats comparant trois médicaments : fénofibrate 10 et 60 mg/kg/jour (0,3 et 2 fois la MRHD, d'après des comparaisons de surface corporelle), clofibrate (400 mg/kg/jour ; 2 fois la dose humaine) et gemfibrozil (250 mg/kg/jour; 2 fois la dose humaine, basée sur la surface en mg/m²). Le fénofibrate a augmenté les adénomes acineux pancréatiques chez les deux sexes. Le clofibrate a augmenté le carcinome hépatocellulaire et les adénomes acineux pancréatiques chez les mâles et les nodules néoplasiques hépatiques chez les femelles. Le gemfibrozil a augmenté les nodules néoplasiques hépatiques chez les hommes et les femmes, tandis que les trois médicaments ont augmenté les tumeurs des cellules interstitielles testiculaires chez les hommes.
Dans une étude de 21 mois chez des souris CF-1, le fénofibrate à 10, 45 et 200 mg/kg/jour (environ 0,2, 1 et 3 fois la MRHD, d'après des comparaisons de surface corporelle) a augmenté de manière significative les carcinomes du foie chez les deux sexes à 3 fois la MRHD. Dans une deuxième étude de 18 mois à 10, 60 et 200 mg/kg/jour, le fénofibrate a significativement augmenté les carcinomes du foie chez les souris mâles et les adénomes du foie chez les souris femelles à 3 fois la MRHD.
Des études au microscope électronique ont démontré une prolifération des peroxysomes suite à l'administration de fénofibrate au rat. Une étude adéquate pour tester la prolifération des peroxysomes chez l'homme n'a pas été réalisée, mais des changements dans la morphologie et le nombre de peroxysomes ont été observés chez l'homme après traitement avec d'autres membres de la classe des fibrates lorsque des biopsies hépatiques ont été comparées avant et après traitement chez le même individu.
Le fénofibrate s'est avéré dépourvu de potentiel mutagène dans les tests suivants : Ames, lymphome de souris, aberration chromosomique et synthèse d'ADN non programmée dans les hépatocytes primaires de rat.
Dans les études de fertilité, les rats ont reçu des doses alimentaires orales de fénofibrate, les mâles ont reçu 61 jours avant l'accouplement et les femelles 15 jours avant l'accouplement jusqu'au sevrage, ce qui n'a entraîné aucun effet indésirable sur la fertilité à des doses allant jusqu'à 300 mg/kg/jour (10 fois la MRHD, basé sur des comparaisons de surface corporelle).
Utilisation dans des populations spécifiques
Grossesse
Résumé des risques
Les données limitées disponibles sur l'utilisation du fénofibrate chez la femme enceinte sont insuffisantes pour déterminer un risque associé au médicament d'anomalies congénitales majeures, de fausse couche ou d'issues maternelles ou fœtales indésirables. Dans les études de reproduction chez l'animal, aucun signe de toxicité embryo-fœtale n'a été observé avec l'administration orale de fénofibrate chez le rat et le lapin au cours de l'organogenèse à des doses inférieures ou équivalentes à la dose clinique maximale recommandée de 145 mg par jour, basée sur la surface corporelle (mg/ m²). Des effets indésirables sur la reproduction sont survenus à des doses plus élevées en présence de toxicité maternelle (voir Données ). TRICOR 200 mg ne doit être utilisé pendant la grossesse que si le bénéfice potentiel justifie le risque potentiel pour le fœtus.
Le risque de fond estimé de malformations congénitales majeures et de fausse couche pour la population indiquée est inconnu. Dans la population générale des États-Unis, le risque de fond estimé de malformations congénitales majeures et de fausse couche dans les grossesses cliniquement reconnues est de 2 à 4 % et de 15 à 20 %, respectivement.
Données
Données animales
Chez des rats gravides ayant reçu des doses alimentaires orales de 14, 127 et 361 mg/kg/jour du 6e au 15e jour de gestation pendant la période d'organogenèse, aucun effet indésirable sur le développement n'a été observé à 14 mg/kg/jour (moins que l'exposition clinique à la dose humaine maximale recommandée [MRHD] de 300 mg de fénofibrate par jour, équivalent à 145 mg de TRICOR par jour, sur la base de comparaisons de surface corporelle). Des malformations squelettiques fœtales accrues ont été observées à des doses maternellement toxiques (361 mg/kg/jour, correspondant à 12 fois l'exposition clinique à la MRHD) qui ont significativement supprimé le gain de poids corporel maternel.
Chez des lapines gravides ayant reçu par gavage oral des doses de 15, 150 et 300 mg/kg/jour à partir du jour de gestation 618 pendant la période d'organogenèse et autorisées à mettre bas, aucun effet indésirable sur le développement n'a été observé à 15 mg/kg/jour (une dose qui se rapproche de l'exposition clinique au MRHD, sur la base de comparaisons de surface corporelle). Des portées avortées ont été observées à des doses maternellement toxiques (≥ 150 mg/kg/jour, correspondant à ≥ 10 fois l'exposition clinique à la MRHD) qui ont supprimé le gain de poids maternel.
Chez des rats gravides ayant reçu des doses alimentaires orales de 15, 75 et 300 mg/kg/jour du jour de gestation 15 au jour de lactation 21 (sevrage), aucun effet indésirable sur le développement n'a été observé à 15 mg/kg/jour (moins que l'exposition clinique au MRHD, sur la base de comparaisons de surface corporelle), malgré la toxicité maternelle (diminution de la prise de poids). Une perte post-implantation a été observée à ≥ 75 mg/kg/jour (≥ 2 fois l'exposition clinique à la MRHD) en présence de toxicité maternelle (diminution de la prise de poids). Une diminution de la survie des ratons a été notée à 300 mg/kg/jour (10 fois l'exposition clinique à la MRHD), ce qui a été associé à une diminution du gain de poids corporel maternel/de la négligence maternelle.
Lactation
Résumé des risques
Il n'existe aucune information disponible sur la présence de fénofibrate dans le lait maternel, les effets du médicament sur le nourrisson allaité ou les effets sur la production de lait. Le fénofibrate est présent dans le lait des rats et est donc susceptible d'être présent dans le lait maternel. En raison du risque d'effets indésirables graves chez les nourrissons allaités, tels qu'une perturbation du métabolisme lipidique du nourrisson, les femmes ne doivent pas allaiter pendant le traitement par TRICOR 200 mg et pendant 5 jours après la dernière dose [voir CONTRE-INDICATIONS ].
Utilisation pédiatrique
L'innocuité et l'efficacité n'ont pas été établies chez les patients pédiatriques.
Utilisation gériatrique
L'acide fénofibrique est connu pour être en grande partie excrété par les reins, et le risque de réactions indésirables à ce médicament peut être plus élevé chez les patients présentant une insuffisance rénale. L'exposition à l'acide fénofibrique n'est pas influencée par l'âge. Étant donné que les patients âgés ont une incidence plus élevée d'insuffisance rénale, la sélection de la dose pour les personnes âgées doit être faite sur la base de la fonction rénale [voir DOSAGE ET ADMINISTRATION et PHARMACOLOGIE CLINIQUE ]. Les patients âgés ayant une fonction rénale normale ne devraient nécessiter aucune modification de dose. Envisagez de surveiller la fonction rénale chez les patients âgés prenant TRICOR.
Insuffisance rénale
L'utilisation de TRICOR 160 mg doit être évitée chez les patients présentant une insuffisance rénale sévère [voir CONTRE-INDICATIONS ]. Une réduction de la dose est nécessaire chez les patients présentant une insuffisance rénale légère à modérée [voir DOSAGE ET ADMINISTRATION et PHARMACOLOGIE CLINIQUE ]. La surveillance de la fonction rénale chez les patients insuffisants rénaux est recommandée.
Insuffisance hépatique
L'utilisation de TRICOR 200 mg n'a pas été évaluée chez les sujets insuffisants hépatiques [voir CONTRE-INDICATIONS et PHARMACOLOGIE CLINIQUE ].
SURDOSAGE
Il n'y a aucun traitement spécifique pour l'overdose avec TRICOR. Les soins généraux de soutien du patient sont indiqués, y compris la surveillance des signes vitaux et l'observation de l'état clinique, en cas de surdosage. Si indiqué, l'élimination du médicament non absorbé doit être réalisée par des vomissements ou un lavage gastrique; les précautions habituelles doivent être observées pour maintenir les voies respiratoires. Étant donné que l'acide fénofibrique est fortement lié aux protéines plasmatiques, l'hémodialyse ne doit pas être envisagée.
CONTRE-INDICATIONS
TRICOR 200 mg est contre-indiqué dans :
- les patients atteints d'insuffisance rénale sévère, y compris ceux sous dialyse [voir PHARMACOLOGIE CLINIQUE ].
- les patients atteints d'une maladie hépatique active, y compris ceux atteints de cirrhose biliaire primitive et d'anomalies persistantes inexpliquées de la fonction hépatique [voir AVERTISSEMENTS ET PRECAUTIONS ].
- les patients atteints d'une maladie préexistante de la vésicule biliaire [voir AVERTISSEMENTS ET PRECAUTIONS ].
- mères allaitantes [voir Utilisation dans des populations spécifiques ].
- les patients présentant une hypersensibilité connue au fénofibrate ou à l'acide fénofibrique [voir AVERTISSEMENTS ET PRECAUTIONS ].
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
La fraction active de TRICOR est l'acide fénofibrique. Les effets pharmacologiques de l'acide fénofibrique chez les animaux et les humains ont été largement étudiés par l'administration orale de fénofibrate.
Les effets modificateurs des lipides de l'acide fénofibrique observés dans la pratique clinique ont été expliqués in vivo chez des souris transgéniques et in vitro dans des cultures d'hépatocytes humains par l'activation du récepteur α activé par les proliférateurs de peroxysomes (PPARα). Par ce mécanisme, le fénofibrate augmente la lipolyse et l'élimination des particules riches en triglycérides du plasma en activant la lipoprotéine lipase et en réduisant la production d'apoprotéine C-III (un inhibiteur de l'activité de la lipoprotéine lipase).
La diminution de TG qui en résulte produit une modification de la taille et de la composition des LDL à partir de petites particules denses (que l'on pense être athérogènes en raison de leur sensibilité à l'oxydation) à de grosses particules flottantes. Ces particules plus grosses ont une plus grande affinité pour les récepteurs du cholestérol et sont rapidement catabolisées. L'activation de PPARα induit également une augmentation de la synthèse des apolipoprotéines AI, A-II et HDL-cholestérol.
Le fénofibrate réduit également les taux sériques d'acide urique chez les individus hyperuricémiques et normaux en augmentant l'excrétion urinaire d'acide urique.
Pharmacodynamie
Diverses études cliniques ont démontré que des niveaux élevés de C total, de LDL-C et d'apo B, un complexe membranaire LDL, sont associés à l'athérosclérose humaine. De même, des taux réduits de HDL-C et de son complexe de transport, l'apolipoprotéine A (apo AI et apo AII) sont associés au développement de l'athérosclérose. Des enquêtes épidémiologiques ont établi que la morbidité et la mortalité cardiovasculaires varient directement avec le niveau de C total, de LDL-C et de TG, et inversement avec le niveau de HDL-C. L'effet indépendant de l'augmentation du HDL-C ou de la diminution des triglycérides (TG) sur le risque de morbidité et de mortalité cardiovasculaires n'a pas été déterminé.
L'acide fénofibrique, le métabolite actif du fénofibrate, produit des réductions du cholestérol total, du cholestérol LDL, de l'apolipoprotéine B, des triglycérides totaux et des lipoprotéines riches en triglycérides (VLDL) chez les patients traités. De plus, le traitement par le fénofibrate entraîne une augmentation des lipoprotéines de haute densité (HDL) et des apolipoprotéines apoAI et apoAII.
Pharmacocinétique
Les concentrations plasmatiques d'acide fénofibrique après administration de trois comprimés de 48 mg ou d'un comprimé de 145 mg sont équivalentes dans des conditions non nourries à une gélule de fénofibrate micronisé de 200 mg.
Le fénofibrate est une prodrogue de la fraction chimique active acide fénofibrique. Le fénofibrate est converti par hydrolyse des esters dans le corps en acide fénofibrique qui est le constituant actif mesurable dans la circulation.
Absorption
La biodisponibilité absolue du fénofibrate ne peut pas être déterminée car le composé est pratiquement insoluble dans les milieux aqueux adaptés à l'injection. Cependant, le fénofibrate est bien absorbé par le tractus gastro-intestinal. Après administration orale chez des volontaires sains, environ 60 % d'une dose unique de fénofibrate radiomarqué sont apparus dans les urines, principalement sous forme d'acide fénofibrique et de son glucuronate conjugué, et 25 % ont été excrétés dans les fèces. Les concentrations plasmatiques maximales d'acide fénofibrique surviennent dans les 6 à 8 heures suivant l'administration.
L'exposition plasmatique à l'acide fénofibrique, mesurée par la Cmax et l'ASC, n'est pas significativement différente lorsqu'une dose unique de 145 mg de fénofibrate est administrée à jeun ou non.
Distribution
Lors de doses multiples de fénofibrate, l'état d'équilibre de l'acide fénofibrique est atteint en 9 jours. Les concentrations plasmatiques d'acide fénofibrique à l'état d'équilibre sont environ le double de celles observées après une dose unique. La liaison aux protéines sériques était d'environ 99 % chez les sujets normaux et hyperlipidémiques.
Métabolisme
Après administration orale, le fénofibrate est rapidement hydrolysé par les estérases en son métabolite actif, l'acide fénofibrique ; aucun fénofibrate inchangé n'est détecté dans le plasma.
L'acide fénofibrique est principalement conjugué à l'acide glucuronique puis excrété dans l'urine. Une petite quantité d'acide fénofibrique est réduite au niveau de la fraction carbonyle en un métabolite benzhydrol qui est, à son tour, conjugué à l'acide glucuronique et excrété dans l'urine.
Les données sur le métabolisme in vivo indiquent que ni le fénofibrate ni l'acide fénofibrique ne subissent un métabolisme oxydatif (par exemple, le cytochrome P450) dans une mesure significative.
Élimination
Après absorption, le fénofibrate est principalement excrété dans l'urine sous forme de métabolites, principalement l'acide fénofibrique et l'acide fénofibrique glucuronide. Après administration de fénofibrate radiomarqué, environ 60 % de la dose sont apparus dans les urines et 25 % ont été excrétés dans les fèces.
L'acide fénofibrique est éliminé avec une demi-vie de 20 heures, permettant une prise unique par jour.
Populations particulières
Gériatrie
Chez des volontaires âgés de 77 à 87 ans, la clairance orale de l'acide fénofibrique après une dose orale unique de fénofibrate était de 1,2 L/h, contre 1,1 L/h chez les jeunes adultes. Cela indique qu'un schéma posologique similaire peut être utilisé chez les personnes âgées ayant une fonction rénale normale, sans augmenter l'accumulation du médicament ou des métabolites [voir DOSAGE ET ADMINISTRATION et Utilisation dans des populations spécifiques ].
Pédiatrie
La pharmacocinétique de TRICOR 160 mg n'a pas été étudiée dans les populations pédiatriques.
Le genre
Aucune différence pharmacocinétique entre les hommes et les femmes n'a été observée pour le fénofibrate.
Course
L'influence de la race sur la pharmacocinétique du fénofibrate n'a pas été étudiée, cependant le fénofibrate n'est pas métabolisé par des enzymes connues pour présenter une variabilité interethnique.
Insuffisance rénale
La pharmacocinétique de l'acide fénofibrique a été examinée chez des patients atteints d'insuffisance rénale légère, modérée et grave. Les patients atteints d'insuffisance rénale sévère (taux de filtration glomérulaire estimé [eGFR] DOSAGE ET ADMINISTRATION ].
Insuffisance hépatique
Aucune étude pharmacocinétique n'a été menée chez des patients insuffisants hépatiques.
Interactions médicament-médicament
Des études in vitro utilisant des microsomes hépatiques humains indiquent que le fénofibrate et l'acide fénofibrique ne sont pas des inhibiteurs des isoformes du cytochrome (CYP) P450 CYP3A4, CYP2D6, CYP2E1 ou CYP1A2. Ce sont de faibles inhibiteurs du CYP2C8, du CYP2C19 et du CYP2A6, et des inhibiteurs légers à modérés du CYP2C9 aux concentrations thérapeutiques.
Le tableau 2 décrit les effets des médicaments co-administrés sur l'exposition systémique à l'acide fénofibrique. Le tableau 3 décrit les effets du fénofibrate ou de l'acide fénofibrique co-administré sur d'autres médicaments.
Etudes cliniques
Hypercholestérolémie primaire (hétérozygote familiale et non familiale) et dyslipidémie mixte
Les effets du fénofibrate à une dose équivalente à 145 mg de TRICOR (comprimés de fénofibrate) par jour ont été évalués à partir de quatre études randomisées, contrôlées par placebo, en double aveugle, en groupes parallèles, incluant des patients présentant les valeurs moyennes de lipides initiales suivantes : total-C 306,9 mg/dl ; LDL-C 213,8 mg/dL ; HDL-C 52,3 mg/dL ; et triglycérides 191,0 mg/dL. Le traitement par TRICOR 200 mg a réduit le LDL-C, le C total et le rapport LDL-C/HDL-C. La thérapie TRICOR a également réduit les triglycérides et augmenté le HDL-C (voir tableau 4).
Dans un sous-ensemble de sujets, des mesures d'apo B ont été effectuées. Le traitement par TRICOR 200 mg a significativement réduit l'apo B du début à la fin par rapport au placebo (-25,1 % contre 2,4 %, p
Hypertriglycéridémie sévère
Les effets du fénofibrate sur les triglycérides sériques ont été étudiés dans deux essais cliniques randomisés, à double insu et contrôlés par placebo portant sur 147 patients hypertriglycéridémiques. Les patients ont été traités pendant huit semaines selon des protocoles qui ne différaient que par le fait que l'un d'entre eux présentait des taux initiaux de TG de 500 à 1 500 mg/dL et les autres taux de TG de 350 à 500 mg/dL. Chez les patients présentant une hypertriglycéridémie et une cholestérolémie normale avec ou sans hyperchylomicronémie, le traitement par le fénofibrate à des doses équivalentes à TRICOR 145 mg par jour a diminué principalement les triglycérides des lipoprotéines de très basse densité (VLDL) et le cholestérol VLDL. Le traitement des patients avec des triglycérides élevés entraîne souvent une augmentation du LDL-C (voir tableau 5).
L'effet de TRICOR 160 mg sur la morbi-mortalité cardiovasculaire n'a pas été déterminé.
INFORMATIONS PATIENTS
Les patients doivent être informés :
- des avantages et des risques potentiels de TRICOR.
- ne pas utiliser TRICOR en cas d'hypersensibilité connue au fénofibrate ou à l'acide fénofibrique.
- de médicaments qui ne doivent pas être pris en association avec TRICOR.
- que s'ils prennent des anticoagulants coumariniques, TRICOR 160 mg peut augmenter leur effet anticoagulant, et une surveillance accrue peut être nécessaire.
- de continuer à suivre un régime approprié de modification des lipides pendant la prise de TRICOR.
- prendre TRICOR 160 mg une fois par jour, sans égard aux aliments, à la dose prescrite, en avalant chaque comprimé entier.
- de retourner au cabinet de leur médecin pour un suivi de routine.
- d'informer leur médecin de tous les médicaments, suppléments et préparations à base de plantes qu'ils prennent et de tout changement dans leur état de santé. On devrait également conseiller aux patients d'informer leurs médecins prescrivant une nouvelle médication qu'ils prennent TRICOR.
- informer leur médecin des symptômes de lésions hépatiques (p. ex., jaunisse, douleurs abdominales, nausées, malaise, urine foncée, selles anormales, prurit); toute douleur musculaire, sensibilité ou faiblesse ; ou tout autre nouveau symptôme.
- ne pas allaiter pendant le traitement par TRICOR et pendant 5 jours après la dernière dose.
