Crestor 10mg, 20mg, 5mg Rosuvastatin Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Crestor et comment est-il utilisé ?
Crestor est un médicament délivré sur ordonnance utilisé pour réduire le cholestérol LDL (lipoprotéines de basse densité) et les triglycérides dans le sang, ralentir la progression de la plaque dans les vaisseaux sanguins, réduire le risque d'accident vasculaire cérébral et de crise cardiaque. Crestor 20 mg peut être utilisé seul ou avec d'autres médicaments.
Crestor est un agent hypolipidémiant, statines, inhibiteurs de l'HMG-CoA réductase.
On ne sait pas si Crestor est sûr et efficace chez les enfants de moins de 8 ans.
Quels sont les effets secondaires possibles de Crestor ?
Crestor peut provoquer des effets secondaires graves, notamment :
- douleurs musculaires inexpliquées
- sensibilité musculaire
- faiblesse musculaire
- confusion
- problèmes de mémoire
- douleur dans le haut de l'estomac
- fatigue
- perte d'appétit
- urine foncée
- jaunissement de la peau ou des yeux (jaunisse)
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Crestor incluent :
- mal de tête
- la faiblesse
- douleurs musculaires
- nausée
- Douleur d'estomac
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Crestor. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
LA DESCRIPTION
CRESTOR (rosuvastatine calcique) est un hypolipémiant synthétique pour administration orale.
Le nom chimique de la rosuvastatine calcique est bis[(E)-7-[4-(4-fluorophényl)-6-isopropyl-2- [méthyl(méthylsulfonyl)amino]pyrimidin-5-yl](3R,5S)-3 sel de calcium de l'acide ,5-dihydroxyhept-6-énoïque] de formule structurale suivante :
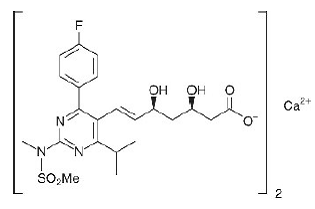
La formule empirique de la rosuvastatine calcique est (C22H27FN3O6S)2Ca et le poids moléculaire est de 1001,14. La rosuvastatine calcique est une poudre blanche amorphe peu soluble dans l'eau et le méthanol, et légèrement soluble dans l'éthanol. La rosuvastatine calcique est un composé hydrophile avec un coefficient de partage (octanol/eau) de 0,13 à un pH de 7,0.
Les comprimés CRESTOR pour administration orale contiennent 5, 10, 20 ou 40 mg de rosuvastatine et les ingrédients inactifs suivants : Chaque comprimé contient : cellulose microcristalline NF, lactose monohydraté NF, phosphate de calcium tribasique NF, crospovidone NF, stéarate de magnésium NF, hypromellose NF, triacétine NF, dioxyde de titane USP, oxyde de fer jaune et oxyde de fer rouge NF.
LES INDICATIONS
Hyperlipidémie et dyslipidémie mixte
CRESTOR est indiqué comme traitement d'appoint à un régime alimentaire pour réduire les taux élevés de C total, de LDL-C, d'ApoB, de non-HDL-C et de triglycérides et pour augmenter le HDL-C chez les patients adultes atteints d'hyperlipidémie primaire ou de dyslipidémie mixte. Les agents altérant les lipides doivent être utilisés en plus d'un régime restreint en graisses saturées et en cholestérol lorsque la réponse au régime et aux interventions non pharmacologiques seules a été inadéquate.
Patients pédiatriques atteints d'hypercholestérolémie familiale
CRESTOR 10mg est indiqué en complément d'un régime pour :
- réduire les taux de C total, de LDL-C et d'ApoB chez les enfants et les adolescents âgés de 8 à 17 ans atteints d'hypercholestérolémie familiale hétérozygote si, après un essai adéquat de traitement diététique, les résultats suivants sont présents : LDL-C > 190 mg/dL ou > 160 mg/dL avec des antécédents familiaux positifs de maladie cardiovasculaire prématurée (MCV) ou deux ou plusieurs autres facteurs de risque de MCV.
- réduire le LDL-C, le Total-C, le non-HDL-C et l'ApoB chez les enfants et les adolescents de 7 à 17 ans atteints d'hypercholestérolémie familiale homozygote, seul ou avec d'autres traitements hypolipémiants (p. ex. aphérèse des LDL).
Hypertriglycéridémie
CRESTOR est indiqué en complément d'un régime alimentaire pour le traitement des patients adultes atteints d'hypertriglycéridémie.
Dysbêtalipoprotéinémie primaire (hyperlipoprotéinémie de type III)
CRESTOR est indiqué en complément d'un régime alimentaire pour le traitement des patients adultes atteints de dysbêtalipoprotéinémie primaire (hyperlipoprotéinémie de type III).
Patients adultes atteints d'hypercholestérolémie familiale homozygote
CRESTOR est indiqué comme traitement adjuvant à d'autres traitements hypolipémiants (p. ex., aphérèse des LDL) ou seul si de tels traitements ne sont pas disponibles pour réduire le LDL-C, le Total-C et l'ApoB chez les patients adultes atteints d'hypercholestérolémie familiale homozygote.
Ralentissement de la progression de l'athérosclérose
CRESTOR 5mg est indiqué en complément d'un régime alimentaire pour ralentir la progression de l'athérosclérose chez les patients adultes dans le cadre d'une stratégie de traitement visant à abaisser le C-Total et le C-LDL à des niveaux cibles.
Prévention primaire des maladies cardiovasculaires
Chez les personnes sans maladie coronarienne cliniquement évidente mais avec un risque accru de maladie cardiovasculaire en fonction de l'âge ≥ 50 ans chez les hommes et ≥ 60 ans chez les femmes, hsCRP ≥ 2 mg/L et la présence d'au moins une maladie cardiovasculaire supplémentaire facteur de risque tel que l'hypertension, un faible taux de HDL-C, le tabagisme ou des antécédents familiaux de maladie coronarienne prématurée, CRESTOR est indiqué pour :
- réduire le risque d'AVC
- réduire le risque d'infarctus du myocarde
- réduire le risque de procédures de revascularisation artérielle
Limites d'utilisation
CRESTOR n'a pas été étudié dans les dyslipidémies de Fredrickson de type I et V.
DOSAGE ET ADMINISTRATION
Informations générales sur le dosage
La gamme posologique de CRESTOR 5 mg chez l'adulte est de 5 à 40 mg par voie orale une fois par jour. La dose initiale habituelle est de 10 à 20 mg une fois par jour. La dose initiale habituelle chez les patients adultes atteints d'hypercholestérolémie familiale homozygote est de 20 mg une fois par jour.
La dose maximale de CRESTOR 20 mg de 40 mg ne doit être utilisée que chez les patients qui n'ont pas atteint leur objectif de C-LDL en utilisant la dose de 20 mg [voir AVERTISSEMENTS ET PRECAUTIONS ].
CRESTOR 5 mg peut être administré en une seule prise à tout moment de la journée, avec ou sans nourriture. Le comprimé doit être avalé entier.
Lors de l'initiation d'un traitement par CRESTOR ou du passage d'un autre traitement par un inhibiteur de l'HMG-CoA réductase, la dose initiale appropriée de CRESTOR de 10 mg doit d'abord être utilisée, puis titrée en fonction de la réponse du patient et de l'objectif individualisé du traitement.
Après l'initiation ou lors de la titration de CRESTOR, les taux de lipides doivent être analysés dans les 2 à 4 semaines et la posologie ajustée en conséquence.
Dosage pédiatrique
Dans l'hypercholestérolémie familiale hétérozygote, la dose recommandée est de 5 à 10 mg par voie orale une fois par jour chez les patients âgés de 8 à moins de 10 ans et de 5 à 20 mg par voie orale une fois par jour chez les patients âgés de 10 à 17 ans.
Dans l'hypercholestérolémie familiale homozygote, la dose recommandée est de 20 mg par voie orale une fois par jour chez les patients âgés de 7 à 17 ans.
Posologie chez les patients asiatiques
Chez les patients asiatiques, envisager l'initiation d'un traitement par CRESTOR 20 mg avec 5 mg une fois par jour en raison de l'augmentation des concentrations plasmatiques de rosuvastatine. L'augmentation de l'exposition systémique doit être prise en compte lors du traitement de patients asiatiques insuffisamment contrôlés à des doses allant jusqu'à 20 mg/jour [voir Utilisation dans des populations spécifiques et PHARMACOLOGIE CLINIQUE ].
Utiliser avec une thérapie concomitante
Patients prenant de la ciclosporine
La dose de CRESTOR 20 mg ne doit pas dépasser 5 mg une fois par jour [voir AVERTISSEMENTS ET PRECAUTIONS , INTERACTIONS MÉDICAMENTEUSES et PHARMACOLOGIE CLINIQUE ].
Patients prenant du gemfibrozil
Éviter l'utilisation concomitante de CRESTOR avec le gemfibrozil. Si l'utilisation concomitante ne peut être évitée, initier CRESTOR à 5 mg une fois par jour. La dose de CRESTOR ne doit pas dépasser 10 mg une fois par jour [voir AVERTISSEMENTS ET PRECAUTIONS , INTERACTIONS MÉDICAMENTEUSES et PHARMACOLOGIE CLINIQUE ].
Patients prenant de l'atazanavir et du ritonavir, du lopinavir et du ritonavir ou du siméprévir
Initier le traitement par CRESTOR 10 mg avec 5 mg une fois par jour. La dose de CRESTOR ne doit pas dépasser 10 mg une fois par jour [voir AVERTISSEMENTS ET PRECAUTIONS , INTERACTIONS MÉDICAMENTEUSES et PHARMACOLOGIE CLINIQUE ].
Posologie chez les patients atteints d'insuffisance rénale sévère
Pour les patients atteints d'insuffisance rénale sévère (CLcr Utilisation dans des populations spécifiques et PHARMACOLOGIE CLINIQUE ].
COMMENT FOURNIE
Formes posologiques et points forts
5 mg : Comprimés pelliculés jaunes, ronds, biconvexes. « CRESTOR » et « 5 » gravés sur un côté du comprimé.
10 mg : Comprimés enrobés roses, ronds, biconvexes. « CRESTOR » et « 10 » gravés sur un côté du comprimé.
20 mg : Comprimés enrobés roses, ronds, biconvexes. « CRESTOR » et « 20 » gravés sur un côté de la tablette.
40 mg : Comprimés enrobés roses, ovales, biconvexes. En creux « CRESTOR » d'un côté et « 40 » de l'autre côté du comprimé.
Stockage et manutention
Comprimés CRESTOR® (rosuvastatine calcique) sont fournis comme :
CDN 0310-0755-90 : 5mg. Comprimés enrobés jaunes, ronds, biconvexes. En creux "CRESTOR" et "5" sur un côté ; flacon de 90 comprimés
CDN 0310-0751-90 : 10mg. Comprimés roses, ronds, biconvexes, enrobés. « CRESTOR » et « 10 » gravés sur un côté ; flacon de 90 comprimés
CDN 0310-0751-39 : 10mg. Comprimés roses, ronds, biconvexes, enrobés. En creux « CRESTOR » et « 10 » sur un côté ; paquets de dose unitaire de 100
CDN 0310-0752-90 : 20mg. Comprimés roses, ronds, biconvexes, enrobés. En creux « CRESTOR » et « 20 » sur un côté ; bouteilles de 90
CDN 0310-0752-39 : 20mg. Comprimés roses, ronds, biconvexes, enrobés. En creux "CRESTOR" et "20" sur un côté ; paquets de dose unitaire de 100
CDN 0310-0754-30 : 40mg. Comprimés enrobés roses, ovales, biconvexes. En creux "CRESTOR" d'un côté et "40" de l'autre côté ; bouteilles de 30
Stockage
Conserver à température ambiante contrôlée, 20-25°C (68-77°F) [voir Température ambiante contrôlée USP ]. Protéger de l'humidité.
Distribué par : AstraZeneca Pharmaceuticals LP Wilmington, DE 19850. Révisé : septembre 2018
EFFETS SECONDAIRES
Les effets indésirables graves suivants sont discutés plus en détail dans d'autres sections de l'étiquette :
- Rhabdomyolyse avec myoglobinurie et insuffisance rénale aiguë et myopathie (y compris myosite) [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Anomalies des enzymes hépatiques [voir AVERTISSEMENTS ET PRECAUTIONS ]
Expérience des études cliniques
Étant donné que les études cliniques sont menées dans des conditions très variables, les taux d'effets indésirables observés dans les études cliniques d'un médicament ne peuvent pas être directement comparés aux taux des études cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique clinique.
Dans la base de données des essais cliniques contrôlés CRESTOR (placebo ou contrôle actif) de 5394 patients avec une durée moyenne de traitement de 15 semaines, 1,4% des patients ont arrêté en raison d'effets indésirables. Les effets indésirables les plus fréquents ayant conduit à l'arrêt du traitement ont été :
- myalgie
- douleur abdominale
- nausée
Les effets indésirables les plus fréquemment rapportés (incidence ≥ 2 %) dans la base de données des essais cliniques contrôlés CRESTOR 5 mg portant sur 5 394 patients étaient :
- mal de tête
- myalgie
- douleur abdominale
- asthénie
- nausée
Les effets indésirables signalés chez ≥ 2 % des patients dans les études cliniques contrôlées par placebo et à un taux supérieur à celui du placebo sont présentés dans le tableau 1. Ces études ont duré jusqu'à 12 semaines.
Les autres effets indésirables signalés dans les études cliniques étaient des douleurs abdominales, des étourdissements, une hypersensibilité (y compris éruption cutanée, prurit, urticaire et œdème de Quincke) et une pancréatite. Les anomalies de laboratoire suivantes ont également été signalées : protéinurie positive à la bandelette réactive et hématurie microscopique [voir AVERTISSEMENTS ET PRECAUTIONS ] ; augmentation de la créatine phosphokinase, des transaminases, du glucose, de la glutamyl transpeptidase, de la phosphatase alcaline et de la bilirubine ; et des anomalies de la fonction thyroïdienne.
Dans l'étude METEOR, impliquant 981 participants traités par la rosuvastatine 40 mg (n = 700) ou un placebo (n = 281) avec une durée moyenne de traitement de 1,7 an, 5,6 % des sujets traités par CRESTOR 5 mg versus 2,8 % des sujets traités par placebo interrompu en raison d'effets indésirables. Les effets indésirables les plus fréquents ayant conduit à l'arrêt du traitement ont été : myalgies, augmentation des enzymes hépatiques, céphalées et nausées [voir Etudes cliniques ].
Les effets indésirables rapportés chez ≥ 2 % des patients et à un taux supérieur à celui du placebo sont présentés dans le tableau 2.
Dans l'étude JUPITER, 17 802 participants ont été traités par la rosuvastatine 20 mg (n = 8 901) ou un placebo (n = 8 901) pendant une durée moyenne de 2 ans. Un pourcentage plus élevé de patients traités par la rosuvastatine par rapport aux patients traités par placebo, 6,6 % et 6,2 %, respectivement, ont arrêté le médicament à l'étude en raison d'un événement indésirable, quelle que soit la causalité du traitement. La myalgie était l'effet indésirable le plus fréquent ayant conduit à l'arrêt du traitement.
Dans l'étude JUPITER, une fréquence significativement plus élevée de diabète sucré a été signalée chez les patients prenant de la rosuvastatine (2,8 %) par rapport aux patients sous placebo (2,3 %). L'HbA1c moyenne était significativement augmentée de 0,1 % chez les patients traités par la rosuvastatine par rapport aux patients traités par placebo. Le nombre de patients avec une HbA1c > 6,5 % à la fin de l'essai était significativement plus élevé chez les patients traités par la rosuvastatine que chez les patients sous placebo [voir AVERTISSEMENTS ET PRECAUTIONS et Etudes cliniques ].
Les effets indésirables rapportés chez ≥ 2 % des patients et à un taux supérieur à celui du placebo sont présentés dans le tableau 3.
Patients pédiatriques atteints d'hypercholestérolémie familiale hétérozygote
Dans une étude contrôlée de 12 semaines chez des garçons et des filles postménarchées âgés de 10 à 17 ans atteints d'hypercholestérolémie familiale hétérozygote avec CRESTOR 5 à 20 mg par jour [voir Utilisation dans des populations spécifiques et Etudes cliniques ], des élévations de la créatine phosphokinase (CK) sérique > 10 x LSN ont été observées plus fréquemment avec la rosuvastatine par rapport aux enfants traités par placebo. Quatre des 130 (3 %) enfants traités par la rosuvastatine (2 traités par 10 mg et 2 traités par 20 mg) ont présenté une augmentation de la CK > 10 x LSN, comparativement à 0 des 46 enfants sous placebo.
Expérience post-commercialisation
Les effets indésirables suivants ont été identifiés lors de l'utilisation post-approbation de CRESTOR : arthralgie, insuffisance hépatique mortelle et non mortelle, hépatite, ictère, thrombocytopénie, dépression, troubles du sommeil (y compris insomnie et cauchemars), neuropathie périphérique, maladie pulmonaire interstitielle et gynécomastie. Étant donné que ces réactions sont signalées volontairement par une population de taille incertaine, il n'est pas toujours possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale avec l'exposition au médicament.
De rares cas de myopathie nécrosante à médiation immunitaire associés à l'utilisation de statines ont été signalés [voir AVERTISSEMENTS ET PRECAUTIONS ].
Il y a eu de rares rapports post-commercialisation de troubles cognitifs (par exemple, perte de mémoire, oubli, amnésie, troubles de la mémoire et confusion) associés à l'utilisation de statines. Ces problèmes cognitifs ont été signalés pour toutes les statines. Les rapports sont généralement non graves et réversibles à l'arrêt des statines, avec des délais variables d'apparition des symptômes (1 jour à plusieurs années) et de résolution des symptômes (médiane de 3 semaines).
INTERACTIONS MÉDICAMENTEUSES
Ciclosporine
La ciclosporine a augmenté l'exposition à la rosuvastatine et peut entraîner un risque accru de myopathie. Par conséquent, chez les patients prenant de la ciclosporine, la dose de CRESTOR 10 mg ne doit pas dépasser 5 mg une fois par jour [voir DOSAGE ET ADMINISTRATION , AVERTISSEMENTS ET PRECAUTIONS et PHARMACOLOGIE CLINIQUE ].
Gemfibrozil
Le gemfibrozil a significativement augmenté l'exposition à la rosuvastatine. En raison d'un risque accru observé de myopathie/rhabdomyolyse, l'association de CRESTOR et de gemfibrozil doit être évitée. En cas d'utilisation concomitante, la dose de CRESTOR 10 mg ne doit pas dépasser 10 mg une fois par jour [voir PHARMACOLOGIE CLINIQUE ].
Inhibiteurs de protéase
L'administration concomitante de rosuvastatine avec certains inhibiteurs de la protéase a des effets différents sur l'exposition à la rosuvastatine et peut augmenter le risque de myopathie. Le siméprévir, qui est un inhibiteur de la protéase du virus de l'hépatite C (VHC), ou les associations d'atazanavir/ritonavir ou de lopinavir/ritonavir, qui sont des inhibiteurs de la protéase du VIH-1, augmentent l'exposition à la rosuvastatine [voir Tableau 4 - PHARMACOLOGIE CLINIQUE ]. Pour ces inhibiteurs de protéase, la dose de CRESTOR 5 mg ne doit pas dépasser 10 mg une fois par jour. Les associations fosamprénavir/ritonavir ou tipranavir/ritonavir, qui sont des inhibiteurs de la protéase du VIH-1, ne modifient que peu ou pas l'exposition à la rosuvastatine. La prudence s'impose lorsque la rosuvastatine est co-administrée avec des inhibiteurs de la protéase [voir DOSAGE ET ADMINISTRATION , AVERTISSEMENTS ET PRECAUTIONS et PHARMACOLOGIE CLINIQUE ].
Anticoagulants coumariniques
CRESTOR 20 mg a significativement augmenté l'INR chez les patients recevant des anticoagulants coumariniques. Par conséquent, la prudence s'impose lorsque des anticoagulants coumariniques sont administrés en même temps que CRESTOR. Chez les patients prenant simultanément des anticoagulants coumariniques et CRESTOR, l'INR doit être déterminé avant de commencer CRESTOR et suffisamment fréquemment au début du traitement pour s'assurer qu'aucune altération significative de l'INR ne se produit [voir AVERTISSEMENTS ET PRECAUTIONS et PHARMACOLOGIE CLINIQUE ].
Niacine
Le risque d'effets sur les muscles squelettiques peut être accru lorsque CRESTOR 5 mg est utilisé en association avec des doses modificatrices des lipides (≥ 1 g/jour) de niacine ; la prudence s'impose lors de la prescription de CRESTOR [voir AVERTISSEMENTS ET PRECAUTIONS ].
Fénofibrate
Lorsque CRESTOR 20 mg a été co-administré avec le fénofibrate, aucune augmentation cliniquement significative de l'ASC de la rosuvastatine ou du fénofibrate n'a été observée. Étant donné qu'il est connu que le risque de myopathie pendant le traitement par les inhibiteurs de l'HMG-CoA réductase est augmenté lors de l'utilisation concomitante de fénofibrates, la prudence s'impose lors de la prescription de fénofibrates avec CRESTOR [voir AVERTISSEMENTS ET PRECAUTIONS et PHARMACOLOGIE CLINIQUE ].
Colchicine
Des cas de myopathie, y compris de rhabdomyolyse, ont été rapportés avec les inhibiteurs de l'HMG-CoA réductase, y compris la rosuvastatine, co-administrés avec la colchicine, et la prudence s'impose lors de la prescription de CRESTOR avec la colchicine [voir AVERTISSEMENTS ET PRECAUTIONS ].
AVERTISSEMENTS
Inclus dans le cadre du PRÉCAUTIONS section.
PRÉCAUTIONS
Effets sur les muscles squelettiques
Des cas de myopathie et de rhabdomyolyse avec insuffisance rénale aiguë secondaire à une myoglobinurie ont été rapportés avec les inhibiteurs de l'HMG-CoA réductase, y compris CRESTOR. Ces risques peuvent survenir à n'importe quelle dose, mais sont accrus à la dose la plus élevée (40 mg).
CRESTOR 5 mg doit être prescrit avec prudence chez les patients présentant des facteurs prédisposant à la myopathie (par exemple, âge ≥ 65 ans, hypothyroïdie insuffisamment traitée, insuffisance rénale). Le risque de myopathie pendant le traitement par CRESTOR 5 mg peut être augmenté avec l'administration concomitante de certains autres traitements hypolipémiants (fibrates ou niacine), du gemfibrozil, de la cyclosporine, de l'atazanavir/ritonavir, du lopinavir/ritonavir ou du siméprévir [voir DOSAGE ET ADMINISTRATION et INTERACTIONS MÉDICAMENTEUSES ]. Des cas de myopathie, y compris de rhabdomyolyse, ont été rapportés avec les inhibiteurs de l'HMG-CoA réductase, y compris la rosuvastatine, co-administrés avec la colchicine, et la prudence s'impose lors de la prescription de CRESTOR avec des colchicines [voir INTERACTIONS MÉDICAMENTEUSES ].
Le traitement par CRESTOR doit être interrompu si des taux de créatine kinase nettement élevés surviennent ou si une myopathie est diagnostiquée ou suspectée. Le traitement par CRESTOR 5 mg doit également être temporairement suspendu chez tout patient présentant une affection aiguë et grave évoquant une myopathie ou prédisposant au développement d'une insuffisance rénale secondaire à une rhabdomyolyse (par exemple, septicémie, hypotension, déshydratation, chirurgie majeure, traumatisme, troubles métaboliques, troubles électrolytiques ou convulsions incontrôlées).
De rares cas de myopathie nécrosante à médiation immunitaire (IMNM), une myopathie auto-immune, associée à l'utilisation de statines ont été signalés. L'IMNM se caractérise par : une faiblesse musculaire proximale et une élévation de la créatine kinase sérique, qui persistent malgré l'arrêt du traitement par statine ; biopsie musculaire montrant une myopathie nécrosante sans inflammation importante ; amélioration avec des agents immunosuppresseurs.
Tous les patients doivent être avisés de signaler rapidement à leur médecin toute douleur, sensibilité ou faiblesse musculaire inexpliquée, en particulier si elles s'accompagnent de malaise ou de fièvre ou si les signes et symptômes musculaires persistent après l'arrêt de CRESTOR.
Anomalies des enzymes hépatiques
Il est recommandé d'effectuer des tests d'enzymes hépatiques avant l'initiation de CRESTOR 10 mg et si des signes ou symptômes d'atteinte hépatique apparaissent.
Des augmentations des transaminases sériques [AST (SGOT) ou ALT (SGPT)] ont été rapportées avec les inhibiteurs de l'HMG-CoA réductase, y compris CRESTOR. Dans la plupart des cas, les élévations étaient transitoires et résolues ou améliorées lors de la poursuite du traitement ou après une brève interruption du traitement. Il y a eu deux cas d'ictère, pour lesquels une relation avec le traitement par CRESTOR n'a pu être déterminée, qui ont disparu après l'arrêt du traitement. Il n'y a eu aucun cas d'insuffisance hépatique ou de maladie hépatique irréversible dans ces essais. Dans une analyse groupée d'essais contrôlés par placebo, des augmentations des transaminases sériques à > 3 fois la limite supérieure de la normale se sont produites chez 1,1 % des patients prenant CRESTOR 5 mg contre 0,5 % des patients traités par placebo.
De rares cas d'insuffisance hépatique mortelle et non mortelle ont été rapportés après commercialisation chez des patients prenant des statines, y compris la rosuvastatine. Si des lésions hépatiques graves accompagnées de symptômes cliniques et/ou d'hyperbilirubinémie ou d'ictère surviennent pendant le traitement par CRESTOR 20 mg, interrompez rapidement le traitement. Si une étiologie alternative n'est pas trouvée, ne pas redémarrer CRESTOR.
CRESTOR 5 mg doit être utilisé avec prudence chez les patients qui consomment des quantités importantes d'alcool et/ou qui ont des antécédents de maladie chronique du foie [voir PHARMACOLOGIE CLINIQUE ]. Une maladie hépatique active, qui peut inclure des élévations persistantes et inexpliquées des transaminases, est une contre-indication à l'utilisation de CRESTOR [voir CONTRE-INDICATIONS ].
Anticoagulants coumariniques concomitants
La prudence s'impose lorsque des anticoagulants sont administrés en association avec CRESTOR en raison de sa potentialisation de l'effet des anticoagulants coumariniques sur l'allongement du temps de prothrombine/INR. Chez les patients prenant simultanément des anticoagulants coumariniques et CRESTOR, l'INR doit être déterminé avant de commencer CRESTOR 10 mg et suffisamment fréquemment au début du traitement pour s'assurer qu'aucune altération significative de l'INR ne se produit [voir INTERACTIONS MÉDICAMENTEUSES ].
Protéinurie et hématurie
Dans le programme d'essais cliniques CRESTOR, une protéinurie positive à la bandelette réactive et une hématurie microscopique ont été observées chez les patients traités par CRESTOR. Ces résultats étaient plus fréquents chez les patients prenant CRESTOR 40 mg, par rapport à des doses plus faibles de CRESTOR 20 mg ou d'inhibiteurs comparateurs de l'HMG-CoA réductase, bien qu'ils aient été généralement transitoires et n'aient pas été associés à une détérioration de la fonction rénale. Bien que la signification clinique de ce résultat soit inconnue, une réduction de la dose doit être envisagée chez les patients sous traitement par CRESTOR présentant une protéinurie et/ou une hématurie persistante inexpliquée lors des analyses d'urine de routine.
Effets endocriniens
Des augmentations de l'HbA1c et de la glycémie à jeun ont été rapportées avec les inhibiteurs de l'HMG-CoA réductase, y compris CRESTOR. D'après les données des essais cliniques avec CRESTOR, dans certains cas, ces augmentations peuvent dépasser le seuil de diagnostic du diabète sucré [voir EFFETS INDÉSIRABLES ].
Bien que des études cliniques aient montré que CRESTOR 10 mg seul ne réduit pas la concentration plasmatique basale de cortisol ni n'altère la réserve surrénalienne, la prudence s'impose si CRESTOR est administré en concomitance avec des médicaments susceptibles de diminuer les taux ou l'activité d'hormones stéroïdes endogènes telles que le kétoconazole, la spironolactone et cimétidine.
Informations sur les conseils aux patients
Conseillez au patient de lire l'étiquetage patient approuvé par la FDA ( INFORMATIONS PATIENTS ).
Les patients doivent être informés de ne pas prendre 2 doses de CRESTOR à moins de 12 heures d'intervalle.
Effets sur les muscles squelettiques
Les patients doivent être informés qu'ils doivent signaler rapidement toute douleur, sensibilité ou faiblesse musculaire inexpliquée, en particulier si elles s'accompagnent de malaises ou de fièvre ou si ces signes ou symptômes musculaires persistent après l'arrêt de CRESTOR.
Utilisation concomitante d'antiacides
Lors de la prise de CRESTOR 5 mg avec un antiacide à base d'hydroxyde d'aluminium et de magnésium, l'antiacide doit être pris au moins 2 heures après l'administration de CRESTOR 10 mg.
Toxicité embryofœtale
Conseillez aux femmes en âge de procréer du risque pour le fœtus, d'utiliser une contraception efficace pendant le traitement et d'informer leur professionnel de la santé d'une grossesse connue ou suspectée. [voir CONTRE-INDICATIONS et Utilisation dans des populations spécifiques ].
Lactation
Déconseiller aux femmes d'allaiter pendant le traitement par CRESTOR [voir CONTRE-INDICATIONS et Utilisation dans des populations spécifiques ].
Des enzymes hépatiques
Il est recommandé que des tests d'enzymes hépatiques soient effectués avant le début de CRESTOR et si des signes ou des symptômes de lésions hépatiques apparaissent. Tous les patients traités par CRESTOR doivent être avisés de signaler rapidement tout symptôme pouvant indiquer une atteinte hépatique, y compris la fatigue, l'anorexie, une gêne abdominale supérieure droite, des urines foncées ou une jaunisse.
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Dans une étude de cancérogénicité de 104 semaines chez le rat à des doses de 2, 20, 60 ou 80 mg/kg/jour par gavage oral, l'incidence des polypes stromaux utérins a été significativement augmentée chez les femelles à 80 mg/kg/jour en administration systémique. exposition 20 fois l'exposition humaine à 40 mg/jour sur la base de l'ASC. L'incidence accrue de polypes n'a pas été observée à des doses plus faibles.
Dans une étude de cancérogénicité de 107 semaines chez des souris ayant reçu 10, 60 ou 200 mg/kg/jour par gavage oral, une incidence accrue d'adénome/carcinome hépatocellulaire a été observée à 200 mg/kg/jour à des expositions systémiques 20 fois supérieures à l'exposition humaine. à 40 mg/jour en fonction de l'ASC. Une incidence accrue de tumeurs hépatocellulaires n'a pas été observée à des doses plus faibles.
La rosuvastatine n'a pas été mutagène ou clastogène avec ou sans activation métabolique dans le test d'Ames avec Salmonella typhimurium et Escherichia coli, le test du lymphome de souris et le test d'aberration chromosomique dans les cellules pulmonaires du hamster chinois. La rosuvastatine était négative dans le test in vivo du micronoyau chez la souris.
Dans des études de fertilité chez le rat avec des doses de gavage oral de 5, 15, 50 mg/kg/jour, les mâles ont été traités pendant 9 semaines avant et pendant l'accouplement et les femelles ont été traitées 2 semaines avant l'accouplement et pendant l'accouplement jusqu'au jour 7 de la gestation. un effet sur la fertilité a été observé à 50 mg/kg/jour (expositions systémiques jusqu'à 10 fois l'exposition humaine à 40 mg/jour sur la base de l'ASC). Dans les testicules de chiens traités par la rosuvastatine à raison de 30 mg/kg/jour pendant un mois, des cellules géantes spermatidiques ont été observées. Des cellules géantes spermatidiques ont été observées chez des singes après un traitement de 6 mois à 30 mg/kg/jour en plus de la vacuolisation de l'épithélium tubulaire séminifère. Les expositions chez le chien étaient 20 fois et chez le singe 10 fois l'exposition humaine à 40 mg/jour sur la base de la surface corporelle. Des résultats similaires ont été observés avec d'autres médicaments de cette classe.
Utilisation dans des populations spécifiques
Grossesse
Résumé des risques
CRESTOR 5 mg est contre-indiqué chez les femmes enceintes car la sécurité chez les femmes enceintes n'a pas été établie et il n'y a aucun avantage apparent au traitement par CRESTOR 20 mg pendant la grossesse. Étant donné que les inhibiteurs de l'HMG-CoA réductase diminuent la synthèse du cholestérol et éventuellement la synthèse d'autres substances biologiquement actives dérivées du cholestérol, CRESTOR peut être nocif pour le fœtus lorsqu'il est administré à des femmes enceintes. CRESTOR 5 mg doit être arrêté dès que la grossesse est reconnue [voir CONTRE-INDICATIONS ]. Les données limitées publiées sur l'utilisation de la rosuvastatine sont insuffisantes pour déterminer un risque associé au médicament de malformations congénitales majeures ou de fausse couche. Dans les études de reproduction chez l'animal, il n'y a eu aucun effet indésirable sur le développement avec l'administration orale de rosuvastatine pendant l'organogenèse à des expositions systémiques équivalentes à une dose humaine maximale recommandée (MRHD) de 40 mg/jour chez le rat ou le lapin (sur la base de l'ASC et de la surface corporelle, respectivement). ). Chez les rats et les lapins, une diminution de la survie des ratons/fœtus s'est produite à 12 fois et équivalait, respectivement, à la MRHD de 40 mg/jour [voir Données ].
Le risque de fond estimé de malformations congénitales majeures et de fausse couche pour la population indiquée est inconnu. Dans la population générale des États-Unis, le risque de fond estimé de malformations congénitales majeures et de fausse couche dans les grossesses cliniquement reconnues est de 2 à 4 % et de 15 à 20 %, respectivement.
Données
Données humaines
Des données limitées publiées sur la rosuvastatine n'ont pas montré d'augmentation du risque de malformations congénitales majeures ou de fausse couche. De rares cas d'anomalies congénitales ont été signalés à la suite d'une exposition intra-utérine à d'autres statines. Dans une revue d'environ 100 grossesses suivies de manière prospective chez des femmes exposées à la simvastatine ou à la lovastatine, l'incidence des anomalies congénitales, des avortements spontanés et des morts fœtales/mortinaissances n'a pas dépassé ce qui serait attendu dans la population générale. Le nombre de cas est suffisant pour exclure une augmentation ≥ 3 à 4 fois des anomalies congénitales par rapport à l'incidence de fond. Dans 89 % des grossesses suivies de manière prospective, le traitement médicamenteux a été initié avant la grossesse et a été interrompu à un moment donné du premier trimestre lorsque la grossesse a été identifiée.
Données animales
La rosuvastatine traverse le placenta chez le rat et le lapin et se retrouve dans le tissu fœtal et le liquide amniotique à 3 % et 20 %, respectivement, de la concentration plasmatique maternelle après une dose unique de 25 mg/kg par gavage oral au 16e jour de gestation chez le rat. Une distribution tissulaire fœtale plus élevée (concentration plasmatique maternelle de 25 %) a été observée chez les lapins après une dose unique de gavage oral de 1 mg/kg au 18e jour de gestation.
L'administration de rosuvastatine n'a pas indiqué d'effet tératogène chez le rat à ≤ 25 mg/kg/jour ou chez le lapin ≤ 3 mg/kg/jour (doses équivalentes à la MRHD de 40 mg/jour en fonction de l'ASC et de la surface corporelle, respectivement).
Chez les rats femelles ayant reçu 5, 15 et 50 mg/kg/jour avant l'accouplement et jusqu'au 7e jour de gestation, il en est résulté une diminution du poids corporel du fœtus (chiots femelles) et un retard de l'ossification à 50 mg/kg/jour (10 fois l'exposition humaine à la dose de MRHD de 40 mg/jour en fonction de l'ASC).
Chez les rates gravides ayant reçu 2, 10 et 50 mg/kg/jour de rosuvastatine du 7e jour de gestation au 21e jour de lactation (sevrage), une diminution de la survie des ratons s'est produite à 50 mg/kg/jour (dose équivalente à 12 fois la MRHD de 40 mg /jour en fonction de la surface corporelle).
Chez des lapines gravides ayant reçu 0,3, 1 et 3 mg/kg/jour de rosuvastatine du jour 6 au jour 18 de la gestation, une diminution de la viabilité fœtale et de la mortalité maternelle a été observée à 3 mg/kg/jour (dose équivalente à la MRHD de 40 mg/ jour en fonction de la surface corporelle).
Lactation
Résumé des risques
L'utilisation de la rosuvastatine est contre-indiquée pendant l'allaitement [voir CONTRE-INDICATIONS ]. Des données limitées indiquent que CRESTOR est présent dans le lait maternel. Il n'y a pas d'informations disponibles sur les effets du médicament sur le nourrisson allaité ou sur les effets du médicament sur la production de lait. En raison du risque d'effets indésirables graves chez un nourrisson allaité, informez les patients que l'allaitement n'est pas recommandé pendant le traitement par CRESTOR.
Femelles et mâles de potentiel reproducteur
La contraception
CRESTOR peut nuire au fœtus lorsqu'il est administré à une femme enceinte [voir Utilisation dans des populations spécifiques ]. Conseillez aux femmes en âge de procréer d'utiliser une contraception efficace pendant le traitement par CRESTOR.
Utilisation pédiatrique
Chez les enfants et les adolescents de 8 à 17 ans atteints d'hypercholestérolémie familiale hétérozygote, la sécurité et l'efficacité de CRESTOR 10 mg en complément d'un régime alimentaire pour réduire les taux de cholestérol total, de LDL-C et d'ApoB lorsque, après un essai adéquat de thérapie diététique, le LDL -C dépasse 190 mg/dL ou lorsque le LDL-C dépasse 160 mg/dL et qu'il existe des antécédents familiaux positifs de MCV prématurée ou deux ou plusieurs autres facteurs de risque de MCV, ont été établis dans un essai contrôlé et dans un essai ouvert, non contrôlé procès [voir Etudes cliniques ]. L'efficacité à long terme du traitement par CRESTOR initié dans l'enfance pour réduire la morbidité et la mortalité à l'âge adulte n'a pas été établie.
La sécurité et l'efficacité de CRESTOR 5 mg chez les enfants et les adolescents de 10 à 17 ans atteints d'hypercholestérolémie familiale hétérozygote ont été évaluées dans un essai clinique contrôlé d'une durée de 12 semaines suivi de 40 semaines d'exposition en ouvert. Les patients traités avec 5 mg, 10 mg et 20 mg par jour de CRESTOR 10 mg présentaient un profil d'effets indésirables généralement similaire à celui des patients traités avec un placebo. Il n'y avait aucun effet détectable de CRESTOR sur la croissance, le poids, l'IMC (indice de masse corporelle) ou la maturation sexuelle [voir Etudes cliniques ] chez les enfants et les adolescents (10 à 17 ans).
CRESTOR n'a pas été étudié dans des essais cliniques contrôlés impliquant des patients prépubères ou des patients de moins de 10 ans atteints d'hypercholestérolémie familiale hétérozygote. Cependant, la sécurité et l'efficacité de CRESTOR ont été évaluées dans un essai ouvert non contrôlé de deux ans qui a inclus des enfants et des adolescents âgés de 8 à 17 ans atteints d'hypercholestérolémie familiale hétérozygote [voir Etudes cliniques ]. L'innocuité et l'efficacité de CRESTOR 5 mg dans la réduction du LDL-C semblaient généralement cohérentes avec celles observées chez les patients adultes, malgré les limites de la conception de l'étude non contrôlée.
Des enfants et des adolescents âgés de 7 à 15 ans atteints d'hypercholestérolémie familiale homozygote ont été étudiés dans une étude croisée randomisée, contrôlée par placebo de 6 semaines avec CRESTOR 20 mg une fois par jour suivi de 12 semaines de traitement en ouvert [voir Etudes cliniques ]. En général, le profil d'innocuité dans cet essai était cohérent avec celui du profil d'innocuité précédemment établi chez l'adulte.
Bien que tous les effets indésirables identifiés dans la population adulte n'aient pas été observés dans les essais cliniques chez les enfants et les adolescents, les mêmes mises en garde et précautions pour les adultes doivent être prises en compte pour les enfants et les adolescents. Les adolescentes doivent être conseillées sur les méthodes contraceptives appropriées pendant le traitement par CRESTOR 5 mg [voir Utilisation dans des populations spécifiques ].
Utilisation gériatrique
Des 10 275 patients dans les études cliniques avec CRESTOR, 3159 (31 %) avaient 65 ans et plus et 698 (6,8 %) avaient 75 ans et plus. Aucune différence globale d'innocuité ou d'efficacité n'a été observée entre ces sujets et les sujets plus jeunes, et d'autres expériences cliniques rapportées n'ont pas identifié de différences dans les réponses entre les patients âgés et les patients plus jeunes, mais une plus grande sensibilité de certains individus plus âgés ne peut être exclue.
Les patients âgés sont plus à risque de myopathie et CRESTOR doit être prescrit avec prudence chez les personnes âgées [voir AVERTISSEMENTS ET PRECAUTIONS et PHARMACOLOGIE CLINIQUE ].
Insuffisance rénale
L'exposition à la rosuvastatine n'est pas influencée par une insuffisance rénale légère à modérée (CLcr ≥ 30 ml/min/1,73 m²). L'exposition à la rosuvastatine est augmentée de manière cliniquement significative chez les patients présentant une insuffisance rénale sévère (CLcr DOSAGE ET ADMINISTRATION , AVERTISSEMENTS ET PRECAUTIONS et PHARMACOLOGIE CLINIQUE ].
Insuffisance hépatique
CRESTOR est contre-indiqué chez les patients atteints d'une maladie hépatique active, qui peut inclure des élévations persistantes inexpliquées des taux de transaminases hépatiques. On sait que l'hépatopathie chronique due à l'alcool augmente l'exposition à la rosuvastatine ; CRESTOR 20 mg doit être utilisé avec prudence chez ces patients [voir CONTRE-INDICATIONS , AVERTISSEMENTS ET PRECAUTIONS et PHARMACOLOGIE CLINIQUE ].
Patients asiatiques
Les études pharmacocinétiques ont démontré une augmentation d'environ 2 fois de l'exposition médiane à la rosuvastatine chez les sujets asiatiques par rapport aux témoins caucasiens. La posologie de CRESTOR doit être ajustée chez les patients asiatiques [voir DOSAGE ET ADMINISTRATION et PHARMACOLOGIE CLINIQUE ].
SURDOSAGE
Il n'existe pas de traitement spécifique en cas de surdosage. En cas de surdosage, le patient doit être traité de manière symptomatique et des mesures de soutien doivent être mises en place si nécessaire. L'hémodialyse n'améliore pas significativement la clairance de la rosuvastatine.
CONTRE-INDICATIONS
CRESTOR 20mg est contre-indiqué dans les conditions suivantes :
- Patients présentant une hypersensibilité connue à l'un des composants de ce produit. Des réactions d'hypersensibilité incluant rash, prurit, urticaire et œdème de Quincke ont été rapportées avec CRESTOR [voir EFFETS INDÉSIRABLES ].
- Patients atteints d'une maladie hépatique active, pouvant inclure des élévations persistantes inexpliquées des taux de transaminases hépatiques [voir AVERTISSEMENTS ET PRECAUTIONS ].
- Grossesse [voir Utilisation dans des populations spécifiques ].
- Lactation. Des données limitées indiquent que CRESTOR 20 mg est présent dans le lait maternel. Étant donné que les statines peuvent entraîner des effets indésirables graves chez les nourrissons, les femmes qui nécessitent un traitement par CRESTOR ne doivent pas allaiter leurs nourrissons [voir Utilisation dans des populations spécifiques ].
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
CRESTOR 10 mg est un inhibiteur sélectif et compétitif de l'HMG-CoA réductase, l'enzyme limitant la vitesse qui convertit la 3-hydroxy-3-méthylglutaryl coenzyme A en mévalonate, un précurseur du cholestérol. Des études in vivo chez l'animal et des études in vitro sur des cellules animales et humaines en culture ont montré que la rosuvastatine a une absorption et une sélectivité élevées pour l'action dans le foie, l'organe cible de la réduction du cholestérol. Dans des études in vivo et in vitro, la rosuvastatine produit ses effets modificateurs des lipides de deux manières. Premièrement, il augmente le nombre de récepteurs hépatiques des LDL à la surface des cellules pour améliorer l'absorption et le catabolisme des LDL. Deuxièmement, la rosuvastatine inhibe la synthèse hépatique des VLDL, ce qui réduit le nombre total de particules de VLDL et de LDL.
Pharmacodynamie
CRESTOR 5 mg réduit en fonction de la dose de cholestérol LDL élevé et réduit le cholestérol total et les triglycérides et augmente le cholestérol HDL [voir Etudes cliniques ]. Une réponse thérapeutique à CRESTOR 5 mg est évidente dans la semaine suivant le début du traitement et 90 % de la réponse maximale est généralement obtenue en 2 semaines. La réponse maximale est généralement atteinte au bout de 4 semaines et se maintient ensuite. L'individualisation de la posologie du médicament doit être basée sur la réponse thérapeutique [voir DOSAGE ET ADMINISTRATION ].
Pharmacocinétique
Absorption
Dans les études de pharmacologie clinique chez l'homme, les concentrations plasmatiques maximales de rosuvastatine ont été atteintes 3 à 5 heures après administration orale. La Cmax et l'ASC ont augmenté en proportion approximative avec la dose de 10 mg de CRESTOR. La biodisponibilité absolue de la rosuvastatine est d'environ 20 %.
L'administration de CRESTOR avec de la nourriture n'a pas modifié l'ASC de la rosuvastatine.
L'ASC de la rosuvastatine ne diffère pas après l'administration du médicament le soir ou le matin.
Distribution
Le volume moyen de distribution à l'état d'équilibre de la rosuvastatine est d'environ 134 litres. La rosuvastatine est liée à 88 % aux protéines plasmatiques, principalement l'albumine. Cette liaison est réversible et indépendante des concentrations plasmatiques.
Élimination
La rosuvastatine est principalement éliminée par excrétion dans les fèces. La demi-vie d'élimination de la rosuvastatine est d'environ 19 heures.
Métabolisme
La rosuvastatine n'est pas largement métabolisée ; environ 10 % d'une dose radiomarquée est récupérée sous forme de métabolite. Le principal métabolite est la N-desméthyl rosuvastatine, qui est formée principalement par le cytochrome P450 \ 2C9, et des études in vitro ont démontré que la N-desméthyl rosuvastatine a environ un sixième à la moitié de l'activité inhibitrice de l'HMG-CoA réductase du composé parent. . Dans l'ensemble, plus de 90 % de l'activité inhibitrice de l'HMG-CoA réductase plasmatique active est due au composé parent.
Excrétion
Après administration orale, la rosuvastatine et ses métabolites sont principalement excrétés dans les fèces (90 %). Après une dose intraveineuse, environ 28 % de la clairance corporelle totale se faisait par voie rénale et 72 % par voie hépatique.
Populations spécifiques
Groupes raciaux ou ethniques
Une analyse pharmacocinétique de population n'a révélé aucune différence cliniquement pertinente dans la pharmacocinétique entre les groupes caucasiens, hispaniques et noirs ou afro-caribéens. Cependant, des études pharmacocinétiques, dont une menée aux États-Unis, ont démontré une augmentation d'environ 2 fois de l'exposition médiane (ASC et Cmax) chez les sujets asiatiques par rapport à un groupe témoin caucasien.
Patients masculins et féminins
Il n'y avait aucune différence dans les concentrations plasmatiques de rosuvastatine entre les hommes et les femmes.
Patients pédiatriques
Dans une analyse pharmacocinétique de population de deux essais pédiatriques impliquant des patients atteints d'hypercholestérolémie familiale hétérozygote âgés de 10 à 17 ans et de 8 à 17 ans, respectivement, l'exposition à la rosuvastatine est apparue comparable ou inférieure à l'exposition à la rosuvastatine chez les patients adultes.
Patients gériatriques
Il n'y avait aucune différence dans les concentrations plasmatiques de rosuvastatine entre les populations non âgées et âgées (âge ≥ 65 ans).
Patients atteints d'insuffisance rénale
Une insuffisance rénale légère à modérée (CLcr ≥ 30 ml/min/1,73 m²) n'a eu aucune influence sur les concentrations plasmatiques de rosuvastatine. Cependant, les concentrations plasmatiques de rosuvastatine ont augmenté de manière cliniquement significative (environ 3 fois) chez les patients atteints d'insuffisance rénale sévère (CLcr 80 ml/min/ 1,73 m²).
Hémodialyse
Les concentrations plasmatiques à l'état d'équilibre de la rosuvastatine chez les patients sous hémodialyse chronique étaient environ 50 % supérieures à celles des volontaires sains ayant une fonction rénale normale.
Patients atteints d'insuffisance hépatique
Chez les patients atteints d'hépatopathie chronique liée à l'alcool, les concentrations plasmatiques de rosuvastatine ont été légèrement augmentées.
Chez les patients atteints de la maladie de Child-Pugh A, la Cmax et l'ASC ont augmenté de 60 % et 5 %, respectivement, par rapport aux patients ayant une fonction hépatique normale. Chez les patients atteints de la maladie de Child-Pugh B, la Cmax et l'ASC ont augmenté de 100 % et 21 %, respectivement, par rapport aux patients ayant une fonction hépatique normale.
Études sur les interactions médicamenteuses
La clairance de la rosuvastatine ne dépend pas du métabolisme par le cytochrome P450 3A4 dans une mesure cliniquement significative.
La rosuvastatine est un substrat pour certaines protéines de transport, notamment la polyprotéine 1B1 de transport d'anions organiques du transporteur de captation hépatique (OATP1B1) et la protéine de résistance au cancer du sein du transporteur d'efflux (BCRP). L'administration concomitante de CRESTOR 10 mg avec des médicaments qui sont des inhibiteurs de ces protéines de transport (par exemple, la cyclosporine, certains inhibiteurs de la protéase du VIH) peut entraîner une augmentation des concentrations plasmatiques de rosuvastatine [voir DOSAGE ET ADMINISTRATION et INTERACTIONS MÉDICAMENTEUSES ].
Pharmacogénomique
L'élimination des inhibiteurs de l'HMG-CoA réductase, y compris la rosuvastatine, implique OATP1B1 et d'autres protéines de transport. Des concentrations plasmatiques plus élevées de rosuvastatine ont été rapportées dans de très petits groupes de patients (n = 3 à 5) présentant deux allèles à fonction réduite du gène codant pour OATP1B1 (SLCO1B1 521T > C). La fréquence de ce génotype (c'est-à-dire SLCO1B1 521 C/C) est généralement inférieure à 5 % dans la plupart des groupes raciaux/ethniques. L'impact de ce polymorphisme sur l'efficacité et/ou la tolérance de la rosuvastatine n'est pas clairement établi.
Toxicologie animale et/ou pharmacologie
Toxicité du système nerveux central
Des lésions vasculaires du SNC, caractérisées par des hémorragies périvasculaires, un œdème et une infiltration de cellules mononucléaires dans les espaces périvasculaires, ont été observées chez des chiens traités avec plusieurs autres membres de cette classe de médicaments. Un médicament chimiquement similaire de cette classe a produit une dégénérescence du nerf optique dose-dépendante (dégénérescence wallérienne des fibres rétinogéniques) chez le chien, à une dose produisant des taux plasmatiques de médicament environ 30 fois plus élevés que le taux moyen de médicament chez l'homme prenant la dose recommandée la plus élevée. Un œdème, une hémorragie et une nécrose partielle dans l'interstitium du plexus choroïde ont été observés chez une chienne sacrifiée moribonde au jour 24 à 90 mg/kg/jour par gavage oral (expositions systémiques 100 fois l'exposition humaine à 40 mg/jour sur la base de ASC). Une opacité cornéenne a été observée chez des chiens traités pendant 52 semaines à 6 mg/kg/jour par gavage oral (expositions systémiques 20 fois supérieures à l'exposition humaine à 40 mg/jour sur la base de l'ASC). Des cataractes ont été observées chez des chiens traités pendant 12 semaines par gavage oral à 30 mg/kg/jour (expositions systémiques 60 fois supérieures à l'exposition humaine à 40 mg/jour sur la base de l'ASC). Une dysplasie rétinienne et une perte de rétine ont été observées chez des chiens traités pendant 4 semaines par gavage oral à 90 mg/kg/jour (expositions systémiques 100 fois supérieures à l'exposition humaine à 40 mg/jour sur la base de l'ASC). Des doses ≤ 30 mg/kg/jour (expositions systémiques ≤ 60 fois l'exposition humaine à 40 mg/jour sur la base de l'ASC) n'ont pas révélé d'effets rétiniens pendant le traitement jusqu'à un an.
Étude de toxicologie juvénile
Dans une étude juvénile, des rats ont reçu par gavage oral 10 ou 50 mg/kg/jour à partir du sevrage pendant 9 semaines avant l'accouplement, tout au long de l'accouplement et jusqu'à la veille de l'autopsie pour les mâles ou jusqu'au jour de gestation 7 pour les femelles. Aucun effet sur le développement sexuel, l'apparence testiculaire et épididymaire ou la fertilité n'a été observé à l'une ou l'autre des doses (2 fois ou jusqu'à 24 fois l'exposition humaine (ASC) à la dose pédiatrique maximale de 20 mg/jour).
Etudes cliniques
Hyperlipidémie et dyslipidémie mixte
CRESTOR 5 mg réduit le C total, le LDL-C, l'ApoB, le non-HDL-C et les TG, et augmente le HDL-C, chez les patients adultes atteints d'hyperlipidémie et de dyslipidémie mixte.
Étude de dosage
Dans une étude multicentrique, en double aveugle, contrôlée par placebo et de dosage chez des patients atteints d'hyperlipidémie, CRESTOR administré en une seule dose quotidienne pendant 6 semaines a réduit de manière significative le C total, le LDL-C, le non-HDL-C et l'ApoB, à travers la dose gamme (tableau 6).
Étude contrôlée active
CRESTOR 5 mg a été comparé aux inhibiteurs de l'HMG-CoA réductase atorvastatine, simvastatine et pravastatine dans une étude multicentrique, en ouvert, de dosage portant sur 2240 patients atteints d'hyperlipidémie ou de dyslipidémie mixte. Après randomisation, les patients ont été traités pendant 6 semaines avec une seule dose quotidienne de CRESTOR 20 mg, d'atorvastatine, de simvastatine ou de pravastatine (Figure 1 et Tableau 7).
Figure 1 : Pourcentage de variation du LDL-C par dose de CRESTOR à 20 mg, d'atorvastatine, de simvastatine et de pravastatine à la semaine 6 chez des patients atteints d'hyperlipidémie ou de dyslipidémie mixte 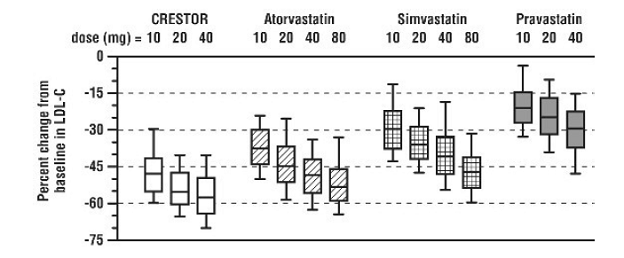
Les boîtes à moustaches sont une représentation des valeurs des 25e, 50e et 75e centiles, les moustaches représentant les valeurs des 10e et 90e centiles. LDL-C moyen initial : 189 mg/dl
Hypercholestérolémie familiale hétérozygote
Étude contrôlée active
Dans une étude portant sur des patients atteints d'HF hétérozygote (LDL moyen initial de 291), les patients ont été randomisés pour recevoir CRESTOR 20 mg ou atorvastatine 20 mg. La dose a été augmentée toutes les 6 semaines. Des réductions significatives du LDL-C par rapport au départ ont été observées à chaque dose dans les deux groupes de traitement (tableau 8).
Hypertriglycéridémie
Étude dose-réponse
Dans une étude dose-réponse en double aveugle, contrôlée par placebo chez des patients présentant des taux initiaux de TG de 273 à 817 mg/dL, CRESTOR 10 mg administré en une seule dose quotidienne (5 à 40 mg) pendant 6 semaines a significativement réduit les taux sériques de TG ( Tableau 9).
Dysbêtalipoprotéinémie primaire (hyperlipoprotéinémie de type III)
Dans une étude croisée randomisée, multicentrique et en double aveugle, 32 patients (27 avec la mutation ε2/ε2 et 4 avec la mutation apo E [Arg145Cys] atteints de dysbêtalipoprotéinémie primaire (hyperlipoprotéinémie de type III) sont entrés dans une période d'initiation alimentaire de 6 semaines sur le NCEP Régime de changement thérapeutique du mode de vie (TLC) : après une introduction diététique, les patients ont été randomisés pour recevoir une séquence de traitements en conjonction avec le régime TLC pendant 6 semaines chacun : rosuvastatine 10 mg suivie de rosuvastatine 20 mg ou rosuvastatine 20 mg suivie de rosuvastatine 10 mg CRESTOR a réduit les taux de C non HDL (critère principal) et de lipoprotéines résiduelles circulantes. Les résultats sont présentés dans le tableau ci-dessous.
Hypercholestérolémie familiale homozygote
Étude de titration de dose
Dans une étude ouverte à titration forcée, des patients homozygotes FH (n=40, 8-63 ans) ont été évalués pour leur réponse à CRESTOR 20 à 40 mg titré à 6 semaines d'intervalle. Dans l'ensemble de la population, la réduction moyenne du LDL-C par rapport au départ était de 22 %. Environ un tiers des patients ont bénéficié d'une augmentation de leur dose de 20 mg à 40 mg avec une réduction supplémentaire des LDL supérieure à 6 %. Chez les 27 patients présentant une réduction d'au moins 15 % du LDL-C, la réduction moyenne du LDL-C était de 30 % (réduction médiane de 28 %). Parmi 13 patients avec une réduction du LDL-C
Patients pédiatriques atteints d'hypercholestérolémie familiale homozygote
CRESTOR a fait l'objet d'une étude randomisée, en double aveugle, contrôlée par placebo, multicentrique et croisée chez 14 enfants et adolescents atteints d'hypercholestérolémie familiale homozygote. L'étude comportait une phase d'initiation diététique de 4 semaines au cours de laquelle les patients recevaient CRESTOR 10 mg par jour, une phase croisée comprenant deux périodes de traitement de 6 semaines avec CRESTOR 20 mg ou un placebo dans un ordre aléatoire, suivies d'une période de 12 phase ouverte d'une semaine durant laquelle tous les patients ont reçu CRESTOR 20 mg. Les patients étaient âgés de 7 à 15 ans (médiane de 11 ans), 50 % étaient des hommes, 71 % étaient de race blanche, 21 % étaient asiatiques, 7 % étaient noirs et aucun patient n'était d'origine hispanique. Cinquante pour cent suivaient un traitement par aphérèse et 57 % prenaient de l'ézétimibe. Les patients entrés dans l'étude sous traitement par aphérèse ou ézétimibe ont poursuivi le traitement pendant toute la durée de l'étude. Le LDL-C moyen au départ était de 416 mg/dL (intervalle de 152 à 716 mg/dL). Au total, 13 patients ont terminé les deux périodes de traitement de la phase croisée randomisée ; un patient a retiré son consentement en raison de l'impossibilité de se faire prélever du sang pendant la phase de croisement.
CRESTOR à 20 mg a significativement réduit le LDL-C, le cholestérol total, l'ApoB et le non-HDL-C par rapport au placebo (Tableau 11).
Patients pédiatriques atteints d'hypercholestérolémie familiale hétérozygote
Dans une étude en double aveugle, randomisée, multicentrique, contrôlée par placebo, d'une durée de 12 semaines, 176 enfants et adolescents (97 hommes et 79 femmes) atteints d'hypercholestérolémie familiale hétérozygote ont été randomisés pour recevoir 5, 10 ou 20 mg de rosuvastatine ou un placebo par jour. Les patients étaient âgés de 10 à 17 ans (âge médian de 14 ans) avec environ 30 % des patients âgés de 10 à 13 ans et environ 17 %, 18 %, 40 % et 25 % aux stades de Tanner II, III, IV, et V, respectivement. Les femelles étaient au moins 1 an après la ménarche. Le LDL-C moyen au départ était de 233 mg/dL (intervalle de 129 à 399). La phase en double aveugle de 12 semaines a été suivie d'une phase de titration de dose en ouvert de 40 semaines, où tous les patients (n = 173) ont reçu 5 mg, 10 mg ou 20 mg de rosuvastatine par jour.
La rosuvastatine a réduit de manière significative les taux de LDL-C (critère principal), de cholestérol total et d'ApoB à chaque dose par rapport au placebo. Les résultats sont présentés dans le tableau 12 ci-dessous.
À la fin de la période de traitement en double aveugle de 12 semaines, le pourcentage de patients atteignant l'objectif de LDL-C inférieur à 110 mg/dL (2,8 mmol/L) était de 0 % pour le placebo, 12 % pour la rosuvastatine 5 mg , 41 % pour la rosuvastatine 10 mg et 41 % pour la rosuvastatine 20 mg. Pour la phase ouverte de 40 semaines, 71 % des patients ont été titrés à la dose maximale de 20 mg et 41 % des patients ont atteint l'objectif de LDL-C de 110 mg/dL.
La rosuvastatine a également été étudiée dans le cadre d'un essai de titration à l'objectif, en ouvert, non contrôlé, de deux ans, qui a inclus 175 enfants et adolescents atteints d'hypercholestérolémie familiale hétérozygote âgés de 8 à 17 ans (79 garçons et 96 filles). Tous les patients avaient un défaut génétique documenté dans le récepteur LDL ou dans ApoB. Environ 89 % étaient de race blanche, 7 % étaient asiatiques, 1 % étaient noirs et moins de 1 % étaient hispaniques. Le LDL-C moyen au départ était de 236 mg/dL. Cinquante-huit (33 %) patients étaient prépubères au départ. La dose initiale de rosuvastatine pour tous les enfants et adolescents était de 5 mg une fois par jour. Les enfants de 8 à moins de 10 ans (n = 41 au départ) pouvaient titrer jusqu'à une dose maximale de 10 mg une fois par jour, et les enfants et adolescents de 10 à 17 ans pouvaient titrer jusqu'à une dose maximale de 20 mg une fois par jour.
Les réductions du LDL-C par rapport au départ étaient généralement cohérentes dans tous les groupes d'âge au sein de l'essai ainsi qu'avec l'expérience antérieure dans les essais contrôlés adultes et pédiatriques.
L'efficacité à long terme d'un traitement par la rosuvastatine initié dans l'enfance pour réduire la morbidité et la mortalité à l'âge adulte n'a pas été établie.
Ralentissement de la progression de l'athérosclérose
Dans l'étude Measuring Effects on Intima Media Thickness: an Evaluation Of Rosuvastatine 40 mg (METEOR), l'effet du traitement par CRESTOR sur l'athérosclérose carotidienne a été évalué par échographie en mode B chez des patients présentant un taux élevé de LDL-C, à faible risque (risque de Framingham
Le taux de changement annualisé par rapport au départ pour le groupe placebo était de +0,0131 mm/an (p
Au niveau individuel des patients du groupe traité par CRESTOR, 52,1 % des patients ont démontré une absence de progression de la maladie (définie comme un taux de variation annualisé négatif), contre 37,7 % des patients du groupe placebo.
Prévention primaire des maladies cardiovasculaires
Dans l'étude JUPITER (Justification for the Use of Statins in Primary Prevention: An Intervention Trial Evaluating Rosuvastatin), l'effet de CRESTOR (rosuvastatine calcique) sur la survenue d'événements cardiovasculaires (CV) majeurs a été évalué chez 17 802 hommes (≥ 50 ans ) et des femmes (≥ 60 ans) qui n'avaient pas de maladie cardiovasculaire cliniquement évidente, des taux de LDL-C
Le critère d'évaluation principal était un critère d'évaluation composite comprenant le délai jusqu'à la première survenue de l'un des événements CV majeurs suivants : décès CV, infarctus du myocarde non mortel, accident vasculaire cérébral non mortel, hospitalisation pour angor instable ou procédure de revascularisation artérielle.
La rosuvastatine a significativement réduit le risque d'événements CV majeurs (252 événements dans le groupe placebo contre 142 événements dans le groupe rosuvastatine) avec une réduction du risque relatif statistiquement significative (p
Figure 2 : Délai avant la première apparition d'événements cardiovasculaires majeurs dans JUPITER 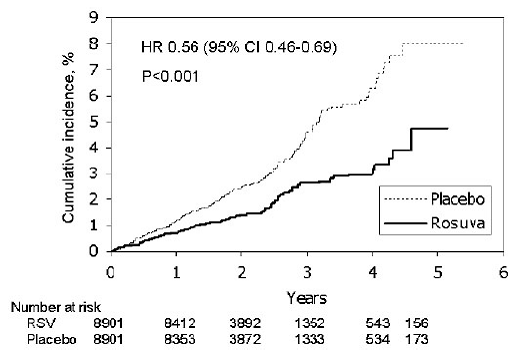
Les composants individuels du critère d'évaluation principal sont présentés à la figure 3. La rosuvastatine a significativement réduit le risque d'infarctus du myocarde non mortel, d'accident vasculaire cérébral non mortel et de procédures de revascularisation artérielle. Il n'y avait pas de différences de traitement significatives entre les groupes rosuvastatine et placebo pour les décès dus à des causes cardiovasculaires ou les hospitalisations pour angor instable.
La rosuvastatine a significativement réduit le risque d'infarctus du myocarde (6 événements mortels et 62 événements non mortels chez les sujets traités par placebo contre 9 événements mortels et 22 événements non mortels chez les sujets traités par la rosuvastatine) et le risque d'accident vasculaire cérébral (6 événements mortels et 58 événements non mortels chez les sujets traités par la rosuvastatine). sujets traités par placebo contre 3 événements mortels et 30 événements non mortels chez les sujets traités par la rosuvastatine).
Dans une analyse post-hoc de sous-groupes de sujets JUPITER (n=1405 ; rosuvastatine=725, placebo=680) avec une hsCRP ≥2 mg/L et aucun autre facteur de risque traditionnel (tabagisme, TA ≥140/90 ou prise d'antihypertenseurs, faible HDL-C) autre que l'âge, après ajustement pour un taux élevé de HDL-C, il n'y avait pas de bénéfice thérapeutique significatif avec le traitement par la rosuvastatine.
Figure 3 : Événements CV majeurs par groupe de traitement dans JUPITER 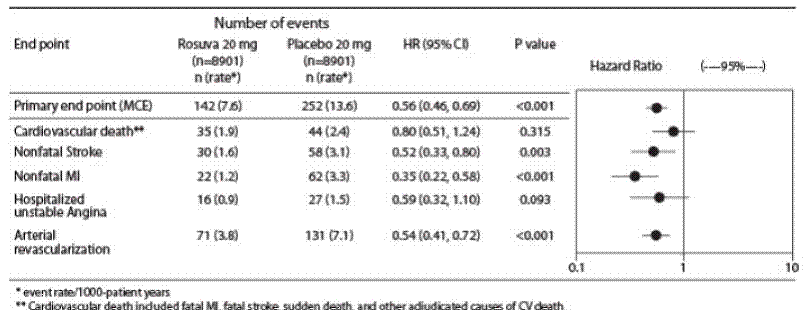
À un an, la rosuvastatine a augmenté le HDL-C et réduit le LDL-C, la hsCRP, le cholestérol total et les triglycérides sériques (p
INFORMATIONS PATIENTS
CRESTOR® (Kres-tor) Comprimés de rosuvastatine calcique
Lisez attentivement ces informations patient avant de commencer à prendre CRESTOR 20 mg et chaque fois que vous recevez une recharge. Si vous avez des questions sur CRESTOR, consultez votre médecin. Seul votre médecin peut déterminer si CRESTOR vous convient.
Qu'est-ce que CRESTOR ?
CRESTOR 20 mg est un médicament délivré sur ordonnance qui contient un médicament hypocholestérolémiant appelé rosuvastatine calcique. La majeure partie du cholestérol dans votre sang est fabriquée dans le foie. CRESTOR 20 mg agit en réduisant le cholestérol de deux manières : CRESTOR 5 mg bloque une enzyme dans le foie, ce qui fait que le foie produit moins de cholestérol, et CRESTOR 20 mg augmente l'absorption et la dégradation par le foie du cholestérol déjà présent dans le sang.
- CRESTOR est utilisé en complément d'un régime alimentaire pour :
- abaisser le niveau de votre « mauvais » cholestérol (LDL)
- augmenter le niveau de votre « bon » cholestérol (HDL)
- abaisser le taux de graisse dans votre sang (triglycérides)
- ralentir l'accumulation de dépôts graisseux (plaque) dans les parois des vaisseaux sanguins
- CRESTOR est utilisé pour traiter :
- les adultes qui ne peuvent pas contrôler leur taux de cholestérol uniquement par un régime alimentaire et de l'exercice
- enfants de 8 à 17 ans atteints d'hypercholestérolémie familiale hétérozygote (une maladie héréditaire qui provoque des taux élevés de LDL)
- les enfants de 7 à 17 ans atteints d'hypercholestérolémie familiale homozygote (une maladie héréditaire qui provoque des taux élevés de LDL).
CRESTOR 20 mg n'est pas approuvé pour une utilisation chez les enfants atteints d'hypercholestérolémie familiale hétérozygote de moins de 8 ans ou pour une utilisation chez les enfants atteints d'hypercholestérolémie familiale homozygote de moins de 7 ans.
CRESTOR 5 mg est utilisé pour réduire le risque de crises cardiaques et d'accidents vasculaires cérébraux chez les hommes de 50 ans et plus et les femmes de 60 ans et plus qui n'ont pas de maladie cardiaque connue mais qui présentent certains facteurs de risque supplémentaires.
On ne sait pas si CRESTOR 10 mg est sûr et efficace chez les personnes atteintes de dyslipidémie de Fredrickson de type I et V.
Qui ne devrait pas prendre CRESTOR ?
Ne prenez pas CRESTOR si vous :
- êtes allergique à la rosuvastatine calcique ou à l'un des ingrédients de CRESTOR. Voir la fin de cette notice pour la liste complète des ingrédients de CRESTOR.
- avoir des problèmes de foie.
- êtes enceinte ou pensez que vous pourriez être enceinte, ou envisagez de devenir enceinte. CRESTOR 20 mg peut nuire à votre bébé à naître. Si vous tombez enceinte, arrêtez de prendre CRESTOR et appelez immédiatement votre médecin. Si vous ne prévoyez pas de devenir enceinte, vous devez utiliser un moyen de contraception efficace pendant que vous prenez CRESTOR.
- allaitent. Des médicaments tels que CRESTOR 5 mg peuvent passer dans votre lait maternel et nuire à votre bébé.
Que dois-je dire à mon médecin avant et pendant la prise de CRESTOR ?
Informez votre médecin si vous :
- avez des douleurs ou une faiblesse musculaires inexpliquées
- avez ou avez eu des problèmes rénaux
- avez ou avez eu des problèmes de foie
- boire plus de 2 verres d'alcool par jour
- avoir des problèmes de thyroïde
- avez 65 ans ou plus
- sont d'origine asiatique
- êtes enceinte ou pensez que vous pourriez être enceinte, ou envisagez de devenir enceinte
- allaitent
Informez votre médecin de tous les médicaments que vous prenez, y compris les médicaments sur ordonnance et en vente libre, les vitamines et les suppléments à base de plantes.
Parlez-en à votre médecin avant de commencer à prendre de nouveaux médicaments.
La prise de CRESTOR 20 mg avec certains autres médicaments peut s'influencer mutuellement et provoquer des effets secondaires. CRESTOR peut affecter le mode d'action d'autres médicaments, et d'autres médicaments peuvent affecter le mode d'action de CRESTOR.
Prévenez surtout votre médecin si vous prenez :
- cyclosporine (un médicament pour votre système immunitaire)
- gemfibrozil (un médicament à base d'acide fibrique pour réduire le cholestérol)
- médicaments antiviraux, y compris les inhibiteurs de la protéase du VIH ou de l'hépatite C (tels que le lopinavir, le ritonavir, le fosamprénavir, le tipranavir, l'atazanavir ou le siméprévir)
- certains médicaments antifongiques (tels que l'itraconazole, le kétoconazole et le fluconazole)
- anticoagulants coumariniques (médicaments qui préviennent la formation de caillots sanguins, comme la warfarine)
- niacine ou acide nicotinique
- dérivés de l'acide fibrique (comme le fénofibrate)
- colchicine (un médicament utilisé pour traiter la goutte)
Demandez à votre médecin ou à votre pharmacien une liste de ces médicaments en cas de doute.
Connaissez tous les médicaments que vous prenez. Conservez-en une liste pour la montrer à votre médecin et à votre pharmacien lorsque vous recevez un nouveau médicament.
Comment dois-je prendre CRESTOR 10 mg ?
- Prenez CRESTOR exactement comme votre médecin vous l'a dit.
- Prenez CRESTOR, par voie orale, 1 fois par jour. Avalez le comprimé entier.
- CRESTOR peut être pris à tout moment de la journée, avec ou sans nourriture.
- Ne pas modifiez votre dose ou arrêtez CRESTOR 10 mg sans en parler à votre médecin, même si vous vous sentez bien.
- Votre médecin peut effectuer des tests sanguins pour vérifier votre taux de cholestérol avant et pendant votre traitement par CRESTOR. Votre médecin peut modifier votre dose de CRESTOR 10 mg si nécessaire.
- Votre médecin peut vous initier à un régime hypocholestérolémiant avant de vous donner CRESTOR. Continuez à suivre ce régime lorsque vous prenez CRESTOR.
- Attendez au moins 2 heures après la prise de CRESTOR pour prendre un antiacide qui contient une combinaison d'hydroxyde d'aluminium et de magnésium.
- Si vous manquez une dose de CRESTOR 10 mg, prenez-la dès que vous vous en souvenez. Cependant, ne pas prendre 2 doses de CRESTOR 10 mg à moins de 12 heures d'intervalle.
- Si vous avez pris trop de CRESTOR 20 mg ou un surdosage, appelez votre médecin ou rendez-vous immédiatement aux urgences de l'hôpital le plus proche.
Quels sont les effets secondaires possibles de CRESTOR 20mg ?
CRESTOR 10 mg peut provoquer des effets indésirables graves, notamment :
- Douleurs musculaires, sensibilité et faiblesse (myopathie). Les problèmes musculaires, y compris la dégradation musculaire, peuvent être graves chez certaines personnes et causent rarement des lésions rénales pouvant entraîner la mort. Informez immédiatement votre médecin si :
- vous avez des douleurs, une sensibilité ou une faiblesse musculaires inexpliquées, surtout si vous avez de la fièvre ou si vous vous sentez plus fatigué que d'habitude, pendant que vous prenez CRESTOR.
- vous avez des problèmes musculaires qui ne disparaissent pas même après que votre médecin vous a dit d'arrêter de prendre CRESTOR. Votre médecin peut faire d'autres tests pour diagnostiquer la cause de vos problèmes musculaires.
Vos chances d'avoir des problèmes musculaires sont plus élevées si vous :
- prenez certains autres médicaments pendant que vous prenez CRESTOR
- avez 65 ans ou plus
- avez des problèmes de thyroïde (hypothyroïdie) qui ne sont pas contrôlés
- avoir des problèmes rénaux
- prenez des doses plus élevées de CRESTOR
- Problèmes de foie. Votre médecin doit effectuer des tests sanguins pour vérifier votre foie avant que vous ne commenciez à prendre CRESTOR 5 mg et si vous présentez des symptômes de problèmes hépatiques pendant que vous prenez CRESTOR. Appelez immédiatement votre médecin si vous présentez l'un des symptômes suivants de problèmes de foie :
- se sentir anormalement fatigué ou faible
- perte d'appétit
- douleur dans le haut du ventre
- urine foncée
- jaunissement de votre peau ou du blanc de vos yeux
Les effets secondaires les plus courants peuvent inclure : maux de tête, douleurs musculaires, douleurs abdominales, faiblesse et nausées.
Les effets secondaires supplémentaires qui ont été signalés avec CRESTOR comprennent la perte de mémoire et la confusion.
Dites à votre médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de CRESTOR. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
Comment dois-je conserver CRESTOR 20 mg ?
- Conservez CRESTOR 10mg à température ambiante, entre 68°F et 77°F (20°C à 25°C) et dans un endroit sec.
- Jetez en toute sécurité les médicaments périmés ou dont vous n'avez plus besoin.
Gardez CRESTOR 10 mg et tous les médicaments hors de la portée des enfants.
Quels sont les ingrédients de CRESTOR ?
Ingrédient actif: rosuvastatine sous forme de rosuvastatine calcique
Ingrédients inactifs: cellulose microcristalline NF, lactose monohydraté NF, phosphate de calcium tribasique NF, crospovidone NF, stéarate de magnésium NF, hypromellose NF, triacétine NF, dioxyde de titane USP, oxyde de fer jaune et oxyde de fer rouge NF.
Informations générales sur l'utilisation sûre et efficace de CRESTOR
Les médicaments sont parfois prescrits à des fins autres que celles énumérées dans une notice d'information destinée aux patients. N'utilisez pas CRESTOR 10 mg pour une affection pour laquelle il n'a pas été prescrit. Ne donnez pas CRESTOR 20 mg à d'autres personnes, même si elles ont la même condition médicale que vous. Cela peut leur nuire.
Vous pouvez demander à votre pharmacien ou à votre médecin des informations sur CRESTOR 5 mg destinées aux professionnels de santé.
Ces informations patient ont été approuvées par la Food and Drug Administration des États-Unis Révisé 9/2018
