Zetia 10mg Ezetimibe Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Zetia et comment est-il utilisé ?
Zetia est un médicament d'ordonnance utilisé pour traiter les symptômes de l'hypercholestérolémie et pour réduire le cholestérol. Zetia peut être utilisé seul ou avec d'autres médicaments.
Zetia appartient à une classe de médicaments appelés agents hypolipémiants, 2-azétidinones.
On ne sait pas si Zetia 10 mg est sûr et efficace chez les enfants de moins de 10 ans.
Quels sont les effets secondaires possibles de Zetia ?
Zetia peut provoquer des effets secondaires graves, notamment :
- douleur musculaire,
- sensibilité ou faiblesse musculaire,
- fièvre,
- fatigue inhabituelle et
- urine de couleur foncée
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Zetia 10 mg incluent :
- douleurs musculaires ou articulaires,
- nez encombré,
- douleur des sinus,
- mal de gorge,
- diarrhée, et
- douleur dans un bras ou une jambe
Dites à votre médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Zetia. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
LA DESCRIPTION
ZETIA (ézétimibe) appartient à une classe de composés hypolipidémiants qui inhibent sélectivement l'absorption intestinale du cholestérol et des phytostérols apparentés. Le nom chimique de l'ézétimibe est 1-(4- fluorophényl)-3(R)-[3-(4-fluorophényl)-3(S)-hydroxypropyl]-4(S)-(4-hydroxyphényl)-2-azétidinone . La formule empirique est C24H21F2NO3. Son poids moléculaire est de 409,4 et sa formule structurale est :
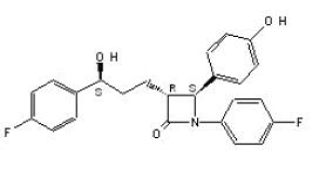
L'ézétimibe est une poudre cristalline blanche librement à très soluble dans l'éthanol, le méthanol et l'acétone et pratiquement insoluble dans l'eau. L'ézétimibe a un point de fusion d'environ 163°C et est stable à température ambiante. ZETIA 10 mg est disponible sous forme de comprimé pour administration orale contenant 10 mg d'ézétimibe et les ingrédients inactifs suivants : croscarmellose sodique NF, lactose monohydraté NF, stéarate de magnésium NF, cellulose microcristalline NF, povidone USP et laurylsulfate de sodium NF.
LES INDICATIONS
La thérapie avec des agents altérant les lipides ne devrait être qu'un élément de l'intervention sur les facteurs de risque multiples chez les personnes présentant un risque significativement accru de maladie vasculaire athéroscléreuse due à l'hypercholestérolémie. Le traitement médicamenteux est indiqué en complément d'un régime alimentaire lorsque la réponse à un régime restreint en graisses saturées et en cholestérol et à d'autres mesures non pharmacologiques seules a été inadéquate.
Hyperlipidémie primaire
Monothérapie
ZETIA®, administré seul, est indiqué comme traitement d'appoint au régime alimentaire pour la réduction des taux élevés de cholestérol total (C total), de cholestérol à lipoprotéines de basse densité (LDL-C), d'apolipoprotéine B (Apo B) et de cholestérol à lipoprotéines autres que de haute densité (non-HDL-C) chez les patients atteints d'hyperlipidémie primaire (hétérozygote familiale et non familiale).
Thérapie combinée avec les inhibiteurs de l'HMG-CoA réductase (statines)
ZETIA 10 mg, administré en association avec un inhibiteur de la 3-hydroxy-3-méthylglutaryl-coenzyme A (HMG-CoA) réductase (statine), est indiqué comme traitement adjuvant au régime alimentaire pour la réduction des taux élevés de C total, C-LDL, Apo B et non-HDL-C chez les patients atteints d'hyperlipidémie primaire (hétérozygote familiale et non familiale).
Thérapie combinée avec le fénofibrate
ZETIA 10 mg, administré en association avec le fénofibrate, est indiqué comme traitement adjuvant au régime alimentaire pour la réduction des taux élevés de C total, de LDL-C, d'Apo B et de non-HDL-C chez les patients adultes atteints d'hyperlipidémie mixte.
Hypercholestérolémie familiale homozygote (HoFH)
L'association de ZETIA 10 mg et d'atorvastatine ou de simvastatine est indiquée pour la réduction des taux élevés de C total et de LDL-C chez les patients atteints d'HFHo, en complément d'autres traitements hypolipidémiants (par exemple, aphérèse des LDL) ou si ces traitements ne sont pas disponibles .
Sitostérolémie homozygote
ZETIA 10 mg est indiqué comme traitement d'appoint au régime pour la réduction des taux élevés de sitostérol et de campestérol chez les patients atteints de sitostérolémie familiale homozygote.
Limites d'utilisation
L'effet de ZETIA sur la morbidité et la mortalité cardiovasculaires n'a pas été déterminé.
ZETIA n'a pas été étudié dans les dyslipidémies de Fredrickson de type I, III, IV et V.
DOSAGE ET ADMINISTRATION
Informations générales sur le dosage
La dose recommandée de ZETIA est de 10 mg une fois par jour.
ZETIA 10mg peut être administré avec ou sans nourriture.
Thérapie hypolipémiante concomitante
ZETIA 10 mg peut être administré avec une statine (chez les patients présentant une hyperlipidémie primaire) ou avec du fénofibrate (chez les patients présentant une hyperlipidémie mixte) pour un effet supplémentaire. Pour plus de commodité, la dose quotidienne de ZETIA peut être prise en même temps que la statine ou le fénofibrate, selon les recommandations posologiques des médicaments respectifs.
Coadminis avec séquestrants des acides biliaires
L'administration de ZETIA doit avoir lieu ≥ 2 heures avant ou ≥ 4 heures après l'administration d'un séquestrant des acides biliaires [voir INTERACTIONS MÉDICAMENTEUSES ].
Patients atteints d'insuffisance hépatique
Aucun ajustement posologique n'est nécessaire chez les patients présentant une insuffisance hépatique légère [voir AVERTISSEMENTS ET PRECAUTIONS ].
Patients atteints d'insuffisance rénale
Aucun ajustement posologique n'est nécessaire chez les insuffisants rénaux [voir PHARMACOLOGIE CLINIQUE ]. Lorsqu'elle est administrée avec la simvastatine chez des patients présentant une insuffisance rénale modérée à sévère (taux de filtration glomérulaire estimé Utilisation dans des populations spécifiques ].
Patients gériatriques
Aucun ajustement posologique n'est nécessaire chez les patients gériatriques [voir PHARMACOLOGIE CLINIQUE ].
COMMENT FOURNIE
Formes posologiques et points forts
Les comprimés de 10 mg sont des comprimés blancs à blanc cassé, en forme de capsule, portant l'inscription « 414 » gravée sur une face.
Stockage et manutention
N° 3861 - Comprimés ZETIA, 10 mg , sont des comprimés blancs à blanc cassé en forme de gélule portant l'inscription « 414 » gravée sur une face. Ils sont fournis comme suit :
CDN 66582-414-31 bouteilles de 30 CDN 66582-414-54 bouteilles de 90 CDN 66582-414-74 bouteilles de 500 CDN 66582-414-76 bouteilles de 5000 CDN 66582-414-28 doses unitaires de 100.
Stockage
Conserver à 25 °C (77 °F); excursions autorisées jusqu'à 15-30°C (59-86°F). [Voir Température ambiante contrôlée USP .] Protéger de l'humidité.
Merck Sharp & Dohme Corp., une filiale de MERCK & CO., INC., Whitehouse Station, NJ 08889, États-Unis. Révisé : août 2013
EFFETS SECONDAIRES
Les effets indésirables graves suivants sont discutés plus en détail dans d'autres sections de l'étiquette :
- Anomalies des enzymes hépatiques [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Rhabdomyolyse et myopathie [voir AVERTISSEMENTS ET PRECAUTIONS ]
Études sur la monothérapie
Dans la base de données des essais cliniques contrôlés ZETIA 10 mg (contrôlés par placebo) de 2396 patients avec une durée médiane de traitement de 12 semaines (intervalle de 0 à 39 semaines), 3,3 % des patients sous ZETIA 10 mg et 2,9 % des patients sous placebo ont arrêté en raison d'effets indésirables. réactions. Les effets indésirables les plus fréquents dans le groupe de patients traités par ZETIA 10 mg ayant conduit à l'arrêt du traitement et survenus à une fréquence supérieure au placebo ont été :
- Arthralgie (0,3 %)
- Vertiges (0,2 %)
- Augmentation de la gamma-glutamyltransférase (0,2 %)
Les effets indésirables les plus fréquemment rapportés (incidence ≥ 2 % et supérieure au placebo) dans la base de données des essais cliniques contrôlés ZETIA en monothérapie portant sur 2 396 patients étaient : infection des voies respiratoires supérieures (4,3 %), diarrhée (4,1 %), arthralgie (3,0 %), sinusite (2,8 %) et douleur aux extrémités (2,7 %).
Études de co-administration de statines
Dans la base de données des essais cliniques contrôlés ZETIA + statine de 11 308 patients avec une durée médiane de traitement de 8 semaines (intervalle de 0 à 112 semaines), 4,0 % des patients sous ZETIA + statine et 3,3 % des patients sous statine seule ont arrêté en raison d'effets indésirables. Les effets indésirables les plus fréquents dans le groupe de patients traités par ZETIA + statine ayant conduit à l'arrêt du traitement et survenus à une fréquence supérieure à la statine seule ont été :
- Augmentation de l'alanine aminotransférase (0,6 %)
- Myalgie (0,5 %)
- Fatigue, augmentation de l'aspartate aminotransférase, maux de tête et douleurs aux extrémités (chacun à 0,2 %)
Les effets indésirables les plus fréquemment rapportés (incidence ≥ 2 % et supérieure à la statine seule) dans la base de données des essais cliniques contrôlés ZETIA + statine de 11 308 patients étaient : rhinopharyngite (3,7 %), myalgie (3,2 %), infection des voies respiratoires supérieures (2,9 % ), arthralgie (2,6 %) et diarrhée (2,5 %).
Expérience des essais cliniques
Étant donné que les études cliniques sont menées dans des conditions très variables, les taux d'effets indésirables observés dans les études cliniques d'un médicament ne peuvent pas être directement comparés aux taux des études cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique clinique.
Monothérapie
Dans 10 essais cliniques en double aveugle contrôlés par placebo, 2 396 patients atteints d'hyperlipidémie primaire (tranche d'âge de 9 à 86 ans, 50 % de femmes, 90 % de Caucasiens, 5 % de Noirs, 3 % d'Hispaniques, 2 % d'Asiatiques) et un taux élevé de LDL-C ont été traités par ZETIA 10 mg/jour pendant une durée médiane de traitement de 12 semaines (intervalle de 0 à 39 semaines).
Les effets indésirables signalés chez ≥ 2 % des patients traités par ZETIA et à une incidence supérieure à celle du placebo dans les études contrôlées par placebo de ZETIA 10 mg, quelle que soit l'évaluation de la causalité, sont présentés dans le tableau 1.
TABLEAU 1 : Effets indésirables cliniques survenus chez ≥ 2 % des patients traités par ZETIA à 10 mg et à une incidence supérieure à celle du placebo, quelle qu'en soit la cause
La fréquence des effets indésirables moins fréquents était comparable entre ZETIA 10 mg et le placebo.
Association avec une statine
Dans 28 essais cliniques contrôlés en double aveugle (placebo ou contrôle actif), 11 308 patients atteints d'hyperlipidémie primaire (tranche d'âge 10-93 ans, 48 % de femmes, 85 % de race blanche, 7 % de Noirs, 4 % d'Hispaniques, 3 % d'Asiatiques) et un taux élevé de LDL-C ont été traités avec ZETIA 10 mg/jour en même temps ou en complément d'un traitement par statine en cours pendant une durée médiane de traitement de 8 semaines (intervalle de 0 à 112 semaines).
L'incidence d'augmentation consécutive des transaminases (≥3 × LSN) était plus élevée chez les patients recevant ZETIA 10 mg administré avec des statines (1,3 %) que chez les patients traités avec des statines seules (0,4 %). [Voir AVERTISSEMENTS ET PRECAUTIONS ]
Les effets indésirables cliniques signalés chez ≥ 2 % des patients traités par ZETIA + statine et à une incidence supérieure à la statine, quelle que soit l'évaluation de la causalité, sont présentés dans le tableau 2.
TABLEAU 2 : Effets indésirables cliniques survenus chez ≥ 2 % des patients traités par ZETIA 10 mg co-administré avec une statine et à une incidence supérieure à la statine, quelle qu'en soit la cause
Association avec le fénofibrate
Cette étude clinique portant sur 625 patients atteints de dyslipidémie mixte (tranche d'âge de 20 à 76 ans, 44 % de femmes, 79 % de Caucasiens, 0,1 % de Noirs, 11 % d'Hispaniques, 5 % d'Asiatiques) traités jusqu'à 12 semaines et 576 patients traités jusqu'à 48 semaines supplémentaires ont évalué l'administration concomitante de ZETIA et de fénofibrate. Cette étude n'a pas été conçue pour comparer des groupes de traitement pour des événements peu fréquents. Les taux d'incidence (IC à 95 %) pour les élévations cliniquement importantes (≥ 3 - LSN, consécutives) des taux de transaminases hépatiques étaient de 4,5 % (1,9, 8,8) et de 2,7 % (1,2, 5,4) pour le fénofibrate en monothérapie (n = 188) et ZETIA coadministré avec le fénofibrate (n = 183), respectivement, ajusté en fonction de l'exposition au traitement. Les taux d'incidence correspondants pour la cholécystectomie étaient de 0,6 % (IC à 95 % : 0,0 %, 3,1 %) et de 1,7 % (IC à 95 % : 0,6 %, 4,0 %) pour le fénofibrate en monothérapie et ZETIA 10 mg co-administré avec le fénofibrate, respectivement [voir INTERACTIONS MÉDICAMENTEUSES ]. Le nombre de patients exposés à un traitement co-administré ainsi qu'à une monothérapie par fénofibrate et ézétimibe était insuffisant pour évaluer le risque de maladie de la vésicule biliaire. Il n'y avait aucune élévation de CPK > 10 — LSN dans aucun des groupes de traitement.
Expérience post-commercialisation
Étant donné que les réactions ci-dessous sont signalées volontairement à partir d'une population de taille incertaine, il n'est généralement pas possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale avec l'exposition au médicament.
Les effets indésirables supplémentaires suivants ont été identifiés lors de l'utilisation post-approbation de ZETIA :
Réactions d'hypersensibilité, y compris anaphylaxie, œdème de Quincke, éruption cutanée et urticaire ; érythème polymorphe ; arthralgie; myalgie; créatine phosphokinase élevée; myopathie/rhabdomyolyse [voir AVERTISSEMENTS ET PRECAUTIONS ] ; élévations des transaminases hépatiques ; hépatite; douleur abdominale; thrombocytopénie; pancréatite; nausée; vertiges; paresthésie; la dépression; mal de tête; cholélithiase; cholécystite.
INTERACTIONS MÉDICAMENTEUSES
[Voir PHARMACOLOGIE CLINIQUE ]
Ciclosporine
La prudence s'impose lors de l'utilisation concomitante de ZETIA 10 mg et de cyclosporine en raison d'une exposition accrue à la fois à l'ézétimibe et à la cyclosporine. Les concentrations de cyclosporine doivent être surveillées chez les patients recevant ZETIA et de la cyclosporine.
Le degré d'augmentation de l'exposition à l'ézétimibe peut être plus important chez les patients présentant une insuffisance rénale sévère. Chez les patients traités par la ciclosporine, les effets potentiels d'une exposition accrue à l'ézétimibe lors d'une utilisation concomitante doivent être soigneusement pesés par rapport aux bénéfices des modifications des taux de lipides apportés par l'ézétimibe.
Fibrates
L'efficacité et la sécurité de la co-administration d'ézétimibe avec des fibrates autres que le fénofibrate n'ont pas été étudiées.
Les fibrates peuvent augmenter l'excrétion de cholestérol dans la bile, entraînant une lithiase biliaire. Dans une étude préclinique chez le chien, l'ézétimibe a augmenté le taux de cholestérol dans la bile de la vésicule biliaire [voir Toxicologie non clinique ]. L'administration concomitante de ZETIA avec des fibrates autres que le fénofibrate n'est pas recommandée tant que l'utilisation chez les patients n'a pas été suffisamment étudiée.
Fénofibrate
Si une lithiase biliaire est suspectée chez un patient recevant ZETIA 10 mg et du fénofibrate, des études de la vésicule biliaire sont indiquées et un autre traitement hypolipidémiant doit être envisagé [voir EFFETS INDÉSIRABLES et l'étiquetage du produit pour le fénofibrate].
Cholestyramine
L'administration concomitante de cholestyramine a diminué l'aire sous la courbe moyenne (ASC) de l'ézétimibe total d'environ 55 %. La réduction supplémentaire du LDL-C due à l'ajout d'ézétimibe à la cholestyramine peut être réduite par cette interaction.
Anticoagulants coumariniques
Si l'ézétimibe est ajouté à la warfarine, un anticoagulant coumarinique, le rapport international normalisé (INR) doit être surveillé de manière appropriée.
AVERTISSEMENTS
Inclus dans le cadre du PRÉCAUTIONS section.
PRÉCAUTIONS
Utiliser avec des statines ou du fénofibrate
L'administration concomitante de ZETIA avec une statine ou un fénofibrate spécifique doit être conforme à l'étiquetage du produit pour ce médicament.
Des enzymes hépatiques
Dans les études cliniques contrôlées en monothérapie, l'incidence des élévations consécutives (≥ 3 x la limite supérieure de la normale [LSN]) des taux de transaminases hépatiques était similaire entre ZETIA (0,5 %) et le placebo (0,3 %).
Dans des études cliniques contrôlées d'association de ZETIA 10 mg initiées en même temps qu'une statine, l'incidence des élévations consécutives (≥ 3 x LSN) des taux de transaminases hépatiques était de 1,3 % pour les patients traités par ZETIA administré avec des statines et de 0,4 % pour les patients traités avec des statines seules. Ces élévations des transaminases étaient généralement asymptomatiques, non associées à une cholestase et sont revenues aux valeurs initiales après l'arrêt du traitement ou avec la poursuite du traitement. Lorsque ZETIA est co-administré avec une statine, des tests hépatiques doivent être effectués au début du traitement et selon les recommandations de la statine. Si une augmentation de l'ALT ou de l'AST ≥ 3 x LSN persiste, envisager le retrait de ZETIA 10 mg et/ou de la statine.
Myopathie/Rhabdomyolyse
Dans les essais cliniques, il n'y a pas eu d'excès de myopathie ou de rhabdomyolyse associée à ZETIA 10 mg par rapport au bras contrôle concerné (placebo ou statine seule). Cependant, la myopathie et la rhabdomyolyse sont des effets indésirables connus des statines et d'autres médicaments hypolipémiants. Dans les essais cliniques, l'incidence de la créatine phosphokinase (CPK) > 10 x LSN était de 0,2 % pour ZETIA contre 0,1 % pour le placebo et de 0,1 % pour ZETIA co-administré avec une statine contre 0,4 % pour les statines seules. Le risque de toxicité musculaire squelettique augmente avec des doses plus élevées de statine, un âge avancé (> 65 ans), une hypothyroïdie, une insuffisance rénale et, selon la statine utilisée, l'utilisation concomitante d'autres médicaments.
Depuis la commercialisation de ZETIA, des cas de myopathie et de rhabdomyolyse ont été rapportés. La plupart des patients qui ont développé une rhabdomyolyse prenaient une statine avant de commencer ZETIA. Cependant, une rhabdomyolyse a été rapportée avec ZETIA 10 mg en monothérapie et avec l'ajout de ZETIA 10 mg à des agents connus pour être associés à un risque accru de rhabdomyolyse, tels que les fibrates. ZETIA et toute statine ou fibrate que le patient prend simultanément doivent être immédiatement arrêtés si une myopathie est diagnostiquée ou suspectée. La présence de symptômes musculaires et d'un taux de CPK > 10 x la LSN indique une myopathie.
Insuffisance hépatique
En raison des effets inconnus de l'augmentation de l'exposition à l'ézétimibe chez les patients présentant une insuffisance hépatique modérée à sévère, ZETIA n'est pas recommandé chez ces patients. [Voir PHARMACOLOGIE CLINIQUE ]
Informations sur les conseils aux patients
Voir Étiquetage du patient approuvé par la FDA (INFORMATION DU PATIENT).
Les patients doivent être informés qu'ils doivent suivre le régime alimentaire recommandé par leur programme national d'éducation sur le cholestérol (NCEP), un programme d'exercices réguliers et des tests périodiques d'un bilan lipidique à jeun.
Douleur musculaire
Tous les patients commençant un traitement par l'ézétimibe doivent être informés du risque de myopathie et doivent signaler rapidement toute douleur, sensibilité ou faiblesse musculaire inexpliquée. Le risque que cela se produise est accru lors de la prise de certains types de médicaments. Les patients doivent discuter de tous les médicaments, qu'ils soient sur ordonnance ou en vente libre, avec leur médecin.
Des enzymes hépatiques
Des tests hépatiques doivent être effectués lorsque ZETIA 10 mg est ajouté au traitement par statine et conformément aux recommandations relatives aux statines.
Grossesse
Il convient de conseiller aux femmes en âge de procréer d'utiliser une méthode de contraception efficace pour prévenir une grossesse pendant l'utilisation de ZETIA en association avec un traitement par statine. Discutez de vos futurs plans de grossesse avec vos patientes et discutez du moment où elles doivent arrêter l'association ZETIA 10 mg et le traitement par statine si elles essaient de concevoir. Les patientes doivent être informées qu'en cas de grossesse, elles doivent arrêter de prendre l'association ZETIA 10 mg et une statine et appeler leur professionnel de la santé.
Allaitement maternel
Les femmes qui allaitent doivent être avisées de ne pas utiliser ZETIA en association avec un traitement par statine. Les patientes qui ont un trouble lipidique et qui allaitent doivent être avisées de discuter des options avec leurs professionnels de la santé.
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Une étude de cancérogénicité alimentaire de 104 semaines avec l'ézétimibe a été menée chez des rats à des doses allant jusqu'à 1 500 mg/kg/jour (mâles) et 500 mg/kg/jour (femelles) (~20 x l'exposition humaine à 10 mg par jour sur la base de l'ASC0 -24h pour l'ézétimibe total). Une étude de cancérogénicité alimentaire de 104 semaines avec l'ézétimibe a également été menée chez la souris à des doses allant jusqu'à 500 mg/kg/jour (> 150 x l'exposition humaine à 10 mg par jour sur la base de l'ASC0-24 h pour l'ézétimibe total). Il n'y a pas eu d'augmentation statistiquement significative de l'incidence des tumeurs chez les rats ou les souris traités avec le médicament.
Aucun signe de mutagénicité n'a été observé in vitro dans un test de mutagénicité microbienne (Ames) avec Salmonella typhimurium et Escherichia coli avec ou sans activation métabolique. Aucun signe de clastogénicité n'a été observé in vitro lors d'un test d'aberration chromosomique sur des lymphocytes du sang périphérique humain avec ou sans activation métabolique. De plus, il n'y avait aucune preuve de génotoxicité dans le test in vivo du micronoyau chez la souris.
Dans les études de fertilité par voie orale (gavage) sur l'ézétimibe menées chez le rat, il n'y a eu aucun signe de toxicité pour la reproduction à des doses allant jusqu'à 1 000 mg/kg/jour chez le rat mâle ou femelle (~7 x l'exposition humaine à 10 mg par jour sur la base de l'ASC0- 24h pour l'ézétimibe total).
Utilisation dans des populations spécifiques
Grossesse
Catégorie de grossesse C
Il n'y a pas d'études adéquates et bien contrôlées sur l'ézétimibe chez la femme enceinte. L'ézétimibe ne doit être utilisé pendant la grossesse que si le bénéfice potentiel justifie le risque pour le fœtus.
Dans les études orales (gavage) sur le développement embryo-fœtal de l'ézétimibe menées chez le rat et le lapin au cours de l'organogenèse, il n'y a eu aucune preuve d'effets embryolétaux aux doses testées (250, 500, 1000 mg/kg/jour). Chez le rat, des incidences accrues d'anomalies squelettiques fœtales courantes (paire supplémentaire de côtes thoraciques, centre vertébral cervical non ossifié, côtes raccourcies) ont été observées à 1 000 mg/kg/jour (environ 10 x l'exposition humaine à 10 mg par jour sur la base de l'ASC0-24 heures pour l'ézétimibe total). Chez les lapins traités par l'ézétimibe, une incidence accrue de côtes extrathoraciques a été observée à 1000 mg/kg/jour (150 x l'exposition humaine à 10 mg par jour sur la base de l'ASC0-24h pour l'ézétimibe total). L'ézétimibe a traversé le placenta lorsque des rats et lapins gravides ont reçu plusieurs doses orales.
Des études à doses multiples d'ézétimibe administré en association avec des statines chez le rat et le lapin au cours de l'organogenèse ont entraîné des expositions plus élevées à l'ézétimibe et aux statines. Les effets sur la reproduction surviennent à des doses plus faibles dans le traitement combiné par rapport à la monothérapie.
Toutes les statines sont contre-indiquées chez les femmes enceintes et allaitantes. Lorsque ZETIA 10 mg est administré avec une statine chez une femme en âge de procréer, se référer à la catégorie de grossesse et à l'étiquetage du produit pour la statine. [Voir CONTRE-INDICATIONS]
Mères allaitantes
On ne sait pas si l'ézétimibe est excrété dans le lait maternel humain. Dans les études chez le rat, l'exposition à l'ézétimibe total chez les petits allaités était jusqu'à la moitié de celle observée dans le plasma maternel. Étant donné que de nombreux médicaments sont excrétés dans le lait maternel, la prudence s'impose lorsque ZETIA 10 mg est administré à une femme qui allaite. ZETIA ne doit pas être utilisé chez les mères qui allaitent à moins que le bénéfice potentiel ne justifie le risque potentiel pour le nourrisson.
Utilisation pédiatrique
Les effets de ZETIA co-administré avec la simvastatine (n = 126) par rapport à la monothérapie par la simvastatine (n = 122) ont été évalués chez des garçons et des filles adolescents atteints d'hypercholestérolémie familiale hétérozygote (HeFH). Dans une étude multicentrique, en double aveugle, contrôlée suivie d'une phase ouverte, 142 garçons et 106 filles postménarchiques, âgés de 10 à 17 ans (âge moyen 14,2 ans, 43 % de femmes, 82 % de Caucasiens, 4 % d'Asiatiques, 2 % de Noirs , 13 % multiraciale) avec HeFH ont été randomisés pour recevoir soit ZETIA 10 mg co-administré avec la simvastatine, soit la simvastatine en monothérapie. L'inclusion dans l'étude nécessitait 1) un niveau de base de LDL-C entre 160 et 400 mg/dL et 2) des antécédents médicaux et une présentation clinique compatibles avec l'HeFH. La valeur initiale moyenne de LDL-C était de 225 mg/dL (intervalle : 161-351 mg/dL) dans le groupe ZETIA 10 mg co-administré avec la simvastatine, contre 219 mg/dL (intervalle : 149-336 mg/dL) dans le groupe simvastatine en monothérapie. groupe. Les patients ont reçu ZETIA et simvastatine (10 mg, 20 mg ou 40 mg) ou simvastatine en monothérapie (10 mg, 20 mg ou 40 mg) pendant 6 semaines, ZETIA et simvastatine 40 mg ou simvastatine 40 mg en monothérapie pendant les 27 semaines suivantes, et co-administré en ouvert ZETIA et simvastatine (10 mg, 20 mg ou 40 mg) pendant 20 semaines par la suite.
Les résultats de l'étude à la semaine 6 sont résumés dans le tableau 3. Les résultats à la semaine 33 étaient cohérents avec ceux de la semaine 6.
TABLEAU 3 : Différence moyenne en pourcentage à la semaine 6 entre le groupe ZETIA 10 mg combiné co-administré avec la simvastatine et le groupe regroupé en monothérapie à la simvastatine chez les patients adolescents atteints d'hypercholestérolémie familiale hétérozygote
Du début de l'essai à la fin de la semaine 33, des arrêts dus à un effet indésirable sont survenus chez 7 (6 %) patients du groupe ZETIA co-administré avec la simvastatine et chez 2 (2 %) patients du groupe simvastatine en monothérapie.
Au cours de l'essai, des élévations des transaminases hépatiques (deux mesures consécutives pour ALT et/ou AST ≥ 3 x LSN) sont survenues chez quatre (3 %) personnes du groupe ZETIA 10 mg co-administré avec la simvastatine et chez deux (2 %) personnes du groupe simvastatine en monothérapie groupe. Des élévations de CPK (≥ 10 x LSN) sont survenues chez deux (2 %) individus du groupe ZETIA co-administré avec la simvastatine et chez aucun individu du groupe simvastatine en monothérapie.
Dans cette étude contrôlée limitée, il n'y avait aucun effet significatif sur la croissance ou la maturation sexuelle chez les adolescents ou les adolescentes, ou sur la durée du cycle menstruel chez les filles.
L'administration concomitante de ZETIA 10 mg avec la simvastatine à des doses supérieures à 40 mg/jour n'a pas été étudiée chez les adolescents. De plus, ZETIA 10 mg n'a pas été étudié chez les patients de moins de 10 ans ou chez les filles préménarchées.
Sur la base de l'ézétimibe total (ézétimibe + ézétimibe-glucuronide), il n'y a pas de différences pharmacocinétiques entre les adolescents et les adultes. Les données pharmacocinétiques dans la population pédiatrique
Utilisation gériatrique
Études sur la monothérapie
Sur les 2396 patients qui ont reçu ZETIA 10 mg dans les études cliniques, 669 (28 %) avaient 65 ans et plus et 111 (5 %) avaient 75 ans et plus.
Études de co-administration de statines
Sur les 11 308 patients qui ont reçu ZETIA + statine dans les études cliniques, 3 587 (32 %) avaient 65 ans et plus et 924 (8 %) avaient 75 ans et plus.
Aucune différence globale d'innocuité et d'efficacité n'a été observée entre ces patients et les patients plus jeunes, et d'autres expériences cliniques rapportées n'ont pas identifié de différences dans les réponses entre les patients âgés et les patients plus jeunes, mais une plus grande sensibilité de certains individus plus âgés ne peut être exclue [voir PHARMACOLOGIE CLINIQUE ].
Insuffisance rénale
Lorsqu'il est utilisé en monothérapie, aucun ajustement posologique de ZETIA 10 mg n'est nécessaire.
Dans l'essai Study of Heart and Renal Protection (SHARP) portant sur 9 270 patients atteints d'insuffisance rénale modérée à sévère (6 247 patients non dialysés avec une créatinine sérique médiane de 2,5 mg/dL et un taux de filtration glomérulaire médian estimé de 25,6 mL/min/1,73 m², et 3023 patients dialysés), l'incidence des événements indésirables graves, des événements indésirables entraînant l'arrêt du traitement à l'étude ou des événements indésirables d'intérêt particulier (événements indésirables musculo-squelettiques, anomalies des enzymes hépatiques, cancer incident) était similaire entre les patients ayant déjà reçu 10 mg d'ézétimibe plus simvastatine 20 mg (n=4650) ou placebo (n=4620) pendant un suivi médian de 4,9 ans. Cependant, l'insuffisance rénale étant un facteur de risque de myopathie associée aux statines, les doses de simvastatine supérieures à 20 mg doivent être utilisées avec prudence et sous surveillance étroite lorsqu'elles sont administrées en concomitance avec ZETIA chez les patients présentant une insuffisance rénale modérée à sévère.
Insuffisance hépatique
ZETIA n'est pas recommandé chez les patients présentant une insuffisance hépatique modérée à sévère [voir AVERTISSEMENTS ET PRECAUTIONS et PHARMACOLOGIE CLINIQUE ].
ZETIA 10 mg administré en concomitance avec une statine est contre-indiqué chez les patients présentant une maladie hépatique active ou des élévations persistantes inexpliquées des taux de transaminases hépatiques [voir CONTRE-INDICATIONS ; AVERTISSEMENTS ET PRECAUTIONS et PHARMACOLOGIE CLINIQUE ].
SURDOSAGE
Dans les études cliniques, administration d'ézétimibe, 50 mg/jour à 15 sujets sains pendant jusqu'à 14 jours, 40 mg/jour à 18 patients atteints d'hyperlipidémie primaire pendant jusqu'à 56 jours et 40 mg/jour à 27 patients atteints de sitostérolémie homozygote pendant 26 semaines a été généralement bien toléré. Une patiente atteinte de sitostérolémie homozygote a pris une surdose accidentelle d'ézétimibe 120 mg/jour pendant 28 jours sans qu'aucun effet indésirable clinique ou biologique n'ait été signalé.
En cas de surdosage, des mesures symptomatiques et de soutien doivent être prises.
CONTRE-INDICATIONS
ZETIA est contre-indiqué dans les conditions suivantes :
- L'association de ZETIA 10 mg avec une statine est contre-indiquée chez les patients présentant une maladie hépatique active ou des élévations persistantes inexpliquées des taux de transaminases hépatiques.
- Les femmes enceintes ou susceptibles de le devenir. Étant donné que les statines diminuent la synthèse du cholestérol et éventuellement la synthèse d'autres substances biologiquement actives dérivées du cholestérol, ZETIA en association avec une statine peut nuire au fœtus lorsqu'il est administré à des femmes enceintes. De plus, il n'y a aucun avantage apparent au traitement pendant la grossesse et la sécurité chez les femmes enceintes n'a pas été établie. Si la patiente tombe enceinte pendant qu'elle prend ce médicament, elle doit être informée du risque potentiel pour le fœtus et de l'absence de bénéfice clinique connu en cas d'utilisation continue pendant la grossesse. [Voir Utilisation dans des populations spécifiques ]
- Les mères allaitantes. Étant donné que les statines peuvent passer dans le lait maternel et que les statines sont susceptibles de provoquer des effets indésirables graves chez les nourrissons, les femmes qui nécessitent un traitement par ZETIA en association avec une statine doivent être averties de ne pas allaiter leurs nourrissons [voir Utilisation dans des populations spécifiques ].
- Patients présentant une hypersensibilité connue à l'un des composants de ce produit. Des réactions d'hypersensibilité, notamment anaphylaxie, œdème de Quincke, éruption cutanée et urticaire, ont été signalées avec ZETIA [voir EFFETS INDÉSIRABLES ].
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
L'ézétimibe réduit le cholestérol sanguin en inhibant l'absorption du cholestérol par l'intestin grêle. Dans une étude clinique de 2 semaines chez 18 patients hypercholestérolémiques, ZETIA 10 mg a inhibé l'absorption intestinale du cholestérol de 54 %, par rapport au placebo. ZETIA n'a eu aucun effet cliniquement significatif sur les concentrations plasmatiques des vitamines liposolubles A, D et E (dans une étude portant sur 113 patients) et n'a pas altéré la production d'hormones stéroïdes corticosurrénaliennes (dans une étude portant sur 118 patients).
La teneur en cholestérol du foie provient principalement de trois sources. Le foie peut synthétiser le cholestérol, absorber le cholestérol du sang à partir des lipoprotéines circulantes ou absorber le cholestérol absorbé par l'intestin grêle. Le cholestérol intestinal provient principalement du cholestérol sécrété dans la bile et du cholestérol alimentaire.
L'ézétimibe a un mécanisme d'action qui diffère de ceux des autres classes de composés hypocholestérolémiants (statines, séquestrants des acides biliaires [résines], dérivés de l'acide fibrique et stanols végétaux). Il a été démontré que la cible moléculaire de l'ézétimibe est le transporteur de stérols, Niemann-Pick C1-Like 1 (NPC1L1), qui est impliqué dans l'absorption intestinale du cholestérol et des phytostérols.
L'ézétimibe n'inhibe pas la synthèse du cholestérol dans le foie et n'augmente pas l'excrétion des acides biliaires. Au lieu de cela, l'ézétimibe se localise à la bordure en brosse de l'intestin grêle et inhibe l'absorption du cholestérol, entraînant une diminution de l'apport de cholestérol intestinal au foie. Cela provoque une réduction des réserves hépatiques de cholestérol et une augmentation de la clairance du cholestérol dans le sang ; ce mécanisme distinct est complémentaire de celui des statines et du fénofibrate [voir Etudes cliniques ].
Pharmacodynamie
Des études cliniques ont démontré que des niveaux élevés de C total, de LDL-C et d'Apo B, le principal constituant protéique des LDL, favorisent l'athérosclérose humaine. De plus, une diminution des niveaux de HDL-C est associée au développement de l'athérosclérose. Des études épidémiologiques ont établi que la morbi-mortalité cardiovasculaire varie directement avec le taux de C total et de LDL-C et inversement avec le taux de HDL-C. Comme les LDL, les lipoprotéines riches en triglycérides enrichies en cholestérol, y compris les lipoprotéines de très basse densité (VLDL), les lipoprotéines de densité intermédiaire (IDL) et les restes, peuvent également favoriser l'athérosclérose. L'effet indépendant de l'augmentation du HDL-C ou de la diminution des TG sur le risque de morbidité et de mortalité coronariennes et cardiovasculaires n'a pas été déterminé.
ZETIA réduit le C total, le LDL-C, l'Apo B, le non-HDL-C et les TG, et augmente le HDL-C chez les patients atteints d'hyperlipidémie. L'administration de ZETIA 10 mg avec une statine est efficace pour améliorer le C total sérique, le LDL-C, l'Apo B, le non-HDL-C, le TG et le HDL-C au-delà de l'un ou l'autre traitement seul. L'administration de ZETIA 10 mg avec du fénofibrate est efficace pour améliorer le C total sérique, le LDL-C, l'Apo B et le non-HDL-C chez les patients atteints d'hyperlipidémie mixte par rapport à l'un ou l'autre traitement seul. Les effets de l'ézétimibe administré seul ou en association avec une statine ou le fénofibrate sur la morbi-mortalité cardiovasculaire n'ont pas été établis.
Pharmacocinétique
Absorption
Après administration orale, l'ézétimibe est absorbé et largement conjugué à un glucuronide phénolique pharmacologiquement actif (ézétimibe-glucuronide). Après une dose unique de 10 mg de ZETIA 10 mg chez des adultes à jeun, des concentrations plasmatiques maximales moyennes d'ézétimibe (Cmax) de 3,4 à 5,5 ng/mL ont été atteintes en 4 à 12 heures (Tmax). Des valeurs moyennes de Cmax d'ézétimibe-glucuronide de 45 à 71 ng/mL ont été atteintes entre 1 et 2 heures (Tmax). Il n'y avait pas d'écart substantiel par rapport à la proportionnalité de la dose entre 5 et 20 mg. La biodisponibilité absolue de l'ézétimibe ne peut être déterminée, car le composé est pratiquement insoluble dans les milieux aqueux adaptés à l'injection.
Effet de la nourriture sur l'absorption orale
L'administration concomitante d'aliments (repas riches en matières grasses ou sans matières grasses) n'a eu aucun effet sur le degré d'absorption de l'ézétimibe lorsqu'il était administré sous forme de comprimés de ZETIA à 10 mg. La valeur C de l'ézétimibe a augmenté de 38 % avec la consommation de repas riches en graisses. ZETIA peut être administré avec ou sans nourriture.
Distribution
L'ézétimibe et l'ézétimibe-glucuronide sont fortement liés (> 90 %) aux protéines plasmatiques humaines.
Métabolisme et excrétion
L'ézétimibe est principalement métabolisé dans l'intestin grêle et le foie par conjugaison de glucuronide (une réaction de phase II) avec excrétion biliaire et rénale ultérieure. Un métabolisme oxydatif minimal (une réaction de phase I) a été observé chez toutes les espèces évaluées.
Chez l'homme, l'ézétimibe est rapidement métabolisé en ézétimibe-glucuronide. L'ézétimibe et l'ézétimibéglucuronide sont les principaux composés dérivés du médicament détectés dans le plasma, constituant respectivement environ 10 à 20 % et 80 à 90 % du médicament total dans le plasma. L'ézétimibe et l'ézétimibe-glucuronide sont éliminés du plasma avec une demi-vie d'environ 22 heures pour l'ézétimibe et l'ézétimibe-glucuronide. Les profils concentration plasmatique-temps présentent plusieurs pics, suggérant un recyclage entérohépatique.
Après administration orale de 14C-ézétimibe (20 mg) à des sujets humains, l'ézétimibe total (ézétimibe + ézétimibe-glucuronide) représentait environ 93 % de la radioactivité totale dans le plasma. Après 48 heures, il n'y avait aucun niveau détectable de radioactivité dans le plasma.
Environ 78 % et 11 % de la radioactivité administrée ont été récupérés dans les fèces et l'urine, respectivement, sur une période de collecte de 10 jours. L'ézétimibe était le composant principal dans les fèces et représentait 69 % de la dose administrée, tandis que l'ézétimibe-glucuronide était le composant principal dans l'urine et représentait 9 % de la dose administrée.
Populations spécifiques
Patients gériatriques : Dans une étude à doses multiples d'ézétimibe administré 10 mg une fois par jour pendant 10 jours, les concentrations plasmatiques d'ézétimibe total étaient environ 2 fois plus élevées chez les sujets sains âgés (≥ 65 ans) que chez les sujets plus jeunes.
Patients pédiatriques : [Voir Utilisation dans des populations spécifiques ]
Le genre: Dans une étude à doses multiples d'ézétimibe administré 10 mg une fois par jour pendant 10 jours, les concentrations plasmatiques d'ézétimibe total étaient légèrement plus élevées (
Course: D'après une méta-analyse d'études pharmacocinétiques à doses multiples, il n'y a pas eu de différences pharmacocinétiques entre les sujets noirs et caucasiens. Des études chez des sujets asiatiques ont indiqué que la pharmacocinétique de l'ézétimibe était similaire à celle observée chez des sujets caucasiens.
Insuffisance hépatique : Après une dose unique de 10 mg d'ézétimibe, l'ASC moyenne de l'ézétimibe total a été augmentée d'environ 1,7 fois chez les patients atteints d'insuffisance hépatique légère (score de Child-Pugh de 5 à 6), par rapport aux sujets sains. Les valeurs moyennes de l'ASC pour l'ézétimibe total et l'ézétimibe ont été augmentées d'environ 3 à 4 fois et 5 à 6 fois, respectivement, chez les patients atteints d'insuffisance hépatique modérée (score de Child-Pugh de 7 à 9) ou sévère (score de Child-Pugh 10 à 15). Dans une étude à doses multiples de 14 jours (10 mg par jour) chez des patients atteints d'insuffisance hépatique modérée, les valeurs moyennes de l'ASC de l'ézétimibe total et de l'ézétimibe ont été multipliées par environ 4 le jour 1 et le jour 14 par rapport aux sujets sains. En raison des effets inconnus de l'exposition accrue à l'ézétimibe chez les patients présentant une insuffisance hépatique modérée ou sévère, ZETIA n'est pas recommandé chez ces patients [voir AVERTISSEMENTS ET PRECAUTIONS ].
Insuffisance rénale: Après une dose unique de 10 mg d'ézétimibe chez des patients atteints d'insuffisance rénale sévère (n = 8 ; ClCr moyenne ≥ 30 mL/min/1,73 m²), les valeurs moyennes de l'ASC pour l'ézétimibe total, l'ézétimibe-glucuronide et l'ézétimibe ont augmenté d'environ 1,5 - fois par rapport aux sujets sains (n=9).
Interactions médicamenteuses
[Voir également INTERACTIONS MÉDICAMENTEUSES ]
ZETIA 10 mg n'a eu aucun effet significatif sur une série de médicaments sondes (caféine, dextrométhorphane, tolbutamide et midazolam IV) connus pour être métabolisés par le cytochrome P450 (1A2, 2D6, 2C8/9 et 3A4) dans une étude « cocktail » de douze sujets sains. mâles adultes. Cela indique que l'ézétimibe n'est ni un inhibiteur ni un inducteur de ces isozymes du cytochrome P450, et il est peu probable que l'ézétimibe affecte le métabolisme des médicaments qui sont métabolisés par ces enzymes.
TABLEAU 4 : Effet des médicaments coadministrés sur l'ézétimibe total
TABLEAU 5 : Effet de la co-administration d'ézétimibe sur l'exposition systémique à d'autres médicaments
Toxicologie animale et/ou pharmacologie
L'effet hypocholestérolémiant de l'ézétimibe a été évalué chez des singes rhésus, des chiens, des rats et des souris modèles du métabolisme du cholestérol humain nourris au cholestérol. L'ézétimibe s'est avéré avoir une valeur de DE50 de 0,5 μg/kg/jour pour inhiber l'augmentation du taux de cholestérol plasmatique chez les singes. Les valeurs de DE50 chez le chien, le rat et la souris étaient respectivement de 7, 30 et 700 μg/kg/jour. Ces résultats sont cohérents avec le fait que ZETIA est un puissant inhibiteur de l'absorption du cholestérol.
Dans un modèle de rat, où le métabolite glucuronide de l'ézétimibe (SCH 60663) a été administré par voie intraduodénale, le métabolite était aussi puissant que le composé parent (SCH 58235) pour inhiber l'absorption du cholestérol, suggérant que le métabolite glucuronide avait une activité similaire à celle du composé parent. médicament.
Dans des études d'un mois chez des chiens ayant reçu de l'ézétimibe (0,03 à 300 mg/kg/jour), la concentration de cholestérol dans la bile de la vésicule biliaire a augmenté d'environ 2 à 4 fois. Cependant, une dose de 300 mg/kg/jour administrée à des chiens pendant un an n'a pas entraîné la formation de calculs biliaires ni aucun autre effet hépatobiliaire indésirable. Dans une étude de 14 jours chez des souris ayant reçu de l'ézétimibe (0,3 à 5 mg/kg/jour) et ayant suivi un régime pauvre en graisses ou riche en cholestérol, la concentration de cholestérol dans la bile de la vésicule biliaire était soit inchangée, soit réduite à des niveaux normaux, respectivement.
Une série d'études précliniques aiguës a été réalisée pour déterminer la sélectivité de ZETIA pour inhiber l'absorption du cholestérol. L'ézétimibe a inhibé l'absorption du 14C-cholestérol sans effet sur l'absorption des triglycérides, des acides gras, des acides biliaires, de la progestérone, de l'éthinylestradiol ou des vitamines liposolubles A et D.
Dans des études de toxicité de 4 à 12 semaines chez la souris, l'ézétimibe n'a pas induit d'enzymes métabolisant le médicament du cytochrome P450. Dans les études de toxicité, une interaction pharmacocinétique de l'ézétimibe avec les statines (parents ou leurs métabolites hydroxyacides actifs) a été observée chez le rat, le chien et le lapin.
Etudes cliniques
Hyperlipidémie primaire
ZETIA 10 mg réduit le C total, le LDL-C, l'Apo B, le non-HDL-C et les TG, et augmente le HDL-C chez les patients atteints d'hyperlipidémie. La réponse maximale à presque maximale est généralement obtenue en 2 semaines et maintenue pendant le traitement chronique.
Monothérapie
Dans deux études multicentriques, en double aveugle, contrôlées par placebo, de 12 semaines chez 1719 patients atteints d'hyperlipidémie primaire, ZETIA a considérablement réduit le C total, le LDL-C, l'Apo B, le non-HDL-C et le TG, et a augmenté le HDL- C par rapport au placebo (voir Tableau 6). La réduction du LDL-C était constante quel que soit l'âge, le sexe et le LDL-C initial.
TABLEAU 6 : Réponse à ZETIA à 10 mg chez les patients atteints d'hyperlipidémie primaire (% moyen de changement par rapport à la ligne de base non traitée†)
Association avec des statines
ZETIA 10 mg ajouté au traitement par statine en cours
Dans une étude multicentrique, en double aveugle, contrôlée par placebo, de 8 semaines, 769 patients atteints d'hyperlipidémie primaire, de maladie coronarienne connue ou de facteurs de risque cardiovasculaire multiples qui recevaient déjà une monothérapie par statine, mais qui n'avaient pas atteint leur cible NCEP ATP II LDL -C objectif ont été randomisés pour recevoir soit ZETIA 10 mg ou un placebo en plus de leur statine en cours.
ZETIA 10 mg, ajouté à un traitement par statine en cours, a considérablement réduit le C total, le LDL-C, l'Apo B, le non-HDL-C et les TG, et a augmenté le HDL-C par rapport à une statine administrée seule (voir tableau 7). Les réductions de LDL-C induites par ZETIA 10 mg étaient généralement constantes pour toutes les statines.
TABLEAU 7 : Réponse à l'ajout de ZETIA à 10 mg au traitement par statine en cours chez les patients atteints d'hyperlipidémie (moyenne en % de changement par rapport à la ligne de base traitée‡)
ZETIA initié en même temps qu'une statine
Dans quatre essais multicentriques, en double aveugle, contrôlés par placebo, d'une durée de 12 semaines, chez 2382 patients hyperlipidémiques, ZETIA ou un placebo a été administré seul ou avec diverses doses d'atorvastatine, de simvastatine, de pravastatine ou de lovastatine.
Lorsque tous les patients recevant ZETIA avec une statine ont été comparés à tous ceux recevant la statine correspondante seule, ZETIA 10 mg a considérablement réduit le C total, le LDL-C, l'Apo B, le non-HDL-C et les TG, et, à l'exception de la pravastatine , augmentation du HDL-C par rapport à la statine administrée seule. Les réductions de LDL-C induites par ZETIA 10 mg étaient généralement constantes pour toutes les statines. (Voir note de bas de page , Tableaux 8 à 11.)
TABLEAU 8 : Réponse à ZETIA 10 mg et à l'atorvastatine initiée simultanément chez des patients atteints d'hyperlipidémie primaire (% moyen de changement par rapport à la ligne de base non traitée†)
TABLEAU 9 : Réponse à ZETIA 10 mg et à la simvastatine initiée simultanément chez des patients atteints d'hyperlipidémie primaire (% moyen de changement par rapport à la ligne de base non traitée†)
TABLEAU 10 : Réponse à ZETIA et à la pravastatine initiée simultanément chez des patients atteints d'hyperlipidémie primaire (% moyen de changement par rapport à la ligne de base non traitée†)
TABLEAU 11 : Réponse à ZETIA et à la lovastatine initiée simultanément chez des patients atteints d'hyperlipidémie primaire (% moyen de changement par rapport à la ligne de base non traitée†)
Association avec le fénofibrate
Dans une étude clinique multicentrique, en double aveugle, contrôlée par placebo chez des patients atteints d'hyperlipidémie mixte, 625 patients ont été traités jusqu'à 12 semaines et 576 jusqu'à 48 semaines supplémentaires. Les patients ont été randomisés pour recevoir un placebo, ZETIA seul, 160 mg de fénofibrate seul ou ZETIA 10 mg et 160 mg de fénofibrate dans l'étude de 12 semaines. Après avoir terminé l'étude de 12 semaines, les patients éligibles ont reçu ZETIA co-administré avec du fénofibrate ou du fénofibrate en monothérapie pendant 48 semaines supplémentaires.
ZETIA 10 mg co-administré avec le fénofibrate a considérablement réduit le C total, le LDL-C, l'Apo B et le non-HDL-C par rapport au fénofibrate administré seul. Le pourcentage de diminution des TG et le pourcentage d'augmentation des HDLC pour ZETIA co-administré avec le fénofibrate étaient comparables à ceux du fénofibrate administré seul (voir tableau 12).
TABLEAU 12 : Réponse à ZETIA 10 mg et au fénofibrate initiés simultanément chez des patients atteints d'hyperlipidémie mixte (% moyen de changement par rapport à la ligne de base non traitée† à 12 semaines†)
Les modifications des paramètres lipidiques après 48 semaines supplémentaires de traitement par ZETIA co-administré avec le fénofibrate ou avec le fénofibrate seul étaient cohérentes avec les données sur 12 semaines présentées ci-dessus.
Hypercholestérolémie familiale homozygote (HoFH)
Une étude a été menée pour évaluer l'efficacité de ZETIA dans le traitement de l'HFHo. Cette étude randomisée en double aveugle de 12 semaines a inclus 50 patients avec un diagnostic clinique et/ou génotypique d'HFHo, avec ou sans aphérèse concomitante des LDL, recevant déjà de l'atorvastatine ou de la simvastatine (40 mg). Les patients ont été randomisés dans l'un des trois groupes de traitement, atorvastatine ou simvastatine (80 mg), ZETIA 10 mg administré avec de l'atorvastatine ou de la simvastatine (40 mg) ou ZETIA administré avec de l'atorvastatine ou de la simvastatine (80 mg). En raison de la diminution de la biodisponibilité de l'ézétimibe chez les patients recevant simultanément de la cholestyramine [voir INTERACTIONS MÉDICAMENTEUSES ], l'ézétimibe a été administré au moins 4 heures avant ou après l'administration des résines. Le LDL-C moyen initial était de 341 mg/dL chez les patients randomisés pour recevoir 80 mg d'atorvastatine ou 80 mg de simvastatine seuls et de 316 mg/dL dans le groupe randomisé pour recevoir ZETIA 10 mg plus atorvastatine 40 ou 80 mg ou simvastatine 40 ou 80 mg. ZETIA 10 mg, administré avec de l'atorvastatine ou de la simvastatine (groupes de statines à 40 et 80 mg, regroupés), a significativement réduit le LDL-C (21 %) par rapport à l'augmentation de la dose de simvastatine ou d'atorvastatine en monothérapie de 40 à 80 mg (7 %). Chez les personnes traitées avec ZETIA 10 mg plus 80 mg d'atorvastatine ou avec ZETIA 10 mg plus 80 mg de simvastatine, le LDL-C a été réduit de 27 %.
Sitostérolémie homozygote (phytostérolémie)
Une étude a été menée pour évaluer l'efficacité de ZETIA dans le traitement de la sitostérolémie homozygote. Dans cet essai multicentrique, en double aveugle, contrôlé par placebo, d'une durée de 8 semaines, 37 patients homozygotes présentant des taux plasmatiques élevés de sitostérol (> 5 mg/dL) sous leur régime thérapeutique actuel (régime, résines liant les acides biliaires, statines, pontage iléal et/ou aphérèse des LDL), ont été randomisés pour recevoir ZETIA (n=30) ou un placebo (n=7). En raison de la diminution de la biodisponibilité de l'ézétimibe chez les patients recevant simultanément de la cholestyramine [voir INTERACTIONS MÉDICAMENTEUSES ], l'ézétimibe a été administré au moins 2 heures avant ou 4 heures après l'administration des résines. En excluant le seul sujet recevant une aphérèse des LDL, ZETIA a considérablement réduit le sitostérol et le campestérol plasmatiques, respectivement de 21 % et 24 % par rapport au départ. En revanche, les patients ayant reçu un placebo ont présenté des augmentations du sitostérol et du campestérol de 4 % et 3 % par rapport au départ, respectivement. Pour les patients traités par ZETIA 10 mg, les taux plasmatiques moyens de stérols végétaux ont été progressivement réduits au cours de l'étude. Les effets de la réduction du sitostérol et du campestérol plasmatiques sur la réduction des risques de morbi-mortalité cardiovasculaire n'ont pas été établis.
Les réductions du sitostérol et du campestérol étaient cohérentes entre les patients prenant ZETIA 10 mg en même temps que des séquestrants des acides biliaires (n = 8) et les patients ne recevant pas de traitement concomitant avec des séquestrants des acides biliaires (n = 21).
Limites d'utilisation
L'effet de ZETIA 10 mg sur la morbi-mortalité cardiovasculaire n'a pas été déterminé.
INFORMATIONS PATIENTS
ZETIA® (ézétimibe) Comprimés
Informations pour les patients sur ZETIA (zet´-ea)
Nom générique : ézétimibe (e-zet´-e-mib)
Lisez attentivement ces informations avant de commencer à prendre ZETIA® et chaque fois que vous prenez plus de ZETIA. Il peut y avoir de nouvelles informations. Ces informations ne remplacent pas une discussion avec votre médecin au sujet de votre état de santé ou de votre traitement. Si vous avez des questions sur ZETIA, posez-les à votre médecin. Seul votre médecin peut déterminer si ZETIA vous convient.
Qu'est-ce que ZETIA ?
ZETIA est un médicament utilisé pour abaisser les taux de cholestérol total et de LDL (mauvais) cholestérol dans le sang. ZETIA est destiné aux patients qui ne peuvent pas contrôler leur taux de cholestérol uniquement par un régime alimentaire et de l'exercice. Il peut être utilisé seul ou avec d'autres médicaments pour traiter l'hypercholestérolémie. Vous devez suivre un régime hypocholestérolémiant pendant que vous prenez ce médicament.
ZETIA agit pour réduire la quantité de cholestérol que votre corps absorbe. ZETIA 10mg ne fait pas maigrir. Il n'a pas été démontré que ZETIA 10 mg prévient les maladies cardiaques ou les crises cardiaques.
Pour plus d'informations sur le cholestérol, consultez la section « Que dois-je savoir sur l'hypercholestérolémie ? » partie qui suit.
Qui ne devrait pas prendre ZETIA 10mg ?
- Ne prenez pas ZETIA 10 mg si vous êtes allergique à l'ézétimibe, l'ingrédient actif de ZETIA, ou aux ingrédients inactifs. Pour une liste des ingrédients inactifs, voir la section « Ingrédients inactifs » qui suit.
- Si vous avez une maladie hépatique active, ne prenez pas ZETIA 10 mg pendant que vous prenez des médicaments hypocholestérolémiants appelés statines.
- Si vous êtes enceinte ou si vous allaitez, ne prenez pas ZETIA pendant que vous prenez une statine.
- Si vous êtes une femme en âge de procréer, vous devez utiliser une méthode de contraception efficace pour prévenir une grossesse tout en utilisant ZETIA en association avec un traitement par statine.
ZETIA n'a pas été étudié chez les enfants de moins de 10 ans.
Que dois-je dire à mon médecin avant et pendant la prise de ZETIA 10 mg ?
Informez votre médecin de tous les médicaments sur ordonnance et en vente libre que vous prenez ou envisagez de prendre, y compris les remèdes naturels ou à base de plantes.
Informez votre médecin de toutes vos conditions médicales, y compris les allergies.
Informez votre médecin si vous :
- déjà eu des problèmes de foie. ZETIA 10 mg peut ne pas vous convenir.
- êtes enceinte ou envisagez de devenir enceinte. Votre médecin discutera avec vous pour savoir si ZETIA 10 mg vous convient.
- allaitent. Nous ne savons pas si ZETIA 10 mg peut passer à votre bébé via votre lait. Votre médecin discutera avec vous pour savoir si ZETIA 10 mg vous convient.
- ressentez des douleurs, une sensibilité ou une faiblesse musculaires inexpliquées.
Comment dois-je prendre ZETIA 10 mg ?
- Prenez ZETIA une fois par jour, avec ou sans nourriture. Il peut être plus facile de se souvenir de prendre votre dose si vous le faites à la même heure chaque jour, comme au petit-déjeuner, au dîner ou au coucher. Si vous prenez également un autre médicament pour réduire votre cholestérol, demandez à votre médecin si vous pouvez les prendre en même temps.
- Si vous oubliez de prendre ZETIA, prenez-le dès que vous vous en rendez compte. Cependant, ne prenez pas plus d'une dose de ZETIA par jour.
- Continuez à suivre un régime hypocholestérolémiant pendant que vous prenez ZETIA. Demandez à votre médecin si vous avez besoin d'informations sur le régime alimentaire.
- Continuez à prendre ZETIA 10 mg sauf si votre médecin vous dit d'arrêter. Il est important que vous continuiez à prendre ZETIA 10 mg même si vous ne vous sentez pas malade.
- Consultez votre médecin régulièrement pour vérifier votre taux de cholestérol et pour vérifier les effets secondaires. Votre médecin peut effectuer des tests sanguins pour vérifier votre foie avant que vous ne commenciez à prendre ZETIA avec une statine et pendant le traitement.
Quels sont les effets secondaires possibles de ZETIA ?
Dans les études cliniques, les patients ont signalé peu d'effets secondaires lors de la prise de ZETIA. Ceux-ci comprenaient la diarrhée, les douleurs articulaires et la sensation de fatigue.
Des patients ont éprouvé de graves problèmes musculaires lors de la prise de ZETIA 10 mg, généralement lorsque ZETIA 10 mg était ajouté à une statine. Si vous ressentez une douleur, une sensibilité ou une faiblesse musculaires inexpliquées pendant que vous prenez ZETIA, contactez immédiatement votre médecin. Vous devez le faire rapidement, car en de rares occasions, ces problèmes musculaires peuvent être graves, avec une dégradation musculaire entraînant des lésions rénales.
De plus, les effets indésirables suivants ont été rapportés lors d'une utilisation générale : réactions allergiques (pouvant nécessiter un traitement immédiat), y compris gonflement du visage, des lèvres, de la langue et/ou de la gorge pouvant entraîner des difficultés à respirer ou à avaler, éruption cutanée et urticaire ; éruption rouge surélevée, parfois avec des lésions en forme de cible ; douleur articulaire; douleurs musculaires; altérations de certains tests sanguins de laboratoire ; problèmes de foie; Douleur d'estomac; inflammation du pancréas; nausée; vertiges; sensation de picotement; la dépression; mal de tête; calculs biliaires; inflammation de la vésicule biliaire.
Informez votre médecin si vous rencontrez ces problèmes ou tout autre problème médical pendant que vous prenez ZETIA. Pour une liste complète des effets secondaires, demandez à votre médecin ou à votre pharmacien.
Que dois-je savoir sur l'hypercholestérolémie ?
Le cholestérol est un type de gras présent dans votre sang. Votre cholestérol total est composé de cholestérol LDL et HDL.
Le cholestérol LDL est appelé « mauvais » cholestérol car il peut s'accumuler dans la paroi de vos artères et former une plaque. Au fil du temps, l'accumulation de plaque peut provoquer un rétrécissement des artères. Ce rétrécissement peut ralentir ou bloquer le flux sanguin vers votre cœur, votre cerveau et d'autres organes. Un taux élevé de cholestérol LDL est une cause majeure de maladie cardiaque et l'une des causes d'accident vasculaire cérébral.
Le cholestérol HDL est appelé « bon » cholestérol car il empêche le mauvais cholestérol de s'accumuler dans les artères.
Les triglycérides sont également des graisses présentes dans votre sang.
Informations générales sur ZETIA
Des médicaments sont parfois prescrits pour des affections qui ne sont pas mentionnées dans les notices d'information destinées aux patients. N'utilisez pas ZETIA 10 mg pour une affection pour laquelle il n'a pas été prescrit. Ne donnez pas ZETIA à d'autres personnes, même si elles ont la même maladie que vous. Cela peut leur nuire.
Ceci résume les informations les plus importantes sur ZETIA. Si vous souhaitez plus d'informations, parlez-en à votre médecin. Vous pouvez demander à votre pharmacien ou à votre médecin des informations sur ZETIA 10 mg destinées aux professionnels de la santé.
Ingrédients inactifs :
Croscarmellose sodique, lactose monohydraté, stéarate de magnésium, cellulose microcristalline, povidone et laurylsulfate de sodium.
