Lopid 300mg Gemfibrozil Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Lopid 300 mg et comment est-il utilisé ?
Lopid (gemfibrozil) est un agent régulateur des lipides utilisé pour traiter les taux très élevés de cholestérol et de triglycérides chez les personnes atteintes de pancréatite, et est également utilisé pour réduire le risque d'accident vasculaire cérébral, de crise cardiaque ou d'autres complications cardiaques chez les personnes ayant un taux élevé de cholestérol et de triglycérides qui ont pas été aidé par d'autres traitements. Lopid est disponible sous forme générique.
Quels sont les effets secondaires de Lopid 300mg ?
Les effets secondaires courants de Lopid 300 mg incluent :
- maux d'estomac,
- douleurs gastriques/abdominales,
- nausée,
- vomissement,
- diarrhée,
- mal de tête,
- vertiges,
- somnolence,
- douleurs articulaires ou musculaires,
- perte d'intérêt pour le sexe,
- impuissance,
- difficulté à avoir un orgasme,
- engourdissement ou sensation de picotement,
- goût inhabituel ou
- symptômes du rhume tels que nez bouché, éternuements, mal de gorge.
Lopid 300 mg peut rarement causer des calculs biliaires et des problèmes de foie.
Informez votre médecin si vous remarquez l'un des effets secondaires peu probables mais graves suivants de Lopid 300 mg, notamment :
- fortes douleurs gastriques/abdominales,
- nausées ou vomissements persistants,
- jaunissement des yeux ou de la peau, et
- urine foncée.
LA DESCRIPTION
LOPID® (comprimés de gemfibrozil, USP) est un agent régulateur des lipides. Il est disponible sous forme de comprimés pour administration orale. Chaque comprimé contient 600 mg de gemfibrozil. Chaque comprimé contient également du stéarate de calcium, NF ; cire de candelilla, FCC; cellulose microcristalline, NF; hydroxypropylcellulose, NF; hypromellose, USP; méthylparaben, NF; Opaspray blanc; polyéthylèneglycol, NF; polysorbate 80, NF; propylparaben, NF; dioxyde de silicium colloïdal, NF; amidon prégélatinisé, NF. Le nom chimique est l'acide 5-(2,5-diméthylphénoxy)-2,2-diméthylpentanoïque, avec la formule structurale suivante :
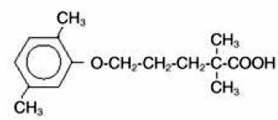
La formule empirique est C15H22O3 et le poids moléculaire est de 250,35 ; la solubilité dans l'eau et l'acide est de 0,0019 % et dans la base diluée elle est supérieure à 1 %. Le point de fusion est de 58° à 61°C. Le gemfibrozil est un solide blanc stable dans les conditions ordinaires.
LES INDICATIONS
LOPID (comprimés de gemfibrozil, USP) est indiqué comme traitement d'appoint à un régime alimentaire pour :
Dans une analyse de sous-groupe de patients de l'étude Helsinki Heart Study avec des valeurs de HDL-cholestérol supérieures à la médiane au départ (plus de 46,4 mg/dL), l'incidence d'événements coronariens graves était similaire pour les sous-groupes gemfibrozil et placebo (voir Tableau I).
Le traitement initial de la dyslipidémie est une thérapie diététique spécifique au type d'anomalie des lipoprotéines. L'excès de poids corporel et la consommation excessive d'alcool peuvent être des facteurs importants de l'hypertriglycéridémie et doivent être pris en charge avant tout traitement médicamenteux. L'exercice physique peut être une mesure auxiliaire importante et a été associé à des augmentations du cholestérol HDL. Les maladies contribuant à l'hyperlipidémie telles que l'hypothyroïdie ou le diabète sucré doivent être recherchées et traitées de manière adéquate. L'oestrogénothérapie est parfois associée à des augmentations massives des triglycérides plasmatiques, en particulier chez les sujets atteints d'hypertriglycéridémie familiale. Dans de tels cas, l'arrêt de l'œstrogénothérapie peut éviter la nécessité d'un traitement médicamenteux spécifique de l'hypertriglycéridémie. L'utilisation de médicaments ne doit être envisagée que lorsque des tentatives raisonnables ont été faites pour obtenir des résultats satisfaisants avec des méthodes non médicamenteuses. Si la décision est prise d'utiliser des médicaments, le patient doit être informé que cela ne diminue pas l'importance du respect du régime alimentaire.
DOSAGE ET ADMINISTRATION
La dose recommandée pour les adultes est de 1200 mg administrée en deux prises fractionnées 30 minutes avant les repas du matin et du soir (voir PHARMACOLOGIE CLINIQUE ).
COMMENT FOURNIE
LOPIDE (Comprimé 737), comprimés blancs, elliptiques, pelliculés, sécables, contenant chacun 600 mg de gemfibrozil, sont disponibles comme suit :
CDN 0071-0737-20 : Bouteilles de 60 CDN 0071-0737-30 : Bouteilles de 500
Le magasin à la température de pièce contrôlée 20° – 25°C (68° – 77°F) [voit USP]. Protéger de la lumière et de l'humidité.
Distribué par Parke-Davis Division de Pfizer Inc, NY, NY 10017. Révisé : décembre 2020
EFFETS SECONDAIRES
Dans la phase contrôlée en double aveugle de la composante de prévention primaire de l'étude cardiaque d'Helsinki, 2 046 patients ont reçu LOPID pendant une période pouvant aller jusqu'à cinq ans. Dans cette étude, les effets indésirables suivants étaient statistiquement plus fréquents chez les sujets du groupe LOPID :
Opération de la vésicule biliaire été réalisée chez 0,9% des sujets LOPID 300mg et 0,5% des sujets placebo dans le volet prévention primaire, soit un excès de 64%, qui n'est pas statistiquement différent de l'excès de chirurgie de la vésicule biliaire observé dans le groupe clofibrate par rapport au groupe placebo de l'étude OMS . La chirurgie de la vésicule biliaire a également été pratiquée plus fréquemment dans le groupe LOPID par rapport au groupe placebo (1,9 % contre 0,3 %, p = 0,07) dans le volet prévention secondaire. Une augmentation statistiquement significative des appendicectomies dans le groupe gemfibrozil a également été observée dans le volet prévention secondaire (6 sous gemfibrozil versus 0 sous placebo, p=0,014).
Les effets indésirables du système nerveux et des sens spéciaux étaient plus fréquents dans le groupe LOPID 300 mg. Ceux-ci comprenaient l'hypoesthésie, les paresthésies et la perversion du goût. D'autres effets indésirables qui étaient plus fréquents chez les sujets du groupe de traitement LOPID 300 mg mais pour lesquels une relation causale n'a pas été établie comprennent les cataractes, les maladies vasculaires périphériques et les hémorragies intracérébrales.
D'après d'autres études, il semble probable que LOPID 300 mg soit causalement lié à la survenue de SYMPTÔMES MUSCULO-SQUELETTIQUES (voir AVERTISSEMENTS ), et aux TESTS ANORMAUX DE LA FONCTION HÉPATIQUE et aux CHANGEMENTS HÉMATOLOGIQUES (voir PRÉCAUTIONS ).
Les rapports d'infections virales et bactériennes (rhume, toux, infections des voies urinaires) étaient plus fréquents chez les patients traités par le gemfibrozil dans d'autres essais cliniques contrôlés portant sur 805 patients. Les effets indésirables supplémentaires qui ont été signalés pour le gemfibrozil sont énumérés ci-dessous par système. Ceux-ci sont classés selon qu'une relation causale avec le traitement par LOPID est probable ou non établie :
Les autres effets indésirables qui ont été signalés comprennent la cholécystite et la lithiase biliaire (voir AVERTISSEMENTS ).
INTERACTIONS MÉDICAMENTEUSES
Inhibiteurs de l'HMG-CoA réductase
L'administration concomitante de LOPID 300 mg avec la simvastatine est contre-indiquée (voir CONTRE-INDICATIONS et AVERTISSEMENTS ). Éviter l'utilisation concomitante de LOPID avec la rosuvastatine. Si l'utilisation concomitante ne peut être évitée, initier la rosuvastatine à 5 mg une fois par jour. La dose de rosuvastatine ne doit pas dépasser 10 mg une fois par jour. Le risque de myopathie et de rhabdomyolyse est accru avec le traitement combiné par le gemfibrozil et l'inhibiteur de l'HMG-CoA réductase. Une myopathie ou une rhabdomyolyse avec ou sans insuffisance rénale aiguë ont été rapportées dès trois semaines après le début du traitement combiné ou après plusieurs mois (voir AVERTISSEMENTS ). Rien ne garantit qu'une surveillance périodique de la créatine kinase empêchera l'apparition d'une myopathie sévère et de lésions rénales.
Anticoagulants
LA PRUDENCE DOIT ÊTRE EXERCÉE LORSQUE WARFARIN EST ADMINISTRÉ EN CONJONCTION AVEC LOPID. LE DOSAGE DE WARFARIN DEVRAIT ÊTRE RÉDUIT POUR MAINTENIR LE TEMPS DE PROTHROMBINE AU NIVEAU SOUHAITÉ POUR PRÉVENIR LES COMPLICATIONS DE SAIGNEMENT. DES DÉTERMINATIONS FRÉQUENTES DE LA PROTHROMBINE SONT RECOMMANDÉES JUSQU'À CE QU'IL SOIT DÉFINITIVEMENT DÉTERMINÉ QUE LE NIVEAU DE PROTHROMBINE S'EST STABILISÉ.
Substrats CYP2C8
Le gemfibrozil est un puissant inhibiteur du CYP2C8 et peut augmenter l'exposition aux médicaments principalement métabolisés par le CYP2C8 (p. ex., dabrafenib, enzalutamide, lopéramide, montélukast, paclitaxel, pioglitazone, rosiglitazone). Par conséquent, une réduction de la posologie des médicaments qui sont principalement métabolisés par l'enzyme CYP2C8 peut être nécessaire lorsque le gemfibrozil est utilisé de façon concomitante (voir AVERTISSEMENTS ).
Répaglinide
Chez des volontaires sains, la co-administration avec le gemfibrozil (600 mg deux fois par jour pendant 3 jours) a entraîné une augmentation de l'ASC du répaglinide 8,1 fois (plage de 5,5 à 15,0 fois) et une augmentation de 28,6 fois (plage de 18,5 à 80,1 fois) concentration plasmatique de répaglinide plus élevée 7 heures après la dose. Dans la même étude, le gemfibrozil (600 mg deux fois par jour pendant 3 jours) + itraconazole (200 mg le matin et 100 mg le soir au jour 1, puis 100 mg deux fois par jour au jour 2-3) ont entraîné une diminution de 19,4-( de 12,9 à 24,7 fois) plus élevée de l'ASC du répaglinide et une concentration plasmatique de répaglinide 70,4 fois plus élevée (de 42,9 à 119,2 fois) plus élevée 7 heures après l'administration de la dose. De plus, le gemfibrozil seul ou le gemfibrozil + itraconazole ont prolongé les effets hypoglycémiants du répaglinide. La co-administration de gemfibrozil et de répaglinide augmente le risque d'hypoglycémie sévère et est contre-indiquée (voir CONTRE-INDICATIONS ).
Dasabuvir
La co-administration de gemfibrozil avec le dasabuvir a augmenté l'ASC et la Cmax du dasabuvir (ratios : 11,3 et 2,01, respectivement) en raison de l'inhibition du CYP2C8. Une exposition accrue au dasabuvir peut augmenter le risque d'allongement de l'intervalle QT, par conséquent, la co-administration de gemfibrozil avec le dasabuvir est contre-indiquée (voir CONTRE-INDICATIONS ).
Sélexipag
La co-administration de gemfibrozil avec le sélexipag a doublé l'exposition au sélexipag et augmenté l'exposition au métabolite actif d'environ 11 fois. L'administration concomitante de gemfibrozil et de sélexipag est contre-indiquée (voir CONTRE-INDICATIONS ).
Enzalutamide
Chez des volontaires sains ayant reçu une dose unique de 160 mg d'enzalutamide après 600 mg de gemfibrozil deux fois par jour, l'ASC de l'enzalutamide plus le métabolite actif (N-desméthyl enzalutamide) a été augmentée de 2,2 fois et la Cmax correspondante a diminué de 16 %. Une exposition accrue à l'enzalutamide peut augmenter le risque de convulsions. Si la co-administration est jugée nécessaire, la dose d'enzalutamide doit être réduite (voir AVERTISSEMENTS ).
Substrats OATP1B1
Le gemfibrozil est un inhibiteur du transporteur OATP1B1 et peut augmenter l'exposition aux médicaments qui sont des substrats de l'OATP1B1 (p. ex., atrasentan, atorvastatine, bosentan, ézétimibe, fluvastatine, glyburide, SN-38 [métabolite actif de l'irinotécan], rosuvastatine, pitavastatine, pravastatine, rifampine , valsartan, olmésartan). Par conséquent, des réductions posologiques des médicaments qui sont des substrats de l'OATP1B1 peuvent être nécessaires lorsque le gemfibrozil est utilisé de façon concomitante (voir AVERTISSEMENTS ). L'association du gemfibrozil avec la simvastatine ou avec le répaglinide, qui sont des substrats de l'OATP1B1, est contre-indiquée (voir CONTRE-INDICATIONS ).
Études in vitro des enzymes CYP, des enzymes UGTA et du transporteur OATP1B1
Des études in vitro ont montré que le gemfibrozil est un inhibiteur du CYP1A2, du CYP2C8, du CYP2C9, du CYP2C19, de l'OATP1B1 et de l'UDP-glucuronosyltransférase (UGT) 1A1 et 1A3 (voir AVERTISSEMENTS ).
Résines fixant les acides biliaires
L'ASC du gemfibrozil a été réduite de 30 % lorsque le gemfibrozil a été administré (600 mg) simultanément avec des médicaments contenant des granulés de résine tels que le colestipol (5 g). L'administration des médicaments à deux heures ou plus d'intervalle est recommandée car l'exposition au gemfibrozil n'a pas été significativement affectée lorsqu'il a été administré à deux heures d'intervalle du colestipol.
Colchicine
Des cas de myopathie, y compris de rhabdomyolyse, ont été signalés lors de l'administration chronique de colchicine à des doses thérapeutiques. L'utilisation concomitante de LOPID peut potentialiser le développement d'une myopathie. Les patients atteints d'insuffisance rénale et les patients âgés présentent un risque accru. La prudence s'impose lors de la prescription de LOPID avec de la colchicine, en particulier chez les patients âgés ou les patients présentant une insuffisance rénale.
AVERTISSEMENTS
En raison de la taille plus limitée de l'étude cardiaque d'Helsinki, la différence observée dans la mortalité toutes causes confondues entre les groupes LOPID 300 mg et placebo n'est pas statistiquement significativement différente de la surmortalité de 29 % signalée dans le groupe clofibrate dans l'étude distincte de l'OMS au suivi de neuf ans (voir PHARMACOLOGIE CLINIQUE ). La mortalité liée aux maladies cardiaques non coronariennes a montré un excès dans le groupe initialement randomisé pour LOPID principalement en raison des décès par cancer observés au cours de l'extension en ouvert.
Au cours de la composante de prévention primaire de cinq ans de la Helsinki Heart Study, la mortalité toutes causes confondues était de 44 (2,2 %) dans le groupe LOPID 300 mg et de 43 (2,1 %) dans le groupe placebo ; y compris la période de suivi de 3,5 ans depuis la fin de l'essai, la mortalité cumulée toutes causes confondues était de 101 (4,9 %) dans le groupe LOPID et de 83 (4,1 %) dans le groupe randomisé à l'origine contre placebo (risque relatif 1:20 en faveur de placebo). En raison de la taille plus limitée de l'étude cardiaque d'Helsinki, la différence observée de mortalité toutes causes confondues entre les groupes LOPID 300 mg et placebo à l'année 5 ou à l'année 8,5 n'est pas statistiquement significativement différente de la surmortalité de 29 % rapportée dans l'étude. groupe clofibrate dans l'étude distincte de l'OMS lors du suivi de neuf ans. La mortalité liée aux maladies cardiaques non coronariennes a montré un excès dans le groupe initialement randomisé pour recevoir LOPID 300 mg lors du suivi de 8,5 ans (65 décès non coronariens avec LOPID 300 mg contre 45 placebo).
L'incidence du cancer (à l'exclusion du carcinome basocellulaire) découvert au cours de l'essai et dans les 3,5 ans suivant la fin de l'essai était de 51 (2,5 %) dans les deux groupes initialement randomisés. De plus, il y avait 16 carcinomes basocellulaires dans le groupe initialement randomisé pour LOPID 300 mg et 9 dans le groupe initialement randomisé pour le placebo (p = 0,22). Il y a eu 30 (1,5 %) décès attribués au cancer dans le groupe initialement randomisé au LOPID 300 mg et 18 (0,9 %) dans le groupe initialement randomisé au placebo (p = 0,11). Les résultats indésirables, y compris les événements coronariens, étaient plus élevés chez les patients traités au gemfibrozil dans une étude correspondante menée chez des hommes ayant des antécédents de maladie coronarienne connue ou suspectée dans le cadre de la composante de prévention secondaire de l'étude cardiaque d'Helsinki (voir PHARMACOLOGIE CLINIQUE ).
Une étude comparative de cancérogénicité a également été réalisée chez le rat comparant trois médicaments de cette classe : le fénofibrate (10 et 60 mg/kg ; 0,3 et 1,6 fois la dose humaine, respectivement), le clofibrate (400 mg/kg ; 1,6 fois la dose humaine), et gemfibrozil (250 mg/kg; 1,7 fois la dose humaine). Les adénomes acineux pancréatiques ont augmenté chez les hommes et les femmes sous fénofibrate ; le carcinome hépatocellulaire et les adénomes acineux pancréatiques ont augmenté chez les mâles et les nodules néoplasiques hépatiques chez les femelles traitées avec le clofibrate ; les nodules néoplasiques hépatiques ont augmenté chez les mâles et les femelles traités au clofibrate ; les nodules néoplasiques hépatiques ont augmenté chez les hommes et les femmes traités par le gemfibrozil, tandis que les tumeurs des cellules interstitielles testiculaires (cellules de Leydig) ont augmenté chez les hommes sous les trois médicaments.
PRÉCAUTIONS
Thérapie initiale
Des études de laboratoire doivent être effectuées pour s'assurer que les taux de lipides sont constamment anormaux. Avant d'instaurer un traitement par LOPID, tous les efforts doivent être faits pour contrôler les lipides sériques avec un régime alimentaire approprié, de l'exercice, une perte de poids chez les patients obèses et le contrôle de tout problème médical tel que le diabète sucré et l'hypothyroïdie qui contribuent aux anomalies lipidiques.
Thérapie continue
Une détermination périodique des lipides sériques doit être obtenue et le médicament retiré si la réponse lipidique est inadéquate après trois mois de traitement.
Carcinogenèse, mutagenèse, altération de la fertilité
Des études à long terme ont été menées sur des rats à 0,2 et 1,3 fois l'exposition humaine (sur la base de l'ASC). L'incidence des nodules hépatiques bénins et des carcinomes hépatiques a augmenté de façon significative chez les rats mâles recevant la dose élevée. L'incidence des carcinomes du foie a également augmenté chez les mâles à faible dose, mais cette augmentation n'était pas statistiquement significative (p = 0,1). Les rats mâles ont présenté une augmentation liée à la dose et statistiquement significative des tumeurs bénignes à cellules de Leydig. Les rats femelles recevant la dose la plus élevée présentaient une augmentation significative de l'incidence combinée des néoplasmes hépatiques bénins et malins.
Des études à long terme ont été menées chez la souris à 0,1 et 0,7 fois l'exposition humaine (sur la base de l'ASC). Il n'y avait pas de différences statistiquement significatives par rapport aux témoins dans l'incidence des tumeurs du foie, mais les doses testées étaient inférieures à celles qui se sont avérées cancérigènes avec d'autres fibrates.
Des études de microscopie électronique ont démontré une prolifération de peroxysomes hépatiques florides suite à l'administration de LOPID au rat mâle. Une étude adéquate pour tester la prolifération des peroxysomes n'a pas été réalisée chez l'homme, mais des changements dans la morphologie des peroxysomes ont été observés. Il a été démontré que la prolifération des peroxysomes se produit chez l'homme avec l'un ou l'autre des deux autres médicaments de la classe des fibrates lorsque des biopsies hépatiques ont été comparées avant et après le traitement chez le même individu.
L'administration d'environ 2 fois la dose humaine (basée sur la surface) à des rats mâles pendant 10 semaines a entraîné une diminution de la fertilité liée à la dose. Des études ultérieures ont démontré que cet effet était inversé après une période sans médicament d'environ huit semaines et qu'il n'était pas transmis à la progéniture.
Grossesse
Il a été démontré que LOPID 300 mg produit des effets indésirables chez le rat et le lapin à des doses comprises entre 0,5 et 3 fois la dose humaine (basée sur la surface). Il n'y a pas d'études adéquates et bien contrôlées chez les femmes enceintes. LOPID 300 mg ne doit être utilisé pendant la grossesse que si le bénéfice potentiel justifie le risque potentiel pour le fœtus.
L'administration de LOPID 300 mg à des rats femelles à 2 fois la dose humaine (basée sur la surface) avant et tout au long de la gestation a entraîné une diminution liée à la dose du taux de conception, une augmentation des mort-nés et une légère réduction du poids des ratons pendant la lactation. Il y avait également des variations squelettiques accrues liées à la dose. Une anophtalmie s'est produite, mais rarement.
L'administration de 0,6 et 2 fois la dose humaine (basée sur la surface) de LOPID à des rats femelles du jour de gestation 15 jusqu'au sevrage a entraîné des diminutions liées à la dose du poids à la naissance et des suppressions de la croissance des ratons pendant la lactation.
L'administration de 1 et 3 fois la dose humaine (basée sur la surface) de LOPID 300 mg à des lapines pendant l'organogenèse a entraîné une diminution liée à la dose de la taille de la portée et, à la dose élevée, une incidence accrue des variations de l'os pariétal.
Mères allaitantes
On ne sait pas si ce médicament est excrété dans le lait maternel. Étant donné que de nombreux médicaments sont excrétés dans le lait maternel et en raison du potentiel de tumorigénicité démontré pour LOPID dans les études animales, une décision doit être prise d'interrompre l'allaitement ou d'arrêter le médicament, en tenant compte de l'importance du médicament pour la mère.
Changements hématologiques
De légères diminutions de l'hémoglobine, de l'hématocrite et des globules blancs ont été observées chez des patients occasionnels après le début du traitement par LOPID. Cependant, ces niveaux se stabilisent pendant l'administration à long terme. De rares cas d'anémie sévère, de leucopénie, de thrombocytopénie et d'hypoplasie médullaire ont été rapportés.
Par conséquent, des numérations globulaires périodiques sont recommandées au cours des 12 premiers mois d'administration de LOPID 300 mg.
La fonction hépatique
Des tests de la fonction hépatique anormaux ont été observés occasionnellement pendant l'administration de LOPID, y compris des élévations de l'AST, de l'ALT, de la LDH, de la bilirubine et de la phosphatase alcaline. Celles-ci sont généralement réversibles à l'arrêt de LOPID 300 mg. Par conséquent, des études périodiques de la fonction hépatique sont recommandées et le traitement par LOPID 300 mg doit être interrompu si les anomalies persistent.
Fonction rénale
Des cas d'aggravation de l'insuffisance rénale ont été signalés après l'ajout d'un traitement par LOPID chez des personnes dont la créatinine plasmatique initiale était > 2,0 mg/dL. Chez ces patients, l'utilisation d'un traitement alternatif doit être considérée par rapport aux risques et aux avantages d'une dose plus faible de LOPID.
Utilisation pédiatrique
L'innocuité et l'efficacité chez les patients pédiatriques n'ont pas été établies.
SURDOSAGE
Des cas de surdosage avec LOPID ont été rapportés. Dans un cas, un enfant de 7 ans s'est rétabli après avoir ingéré jusqu'à 9 grammes de LOPID. Les symptômes signalés en cas de surdosage étaient des crampes abdominales, des anomalies des tests de la fonction hépatique, de la diarrhée, une augmentation des CPK, des douleurs articulaires et musculaires, des nausées et des vomissements. Des mesures de soutien symptomatiques doivent être prises en cas de surdosage.
CONTRE-INDICATIONS
PHARMACOLOGIE CLINIQUE
LOPID est un agent régulateur des lipides qui diminue les triglycérides sériques et le cholestérol des lipoprotéines de très basse densité (VLDL), et augmente le cholestérol des lipoprotéines de haute densité (HDL). Bien que des diminutions modestes du cholestérol total et des lipoprotéines de basse densité (LDL) puissent être observées avec le traitement par LOPID 300 mg, le traitement des patients présentant des triglycérides élevés en raison d'une hyperlipoprotéinémie de type IV entraîne souvent une augmentation du cholestérol LDL. Les taux de cholestérol LDL chez les patients de type IIb présentant des élévations à la fois du cholestérol LDL sérique et des triglycérides sont, en général, peu affectés par le traitement par LOPID 300 mg ; cependant, LOPID 300 mg augmente généralement le cholestérol HDL de manière significative dans ce groupe. LOPID 300 mg augmente les niveaux des sous-fractions HDL2 et HDL3 des lipoprotéines de haute densité (HDL), ainsi que des apolipoprotéines AI et AII. Des études épidémiologiques ont montré qu'un faible taux de cholestérol HDL et un taux élevé de cholestérol LDL sont des facteurs de risque indépendants de maladie coronarienne.
Dans le volet de prévention primaire de l'étude cardiaque d'Helsinki, dans laquelle 4 081 hommes âgés de 40 à 55 ans ont été étudiés de manière randomisée, en double aveugle et contrôlée par placebo, le traitement par LOPID à 300 mg a été associé à des réductions significatives des triglycérides plasmatiques totaux. et une augmentation significative du cholestérol des lipoprotéines de haute densité. Des réductions modérées du cholestérol plasmatique total et du cholestérol des lipoprotéines de basse densité ont été observées pour le groupe de traitement LOPID dans son ensemble, mais la réponse lipidique était hétérogène, en particulier parmi les différents types de Fredrickson. L'étude a porté sur des sujets ayant un taux sérique de cholestérol non HDL supérieur à 200 mg/dL et aucun antécédent de maladie coronarienne. Au cours de la période d'étude de cinq ans, le groupe LOPID 300 mg a présenté une réduction absolue de 1,4 % (relative de 34 %) du taux d'événements coronariens graves (morts cardiaques subites plus infarctus du myocarde mortels et non mortels) par rapport au placebo, p = 0,04 (voir Tableau I). Il y a eu une réduction relative de 37 % du taux d'infarctus du myocarde non mortel par rapport au placebo, ce qui équivaut à une différence liée au traitement de 13,1 événements pour mille personnes. Les décès toutes causes confondues au cours de la partie en double aveugle de l'étude ont totalisé 44 (2,2 %) dans le groupe de randomisation LOPID 300 mg et 43 (2,1 %) dans le groupe placebo.
Parmi les types de Fredrickson, au cours de la partie en double aveugle de 5 ans de la composante de prévention primaire de l'étude cardiaque d'Helsinki, la plus grande réduction de l'incidence des événements coronariens graves s'est produite chez les patients de type IIb qui présentaient des élévations à la fois du cholestérol LDL et du plasma total triglycérides. Ce sous-groupe de patients du groupe gemfibrozil de type IIb avait un taux de cholestérol HDL moyen inférieur au départ que le sous-groupe de type IIa qui présentait des élévations du cholestérol LDL et des triglycérides plasmatiques normaux. L'augmentation moyenne du cholestérol HDL chez les patients de type IIb de cette étude était de 12,6 % par rapport au placebo. La variation moyenne du cholestérol LDL chez les patients de type IIb était de -4,1 % avec LOPID par rapport à une augmentation de 3,9 % dans le sous-groupe placebo. Les sujets de type IIb de l'étude cardiaque d'Helsinki ont eu 26 événements coronariens de moins pour mille personnes sur cinq ans dans le groupe gemfibrozil par rapport au groupe placebo. La différence d'événements coronariens était nettement plus importante entre LOPID 300 mg et le placebo pour ce sous-groupe de patients présentant la triade de cholestérol LDL > 175 mg/dL (> 4,5 mmol), de triglycérides > 200 mg/dL (> 2,2 mmol) et de HDL -cholestérol
Des informations supplémentaires sont disponibles à partir d'un suivi de 3,5 ans (8,5 ans cumulés) de tous les sujets ayant participé à l'étude cardiaque d'Helsinki. À la fin de l'étude cardiaque d'Helsinki, les sujets pouvaient choisir de commencer, d'arrêter ou de continuer à recevoir LOPID ; sans connaissance de leurs propres valeurs lipidiques ou d'un traitement en double aveugle, 60 % des patients initialement randomisés pour recevoir un placebo ont commencé un traitement par LOPID 300 mg et 60 % des patients initialement randomisés pour recevoir LOPID ont continué le traitement. Environ 6,5 ans après la randomisation, tous les patients ont été informés de leur groupe de traitement d'origine et des valeurs lipidiques au cours des cinq années du traitement en double aveugle. Après d'autres modifications électives du statut du traitement LOPID, 61 % des patients du groupe initialement randomisé pour LOPID prenaient le médicament ; dans le groupe initialement randomisé pour recevoir un placebo, 65 % prenaient LOPID. Le taux d'événements pour 1000 survenus pendant la période de suivi en ouvert est détaillé dans le tableau II.
La mortalité cumulée sur 8,5 ans a montré un excès relatif de 20 % de décès dans le groupe initialement randomisé pour LOPID 300 mg par rapport au groupe placebo initialement randomisé et une diminution relative de 20 % des événements cardiaques dans le groupe initialement randomisé pour LOPID 300 mg par rapport au groupe placebo initialement randomisé (voir tableau III). Cette analyse de la population initialement randomisée « en intention de traiter » néglige les possibles effets de complication du changement de traitement pendant la phase en ouvert. L'ajustement des rapports de risque, en tenant compte du statut de traitement en ouvert des années 6,5 à 8,5, pourrait modifier les rapports de risque rapportés pour la mortalité vers l'unité.
Il n'est pas clair dans quelle mesure les résultats de la composante de prévention primaire de l'étude cardiaque d'Helsinki peuvent être extrapolés à d'autres segments de la population dyslipidémique non étudiée (comme les femmes, les hommes plus jeunes ou plus âgés, ou ceux présentant des anomalies lipidiques limitées uniquement au HDL -cholestérol) ou à d'autres médicaments altérant les lipides.
La composante de prévention secondaire de l'étude cardiaque d'Helsinki a été menée sur cinq ans en parallèle et dans les mêmes centres en Finlande auprès de 628 hommes d'âge moyen exclus de la composante de prévention primaire de l'étude cardiaque d'Helsinki en raison d'antécédents d'angine de poitrine, d'infarctus du myocarde, ou modifications inexpliquées de l'ECG. Le principal critère d'évaluation de l'efficacité de l'étude était les événements cardiaques (la somme des infarctus du myocarde mortels et non mortels et des morts cardiaques subites). Le rapport de risque (LOPID:placebo) pour les événements cardiaques était de 1,47 (limites de confiance à 95 % 0,88-2,48, p = 0,14). Sur les 35 patients du groupe LOPID 300 mg qui ont présenté des événements cardiaques, 12 patients ont subi des événements après l'arrêt de l'étude. Sur les 24 patients du groupe placebo ayant subi des événements cardiaques, 4 patients ont subi des événements après l'arrêt de l'étude. Il y a eu 17 décès cardiaques dans le groupe LOPID et 8 dans le groupe placebo (risque relatif 2,18 ; limites de confiance à 95 % 0,94-5,05, p = 0,06). Dix de ces décès dans le groupe LOPID et 3 dans le groupe placebo sont survenus après l'arrêt du traitement. Dans cette étude portant sur des patients atteints d'une maladie coronarienne connue ou suspectée, aucun bénéfice du traitement par LOPID 300 mg n'a été observé dans la réduction des événements cardiaques ou des décès cardiaques. Ainsi, LOPID 300 mg a montré un bénéfice uniquement chez des patients dyslipidémiques sélectionnés sans maladie coronarienne suspectée ou établie. Même chez les patients atteints de maladie coronarienne et de la triade de cholestérol LDL élevé, de triglycérides élevés et de cholestérol HDL bas, l'effet possible de LOPID sur les événements coronariens n'a pas été suffisamment étudié.
Aucune efficacité chez les patients atteints d'une maladie coronarienne établie n'a été observée au cours du Coronary Drug Project avec le médicament chimiquement et pharmacologiquement apparenté, le clofibrate. Le Coronary Drug Project était une étude randomisée en double aveugle d'une durée de 6 ans portant sur 1 000 patients sous clofibrate, 1 000 sous acide nicotinique et 3 000 sous placebo atteints d'une maladie coronarienne connue. Une réduction cliniquement et statistiquement significative des infarctus du myocarde a été observée dans le groupe acide nicotinique concomitant par rapport au placebo ; aucune réduction n'a été observée avec le clofibrate.
Le mécanisme d'action du gemfibrozil n'a pas été définitivement établi. Chez l'homme, il a été démontré que LOPID 300 mg inhibe la lipolyse périphérique et diminue l'extraction hépatique des acides gras libres, réduisant ainsi la production hépatique de triglycérides. LOPID 300 mg inhibe la synthèse et augmente la clairance de l'apolipoprotéine B porteuse des VLDL, entraînant une diminution de la production de VLDL.
Des études animales suggèrent que le gemfibrozil peut, en plus d'élever le cholestérol HDL, réduire l'incorporation d'acides gras à longue chaîne dans les triglycérides nouvellement formés, accélérer le renouvellement et l'élimination du cholestérol du foie et augmenter l'excrétion de cholestérol dans les selles. LOPID 300 mg est bien absorbé par le tractus gastro-intestinal après administration orale. Les concentrations plasmatiques maximales surviennent en 1 à 2 heures avec une demi-vie plasmatique de 1,5 heure après plusieurs doses.
Le gemfibrozil est complètement absorbé après administration orale de comprimés de LOPID 300 mg, atteignant des concentrations plasmatiques maximales 1 à 2 heures après l'administration. La pharmacocinétique du gemfibrozil est affectée par le moment des repas par rapport au moment de l'administration. Dans une étude (réf. 4), le taux et l'étendue de l'absorption du médicament ont été significativement augmentés lorsqu'il est administré 0,5 heure avant les repas. L'ASC moyenne a été réduite de 14 à 44 % lorsque LOPID a été administré après les repas par rapport à 0,5 heure avant les repas. Dans une étude ultérieure, le taux d'absorption de LOPID 300 mg était maximal lorsqu'il était administré 0,5 heure avant les repas avec une Cmax de 50 à 60 % supérieure à celle administrée avec les repas ou à jeun. Dans cette étude, il n'y a pas eu d'effets significatifs sur l'ASC du moment de l'administration de la dose par rapport aux repas (voir DOSAGE ET ADMINISTRATION ).
LOPID subit principalement l'oxydation d'un groupe méthyle cyclique pour former successivement un hydroxyméthyle et un métabolite carboxyle. Environ soixante-dix pour cent de la dose humaine administrée sont excrétés dans l'urine, principalement sous forme de conjugué glucuronide, avec moins de 2 % excrétés sous forme de gemfibrozil inchangé. Six pour cent de la dose sont représentés dans les matières fécales. Le gemfibrozil est fortement lié aux protéines plasmatiques et il existe un potentiel d'interactions de déplacement avec d'autres médicaments (voir PRÉCAUTIONS ).
INFORMATIONS PATIENTS
Aucune information fournie. Veuillez vous référer au AVERTISSEMENTS et PRÉCAUTIONS sections.
