Zanaflex 2mg, 4mg Tizanidine Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Zanaflex 2 mg et comment est-il utilisé ?
Zanaflex 2 mg est un médicament sur ordonnance utilisé pour traiter les symptômes de raideur musculaire (spasticité) associés à des conditions telles que la paralysie cérébrale ou d'autres troubles neurologiques. Zanaflex 2 mg peut être utilisé seul ou avec d'autres médicaments.
Zanaflex 2 mg appartient à une classe de médicaments appelés agonistes alpha-2-adrénergiques centraux.
On ne sait pas si Zanaflex est sûr et efficace chez les enfants.
Quels sont les effets secondaires possibles de Zanaflex ?
Zanaflex 2 mg peut provoquer des effets secondaires graves, notamment :
- Pression artérielle faible,
- tests anormaux de la fonction hépatique,
- somnolence,
- hallucinations,
- somnolence excessive,
- rythme cardiaque lent,
- bouche sèche,
- fatigue, et
- la faiblesse
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Zanaflex incluent :
- bouche sèche,
- fatigue,
- la faiblesse,
- fatigue,
- fatigue,
- vertiges,
- infection urinaire,
- constipation,
- tests anormaux de la fonction hépatique,
- vomissement,
- trouble de la parole,
- œil paresseux (amblyopie),
- fréquence urinaire,
- symptômes de la grippe,
- mouvements musculaires incontrôlés,
- nervosité,
- mal de gorge, et
- nez qui coule
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Zanaflex. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
LA DESCRIPTION
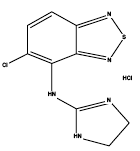
Zanaflex® (chlorhydrate de tizanidine) est un agoniste central alpha2-adrénergique. Le chlorhydrate de tizanidine est une fine poudre cristalline blanche à blanc cassé, inodore ou avec une légère odeur caractéristique. La tizanidine est légèrement soluble dans l'eau et le méthanol ; la solubilité dans l'eau diminue à mesure que le pH augmente. Son nom chimique est le monochlorhydrate de 5-chloro-4-(2- imidazolin-2-ylamino)-2,1,3-benzothiadiazole. La formule moléculaire de la tizanidine est C9H8ClN5S-HCl, son poids moléculaire est de 290,2 et sa formule structurelle est :
Zanaflex 4mg Capsules® est fourni sous forme de capsules de 2, 4 et 6 mg pour une administration orale. Zanaflex Capsules® contient l'ingrédient actif, le chlorhydrate de tizanidine (2,29 mg équivalent à 2 mg de tizanidine base, 4,58 mg équivalent à 4 mg de tizanidine base et 6,87 mg équivalent à 6 mg de tizanidine base), et les ingrédients inactifs, hypromellose, dioxyde de silicium, sphères de sucre, dioxyde de titane, gélatine et colorants.
Les comprimés Zanaflex® sont fournis sous forme de comprimés de 4 mg pour administration orale. Les comprimés Zanaflex® contiennent l'ingrédient actif, le chlorhydrate de tizanidine (4,58 mg équivalant à 4 mg de tizanidine base), et les ingrédients inactifs, le dioxyde de silicium colloïdal, l'acide stéarique, la cellulose microcristalline et le lactose anhydre.
LES INDICATIONS
Zanaflex est indiqué pour la gestion de la spasticité. En raison de la courte durée de l'effet thérapeutique, le traitement par Zanaflex doit être réservé aux activités quotidiennes et aux moments où le soulagement de la spasticité est le plus important [voir DOSAGE ET ADMINISTRATION ].
DOSAGE ET ADMINISTRATION
Informations sur le dosage
Zanaflex 2mg Capsules® ou Zanaflex® comprimés peuvent être prescrits avec ou sans nourriture. Une fois que la formulation a été sélectionnée et que la décision de prendre avec ou sans nourriture a été prise, ce régime ne doit pas être modifié.
Les aliments ont des effets complexes sur la pharmacocinétique de la tizanidine, qui diffèrent selon les différentes formulations. Les capsules Zanaflex et les comprimés Zanaflex sont bioéquivalents l'un à l'autre dans des conditions de jeûne (plus de 3 heures après un repas), mais pas dans des conditions d'alimentation (dans les 30 minutes suivant un repas). Ces différences pharmacocinétiques peuvent entraîner des différences cliniquement significatives lors du changement d'administration de comprimés et de gélules et lors du changement d'administration entre l'état nourri ou à jeun. Ces changements peuvent entraîner une augmentation des événements indésirables ou un début d'activité retardé ou plus rapide, selon la nature du changement. Pour cette raison, le prescripteur doit être parfaitement familiarisé avec les modifications de la cinétique associées à ces différentes affections [voir PHARMACOLOGIE CLINIQUE ].
La dose initiale recommandée est de 2 mg. Étant donné que l'effet de Zanaflex atteint son maximum environ 1 à 2 heures après l'administration et se dissipe entre 3 et 6 heures après l'administration, le traitement peut être répété à des intervalles de 6 à 8 heures, selon les besoins, jusqu'à un maximum de trois doses en 24 heures.
La posologie peut être progressivement augmentée de 2 mg à 4 mg à chaque dose, avec un intervalle de 1 à 4 jours entre les augmentations de dose, jusqu'à l'obtention d'une réduction satisfaisante du tonus musculaire. La dose quotidienne totale ne doit pas dépasser 36 mg. Des doses uniques supérieures à 16 mg n'ont pas été étudiées.
Posologie chez les patients atteints d'insuffisance rénale
Zanaflex doit être utilisé avec prudence chez les insuffisants rénaux (clairance de la créatinine AVERTISSEMENTS ET PRECAUTIONS ].
Posologie chez les patients atteints d'insuffisance hépatique
Zanaflex 4 mg doit être utilisé avec prudence chez les patients présentant une insuffisance hépatique. Chez ces patients, lors de la titration, les doses individuelles doivent être réduites. Si des doses plus élevées sont nécessaires, les doses individuelles plutôt que la fréquence de dosage doivent être augmentées. La surveillance des taux d'aminotransférase est recommandée pour la ligne de base et 1 mois après l'atteinte de la dose maximale, ou si une lésion hépatique est suspectée [voir Utilisation dans des populations spécifiques ].
Arrêt du médicament
Si le traitement doit être interrompu, en particulier chez les patients qui ont reçu des doses élevées (20 mg à 36 mg par jour) pendant de longues périodes (9 semaines ou plus) ou qui peuvent être sous traitement concomitant avec des narcotiques, la dose doit être diminuée lentement ( 2 mg à 4 mg par jour) pour minimiser le risque d'hypertension de sevrage et de rebond, de tachycardie et d'hypertonie [voir Toxicomanie et dépendance ].
COMMENT FOURNIE
Formes posologiques et points forts
Gélules
mg : corps opaque bleu clair avec une coiffe opaque bleu clair avec « 2 MG » imprimé sur la coiffe 4 mg : corps opaque blanc avec une coiffe opaque bleue avec « 4 MG » imprimé sur la coiffe 6 mg : corps opaque bleu avec une bande blanche et capuchon opaque bleu avec "6 MG" imprimé sur le capuchon
Comprimés
Comprimés blancs non pelliculés de 4 mg avec une barre quadrisectionnelle sur une face et gravé « A594 » sur l'autre face
Stockage et manutention
Gélules Zanaflex®
Gélules Zanaflex Capsules® (chlorhydrate de tizanidine) sont disponibles en trois dosages sous forme de capsules de gélatine dure en deux parties contenant du chlorhydrate de tizanidine 2,29 mg, 4,58 mg et 6,87 mg, équivalent à 2 mg, 4 mg et 6 mg de base de tizanidine.
Les gélules de 2 mg ont un corps opaque bleu clair avec une coiffe opaque bleu clair avec « 2 MG » imprimé sur la coiffe : flacons de 150 gélules ( CDN 70515-602-15)
Les gélules de 4 mg ont un corps blanc opaque avec un capuchon bleu opaque avec « 4 MG » imprimé sur le capuchon : flacons de 150 gélules ( CDN 70515-604-15)
Les gélules de 6 mg ont un corps bleu opaque avec une bande blanche et un capuchon bleu opaque avec « 6 MG » imprimé sur les gélules : flacons de 150 gélules ( CDN 70515-606-15)
Conserver à 25 °C (77 °F); excursions permises de 15°C à 30°C (59°F à 86°F) [voir Température ambiante contrôlée USP ]. Distribuer dans des récipients avec fermeture à l'épreuve des enfants.
Comprimés Zanaflex®
Les comprimés Zanaflex® (chlorhydrate de tizanidine) sont disponibles sous forme de comprimés blancs non enrobés de 4 mg contenant 4,58 mg de chlorhydrate de tizanidine, équivalent à 4 mg de tizanidine base. Les comprimés ont un quadrisection sur un côté et sont gravés avec "A594" sur l'autre côté. Les comprimés sont fournis comme suit : flacons de 150 comprimés (NDC 70515-594-15).
Conserver à 25 °C (77 °F); excursions permises de 15°C à 30°C (59°F à 86°F) [voir Température ambiante contrôlée USP ].
Distribuer dans des récipients avec fermeture à l'épreuve des enfants.
Fabriqué pour : Covis Pharma Zug, 6300 Suisse. Révisé : décembre 2020
EFFETS SECONDAIRES
Les effets indésirables suivants sont décrits ailleurs dans d'autres sections des informations de prescription :
- Hypotension [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Lésion hépatique [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Sédation [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Hallucinose/Symptômes pseudo-psychotiques [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Réactions d'hypersensibilité [voir AVERTISSEMENTS ET PRECAUTIONS ]
Expérience des essais cliniques
Étant donné que les études cliniques sont menées dans des conditions très variables, les taux d'effets indésirables observés dans les études cliniques d'un médicament ne peuvent pas être directement comparés aux taux des études cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique clinique.
Trois études cliniques à double insu, randomisées et contrôlées par placebo ont été menées pour évaluer l'effet de la tizanidine sur le contrôle de la spasticité. Deux études ont été menées chez des patients atteints de sclérose en plaques et une chez des patients atteints de lésions de la moelle épinière. Chaque étude comportait une période de traitement actif de 13 semaines qui comprenait une phase de titration de 3 semaines jusqu'à la dose maximale tolérée jusqu'à 36 mg/jour en trois doses fractionnées, une phase de plateau de 9 semaines où la dose de tizanidine était maintenue constante et une Diminution de la dose sur 1 semaine. Au total, 264 patients ont reçu de la tizanidine et 261 patients ont reçu un placebo. Dans les trois études, l'âge des patients variait de 15 à 69 ans et 51,4 % étaient des femmes. La dose médiane pendant la phase de plateau variait de 20 à 28 mg/jour.
Les effets indésirables les plus fréquemment rapportés dans les études cliniques à doses multiples contrôlées contre placebo portant sur 264 patients spastiques étaient la bouche sèche, la somnolence/sédation, l'asthénie (faiblesse, fatigue et/ou fatigue) et les étourdissements. Trois quarts des patients ont qualifié les événements de légers à modérés et un quart des patients ont qualifié les événements de graves. Ces événements semblaient être liés à la dose.
Le tableau 1 énumère les signes et symptômes qui ont été signalés chez plus de 2 % des patients dans trois études à doses multiples contrôlées par placebo qui ont reçu Zanaflex où la fréquence dans le groupe Zanaflex était supérieure à celle du groupe placebo. À des fins de comparaison, la fréquence correspondante de l'événement (pour 100 patients) chez les patients traités par placebo est également fournie.
Dans l'étude à dose unique contrôlée par placebo portant sur 142 patients atteints de spasticité due à la sclérose en plaques (étude 1) [voir Etudes cliniques ], il a été spécifiquement demandé aux patients s'ils avaient présenté l'un des quatre effets indésirables les plus fréquents : bouche sèche, somnolence (somnolence), asthénie (faiblesse, fatigue et/ou fatigue) et étourdissements. De plus, une hypotension et une bradycardie ont été observées. La survenue de ces réactions est résumée dans le tableau 2. D'autres événements ont été, en général, signalés à un taux de 2 % ou moins.
Expérience post-commercialisation
Les effets indésirables suivants ont été identifiés lors de l'utilisation post-approbation de Zanaflex. Étant donné que ces réactions sont signalées volontairement par une population de taille incertaine, il n'est pas toujours possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale avec l'exposition au médicament.
Certains événements, tels que somnolence, bouche sèche, hypotension, diminution de la pression artérielle, bradycardie, étourdissements, faiblesse ou asthénie, spasmes musculaires, hallucinations, fatigue, anomalies des tests de la fonction hépatique et hépatotoxicité, ont été observés dans les essais post-commercialisation et cliniques et sont discutés dans les sections précédentes de ce document.
Les effets indésirables suivants ont été identifiés comme survenant dans l'expérience post-commercialisation de Zanaflex. Sur la base des informations fournies concernant ces réactions, une relation causale avec Zanaflex ne peut être entièrement exclue. Les événements sont répertoriés par ordre décroissant de signification clinique ; la gravité dans le cadre post-commercialisation n'est pas signalée.
- Syndrome de Stevens-Johnson
- Réaction anaphylactique
- Dermatite exfoliative
- Tachycardie ventriculaire
- Hépatite
- Convulsion
- La dépression
- Arthralgie
- Paresthésie
- Éruption
- Tremblement
INTERACTIONS MÉDICAMENTEUSES
Fluvoxamine
L'utilisation concomitante de fluvoxamine et de Zanaflex 4 mg est contre-indiquée. Les modifications de la pharmacocinétique de la tizanidine lorsqu'elle est administrée avec de la fluvoxamine ont entraîné une diminution significative de la pression artérielle, une augmentation de la somnolence et une augmentation des troubles psychomoteurs [voir CONTRE-INDICATIONS et PHARMACOLOGIE CLINIQUE ].
Ciprofloxacine
L'utilisation concomitante de ciprofloxacine et de Zanaflex est contre-indiquée. Les modifications de la pharmacocinétique de la tizanidine lorsqu'elle est administrée avec la ciprofloxacine ont entraîné une diminution significative de la pression artérielle, une augmentation de la somnolence et une augmentation des troubles psychomoteurs [voir CONTRE-INDICATIONS et PHARMACOLOGIE CLINIQUE ].
Inhibiteurs du CYP1A2 autres que la fluvoxamine et la ciprofloxacine
En raison d'interactions médicamenteuses potentielles, l'utilisation concomitante de Zanaflex avec d'autres inhibiteurs du CYP1A2, tels que le zileuton, les fluoroquinolones autres que les inhibiteurs puissants du CYP1A2 (qui sont contre-indiqués), les antiarythmiques (amiodarone, mexilétine, propafénone et vérapamil), la cimétidine, la famotidine, les contraceptifs oraux, acyclovir et ticlopidine) doivent être évités. Si leur utilisation est cliniquement nécessaire, le traitement doit être initié avec une dose de 2 mg et augmenté par paliers de 2 à 4 mg par jour en fonction de la réponse du patient au traitement. En cas d'effets indésirables tels qu'hypotension, bradycardie ou somnolence excessive, réduisez ou arrêtez le traitement par Zanaflex [voir AVERTISSEMENTS ET PRECAUTIONS et PHARMACOLOGIE CLINIQUE ].
Contraceptifs oraux
L'utilisation concomitante de Zanaflex 2 mg avec des contraceptifs oraux n'est pas recommandée. Cependant, si une utilisation concomitante est cliniquement nécessaire, initier Zanaflex 4 mg avec une dose unique de 2 mg et augmenter par paliers de 2 à 4 mg par jour en fonction de la réponse du patient au traitement. En cas d'effets indésirables tels qu'hypotension, bradycardie ou somnolence excessive, réduisez ou arrêtez le traitement par Zanaflex [voir PHARMACOLOGIE CLINIQUE ].
De l'alcool
L'alcool augmente la quantité globale de drogue dans le sang après une dose de Zanaflex. Cela a été associé à une augmentation des effets indésirables de Zanaflex. Les effets dépresseurs sur le SNC de Zanaflex et de l'alcool s'additionnent [voir PHARMACOLOGIE CLINIQUE ].
Autres dépresseurs du SNC
Les effets sédatifs de Zanaflex avec les dépresseurs du SNC (par exemple, les benzodiazépines, les opioïdes, les antidépresseurs tricycliques) peuvent être additifs. Surveillez les patients qui prennent Zanaflex 2mg avec un autre dépresseur du SNC pour des symptômes de sédation excessive [voir PHARMACOLOGIE CLINIQUE ].
Agonistes α2-adrénergiques
Étant donné que les effets hypotenseurs peuvent être cumulatifs, il n'est pas recommandé d'utiliser Zanaflex 4 mg avec d'autres agonistes α2-adrénergiques [voir AVERTISSEMENTS ET PRECAUTIONS ].
Toxicomanie et dépendance
Abuser de
Le potentiel d'abus n'a pas été évalué dans les études humaines. Les rats ont pu distinguer la tizanidine de la solution saline dans un paradigme de discrimination standard, après entraînement, mais n'ont pas réussi à généraliser les effets de la morphine, de la cocaïne, du diazépam ou du phénobarbital à la tizanidine.
Dépendance
La tizanidine est étroitement liée à la clonidine, qui est souvent consommée en combinaison avec des narcotiques et est connue pour provoquer des symptômes de rebond lors d'un sevrage brutal. Trois cas de symptômes de rebond lors d'un arrêt soudain de la tizanidine ont été rapportés. Les rapports de cas suggèrent que ces patients abusaient également de stupéfiants. Les symptômes de sevrage comprenaient l'hypertension, la tachycardie, l'hypertonie, les tremblements et l'anxiété. Les symptômes de sevrage sont plus susceptibles de se produire dans les cas où des doses élevées sont utilisées, en particulier pendant des périodes prolongées, ou avec l'utilisation concomitante de narcotiques. Si le traitement doit être interrompu, la dose doit être diminuée lentement pour minimiser le risque de symptômes de sevrage [voir DOSAGE ET ADMINISTRATION ].
Il a été démontré que les singes s'auto-administrent de la tizanidine de manière dose-dépendante, et l'arrêt brutal de la tizanidine a produit des signes transitoires de sevrage à des doses > 35 fois la dose humaine maximale recommandée sur une base en mg/m². Ces signes de sevrage transitoires (augmentation de la locomotion, contractions corporelles et comportement aversif envers l'observateur) n'ont pas été inversés par l'administration de naloxone.
AVERTISSEMENTS
Inclus dans le cadre du PRÉCAUTIONS section.
PRÉCAUTIONS
Hypotension
La tizanidine est un agoniste α2-adrénergique qui peut provoquer une hypotension. Une syncope a été signalée après la mise sur le marché. Le risque d'hypotension significative peut éventuellement être minimisé en titrant la dose et en concentrant l'attention sur les signes et les symptômes d'hypotension avant l'augmentation de la dose. De plus, les patients passant d'une position couchée à une position verticale fixe peuvent présenter un risque accru d'hypotension et d'effets orthostatiques.
Surveiller l'hypotension lorsque Zanaflex est utilisé chez des patients recevant un traitement antihypertenseur concomitant. Il n'est pas recommandé d'utiliser Zanaflex 2 mg avec d'autres agonistes α2-adrénergiques. Une hypotension cliniquement significative (diminution de la pression systolique et diastolique) a été rapportée lors de l'administration concomitante de fluvoxamine ou de ciprofloxacine et de doses uniques de 4 mg de Zanaflex. Par conséquent, l'utilisation concomitante de Zanaflex avec de la fluvoxamine ou de la ciprofloxacine, de puissants inhibiteurs du CYP1A2, est contre-indiquée [voir CONTRE-INDICATIONS et INTERACTIONS MÉDICAMENTEUSES ].
Risque de lésions hépatiques
Zanaflex peut provoquer des lésions hépatiques hépatocellulaires. Zanaflex 4 mg doit être utilisé avec prudence chez les patients présentant une insuffisance hépatique. La surveillance des taux d'aminotransférase est recommandée pour la ligne de base et 1 mois après l'atteinte de la dose maximale, ou si une lésion hépatique est suspectée [voir DOSAGE ET ADMINISTRATION et Utilisation dans des populations spécifiques ].
Sédation
Zanaflex peut provoquer une sédation, qui peut interférer avec les activités quotidiennes. Dans les études à doses multiples, la prévalence des patients sous sédation a culminé après la première semaine de titration, puis est restée stable pendant toute la durée de la phase d'entretien de l'étude. Les effets dépresseurs du SNC de Zanaflex avec l'alcool et d'autres dépresseurs du SNC (par exemple, les benzodiazépines, les opioïdes, les antidépresseurs tricycliques) peuvent être additifs. Surveiller les patients qui prennent Zanaflex 4mg avec un autre dépresseur du SNC pour des symptômes de sédation excessive [voir INTERACTIONS MÉDICAMENTEUSES ].

Hallucinose/symptômes de type psychotique
L'utilisation de Zanaflex 4 mg a été associée à des hallucinations. Des hallucinations visuelles ou des idées délirantes formées ont été signalées chez 5 des 170 patients (3 %) dans deux études cliniques contrôlées nord-américaines. La plupart des patients étaient conscients que les événements étaient irréels. Un patient a développé une psychose en association avec les hallucinations. Un patient parmi ces 5 a continué à avoir des problèmes pendant au moins 2 semaines après l'arrêt de la tizanidine. Envisagez d'arrêter Zanaflex chez les patients qui développent des hallucinations.
Interaction avec les inhibiteurs du CYP1A2
En raison d'interactions médicamenteuses potentielles, Zanaflex 4 mg est contre-indiqué chez les patients prenant de puissants inhibiteurs du CYP1A2, tels que la fluvoxamine ou la ciprofloxacine. Des effets indésirables tels qu'hypotension, bradycardie ou somnolence excessive peuvent survenir lorsque Zanaflex est pris avec d'autres inhibiteurs du CYP1A2, tels que le zileuton, les fluoroquinolones autres que la ciprofloxacine (qui est contre-indiquée), les antiarythmiques (amiodarone, mexilétine, propafénone), la cimétidine, la famotidine, la contraceptifs, acyclovir et ticlopidine). L'utilisation concomitante doit être évitée sauf si la nécessité d'un traitement par Zanaflex 2 mg est cliniquement évidente. Dans un tel cas, utilisez avec prudence [voir INTERACTIONS MÉDICAMENTEUSES et PHARMACOLOGIE CLINIQUE ].
Réactions d'hypersensibilité
Zanaflex peut provoquer une anaphylaxie. Des signes et symptômes, notamment une insuffisance respiratoire, de l'urticaire et un œdème de Quincke de la gorge et de la langue, ont été signalés. Les patients doivent être informés des signes et symptômes de réactions allergiques sévères et doivent interrompre Zanaflex et consulter immédiatement un médecin si ces signes et symptômes apparaissent [voir CONTRE-INDICATIONS ].
Risque accru d'effets indésirables chez les patients atteints d'insuffisance rénale
Zanaflex doit être utilisé avec prudence chez les insuffisants rénaux (clairance de la créatinine DOSAGE ET ADMINISTRATION et Utilisation dans des populations spécifiques ].
Effets indésirables au sevrage
Les effets indésirables de sevrage comprennent l'hypertension rebond, la tachycardie et l'hypertonie. Pour minimiser le risque de ces réactions, en particulier chez les patients qui ont reçu des doses élevées (20 à 28 mg par jour) pendant de longues périodes (9 semaines ou plus) ou qui peuvent être sous traitement concomitant avec des narcotiques, la dose doit être diminuée. lentement (2 à 4 mg par jour) [voir DOSAGE ET ADMINISTRATION ].
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Carcinogenèse
La tizanidine a été administrée à des souris pendant 78 semaines à des doses orales allant jusqu'à 16 mg/kg/jour, soit 2 fois la dose humaine recommandée maximale (MRHD) de 36 mg/jour sur une base de surface corporelle (mg/m²). La tizanidine a été administrée à des rats pendant 104 semaines à des doses orales allant jusqu'à 9 mg/kg/jour, soit 2,5 fois la MRHD en mg/m². Il n'y a pas eu d'augmentation des tumeurs chez les deux espèces.
Mutagenèse
La tizanidine était négative dans les tests in vitro (mutation bactérienne inverse [Ames], mutation du gène de mammifère et test d'aberration chromosomique dans les cellules de mammifère) et in vivo (micronoyau de la moelle osseuse et cytogénétique).
Altération de la fertilité
L'administration orale de tizanidine à des rats avant et pendant l'accouplement et poursuivie au début de la grossesse chez les femelles a entraîné une diminution de la fertilité chez les rats mâles et femelles à des doses de 30 et 10 mg/kg/jour, respectivement. Aucun effet sur la fertilité n'a été observé aux doses de 10 (mâle) et 3 (femelle) mg/kg/jour, qui sont respectivement environ 3 fois et similaires à la MRHD, sur une base mg/m².
Utilisation dans des populations spécifiques
Grossesse
Résumé des risques
Il n'y a pas de données adéquates sur le risque de développement associé à l'utilisation de Zanaflex 2 mg chez la femme enceinte. Dans les études animales, l'administration de tizanidine pendant la grossesse a entraîné une toxicité développementale (mortalité embryofœtale et postnatale de la progéniture et déficits de croissance) à des doses inférieures à celles utilisées en clinique, qui n'étaient pas associées à une toxicité maternelle (voir Données animales ).
Dans la population générale des États-Unis, le risque de fond estimé de malformations congénitales majeures et de fausse couche dans les grossesses cliniquement reconnues est de 2 % à 4 % et de 15 % à 20 %, respectivement. Le risque de fond de malformations congénitales majeures et de fausse couche pour la population indiquée est inconnu.
Données
Données animales
L'administration orale de tizanidine (0,3 à 100 mg/kg/jour) à des rats gravides pendant la période d'organogenèse a entraîné une mortalité embryofœtale et postnatale de la progéniture et une réduction du poids corporel à des doses de 30 mg/kg/jour et plus. Une toxicité maternelle a été observée à la dose la plus élevée testée. La dose sans effet sur la toxicité pour le développement embryofœtal chez le rat (3 mg/kg/jour) est similaire à la dose humaine maximale recommandée (MRHD) de 36 mg/jour sur une base de surface corporelle (mg/m²).
L'administration orale de tizanidine (1 à 100 mg/kg/jour) à des lapines gravides pendant la période d'organogenèse a entraîné une mortalité embryofœtale et postnatale de la progéniture à toutes les doses. Une toxicité maternelle a été observée à la dose la plus élevée testée. L'administration orale de tizanidine (10 et 30 mg/kg/jour) pendant la période périnatale de la grossesse (2 à 6 jours avant l'accouchement) a entraîné une augmentation de la mortalité postnatale de la progéniture aux deux doses. Une dose sans effet sur la toxicité pour le développement embryofœtal chez le lapin n'a pas été identifiée. La plus faible dose testée (1 mg/kg/jour) est inférieure à la MRHD exprimée en mg/m².
Dans une étude sur le développement prénatal et postnatal chez le rat, l'administration orale de tizanidine (3 à 30 mg/kg/jour) a entraîné une augmentation de la mortalité postnatale de la progéniture. Aucune dose sans effet sur la toxicité pour le développement prénatal et postnatal n'a été identifiée. La dose la plus faible testée (3 mg/kg/jour) est similaire à la MRHD sur une base mg/m², respectivement.
Lactation
Résumé des risques
Il n'y a pas de données sur la présence de tizanidine dans le lait maternel, les effets sur le nourrisson allaité ou les effets sur la production de lait maternel. Des études animales ont rapporté la présence de tizanidine dans le lait d'animaux en lactation.
Les avantages de l'allaitement pour le développement et la santé doivent être pris en compte, ainsi que le besoin clinique de Zanaflex 4 mg pour la mère et tout effet indésirable potentiel sur le nourrisson allaité de Zanaflex ou de l'affection maternelle sous-jacente.
Femelles et mâles de potentiel reproducteur
Il n'y a pas d'études adéquates et bien contrôlées chez l'homme sur l'effet de Zanaflex 4 mg sur le potentiel reproducteur féminin ou masculin. L'administration orale de tizanidine à des rats mâles et femelles a entraîné des effets indésirables sur la fertilité [voir Toxicologie non clinique ].
Utilisation pédiatrique
L'innocuité et l'efficacité chez les patients pédiatriques n'ont pas été établies.
Utilisation gériatrique
Zanaflex 2 mg est connu pour être en grande partie excrété par les reins, et le risque de réactions indésirables à ce médicament peut être plus élevé chez les patients présentant une insuffisance rénale. Étant donné que les patients âgés sont plus susceptibles d'avoir une fonction rénale diminuée, des précautions doivent être prises lors du choix de la dose et il peut être utile de surveiller la fonction rénale.
Les études cliniques de Zanaflex 2 mg n'ont pas inclus un nombre suffisant de sujets âgés de 65 ans et plus pour déterminer s'ils répondent différemment des sujets plus jeunes. La comparaison entre études des données pharmacocinétiques après l'administration d'une dose unique de 6 mg de Zanaflex 2 mg a montré que les sujets plus jeunes éliminaient le médicament quatre fois plus rapidement que les sujets âgés. Chez les patients âgés insuffisants rénaux (clairance de la créatinine
Fonction rénale altérée
Zanaflex est connu pour être en grande partie excrété par les reins, et le risque de réactions indésirables à ce médicament peut être plus élevé chez les patients présentant une insuffisance rénale. Chez les insuffisants rénaux (clairance de la créatinine DOSAGE ET ADMINISTRATION , AVERTISSEMENTS ET PRECAUTIONS et PHARMACOLOGIE CLINIQUE ].
Fonction hépatique altérée
L'influence de l'insuffisance hépatique sur la pharmacocinétique de la tizanidine n'a pas été évaluée. Étant donné que la tizanidine est largement métabolisée dans le foie, une insuffisance hépatique devrait avoir des effets significatifs sur la pharmacocinétique de la tizanidine [voir POSOLOGIE ET ADMINISTRATION , AVERTISSEMENTS ET PRECAUTIONS , et PHARMACOLOGIE CLINIQUE ].
SURDOSAGE
Un examen de la base de données de surveillance de la sécurité a révélé des cas de surdosage intentionnel et accidentel de Zanaflex. Certains des cas ont entraîné la mort et bon nombre des surdoses intentionnelles concernaient plusieurs médicaments, y compris des dépresseurs du SNC. Les manifestations cliniques du surdosage en tizanidine étaient compatibles avec sa pharmacologie connue. Dans la majorité des cas, une diminution du sensorium a été observée, y compris la léthargie, la somnolence, la confusion et le coma. Une fonction cardiaque déprimée est également observée incluant le plus souvent une bradycardie et une hypotension. La dépression respiratoire est une autre caractéristique courante du surdosage en tizanidine.
En cas de surdosage, des mesures de base pour assurer l'adéquation des voies respiratoires et la surveillance des systèmes cardiovasculaire et respiratoire doivent être entreprises. La tizanidine est un médicament liposoluble, qui n'est que légèrement soluble dans l'eau et le méthanol. Par conséquent, la dialyse n'est probablement pas une méthode efficace pour éliminer le médicament du corps. En général, les symptômes disparaissent en un à trois jours après l'arrêt de la tizanidine et l'administration d'un traitement approprié. En raison du mécanisme d'action similaire, les symptômes et la prise en charge d'un surdosage en tizanidine sont similaires à ceux d'un surdosage en clonidine. Pour obtenir les informations les plus récentes concernant la prise en charge d'un surdosage, contactez un centre antipoison.
CONTRE-INDICATIONS
Zanaflex est contre-indiqué chez les patients prenant des inhibiteurs puissants du CYP1A2, tels que la fluvoxamine ou la ciprofloxacine [voir INTERACTIONS MÉDICAMENTEUSES ].
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
La tizanidine est un agoniste central des récepteurs alpha-2-adrénergiques et réduit vraisemblablement la spasticité en augmentant l'inhibition présynaptique des motoneurones. Les effets de la tizanidine sont les plus importants sur les voies polysynaptiques. On pense que l'effet global de ces actions réduit la facilitation des motoneurones spinaux.
Pharmacocinétique
Absorption et distribution
Après administration orale, la tizanidine est essentiellement complètement absorbée. La biodisponibilité orale absolue de la tizanidine est d'environ 40 % (CV = 24 %), en raison d'un important métabolisme hépatique de premier passage. La tizanidine est largement distribuée dans tout l'organisme avec un volume de distribution moyen à l'état d'équilibre de 2,4 L/kg (CV = 21 %) après administration intraveineuse chez des volontaires adultes sains. La tizanidine est liée à environ 30 % aux protéines plasmatiques.
Différences entre Zanaflex 4mg Capsules® et Zanaflex® Tablets
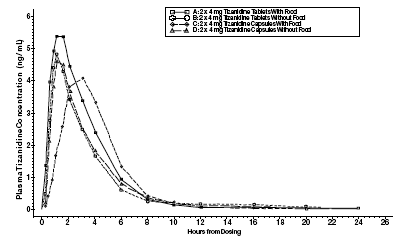
Zanaflex 2mg Capsules® et les comprimés Zanaflex® sont bioéquivalents l'un à l'autre dans des conditions de jeûne, mais pas dans des conditions d'alimentation. Une dose unique de deux comprimés de 4 mg ou de deux gélules de 4 mg a été administrée dans des conditions d'alimentation et de jeûne dans une étude croisée randomisée ouverte de quatre périodes chez 96 volontaires humains, dont 81 étaient éligibles pour l'analyse statistique. Suite à l'administration orale du comprimé ou de la capsule (à jeun), les concentrations plasmatiques maximales de tizanidine sont survenues 1,0 heure après l'administration avec une demi-vie d'environ 2 heures. Lorsque deux comprimés de 4 mg ont été administrés avec de la nourriture, la concentration plasmatique maximale moyenne a augmenté d'environ 30 % et le temps médian jusqu'au pic de concentration plasmatique a augmenté de 25 minutes, à 1 heure et 25 minutes. En revanche, lorsque deux gélules de 4 mg ont été administrées avec de la nourriture, la concentration plasmatique maximale moyenne a diminué de 20 %, le temps médian jusqu'au pic de concentration plasmatique a augmenté de 2 à 3 heures. Par conséquent, la Cmax moyenne de la gélule lorsqu'elle est administrée avec de la nourriture est d'environ 66 % de la Cmax du comprimé lorsqu'elle est administrée avec de la nourriture. La nourriture a également augmenté le degré d'absorption des comprimés et des gélules. L'augmentation avec le comprimé (~30 %) était significativement plus importante qu'avec la gélule (~10 %). Par conséquent, lorsque chacun était administré avec de la nourriture, la quantité absorbée par la capsule était d'environ 80 % de la quantité absorbée par le comprimé. L'administration du contenu de la gélule saupoudré sur de la compote de pommes n'était pas bioéquivalente à l'administration d'une gélule intacte à jeun. L'administration du contenu de la capsule sur de la compote de pommes a entraîné une augmentation de 15 % à 20 % de la Cmax et de l'ASC de la tizanidine et une diminution de 15 minutes du temps de latence médian et du temps jusqu'à la concentration maximale par rapport à l'administration d'une capsule intacte à jeun.
Figure 1 : Concentration moyenne de tizanidine par rapport aux profils de temps pour les comprimés et gélules de Zanaflex (2 × 4 mg) à jeun et à jeun
Métabolisme et excrétion
La tizanidine a une pharmacocinétique linéaire sur les doses étudiées en développement clinique (1-20 mg). La tizanidine a une demi-vie d'environ 2,5 heures (CV = 33 %). Environ 95 % d'une dose administrée est métabolisée. La principale isoenzyme du cytochrome P450 impliquée dans le métabolisme de la tizanidine est le CYP1A2. Les métabolites de la tizanidine ne sont pas connus pour être actifs ; leurs demi-vies varient de 20 à 40 heures.
Après administration orale unique et répétée de 14C-tizanidine, une moyenne de 60 % et 20 % de la radioactivité totale a été récupérée dans l'urine et les fèces, respectivement.
Populations spécifiques
Effets de l'âge
Aucune étude pharmacocinétique spécifique n'a été menée pour étudier les effets de l'âge. La comparaison croisée des données pharmacocinétiques après l'administration d'une dose unique de 6 mg de Zanaflex 2 mg a montré que les sujets plus jeunes éliminaient le médicament quatre fois plus rapidement que les sujets âgés. Zanaflex 4mg n'a pas été évalué chez les enfants [voir Utilisation dans des populations spécifiques ].
Insuffisance hépatique
L'influence de l'insuffisance hépatique sur la pharmacocinétique de la tizanidine n'a pas été évaluée. Étant donné que la tizanidine est largement métabolisée dans le foie, une insuffisance hépatique devrait avoir des effets significatifs sur la pharmacocinétique de la tizanidine. Zanaflex n'est pas recommandé dans cette population de patients [voir Utilisation dans des populations spécifiques ].
Insuffisance rénale
La clairance de la tizanidine est réduite de plus de 50 % chez les patients âgés insuffisants rénaux (clairance de la créatinine AVERTISSEMENTS ET PRECAUTIONS et Utilisation dans des populations spécifiques ].
Effets de genre
Aucune étude pharmacocinétique spécifique n'a été menée pour étudier les effets liés au sexe. Cependant, l'analyse rétrospective des données pharmacocinétiques, suite à l'administration d'une dose unique et de doses multiples de 4 mg de Zanaflex 2 mg, a montré que le sexe n'avait aucun effet sur la pharmacocinétique de la tizanidine.
Effets de course
Les différences pharmacocinétiques dues à la race n'ont pas été étudiées.
Interactions médicamenteuses
Inhibiteurs du CYP1A2
L'interaction entre Zanaflex et la fluvoxamine ou la ciprofloxacine est très probablement due à l'inhibition du CYP1A2 par la fluvoxamine ou la ciprofloxacine. L'effet de la fluvoxamine sur la pharmacocinétique d'une dose unique de 4 mg de Zanaflex a été étudié chez 10 sujets sains. La Cmax, l'ASC et la demi-vie de la tizanidine ont été respectivement multipliées par 12, 33 et 3. L'effet de la ciprofloxacine sur la pharmacocinétique d'une dose unique de 4 mg de Zanaflex 4 mg a été étudié chez 10 sujets sains. La Cmax et l'ASC de la tizanidine ont été respectivement multipliées par 7 et 10 [voir CONTRE-INDICATIONS ].
Bien qu'il n'y ait pas eu d'études cliniques évaluant les effets d'autres inhibiteurs du CYP1A2 sur la tizanidine, d'autres inhibiteurs du CYP1A2, tels que le zileuton, d'autres fluoroquinolones, les antiarythmiques (amiodarone, mexilétine, propafénone et vérapamil), la cimétidine, la famotidine, les contraceptifs oraux, l'acyclovir et la ticlopidine, peut également entraîner une augmentation substantielle des concentrations sanguines de tizanidine [voir AVERTISSEMENTS ET PRECAUTIONS ].
Des études in vitro des isoenzymes du cytochrome P450 utilisant des microsomes hépatiques humains indiquent que ni la tizanidine ni les principaux métabolites ne sont susceptibles d'affecter le métabolisme d'autres médicaments métabolisés par les isoenzymes du cytochrome P450.
Contraceptifs oraux
Aucune étude pharmacocinétique spécifique n'a été menée pour étudier l'interaction entre les contraceptifs oraux et Zanaflex. L'analyse rétrospective des données pharmacocinétiques de population suite à l'administration d'une dose unique et de doses multiples de 4 mg de Zanaflex a cependant montré que les femmes prenant simultanément des contraceptifs oraux présentaient une clairance de tizanidine inférieure de 50 % par rapport aux femmes ne prenant pas de contraceptifs oraux [voir AVERTISSEMENTS ET PRECAUTIONS ].
Acétaminophène
La tizanidine a retardé le Tmax de l'acétaminophène de 16 minutes. L'acétaminophène n'a pas affecté la pharmacocinétique de la tizanidine.
De l'alcool
L'alcool a augmenté l'ASC de la tizanidine d'environ 20 %, tout en augmentant également sa Cmax d'environ 15 %. Cela a été associé à une augmentation des effets secondaires de la tizanidine. Les effets dépresseurs sur le SNC de la tizanidine et de l'alcool sont additifs.
Etudes cliniques
La capacité de la tizanidine à réduire l'augmentation du tonus musculaire associée à la spasticité a été démontrée dans deux études adéquates et bien contrôlées chez des patients atteints de sclérose en plaques ou de lésions de la moelle épinière (études 1 et 2).
Étude à dose unique chez des patients atteints de sclérose en plaques avec spasticité
Dans l'étude 1, les patients atteints de sclérose en plaques ont été randomisés pour recevoir des doses orales uniques de médicament ou un placebo. Les patients et les évaluateurs étaient aveugles à l'attribution du traitement et des efforts ont été faits pour réduire la probabilité que les évaluateurs prennent indirectement connaissance de l'attribution du traitement (p. ex., ils ne fournissaient pas de soins directs aux patients et il leur était interdit de poser des questions sur les effets secondaires). Au total, 140 patients ont reçu un placebo, 8 mg ou 16 mg de Zanaflex.
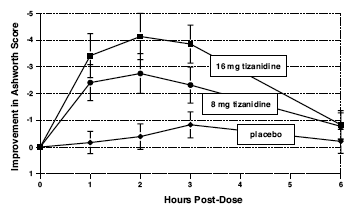
La réponse a été évaluée par un examen physique ; le tonus musculaire a été évalué sur une échelle de 5 points (score d'Ashworth), avec un score de 0 utilisé pour décrire le tonus musculaire normal. Un score de 1 indiquait une légère prise spasmodique tandis qu'un score de 2 indiquait une résistance musculaire plus marquée. Un score de 3 a été utilisé pour décrire une augmentation considérable du tonus, rendant les mouvements passifs difficiles. Un muscle immobilisé par la spasticité a reçu un score de 4. Les comptages de spasmes ont également été collectés.
Les évaluations ont été faites à 1, 2, 3 et 6 heures après le traitement. Une réduction statistiquement significative du score d'Ashworth pour Zanaflex 2 mg par rapport au placebo a été détectée 1, 2 et 3 heures après le traitement. La figure 2 ci-dessous montre une comparaison de la variation moyenne du tonus musculaire par rapport à la ligne de base, telle que mesurée par l'échelle d'Ashworth. La plus grande réduction du tonus musculaire était de 1 à 2 heures après le traitement. 6 heures après le traitement, le tonus musculaire dans les groupes 8 et 16 mg de Zanaflex 2 mg était indiscernable du tonus musculaire chez les patients traités par placebo. Chez un patient donné, l'amélioration du tonus musculaire était corrélée à la concentration plasmatique. Les concentrations plasmatiques étaient variables d'un patient à l'autre à une dose donnée. Bien que 16 mg aient produit un effet plus important, les événements indésirables, y compris l'hypotension, étaient plus fréquents et plus graves que dans le groupe 8 mg. Il n'y avait aucune différence dans le nombre de spasmes survenant dans chaque groupe.
Figure 2 : Étude à dose unique - Changement moyen du tonus musculaire par rapport au départ tel que mesuré par l'échelle d'Ashworth ± intervalle de confiance à 95 % (un score d'Ashworth négatif signifie une amélioration du tonus musculaire par rapport au départ)
Étude de sept semaines chez des patients atteints de lésions de la moelle épinière avec spasticité
Dans une étude de 7 semaines (étude 2), 118 patients souffrant de spasticité secondaire à une lésion de la moelle épinière ont été randomisés pour recevoir soit un placebo soit Zanaflex. Des mesures similaires à celles prises dans la première étude ont été employées pour assurer l'intégrité de l'insu.
Les patients ont été titrés sur 3 semaines jusqu'à une dose maximale tolérée ou 36 mg par jour administrés en trois doses inégales (p. ex., 10 mg administrés le matin et l'après-midi et 16 mg administrés le soir). Les patients ont ensuite été maintenus à leur dose maximale tolérée pendant 4 semaines supplémentaires (c'est-à-dire la phase d'entretien). Tout au long de la phase d'entretien, le tonus musculaire a été évalué sur l'échelle d'Ashworth sur une période de 2,5 heures après la dose du matin ou de l'après-midi. Le nombre de spasmes diurnes a été enregistré quotidiennement par les patients.
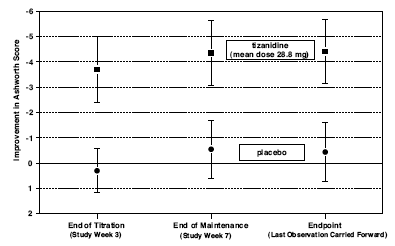
Au point final (le moment de l'évaluation des résultats spécifié par le protocole), il y avait une réduction statistiquement significative du tonus musculaire et de la fréquence des spasmes dans le groupe traité par Zanaflex par rapport au groupe placebo. La réduction du tonus musculaire n'a pas été associée à une réduction de la force musculaire (un résultat souhaitable) mais n'a pas non plus conduit à un avantage constant des patients traités par Zanaflex sur les mesures des activités de la vie quotidienne. La figure 3 ci-dessous montre une comparaison de la variation moyenne du tonus musculaire par rapport au départ, telle que mesurée par l'échelle d'Ashworth.
Figure 3 : Étude de sept semaines - Changement moyen du tonus musculaire 0,5 à 2,5 heures après l'administration tel que mesuré par l'échelle d'Ashworth ± intervalle de confiance à 95 % (un score d'Ashworth négatif signifie une amélioration du tonus musculaire par rapport à la ligne de base)
INFORMATIONS PATIENTS
Interactions médicamenteuses graves
Aviser les patients qu'ils ne doivent pas prendre Zanaflex s'ils prennent de la fluvoxamine ou de la ciprofloxacine en raison du risque accru d'effets indésirables graves, y compris une baisse sévère de la pression artérielle et une sédation. Demandez aux patients d'informer leur médecin ou leur pharmacien lorsqu'ils commencent ou arrêtent de prendre un médicament en raison des risques associés à l'interaction entre Zanaflex et d'autres médicaments.
Dosage de Zanaflex
Dites aux patients de prendre Zanaflex 2 mg exactement comme prescrit (systématiquement avec ou sans nourriture) et de ne pas alterner entre les comprimés et les gélules. Informez les patients qu'ils ne doivent pas prendre plus de Zanaflex 2 mg que prescrit en raison du risque d'effets indésirables à des doses uniques supérieures à 8 mg ou à des doses quotidiennes totales supérieures à 36 mg. Dites aux patients qu'ils ne doivent pas interrompre brusquement Zanaflex 4 mg, car une hypertension rebond et une tachycardie peuvent survenir.
Effets de Zanaflex
Avertissez les patients qu'ils peuvent souffrir d'hypotension et qu'ils doivent être prudents lorsqu'ils passent d'une position allongée ou assise à une position debout. Dites aux patients que Zanaflex peut provoquer une sédation ou une somnolence et qu'ils doivent être prudents lorsqu'ils effectuent des activités nécessitant de la vigilance, telles que la conduite d'un véhicule ou l'utilisation de machines. Dites aux patients que la sédation peut être additive lorsque Zanaflex 4 mg est pris en association avec des médicaments (baclofène, benzodiazépines) ou des substances (par exemple, l'alcool) qui agissent comme des dépresseurs du SNC. Rappelez aux patients que s'ils dépendent de leur spasticité pour maintenir la posture et l'équilibre dans la locomotion, ou chaque fois que la spasticité est utilisée pour obtenir une fonction accrue, Zanaflex diminue la spasticité et la prudence doit être utilisée.
