Elocon 5g Mometasone Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce qu'Elocon 5g et comment est-il utilisé ?
La crème Elocon (furoate de mométasone) à 0,1 % est une crème, une lotion ou une pommade topique corticostéroïde indiquée pour le soulagement des manifestations inflammatoires et prurigineuses des dermatoses sensibles aux corticostéroïdes chez les patients âgés de 2 ans ou plus.
Quels sont les effets secondaires d'Elocon 5g ?
Les effets secondaires courants d'Elocon comprennent :
- démangeaison de la peau,
- démangeaison,
- brûlant,
- rougeur,
- sécheresse,
- amincissement ou ramollissement de votre peau,
- éruption cutanée ou irritation autour de la bouche,
- follicules pileux gonflés,
- veines araignées,
- engourdissement ou fourmillement,
- changements de couleur de la peau traitée,
- ampoules,
- boutons,
- formation de croûtes sur la peau traitée, ou
- vergetures.
LA DESCRIPTION
La crème ELOCON (furoate de mométasone) à 0,1 % contient du furoate de mométasone pour usage topique. Le furoate de mométasone est un corticostéroïde synthétique à activité anti-inflammatoire.
Chimiquement, le furoate de mométasone est le 9α,21-dichloro-11β,17-dihydroxy-16α-méthylprégna-1,4-diène3,20-dione 17-(2-furoate), avec la formule empirique C27 H30CI2O6, un poids moléculaire de 521,4 et la formule structurale suivante :
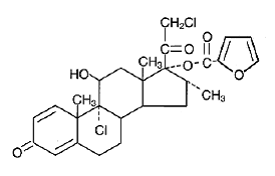
Le furoate de mométasone est une poudre blanche à blanc cassé pratiquement insoluble dans l'eau, légèrement soluble dans l'octanol et modérément soluble dans l'alcool éthylique.
Chaque gramme de crème ELOCON 5g, 0,1% contient 1 mg de furoate de mométasone dans une base de crème blanc à blanc cassé d'octénylsuccinate d'amidon d'aluminium (irradié aux rayons gamma), hexylène glycol, lécithine de soja hydrogénée, acide phosphorique, eau purifiée, dioxyde de titane, blanc doux paraffine et cire blanche.
LES INDICATIONS
La crème ELOCON® est un corticostéroïde indiqué pour le soulagement des manifestations inflammatoires et prurigineuses des dermatoses répondant aux corticostéroïdes chez les patients âgés de 2 ans ou plus.
DOSAGE ET ADMINISTRATION
Appliquez une fine couche de crème ELOCON sur les zones cutanées affectées une fois par jour. La crème ELOCON peut être utilisée chez les patients pédiatriques âgés de 2 ans ou plus. Étant donné que la sécurité et l'efficacité de la crème ELOCON n'ont pas été établies chez les patients pédiatriques de moins de 2 ans ; l'utilisation dans ce groupe d'âge n'est pas recommandée [voir AVERTISSEMENTS ET PRECAUTIONS et Utilisation dans des populations spécifiques ].
Le traitement doit être interrompu lorsque le contrôle est obtenu. Si aucune amélioration n'est observée dans les 2 semaines, une réévaluation du diagnostic peut être nécessaire. L'innocuité et l'efficacité de la crème ELOCON chez les patients pédiatriques pendant plus de 3 semaines d'utilisation n'ont pas été établies.
La crème ELOCON ne doit pas être utilisée avec des pansements occlusifs, sauf indication contraire d'un médecin. ELOCON 5g Crème ne doit pas être appliqué au niveau du siège si l'enfant a encore besoin de couches ou de culottes en plastique, car ces vêtements peuvent constituer un pansement occlusif.
La crème ELOCON est à usage topique uniquement. Il n'est pas destiné à une utilisation orale, ophtalmique ou intravaginale.
Évitez de l'utiliser sur le visage, l'aine ou les aisselles.
COMMENT FOURNIE
Formes posologiques et points forts
Crème, 0,1 %. Chaque gramme de crème ELOCON contient 1 mg de furoate de mométasone dans une base de crème lisse et homogène de couleur blanche à blanc cassé.
Stockage et manutention
Crème ELOCON est de couleur blanche à blanc cassé et fourni en 15 grammes (NDC 0085-3149-01) et 50 grammes ( CDN 0085-3149-03).
Conserver à 25 °C (77 °F); excursions autorisées jusqu'à 15-30°C (59-86°F) [voir Température ambiante contrôlée USP ]. Évitez la chaleur excessive.
Fabriqué pour : Merck Sharp & Dohme Corp., une filiale de Merck & Co., Inc., Whitehouse Station, NJ 08889, USA. Fabriqué par : Schering-Plough Labo NV Heist-op-den-Berg, Belgique. Révisé : avril 2013
EFFETS SECONDAIRES
Étant donné que les essais cliniques sont menés dans des conditions très variables, les taux d'effets indésirables observés dans les essais cliniques d'un médicament ne peuvent pas être directement comparés aux taux des essais cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique clinique.
Dans des essais cliniques contrôlés portant sur 319 sujets, l'incidence des effets indésirables associés à l'utilisation de la crème ELOCON 5 g était de 1,6 %. Les réactions signalées comprenaient des brûlures, du prurit et une atrophie cutanée. Des cas de rosacée associés à l'utilisation de la crème ELOCON 5g ont également été signalés. Dans les essais cliniques contrôlés (n = 74) impliquant des sujets pédiatriques âgés de 2 à 12 ans, l'incidence des effets indésirables associés à l'utilisation de la crème ELOCON 5 g était d'environ 7 %. Les réactions signalées comprenaient des picotements, du prurit et de la furonculose.
Les effets indésirables suivants ont été signalés comme pouvant ou probablement être liés au traitement par la crème ELOCON 5g au cours des essais cliniques chez 4 % des 182 sujets pédiatriques âgés de 6 mois à 2 ans : diminution des taux de glucocorticoïdes, 2 ; paresthésie, 2 ; folliculite, 1 ; candidose, 1 ; infection bactérienne, 1 ; dépigmentation de la peau, 1. Les signes suivants d'atrophie cutanée ont également été observés chez 97 sujets traités avec la crème ELOCON dans un essai clinique : brillance, 4 ; télangiectasies, 1 ; perte d'élasticité, 4 ; perte des marques cutanées normales, 4 ; minceur, 1 ; et ecchymoses, 1.
Les effets indésirables locaux supplémentaires suivants ont été rapportés avec les corticostéroïdes topiques, mais peuvent survenir plus fréquemment avec l'utilisation de pansements occlusifs. Ces réactions sont les suivantes : irritation, sécheresse, folliculite, hypertrichose, éruptions acnéiformes, hypopigmentation, dermatite périorale, dermatite de contact allergique, infection secondaire, vergetures et miliaire.
INTERACTIONS MÉDICAMENTEUSES
Aucune étude d'interaction médicamenteuse n'a été menée avec la crème ELOCON.
AVERTISSEMENTS
Inclus dans le cadre du PRÉCAUTIONS section.
PRÉCAUTIONS
Effets sur le système endocrinien
L'absorption systémique de corticostéroïdes topiques peut produire une suppression réversible de l'axe hypothalamo-hypophyso-surrénalien (HHS) avec un potentiel d'insuffisance en glucocorticostéroïdes. Cela peut survenir pendant le traitement ou après l'arrêt du traitement. Des manifestations du syndrome de Cushing, de l'hyperglycémie et de la glycosurie peuvent également être produites chez certains patients par l'absorption systémique de corticostéroïdes topiques pendant le traitement. Les facteurs qui prédisposent un patient utilisant un corticostéroïde topique à la suppression de l'axe HPA comprennent l'utilisation de stéroïdes puissants, de grandes surfaces de traitement, une utilisation prolongée, l'utilisation de pansements occlusifs, une altération de la barrière cutanée, une insuffisance hépatique et le jeune âge.
En raison du potentiel d'absorption systémique, l'utilisation de corticostéroïdes topiques peut nécessiter que les patients soient périodiquement évalués pour la suppression de l'axe HPA. Cela peut être fait en utilisant le test de stimulation de l'hormone adrénocorticotrope (ACTH).
Dans une étude évaluant les effets de la crème de furoate de mométasone sur l'axe HPA, 15 grammes ont été appliqués deux fois par jour pendant 7 jours à six sujets adultes atteints de psoriasis ou de dermatite atopique. Les résultats montrent que le médicament a provoqué une légère baisse de la sécrétion de corticostéroïdes surrénaliens.
Si la suppression de l'axe HPA est notée, une tentative doit être faite pour retirer progressivement le médicament, pour réduire la fréquence d'application ou pour remplacer un corticostéroïde moins puissant. La récupération de la fonction de l'axe HPA est généralement rapide après l'arrêt des corticostéroïdes topiques. Rarement, des signes et des symptômes d'insuffisance en glucocorticostéroïdes peuvent survenir, nécessitant des corticostéroïdes systémiques supplémentaires.
Les patients pédiatriques peuvent être plus sensibles à la toxicité systémique à des doses équivalentes en raison de leur plus grand rapport surface cutanée/masse corporelle [voir Utilisation dans des populations spécifiques ].
Dermatite allergique de contact
Si une irritation se développe, la crème ELOCON doit être interrompue et un traitement approprié institué. La dermatite de contact allergique aux corticostéroïdes est généralement diagnostiquée en observant un défaut de cicatrisation plutôt qu'en notant une exacerbation clinique comme avec la plupart des produits topiques ne contenant pas de corticostéroïdes. Une telle observation doit être corroborée par des tests de patch diagnostiques appropriés.
Infections cutanées concomitantes
Si des infections cutanées concomitantes sont présentes ou se développent, un agent antifongique ou antibactérien approprié doit être utilisé. Si une réponse favorable ne se produit pas rapidement, l'utilisation d'ELOCON 5g Crème doit être interrompue jusqu'à ce que l'infection ait été correctement contrôlée.

Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Aucune étude animale à long terme n'a été réalisée pour évaluer le potentiel carcinogène de la crème ELOCON 5g. Des études de cancérogénicité à long terme du furoate de mométasone ont été menées par inhalation chez le rat et la souris. Dans une étude de cancérogénicité de 2 ans chez des rats Sprague Dawley, le furoate de mométasone n'a démontré aucune augmentation statistiquement significative des tumeurs à des doses d'inhalation allant jusqu'à 67 mcg/kg (environ 0,04 fois la dose topique clinique maximale estimée de la crème ELOCON 5g sur une base mcg/m² ). Dans une étude de cancérogénicité de 19 mois chez des souris Swiss CD-1, le furoate de mométasone n'a démontré aucune augmentation statistiquement significative de l'incidence des tumeurs à des doses d'inhalation allant jusqu'à 160 mcg/kg (environ 0,05 fois la dose topique clinique maximale estimée de la crème ELOCON sur un base mcg/m²).
Le furoate de mométasone a augmenté les aberrations chromosomiques dans un essai in vitro sur des cellules ovariennes de hamster chinois, mais n'a pas augmenté les aberrations chromosomiques dans un essai in vitro sur des cellules pulmonaires de hamster chinois. Le furoate de mométasone ne s'est pas révélé mutagène dans le test d'Ames ou dans le test du lymphome de souris, et n'a pas été clastogène dans un test in vivo du micronoyau chez la souris, un test d'aberration chromosomique de la moelle osseuse de rat ou un test d'aberration chromosomique des cellules germinales mâles de souris. Le furoate de mométasone n'a pas non plus induit de synthèse d'ADN non programmée in vivo dans les hépatocytes de rat.
Dans les études de reproduction chez les rats, aucune altération de la fertilité n'a été produite chez les rats mâles ou femelles par des doses sous-cutanées allant jusqu'à 15 mcg/kg (environ 0,01 fois la dose topique clinique maximale estimée de la crème ELOCON 5g, sur une base mcg/m²).
Utilisation dans des populations spécifiques
Grossesse
Effets tératogènes - Catégorie de grossesse C
Il n'y a pas d'études adéquates et bien contrôlées chez les femmes enceintes. Par conséquent, ELOCON 5g Crème ne doit être utilisé pendant la grossesse que si le bénéfice potentiel justifie le risque potentiel pour le fœtus.
Les corticostéroïdes se sont avérés tératogènes chez les animaux de laboratoire lorsqu'ils sont administrés par voie systémique à des doses relativement faibles. Certains corticostéroïdes se sont révélés tératogènes après application cutanée chez des animaux de laboratoire.
Lorsqu'il est administré à des rats, des lapins et des souris gravides, le furoate de mométasone a augmenté les malformations fœtales. Les doses qui ont produit des malformations ont également diminué la croissance fœtale, mesurée par des poids fœtaux plus faibles et/ou un retard d'ossification. Le furoate de mométasone a également provoqué une dystocie et des complications associées lorsqu'il a été administré à des rats en fin de gestation.
Chez la souris, le furoate de mométasone a provoqué une fente palatine à des doses sous-cutanées de 60 mcg/kg et plus. La survie fœtale a été réduite à 180 mcg/kg. Aucune toxicité n'a été observée à 20 mcg/kg. (Les doses de 20, 60 et 180 mcg/kg chez la souris sont environ 0,01, 0,02 et 0,05 fois la dose topique clinique maximale estimée de la crème ELOCON sur une base mcg/m².)
Chez le rat, le furoate de mométasone a produit des hernies ombilicales à des doses topiques de 600 mcg/kg et plus. Une dose de 300 mcg/kg a entraîné des retards d'ossification, mais pas de malformations. (Les doses de 300 et 600 mcg/kg chez le rat sont environ 0,2 et 0,4 fois la dose topique clinique maximale estimée de la crème ELOCON 5g sur une base mcg/m².)
Chez le lapin, le furoate de mométasone a causé de multiples malformations (p. ex. pattes avant fléchies, agénésie de la vésicule biliaire, hernie ombilicale, hydrocéphalie) à des doses topiques de 150 mcg/kg et plus (environ 0,2 fois la dose topique clinique maximale estimée de la crème ELOCON sur un mcg/ base m²). Dans une étude par voie orale, le furoate de mométasone a augmenté les résorptions et provoqué une fente palatine et/ou des malformations de la tête (hydrocéphalie et tête bombée) à 700 mcg/kg. À 2800 mcg/kg, la plupart des portées ont été avortées ou résorbées. Aucune toxicité n'a été observée à 140 mcg/kg. (Les doses à 140, 700 et 2800 mcg/kg chez le lapin sont environ 0,2, 0,9 et 3,6 fois la dose topique clinique maximale estimée de la crème ELOCON 5g sur une base mcg/m².)
Lorsque des rats ont reçu des doses sous-cutanées de furoate de mométasone tout au long de la grossesse ou au cours des derniers stades de la grossesse, 15 mcg/kg ont provoqué un travail prolongé et difficile et ont réduit le nombre de naissances vivantes, le poids à la naissance et la survie précoce des ratons. Des effets similaires n'ont pas été observés à 7,5 mcg/kg. (Les doses de 7,5 et 15 mcg/kg chez le rat sont environ 0,005 et 0,01 fois la dose topique clinique maximale estimée de la crème ELOCON sur une base mcg/m².)
Mères allaitantes
Les corticostéroïdes administrés par voie systémique apparaissent dans le lait maternel et peuvent inhiber la croissance, interférer avec la production endogène de corticostéroïdes ou provoquer d'autres effets indésirables. On ne sait pas si l'administration topique de corticostéroïdes pourrait entraîner une absorption systémique suffisante pour produire des quantités détectables dans le lait maternel. Étant donné que de nombreux médicaments sont excrétés dans le lait maternel, la prudence s'impose lorsqu'ELOCON 5g crème est administré à une femme qui allaite.
Utilisation pédiatrique
La crème ELOCON peut être utilisée avec prudence chez les patients pédiatriques de 2 ans ou plus, bien que l'innocuité et l'efficacité de l'utilisation du médicament pendant plus de 3 semaines n'aient pas été établies. Étant donné que la sécurité et l'efficacité d'ELOCON 5g Crème n'ont pas été établies chez les patients pédiatriques de moins de 2 ans, son utilisation dans ce groupe d'âge n'est pas recommandée.
Dans un essai pédiatrique, 24 sujets atteints de dermatite atopique, dont 19 sujets étaient âgés de 2 à 12 ans, ont été traités avec la crème ELOCON une fois par jour. La majorité des sujets ont guéri en 3 semaines. La crème ELOCON 5g a provoqué une suppression de l'axe HPA chez environ 16 % des sujets pédiatriques âgés de 6 à 23 mois, qui ont montré une fonction surrénalienne normale par le test Cortrosyn avant le début du traitement, et ont été traités pendant environ 3 semaines sur une surface corporelle moyenne de 41 % (intervalle de 15 % à 94 %). Les critères de suppression étaient : un taux basal de cortisol ≤ 5 mcg/dL, un taux post-stimulation à 30 minutes ≤ 18 mcg/dL ou une augmentation de PHARMACOLOGIE CLINIQUE ].
En raison d'un rapport plus élevé entre la surface cutanée et la masse corporelle, les patients pédiatriques sont plus à risque que les adultes de suppression de l'axe HPA et de syndrome de Cushing lorsqu'ils sont traités avec des corticostéroïdes topiques. Ils sont donc également plus à risque d'insuffisance surrénalienne pendant et/ou après l'arrêt du traitement. Les patients pédiatriques peuvent être plus sensibles que les adultes à l'atrophie cutanée, y compris les stries, lorsqu'ils sont traités avec des corticostéroïdes topiques. Les patients pédiatriques appliquant des corticostéroïdes topiques sur plus de 20 % de la surface corporelle présentent un risque plus élevé de suppression de l'axe HPA.
La suppression de l'axe HPA, le syndrome de Cushing, le retard de croissance linéaire, le gain de poids retardé et l'hypertension intracrânienne ont été rapportés chez des patients pédiatriques recevant des corticostéroïdes topiques. Les manifestations de la suppression surrénalienne chez les enfants comprennent de faibles niveaux de cortisol plasmatique et une absence de réponse à la stimulation par l'ACTH. Les manifestations de l'hypertension intracrânienne comprennent des fontanelles bombées, des maux de tête et un œdème papillaire bilatéral.
La crème ELOCON ne doit pas être utilisée dans le traitement de l'érythème fessier.
Utilisation gériatrique
Les études cliniques de la crème ELOCON 5g ont inclus 190 sujets âgés de 65 ans et plus et 39 sujets âgés de 75 ans et plus. Aucune différence globale d'innocuité ou d'efficacité n'a été observée entre ces sujets et les sujets plus jeunes, et d'autres expériences cliniques rapportées n'ont pas identifié de différences de réponses entre les patients âgés et les patients plus jeunes. Cependant, une plus grande sensibilité de certaines personnes âgées ne peut être exclue.
SURDOSAGE
La crème ELOCON appliquée localement peut être absorbée en quantités suffisantes pour produire des effets systémiques [voir AVERTISSEMENTS ET PRECAUTIONS ].
CONTRE-INDICATIONS
Aucun.
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
Comme les autres corticostéroïdes topiques, le furoate de mométasone possède des propriétés anti-inflammatoires, antiprurigineuses et vasoconstrictrices. Le mécanisme de l'activité anti-inflammatoire des stéroïdes topiques, en général, n'est pas clair. Cependant, on pense que les corticostéroïdes agissent par l'induction de protéines inhibitrices de la phospholipase A2, collectivement appelées lipocortines. Il est postulé que ces protéines contrôlent la biosynthèse de puissants médiateurs de l'inflammation tels que les prostaglandines et les leucotriènes en inhibant la libération de leur précurseur commun, l'acide arachidonique. L'acide arachidonique est libéré des phospholipides membranaires par la phospholipase A2.
Pharmacodynamie
Les études réalisées avec la crème ELOCON 5g indiquent qu'elle se situe dans la plage de puissance moyenne par rapport à d'autres corticostéroïdes topiques.
Dans une étude évaluant les effets de la crème de furoate de mométasone sur l'axe HPA, 15 grammes ont été appliqués deux fois par jour pendant 7 jours à six sujets adultes atteints de psoriasis ou de dermatite atopique. La crème a été appliquée sans occlusion sur au moins 30 % de la surface corporelle. Les résultats ont montré que le médicament provoquait une légère baisse de la sécrétion de corticostéroïdes surrénaliens [voir AVERTISSEMENTS ET PRECAUTIONS ].
Quatre-vingt-dix-sept sujets pédiatriques âgés de 6 à 23 mois atteints de dermatite atopique ont été recrutés dans une étude ouverte sur l'innocuité de l'axe HPA. La crème ELOCON a été appliquée une fois par jour pendant environ 3 semaines sur une surface corporelle moyenne de 41 % (intervalle de 15 % à 94 %). Chez environ 16 % des sujets qui présentaient une fonction surrénalienne normale au test de Cortrosyn avant le début du traitement, une suppression surrénalienne a été observée à la fin du traitement par ELOCON 5 g crème. Les critères de suppression étaient : un taux basal de cortisol ≤ 5 mcg/dL, un taux post-stimulation à 30 minutes ≤ 18 mcg/dL ou une augmentation de Utilisation dans des populations spécifiques ].
Pharmacocinétique
L'étendue de l'absorption percutanée des corticostéroïdes topiques est déterminée par de nombreux facteurs, notamment le véhicule et l'intégrité de la barrière épidermique. Des études chez l'homme indiquent qu'environ 0,4% de la dose appliquée d'ELOCON 5g Crème passe dans la circulation après 8 heures de contact sur une peau normale sans occlusion. L'inflammation et/ou d'autres processus pathologiques de la peau peuvent augmenter l'absorption percutanée.
Etudes cliniques
La sécurité et l'efficacité de la crème ELOCON 5g pour le traitement des dermatoses répondant aux corticostéroïdes ont été évaluées dans deux essais cliniques randomisés, en double aveugle, contrôlés par véhicule, l'un dans le psoriasis et l'autre dans la dermatite atopique. Au total, 366 sujets (âgés de 12 à 81 ans), dont 177 ont reçu la crème ELOCON et 181 sujets ont reçu la crème excipient, ont été évalués dans ces essais. La crème ELOCON ou la crème véhicule ont été appliquées une fois par jour pendant 21 jours.
Les deux essais ont montré qu'ELOCON 5g Cream est efficace dans le traitement du psoriasis et de la dermatite atopique.
INFORMATIONS PATIENTS
Informez les patients de ce qui suit :
- Utilisez la crème ELOCON 5g selon les directives du médecin. Pour usage externe seulement.
- Eviter le contact avec les yeux.
- N'utilisez pas la crème ELOCON sur le visage, les aisselles ou l'aine, sauf indication contraire du médecin.
- Ne pas utiliser ELOCON 5g Crème pour un trouble autre que celui pour lequel il a été prescrit.
- La zone de peau traitée ne doit pas être bandée ou autrement couverte ou enveloppée de manière à être occlusive, sauf indication contraire du médecin.
- Signalez tout signe de réaction indésirable locale au médecin.
- Déconseiller aux patients d'utiliser ELOCON 5g Crème dans le traitement de l'érythème fessier. Ne pas appliquer la crème ELOCON dans la zone du siège, car les couches ou les culottes en plastique peuvent constituer un pansement occlusif.
- Interrompre le traitement lorsque le contrôle est obtenu. Si aucune amélioration n'est observée dans les 2 semaines, contactez le médecin.
- N'utilisez pas d'autres produits contenant des corticostéroïdes avec la crème ELOCON sans d'abord consulter le médecin.
