Brand Temovate 15g Clobetasol Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Temovate et comment est-il utilisé ?
Temovate est un médicament d'ordonnance utilisé pour traiter les symptômes du psoriasis en plaques et du cuir chevelu et des dermatoses sensibles aux corticostéroïdes. Temovate peut être utilisé seul ou avec d'autres médicaments.
Temovate appartient à une classe de médicaments appelés corticostéroïdes topiques.
On ne sait pas si Temovate est sûr et efficace chez les enfants de moins de 12 ans.
Quels sont les effets secondaires possibles de Temovate ?
Temovate peut provoquer des effets secondaires graves, notamment :
- aggravation de votre état de peau,
- rougeur, chaleur, gonflement, suintement ou irritation grave de toute peau traitée,
- Vision floue,
- vision tunnel,
- douleur oculaire,
- voir des halos autour des lumières,
- augmentation de la soif,
- bouche sèche,
- odeur d'haleine fruitée,
- prise de poids au niveau du visage et des épaules,
- cicatrisation lente,
- décoloration de la peau,
- amincissement de la peau,
- augmentation de la pilosité corporelle,
- fatigue,
- des changements d'humeur,
- changements menstruels, et
- changements sexuels
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Temovate incluent :
- brûlure, démangeaison, gonflement ou irritation de la peau traitée,
- peau sèche ou gercée,
- rougeur ou croûte autour de vos follicules pileux,
- veines araignées,
- vergetures,
- amincissement de la peau,
- éruption cutanée ou urticaire,
- l'acné, et
- perte de cheveux temporaire
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Temovate. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
LA DESCRIPTION
La crème et l'onguent TEMOVATE® (crème et pommade au propionate de clobétasol) à 0,05 % contiennent le composé actif propionate de clobétasol, un corticostéroïde synthétique, à usage dermatologique topique. Le clobétasol, un analogue de la prednisolone, a un degré élevé d'activité glucocorticoïde et un faible degré d'activité minéralocorticoïde.
Chimiquement, le propionate de clobétasol est le (11ß,16ß)-21-chloro-9-fluoro-11-hydroxy-16-méthyl-17-(1-oxopropoxy)-pregna-1,4-diène-3,20-dione, et il a la formule structurale suivante :
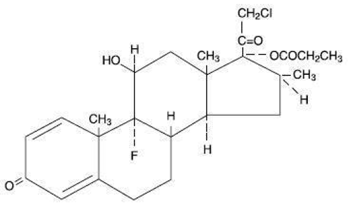
Le propionate de clobétasol a la formule moléculaire C25H32CIFO5 et un poids moléculaire de 467. Il s'agit d'une poudre cristalline de couleur blanche à crème insoluble dans l'eau.
La crème TEMOVATE® contient du propionate de clobétasol 0,5 mg/g dans une crème à base de propylène glycol, de monostéarate de glycéryle, d'alcool cétostéarylique, de stéarate de glycéryle, de stéarate de PEG 100, de cire blanche, de chlorocrésol, de citrate de sodium, d'acide citrique monohydraté et d'eau purifiée.
La pommade TEMOVATE® contient du propionate de clobétasol à 0,5 mg/g dans une base de propylène glycol, de sesquioléate de sorbitan et de pétrolatum blanc.
LES INDICATIONS
La crème et l'onguent TEMOVATE® sont des formulations de corticostéroïdes à très haute puissance indiquées pour le soulagement des manifestations inflammatoires et prurigineuses des dermatoses sensibles aux corticostéroïdes. Le traitement au-delà de 2 semaines consécutives n'est pas recommandé et la dose totale ne doit pas dépasser 50 g/semaine en raison du potentiel du médicament à supprimer l'axe hypothalamo-hypophyso-surrénalien (HHS). L'utilisation chez les patients pédiatriques de moins de 12 ans n'est pas recommandée.
Comme avec d'autres corticostéroïdes hautement actifs, le traitement doit être interrompu lorsque le contrôle a été atteint. Si aucune amélioration n'est observée dans les 2 semaines, une réévaluation du diagnostic peut être nécessaire.
DOSAGE ET ADMINISTRATION
Appliquez une fine couche de crème ou d'onguent TEMOVATE® sur les zones cutanées affectées deux fois par jour et frottez doucement et complètement (voir INDICATIONS ET USAGE ).
La crème et l'onguent TEMOVATE® sont des corticostéroïdes topiques très puissants ; Donc, le traitement doit être limité à 2 semaines consécutives et des quantités supérieures à 50 g/semaine ne doivent pas être utilisées.
Comme avec d'autres corticostéroïdes hautement actifs, le traitement doit être interrompu lorsque le contrôle a été atteint. Si aucune amélioration n'est observée dans les 2 semaines, une réévaluation du diagnostic peut être nécessaire.
La crème et l'onguent TEMOVATE® ne doivent pas être utilisés avec des pansements occlusifs.
Utilisation gériatrique
Dans les études où les patients gériatriques (65 ans ou plus, voir PRÉCAUTIONS ont été traités avec la crème ou l'onguent TEMOVATE®, l'innocuité n'a pas différé de celle des patients plus jeunes ; par conséquent, aucun ajustement posologique n'est recommandé.
COMMENT FOURNIE
TEMOVATE® (crème de propionate de clobétasol) Crème, 0,05 % est livré en :
tubes de 30 g ( CDN 10337-163-30), et tubes de 60 g ( CDN 10337-163-60).
L'onguent TEMOVATE® (pommade au propionate de clobétasol) à 0,05 % est offert en :
tubes de 15 g ( CDN 10337-162-15), et tubes de 30 g ( CDN 10337-162-30).
Conserver entre 15° et 30°C (59° et 86°F). La crème TEMOVATE® ne doit pas être réfrigérée. PharmaDerm
Une division de Fougera Pharmaceuticals Inc., Melville, NY 11747 États-Unis. Révisé : janvier 2012
EFFETS SECONDAIRES
Dans les essais cliniques contrôlés, les effets indésirables les plus fréquemment signalés pour la crème TEMOVATE® étaient des sensations de brûlure et de piqûre chez 1 % des patients traités. Les effets indésirables moins fréquents étaient les démangeaisons, l'atrophie cutanée et les craquelures et fissures de la peau.
Dans les essais cliniques contrôlés, les effets indésirables les plus fréquemment signalés pour l'onguent TEMOVATE® étaient une sensation de brûlure, une irritation et des démangeaisons chez 0,5 % des patients traités. Les effets indésirables moins fréquents étaient les picotements, les craquements, l'érythème, la folliculite, l'engourdissement des doigts, l'atrophie cutanée et la télangiectasie.
Le syndrome de Cushing a été signalé chez des nourrissons et des adultes à la suite d'une utilisation prolongée de formulations topiques de propionate de clobétasol.
Les effets indésirables locaux supplémentaires suivants ont été signalés avec des corticostéroïdes topiques, et ils peuvent survenir plus fréquemment avec l'utilisation de pansements occlusifs et de corticostéroïdes plus puissants. Ces réactions sont répertoriées dans un ordre approximativement décroissant de survenue : sécheresse, éruptions acnéiformes, hypopigmentation, dermatite périorale, dermatite allergique de contact, infection secondaire, irritation, vergetures et miliaire.

INTERACTIONS MÉDICAMENTEUSES
Aucune information fournie.
AVERTISSEMENTS
Aucune information fournie. S'il te plait regarde PRÉCATIONS section ci-dessous.
PRÉCAUTIONS
Général
La crème et l'onguent TEMOVATE® ne doivent pas être utilisés dans le traitement de la rosacée ou de la dermatite périorale, et ne doivent pas être utilisés sur le visage, l'aine ou les aisselles.
L'absorption systémique de corticostéroïdes topiques peut produire une suppression réversible de l'axe HPA avec un potentiel d'insuffisance en glucocorticostéroïdes après l'arrêt du traitement. Des manifestations du syndrome de Cushing, de l'hyperglycémie et de la glycosurie peuvent également être produites chez certains patients par l'absorption systémique de corticostéroïdes topiques pendant le traitement.
Les patients appliquant un stéroïde topique sur une grande surface ou sur des zones sous occlusion doivent être évalués périodiquement pour rechercher des signes de suppression de l'axe HPA. Cela peut être fait en utilisant la stimulation à l'ACTH, le cortisol plasmatique AM et les tests de cortisol libre urinaire. Les patients recevant des corticostéroïdes super puissants ne doivent pas être traités pendant plus de 2 semaines à la fois, et seules de petites zones doivent être traitées à la fois en raison du risque accru de suppression de l'HPA.
La crème et l'onguent TEMOVATE® ont produit une suppression de l'axe HPA lorsqu'ils étaient utilisés à des doses aussi faibles que 2 g/jour pendant 1 semaine chez des patients souffrant d'eczéma.
Si la suppression de l'axe HPA est notée, une tentative doit être faite pour retirer le médicament, pour réduire la fréquence d'application ou pour remplacer un corticostéroïde moins puissant. La récupération de la fonction de l'axe HPA est généralement rapide après l'arrêt des corticostéroïdes topiques. Rarement, des signes et des symptômes d'insuffisance en glucocorticostéroïdes peuvent survenir et nécessiter des corticostéroïdes systémiques supplémentaires. Pour plus d'informations sur la supplémentation systémique, voir les informations de prescription de ces produits.
Les patients pédiatriques peuvent être plus sensibles à la toxicité systémique à des doses équivalentes en raison de leur plus grand rapport surface cutanée/masse corporelle (voir PRÉCAUTIONS : Utilisation pédiatrique ).
Si une irritation se développe, la crème et l'onguent TEMOVATE® doivent être interrompus et un traitement approprié doit être institué. La dermatite de contact allergique aux corticostéroïdes est généralement diagnostiquée en observant un défaut de cicatrisation plutôt qu'en notant une exacerbation clinique comme avec la plupart des produits topiques ne contenant pas de corticostéroïdes. Une telle observation doit être corroborée par des tests de patch diagnostiques appropriés.
Si des infections cutanées concomitantes sont présentes ou se développent, un agent antifongique ou antibactérien approprié doit être utilisé. Si une réponse favorable ne se produit pas rapidement, l'utilisation de la crème et de l'onguent TEMOVATE® doit être interrompue jusqu'à ce que l'infection soit suffisamment contrôlée.
Tests de laboratoire
Les tests suivants peuvent être utiles pour évaluer les patients pour la suppression de l'axe HPA :
Test de stimulation à l'ACTH Test de cortisol plasmatique AM Test de cortisol libre urinaire
Carcinogenèse, mutagenèse, altération de la fertilité
Aucune étude animale à long terme n'a été réalisée pour évaluer le potentiel carcinogène du propionate de clobétasol.
Des études chez le rat après administration sous-cutanée à des doses allant jusqu'à 50 mcg/kg/jour ont révélé que les femelles présentaient une augmentation du nombre d'embryons résorbés et une diminution du nombre de fœtus vivants à la dose la plus élevée.
Le propionate de clobétasol s'est avéré non mutagène dans 3 systèmes de test différents : le test d'Ames, le test de conversion du gène Saccharomyces cerevisiae et le test de fluctuation E. coli B WP2.
Grossesse
Effets tératogènes
Catégorie de grossesse C. Les corticostéroïdes se sont avérés tératogènes chez les animaux de laboratoire lorsqu'ils sont administrés par voie systémique à des doses relativement faibles. Certains corticos-stéroïdes se sont révélés tératogènes après application cutanée sur des animaux de laboratoire.
Le propionate de clobétasol n'a pas été testé pour la tératogénicité lorsqu'il est appliqué par voie topique ; cependant, il est absorbé par voie percutanée et, lorsqu'il est administré par voie sous-cutanée, il s'est avéré un tératogène important chez le lapin et la souris. Le propionate de clobétasol a un plus grand potentiel tératogène que les stéroïdes qui sont moins puissants.
Des études de tératogénicité chez la souris par voie sous-cutanée ont entraîné une fœtotoxicité à la dose la plus élevée testée (1 mg/kg) et une tératogénicité à toutes les doses testées jusqu'à 0,03 mg/kg. Ces doses sont respectivement d'environ 1,4 et 0,04 fois la dose topique humaine de crème et d'onguent TEMOVATE®. Les anomalies observées comprenaient une fente palatine et des anomalies squelettiques.
Chez le lapin, le propionate de clobétasol était tératogène aux doses de 3 et 10 mcg/kg. Ces doses sont respectivement d'environ 0,02 et 0,05 fois la dose topique humaine de crème et d'onguent TEMOVATE®. Les anomalies observées comprenaient une fente palatine, un cranioschisis et d'autres anomalies squelettiques.
Il n'y a pas d'études adéquates et bien contrôlées du potentiel tératogène du propionate de clobétasol chez la femme enceinte. La crème et l'onguent TEMOVATE® ne doivent être utilisés pendant la grossesse que si le bénéfice potentiel justifie le risque potentiel pour le fœtus.
Mères allaitantes
Les corticostéroïdes administrés par voie systémique apparaissent dans le lait maternel et peuvent inhiber la croissance, interférer avec la production endogène de corticostéroïdes ou provoquer d'autres effets indésirables. On ne sait pas si l'administration topique de corticostéroïdes pourrait entraîner une absorption systémique suffisante pour produire des quantités détectables dans le lait maternel. Étant donné que de nombreux médicaments sont excrétés dans le lait maternel, la prudence s'impose lorsque la crème ou l'onguent TEMOVATE® est administré à une femme qui allaite.
Utilisation pédiatrique
L'innocuité et l'efficacité de la crème et de l'onguent TEMOVATE® chez les patients pédiatriques n'ont pas été établies. L'utilisation chez les patients pédiatriques de moins de 12 ans n'est pas recommandée. En raison d'un rapport plus élevé entre la surface cutanée et la masse corporelle, les patients pédiatriques sont plus à risque que les adultes de suppression de l'axe HPA et de syndrome de Cushing lorsqu'ils sont traités avec des corticostéroïdes topiques. Ils sont donc également plus à risque d'insuffisance surrénalienne pendant ou après l'arrêt du traitement. Des effets indésirables, notamment des vergetures, ont été signalés lors d'une utilisation inappropriée de corticostéroïdes topiques chez les nourrissons et les enfants.
La suppression de l'axe HHS, le syndrome de Cushing, le retard de croissance linéaire, la prise de poids retardée et l'hypertension intracrânienne ont été rapportés chez des enfants recevant des corticostéroïdes topiques. Les manifestations de la suppression surrénalienne chez les enfants comprennent de faibles niveaux de cortisol plasmatique et une absence de réponse à la stimulation par l'ACTH. Les manifestations de l'hypertension intracrânienne comprennent des fontanelles bombées, des maux de tête et un œdème papillaire bilatéral.
Utilisation gériatrique
Un nombre limité de patients âgés de 65 ans ou plus ont été traités avec la crème TEMOVATE® (n = 231) et avec la pommade TEMOVATE® (n = 101) dans des essais cliniques américains et non américains. Bien que le nombre de patients soit trop petit pour permettre une analyse séparée de l'efficacité et de la sécurité, les effets indésirables rapportés dans cette population étaient similaires à ceux rapportés par les patients plus jeunes. D'après les données disponibles, aucun ajustement de la posologie de la crème et de l'onguent TEMOVATE® chez les patients gériatriques n'est justifié.
SURDOSAGE
La crème et l'onguent TEMOVATE® appliqués localement peuvent être absorbés en quantités suffisantes pour produire des effets systémiques (voir PRÉCAUTIONS ).
CONTRE-INDICATIONS
La crème et l'onguent TEMOVATE® (crème et onguent de propionate de clobétasol) à 0,05 % sont contre-indiqués chez les patients ayant des antécédents d'hypersensibilité à l'un des composants des préparations.
PHARMACOLOGIE CLINIQUE
Comme les autres corticostéroïdes topiques, le propionate de clobétasol possède des propriétés anti-inflammatoires, antiprurigineuses et vasoconstrictrices. Le mécanisme de l'activité anti-inflammatoire des stéroïdes topiques, en général, n'est pas clair. Cependant, on pense que les corticostéroïdes agissent par l'induction de protéines inhibitrices de la phospholipase A2, collectivement appelées lipocortines. Il est postulé que ces protéines contrôlent la biosynthèse de puissants médiateurs de l'inflammation tels que les prostaglandines et les leucotriènes en inhibant la libération de leur précurseur commun, l'acide arachidonique. L'acide arachidonique est libéré des phospholipides membranaires par la phospholipase A2.
Pharmacocinétique
L'étendue de l'absorption percutanée des corticostéroïdes topiques est déterminée par de nombreux facteurs, y compris le véhicule et l'intégrité de la barrière épidermique. Il n'a pas été démontré qu'un pansement occlusif avec de l'hydrocortisone pendant jusqu'à 24 heures augmente la pénétration; cependant, l'occlusion de l'hydrocortisone pendant 96 heures améliore nettement la pénétration. Les corticostéroïdes topiques peuvent être absorbés à partir d'une peau normale intacte. L'inflammation et/ou d'autres processus pathologiques de la peau peuvent augmenter l'absorption percutanée.
Les études réalisées avec la crème et l'onguent TEMOVATE® indiquent qu'ils se situent dans la plage de puissance très élevée par rapport à d'autres corticostéroïdes topiques.
INFORMATIONS PATIENTS
Les patients utilisant des corticostéroïdes topiques doivent recevoir les informations et instructions suivantes :
