Mircette 0.15/0.02 mg Desogestrel Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Mircette 0,15 mg et comment est-il utilisé ?
Mircette est un médicament sur ordonnance utilisé comme Contraception pour prévenir la Grossesse. Mircette peut être utilisé seul ou avec d'autres médicaments.
Mircette appartient à une classe de médicaments appelés œstrogènes/progestatifs ; Contraceptifs oraux.
On ne sait pas si Mircette est sûr et efficace chez les enfants en préménarche.
Quels sont les effets secondaires possibles de Mircette ?
Mircette peut provoquer des effets secondaires graves, notamment :
- urticaire,
- difficulté à respirer,
- gonflement du visage, des lèvres, de la langue ou de la gorge,
- engourdissement ou faiblesse soudaine (surtout d'un côté du corps),
- maux de tête soudains et violents,
- troubles de l'élocution,
- problèmes de vision ou d'équilibre,
- perte de vision soudaine,
- douleur thoracique lancinante,
- essoufflement,
- tousser du sang,
- douleur ou chaleur dans une ou les deux jambes,
- douleur ou pression thoracique,
- douleur se propageant à la mâchoire ou à l'épaule,
- nausée,
- transpiration,
- perte d'appétit,
- douleur dans le haut du ventre,
- fatigue,
- fièvre,
- urine foncée,
- selles de couleur argile,
- jaunissement de la peau ou des yeux (jaunisse),
- Maux de tête sévères,
- Vision floue,
- battant dans votre cou ou vos oreilles,
- gonflement des mains, des chevilles ou des pieds,
- changements dans le schéma ou la gravité des migraines,
- masse mammaire,
- problèmes de sommeil,
- la faiblesse,
- sensation de fatigue et
- des changements d'humeur
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Mircette incluent :
- nausée,
- vomissements (en particulier lorsque vous commencez à prendre ce médicament),
- sensibilité des seins,
- saignement intermenstruel,
- acné,
- assombrissement de la peau du visage,
- gain de poids, et
- problèmes avec les lentilles de contact
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Mircette. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
Les patients doivent être informés que ce produit ne protège pas contre l'infection par le VIH (SIDA) et d'autres maladies sexuellement transmissibles.
LA DESCRIPTION
Les comprimés Mircette® (désogestrel/éthinylestradiol et éthinylestradiol) fournissent un régime contraceptif oral de 21 comprimés ronds blancs contenant chacun 0,15 mg de désogestrel (13-éthyl11- méthylène-18,19-dinor-17 alpha-pregn- 4-en- 20 -yn-17-ol), 0,02 mg d'éthinylestradiol (19-nor17 alpha-pregna-1,3,5 (10)-trien-20-yne-3,17-diol) et des ingrédients inactifs qui comprennent du dioxyde de silicium colloïdal , hypromellose, lactose monohydraté, polyéthylèneglycol, povidone, amidon prégélatinisé, acide stéarique et vitamine E, suivi de 2 comprimés ronds vert clair inertes avec les ingrédients inactifs suivants : FD&C bleu no. 1 laque d'aluminium, FD & C jaune no. 6 laque d'aluminium, D&C jaune no. 10 laque d'aluminium, lactose monohydraté, stéarate de magnésium, cellulose microcristalline et amidon prégélatinisé. Mircette® contient également 5 comprimés ronds jaunes contenant 0,01 mg d'éthinylestradiol (19-nor-17 alpha-pregna-1,3,5 (10)-trien-20-yne3,17-diol) et des ingrédients inactifs qui incluent du dioxyde de silicium colloïdal , D&C jaune non. 10, laque d'aluminium, FD&C jaune no. 6 laque d'aluminium, hypromellose, lactose monohydraté, polyéthylèneglycol, povidone, polysorbate 80, amidon prégélatinisé, acide stéarique, dioxyde de titane et vitamine E. Les poids moléculaires du désogestrel et de l'éthinylestradiol sont respectivement de 310,48 et 296,40. Les formules structurales sont les suivantes :
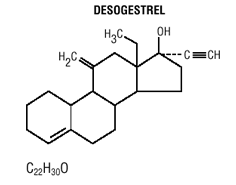
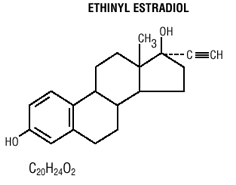
LES INDICATIONS
Les comprimés Mircette® (désogestrel/éthinylestradiol et éthinylestradiol) sont indiqués pour la prévention de la grossesse chez les femmes qui choisissent d'utiliser ce produit comme méthode de contraception.
Les contraceptifs oraux sont très efficaces. Le tableau II énumère les taux typiques de grossesses accidentelles chez les utilisatrices de contraceptifs oraux combinés et d'autres méthodes de contraception. L'efficacité de ces méthodes contraceptives, à l'exception de la stérilisation, dépend de la fiabilité avec laquelle elles sont utilisées. L'utilisation correcte et cohérente de ces méthodes peut entraîner des taux d'échec inférieurs.
TABLEAU II : Pourcentage de femmes connaissant une grossesse non désirée au cours de la première année d'utilisation typique et de la première année d'utilisation parfaite de la contraception et pourcentage d'utilisation continue à la fin de la première année, États-Unis.
DOSAGE ET ADMINISTRATION
Pour obtenir une efficacité contraceptive maximale, les comprimés Mircette® (désogestrel/éthinylestradiol et éthinylestradiol) doivent être pris exactement comme indiqué et à des intervalles ne dépassant pas 24 heures. Mircette® peut être lancé en utilisant soit un départ le dimanche soit un départ du Jour 1.
REMARQUE : Chaque distributeur de cycle pack est préimprimé avec les jours de la semaine, en commençant par le dimanche, pour faciliter un régime de démarrage le dimanche. Six "bandes d'étiquettes de jour" différentes sont fournies avec chaque distributeur de cycle pack afin de s'adapter à un régime de démarrage du jour 1. Dans ce cas, la patiente doit placer la "bande d'étiquette de jour" autocollante qui correspond à son jour de départ sur les jours préimprimés.
IMPORTANT : La possibilité d'ovulation et de conception avant le début de l'utilisation de Mircette® doit être envisagée.
L'utilisation de Mircette® pour la contraception peut être initiée 4 semaines après l'accouchement chez les femmes qui choisissent de ne pas allaiter. Lorsque les comprimés sont administrés pendant la période post-partum, le risque accru de maladie thromboembolique associée à la période post-partum doit être pris en compte (voir CONTRE-INDICATIONS et AVERTISSEMENTS concernant la maladie thromboembolique. Voir également PRÉCAUTIONS pour Mères allaitantes ).
Si la patiente commence Mircette® après l'accouchement et qu'elle n'a pas encore eu ses règles, elle doit être informée d'utiliser une autre méthode de contraception jusqu'à ce qu'un comprimé blanc ait été pris quotidiennement pendant 7 jours.
Début du dimanche
Lors de l'initiation d'un schéma posologique le dimanche, une autre méthode de contraception doit être utilisée jusqu'à la fin des 7 premiers jours consécutifs d'administration.
En commençant le dimanche, les comprimés sont pris quotidiennement sans interruption comme suit : Le premier comprimé blanc doit être pris le premier dimanche après le début des règles (si les règles commencent le dimanche, le premier comprimé blanc est pris ce jour-là). Un comprimé blanc est pris quotidiennement pendant 21 jours, suivi de 1 comprimé vert clair (inerte) par jour pendant 2 jours et de 1 comprimé jaune (actif) par jour pendant 5 jours. Pour tous les cycles suivants, le patient commence alors un nouveau régime de 28 comprimés le lendemain (dimanche) après avoir pris le dernier comprimé jaune. [Si vous passez d'un contraceptif oral à début du dimanche, le premier comprimé de Mircette® (désogestrel/éthinylestradiol et éthinylestradiol) doit être pris le deuxième dimanche après le dernier comprimé d'un régime de 21 jours ou doit être pris le premier dimanche après le dernier comprimé inactif d'un régime de 28 jours.]
Si une patiente oublie 1 comprimé blanc, elle doit prendre le comprimé oublié dès qu'elle s'en souvient. Si la patiente oublie 2 comprimés blancs consécutifs au cours de la semaine 1 ou de la semaine 2, la patiente doit prendre 2 comprimés le jour où elle s'en souvient et 2 comprimés le jour suivant ; par la suite, la patiente doit reprendre la prise de 1 comprimé par jour jusqu'à ce qu'elle termine le cycle pack. La patiente doit être informée qu'elle doit utiliser une méthode contraceptive d'appoint si elle a des rapports sexuels dans les 7 jours suivant l'oubli de pilules. Si le patient oublie 2 comprimés blancs consécutifs au cours de la troisième semaine ou oublie 3 comprimés blancs consécutifs ou plus à tout moment du cycle, le patient doit continuer à prendre 1 comprimé blanc par jour jusqu'au dimanche suivant. Le dimanche, le patient doit jeter le reste de ce cycle pack et commencer un nouveau cycle pack le même jour. La patiente doit être informée qu'elle doit utiliser une méthode contraceptive d'appoint si elle a des rapports sexuels dans les 7 jours suivant l'oubli de pilules.
Jour 1 Début
En comptant le premier jour des menstruations comme "Jour 1", les comprimés sont pris sans interruption comme suit : un comprimé blanc par jour pendant 21 jours, un comprimé vert clair (inerte) par jour pendant 2 jours suivi d'un comprimé jaune (éthinylestradiol) par jour. pendant 5 jours. Pour tous les cycles suivants, le patient commence alors un nouveau régime de 28 comprimés le lendemain après avoir pris le dernier comprimé jaune. [Si vous passez directement d'un autre contraceptif oral, le premier comprimé blanc doit être pris le premier jour de la menstruation qui commence après le dernier comprimé ACTIF du produit précédent.]
Si une patiente oublie 1 comprimé blanc, elle doit prendre le comprimé oublié dès qu'elle s'en souvient. Si la patiente oublie 2 comprimés blancs consécutifs au cours de la semaine 1 ou de la semaine 2, la patiente doit prendre 2 comprimés le jour où elle s'en souvient et 2 comprimés le jour suivant ; par la suite, la patiente doit reprendre la prise de 1 comprimé par jour jusqu'à ce qu'elle termine le cycle pack. La patiente doit être informée qu'elle doit utiliser une méthode contraceptive d'appoint si elle a des rapports sexuels dans les 7 jours suivant l'oubli de pilules. Si le patient oublie 2 comprimés blancs consécutifs au cours de la troisième semaine ou si le patient oublie 3 comprimés blancs consécutifs ou plus à tout moment du cycle, le patient doit jeter le reste de la plaquette du cycle et commencer une nouvelle plaquette du cycle qui même jour. La patiente doit être informée qu'elle doit utiliser une méthode contraceptive d'appoint si elle a des rapports sexuels dans les 7 jours suivant l'oubli de pilules.
Tous les contraceptifs oraux
Les saignements intermenstruels, les saignotements et l'aménorrhée sont des raisons fréquentes pour lesquelles les patientes arrêtent les contraceptifs oraux. Dans les saignements intermenstruels, comme dans tous les cas de saignements vaginaux irréguliers, les causes non fonctionnelles doivent être prises en compte. En cas de saignement anormal persistant ou récurrent non diagnostiqué du vagin, des mesures diagnostiques adéquates sont indiquées pour exclure une grossesse ou une malignité. Si la grossesse et la pathologie ont été exclues, le temps ou le passage à une autre préparation peut résoudre le problème. Le passage à un contraceptif oral à teneur plus élevée en œstrogènes, bien que potentiellement utile pour minimiser les irrégularités menstruelles, ne doit être fait que si nécessaire, car cela peut augmenter le risque de maladie thromboembolique.
Utilisation de contraceptifs oraux en cas d'absence de règles :
COMMENT FOURNIE
Mircette ® (désogestrel/éthinylestradiol et éthinylestradiol) Les comprimés contiennent 21 comprimés ronds blancs, 2 comprimés ronds verts et 5 comprimés ronds jaunes dans une plaquette alvéolée dans un distributeur en plastique recyclable. Chaque comprimé blanc (gravé « dp » sur une face et « 021 » sur l'autre) contient 0,15 mg de désogestrel et 0,02 mg d'éthinylestradiol. Chaque comprimé vert (gravé « dp » sur une face et « 331 » sur l'autre) contient des ingrédients inertes. Chaque comprimé jaune (gravé « dp » sur une face et « 457 » sur l'autre) contient 0,01 mg d'éthinylestradiol.
Boîtes de 6 CDN 51285-114-58
Conserver à 20° à 25°C (68° à 77°F) [Voir Température ambiante contrôlée USP ].
RÉFÉRENCES
1. Hatcher RA, Trussell J, Stewart F et al. Contraceptive Technology : Seventeenth Revised Edition, New York : Irvington Publishers, 1998, sous presse.
2. Stadel BV. Contraceptifs oraux et maladies cardiovasculaires. (Partie 1). N Engl J Med 1981; 305 : 612–618.
3. Stadel BV. Contraceptifs oraux et maladies cardiovasculaires. (Partie 2). N Engl J Med 1981; 305:672–677.
44. Shapiro S. Contraceptifs oraux—il est temps de faire le point. N Engl J Med 1987; 315:450–451.
73. L'étude sur le cancer et les hormones stéroïdes des Centers for Disease Control et de l'Institut national de la santé infantile et du développement humain : utilisation de contraceptifs oraux et risque de cancer de l'ovaire. JAMA 1983; 249:1596–1599.
74. L'étude sur le cancer et les hormones stéroïdiennes des Centers for Disease Control et de l'Institut national de la santé infantile et du développement humain : Utilisation combinée de contraceptifs oraux et risque de cancer de l'endomètre. JAMA 1987; 257 : 796–800.
75. Ory HW. Kystes ovariens fonctionnels et contraceptifs oraux : association négative confirmée chirurgicalement. JAMA 1974; 228:68–69.
76. Ory HW, Cole P, Macmahon B, Hoover R. Contraceptifs oraux et risque réduit de maladie bénigne du sein. N Engl J Med 1976; 294:419–422.
77. Ory HW. Les avantages pour la santé non contraceptifs de l'utilisation de contraceptifs oraux. Fam Plann Perspective 1982; 14:182–184.
78. Ory HW, Forrest JD, Lincoln R. Faire des choix : Évaluer les risques pour la santé et les avantages des méthodes de contrôle des naissances. New York, Institut Alan Guttmacher, 1983 ; p. 1.
90. Godsland, I et al. Les effets de différentes formulations d'agents contraceptifs oraux sur le métabolisme des lipides et des glucides. N Engl J Med 1990; 323:1375–81.
91. Kloosterboer, HJ et al. Sélectivité dans la liaison aux récepteurs de la progestérone et des androgènes des progestatifs utilisés dans la contraception orale. Contraception, 1988 ; 38:325–32.
92. Van der Vies, J et de Visser, J. Études endocrinologiques avec désogestrel. Arzneim. Forsch./Drug Res., 1983; 33(l),2:231–6.
93. Données internes, Organon Inc.
94. Fotherby, K. Contraceptifs oraux, lipides et maladies cardiovasculaires. Contraception, 1985 ; Vol. 31; 4:367–94.
95. Lawrence, DM et al. Réduction de la globuline liant les hormones sexuelles et des niveaux de testostérone libre dérivés chez les femmes souffrant d'acné sévère. endocrinologie clinique, 1981 ; 15:87–91.
96. Cullberg, G et al. Effets d'une association désogestrel-éthinylestradiol à faible dose sur l'hirsutisme, les androgènes et la globuline liant les hormones sexuelles chez les femmes atteintes d'un syndrome des ovaires polykystiques. Acta Obstet Gynecol Scand, 1985; 64 : 195–202.
97. Jung-Hoffmann, C et Kuhl, H. Effets divergents de deux contraceptifs oraux à faible dose sur la globuline liant les hormones sexuelles et la testostérone libre. AJOG, 1987; 156 : 199–203.
98. Hammond, G et al. Concentrations sériques de protéine de liaison aux stéroïdes, distribution des progestatifs et biodisponibilité de la testostérone pendant le traitement par des contraceptifs contenant du désogestrel ou du lévonorgestrel. Fertilité. Steril., 1984; 42:44–51.
99. Palatsi, R et al. Testostérone totale et non liée sérique et globuline liant les hormones sexuelles (SHBG) chez des patientes acnéiques traitées avec deux contraceptifs oraux différents. Acta Derm Venereol, 1984; 64:517–23.
Teva Women'S Health, Inc., filiale de Teva Pharmaceuticals USA, Inc. Sellersville, PA 18960. Rév. 06/2012
EFFETS SECONDAIRES
Un risque accru des effets indésirables graves suivants a été associé à l'utilisation de contraceptifs oraux (voir AVERTISSEMENTS section):
- Thrombophlébite et thrombose veineuse avec ou sans embolie
- Thromboembolie artérielle
- Embolie pulmonaire
- Infarctus du myocarde
- Hémorragie cérébrale
- Thrombose cérébrale
- Hypertension
- Maladie de la vésicule biliaire
- Adénomes hépatiques ou tumeurs bénignes du foie
Il existe des preuves d'une association entre les conditions suivantes et l'utilisation de contraceptifs oraux :
- Thrombose mésentérique
- Thrombose rétinienne
Les effets indésirables suivants ont été rapportés chez des patientes recevant des contraceptifs oraux et sont supposés être liés au médicament :
- Nausée
- Vomissement
- Symptômes gastro-intestinaux (tels que crampes abdominales et ballonnements)
- Saignement interminable
- Repérage
- Modification du flux menstruel
- Aménorrhée
- Infertilité passagère après arrêt du traitement
- Œdème
- Mélasma qui peut persister
- Changements mammaires : sensibilité, hypertrophie, sécrétion
- Changement de poids (augmentation ou diminution)
- Modification de l'érosion cervicale et de la sécrétion
- Diminution de la lactation lorsqu'il est administré immédiatement après l'accouchement
- Ictère cholestatique
- Migraine
- Rash (allergique)
- Dépression mentale
- Tolérance réduite aux glucides
- Candidose vaginale
- Modification de la courbure de la cornée (pentification)
- Intolérance aux lentilles de contact
Les effets indésirables suivants ont été rapportés chez les utilisatrices de contraceptifs oraux et l'association n'a été ni confirmée ni infirmée :
- Syndrome prémenstruel
- Cataractes
- Changements d'appétit
- Syndrome de type cystite
- Mal de tête
- Nervosité
- Vertiges
- Hirsutisme
- Perte de cheveux du cuir chevelu
- Érythème polymorphe
- Érythème noueux
- Éruption hémorragique
- Vaginite
- Porphyrie
- Fonction rénale altérée
- Syndrome hémolytique urémique
- Acné
- Modifications de la libido
- Colite
- Syndrome de Budd-Chiari
INTERACTIONS MÉDICAMENTEUSES
Une efficacité réduite et une incidence accrue de saignements intermenstruels et d'irrégularités menstruelles ont été associées à l'utilisation concomitante de rifampicine. Une association similaire, bien que moins marquée, a été suggérée avec les barbituriques, la phénylbutazone, la phénytoïne sodique, la carbamazépine et peut-être avec la griséofulvine, l'ampicilline et les tétracyclines (72).
Il a été démontré que les contraceptifs hormonaux combinés diminuent significativement les concentrations plasmatiques de lamotrigine lorsqu'ils sont co-administrés, probablement en raison de l'induction de la glucuronidation de la lamotrigine. Cela peut réduire le contrôle des crises; par conséquent, des ajustements posologiques de la lamotrigine peuvent être nécessaires.
Consultez l'étiquette du médicament utilisé simultanément pour obtenir de plus amples informations sur les interactions avec les contraceptifs hormonaux ou le potentiel d'altérations enzymatiques.
Interactions avec les tests de laboratoire
Certains tests de la fonction endocrinienne et hépatique et certains composants sanguins peuvent être affectés par les contraceptifs oraux :
AVERTISSEMENTS
Le tabagisme augmente le risque d'effets secondaires cardiovasculaires graves liés à l'utilisation de contraceptifs oraux. Ce risque augmente avec l'âge et en cas de forte consommation de tabac (15 cigarettes ou plus par jour) et est assez marqué chez les femmes de plus de 35 ans. Les femmes qui utilisent des contraceptifs oraux doivent être fortement déconseillées de fumer.
L'utilisation de contraceptifs oraux est associée à des risques accrus de plusieurs affections graves, notamment l'infarctus du myocarde, la thromboembolie, l'accident vasculaire cérébral, la néoplasie hépatique et la maladie de la vésicule biliaire, bien que le risque de morbidité ou de mortalité grave soit très faible chez les femmes en bonne santé sans facteurs de risque sous-jacents. Le risque de morbidité et de mortalité augmente significativement en présence d'autres facteurs de risque sous-jacents tels que l'hypertension, les hyperlipidémies, l'obésité et le diabète.
Les praticiens prescrivant des contraceptifs oraux doivent connaître les informations suivantes relatives à ces risques.
Les informations contenues dans cette notice sont principalement basées sur des études menées chez des patientes qui utilisaient des contraceptifs oraux avec des formulations de doses d'œstrogènes et de progestatifs plus élevées que celles couramment utilisées aujourd'hui. L'effet de l'utilisation à long terme des contraceptifs oraux avec des formulations de doses plus faibles d'œstrogènes et de progestatifs reste à déterminer.
Tout au long de cet étiquetage, les études épidémiologiques rapportées sont de deux types : les études rétrospectives ou cas-témoins et les études prospectives ou de cohorte. Les études cas-témoins fournissent une mesure du risque relatif d'une maladie, à savoir un rapport entre l'incidence d'une maladie chez les utilisatrices de contraceptifs oraux et celle chez les non-utilisatrices. Le risque relatif ne renseigne pas sur la survenue clinique réelle d'une maladie. Les études de cohorte fournissent une mesure du risque attribuable, c'est-à-dire la différence d'incidence de la maladie entre les utilisatrices de contraceptifs oraux et les non-utilisatrices. Le risque attribuable fournit des informations sur l'occurrence réelle d'une maladie dans la population (Adapté des références 2 et 3 avec la permission de l'auteur). Pour plus d'informations, le lecteur est renvoyé à un texte sur les méthodes épidémiologiques.
Troubles thromboemboliques et autres problèmes vasculaires
Thromboembolie
Un risque accru de maladie thromboembolique et thrombotique associé à l'utilisation de contraceptifs oraux est bien établi. Des études cas-témoins ont montré que le risque relatif des utilisatrices par rapport aux non-utilisatrices était de 3 pour le premier épisode de maladie thromboembolique veineuse superficielle, de 4 à 11 pour la thrombose veineuse profonde ou l'embolie pulmonaire et de 1,5 à 6 pour les femmes présentant des conditions prédisposant à la maladie veineuse. maladie thromboembolique (2,3,19–24). Des études de cohorte ont montré que le risque relatif était un peu plus faible, environ 3 pour les nouveaux cas et environ 4,5 pour les nouveaux cas nécessitant une hospitalisation (25). Le risque de maladie thromboembolique associé aux contraceptifs oraux n'est pas lié à la durée d'utilisation et disparaît après l'arrêt de la pilule (2).
Plusieurs études épidémiologiques indiquent que les contraceptifs oraux de troisième génération, y compris ceux contenant du désogestrel, sont associés à un risque plus élevé de thromboembolie veineuse que certains contraceptifs oraux de deuxième génération (102-104). En général, ces études indiquent un risque accru d'environ deux fois, ce qui correspond à 1 à 2 cas supplémentaires de thromboembolie veineuse pour 10 000 femmes-années d'utilisation. Cependant, les données d'études supplémentaires n'ont pas montré cette multiplication par deux du risque.
Une augmentation de deux à quatre fois du risque relatif de complications thromboemboliques post-opératoires a été rapportée avec l'utilisation de contraceptifs oraux (9,26). Le risque relatif de thrombose veineuse chez les femmes qui ont des conditions prédisposantes est le double de celui des femmes sans ces conditions médicales (9,26). Si possible, les contraceptifs oraux doivent être interrompus au moins quatre semaines avant et pendant deux semaines après une chirurgie élective d'un type associé à une augmentation du risque thromboembolique et pendant et après une immobilisation prolongée. Étant donné que la période post-partum immédiate est également associée à un risque accru de thromboembolie, les contraceptifs oraux doivent être commencés au plus tôt quatre semaines après l'accouchement chez les femmes qui choisissent de ne pas allaiter.
Infarctus du myocarde
Un risque accru d'infarctus du myocarde a été attribué à l'utilisation de contraceptifs oraux. Ce risque concerne principalement les fumeurs ou les femmes présentant d'autres facteurs de risque sous-jacents de maladie coronarienne tels que l'hypertension, l'hypercholestérolémie, l'obésité morbide et le diabète. Le risque relatif de crise cardiaque pour les utilisatrices actuelles de contraceptifs oraux a été estimé entre deux et six (4–10). Le risque est très faible chez les femmes de moins de 30 ans.
Il a été démontré que le tabagisme en association avec l'utilisation de contraceptifs oraux contribue considérablement à l'incidence de l'infarctus du myocarde chez les femmes dans la trentaine ou plus, le tabagisme représentant la majorité des cas excédentaires (11). Il a été démontré que les taux de mortalité associés aux maladies circulatoires augmentent considérablement chez les fumeurs de plus de 35 ans et les non-fumeurs de plus de 40 ans (tableau III) chez les femmes qui utilisent des contraceptifs oraux.
TABLEAU III : TAUX DE MORTALITÉ PAR MALADIE CIRCULATOIRE POUR 100 000 FEMMES PAR ÂGE, STATUT DE FUMEUR ET UTILISATION DE CONTRACEPTIFS ORAUX
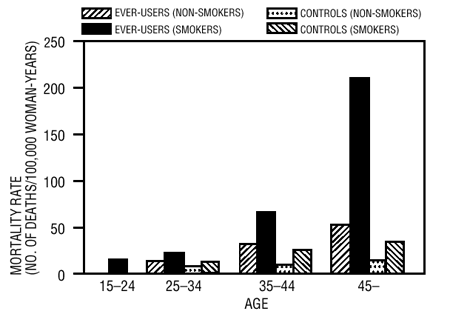
Adapté de PM Layde et V. Beral, réf. #12.
Les contraceptifs oraux peuvent aggraver les effets de facteurs de risque bien connus, tels que l'hypertension, le diabète, les hyperlipidémies, l'âge et l'obésité (13). En particulier, certains progestatifs sont connus pour diminuer le cholestérol HDL et provoquer une intolérance au glucose, tandis que les œstrogènes peuvent créer un état d'hyperinsulinisme (14-18). Il a été démontré que les contraceptifs oraux augmentent la tension artérielle chez les utilisatrices (voir AVERTISSEMENTS ). Des effets similaires sur les facteurs de risque ont été associés à un risque accru de maladie cardiaque. Les contraceptifs oraux doivent être utilisés avec prudence chez les femmes présentant des facteurs de risque de maladies cardiovasculaires.
Maladies cérébrovasculaires
Il a été démontré que les contraceptifs oraux augmentent à la fois les risques relatifs et attribuables d'événements cérébrovasculaires (accidents vasculaires cérébraux thrombotiques et hémorragiques), bien que, en général, le risque soit le plus élevé chez les femmes hypertendues plus âgées (> 35 ans) qui fument également. L'hypertension s'est avérée être un facteur de risque pour les utilisateurs et les non-utilisateurs, pour les deux types d'AVC, tandis que le tabagisme interagissait pour augmenter le risque d'AVC hémorragique (27-29).
Dans une vaste étude, il a été démontré que le risque relatif d'AVC thrombotique variait de 3 pour les utilisateurs normotendus à 14 pour les utilisateurs souffrant d'hypertension sévère (30). Le risque relatif d'AVC hémorragique serait de 1,2 pour les non-fumeuses qui utilisaient des contraceptifs oraux, de 2,6 pour les fumeuses qui n'utilisaient pas de contraceptifs oraux, de 7,6 pour les fumeuses qui utilisaient des contraceptifs oraux, de 1,8 pour les utilisatrices normotendues et de 25,7 pour les utilisatrices souffrant d'hypertension sévère ( 30). Le risque attribuable est également plus élevé chez les femmes âgées (3).
Risque lié à la dose de maladie vasculaire des contraceptifs oraux
Une association positive a été observée entre la quantité d'œstrogène et de progestatif dans les contraceptifs oraux et le risque de maladie vasculaire (31–33). Une diminution des lipoprotéines sériques de haute densité (HDL) a été signalée avec de nombreux agents progestatifs (14–16). Une diminution des lipoprotéines sériques de haute densité a été associée à une incidence accrue de cardiopathie ischémique. Étant donné que les œstrogènes augmentent le cholestérol HDL, l'effet net d'un contraceptif oral dépend de l'équilibre atteint entre les doses d'œstrogène et de progestatif et de la nature et de la quantité absolue de progestatifs utilisés dans les contraceptifs. La quantité des deux hormones doit être prise en compte dans le choix d'un contraceptif oral.
Minimiser l'exposition aux œstrogènes et aux progestatifs est conforme aux bons principes thérapeutiques. Pour toute combinaison oestrogène/progestatif particulière, le schéma posologique prescrit doit être celui qui contient le moins d'oestrogène et de progestatif compatible avec un faible taux d'échec et les besoins de chaque patient. Les nouveaux accepteurs d'agents contraceptifs oraux doivent commencer par des préparations contenant 0,035 mg ou moins d'œstrogène.
Persistance du risque de maladie vasculaire
Deux études ont montré la persistance du risque de maladie vasculaire pour les utilisatrices de contraceptifs oraux. Dans une étude aux États-Unis, le risque de développer un infarctus du myocarde après l'arrêt des contraceptifs oraux persiste pendant au moins 9 ans pour les femmes de 40 à 49 ans qui ont utilisé des contraceptifs oraux pendant cinq ans ou plus, mais ce risque accru n'a pas été démontré dans autres tranches d'âge (8). Dans une autre étude en Grande-Bretagne, le risque de développer une maladie cérébrovasculaire a persisté pendant au moins 6 ans après l'arrêt des contraceptifs oraux, bien que l'excès de risque ait été très faible (34). Cependant, les deux études ont été réalisées avec des formulations contraceptives orales contenant 50 microgrammes ou plus d'œstrogènes.
Estimations de la mortalité due à l'utilisation de contraceptifs
Une étude a recueilli des données provenant de diverses sources qui ont estimé le taux de mortalité associé à différentes méthodes de contraception à différents âges (tableau IV). Ces estimations incluent le risque combiné de décès associé aux méthodes contraceptives plus le risque attribuable à la grossesse en cas d'échec de la méthode. Chaque méthode de contraception a ses avantages et ses risques spécifiques. L'étude a conclu qu'à l'exception des utilisatrices de contraceptifs oraux de 35 ans et plus qui fument et de 40 ans et plus qui ne fument pas, la mortalité associée à toutes les méthodes de contraception est faible et inférieure à celle associée à l'accouchement.
L'observation d'une augmentation possible du risque de mortalité avec l'âge pour les utilisatrices de contraceptifs oraux est basée sur des données recueillies dans les années 1970 - mais non rapportées avant 1983 (35). Cependant, la pratique clinique actuelle implique l'utilisation de formulations à faible teneur en œstrogènes combinées à un examen attentif des facteurs de risque.
En raison de ces changements dans la pratique et, également, en raison de certaines nouvelles données limitées qui suggèrent que le risque de maladie cardiovasculaire associé à l'utilisation de contraceptifs oraux pourrait maintenant être inférieur à celui observé précédemment (100,101), le Comité consultatif sur les médicaments pour la fertilité et la santé maternelle a été demandé d'examiner le sujet en 1989. Le Comité a conclu que bien que les risques de maladies cardiovasculaires puissent être augmentés avec l'utilisation de contraceptifs oraux après l'âge de 40 ans chez les femmes non-fumeuses en bonne santé (même avec les nouvelles formulations à faible dose), il existe également des risques potentiels plus importants pour la santé associées à la grossesse chez les femmes âgées et aux procédures chirurgicales et médicales alternatives qui peuvent être nécessaires si ces femmes n'ont pas accès à des moyens de contraception efficaces et acceptables.
Par conséquent, le Comité a recommandé que les avantages de l'utilisation de contraceptifs oraux à faible dose par les femmes non-fumeuses en bonne santé de plus de 40 ans puissent l'emporter sur les risques éventuels. Bien sûr, les femmes âgées, comme toutes les femmes qui prennent des contraceptifs oraux, doivent prendre la formulation à la dose la plus faible possible qui soit efficace.
TABLEAU IV : NOMBRE ANNUEL DE DÉCÈS LIÉS À LA NAISSANCE OU À LA MÉTHODE ASSOCIÉS AU CONTRÔLE DE LA FERTILITÉ POUR 100 000 FEMMES NON STÉRILES, PAR MÉTHODE DE CONTRÔLE DE LA FERTILITÉ SELON L'ÂGE
Carcinome des organes reproducteurs et des seins
De nombreuses études épidémiologiques ont été réalisées sur l'incidence des cancers du sein, de l'endomètre, de l'ovaire et du col de l'utérus chez les femmes utilisant des contraceptifs oraux. Bien qu'il existe des rapports contradictoires, la plupart des études suggèrent que l'utilisation de contraceptifs oraux n'est pas associée à une augmentation globale du risque de développer un cancer du sein. Certaines études ont rapporté un risque relatif accru de développer un cancer du sein, en particulier à un plus jeune âge. Ce risque relatif accru semble lié à la durée d'utilisation (36–43, 79–89).
Certaines études suggèrent que l'utilisation de contraceptifs oraux a été associée à une augmentation du risque de néoplasie cervicale intra-épithéliale dans certaines populations de femmes (45-48). Cependant, il continue d'y avoir une controverse sur la mesure dans laquelle ces résultats peuvent être dus à des différences de comportement sexuel et à d'autres facteurs.
Néoplasie hépatique
Les adénomes hépatiques bénins sont associés à l'utilisation de contraceptifs oraux, bien que l'incidence des tumeurs bénignes soit rare aux États-Unis. Des calculs indirects ont estimé que le risque attribuable était de l'ordre de 3,3 cas/100 000 pour les utilisatrices, un risque qui augmente après quatre ans ou plus d'utilisation, en particulier avec les contraceptifs oraux à dose plus élevée (49). La rupture d'adénomes hépatiques rares et bénins peut entraîner la mort par hémorragie intra-abdominale (50,51).
Des études britanniques ont montré un risque accru de développer un carcinome hépatocellulaire (52–54) chez les utilisatrices de contraceptifs oraux à long terme (> 8 ans). Cependant, ces cancers sont extrêmement rares aux États-Unis et le risque attribuable (l'incidence excessive) de cancers du foie chez les utilisatrices de contraceptifs oraux approche moins d'un par million d'utilisatrices.
Lésions oculaires
Des cas cliniques de thrombose rétinienne associés à l'utilisation de contraceptifs oraux ont été rapportés. Les contraceptifs oraux doivent être arrêtés en cas de perte de vision partielle ou complète inexpliquée ; apparition d'exophtalmie ou de diplopie ; œdème papillaire; ou des lésions vasculaires rétiniennes. Des mesures diagnostiques et thérapeutiques appropriées doivent être prises immédiatement.
Utilisation de contraceptifs oraux avant ou pendant le début de la grossesse
Des études épidémiologiques approfondies n'ont révélé aucun risque accru de malformations congénitales chez les femmes qui ont utilisé des contraceptifs oraux avant la grossesse (55–57). Les études ne suggèrent pas non plus d'effet tératogène, notamment en ce qui concerne les anomalies cardiaques et les malformations des membres (55,56,58,59), lorsque des contraceptifs oraux sont pris par inadvertance en début de grossesse.
L'administration de contraceptifs oraux pour induire une hémorragie de privation ne doit pas être utilisée comme test de grossesse. Les contraceptifs oraux ne doivent pas être utilisés pendant la grossesse pour traiter la menace d'avortement ou l'avortement habituel. Il est recommandé que pour toute patiente qui a manqué deux règles consécutives, une grossesse soit exclue avant de continuer à utiliser un contraceptif oral. Si la patiente n'a pas respecté le calendrier prescrit, la possibilité d'une grossesse doit être envisagée dès la première période manquée. L'utilisation de contraceptifs oraux doit être interrompue jusqu'à ce qu'une grossesse soit exclue.
Maladie de la vésicule biliaire
Des études antérieures ont signalé une augmentation du risque relatif à vie de chirurgie de la vésicule biliaire chez les utilisatrices de contraceptifs oraux et d'œstrogènes (60,61). Cependant, des études plus récentes ont montré que le risque relatif de développer une maladie de la vésicule biliaire chez les utilisatrices de contraceptifs oraux peut être minime (62–64). Les découvertes récentes de risque minimal peuvent être liées à l'utilisation de formulations contraceptives orales contenant des doses hormonales plus faibles d'œstrogènes et de progestatifs.
Effets métaboliques des glucides et des lipides
Il a été démontré que les contraceptifs oraux provoquent une diminution de la tolérance au glucose chez un pourcentage important d'utilisateurs (17). Les contraceptifs oraux contenant plus de 75 microgrammes d'œstrogènes provoquent un hyperinsulinisme, tandis que des doses plus faibles d'œstrogènes provoquent moins d'intolérance au glucose (65). Les progestatifs augmentent la sécrétion d'insuline et créent une résistance à l'insuline, cet effet variant selon les différents agents progestatifs (17, 66). Cependant, chez la femme non diabétique, les contraceptifs oraux semblent n'avoir aucun effet sur la glycémie à jeun (67). En raison de ces effets démontrés, les femmes prédiabétiques et diabétiques doivent être étroitement surveillées pendant la prise de contraceptifs oraux.
Une petite proportion de femmes auront une hypertriglycéridémie persistante pendant qu'elles prennent la pilule. Comme discuté précédemment (voir AVERTISSEMENTS ), des modifications des taux sériques de triglycérides et de lipoprotéines ont été signalées chez des utilisatrices de contraceptifs oraux.
Pression artérielle élevée
Une augmentation de la pression artérielle a été signalée chez les femmes prenant des contraceptifs oraux (68) et cette augmentation est plus probable chez les utilisatrices de contraceptifs oraux plus âgées (69) et en cas d'utilisation continue (61). Les données du Royal College of General Practitioners (12) et des essais randomisés ultérieurs ont montré que l'incidence de l'hypertension augmente avec l'augmentation des quantités de progestatifs.
Les femmes ayant des antécédents d'hypertension ou de maladies liées à l'hypertension, ou de maladie rénale (70) devraient être encouragées à utiliser une autre méthode de contraception. Si les femmes choisissent d'utiliser des contraceptifs oraux, elles doivent être étroitement surveillées et en cas d'élévation significative de la pression artérielle, les contraceptifs oraux doivent être arrêtés. Pour la plupart des femmes, une tension artérielle élevée reviendra à la normale après l'arrêt des contraceptifs oraux (69), et il n'y a pas de différence dans la survenue d'hypertension entre les utilisatrices et les non-utilisatrices (68,70,71).
Mal de tête
L'apparition ou l'exacerbation d'une migraine ou le développement d'une céphalée d'un nouveau type récurrent, persistant ou sévère nécessite l'arrêt des contraceptifs oraux et l'évaluation de la cause.
Irrégularités de saignement
Des saignements intermenstruels et des spottings sont parfois rencontrés chez les patientes sous contraceptifs oraux, en particulier au cours des trois premiers mois d'utilisation. Les causes non hormonales doivent être envisagées et des mesures diagnostiques adéquates doivent être prises pour exclure une tumeur maligne ou une grossesse en cas de saignement intermenstruel, comme dans le cas de tout saignement vaginal anormal. Si la pathologie a été exclue, le temps ou un changement vers une autre formulation peut résoudre le problème. En cas d'aménorrhée, une grossesse doit être exclue.
Certaines femmes peuvent rencontrer une aménorrhée ou une oligoménorrhée post-pilule, en particulier lorsqu'une telle condition était préexistante.
Grossesse extra-utérine
Des grossesses extra-utérines et intra-utérines peuvent survenir en cas d'échec de la contraception.
PRÉCAUTIONS
Général
Les patients doivent être informés que ce produit ne protège pas contre l'infection par le VIH (SIDA) et d'autres maladies sexuellement transmissibles.
Examen physique et suivi
C'est une bonne pratique médicale pour toutes les femmes d'avoir des antécédents annuels et des examens physiques, y compris les femmes utilisant des contraceptifs oraux. L'examen physique, cependant, peut être reporté jusqu'après le début des contraceptifs oraux si demandé par la femme et jugé approprié par le clinicien. L'examen physique doit inclure une référence particulière à la pression artérielle, aux seins, à l'abdomen et aux organes pelviens, y compris la cytologie cervicale et les tests de laboratoire pertinents. En cas de saignements vaginaux anormaux non diagnostiqués, persistants ou récurrents, des mesures appropriées doivent être prises pour exclure une malignité. Les femmes ayant de forts antécédents familiaux de cancer du sein ou qui présentent des nodules mammaires doivent faire l'objet d'une surveillance particulière.
Troubles lipidiques
Les femmes qui sont traitées pour des hyperlipidémies doivent être suivies de près si elles choisissent d'utiliser des contraceptifs oraux. Certains progestatifs peuvent élever les taux de LDL et rendre plus difficile le contrôle des hyperlipidémies.
La fonction hépatique
Si la jaunisse se développe chez une femme recevant de tels médicaments, le médicament doit être interrompu. Les hormones stéroïdes peuvent être mal métabolisées chez les patients présentant une fonction hépatique altérée.
Rétention d'eau
Les contraceptifs oraux peuvent provoquer un certain degré de rétention d'eau. Ils doivent être prescrits avec prudence, et uniquement avec une surveillance étroite, chez les patients présentant des affections susceptibles d'être aggravées par une rétention hydrique.
Troubles émotionnels
Les femmes ayant des antécédents de dépression doivent être étroitement surveillées et le médicament doit être interrompu si la dépression se reproduit à un degré grave.
Lentilles de contact
Les porteurs de lentilles de contact qui développent des changements visuels ou des changements dans la tolérance aux lentilles doivent être évalués par un ophtalmologiste.
Carcinogenèse
Voir AVERTISSEMENTS section.
Grossesse
Catégorie de grossesse X (voir CONTRE-INDICATIONS et AVERTISSEMENTS sections).
Mères allaitantes
De petites quantités de stéroïdes contraceptifs oraux ont été identifiées dans le lait des mères allaitantes et quelques effets indésirables sur l'enfant ont été signalés, notamment la jaunisse et l'hypertrophie mammaire. De plus, les contraceptifs oraux administrés pendant la période post-partum peuvent interférer avec la lactation en diminuant la quantité et la qualité du lait maternel. Si possible, il faut conseiller à la mère qui allaite de ne pas utiliser de contraceptifs oraux mais d'utiliser d'autres formes de contraception jusqu'à ce qu'elle ait complètement sevré son enfant.
Utilisation pédiatrique
L'innocuité et l'efficacité des comprimés de Mircette® (désogestrel/éthinylestradiol et éthinylestradiol) ont été établies chez les femmes en âge de procréer. L'innocuité et l'efficacité devraient être les mêmes pour les adolescents postpubères de moins de 16 ans et pour les utilisateurs de 16 ans et plus. L'utilisation de ce produit avant la ménarche n'est pas indiquée.
Informations pour le patient
Voir Étiquetage des patients
RÉFÉRENCES
1. Hatcher RA, Trussell J, Stewart F et al. Contraceptive Technology : Seventeenth Revised Edition, New York : Irvington Publishers, 1998, sous presse.
2. Stadel BV. Contraceptifs oraux et maladies cardiovasculaires. (Partie 1). N Engl J Med 1981; 305 : 612–618.
3. Stadel BV. Contraceptifs oraux et maladies cardiovasculaires. (Partie 2). N Engl J Med 1981; 305:672–677.
4. Adam SA, Thorogood M. La contraception orale et l'infarctus du myocarde revisités : les effets des nouvelles préparations et des modèles de prescription. Br J Obstet et Gynecol 1981; 88:838–845.
5. Mann JI, Inman WH. Contraceptifs oraux et décès par infarctus du myocarde. Br Med J 1975; 2(5965):245–248.
6. Mann JI, Vessey MP, Thorogood M, Doll R. Infarctus du myocarde chez les jeunes femmes avec une référence particulière à la pratique de la contraception orale. Br Med J 1975; 2(5956):241–245.
7. Étude sur la contraception orale du Royal College of General Practitioners : Analyses supplémentaires de la mortalité chez les utilisatrices de contraceptifs oraux. Lancette 1981 ; 1:541–546.
8. Slone D, Shapiro S, Kaufman DW, Rosenberg L, Miettinen OS, Stolley PD. Risque d'infarctus du myocarde lié à l'utilisation actuelle et interrompue de contraceptifs oraux. N Engl J Med 1981; 305:420–424.
9. Député de Vessey. Hormones féminines et maladies vasculaires - un aperçu épidémiologique. Br J Fam Plann 1980; 6:1–12.
10. Russell-Briefel RG, Ezzati TM, Fulwood R, Perlman JA, Murphy RS. Statut de risque cardiovasculaire et utilisation de contraceptifs oraux, États-Unis, 1976–80. Prevent Med 1986; 15:352–362.
11. Goldbaum GM, Kendrick JS, Hogelin GC, Gentry EM. L'impact relatif du tabagisme et de l'utilisation de contraceptifs oraux sur les femmes aux États-Unis. JAMA 1987; 258:1339–1342.
12. Layde PM, Beral V. Analyses complémentaires de la mortalité chez les utilisatrices de contraceptifs oraux : étude sur la contraception orale des médecins généralistes du Collège royal. (Tableau 5) Lancet 1981 ; 1:541–546.
13. Knopp RH. Risque d'artériosclérose : rôles des contraceptifs oraux et des œstrogènes post-ménopausiques. J Reprod Med 1986; 31(9) (Supplément):913–921.
14. Krauss RM, Roy S, Mishell DR, Casagrande J, Pike MC. Effets de deux contraceptifs oraux à faible dose sur les lipides sériques et les lipoprotéines : changements différentiels dans les sous-classes de lipoprotéines de haute densité. Am J Obstet 1983; 145:446–452.
15. Wahl P, Walden C, Knopp R, Hoover J, Wallace R, Heiss G, Rifkind B. Effet de la puissance des œstrogènes/progestatifs sur le cholestérol lipidique/lipoprotéique. N Engl J Med 1983; 308 : 862–867.
16. Wynn V, Niththyananthan R. L'effet du progestatif dans les contraceptifs oraux combinés sur les lipides sériques avec une référence particulière aux lipoprotéines de haute densité. Am J Obstet Gynecol 1982; 142:766–771.
17. Wynn V, Godsland I. Effets des contraceptifs oraux et du métabolisme des glucides. J Reprod Med 1986; 31 (9) (Supplément):892–897.
18. LaRosa JC. Facteurs de risque d'athérosclérose dans les maladies cardiovasculaires. J Reprod Med 1986; 31 (9) (Supplément):906–912.
19. Inman WH, député de Vessey. Enquête sur les décès par thrombose et embolie pulmonaires, coronariennes et cérébrales chez les femmes en âge de procréer. Br Med J 1968; 2 (5599):193–199.
20. Maguire MG, Tonascia J, Sartwell PE, Stolley PD, Tockman MS. Risque accru de thrombose due aux contraceptifs oraux: un autre rapport. Am J Epidémiol 1979; 110 (2):188–195.
21. Pettiti DB, Wingerd J, Pellegrin F, Ramacharan S. Risque de maladie vasculaire chez les femmes : tabagisme, contraceptifs oraux, œstrogènes non contraceptifs et autres facteurs. JAMA 1979; 242:1150–1154.
22. Vessey MP, Doll R. Enquête sur la relation entre l'utilisation de contraceptifs oraux et la maladie thromboembolique. Br Med J 1968; 2 (5599):199–205.
23. Vessey MP, Doll R. Enquête sur la relation entre l'utilisation de contraceptifs oraux et la maladie thromboembolique. Un autre rapport. Br Med J 1969; 2 (5658):651–657.
24. Porter JB, Hunter JR, Danielson DA, Jick H, Stergachis A. Contraceptifs oraux et maladies vasculaires non mortelles - expérience récente. Obstet Gynecol 1982; 59 (3):299–302.
25. Vessey M, Doll R, Peto R, Johnson B, Wiggins P. Une étude de suivi à long terme des femmes utilisant différentes méthodes de contraception : un rapport intermédiaire. Biosocial Sci 1976; 8:375–427.
26. Collège royal des médecins généralistes : contraceptifs oraux, thrombose veineuse et varices. J Royal Coll Gen Pract 1978; 28:393–399.
27. Groupe collaboratif pour l'étude des accidents vasculaires cérébraux chez les jeunes femmes : contraception orale et risque accru d'ischémie cérébrale ou de thrombose. N Engl J Med 1973; 288 : 871–878.
28. Petitti DB, Wingerd J. Utilisation de contraceptifs oraux, tabagisme et risque d'hémorragie sous-arachnoïdienne. Lancette 1978 ; 2:234–236.
29. Inman WH. Contraceptifs oraux et hémorragie sous-arachnoïdienne mortelle. Br Med J 1979; 2 (6203):1468–70.
30. Groupe collaboratif pour l'étude de l'AVC chez la jeune femme : Contraceptifs oraux et AVC chez la jeune femme : facteurs de risque associés. JAMA 1975; 231:718–722.
31. Inman WH, Vessey MP, Westerholm B, Engelund A. Maladie thromboembolique et contenu stéroïdien des contraceptifs oraux. Un rapport au Comité sur la sécurité des médicaments. Br Med J 1970; 2:203–209.
32. Meade TW, Greenberg G, Thompson SG. Progestatifs et réactions cardiovasculaires associés aux contraceptifs oraux et comparaison de l'innocuité des préparations d'œstrogènes à 50 et 35 mcg. Br Med J 1980; 280 (6224):1157–1161.
33. Kay CR. Les progestatifs et les maladies artérielles - preuves de l'étude du Collège royal des médecins généralistes. Am J Obstet Gynecol 1982; 142:762–765.
34. Royal College of General Practitioners : Incidence de la maladie artérielle chez les utilisatrices de contraceptifs oraux. J Royal Coll Gen Pract 1983; 33:75–82.
35. Ory HW. Mortalité associée à la fécondité et au contrôle de la fécondité : 1983. Family Planning Perspectives 1983 ; 15:50–56.
36. L'étude sur le cancer et les hormones stéroïdes des Centers for Disease Control et de l'Institut national de la santé infantile et du développement humain : utilisation de contraceptifs oraux et risque de cancer du sein. N Engl J Med 1986; 315:405–411.
37. Pike MC, Henderson BE, Krailo MD, Duke A, Roy S. Risque de cancer du sein chez les jeunes femmes et utilisation de contraceptifs oraux : effet modificateur possible de la formulation et de l'âge d'utilisation. Lancette 1983 ; 2:926–929.
38. Paul C, Skegg DG, Spears GFS, Kaldor JM. Contraceptifs oraux et cancer du sein : Une étude nationale. Br Med J 1986; 293:723–725.
39. Miller DR, Rosenberg L, Kaufman DW, Schottenfeld D, Stolley PD, Shapiro S. Risque de cancer du sein en relation avec l'utilisation précoce de contraceptifs oraux. Obstet Gynecol 1986; 68:863–868.
40. Olson H, Olson KL, Moller TR, Ranstam J, Holm P. Utilisation de contraceptifs oraux et cancer du sein chez les jeunes femmes en Suède (lettre). Lancette 1985 ; 2:748–749.
41. McPherson K, Vessey M, Neil A, Doll R, Jones L, Roberts M. Utilisation précoce de contraceptifs et cancer du sein : Résultats d'une autre étude cas-témoin. Br J Cancer 1987; 56:653–660
42. Huggins GR, Zucker PF. Contraceptifs oraux et néoplasie : mise à jour de 1987. Fertil Steril 1987; 47:733–761.
43. McPherson K, Drife JO. La pilule et le cancer du sein : pourquoi l'incertitude ? Br Med J 1986; 293:709–710.
45. Ory H, Naib Z, Conger SB, Hatcher RA, Tyler CW. Choix contraceptif et prévalence de la dysplasie cervicale et du carcinome in situ. Am J Obstet Gynecol 1976; 124:573–577.
46. Vessey MP, Lawless M, McPherson K, Yeates D. Néoplasie du col de l'utérus et contraception : un possible effet indésirable de la pilule. Lancette 1983 ; 2:930.
47. Brinton LA, Huggins GR, Lehman HF, Malli K, Savitz DA, Trapido E, Rosenthal J, Hoover R. Utilisation à long terme de contraceptifs oraux et risque de cancer invasif du col de l'utérus. Int J Cancer 1986; 38:339–344.
48. Étude collaborative de l'OMS sur la néoplasie et les contraceptifs stéroïdiens : cancer invasif du col de l'utérus et contraceptifs oraux combinés. Br Med J 1985; 209 :961–965.
49. Rooks JB, Ory HW, Ishak KG, Strauss LT, Greenspan JR, Hill AP, Tyler CW. Epidémiologie de l'adénome hépatocellulaire : place de la contraception orale. JAMA 1979; 242:644–648.
50. Bein NN, orfèvre HS. Hémorragie massive récurrente de tumeurs hépatiques bénignes secondaire aux contraceptifs oraux. Br J Surg 1977; 64:433–435.
51. Klatskin G. Tumeurs hépatiques : relation possible avec l'utilisation de contraceptifs oraux. Gastro-entérologie 1977 ; 73:386–394.
52. Henderson BE, Preston-Martin S, Edmondson HA, Peters RL, Pike MC. Carcinome hépatocellulaire et contraceptifs oraux. Br J Cancer 1983; 48:437–440.
53. Neuberger J, Forman D, Doll R, Williams R. Contraceptifs oraux et carcinome hépatocellulaire. Br Med J 1986; 292:1355–1357.
54. Forman D, Vincent TJ, Doll R. Cancer du foie et contraceptifs oraux. Br Med J 1986; 292 :1357–1361.
55. Harlap S, Eldor J. Naissances suite à des échecs de contraception orale. Obstet Gynecol 1980; 55:447–452.
56. Savolainen E, Saksela E, Saxen L. Dangers tératogènes des contraceptifs oraux analysés dans un registre national des malformations. Am J Obstet Gynecol 1981; 140:521–524.
57. Janerich DT, Piper JM, Glebatis DM. Contraceptifs oraux et anomalies congénitales. Am J Epidémiol 1980; 112:73–79.
58. Ferencz C, Matanoski GM, Wilson PD, Rubin JD, Neill CA, Gutberlet R. Hormonothérapie maternelle et cardiopathie congénitale. Tératologie 1980 ; 21:225–239.
59. Rothman KJ, Fyler DC, Goldbatt A, Kreidberg MB. Hormones exogènes et autres expositions aux médicaments des enfants atteints de cardiopathie congénitale. Am J Epidémiol 1979; 109:433–439.
60. Boston Collaborative Drug Surveillance Program : contraceptifs oraux et maladie thromboembolique veineuse, maladie de la vésicule biliaire confirmée chirurgicalement et tumeurs du sein. Lancette 1973 ; 1:1399–1404.
61. Royal College of General Practitioners : Contraceptifs oraux et santé. New York, Pitman, 1974.
62. Layde PM, Vessey MP, Yeates D. Risque de maladie de la vésicule biliaire : une étude de cohorte de jeunes femmes fréquentant des cliniques de planification familiale. J Epidemiol Community Health 1982; 36:274–278.
63. Groupe de Rome pour l'épidémiologie et la prévention de la lithiase biliaire (GREPCO): Prévalence de la maladie des calculs biliaires dans une population féminine adulte italienne. Am J Epidémiol 1984; 119 : 796–805.
64. Strom BL, Tamragouri RT, Morse ML, Lazar EL, West SL, Stolley PD, Jones JK. Contraceptifs oraux et autres facteurs de risque de maladie de la vésicule biliaire. Clin Pharmacol Ther 1986; 39:335–341.
65. Wynn V, Adams PW, Godsland IF, Melrose J, Niththyananthan R, Oakley NW, Seedj A. Comparaison des effets de différentes formulations combinées orales-contraceptives sur le métabolisme des glucides et des lipides. Lancette 1979 ; 1:1045–1049.
66. Wynn V. Effet de la progestérone et des progestatifs sur le métabolisme des glucides. En progestérone et progestatif. Edité par Bardin CW, Milgrom E, Mauvis-Jarvis P. New York, Raven Press, 1983 pp. 395–410.
67. Perlman JA, Roussell-Briefel RG, Ezzati TM, Lieberknecht G. Oral tolérance au glucose et la puissance des progestatifs contraceptifs oraux. J Chronic Dis 1985; 38:857–864.
68. Étude sur la contraception orale du Collège royal des médecins généralistes : effet sur l'hypertension et les maladies bénignes du sein du composant progestatif dans les contraceptifs oraux combinés. Lancet 1977;
69. Fisch IR, Frank J. Contraceptifs oraux et tension artérielle. JAMA 1977; 237:2499-2503.
70. Laragh AJ. Hypertension induite par les contraceptifs oraux - neuf ans plus tard. Am J Obstet Gynecol 1976; 126:141–147.
71. Ramcharan S, Peritz E, Pellegrin FA, Williams WT. Incidence de l'hypertension dans la cohorte de l'étude sur les médicaments contraceptifs de Walnut Creek. Dans la pharmacologie des médicaments contraceptifs stéroïdiens. Garattini S, Berendes HW. Éd. New York, Raven Press, 1977, p. 277-288. (Monographies de l'Institut Mario Negri de Recherche Pharmacologique, Milan).
73. L'étude sur le cancer et les hormones stéroïdes des Centers for Disease Control et de l'Institut national de la santé infantile et du développement humain : utilisation de contraceptifs oraux et risque de cancer de l'ovaire. JAMA 1983; 249:1596–1599.
79. Schlesselman J, Stadel BV, Murray P, Lai S. Cancer du sein en relation avec l'utilisation précoce des contraceptifs oraux 1988 ; 259:1828–1833.
80. Hennekens CH, Speizer FE, Lipnick RJ, Rosner B, Bain C, Belanger C, Stampfer MJ, Willett W, Peto R. Une étude cas-témoins sur l'utilisation de contraceptifs oraux et le cancer du sein. JNCI 1984 ; 72:39–42.
81. LaVecchia C, Decarli A, Fasoli M, Franceschi S, Gentile A, Negri E, Parazzini F, Tognoni G. Contraceptifs oraux et cancers du sein et du tractus génital féminin. Résultats provisoires d'une étude cas-témoin. Br. J. Cancer 1986; 54:311–317.
82. Meirik O, Lund E, Adami H, Bergstrom R, Christoffersen T, Bergsjo P. Utilisation de contraceptifs oraux dans le cancer du sein chez les jeunes femmes. Une étude cas-témoin nationale conjointe en Suède et en Norvège. Lancet 1986; 11:650–654.
83. Kay CR, Hannaford PC. Le cancer du sein et la pilule—Un autre rapport de l'étude sur la contraception orale du Royal College of General Practitioners. Br. J. Cancer 1988; 58:675–680.
84. Stadel BV, Lai S, Schlesselman JJ, Murray P. Contraceptifs oraux et cancer du sein préménopausique chez les femmes nullipares. Contraception 1988; 38:287–299.
85. Miller DR, Rosenberg L, Kaufman DW, Stolley P, Warshauer ME, Shapiro S. Cancer du sein avant 45 ans et utilisation de contraceptifs oraux : nouvelles découvertes. Un m. J. Epidemiol 1989; 129:269–280.
86. Groupe d'étude national cas-témoin du Royaume-Uni, Utilisation de contraceptifs oraux et risque de cancer du sein chez les jeunes femmes. Lancet 1989; 1:973–982.
87. Schlesselman JJ. Cancer du sein et de l'appareil reproducteur en relation avec l'utilisation de contraceptifs oraux. Contraception 1989; 40:1–38.
88. Vessey MP, McPherson K, Villard-Mackintosh L, Yeates D. Contraceptifs oraux et cancer du sein : derniers résultats d'une vaste étude de cohorte. Br. J. Cancer 1989; 59:613–617.
89. Jick SS, Walker AM, Stergachis A, Jick H. Contraceptifs oraux et cancer du sein. Br. J. Cancer 1989; 59:618–621.
100. Porter JB, Hunter J, Jick H et al. Contraceptifs oraux et maladies vasculaires non mortelles. Obstet Gynecol 1985; 66:1–4.
101. Porter JB, Jick H, Walker AM. Mortalité chez les utilisatrices de contraceptifs oraux. Obstet Gynecol 1987; 7029–32.
102. Jick H, Jick SS, Gurewich V, Myers MW, Vasilakis C. Risque de décès cardiovasculaire idiopathique et de thromboembolie veineuse non mortelle chez les femmes utilisant des contraceptifs oraux avec différents composants progestatifs. Lancette, 1995 ; 346:1589–93.
103. Étude collaborative de l'Organisation mondiale de la santé sur les maladies cardiovasculaires et la contraception hormonale stéroïdienne. Effet de différents progestatifs dans les contraceptifs oraux à faible teneur en œstrogènes sur la maladie thromboembolique veineuse. Lancette, 1995 ; 346:1582–88.
104. Spitzer WO, Lewis MA, Heinemann LAJ, Thorogood M, MacRae KD au nom du Groupe de recherche transnational sur les contraceptifs oraux et la santé des jeunes femmes. Contraceptifs oraux de troisième génération et risque de troubles thromboemboliques veineux : une étude cas-témoin internationale. Br Med J, 1996; 312:83–88.
105. Christensen J, Petrenaite V, Atterman J, et al. Les contraceptifs oraux induisent le métabolisme de la lamotrigine : preuves d'un essai en double aveugle contrôlé par placebo. Épilepsie 2007;48(3):484-489.
SURDOSAGE
Aucun effet nocif grave n'a été signalé après l'ingestion aiguë de fortes doses de contraceptifs oraux par de jeunes enfants. Un surdosage peut provoquer des nausées et des saignements de privation peuvent survenir chez les femmes.
Avantages pour la santé non contraceptifs
Les avantages pour la santé non contraceptifs suivants liés à l'utilisation de contraceptifs oraux sont étayés par des études épidémiologiques qui ont largement utilisé des formulations de contraceptifs oraux contenant des doses d'œstrogène supérieures à 0,035 mg d'éthinylestradiol ou 0,05 mg de mestranol (73–78).
Effets sur les règles
- augmentation de la régularité du cycle menstruel
- diminution de la perte de sang et diminution de l'incidence de l'anémie ferriprive
- diminution de l'incidence de la dysménorrhée
Effets liés à l'inhibition de l'ovulation
- diminution de l'incidence des kystes ovariens fonctionnels
- diminution de l'incidence des grossesses extra-utérines
Effets d'une utilisation à long terme
- diminution de l'incidence des fibroadénomes et de la maladie fibrokystique du sein
- diminution de l'incidence des maladies inflammatoires pelviennes aiguës
- diminution de l'incidence du cancer de l'endomètre
- diminution de l'incidence du cancer de l'ovaire
CONTRE-INDICATIONS
Les contraceptifs oraux ne doivent pas être utilisés chez les femmes qui ont actuellement les conditions suivantes :
- Thrombophlébite ou troubles thromboemboliques
- Antécédents de thrombophlébite veineuse profonde ou de troubles thromboemboliques
- Maladie vasculaire cérébrale ou coronarienne
- Carcinome du sein connu ou suspecté
- Carcinome de l'endomètre ou autre néoplasie dépendante des œstrogènes connue ou suspectée
- Saignements génitaux anormaux non diagnostiqués
- Ictère cholestatique de la grossesse ou ictère avec utilisation antérieure de la pilule
- Adénomes ou carcinomes hépatiques
- Grossesse connue ou suspectée
PHARMACOLOGIE CLINIQUE
Les contraceptifs oraux combinés agissent par suppression des gonadotrophines. Bien que le principal mécanisme de cette action soit l'inhibition de l'ovulation, d'autres altérations comprennent des modifications de la glaire cervicale (qui augmentent la difficulté d'entrée des spermatozoïdes dans l'utérus) et de l'endomètre (qui réduisent la probabilité d'implantation).
Des études de liaison aux récepteurs, ainsi que des études chez l'animal, ont montré que l'étonogestrel, le métabolite biologiquement actif du désogestrel, associe une activité progestative élevée à une androgénicité intrinsèque minimale (91,92). La pertinence de cette dernière découverte chez l'homme est inconnue.
Pharmacocinétique
Absorption
Le désogestrel est rapidement et presque complètement absorbé et converti en étonogestrel, son métabolite biologiquement actif. Après administration orale, la biodisponibilité relative du désogestrel par rapport à une solution, mesurée par les taux sériques d'étonogestrel, est d'environ 100 %. Les comprimés Mircette® (désogestrel/éthinylestradiol et éthinylestradiol) fournissent deux régimes différents d'éthinylestradiol; 0,02 mg dans le comprimé combiné [blanc] ainsi que 0,01 mg dans le comprimé jaune. L'éthinylestradiol est rapidement et presque complètement absorbé. Après une dose unique de comprimé combiné Mircette® [blanc], la biodisponibilité relative de l'éthinylestradiol est d'environ 93 % tandis que la biodisponibilité relative du comprimé de 0,01 mg [jaune] est de 99 %. L'effet de la nourriture sur la biodisponibilité des comprimés Mircette® après administration orale n'a pas été évalué.
La pharmacocinétique de l'étonogestrel et de l'éthinylestradiol suite à l'administration de doses multiples de comprimés Mircette® a été déterminée au cours du troisième cycle chez 17 sujets. Les concentrations plasmatiques d'étonogestrel et d'éthinylestradiol ont atteint l'état d'équilibre au jour 21. L'ASC(0–24) de l'étonogestrel à l'état d'équilibre au jour 21 était environ 2,2 fois supérieure à l'ASC(0–24) au jour 1 du troisième cycle . Les paramètres pharmacocinétiques de l'étonogestrel et de l'éthinylestradiol au cours du troisième cycle suivant l'administration de doses multiples de comprimés Mircette® sont résumés dans le tableau I.
TABLEAU I : PARAMÈTRES PHARMACOCINÉTIQUES MOYENS (ÉT) DE Mircette® SUR UNE PÉRIODE DE POSOLOGIE DE 28 JOURS AU TROISIÈME CYCLE (n=17).
Distribution
L'étonogestrel, le métabolite actif du désogestrel, s'est avéré lié à 99 % aux protéines, principalement à la globuline liant les hormones sexuelles (SHBG). L'éthinylestradiol est lié à environ 98,3 %, principalement à l'albumine plasmatique. L'éthinylestradiol ne se lie pas à la SHBG, mais induit la synthèse de la SHBG. Le désogestrel, en association avec l'éthinylestradiol, ne contrecarre pas l'augmentation de la SHBG induite par les œstrogènes, entraînant une baisse des taux sériques de testostérone libre (96–99).
Métabolisme
Désogestrel :
Le désogestrel est rapidement et complètement métabolisé par hydroxylation dans la muqueuse intestinale et lors du premier passage dans le foie en étonogestrel. D'autres métabolites (c'est-à-dire, 3α-OH-désogestrel, 3β-OHdésogestrel et 3α-OH-5α-H-désogestrel) sans action pharmacologique ont également été identifiés et ces métabolites peuvent subir une conjugaison glucuronide et sulfate.
Éthinylestradiol :
L'éthinylestradiol est sujet à un degré significatif de conjugaison présystémique (métabolisme de phase II). L'éthinylestradiol s'échappant de la conjugaison de la paroi intestinale subit un métabolisme de phase I et une conjugaison hépatique (métabolisme de phase II). Les principaux métabolites de phase I sont le 2-OH-éthinyl estradiol et le 2-méthoxy-éthinyl estradiol. Les conjugués sulfate et glucuronide de l'éthinylestradiol et des métabolites de phase I, qui sont excrétés dans la bile, peuvent subir une circulation entérohépatique.
Excrétion
L'étonogestrel et l'éthinylestradiol sont excrétés dans l'urine, la bile et les fèces. À l'état d'équilibre, au jour 21, la demi-vie d'élimination de l'étonogestrel est de 27,8 ± 7,2 heures et la demi-vie d'élimination de l'éthinylestradiol pour le comprimé combiné est de 23,9 ± 25,5 heures. Pour le comprimé d'éthinylestradiol à 0,01 mg [jaune], la demi-vie d'élimination à l'état d'équilibre, jour 28, est de 18,9 ± 8,3 heures.
Populations particulières
Course
Il n'existe aucune information permettant de déterminer l'effet de la race sur la pharmacocinétique des comprimés Mircette® (désogestrel/éthinylestradiol et éthinylestradiol).
Insuffisance hépatique
Aucune étude formelle n'a été menée pour évaluer l'effet d'une maladie hépatique sur l'élimination de Mircette®.
Insuffisance rénale
Aucune étude formelle n'a été menée pour évaluer l'effet de la maladie rénale sur l'élimination de Mircette®.
Interactions médicament-médicament
Des interactions entre le désogestrel/éthinylestradiol et d'autres médicaments ont été rapportées dans la littérature. Aucune étude formelle sur les interactions médicamenteuses n'a été menée (voir PRÉCAUTIONS section).
RÉFÉRENCES
90. Godsland, I et al. Les effets de différentes formulations d'agents contraceptifs oraux sur le métabolisme des lipides et des glucides. N Engl J Med 1990; 323:1375–81.
91. Kloosterboer, HJ et al. Sélectivité dans la liaison aux récepteurs de la progestérone et des androgènes des progestatifs utilisés dans la contraception orale. Contraception, 1988 ; 38:325–32.
92. Van der Vies, J et de Visser, J. Études endocrinologiques avec désogestrel. Arzneim. Forsch./Drug Res., 1983; 33(l),2:231–6.
96. Cullberg, G et al. Effets d'une association désogestrel-éthinylestradiol à faible dose sur l'hirsutisme, les androgènes et la globuline liant les hormones sexuelles chez les femmes atteintes d'un syndrome des ovaires polykystiques. Acta Obstet Gynecol Scand, 1985; 64 : 195–202.
97. Jung-Hoffmann, C et Kuhl, H. Effets divergents de deux contraceptifs oraux à faible dose sur la globuline liant les hormones sexuelles et la testostérone libre. AJOG, 1987; 156 : 199–203.
98. Hammond, G et al. Concentrations sériques de protéine de liaison aux stéroïdes, distribution des progestatifs et biodisponibilité de la testostérone pendant le traitement par des contraceptifs contenant du désogestrel ou du lévonorgestrel. Fertilité. Steril., 1984; 42:44–51.
99. Palatsi, R et al. Testostérone totale et non liée sérique et globuline liant les hormones sexuelles (SHBG) chez des patientes acnéiques traitées avec deux contraceptifs oraux différents. Acta Derm Venereol, 1984; 64:517–23.
INFORMATIONS PATIENTS
Mircette ® (désogestrel/éthinylestradiol et éthinylestradiol) Comprimés
Ce produit (comme tous les contraceptifs oraux) est destiné à prévenir la grossesse. Il ne protège pas contre l'infection par le VIH (SIDA) et d'autres maladies sexuellement transmissibles.
VEUILLEZ NOTER : Cet étiquetage est révisé de temps à autre à mesure que de nouvelles informations médicales importantes deviennent disponibles. Par conséquent, veuillez lire attentivement cet étiquetage.
LA DESCRIPTION
Le produit contraceptif oral suivant contient une combinaison d'un progestatif et d'un œstrogène, les deux types d'hormones féminines :
Chaque comprimé blanc contient 0,15 mg de désogestrel et 0,02 mg d'éthinylestradiol. Chaque comprimé vert clair contient des ingrédients inertes et chaque comprimé jaune contient 0,01 mg d'éthinylestradiol.
INTRODUCTION
Toute femme qui envisage d'utiliser des contraceptifs oraux (la pilule contraceptive ou la pilule) doit comprendre les avantages et les risques de l'utilisation de cette forme de contraception. Cette notice vous fournira une grande partie des informations dont vous aurez besoin pour prendre cette décision et vous aidera également à déterminer si vous êtes à risque de développer l'un des effets secondaires graves de la pilule. Il vous indiquera comment utiliser correctement la pilule afin qu'elle soit la plus efficace possible. Cependant, cette notice ne remplace pas une discussion approfondie entre vous et votre médecin ou professionnel de la santé. Vous devez discuter des informations fournies dans cette notice avec lui, à la fois lorsque vous commencez à prendre la pilule et lors de vos visites de suivi. Vous devez également suivre les conseils de votre médecin ou de votre professionnel de la santé concernant les contrôles réguliers pendant que vous prenez la pilule.
EFFICACITÉ DES CONTRACEPTIFS ORAUX
Les contraceptifs oraux ou « pilules contraceptives » ou « la pilule » sont utilisés pour prévenir la grossesse et sont plus efficaces que les autres méthodes de contraception non chirurgicales. Lorsqu'ils sont pris correctement, les chances de tomber enceinte sont inférieures à 1% (1 grossesse pour 100 femmes par an d'utilisation) lorsqu'ils sont utilisés parfaitement, sans oublier de pilule. Les taux d'échec typiques sont en fait de 5 % par an. Le risque de tomber enceinte augmente avec chaque pilule oubliée au cours d'un cycle menstruel.
En comparaison, les taux d'échec typiques d'autres méthodes de contraception au cours de la première année d'utilisation sont les suivants :
QUI NE DEVRAIT PAS PRENDRE DE CONTRACEPTIFS ORAUX
Le tabagisme augmente le risque d'effets secondaires cardiovasculaires graves liés à l'utilisation de contraceptifs oraux. Ce risque augmente avec l'âge et en cas de forte consommation de tabac (15 cigarettes ou plus par jour) et est assez marqué chez les femmes de plus de 35 ans. Il est fortement déconseillé aux femmes qui utilisent des contraceptifs oraux de fumer.
Certaines femmes ne devraient pas utiliser la pilule. Par exemple, vous ne devez pas prendre la pilule si vous êtes enceinte ou si vous pensez être enceinte. Vous ne devez pas non plus utiliser la pilule si vous avez l'une des conditions suivantes :
- Antécédents de crise cardiaque ou d'accident vasculaire cérébral
- Caillots sanguins dans les jambes (thrombophlébite), les poumons (embolie pulmonaire) ou les yeux
- Une histoire de caillots sanguins dans les veines profondes de vos jambes
- Douleur thoracique (angine de poitrine)
- Cancer du sein connu ou suspecté ou cancer de la muqueuse de l'utérus, du col de l'utérus ou du vagin
- Saignements vaginaux inexpliqués (jusqu'à ce qu'un diagnostic soit établi par votre médecin)
- Jaunissement du blanc des yeux ou de la peau (jaunisse) pendant la grossesse ou lors de l'utilisation précédente de la pilule
- Tumeur du foie (bénigne ou cancéreuse)
- Grossesse connue ou suspectée.
Dites à votre médecin ou professionnel de la santé si vous avez déjà eu l'une de ces conditions. Votre médecin ou professionnel de la santé peut vous recommander une autre méthode de contraception.
AUTRES CONSIDÉRATIONS AVANT DE PRENDRE DES CONTRACEPTIFS ORAUX
Dites à votre médecin ou professionnel de la santé si vous avez :
- Nodules mammaires, maladie fibrokystique du sein, radiographie mammaire anormale ou mammographie
- Diabète
- Taux élevé de cholestérol ou de triglycérides
- Hypertension artérielle
- Migraine ou autres maux de tête ou épilepsie
- Dépression mentale
- Maladie de la vésicule biliaire, du cœur ou des reins
- Antécédents de menstruations rares ou irrégulières.
Les femmes atteintes de l'une de ces affections doivent être souvent contrôlées par leur médecin ou professionnel de la santé si elles choisissent d'utiliser des contraceptifs oraux.
Assurez-vous également d'informer votre médecin ou votre fournisseur de soins de santé si vous fumez ou prenez des médicaments.
RISQUES LIÉS À LA PRISE DE CONTRACEPTIFS ORAUX
1. Risque de développer des caillots sanguins
Les caillots sanguins et le blocage des vaisseaux sanguins sont l'un des effets secondaires les plus graves de la prise de contraceptifs oraux et peuvent entraîner la mort ou une invalidité grave. En particulier, un caillot dans la jambe peut provoquer une thrombophlébite et un caillot qui se déplace vers les poumons peut provoquer une obstruction soudaine du vaisseau transportant le sang vers les poumons. Les risques de ces effets indésirables peuvent être plus importants avec les contraceptifs oraux contenant du désogestrel tels que Mircette® qu'avec certaines autres pilules à faible dose. Rarement, des caillots se forment dans les vaisseaux sanguins de l'œil et peuvent provoquer la cécité, une vision double ou une vision altérée.
Si vous prenez des contraceptifs oraux et que vous avez besoin d'une intervention chirurgicale non urgente, que vous devez rester alitée pendant une maladie prolongée ou que vous avez récemment accouché, vous risquez de développer des caillots sanguins. Vous devriez consulter votre médecin ou votre fournisseur de soins de santé au sujet de l'arrêt des contraceptifs oraux trois à quatre semaines avant la chirurgie et de ne pas prendre de contraceptifs oraux pendant deux semaines après la chirurgie ou pendant le repos au lit. Vous ne devez pas non plus prendre de contraceptifs oraux peu de temps après l'accouchement d'un bébé. Il est conseillé d'attendre au moins quatre semaines après l'accouchement si vous n'allaitez pas ou quatre semaines après un avortement du deuxième trimestre. Si vous allaitez, vous devez attendre d'avoir sevré votre enfant avant d'utiliser la pilule (voir Allaitement en PRECAUTIONS GENERALES ).
Le risque de maladie circulatoire chez les utilisatrices de contraceptifs oraux peut être plus élevé chez les utilisatrices de pilules à forte dose et peut être plus élevé avec une durée d'utilisation de contraceptifs oraux plus longue. De plus, certains de ces risques accrus peuvent persister pendant plusieurs années après l'arrêt des contraceptifs oraux. Le risque de maladie thromboembolique veineuse associé aux contraceptifs oraux n'augmente pas avec la durée d'utilisation et disparaît après l'arrêt de la pilule. Le risque de coagulation sanguine anormale augmente avec l'âge chez les utilisatrices et les non-utilisatrices de contraceptifs oraux, mais le risque accru lié au contraceptif oral semble être présent à tous les âges. Pour les femmes âgées de 20 à 44 ans, on estime qu'environ 1 sur 2 000 utilisant des contraceptifs oraux sera hospitalisée chaque année en raison d'une coagulation anormale. Parmi les non-utilisateurs du même groupe d'âge, environ 1 sur 20 000 serait hospitalisé chaque année. Pour les utilisatrices de contraceptifs oraux en général, on a estimé que chez les femmes âgées de 15 à 34 ans, le risque de décès dû à un trouble circulatoire est d'environ 1 sur 12 000 par an, alors que pour les non-utilisatrices, le taux est d'environ 1 sur 50 000 par an. Dans le groupe d'âge de 35 à 44 ans, le risque est estimé à environ 1 sur 2 500 par an pour les utilisatrices de contraceptifs oraux et à environ 1 sur 10 000 par an pour les non-utilisatrices.
2. Crises cardiaques et accidents vasculaires cérébraux
Les contraceptifs oraux peuvent augmenter la tendance à développer des accidents vasculaires cérébraux (arrêt ou rupture des vaisseaux sanguins dans le cerveau) et l'angine de poitrine et les crises cardiaques (blocage des vaisseaux sanguins dans le cœur). Chacune de ces conditions peut entraîner la mort ou une invalidité grave.
Fumer augmente considérablement la possibilité de souffrir de crises cardiaques et d'accidents vasculaires cérébraux. De plus, le tabagisme et l'utilisation de contraceptifs oraux augmentent considérablement les risques de développer et de mourir d'une maladie cardiaque.
3. Maladie de la vésicule biliaire
Les utilisatrices de contraceptifs oraux ont probablement un risque plus élevé que les non-utilisatrices d'avoir une maladie de la vésicule biliaire, bien que ce risque puisse être lié aux pilules contenant de fortes doses d'œstrogènes.
4. Tumeurs du foie
Dans de rares cas, les contraceptifs oraux peuvent provoquer des tumeurs hépatiques bénignes mais dangereuses. Ces tumeurs bénignes du foie peuvent se rompre et provoquer une hémorragie interne mortelle. De plus, une association possible mais non définitive a été trouvée avec la pilule et les cancers du foie dans deux études, dans lesquelles quelques femmes ayant développé ces cancers très rares se sont avérées avoir utilisé des contraceptifs oraux pendant de longues périodes. Cependant, les cancers du foie sont extrêmement rares. Le risque de développer un cancer du foie en utilisant la pilule est donc encore plus rare.
5. Cancer des organes reproducteurs et des seins
Il existe un conflit entre les études concernant le cancer du sein et l'utilisation de contraceptifs oraux. Certaines études ont rapporté une augmentation du risque de développer un cancer du sein, en particulier à un plus jeune âge. Ce risque accru semble lié à la durée d'utilisation. La majorité des études n'ont trouvé aucune augmentation globale du risque de développer un cancer du sein.
Certaines études ont trouvé une augmentation de l'incidence du cancer du col de l'utérus chez les femmes qui utilisent des contraceptifs oraux. Cependant, ce résultat peut être lié à des facteurs autres que l'utilisation de contraceptifs oraux. Il n'y a pas suffisamment de preuves pour exclure la possibilité que les pilules puissent causer de tels cancers.
RISQUE ESTIMÉ DE DÉCÈS D'UNE MÉTHODE DE CONTRÔLE DES NAISSANCES OU D'UNE GROSSESSE
Toutes les méthodes de contraception et de grossesse sont associées à un risque de développer certaines maladies pouvant entraîner une invalidité ou la mort. Une estimation du nombre de décès associés aux différentes méthodes de contraception et de grossesse a été calculée et est présentée dans le tableau suivant.
NOMBRE ANNUEL DE DÉCÈS LIÉS À LA NAISSANCE OU À LA MÉTHODE ASSOCIÉS AU CONTRÔLE DE LA FERTILITÉ POUR 100 000 FEMMES NON STÉRILES, PAR MÉTHODE DE CONTRÔLE DE LA FERTILITÉ SELON L'ÂGE
Dans le tableau ci-dessus, le risque de décès lié à toute méthode contraceptive est inférieur au risque d'accouchement, à l'exception des utilisatrices de contraceptifs oraux de plus de 35 ans qui fument et des utilisatrices de pilules de plus de 40 ans même si elles ne fument pas. On peut voir dans le tableau que pour les femmes âgées de 15 à 39 ans, le risque de décès était le plus élevé avec la grossesse (7 à 26 décès pour 100 000 femmes, selon l'âge). Parmi les utilisatrices de pilules qui ne fument pas, le risque de décès est toujours inférieur à celui associé à la grossesse pour n'importe quel groupe d'âge, bien qu'à partir de 40 ans, le risque passe à 32 décès pour 100 000 femmes, contre 28 associés à la grossesse à cette époque. âge. Cependant, pour les utilisatrices de pilules qui fument et qui ont plus de 35 ans, le nombre estimé de décès dépasse ceux des autres méthodes de contraception. Si une femme a plus de 40 ans et fume, son risque estimé de décès est quatre fois plus élevé (117/100 000 femmes) que le risque estimé associé à une grossesse (28/100 000 femmes) dans ce groupe d'âge.
La suggestion selon laquelle les femmes de plus de 40 ans qui ne fument pas ne devraient pas prendre de contraceptifs oraux est basée sur des informations provenant d'anciennes pilules à forte dose et sur une utilisation moins sélective des pilules que celle pratiquée aujourd'hui. Un comité consultatif de la FDA a discuté de cette question en 1989 et a recommandé que les avantages de l'utilisation de contraceptifs oraux par des femmes en bonne santé et non fumeuses de plus de 40 ans puissent l'emporter sur les risques possibles. Cependant, toutes les femmes, en particulier les femmes âgées, sont averties d'utiliser la pilule à la dose la plus faible qui soit efficace.
SIGNAUX D'AVERTISSEMENT
Si l'un de ces effets indésirables survient pendant que vous prenez des contraceptifs oraux, appelez immédiatement votre médecin ou votre professionnel de la santé :
- Douleur thoracique aiguë, toux de sang ou essoufflement soudain (indiquant un possible caillot dans les poumons)
- Douleur au mollet (indiquant un possible caillot dans la jambe)
- Douleur thoracique écrasante ou lourdeur dans la poitrine (indiquant une possible crise cardiaque)
- Maux de tête ou vomissements intenses et soudains, étourdissements ou évanouissements, troubles de la vision ou de la parole, faiblesse ou engourdissement dans un bras ou une jambe (indiquant un possible accident vasculaire cérébral)
- Perte soudaine partielle ou complète de la vision (indiquant un possible caillot dans l'œil)
- Masses mammaires (indiquant un cancer du sein possible ou une maladie fibrokystique du sein ; demandez à votre médecin ou à votre professionnel de la santé de vous montrer comment examiner vos seins)
- Douleur ou sensibilité intense dans la région de l'estomac (indiquant une tumeur du foie éventuellement rompue)
- Difficulté à dormir, faiblesse, manque d'énergie, fatigue ou changement d'humeur (indiquant peut-être une dépression grave)
- Jaunisse ou jaunissement de la peau ou des globes oculaires, accompagné fréquemment de fièvre, fatigue, perte d'appétit, urines de couleur foncée ou selles de couleur claire (indiquant de possibles problèmes de foie).
EFFETS SECONDAIRES DES CONTRACEPTIFS ORAUX
1. Saignement vaginal
Des saignements vaginaux irréguliers ou des saignotements peuvent survenir pendant que vous prenez les pilules. Les saignements irréguliers peuvent varier d'une légère coloration entre les menstruations à des saignements intermenstruels qui ressemblent beaucoup à des règles régulières. Les saignements irréguliers surviennent le plus souvent au cours des premiers mois d'utilisation d'un contraceptif oral, mais peuvent également survenir après que vous ayez pris la pilule pendant un certain temps. Ces saignements peuvent être temporaires et n'indiquent généralement pas de problèmes graves. Il est important de continuer à prendre vos pilules à temps. Si le saignement survient au cours de plusieurs cycles ou dure plus de quelques jours, parlez-en à votre médecin ou à votre professionnel de la santé.
2. Lentilles de contact
Si vous portez des lentilles de contact et remarquez un changement de vision ou une incapacité à porter vos lentilles, contactez votre médecin ou votre professionnel de la santé.
3. Rétention d'eau
Les contraceptifs oraux peuvent provoquer un œdème (rétention d'eau) avec gonflement des doigts ou des chevilles et peuvent augmenter votre tension artérielle. Si vous souffrez de rétention d'eau, contactez votre médecin ou votre fournisseur de soins de santé.
4. Mélasma
Un assombrissement ponctuel de la peau est possible, en particulier du visage.
5. Autres effets secondaires
D'autres effets secondaires peuvent inclure des nausées et des vomissements, un changement d'appétit, des maux de tête, de la nervosité, une dépression, des étourdissements, une perte de cheveux, des éruptions cutanées et des infections vaginales.
Si l'un de ces effets secondaires vous dérange, appelez votre médecin ou votre fournisseur de soins de santé.
PRÉCAUTIONS GÉNÉRALES
1. Périodes manquées et utilisation de contraceptifs oraux avant ou pendant le début de la grossesse
Il peut y avoir des moments où vous ne pouvez pas avoir vos règles régulièrement après avoir terminé de prendre un cycle de pilules. Si vous avez pris vos pilules régulièrement et que vous manquez une période menstruelle, continuez à prendre vos pilules pour le cycle suivant, mais assurez-vous d'en informer votre médecin ou votre professionnel de la santé avant de le faire. Si vous n'avez pas pris les pilules quotidiennement comme indiqué et que vous avez manqué une période menstruelle, ou si vous avez manqué deux périodes menstruelles consécutives, vous pouvez être enceinte. Vérifiez immédiatement auprès de votre médecin ou fournisseur de soins de santé pour déterminer si vous êtes enceinte. Ne continuez pas à prendre des contraceptifs oraux jusqu'à ce que vous soyez sûre que vous n'êtes pas enceinte, mais continuez à utiliser une autre méthode de contraception.
Il n'existe aucune preuve concluante que l'utilisation de contraceptifs oraux soit associée à une augmentation des malformations congénitales, lorsqu'elle est prise par inadvertance au début de la grossesse. Auparavant, quelques études avaient rapporté que les contraceptifs oraux pouvaient être associés à des malformations congénitales, mais ces études n'ont pas été confirmées. Néanmoins, les contraceptifs oraux ou tout autre médicament ne doivent pas être utilisés pendant la grossesse à moins que cela ne soit clairement nécessaire et prescrit par votre médecin ou votre prestataire de soins de santé. Vous devriez vérifier auprès de votre médecin ou professionnel de la santé les risques pour votre enfant à naître de tout médicament pris pendant la grossesse.
2. Pendant l'allaitement
Si vous allaitez, consultez votre médecin ou professionnel de la santé avant de commencer les contraceptifs oraux. Une partie du médicament sera transmise à l'enfant dans le lait. Quelques effets indésirables sur l'enfant ont été rapportés, notamment un jaunissement de la peau (jaunisse) et une hypertrophie mammaire. De plus, les contraceptifs oraux peuvent diminuer la quantité et la qualité de votre lait. Si possible, n'utilisez pas de contraceptifs oraux pendant l'allaitement. Vous devez utiliser une autre méthode de contraception car l'allaitement n'offre qu'une protection partielle contre une grossesse et cette protection partielle diminue de manière significative à mesure que vous allaitez pendant de plus longues périodes.
Vous ne devriez envisager de commencer les contraceptifs oraux qu'après avoir complètement sevré votre enfant.
3. Tests de laboratoire
Si vous devez passer des tests de laboratoire, informez votre médecin ou votre professionnel de la santé que vous prenez des contraceptifs oraux. Certains tests sanguins peuvent être affectés par les pilules contraceptives.
4. Interactions médicamenteuses
Certains médicaments peuvent interagir avec les pilules contraceptives pour les rendre moins efficaces dans la prévention de la grossesse ou provoquer une augmentation des saignements intermenstruels. Ces médicaments comprennent la rifampicine, des médicaments utilisés pour l'épilepsie tels que les barbituriques (par exemple, le phénobarbital), la phénytoïne (Dilantin® est une marque de ce médicament), la phénylbutazone (Butazolidin® est une marque) et éventuellement certains antibiotiques. Vous devrez peut-être utiliser une contraception supplémentaire lorsque vous prenez des médicaments qui peuvent rendre les contraceptifs oraux moins efficaces.
Les pilules contraceptives peuvent interagir avec la lamotrigine, un anticonvulsivant utilisé pour l'épilepsie. Cela peut augmenter le risque de convulsions, de sorte que votre médecin devra peut-être ajuster la dose de lamotrigine.
Certains médicaments peuvent rendre la pilule contraceptive moins efficace, notamment :
- Barbituriques
- Bosentane
- Carbamazépine
- Felbamate
- Griséofulvine
- Oxcarbazépine
- Phénytoïne
- Rifampine
- millepertuis
- Topiramate
Comme pour tous les produits sur ordonnance, vous devez informer votre fournisseur de soins de santé de tout autre médicament et produit à base de plantes que vous prenez. Vous devrez peut-être utiliser un contraceptif barrière lorsque vous prenez des médicaments ou des produits qui peuvent rendre les pilules contraceptives moins efficaces.
5. Maladies sexuellement transmissibles
Ce produit (comme tous les contraceptifs oraux) est destiné à prévenir la grossesse. Il ne protège pas contre la transmission du VIH (SIDA) et d'autres maladies sexuellement transmissibles telles que la chlamydia, l'herpès génital, les verrues génitales, la gonorrhée, l'hépatite B et la syphilis.
COMMENT PRENDRE LA PILULE
POINTS IMPORTANTS À RETENIR
AVANT DE COMMENCER À PRENDRE VOS PILULES :
1. ASSUREZ-VOUS DE LIRE CES DIRECTIVES :
Avant de commencer à prendre vos pilules.
Chaque fois que vous ne savez pas ce qu'il faut faire.
2. LA BONNE FAÇON DE PRENDRE LE COMPRIMÉ EST DE PRENDRE UN COMPRIMÉ CHAQUE JOUR À LA MÊME HEURE.
Si vous oubliez de prendre des pilules, vous pourriez tomber enceinte. Cela inclut le démarrage tardif du pack.
Plus vous oubliez de pilules, plus vous avez de chances de tomber enceinte.
3. DE NOMBREUSES FEMMES ONT DES SPOTTINGS OU DES SAIGNEMENTS LÉGERS, OU PEUVENT SE SENTIR MAL À L'ESTOMAC PENDANT LES 1 À 3 PREMIÈRES PLAQUES DE PILULES.
Si vous avez mal au ventre, n'arrêtez pas de prendre la pilule. Le problème va généralement partir. Si cela ne disparaît pas, consultez votre médecin ou votre fournisseur de soins de santé.
4. LES PILULES MANQUÉES PEUVENT ÉGALEMENT PROVOQUER DES SPOTTINGS OU DES SAIGNEMENTS LÉGERS, même lorsque vous inventez ces pilules oubliées.
Les jours où vous prenez 2 pilules pour rattraper les pilules oubliées, vous pourriez aussi avoir un peu mal au ventre.
5. SI VOUS AVEZ DES VOMISSEMENTS OU DE LA DIARRHÉE, pour quelque raison que ce soit, ou SI VOUS PRENEZ DES MÉDICAMENTS, y compris des antibiotiques, vos pilules peuvent ne pas fonctionner aussi bien.
Utilisez une méthode de secours (telle que des préservatifs, de la mousse ou une éponge) jusqu'à ce que vous consultiez votre médecin ou votre professionnel de la santé.
6. SI VOUS AVEZ DE LA DIFFICULTÉ À VOUS RAPPELER DE PRENDRE LA PILULE, parlez à votre médecin ou à votre professionnel de la santé de la façon de faciliter la prise de la pilule ou de l'utilisation d'une autre méthode de contraception.
7. SI VOUS AVEZ DES QUESTIONS OU QUE VOUS N'ÊTES PAS SÛR DES INFORMATIONS CONTENUES DANS CETTE NOTICE, appelez votre médecin ou votre professionnel de la santé.
AVANT DE COMMENCER À PRENDRE VOS PILULES
8. DÉCIDEZ À QUELLE HEURE DE LA JOURNÉE VOUS VOULEZ PRENDRE VOTRE PILULE.
Il est important de le prendre à peu près à la même heure chaque jour.
8. REGARDEZ VOTRE PILULIER : IL CONTIENDRA 28 PILULES :
Cette plaquette de 28 pilules contient 26 pilules « actives » [blanches et jaunes] (avec hormones) et 2 pilules « inactives » [vert clair] (sans hormones).
10. TROUVER AUSSI :
1) où sur la plaquette pour commencer à prendre les pilules,
2) dans quel ordre prendre les pilules (suivre les flèches) et
3) les numéros de semaine comme indiqué dans l'image ci-dessous.
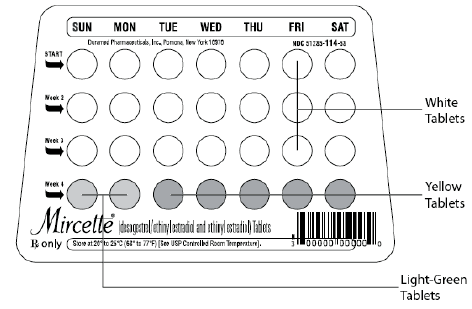
11. ASSUREZ-VOUS D'AVOIR PRÊT À TOUT MOMENT :
UN AUTRE TYPE DE CONTRÔLE DES NAISSANCES (comme des préservatifs, de la mousse ou une éponge) à utiliser en cas d'oubli de pilules.
UN PACK DE PILULES SUPPLÉMENTAIRE ET COMPLET.
QUAND COMMENCER LA PREMIÈRE PLAQUETTE DE PILULES
Vous avez le choix du jour pour commencer à prendre votre première plaquette de pilules. Décidez avec votre médecin ou votre professionnel de la santé quel est le meilleur jour pour vous. Choisissez une heure de la journée dont vous vous souviendrez facilement.
JOUR 1 DEBUT
12. Choisissez la bande d'étiquettes de jour qui commence par le premier jour de vos règles (c'est le jour où vous commencez à saigner ou à saigner, même s'il est presque minuit lorsque le saignement commence).
13. Placez cette bande d'étiquettes de jour dans le distributeur de pastilles du cycle sur la zone sur laquelle les jours de la semaine (en commençant par dimanche) sont imprimés.
Remarque : Si le premier jour de vos règles est un dimanche, vous pouvez sauter les étapes 1 et 2.
14. Prenez la première pilule « active » [blanche] de la première plaquette pendant les 24 premières heures de vos règles.
15. Vous n'aurez pas besoin d'utiliser une méthode contraceptive d'appoint, puisque vous commencez la pilule au début de vos règles.
DÉBUT DU DIMANCHE
16. Prenez la première pilule « active » [blanche] de la première plaquette le dimanche suivant le début de vos règles, même si vous saignez toujours. Si vos règles commencent le dimanche, commencez la plaquette le jour même.
17. Utilisez une autre méthode de contraception comme méthode de secours si vous avez des relations sexuelles à tout moment à partir du dimanche où vous commencez votre première plaquette jusqu'au dimanche suivant (7 jours). Les préservatifs, la mousse ou l'éponge sont de bonnes méthodes de contraception d'appoint.
QUE FAIRE PENDANT LE MOIS
18. PRENEZ UN COMPRIMÉ À LA MÊME HEURE CHAQUE JOUR JUSQU'À CE QUE LA PLAQUETTE SOIT VIDE.
Ne sautez pas de pilules même si vous avez des saignotements ou des saignements entre les menstruations ou si vous avez mal à l'estomac (nausées).
Ne sautez pas de pilules même si vous n'avez pas de relations sexuelles très fréquentes.
19. LORSQUE VOUS TERMINEZ UNE PLAQUETTE OU CHANGEZ DE MARQUE DE PILULES :
21 pilules : Attendez 7 jours pour commencer le prochain pack. Vous aurez probablement vos règles au cours de cette semaine. Assurez-vous qu'il ne s'écoule pas plus de 7 jours entre les packs de 21 jours.
28 pilules : Commencez la plaquette suivante le lendemain de votre dernière pilule. N'attendez pas de jours entre les packs.
QUE FAIRE SI VOUS MANQUEZ DES PILULES
Si vous MANQUEZ 1 pilule "active" [blanche] :
20. Prenez-le dès que vous vous en souvenez. Prenez le prochain comprimé à l'heure habituelle. Cela signifie que vous prenez 2 comprimés en 1 jour.
21. Vous n'avez pas besoin d'utiliser une méthode contraceptive d'appoint si vous avez des relations sexuelles. Si vous MANQUEZ 2 pilules "actives" [blanches] d'affilée dans la SEMAINE 1 OU LA SEMAINE 2 de votre plaquette :
22. Prenez 2 comprimés le jour dont vous vous souvenez et 2 comprimés le jour suivant.
23. Prenez ensuite 1 comprimé par jour jusqu'à ce que vous ayez terminé la plaquette.
24. Vous POURRIEZ TOMBER ENCEINTE si vous avez des rapports sexuels dans les 7 jours suivant l'oubli de pilules. Vous DEVEZ utiliser une autre méthode de contraception (telle que des préservatifs, de la mousse ou une éponge) comme méthode de secours pendant ces 7 jours.
Si vous MANQUEZ 2 pilules « actives » [blanches] d'affilée au cours de la SEMAINE 3 :
25. Si vous êtes un débutant du jour 1 :
JETEZ le reste de la plaquette de pilules et commencez une nouvelle plaquette le jour même.
Si vous êtes un débutant du dimanche :
Continuez à prendre 1 comprimé par jour jusqu'à dimanche.
Le dimanche, JETEZ le reste de la plaquette et commencez une nouvelle plaquette de pilules le même jour.
26. Vous n'aurez peut-être pas vos règles ce mois-ci, mais c'est normal. Cependant, si vous n'avez pas vos règles 2 mois de suite, appelez votre médecin ou votre professionnel de la santé car vous pourriez être enceinte.
27. Vous POURRIEZ TOMBER ENCEINTE si vous avez des rapports sexuels dans les 7 jours suivant l'oubli de pilules. Vous DEVEZ utiliser une autre méthode de contraception (telle que des préservatifs, de la mousse ou une éponge) comme méthode de secours pendant ces 7 jours.
Si vous MANQUER 3 OU PLUS pilules « actives » [blanches] d'affilée (pendant les 3 premières semaines) :
28. Si vous êtes un débutant du jour 1 :
JETEZ le reste de la plaquette de pilules et commencez une nouvelle plaquette le jour même.
Si vous êtes un débutant du dimanche :
Continuez à prendre 1 comprimé par jour jusqu'à dimanche.
Le dimanche, JETEZ le reste de la plaquette et commencez une nouvelle plaquette de pilules le même jour.
29. Vous n'aurez peut-être pas vos règles ce mois-ci, mais c'est normal. Cependant, si vous n'avez pas vos règles 2 mois de suite, appelez votre médecin ou votre professionnel de la santé car vous pourriez être enceinte.
30. Vous POURRIEZ TOMBER ENCEINTE si vous avez des rapports sexuels dans les 7 jours suivant l'oubli de pilules. Vous DEVEZ utiliser une autre méthode de contraception (telle que des préservatifs, de la mousse ou une éponge) comme méthode de secours pendant ces 7 jours.
UN RAPPEL POUR CEUX SUR LES PACKS DE 28 JOURS
Si vous oubliez l'une des 2 pilules [vert clair] ou 5 pilules [jaunes] au cours de la semaine 4 :
JETEZ les pilules que vous avez oubliées.
Continuez à prendre 1 comprimé par jour jusqu'à ce que la plaquette soit vide.
Vous n'avez pas besoin d'une méthode de sauvegarde.
ENFIN, SI VOUS N'ÊTES TOUJOURS PAS SÛR DE QUE FAIRE DES PILULES QUE VOUS AVEZ MANQUÉES
Utilisez une MÉTHODE D'APPOINT chaque fois que vous avez des rapports sexuels.
CONTINUEZ À PRENDRE UN COMPRIMÉ « ACTIF » [BLANC] CHAQUE JOUR jusqu'à ce que vous puissiez joindre votre médecin ou votre fournisseur de soins de santé.
GROSSESSE PAR ERREUR DE PILULE
L'incidence de l'échec de la pilule entraînant une grossesse est d'environ 1 % (c'est-à-dire une grossesse pour 100 femmes par an) si elle est prise tous les jours selon les instructions, mais les taux d'échec plus typiques sont d'environ 5 %. En cas d'échec, le risque pour le fœtus est minime.
GROSSESSE APRÈS ARRÊT DE LA PILULE
Il peut y avoir un certain retard avant de devenir enceinte après avoir cessé d'utiliser des contraceptifs oraux, surtout si vous aviez des cycles menstruels irréguliers avant d'utiliser des contraceptifs oraux. Il peut être conseillé de reporter la conception jusqu'à ce que vous commenciez à avoir des règles régulières une fois que vous avez arrêté de prendre la pilule et que vous désirez une grossesse.
Il ne semble pas y avoir d'augmentation des malformations congénitales chez les nouveau-nés lorsque la grossesse survient peu après l'arrêt de la pilule.
SURDOSAGE
Aucun effet nocif grave n'a été signalé après l'ingestion de fortes doses de contraceptifs oraux par de jeunes enfants. Un surdosage peut provoquer des nausées et des saignements de privation chez les femmes. En cas de surdosage, contactez votre médecin, votre professionnel de la santé ou votre pharmacien.
LES AUTRES INFORMATIONS
Votre médecin ou professionnel de la santé examinera vos antécédents médicaux et familiaux avant de vous prescrire des contraceptifs oraux et vous examinera. L'examen physique peut être reporté à un autre moment si vous le demandez et si votre médecin ou le professionnel de la santé estime que c'est une bonne pratique médicale de le reporter. Vous devriez être réexaminé au moins une fois par an. Assurez-vous d'informer votre médecin ou votre fournisseur de soins de santé s'il existe des antécédents familiaux de l'une des conditions énumérées précédemment dans cette notice. Assurez-vous de respecter tous les rendez-vous avec votre médecin ou votre fournisseur de soins de santé, car c'est le moment de déterminer s'il existe des signes précoces d'effets secondaires liés à l'utilisation de contraceptifs oraux.
N'utilisez pas le médicament pour une condition autre que celle pour laquelle il a été prescrit. Ce médicament vous a été spécifiquement prescrit ; ne le donnez pas à d'autres personnes qui pourraient vouloir des pilules contraceptives.
AVANTAGES POUR LA SANTÉ DES CONTRACEPTIFS ORAUX
En plus de prévenir la grossesse, l'utilisation de contraceptifs oraux combinés peut offrir certains avantages. Elles sont:
- les cycles menstruels peuvent devenir plus réguliers.
- le flux sanguin pendant la menstruation peut être plus léger et moins de fer peut être perdu. Par conséquent, l'anémie due à une carence en fer est moins susceptible de se produire.
- la douleur ou d'autres symptômes pendant la menstruation peuvent être rencontrés moins fréquemment.
- les grossesses extra-utérines (tubaires) peuvent survenir moins fréquemment.
- des kystes ou des masses non cancéreuses dans le sein peuvent survenir moins fréquemment.
- une maladie inflammatoire pelvienne aiguë peut survenir moins fréquemment.
- l'utilisation de contraceptifs oraux peut fournir une certaine protection contre le développement de deux formes de cancer : le cancer des ovaires et le cancer de la muqueuse de l'utérus.
Si vous souhaitez plus d'informations sur les pilules contraceptives, demandez à votre médecin, votre fournisseur de soins de santé ou votre pharmacien. Ils ont une notice plus technique appelée les informations de prescription que vous voudrez peut-être lire.
