Microzide 25mg Hydrochlorothiazide Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Microzide 25 mg et comment est-il utilisé ?
Microzide est un médicament d'ordonnance utilisé pour traiter les symptômes de l'hypertension artérielle (hypertension) et de l'enflure (œdème). Microzide peut être utilisé seul ou avec d'autres médicaments.
Microzide appartient à une classe de médicaments appelés diurétiques, thiazidiques.
On ne sait pas si Microzide est sûr et efficace chez les enfants de moins de 6 mois.
Quels sont les effets secondaires possibles de Microzide ?
Microzide peut provoquer des effets secondaires graves, notamment :
- étourdissement,
- douleur oculaire,
- problèmes de vue,
- jaunissement de la peau ou des yeux (jaunisse),
- peau pâle,
- ecchymoses faciles,
- saignements inhabituels (nez, bouche, vagin ou rectum),
- essoufflement,
- respiration sifflante,
- toux avec mucus mousseux,
- douleur thoracique,
- bouche sèche,
- la soif,
- somnolence,
- manque d'énergie,
- agitation,
- douleur ou faiblesse musculaire,
- rythme cardiaque rapide,
- nausée,
- vomissement,
- peu ou pas d'urine,
- fièvre,
- mal de gorge,
- gonflement du visage ou de la langue,
- brûlant dans tes yeux, et
- douleur cutanée suivie d'une éruption cutanée rouge ou violette qui se propage (en particulier sur le visage ou le haut du corps) et provoque des cloques et une desquamation
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Microzide incluent :
- nausée,
- vomissement,
- perte d'appétit,
- diarrhée,
- constipation,
- spasmes musculaires,
- des étourdissements et
- mal de tête
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Microzide. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
LA DESCRIPTION
MICROZIDE® (hydrochlorothiazide, USP 12,5 mg) est le dérivé 3,4-dihydro du chlorothiazide. Son nom chimique est 6-chloro-3,4-dihydro-2H-1,2,4-benzothiadiazine-7-sulfonamide 1,1-dioxyde. Sa formule empirique est C7H8CIN304S2 ; son poids moléculaire est de 297,74 ; et sa formule structurale est :
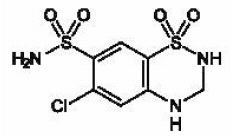
C'est une poudre cristalline blanche ou pratiquement blanche, légèrement soluble dans l'eau, mais librement soluble dans une solution d'hydroxyde de sodium.
MICROZIDE (capsule d'hydrochlorothiazide) est offert sous forme de capsules de 12,5 mg à usage oral.
Ingrédients inactifs : dioxyde de silicium colloïdal, amidon de maïs, lactose monohydraté, stéarate de magnésium. Les capsules de gélatine contiennent D&C Red No. 28, D&C Yellow No. 10, FD&C Blue No. 1, gélatine, dioxyde de titane. Les capsules sont imprimées avec de l'encre comestible contenant de l'oxyde de fer noir, D&C Yellow No. 10, FD&C Blue No. 1, FD&C Blue No. 2, FD&C Red No. 40.
LES INDICATIONS
MICROZIDE (capsule d'hydrochlorothiazide) est indiqué dans la prise en charge de l'hypertension soit comme agent thérapeutique unique, soit en association avec d'autres antihypertenseurs. Contrairement aux combinaisons diurétiques d'épargne potassique, MICROZIDE (capsule d'hydrochlorothiazide) peut être utilisé chez les patients chez qui le développement d'une hyperkaliémie ne peut pas être risqué, y compris les patients prenant des inhibiteurs de l'ECA.
Utilisation pendant la grossesse
L'utilisation systématique de diurétiques chez une femme par ailleurs en bonne santé est inappropriée et expose la mère et le fœtus à des risques inutiles. Les diurétiques n'empêchent pas le développement de la toxémie gravidique et il n'existe aucune preuve satisfaisante de leur utilité dans le traitement de la toxémie développée.
L'œdème pendant la grossesse peut provenir de causes pathologiques ou des conséquences physiologiques et mécaniques de la grossesse. Les diurétiques sont indiqués pendant la grossesse lorsque l'œdème est dû à des causes pathologiques, tout comme ils le sont en l'absence de grossesse. L'œdème dépendant de la grossesse résultant de la restriction du retour veineux par l'utérus expansé est correctement traité par l'élévation des membres inférieurs et l'utilisation d'un tuyau de soutien ; l'utilisation de diurétiques pour réduire le volume intravasculaire dans ce cas est illogique et inutile. Il existe une hypervolémie au cours de la grossesse normale qui n'est nocive ni pour le fœtus ni pour la mère (en l'absence de maladie cardiovasculaire), mais qui est associée à des œdèmes, dont des œdèmes généralisés chez la majorité des femmes enceintes. Si cet œdème produit de l'inconfort, un décubitus accru apportera souvent un soulagement. Dans de rares cas, cet œdème peut provoquer une gêne extrême qui n'est pas soulagée par le repos. Dans ces cas, une courte cure de diurétiques peut apporter un soulagement et peut être appropriée.
DOSAGE ET ADMINISTRATION
Pour le contrôle de l'hypertension : La dose initiale adulte de MICROZIDE (capsule d'hydrochlorothiazide) est d'une capsule administrée une fois par jour, qu'elle soit administrée seule ou en association avec d'autres antihypertenseurs. Des doses quotidiennes totales supérieures à 50 mg ne sont pas recommandées.
COMMENT FOURNIE
MICROZIDE (capsule d'hydrochlorothiazide) Gélules sont des capsules de gélatine dure en deux parties #4 Teal Opaque/Teal Opaque imprimées avec MICROZIDE (capsule d'hydrochlorothiazide) et 12,5 mg à l'encre noire. Ils sont fournis en flacons de 100 avec des bouchons de sécurité enfants ( CDN 52544-622-01).
Dispenser dans un récipient étanche et résistant à la lumière tel que défini dans l'USP.
Tenir hors de portée des enfants.
Conserver à 20°-25°C (68°-77°F). [Voir USP température ambiante contrôlée.] Protéger de la lumière, de l'humidité, du gel, de -20°C (-4°F). Conserver le récipient bien fermé.
Adressez vos demandes de renseignements médicaux à : WATSON., Medical Communications PO Box 1953, Morristown, NJ 07962-1953. 800-272-5525. Fabriqué par : Watson Pharma Private Limited. Verna, Salcette, Goa 403 722 INDE. Distribué par : Watson Pharma, Inc. Morristown, NJ 07962 États-Unis. Révisé : février 2011
EFFETS SECONDAIRES
Il a été démontré que les effets indésirables associés à l'hydrochlorothiazide sont liés à la dose. Dans les essais cliniques contrôlés, les événements indésirables rapportés avec des doses de 12,5 mg d'hydrochlorothiazide une fois par jour étaient comparables au placebo. Les effets indésirables suivants ont été rapportés pour des doses d'hydrochlorothiazide de 25 mg et plus et, dans chaque catégorie, sont répertoriés par ordre décroissant de gravité.
Corps dans son ensemble : La faiblesse.
Cardiovasculaire : Hypotension, y compris hypotension orthostatique (peut être aggravée par l'alcool, les barbituriques, les narcotiques ou les antihypertenseurs).
Digestif Pancréatite, ictère (ictère cholestatique intrahépatique), diarrhée, vomissements, sialadénite, crampes, constipation, irritation gastrique, nausées, anorexie.
Hématologique : Anémie aplasique, agranulocytose, leucopénie, anémie hémolytique, thrombocytopénie.
Hypersensibilité : Réactions anaphylactiques, angéite nécrosante (vascularite et vascularite cutanée), détresse respiratoire incluant pneumonite et œdème pulmonaire, photosensibilité, fièvre, urticaire, rash, purpura.
Métabolique : Déséquilibre électrolytique (voir PRÉCAUTIONS ), hyperglycémie, glycosurie, hyperuricémie.
Musculo-squelettique : Spasmes musculaires.
Système nerveux/psychiatrique : Vertiges, paresthésie, étourdissements, maux de tête, agitation.
Rénal : Insuffisance rénale, dysfonctionnement rénal, néphrite interstitielle (voir AVERTISSEMENTS ).
Peau : Érythème polymorphe dont syndrome de Stevens-Johnson, dermatite exfoliative dont nécrolyse épidermique toxique, alopécie.
Sens spéciaux Vision trouble transitoire, xanthopsie.
Urogénital : Impuissance.
Chaque fois que les effets indésirables sont modérés ou sévères, la dose de thiazide doit être réduite ou le traitement arrêté.
INTERACTIONS MÉDICAMENTEUSES
Lorsqu'ils sont administrés simultanément, les médicaments suivants peuvent interagir avec les diurétiques thiazidiques :
Alcool, barbituriques ou narcotiques - une potentialisation de l'hypotension orthostatique peut survenir.
Médicaments antidiabétiques - (agents oraux et insuline) un ajustement posologique de l'antidiabétique peut être nécessaire.
Autres médicaments antihypertenseurs - effet additif ou potentialisation.
Résines de cholestyramine et de colestipol - Les résines de cholestyramine et de colestipol se lient à l'hydrochlorothiazide et réduisent son absorption par le tractus gastro-intestinal jusqu'à 85 et 43 %, respectivement.
Corticostéroïde, ACTH - déplétion électrolytique intensifiée, en particulier hypokaliémie.
Amines vasopressives (p. ex. noradrénaline) - possible diminution de la réponse aux amines pressives mais pas suffisante pour exclure leur utilisation.
Relaxants des muscles squelettiques, non dépolarisants (p. ex., tubocurarine) possible augmentation de la réactivité au myorelaxant.
Lithium - ne doit généralement pas être administré avec des diurétiques. Les agents diurétiques réduisent la clairance rénale du lithium et augmentent considérablement le risque de toxicité du lithium. Consulter la notice d'accompagnement des préparations de lithium avant d'utiliser ces préparations avec MICROZIDE (capsule d'hydrochlorothiazide) .
Anti-inflammatoires non stéroïdiens - Chez certains patients, l'administration d'un anti-inflammatoire non stéroïdien peut réduire les effets diurétiques, natriurétiques et antihypertenseurs des diurétiques de l'anse, d'épargne potassique et thiazidiques. Lorsque MICROZIDE (capsule d'hydrochlorothiazide) et des agents anti-inflammatoires non stéroïdiens sont utilisés en concomitance, les patients doivent être étroitement surveillés pour déterminer si l'effet désiré du diurétique est obtenu.
Interactions médicament/test de laboratoire
Les thiazides doivent être arrêtés avant de réaliser des tests de la fonction parathyroïdienne (voir PRÉCAUTIONS, Général ).
AVERTISSEMENTS
Diabète et hypoglycémie : Un diabète sucré latent peut se manifester et les patients diabétiques recevant des thiazides peuvent nécessiter un ajustement de leur dose d'insuline.
Maladie rénale: Des effets cumulatifs des thiazidiques peuvent se développer chez les patients présentant une fonction rénale altérée. Chez ces patients, les thiazides peuvent précipiter une azotémie.
PRÉCAUTIONS
État de l'équilibre électrolytique et hydrique
Dans les études publiées, l'hypokaliémie cliniquement significative a toujours été moins fréquente chez les patients ayant reçu 12,5 mg d'hydrochlorothiazide que chez les patients ayant reçu des doses plus élevées. Néanmoins, une détermination périodique des électrolytes sériques doit être effectuée chez les patients susceptibles de développer une hypokaliémie. Les patients doivent être surveillés à la recherche de signes de troubles hydriques ou électrolytiques, c'est-à-dire d'hyponatrémie, d'alcalose hypochlorémique, d'hypokaliémie et d'hypomagnésémie.
Les signes avant-coureurs ou les symptômes d'un déséquilibre hydrique et électrolytique comprennent la sécheresse de la bouche, la soif, la faiblesse, la léthargie, la somnolence, l'agitation, les douleurs ou crampes musculaires, la fatigue musculaire, l'hypotension, l'oligurie, la tachycardie et les troubles gastro-intestinaux tels que les nausées et les vomissements.
Une hypokaliémie peut se développer, en particulier avec une diurèse rapide en présence d'une cirrhose sévère, lors de l'utilisation concomitante de corticostéroïdes ou d'hormone adrénocorticotrope (ACTH) ou après un traitement prolongé. L'interférence avec un apport adéquat d'électrolytes par voie orale contribuera également à l'hypokaliémie. L'hypokaliémie et l'hypomagnésémie peuvent provoquer des arythmies ventriculaires ou sensibiliser ou exagérer la réponse du cœur aux effets toxiques de la digitaline. L'hypokaliémie peut être évitée ou traitée par une supplémentation en potassium ou une consommation accrue d'aliments riches en potassium.
L'hyponatrémie de dilution met la vie en danger et peut survenir chez les patients œdémateux par temps chaud ; le traitement approprié est la restriction hydrique plutôt que l'administration de sel, sauf dans de rares cas où l'hyponatrémie met la vie en danger. En cas d'épuisement réel du sel, un remplacement approprié est la thérapie de choix.
Hyperuricémie
Une hyperuricémie ou une goutte aiguë peuvent être précipitées chez certains patients recevant des diurétiques thiazidiques.
Fonction hépatique altérée
Les thiazides doivent être utilisés avec prudence chez les patients présentant une fonction hépatique altérée. Ils peuvent précipiter un coma hépatique chez les patients atteints d'une maladie hépatique grave.
Maladie parathyroïdienne
L'excrétion de calcium est diminuée par les thiazidiques et des modifications pathologiques des glandes parathyroïdes, avec hypercalcémie et hypophosphatémie, ont été observées chez quelques patients sous traitement thiazidique prolongé.
Carcinogenèse, mutagenèse, altération de la fertilité
Des études d'alimentation de deux ans chez des souris et des rats menées sous les auspices du National Toxicology Program (NTP) n'ont révélé aucune preuve d'un potentiel carcinogène de l'hydrochlorothiazide chez les souris femelles (à des doses allant jusqu'à environ 600 mg/kg/jour) ou chez les mâles. et des rats femelles (à des doses d'environ 100 mg/kg/jour). Le NTP, cependant, a trouvé des preuves équivoques d'hépatocarcinogénicité chez les souris mâles. L'hydrochlorothiazide n'était pas génotoxique in vitro dans le test de mutagénicité d'Ames sur les souches de Salmonella typhimurium TA 98, TA 100, TA 1535, TA 1537 et TA 1538 et dans le test des ovaires de hamster chinois (CHO) pour les aberrations chromosomiques, ou in vivo dans les tests utilisant les chromosomes des cellules germinales de la souris, les chromosomes de la moelle osseuse du hamster chinois et le gène du trait létal récessif lié au sexe de la drosophile. Des résultats de test positifs ont été obtenus uniquement dans les tests in vitro CHO Sister Chromatid Exchange (clastogénicité) et dans les tests Mouse Lymphoma Cell (mutagénicité), en utilisant des concentrations d'hydrochlorothiazide de 43 à 1300 mcg/mL, et dans le test de non-disjonction d'Aspergillus nidulans à une concentration indéterminée.
L'hydrochlorothiazide n'a eu aucun effet indésirable sur la fertilité des souris et des rats des deux sexes dans des études au cours desquelles ces espèces ont été exposées, via leur alimentation, à des doses allant jusqu'à 100 et 4 mg/kg, respectivement, avant la conception et tout au long de la gestation.
Grossesse
Effets tératogènes
Catégorie de grossesse B : Les études dans lesquelles l'hydrochlorothiazide a été administré par voie orale à des souris et des rats gravides pendant leurs périodes respectives d'organogenèse majeure à des doses allant jusqu'à 3 000 et 1 000 mg d'hydrochlorothiazide/kg, respectivement, n'ont fourni aucune preuve d'effet nocif pour le fœtus.
Il n'y a cependant pas d'études adéquates et bien contrôlées chez les femmes enceintes. Étant donné que les études sur la reproduction chez l'animal ne sont pas toujours prédictives de la réponse humaine, ce médicament ne doit être utilisé pendant la grossesse qu'en cas de nécessité absolue.
Effets non tératogènes
Les thiazides traversent la barrière placentaire et apparaissent dans le sang de cordon. Il existe un risque d'ictère fœtal ou néonatal, de thrombocytopénie et éventuellement d'autres effets indésirables survenus chez l'adulte.
Mères allaitantes
Les thiazides sont excrétés dans le lait maternel. En raison du risque d'effets indésirables graves chez les nourrissons, une décision doit être prise soit d'interrompre l'allaitement soit d'arrêter l'hydrochlorothiazide, en tenant compte de l'importance du médicament pour la mère.
Utilisation pédiatrique
L'innocuité et l'efficacité chez les patients pédiatriques n'ont pas été établies.
Utilisation des personnes âgées
Une diminution plus importante de la pression artérielle et une augmentation des effets indésirables peuvent être observées chez les personnes âgées (c'est-à-dire > 65 ans) avec l'hydrochlorothiazide. Il est donc recommandé de commencer le traitement avec la plus faible dose disponible d'hydrochlorothiazide (12,5 mg). Si un titrage supplémentaire est nécessaire, des incréments de 12,5 mg doivent être utilisés.
SURDOSAGE
Les signes et symptômes les plus fréquemment observés sont ceux causés par une déplétion électrolytique (hypokaliémie, hypochlorémie, hyponatrémie) et une déshydratation résultant d'une diurèse excessive. Si de la digitaline a également été administrée, l'hypokaliémie peut accentuer les arythmies cardiaques.
En cas de surdosage, des mesures symptomatiques et de soutien doivent être utilisées. Des vomissements doivent être provoqués ou un lavage gastrique effectué. Corrigez la déshydratation, le déséquilibre électrolytique, le coma hépatique et l'hypotension par des procédures établies. Si nécessaire, donner de l'oxygène ou pratiquer la respiration artificielle en cas d'insuffisance respiratoire. Le degré d'élimination de l'hydrochlorothiazide par hémodialyse n'a pas été établi.
La DL50 orale de l'hydrochlorothiazide est supérieure à 10 g/kg chez la souris et le rat.
CONTRE-INDICATIONS
L'hydrochlorothiazide est contre-indiqué chez les patients souffrant d'anurie. L'hypersensibilité à ce produit ou à d'autres médicaments dérivés des sulfamides est également contre-indiquée.
PHARMACOLOGIE CLINIQUE
L'hydrochlorothiazide bloque la réabsorption des ions sodium et chlorure et augmente ainsi la quantité de sodium traversant le tubule distal et le volume d'eau excrétée. Une partie du sodium supplémentaire présenté au tubule distal y est échangé contre des ions potassium et hydrogène. Avec l'utilisation continue de l'hydrochlorothiazide et l'épuisement du sodium, les mécanismes compensatoires ont tendance à augmenter cet échange et peuvent produire une perte excessive d'ions potassium, hydrogène et chlorure. L'hydrochlorothiazide diminue également l'excrétion de calcium et d'acide urique, peut augmenter l'excrétion d'iodure et peut réduire le taux de filtration glomérulaire. Il a été démontré que les toxicités métaboliques associées à des modifications électrolytiques excessives causées par l'hydrochlorothiazide sont liées à la dose.
Pharmacocinétique et métabolisme
L'hydrochlorothiazide est bien absorbé (65 % à 75 %) après administration orale. L'absorption de l'hydrochlorothiazide est réduite chez les patients atteints d'insuffisance cardiaque congestive.
Les concentrations plasmatiques maximales sont observées dans les 1 à 5 heures suivant l'administration et varient de 70 à 490 ng/mL après des doses orales de 12,5 à 100 mg. Les concentrations plasmatiques sont linéairement liées à la dose administrée. Les concentrations d'hydrochlorothiazide sont 1,6 à 1,8 fois plus élevées dans le sang total que dans le plasma. La liaison aux protéines sériques a été rapportée comme étant d'environ 40 % à 68 %. La demi-vie d'élimination plasmatique est de 6 à 15 heures. L'hydrochlorothiazide est éliminé principalement par les voies rénales. Après des doses orales de 12,5 à 100 mg, 55 % à 77 % de la dose administrée apparaissent dans les urines et plus de 95 % de la dose absorbée est excrétée dans les urines sous forme inchangée. Chez les patients atteints d'insuffisance rénale, les concentrations plasmatiques d'hydrochlorothiazide sont augmentées et la demi-vie d'élimination est prolongée.
Lorsque MICROZIDE (capsule d'hydrochlorothiazide) est administré avec de la nourriture, sa biodisponibilité est réduite de 10 %, la concentration plasmatique maximale est réduite de 20 % et le délai d'obtention de la concentration maximale passe de 1,6 à 2,9 heures.
Pharmacodynamie
On pense que les effets antihypertenseurs aigus des thiazides résultent d'une réduction du volume sanguin et du débit cardiaque, secondaire à un effet natriurétique, bien qu'un mécanisme vasodilatateur direct ait également été proposé. Avec une administration chronique, le volume plasmatique revient à la normale, mais la résistance vasculaire périphérique est diminuée. Le mécanisme exact de l'effet antihypertenseur de l'hydrochlorothiazide n'est pas connu.
Les thiazides n'affectent pas la tension artérielle normale. Le début de l'action se produit dans les 2 heures suivant l'administration, l'effet maximal est observé à environ 4 heures et l'activité persiste jusqu'à 24 heures.
Etudes cliniques
Dans un essai en groupes parallèles, en double aveugle, contrôlé par placebo, d'une durée de 87 patients, les patients ayant reçu MICROZIDE (capsule d'hydrochlorothiazide) ont présenté des réductions de la pression artérielle systolique et diastolique en position assise significativement plus importantes que celles observées chez les patients ayant reçu le placebo. Dans des essais contrôlés par placebo publiés comparant 12,5 mg d'hydrochlorothiazide à 25 mg, la dose de 12,5 mg a préservé la majeure partie de la réduction de la pression artérielle corrigée par placebo observée avec 25 mg.
INFORMATIONS PATIENTS
Aucune information fournie. Veuillez vous référer au AVERTISSEMENTS et PRÉCAUTIONS sections.
