Lasix 40mg, 100mg Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Lasix et comment est-il utilisé ?
Lasix est un médicament d'ordonnance utilisé pour traiter les symptômes de la rétention d'eau (œdème) chez les personnes souffrant d'insuffisance cardiaque congestive, d'une maladie du foie ou d'un trouble rénal. Lasix peut être utilisé seul ou avec d'autres médicaments.
Lasix appartient à une classe de médicaments appelés Diurétiques, Loop.
On ne sait pas si Lasix 40 mg est sûr et efficace chez les enfants de moins de 1 an lorsqu'il est utilisé pour le traitement de l'hypertension résistante.
Quels sont les effets secondaires possibles de Lasix 40 mg ?
Lasix 40 mg peut provoquer des effets secondaires graves, notamment :
- étourdissement,
- résonne dans tes oreilles,
- perte d'audition,
- spasmes ou contractions musculaires,
- peau pâle,
- ecchymoses faciles,
- saignement inhabituel,
- augmentation de la soif,
- augmentation de la miction,
- bouche sèche,
- odeur d'haleine fruitée,
- peu ou pas de miction,
- gonflement des pieds ou des chevilles,
- se sentir fatigué,
- à bout de souffle,
- perte d'appétit,
- douleur dans le haut du ventre,
- nausée,
- vomissement,
- urine foncée,
- jaunissement de la peau ou des yeux (jaunisse),
- somnolence,
- se sentir nerveux,
- se sentir instable,
- battements cardiaques irréguliers,
- flottant dans ta poitrine,
- engourdissement ou fourmillement,
- crampes musculaires et
- faiblesse musculaire ou sensation de boiterie
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Lasix 40 mg incluent :
- diarrhée,
- constipation,
- perte d'appétit,
- engourdissement ou fourmillement,
- mal de tête,
- des étourdissements et
- Vision floue
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles du Lasix. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
ATTENTION
LASIX® (furosémide) est un diurétique puissant qui, s'il est administré en quantité excessive, peut entraîner une diurèse profonde avec déplétion hydrique et électrolytique. Par conséquent, une surveillance médicale attentive est nécessaire et la dose et le schéma posologique doivent être adaptés aux besoins individuels du patient. (Voir POSOLOGIE ET ADMINISTRATION.)
LA DESCRIPTION
LASIX® est un diurétique dérivé de l'acide anthranilique. Les comprimés LASIX 100 mg pour administration orale contiennent du furosémide comme ingrédient actif et les ingrédients inactifs suivants : lactose monohydraté NF, stéarate de magnésium NF, amidon NF, talc USP et dioxyde de silicium colloïdal NF. Chimiquement, il s'agit de l'acide 4-chloro-N-furfuryl-5-sulfamoylanthranilique. LASIX est disponible sous forme de comprimés blancs pour administration orale à des dosages de 20, 40 et 80 mg. Le furosémide est une poudre cristalline inodore blanche à blanc cassé. Il est pratiquement insoluble dans l'eau, peu soluble dans l'alcool, facilement soluble dans les solutions alcalines diluées et insoluble dans les acides dilués.
Le numéro de registre CAS est le 54-31-9.
La formule structurale est la suivante :
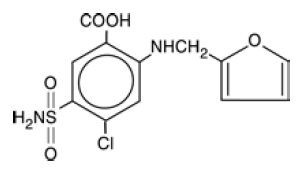
LES INDICATIONS
Œdème
LASIX est indiqué chez les adultes et les patients pédiatriques pour le traitement de l'œdème associé à l'insuffisance cardiaque congestive, à la cirrhose du foie et aux maladies rénales, y compris le syndrome néphrotique. LASIX 100 mg est particulièrement utile lorsqu'un agent ayant un plus grand potentiel diurétique est souhaité.
Hypertension
LASIX oral 40mg peut être utilisé chez l'adulte pour le traitement de l'hypertension seul ou en association avec d'autres agents antihypertenseurs. Les patients hypertendus qui ne peuvent pas être suffisamment contrôlés avec les thiazidiques ne le seront probablement pas non plus avec le LASIX seul.
DOSAGE ET ADMINISTRATION
Œdème
Le traitement doit être individualisé en fonction de la réponse du patient afin d'obtenir une réponse thérapeutique maximale et de déterminer la dose minimale nécessaire pour maintenir cette réponse.
Adultes
La dose initiale habituelle de LASIX est de 20 à 80 mg administrée en une seule dose. Habituellement, une diurèse rapide s'ensuit. Si nécessaire, la même dose peut être administrée 6 à 8 heures plus tard ou la dose peut être augmentée. La dose peut être augmentée de 20 ou 40 mg et administrée au plus tôt 6 à 8 heures après la dose précédente jusqu'à ce que l'effet diurétique souhaité ait été obtenu. La dose unique déterminée individuellement doit ensuite être administrée une ou deux fois par jour (par exemple, à 8 h et 14 h). La dose de LASIX 100 mg peut être ajustée avec précaution jusqu'à 600 mg/jour chez les patients présentant des états oedémateux cliniquement sévères.
L'œdème peut être mobilisé plus efficacement et en toute sécurité en administrant LASIX 100 mg pendant 2 à 4 jours consécutifs chaque semaine.
Lorsque des doses supérieures à 80 mg/jour sont administrées pendant des périodes prolongées, une observation clinique attentive et une surveillance biologique sont particulièrement recommandées. (Voir PRÉCAUTIONS : Tests de laboratoire .)
Patients gériatriques
En général, la sélection de la dose pour le patient âgé doit être prudente, en commençant généralement par le bas de la plage posologique (voir PRÉCAUTIONS : Utilisation gériatrique ).
Patients pédiatriques
La dose initiale habituelle de LASIX 40 mg par voie orale chez les patients pédiatriques est de 2 mg/kg de poids corporel, administrée en une dose unique. Si la réponse diurétique n'est pas satisfaisante après la dose initiale, la posologie peut être augmentée de 1 ou 2 mg/kg au plus tôt 6 à 8 heures après la dose précédente. Des doses supérieures à 6 mg/kg de poids corporel ne sont pas recommandées. Pour le traitement d'entretien chez les patients pédiatriques, la dose doit être ajustée au niveau minimum efficace.
Hypertension
Le traitement doit être individualisé en fonction de la réponse du patient afin d'obtenir une réponse thérapeutique maximale et de déterminer la dose minimale nécessaire pour maintenir la réponse thérapeutique.
Adultes
La dose initiale habituelle de LASIX pour l'hypertension est de 80 mg, généralement divisée en 40 mg deux fois par jour. La posologie doit alors être ajustée en fonction de la réponse. Si la réponse n'est pas satisfaisante, ajouter d'autres agents antihypertenseurs.
Les modifications de la pression artérielle doivent être étroitement surveillées lorsque LASIX 40 mg est utilisé avec d'autres médicaments antihypertenseurs, en particulier pendant le traitement initial. Pour éviter une chute excessive de la pression artérielle, la posologie des autres agents doit être réduite d'au moins 50 % lorsque LASIX 100 mg est ajouté au régime. La tension artérielle tombant sous l'effet potentialisateur de LASIX 100 mg, une réduction supplémentaire de la posologie, voire l'arrêt des autres antihypertenseurs, peut être nécessaire.
Patients gériatriques
En général, la sélection de la dose et l'ajustement de la dose chez le patient âgé doivent être prudents, en commençant généralement par le bas de l'intervalle posologique (voir PRÉCAUTIONS : Utilisation gériatrique ).
COMMENT FOURNIE
LASIX (furosémide) Comprimés 20 mg sont fournis sous forme de comprimés blancs, ovales et monogrammés en flacons de 100 ( CDN 0039-0067-10) et 1000 ( CDN 0039-0067-70). Les comprimés de 20 mg portent l'inscription « Lasix® » sur une face.
Comprimés LASIX 40 mg sont fournis sous forme de comprimés blancs, ronds, monogrammés et sécables en flacons de 100 ( CDN 0039-0060-13), 500 ( CDN 0039-0060-50), et 1000 ( CDN 0039-0060-70). Les comprimés de 40 mg portent l'inscription « Lasix® 40 » sur une face.
Comprimés LASIX 80 mg sont fournis sous forme de comprimés blancs, ronds, monogrammés et à facettes en flacons de 50 ( CDN 0039-0066-05) et 500 ( CDN 0039-0066-50). Les comprimés de 80 mg portent l'inscription « Lasix® 80 » sur une face.
Noter: Répartir dans des récipients bien fermés et résistants à la lumière. L'exposition à la lumière peut provoquer une légère décoloration. Les comprimés décolorés ne doivent pas être distribués.
Testé par le test de dissolution USP 2
Conserver à 25 °C (77 °F); excursions autorisées jusqu'à 15 -30° C (59 -86° F). [Voir Température ambiante contrôlée USP .]
Fabriqué pour : sanofi-aventis US LLC Bridgewater, NJ 08807. Une société Sanofi. Révision : mars 2016
EFFETS SECONDAIRES
Les effets indésirables sont classés ci-dessous par système organique et classés par gravité décroissante.
Réactions du système gastro-intestinal
Réactions d'hypersensibilité systémique
Réactions du système nerveux central
Réactions hématologiques
Réactions dermatologiques d'hypersensibilité
Réaction cardiovasculaire
Autres réactions
Chaque fois que les effets indésirables sont modérés ou graves, la posologie de LASIX doit être réduite ou le traitement arrêté.
INTERACTIONS MÉDICAMENTEUSES
LASIX 100 mg peut augmenter le potentiel ototoxique des antibiotiques aminoglycosides, en particulier en présence d'insuffisance rénale. Sauf dans les situations mettant la vie en danger, évitez cette combinaison.
LASIX ne doit pas être utilisé en même temps que l'acide éthacrynique en raison du risque d'ototoxicité. Les patients recevant des doses élevées de salicylates en même temps que LASIX, comme dans les maladies rhumatismales, peuvent présenter une toxicité salicylée à des doses plus faibles en raison des sites d'excrétion rénaux compétitifs.
Il existe un risque d'effets ototoxiques en cas d'administration concomitante de cisplatine et de LASIX. De plus, la néphrotoxicité des médicaments néphrotoxiques tels que le cisplatine peut être renforcée si LASIX 100 mg n'est pas administré à des doses plus faibles et avec un bilan hydrique positif lorsqu'il est utilisé pour obtenir une diurèse forcée pendant le traitement au cisplatine.
LASIX a tendance à s'opposer à l'effet relaxant des muscles squelettiques de la tubocurarine et peut potentialiser l'action de la succinylcholine.
Le lithium ne doit généralement pas être administré avec des diurétiques car ils réduisent la clairance rénale du lithium et ajoutent un risque élevé de toxicité au lithium.
LASIX 40 mg associé à des inhibiteurs de l'enzyme de conversion de l'angiotensine ou des antagonistes des récepteurs de l'angiotensine II peut entraîner une hypotension sévère et une détérioration de la fonction rénale, y compris une insuffisance rénale. Une interruption ou une réduction de la posologie de LASIX, des inhibiteurs de l'enzyme de conversion de l'angiotensine ou des antagonistes des récepteurs de l'angiotensine peut être nécessaire.
La potentialisation se produit avec des médicaments bloquants adrénergiques ganglionnaires ou périphériques.
LASIX 40 mg peut diminuer la réactivité artérielle à la noradrénaline. Cependant, la norépinéphrine peut toujours être utilisée efficacement.
L'administration simultanée de sucralfate et de comprimés LASIX 100 mg peut réduire les effets natriurétiques et antihypertenseurs de LASIX. Les patients recevant les deux médicaments doivent être étroitement surveillés afin de déterminer si l'effet diurétique et/ou antihypertenseur souhaité de LASIX 40 mg est atteint. La prise de LASIX 100 mg et de sucralfate doit être espacée d'au moins deux heures.
Dans des cas isolés, l'administration intraveineuse de LASIX dans les 24 heures suivant la prise d'hydrate de chloral peut entraîner des bouffées de chaleur, des crises de transpiration, de l'agitation, des nausées, une augmentation de la pression artérielle et une tachycardie. L'utilisation concomitante de LASIX 40 mg avec l'hydrate de chloral n'est donc pas recommandée.
La phénytoïne interfère directement avec l'action rénale du LASIX. Il est prouvé que le traitement par la phénytoïne entraîne une diminution de l'absorption intestinale de LASIX et, par conséquent, une diminution des concentrations sériques maximales de furosémide.
Le méthotrexate et d'autres médicaments qui, comme le LASIX, subissent une importante sécrétion tubulaire rénale peuvent réduire l'effet du LASIX. A l'inverse, LASIX 100mg peut diminuer l'élimination rénale d'autres médicaments qui subissent une sécrétion tubulaire. Le traitement à haute dose de LASIX et de ces autres médicaments peut entraîner des taux sériques élevés de ces médicaments et peut potentialiser leur toxicité ainsi que la toxicité de LASIX.
LASIX peut augmenter le risque de néphrotoxicité induite par les céphalosporines même dans le cadre d'une insuffisance rénale mineure ou transitoire.
L'utilisation concomitante de cyclosporine et de LASIX 40 mg est associée à un risque accru d'arthrite goutteuse secondaire à une hyperurémie induite par LASIX et à une altération de l'excrétion rénale d'urate induite par la cyclosporine.
Des doses élevées (> 80 mg) de furosémide peuvent inhiber la liaison des hormones thyroïdiennes aux protéines porteuses et entraîner une augmentation transitoire des hormones thyroïdiennes libres, suivie d'une diminution globale des taux d'hormones thyroïdiennes totales.
Une étude portant sur six sujets a démontré que l'association de furosémide et d'acide acétylsalicylique réduisait temporairement la clairance de la créatinine chez les patients insuffisants rénaux chroniques. Il existe des rapports de cas de patients qui ont développé une augmentation des taux d'azote uréique sanguin, de créatinine sérique et de potassium sérique, et une prise de poids lorsque le furosémide a été utilisé en conjonction avec des AINS.
Les rapports de la littérature indiquent que l'administration concomitante d'indométhacine peut réduire les effets natriurétiques et antihypertenseurs du LASIX (furosémide) chez certains patients en inhibant la synthèse des prostaglandines. L'indométhacine peut également affecter les taux plasmatiques de rénine, l'excrétion d'aldostérone et l'évaluation du profil de la rénine. Les patients recevant à la fois de l'indométhacine et du LASIX doivent être étroitement surveillés pour déterminer si l'effet diurétique et/ou antihypertenseur souhaité de LASIX 100 mg est atteint.
AVERTISSEMENTS
Chez les patients atteints de cirrhose hépatique et d'ascite, il est préférable d'initier le traitement par LASIX 100 mg à l'hôpital. Dans le coma hépatique et dans les états de déplétion électrolytique, le traitement ne doit pas être institué tant que l'état de base ne s'est pas amélioré. Des altérations soudaines de l'équilibre hydrique et électrolytique chez les patients atteints de cirrhose peuvent précipiter un coma hépatique; par conséquent, une observation stricte est nécessaire pendant la période de diurèse. Une supplémentation en chlorure de potassium et, si nécessaire, un antagoniste de l'aldostérone sont utiles pour prévenir l'hypokaliémie et l'alcalose métabolique.
Si une augmentation de l'azotémie et de l'oligurie se produit pendant le traitement d'une insuffisance rénale sévère progressive, LASIX 100 mg doit être arrêté.
Des cas d'acouphènes et de déficience auditive et de surdité réversibles ou irréversibles ont été rapportés. Les rapports indiquent généralement que l'ototoxicité de LASIX est associée à une injection rapide, une insuffisance rénale sévère, l'utilisation de doses supérieures aux doses recommandées, une hypoprotéinémie ou un traitement concomitant avec des antibiotiques aminosides, de l'acide éthacrynique ou d'autres médicaments ototoxiques. Si le médecin choisit d'utiliser un traitement parentéral à forte dose, une perfusion intraveineuse contrôlée est conseillée (pour les adultes, un débit de perfusion ne dépassant pas 4 mg de LASIX par minute a été utilisé). (Voir PRÉCAUTIONS : INTERACTIONS MÉDICAMENTEUSES )
PRÉCAUTIONS
Général
Une diurèse excessive peut provoquer une déshydratation et une réduction du volume sanguin avec un collapsus circulatoire et éventuellement une thrombose vasculaire et une embolie, en particulier chez les patients âgés. Comme avec tout diurétique efficace, une déplétion électrolytique peut survenir pendant le traitement par LASIX 100 mg, en particulier chez les patients recevant des doses plus élevées et un apport restreint en sel. Une hypokaliémie peut se développer avec LASIX, en particulier avec une diurèse rapide, un apport insuffisant d'électrolytes oraux, en cas de cirrhose, ou lors de l'utilisation concomitante de corticostéroïdes, d'ACTH, de réglisse en grande quantité ou d'une utilisation prolongée de laxatifs. Le traitement digitalique peut exagérer les effets métaboliques de l'hypokaliémie, en particulier les effets myocardiques.
Tous les patients recevant un traitement LASIX doivent être surveillés pour ces signes ou symptômes de déséquilibre hydrique ou électrolytique (hyponatrémie, alcalose hypochlorémique, hypokaliémie, hypomagnésémie ou hypocalcémie) : sécheresse de la bouche, soif, faiblesse, léthargie, somnolence, agitation, douleurs ou crampes musculaires, fatigue musculaire, hypotension, oligurie, tachycardie, arythmie ou troubles gastro-intestinaux tels que nausées et vomissements. Des augmentations de la glycémie et des altérations des tests de tolérance au glucose (avec des anomalies de la glycémie à jeun et postprandiale de 2 heures) ont été observées et, rarement, une précipitation du diabète sucré a été rapportée.
Chez les patients présentant des symptômes sévères de rétention urinaire (en raison de troubles de la vidange vésicale, d'hyperplasie prostatique, de rétrécissement urétral), l'administration de furosémide peut provoquer une rétention urinaire aiguë liée à une augmentation de la production et de la rétention d'urine. Ainsi, ces patients nécessitent une surveillance attentive, en particulier pendant les premières étapes du traitement.
Chez les patients à haut risque de néphropathie par radiocontraste, LASIX 100 mg peut entraîner une incidence plus élevée de détérioration de la fonction rénale après avoir reçu un radiocontraste par rapport aux patients à haut risque qui n'ont reçu qu'une hydratation intraveineuse avant de recevoir un radiocontraste.
Chez les patients présentant une hypoprotéinémie (p. ex. associée à un syndrome néphrotique), l'effet de LASIX 40 mg peut être affaibli et son ototoxicité potentialisée.
Une hyperuricémie asymptomatique peut survenir et la goutte peut rarement être précipitée.
Les patients allergiques aux sulfamides peuvent également être allergiques au LASIX. La possibilité existe d'exacerbation ou d'activation du lupus érythémateux disséminé.
Comme avec de nombreux autres médicaments, les patients doivent être surveillés régulièrement afin de déceler la survenue éventuelle de dyscrasies sanguines, de lésions hépatiques ou rénales ou d'autres réactions idiosyncratiques.
Tests de laboratoire
Les électrolytes sériques (en particulier le potassium), le CO2, la créatinine et l'azote uréique doivent être mesurés fréquemment au cours des premiers mois de traitement par LASIX 100 mg et périodiquement par la suite. Les déterminations des électrolytes sériques et urinaires sont particulièrement importantes lorsque le patient vomit abondamment ou reçoit des liquides parentéraux. Les anomalies doivent être corrigées ou le médicament temporairement arrêté. D'autres médicaments peuvent également influencer les électrolytes sériques.
Des élévations réversibles de l'azote uréique sanguin peuvent survenir et sont associées à une déshydratation, qui doit être évitée, en particulier chez les insuffisants rénaux.
L'urine et la glycémie doivent être contrôlées périodiquement chez les diabétiques recevant LASIX 100 mg, même chez les personnes suspectées de diabète latent.
LASIX 40mg peut abaisser les taux sériques de calcium (rarement des cas de tétanie ont été rapportés) et de magnésium. En conséquence, les taux sériques de ces électrolytes doivent être déterminés périodiquement.
Chez les prématurés, LASIX 100 mg peut précipiter une néphrocalcinose/néphrolithiase. Par conséquent, la fonction rénale doit être surveillée et une échographie rénale doit être réalisée. (Voir PRÉCAUTIONS : Utilisation pédiatrique )
Carcinogenèse, mutagenèse, altération de la fertilité
Le furosémide a été testé pour la cancérogénicité par administration orale dans une souche de souris et une souche de rats. Une incidence faible mais significativement accrue de carcinomes de la glande mammaire s'est produite chez les souris femelles à une dose 17,5 fois la dose humaine maximale de 600 mg. Il y a eu des augmentations marginales des tumeurs rares chez les rats mâles à une dose de 15 mg/kg (légèrement supérieure à la dose humaine maximale) mais pas à 30 mg/kg.
Le furosémide était dépourvu d'activité mutagène dans diverses souches de Salmonella typhimurium lorsqu'il était testé en présence ou en l'absence d'un système d'activation métabolique in vitro, et était douteusement positif pour la mutation génique dans les cellules de lymphome de souris en présence de foie de rat S9 à la dose la plus élevée testée. Le furosémide n'a pas induit d'échange de chromatides sœurs dans les cellules humaines in vitro, mais d'autres études sur les aberrations chromosomiques dans les cellules humaines in vitro ont donné des résultats contradictoires. Dans les cellules de hamster chinois, il induisait des dommages chromosomiques mais était douteusement positif pour l'échange de chromatides sœurs. Les études sur l'induction par le furosémide d'aberrations chromosomiques chez la souris n'ont pas été concluantes. L'urine des rats traités avec ce médicament n'a pas induit de conversion génique chez Saccharomyces cerevisiae.
LASIX (furosémide) n'a produit aucune altération de la fertilité chez les rats mâles ou femelles, à 100 mg/kg/jour (la dose diurétique efficace maximale chez le rat et 8 fois la dose humaine maximale de 600 mg/jour).
Grossesse
Catégorie de grossesse C - Il a été démontré que le furosémide provoque des décès maternels inexpliqués et des avortements chez le lapin à 2, 4 et 8 fois la dose maximale recommandée chez l'homme. Il n'y a pas d'études adéquates et bien contrôlées chez les femmes enceintes. LASIX ne doit être utilisé pendant la grossesse que si le bénéfice potentiel justifie le risque potentiel pour le fœtus.
Le traitement pendant la grossesse nécessite une surveillance de la croissance fœtale en raison du risque d'augmentation du poids à la naissance.
Les effets du furosémide sur le développement embryonnaire et fœtal et sur les mères gravides ont été étudiés chez la souris, le rat et le lapin.
Le furosémide a provoqué des décès maternels inexpliqués et des avortements chez le lapin à la dose la plus faible de 25 mg/kg (2 fois la dose maximale recommandée chez l'homme de 600 mg/jour). Dans une autre étude, une dose de 50 mg/kg (4 fois la dose humaine maximale recommandée de 600 mg/jour) a également causé des décès maternels et des avortements lorsqu'elle a été administrée à des lapins entre les jours 12 et 17 de la gestation. Dans une troisième étude, aucune des lapines gestantes n'a survécu à une dose de 100 mg/kg. Les données des études ci-dessus indiquent une létalité fœtale qui peut précéder les décès maternels.
Les résultats de l'étude chez la souris et de l'une des trois études chez le lapin ont également montré une augmentation de l'incidence et de la gravité de l'hydronéphrose (distension du bassinet du rein et, dans certains cas, des uretères) chez les fœtus issus des mères traitées par rapport à l'incidence chez les fœtus du groupe témoin.
Mères allaitantes
Comme il apparaît dans le lait maternel, la prudence s'impose lorsque LASIX est administré à une mère qui allaite.
LASIX 40mg peut inhiber la lactation.
Utilisation pédiatrique
Chez les prématurés, LASIX peut déclencher une néphrocalcinose/néphrolithiase. Une néphrocalcinose/néphrolithiase a également été observée chez des enfants de moins de 4 ans sans antécédent de prématurité qui ont été traités de façon chronique par LASIX. Surveiller la fonction rénale et une échographie rénale doivent être envisagées chez les patients pédiatriques recevant LASIX.
Si LASIX 40 mg est administré à des prématurés au cours des premières semaines de vie, il peut augmenter le risque de persistance du canal artériel persistant
Utilisation gériatrique
Les études cliniques contrôlées de LASIX 100 mg n'ont pas inclus un nombre suffisant de sujets âgés de 65 ans et plus pour déterminer s'ils répondent différemment des sujets plus jeunes. L'autre expérience clinique annoncée n'a pas identifié de différences dans les réponses entre les patients assez âgés et plus jeunes. En général, la sélection de la dose pour le patient âgé doit être prudente, en commençant généralement à l'extrémité inférieure de la plage posologique, reflétant la fréquence plus élevée de diminution de la fonction hépatique, rénale ou cardiaque et de maladie concomitante ou d'un autre traitement médicamenteux.
Ce médicament est connu pour être en grande partie excrété par les reins et le risque de réactions toxiques à ce médicament peut être plus élevé chez les patients présentant une insuffisance rénale. Étant donné que les patients âgés sont plus susceptibles d'avoir une fonction rénale diminuée, des précautions doivent être prises lors du choix de la dose et il peut être utile de surveiller la fonction rénale. (Voir PRÉCAUTIONS : Général et DOSAGE ET ADMINISTRATION .)
SURDOSAGE
Les principaux signes et symptômes d'un surdosage avec LASIX 40 mg sont la déshydratation, la réduction du volume sanguin, l'hypotension, le déséquilibre électrolytique, l'hypokaliémie et l'alcalose hypochlorémique, et sont des prolongements de son action diurétique.
La toxicité aiguë de LASIX 100 mg a été déterminée chez la souris, le rat et le chien. Dans les trois cas, la DL50 orale dépassait 1000 mg/kg de poids corporel, tandis que la DL50 intraveineuse variait de 300 à 680 mg/kg. La toxicité intragastrique aiguë chez les rats nouveau-nés est de 7 à 10 fois supérieure à celle des rats adultes.
La concentration de LASIX dans les fluides biologiques associée à la toxicité ou à la mort n'est pas connue.
Le traitement du surdosage est symptomatique et consiste à remplacer les pertes excessives de liquide et d'électrolytes. Les électrolytes sériques, le taux de dioxyde de carbone et la tension artérielle doivent être déterminés fréquemment. Un drainage adéquat doit être assuré chez les patients présentant une obstruction de la sortie de la vessie (telle qu'une hypertrophie prostatique).
L'hémodialyse n'accélère pas l'élimination du furosémide.
CONTRE-INDICATIONS
LASIX 40 mg est contre-indiqué chez les patients souffrant d'anurie et chez les patients ayant des antécédents d'hypersensibilité au furosémide.
PHARMACOLOGIE CLINIQUE
Les enquêtes sur le mode d'action de LASIX ont utilisé des études de microponction chez le rat, des expériences d'arrêt du flux chez le chien et diverses études de clairance chez l'homme et les animaux de laboratoire. Il a été démontré que LASIX inhibe principalement l'absorption du sodium et du chlorure non seulement dans les tubules proximaux et distaux mais également dans l'anse de Henle. Le haut degré d'efficacité est largement dû au site d'action unique. L'action sur le tubule distal est indépendante de tout effet inhibiteur sur l'anhydrase carbonique et l'aldostérone.
Des preuves récentes suggèrent que le glucuronide de furosémide est le seul ou du moins le principal produit de biotransformation du furosémide chez l'homme. Le furosémide est fortement lié aux protéines plasmatiques, principalement à l'albumine. Les concentrations plasmatiques allant de 1 à 400 μg/mL sont liées à 91 à 99 % chez les individus en bonne santé. La fraction non liée est en moyenne de 2,3 à 4,1 % aux concentrations thérapeutiques.
Le début de la diurèse après administration orale est dans l'heure qui suit. L'effet maximal se produit dans la première ou la deuxième heure. La durée de l'effet diurétique est de 6 à 8 heures.
Chez les hommes normaux à jeun, la biodisponibilité moyenne du furosémide des comprimés LASIX et de la solution orale LASIX est de 64 % et 60 %, respectivement, de celle d'une injection intraveineuse du médicament. Bien que le furosémide soit plus rapidement absorbé à partir de la solution buvable (50 minutes) qu'à partir du comprimé (87 minutes), les concentrations plasmatiques maximales et l'aire sous les courbes de concentration plasmatique en fonction du temps ne diffèrent pas significativement. Les concentrations plasmatiques maximales augmentent avec l'augmentation de la dose, mais les durées maximales ne diffèrent pas entre les doses. La demi-vie terminale du furosémide est d'environ 2 heures.
Une quantité significativement plus importante de furosémide est excrétée dans l'urine après l'injection IV qu'après le comprimé ou la solution buvable. Il n'y a pas de différences significatives entre les deux formulations orales dans la quantité de médicament inchangé excrété dans l'urine.
Population gériatrique
La liaison du furosémide à l'albumine peut être réduite chez les patients âgés. Le furosémide est principalement excrété sous forme inchangée dans les urines. La clairance rénale du furosémide après administration intraveineuse chez les hommes sains âgés (60-70 ans) est statistiquement significativement plus faible que chez les hommes sains plus jeunes (20-35 ans). L'effet diurétique initial du furosémide chez les sujets âgés est diminué par rapport aux sujets plus jeunes. (Voir PRÉCAUTIONS : Utilisation gériatrique .)
INFORMATIONS PATIENTS
Les patients recevant LASIX doivent être informés qu'ils peuvent présenter des symptômes liés à des pertes excessives de liquide et/ou d'électrolytes. L'hypotension orthostatique qui survient parfois peut généralement être gérée en se levant lentement. Des suppléments de potassium et/ou des mesures diététiques peuvent être nécessaires pour contrôler ou éviter l'hypokaliémie.
Les patients atteints de diabète sucré doivent être informés que le furosémide peut augmenter la glycémie et affecter ainsi les tests de glycémie. La peau de certains patients peut être plus sensible aux effets du soleil lors de la prise de furosémide.
Les patients hypertendus doivent éviter les médicaments susceptibles d'augmenter la tension artérielle, y compris les produits en vente libre pour la suppression de l'appétit et les symptômes du rhume.
