Dostinex 0.25mg, 0.5mg Cabergoline Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Dostinex 0,25 mg et comment est-il utilisé ?
Dostinex (cabergoline) est un antagoniste des récepteurs de la dopamine utilisé pour traiter un déséquilibre hormonal dans lequel il y a trop de prolactine dans le sang (également appelée hyperprolactinémie).
Quels sont les effets secondaires de Dostinex ?
Les effets secondaires courants de Dostinex 0,25 mg incluent :
- nausée,
- vomissement,
- des maux d'estomac ou des douleurs,
- indigestion,
- constipation,
- gaz,
- vertiges,
- sensation de rotation,
- étourdissement,
- somnolence,
- nervosité,
- fatigue,
- mal de tête,
- humeur dépressive,
- les bouffées de chaleur,
- engourdissement ou sensation de picotement, ou
- bouche sèche.
Informez votre médecin si vous ressentez des effets secondaires rares mais graves de Dostinex, notamment :
- essoufflement,
- toux persistante,
- gonflement des chevilles ou des pieds,
- fatigue inhabituelle,
- changements mentaux / d'humeur (tels que la nervosité),
- fortes pulsions inhabituelles (comme une augmentation du jeu, des pulsions sexuelles accrues),
- changements de vision,
- règles douloureuses ou
- douleur mammaire.
LA DESCRIPTION
Les comprimés DOSTINEX contiennent de la cabergoline, un agoniste des récepteurs de la dopamine. Le nom chimique de la cabergoline est 1-[(6-allylergolin-8β-yl)-carbonyl]-1-[3-(diméthylamino)propyl]-3-éthylurée. Sa formule empirique est C26H37N5O2 et son poids moléculaire est de 451,62. La formule structurale est la suivante :
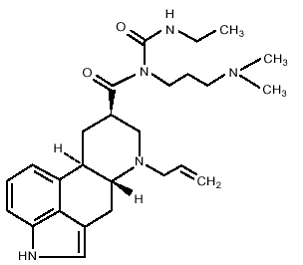
La cabergoline est une poudre blanche soluble dans l'alcool éthylique, le chloroforme et le N, N-diméthylformamide (DMF); légèrement soluble dans l'acide chlorhydrique 0,1 N; très légèrement soluble dans le n-hexane; et insoluble dans l'eau.
Les comprimés DOSTINEX 0,25 mg, pour administration orale, contiennent 0,5 mg de cabergoline. Les ingrédients inactifs sont la leucine, USP, et le lactose, NF.
LES INDICATIONS
Les comprimés DOSTINEX 0,5 mg sont indiqués dans le traitement des troubles hyperprolactinémiques, qu'ils soient idiopathiques ou dus à des adénomes hypophysaires.
DOSAGE ET ADMINISTRATION
La posologie recommandée de DOSTINEX 0,25 mg comprimés pour l'initiation du traitement est de 0,25 mg deux fois par semaine. La posologie peut être augmentée de 0,25 mg deux fois par semaine jusqu'à une posologie de 1 mg deux fois par semaine en fonction du taux de prolactine sérique du patient. Avant de commencer le traitement, une évaluation cardiovasculaire doit être effectuée et une échocardiographie doit être envisagée pour évaluer la maladie valvulaire.
Les augmentations de dosage ne devraient pas se produire plus rapidement que toutes les 4 semaines, de sorte que le médecin puisse évaluer la réponse du patient à chaque niveau de dosage. Si le patient ne répond pas de manière adéquate et qu'aucun bénéfice supplémentaire n'est observé avec des doses plus élevées, la dose la plus faible ayant permis d'obtenir une réponse maximale doit être utilisée et d'autres approches thérapeutiques doivent être envisagées. Les patients recevant un traitement à long terme par DOSTINEX 0,25 mg doivent subir une évaluation périodique de leur état cardiaque et une échocardiographie doit être envisagée.
Après maintien d'un taux de prolactine sérique normal pendant 6 mois, DOSTINEX 0,5 mg peut être arrêté, avec une surveillance périodique du taux de prolactine sérique pour déterminer si ou quand le traitement par DOSTINEX doit être réinstauré. La durabilité de l'efficacité au-delà de 24 mois de traitement par DOSTINEX n'a pas été établie.
COMMENT FOURNIE
Les comprimés DOSTINEX sont des comprimés blancs, sécables, en forme de capsule contenant 0,5 mg de cabergoline. Chaque comprimé est marqué d'un côté et porte la lettre P et la lettre U de chaque côté de la ligne de cassure. L'autre face de la tablette est gravée du chiffre 700.
DOSTINEX est disponible comme suit :
Flacons de 8 comprimés CDN 0013-7001-12
Stockage
Conserver à température ambiante contrôlée de 20 ° à 25 °C (68 ° à 77 °F) [voir USP ].
L'étiquette de ce produit a peut-être été mise à jour. Pour des informations de prescription complètes et à jour, veuillez visiter www.pfizer.com
Distribué par : Pharmacia & Upjohn Company Division of Pfizer Inc., NY, NY 10017. Révisé : septembre 2014
EFFETS SECONDAIRES
La sécurité des comprimés DOSTINEX 0,25 mg a été évaluée chez plus de 900 patients présentant des troubles hyperprolactinémiques. La plupart des événements indésirables étaient d'intensité légère ou modérée.
Dans une étude de 4 semaines, en double aveugle, contrôlée par placebo, le traitement consistait en un placebo ou en cabergoline à des doses fixes de 0,125, 0,5, 0,75 ou 1,0 mg deux fois par semaine. Les doses ont été réduites de moitié au cours de la première semaine. Puisqu'un possible effet lié à la dose n'a été observé que pour les nausées, les quatre groupes de traitement par la cabergoline ont été combinés. L'incidence des événements indésirables les plus fréquents au cours de l'étude contrôlée contre placebo est présentée dans le tableau suivant.
Incidence des événements indésirables signalés au cours de l'essai de 4 semaines, à double insu et contrôlé par placebo
Au cours de la période de 8 semaines en double aveugle de l'essai comparatif avec la bromocriptine, DOSTINEX (à la dose de 0,5 mg deux fois par semaine) a été arrêté en raison d'un événement indésirable chez 4 des 221 patients (2 %) tandis que la bromocriptine (à la dose de 2,5 mg deux fois par jour) a été interrompue chez 14 des 231 patients (6 %). Les raisons les plus fréquentes d'arrêt de DOSTINEX étaient les céphalées, les nausées et les vomissements (respectivement 3, 2 et 2 patients) ; les raisons les plus courantes de l'arrêt de la bromocriptine étaient les nausées, les vomissements, les maux de tête et les étourdissements ou les vertiges (respectivement 10, 3, 3 et 3 patients). L'incidence des événements indésirables les plus fréquents au cours de la partie en double aveugle de l'essai comparatif avec la bromocriptine est présentée dans le tableau suivant.
Incidence des événements indésirables signalés au cours de la période de 8 semaines en double aveugle de l'essai comparatif avec la bromocriptine
D'autres événements indésirables signalés à une incidence
Corps dans son ensemble : œdème facial, symptômes pseudo-grippaux, malaise
Système cardiovasculaire: hypotension, syncope, palpitations
Système digestif: bouche sèche, flatulence, diarrhée, anorexie
Système métabolique et nutritionnel : perte de poids, gain de poids
Système nerveux: somnolence, nervosité, paresthésie, insomnie, anxiété
Système respiratoire: congestion nasale, épistaxis
Peau et appendices : acné, prurit
Sens spéciaux : vision anormale
Système urogénital : dysménorrhée, augmentation de la libido
La sécurité de la cabergoline a été évaluée chez environ 1 200 patients atteints de la maladie de Parkinson dans des études contrôlées et non contrôlées à des doses allant jusqu'à 11,5 mg/jour, ce qui dépasse largement la dose maximale recommandée de cabergoline pour les troubles hyperprolactinémiques. Outre les événements indésirables survenus chez les patients atteints de troubles hyperprolactinémiques, les événements indésirables les plus fréquents chez les patients atteints de la maladie de Parkinson étaient la dyskinésie, les hallucinations, la confusion et l'œdème périphérique. Une insuffisance cardiaque, un épanchement pleural, une fibrose pulmonaire et un ulcère gastrique ou duodénal sont survenus rarement. Un cas de péricardite constrictive a été rapporté.
Données de surveillance post-commercialisation
Les événements suivants ont été rapportés en association avec DOSTINEX : valvulopathie cardiaque et réactions fibrotiques extracardiaques (voir AVERTISSEMENTS , Valvulopathie cardiaque et réactions fibrotiques extracardiaques ).
D'autres événements ont été rapportés en association avec la cabergoline : hypersexualité, augmentation de la libido et jeu pathologique (voir PRÉCAUTIONS , Psychiatrique ). De plus, des cas d'alopécie, d'agressivité et de troubles psychotiques ont été signalés chez des patients prenant DOSTINEX. Certains de ces rapports ont été signalés chez des patients ayant déjà présenté des effets indésirables à des produits agonistes de la dopamine.
INTERACTIONS MÉDICAMENTEUSES
DOSTINEX 0,5 mg ne doit pas être administré en même temps que des antagonistes D, tels que les phénothiazines, les butyrophénones, les thioxanthènes ou le métoclopramide.
AVERTISSEMENTS
Grossesse
Les agonistes de la dopamine en général ne doivent pas être utilisés chez les patientes souffrant d'hypertension induite par la grossesse, par exemple, de prééclampsie, d'éclampsie et d'hypertension post-partum, à moins que le bénéfice potentiel ne soit jugé supérieur au risque éventuel.
Complications fibrotiques
Valvulopathie cardiaque
Tous les patients doivent subir une évaluation cardiovasculaire, y compris une échocardiographie pour évaluer la présence potentielle d'une maladie valvulaire. Si une maladie valvulaire est détectée, le patient ne doit pas être traité par DOSTINEX. (Voir CONTRE-INDICATIONS ) Des cas post-commercialisation de valvulopathie cardiaque ont été rapportés chez des patients recevant DOSTINEX. Ces cas sont généralement survenus lors de l'administration de fortes doses de DOSTINEX (> 2 mg/jour) pour le traitement de la maladie de Parkinson. Des cas de valvulopathie cardiaque ont également été signalés chez des patients recevant des doses plus faibles de DOSTINEX pour le traitement de troubles hyperprolactinémiques.
Une étude de cohorte rétrospective multi-pays utilisant des dossiers de médecine générale et des systèmes de couplage de dossiers au Royaume-Uni, en Italie et aux Pays-Bas a été menée pour évaluer l'association entre la nouvelle utilisation d'agonistes de la dopamine, y compris la cabergoline (n = 27 812) pour la maladie de Parkinson et l'hyperprolactinémie et les troubles cardiaques. régurgitation valvulaire (RVC), autres fibroses et autres événements cardiopulmonaires sur un maximum de 12 ans de suivi. Dans cette étude, l'utilisation de la cabergoline chez les personnes atteintes de la maladie de Parkinson était associée à un risque accru de RVC par rapport aux agonistes de la dopamine (AD) non dérivés de l'ergot et à la lévodopa [taux d'incidence (RI) pour 10 000 années-personnes de 68,1 (95 % intervalle de confiance (IC) : 37,2–115,3) pour la cabergoline vs 10,0 (IC à 95 % : 5,2–19,4) pour les AD autres que l'ergot et 11,3 (IC à 95 % : 7,2 –17,0) pour la lévodopa]. Dans l'analyse de l'étude limitée aux personnes atteintes d'hyperprolactinémie traitée par un agoniste de la dopamine (n = 8 386), par rapport à la non-utilisation (n = 15 147), les personnes exposées à la cabergoline n'avaient pas de risque élevé de CVR. Les résultats concernant le risque de RVC associé au traitement par la cabergoline pour les personnes atteintes de la maladie de Parkinson (risque accru) et celles atteintes d'hyperprolactinémie (pas de risque accru) sont cohérents avec les résultats d'autres études publiées.
Les médecins doivent utiliser la dose efficace la plus faible de DOSTINEX pour le traitement des troubles hyperprolactinémiques et doivent réévaluer périodiquement la nécessité de poursuivre le traitement par DOSTINEX. Après le début du traitement, une surveillance clinique et diagnostique (par exemple, radiographie pulmonaire, tomodensitométrie et échocardiographie cardiaque) doit être effectuée pour évaluer le risque de valvulopathie cardiaque. La fréquence recommandée de la surveillance échocardiographique de routine est tous les 6 à 12 mois ou selon les indications cliniques en présence de signes et de symptômes tels qu'un œdème, un nouveau souffle cardiaque, une dyspnée ou une insuffisance cardiaque congestive.
DOSTINEX doit être interrompu si un échocardiogramme révèle une nouvelle régurgitation valvulaire, une restriction valvulaire ou un épaississement des feuillets valvulaires.
DOSTINEX doit être utilisé avec prudence chez les patients exposés à d'autres médicaments associés à la valvulopathie.

Réactions fibrotiques extracardiaques
Des cas post-commercialisation de fibrose pleurale, péricardique et rétropéritonéale ont été rapportés suite à l'administration de DOSTINEX. Certains cas concernaient des patients précédemment traités avec d'autres agonistes dopaminergiques ergotiniques. DOSTINEX ne doit pas être utilisé chez les patients ayant des antécédents de troubles fibrotiques cardiaques ou extracardiaques.
Les troubles fibrotiques peuvent avoir un début insidieux et les patients doivent être surveillés pour des manifestations de fibrose progressive. Par conséquent, pendant le traitement, une attention particulière doit être portée aux signes et symptômes de :
- Maladie pleuro-pulmonaire telle que dyspnée, essoufflement, toux persistante ou douleur thoracique.
- Insuffisance rénale ou obstruction vasculaire urétérale/abdominale pouvant survenir avec des douleurs dans le rein/le flanc et un œdème des membres inférieurs ainsi que d'éventuelles masses ou sensibilités abdominales pouvant indiquer une fibrose rétropéritonéale.
- Insuffisance cardiaque : les cas de fibrose valvulaire et péricardique se sont souvent manifestés par une insuffisance cardiaque. Par conséquent, la fibrose valvulaire (et la péricardite constrictive) doit être exclue si de tels symptômes surviennent.
La surveillance clinique et diagnostique telle que la vitesse de sédimentation des érythrocytes, la radiographie pulmonaire, les mesures de la créatinine sérique et d'autres investigations doivent être envisagées au départ et si nécessaire pendant que les patients sont traités par DOSTINEX.
Suite au diagnostic d'épanchement pleural ou de fibrose pulmonaire, l'arrêt de DOSTINEX a entraîné une amélioration des signes et des symptômes.
PRÉCAUTIONS
Général
Des doses initiales supérieures à 1,0 mg peuvent produire une hypotension orthostatique. Des précautions doivent être prises lors de l'administration de DOSTINEX avec d'autres médicaments connus pour abaisser la tension artérielle.
Inhibition ou suppression de la lactation post-partum
DOSTINEX 0,25 mg n'est pas indiqué pour l'inhibition ou la suppression de la lactation physiologique. L'utilisation de la bromocriptine, un autre agoniste de la dopamine à cette fin, a été associée à des cas d'hypertension, d'accident vasculaire cérébral et de convulsions.
Insuffisance hépatique
Étant donné que la cabergoline est largement métabolisée par le foie, il convient de faire preuve de prudence et d'exercer une surveillance étroite lors de l'administration de DOSTINEX 0,5 mg à des patients atteints d'insuffisance hépatique.
Psychiatrique
Le jeu pathologique, l'augmentation de la libido et l'hypersexualité ont été rapportés chez des patients traités par des agonistes de la dopamine, y compris la cabergoline. Cela a été généralement réversible lors de la réduction de la dose ou de l'arrêt du traitement (voir Données de surveillance post-commercialisation ).
Carcinogenèse, mutagenèse, altération de la fertilité
Des études de cancérogénicité ont été menées chez des souris et des rats avec de la cabergoline administrée par gavage à des doses allant jusqu'à 0,98 mg/kg/jour et 0,32 mg/kg/jour, respectivement. Ces doses sont 7 fois et 4 fois la dose humaine maximale recommandée calculée sur la base de la surface corporelle en utilisant le total mg/m/semaine chez les rongeurs et mg/m/semaine pour un humain de 50 kg.
Il y a eu une légère augmentation de l'incidence des léiomyomes cervicaux et utérins et des léiomyosarcomes utérins chez la souris. Chez les rats, il y a eu une légère augmentation des tumeurs malignes du col de l'utérus et de l'utérus et des adénomes des cellules interstitielles. L'apparition de tumeurs chez les rongeurs femelles peut être liée à la suppression prolongée de la sécrétion de prolactine, car la prolactine est nécessaire chez les rongeurs pour le maintien du corps jaune. En l'absence de prolactine, le rapport œstrogène/progestérone est augmenté, augmentant ainsi le risque de tumeurs utérines. Chez les rongeurs mâles, la diminution des taux sériques de prolactine était associée à une augmentation de l'hormone lutéinisante sérique, que l'on pense être un effet compensatoire pour maintenir la synthèse des stéroïdes testiculaires. Étant donné que ces mécanismes hormonaux sont considérés comme spécifiques à l'espèce, la pertinence de ces tumeurs pour l'homme n'est pas connue.
Le potentiel mutagène de la cabergoline a été évalué et s'est avéré négatif dans une batterie de tests in vitro. Ces tests comprenaient le test de mutation bactérienne (Ames) avec Salmonella typhimurium, le test de mutation génique avec des cellules de hamster chinois Schizosaccharomyces pombe P1 et V79, les dommages et la réparation de l'ADN chez Saccharomyces cerevisiae D4 et les aberrations chromosomiques dans les lymphocytes humains. La cabergoline était également négative au test du micronoyau de la moelle osseuse chez la souris.
Chez les rats femelles, une dose quotidienne de 0,003 mg/kg pendant 2 semaines avant l'accouplement et tout au long de la période d'accouplement a inhibé la conception. Cette dose représente environ 1/28 de la dose maximale recommandée chez l'homme calculée sur la base de la surface corporelle en utilisant le total mg/m/semaine chez le rat et mg/m/semaine pour un humain de 50 kg.
Grossesse
Effets tératogènes - Catégorie B
Des études de reproduction ont été réalisées avec la cabergoline chez des souris, des rats et des lapins administrés par gavage. (Les multiples de la dose humaine maximale recommandée dans cette section sont calculés sur la base de la surface corporelle en utilisant le total mg/m/semaine pour les animaux et mg/m/semaine pour un humain de 50 kg.)
Il y a eu des effets maternotoxiques mais aucun effet tératogène chez les souris ayant reçu de la cabergoline à des doses allant jusqu'à 8 mg/kg/jour (environ 55 fois la dose maximale recommandée chez l'homme) pendant la période d'organogenèse.
Une dose de 0,012 mg/kg/jour (environ 1/7 de la dose maximale recommandée chez l'homme) pendant la période d'organogenèse chez le rat a provoqué une augmentation des pertes embryofœtales post-implantation. Ces pertes pourraient être dues aux propriétés inhibitrices de la prolactine de la cabergoline chez le rat. À des doses quotidiennes de 0,5 mg/kg/jour (environ 19 fois la dose maximale recommandée chez l'homme) pendant la période d'organogenèse chez le lapin, la cabergoline a provoqué une maternotoxicité caractérisée par une perte de poids corporel et une diminution de la consommation alimentaire. Des doses de 4 mg/kg/jour (environ 150 fois la dose maximale recommandée chez l'homme) pendant la période d'organogenèse chez le lapin ont entraîné une augmentation de la fréquence de diverses malformations. Cependant, dans une autre étude chez le lapin, aucune malformation liée au traitement ou embryofœtotoxicité n'a été observée à des doses allant jusqu'à 8 mg/kg/jour (environ 300 fois la dose maximale recommandée chez l'homme).
Chez le rat, des doses supérieures à 0,003 mg/kg/jour (environ 1/28 de la dose maximale recommandée chez l'homme) à partir de 6 jours avant la parturition et tout au long de la période de lactation ont inhibé la croissance et causé la mort de la progéniture en raison d'une diminution de la sécrétion de lait.
Il n'y a cependant pas d'études adéquates et bien contrôlées chez les femmes enceintes. Étant donné que les études sur la reproduction chez l'animal ne sont pas toujours prédictives de la réponse humaine, ce médicament ne doit être utilisé pendant la grossesse qu'en cas de nécessité absolue.
Mères allaitantes
On ne sait pas si ce médicament est excrété dans le lait maternel. Étant donné que de nombreux médicaments sont excrétés dans le lait maternel et en raison du risque d'effets indésirables graves de la cabergoline chez les nourrissons, une décision doit être prise d'interrompre l'allaitement ou d'arrêter le médicament, en tenant compte de l'importance du médicament pour la mère. L'utilisation de DOSTINEX pour l'inhibition ou la suppression de la lactation physiologique n'est pas recommandée (voir PRÉCAUTIONS section).
L'action hypoprolactine de la cabergoline suggère qu'elle interfère avec la lactation. En raison de cette interférence avec la lactation, DOSTINEX 0,5 mg ne doit pas être administré aux femmes en post-partum qui allaitent ou envisagent d'allaiter.
Utilisation pédiatrique
La sécurité et l'efficacité de DOSTINEX 0,5 mg chez les patients pédiatriques n'ont pas été établies.
Utilisation gériatrique
Les études cliniques de DOSTINEX 0,5 mg n'ont pas inclus un nombre suffisant de sujets âgés de 65 ans et plus pour déterminer s'ils répondent différemment des patients plus jeunes. L'autre expérience clinique annoncée n'a pas identifié de différences dans les réponses entre les patients assez âgés et plus jeunes. En général, la sélection de la dose pour un patient âgé doit être prudente, en commençant généralement à l'extrémité inférieure de la plage posologique, reflétant la plus grande fréquence de diminution de la fonction hépatique, rénale ou cardiaque et de maladie concomitante ou d'un autre traitement médicamenteux.
SURDOSAGE
On peut s'attendre à ce qu'un surdosage produise une congestion nasale, une syncope ou des hallucinations. Des mesures de soutien de la pression artérielle doivent être prises si nécessaire.
CONTRE-INDICATIONS
Les comprimés DOSTINEX sont contre-indiqués chez les patients présentant :
- Hypertension non contrôlée ou hypersensibilité connue aux dérivés de l'ergot de seigle.
- Antécédents de troubles valvulaires cardiaques, tels que suggérés par des preuves anatomiques de valvulopathie de toute valve, déterminés par une évaluation avant le traitement, y compris une démonstration échocardiographique d'un épaississement des feuillets valvulaires, d'une restriction valvulaire ou d'une sténose-restriction valvulaire mixte. (Voir AVERTISSEMENTS )
- Antécédents de troubles fibrotiques pulmonaires, péricardiques ou rétropéritonéaux. (Voir AVERTISSEMENTS )
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
La sécrétion de prolactine par l'hypophyse antérieure est principalement sous contrôle inhibiteur hypothalamique, probablement exercé par la libération de dopamine par les neurones tubéro-infundibulaires. La cabergoline est un agoniste des récepteurs de la dopamine à action prolongée avec une forte affinité pour les récepteurs D2. Les résultats d'études in vitro démontrent que la cabergoline exerce un effet inhibiteur direct sur la sécrétion de prolactine par les lactotrophes hypophysaires du rat. La cabergoline a diminué les taux de prolactine sérique chez les rats réserpinisés. Des études de liaison aux récepteurs indiquent que la cabergoline a une faible affinité pour les récepteurs dopaminergiques D1, α1 et α2-adrénergiques et 5-HT1 et 5-HT2-sérotonine.
Etudes cliniques
L'efficacité hypoprolactinémiante de DOSTINEX 0,25 mg a été démontrée chez des femmes hyperprolactinémiques dans deux études comparatives randomisées, en double aveugle, l'une avec placebo et l'autre avec bromocriptine. Dans l'étude contrôlée versus placebo (placebo n=20 ; cabergoline n=168), DOSTINEX 0,5 mg a entraîné une diminution dose-dépendante des taux sériques de prolactine avec une prolactine normalisée après 4 semaines de traitement chez 29 %, 76 %, 74 % et 95 % % des patients recevant respectivement 0,125, 0,5, 0,75 et 1,0 mg deux fois par semaine.
Au cours de la période de 8 semaines en double aveugle de l'essai comparatif avec la bromocriptine (cabergoline n=223 ; bromocriptine n=236 dans l'analyse en intention de traiter), la prolactine a été normalisée chez 77 % des patients traités par DOSTINEX à 0,5 mg deux fois par semaine contre 59 % des personnes traitées par la bromocriptine à raison de 2,5 mg deux fois par jour. La restauration des règles s'est produite chez 77 % des femmes traitées par DOSTINEX, contre 70 % de celles traitées par la bromocriptine. Parmi les patients atteints de galactorrhée, ce symptôme a disparu chez 73% de ceux traités par DOSTINEX contre 56% de ceux traités par bromocriptine.
Pharmacocinétique
Absorption
Suite à des doses orales uniques de 0,5 mg à 1,5 mg administrées à 12 adultes volontaires sains, des concentrations plasmatiques maximales moyennes de 30 à 70 picogrammes (pg)/mL de cabergoline ont été observées dans les 2 à 3 heures. Sur la plage de doses de 0,5 à 7 mg, les concentrations plasmatiques de cabergoline semblaient être proportionnelles à la dose chez 12 volontaires adultes en bonne santé et neuf patients adultes parkinsoniens. Une étude à doses répétées chez 12 volontaires sains suggère que les niveaux à l'état d'équilibre après un schéma posologique une fois par semaine devraient être deux à trois fois plus élevés qu'après une dose unique. La biodisponibilité absolue de la cabergoline est inconnue. Une fraction importante de la dose administrée subit un effet de premier passage. La demi-vie d'élimination de la cabergoline estimée à partir des données urinaires de 12 sujets sains variait entre 63 et 69 heures. L'effet prolongé de diminution de la prolactine de la cabergoline peut être lié à sa lente élimination et à sa longue demi-vie.
Distribution
Chez les animaux, sur la base de la radioactivité totale, la cabergoline (et/ou ses métabolites) a montré une distribution tissulaire étendue. La radioactivité dans l'hypophyse dépassait celle du plasma de plus de 100 fois et a été éliminée avec une demi-vie d'environ 60 heures. Cette découverte est cohérente avec l'effet antiprolactine durable du médicament. Des études d'autoradiographie du corps entier chez des rats gravides n'ont montré aucune absorption fœtale, mais des niveaux élevés dans la paroi utérine. Une radioactivité importante (parent plus métabolites) détectée dans le lait de rats en lactation suggère un potentiel d'exposition pour les nourrissons. Le médicament est largement distribué dans tout le corps. La cabergoline est modérément liée (40 % à 42 %) aux protéines plasmatiques humaines d'une manière indépendante de la concentration. Il est peu probable que l'administration concomitante de médicaments fortement liés aux protéines affecte sa disposition.
Métabolisme
Chez les animaux et les humains, la cabergoline est largement métabolisée, principalement par hydrolyse de la liaison acylurée ou du fragment urée. Le métabolisme médié par le cytochrome P-450 semble être minime. La cabergoline ne provoque pas d'induction et/ou d'inhibition enzymatique chez le rat. L'hydrolyse de la fraction acylurée ou urée abolit l'effet hypoprolactine de la cabergoline, et les principaux métabolites identifiés jusqu'à présent ne contribuent pas à l'effet thérapeutique.
Excrétion
Après administration orale de cabergoline radioactive à cinq volontaires sains, environ 22 % et 60 % de la dose ont été excrétés dans les 20 jours dans l'urine et les fèces, respectivement. Moins de 4 % de la dose a été excrétée sous forme inchangée dans l'urine. Les clairances non rénales et rénales de la cabergoline sont d'environ 3,2 L/min et 0,08 L/min, respectivement. L'excrétion urinaire chez les patients hyperprolactinémiques était similaire.
Populations particulières
Insuffisance rénale
La pharmacocinétique de la cabergoline n'a pas été modifiée chez 12 patients présentant une insuffisance rénale modérée à sévère, évaluée par la clairance de la créatinine.
Insuffisance hépatique
Chez 12 patients présentant une insuffisance hépatique légère à modérée (score de Child-Pugh ≤ 10), aucun effet sur la Cmax moyenne de la cabergoline ou sur l'aire sous la courbe de concentration plasmatique (ASC) n'a été observé. Cependant, les patients présentant une insuffisance sévère (score de Child-Pugh > 10) présentent une augmentation substantielle de la Cmax et de l'ASC moyennes de la cabergoline, et nécessitent donc la prudence.
Âgé
L'effet de l'âge sur la pharmacocinétique de la cabergoline n'a pas été étudié.
Interaction aliments-médicaments
Chez 12 volontaires adultes sains, la nourriture n'a pas modifié la cinétique de la cabergoline.
Pharmacodynamie
La réponse à la dose avec inhibition de la prolactine plasmatique, apparition de l'effet maximal et durée de l'effet a été documentée après des doses uniques de cabergoline chez des volontaires sains (0,05 à 1,5 mg) et des patients hyperprolactinémiques (0,3 à 1 mg). Chez les volontaires, l'inhibition de la prolactine était évidente à des doses > 0,2 mg, tandis que des doses ≥ 0,5 mg provoquaient une suppression maximale chez la plupart des sujets. Des doses plus élevées produisent une suppression de la prolactine chez une plus grande proportion de sujets et avec un début d'action plus précoce et une durée d'action plus longue. Chez 12 volontaires sains, les doses de 0,5, 1 et 1,5 mg ont entraîné une inhibition complète de la prolactine, avec un effet maximal dans les 3 heures chez 92 % à 100 % des sujets après les doses de 1 et 1,5 mg contre 50 % des sujets après les doses de 0,5 mg. dose de mg.
Chez les patients hyperprolactinémiques (N = 51), la diminution maximale de la prolactine après une dose unique de 0,6 mg de cabergoline était comparable à 2,5 mg de bromocriptine ; cependant, la durée de l'effet était nettement plus longue (14 jours contre 24 heures). Le délai d'effet maximal était plus court pour la bromocriptine que pour la cabergoline (6 heures contre 48 heures).
Chez 72 volontaires sains, des doses uniques ou multiples (jusqu'à 2 mg) de cabergoline ont entraîné une inhibition sélective de la prolactine sans effet apparent sur les autres hormones hypophysaires antérieures (GH, FSH, LH, ACTH et TSH) ou le cortisol.
INFORMATIONS PATIENTS
Les patientes doivent être informées qu'elles doivent informer leur médecin si elles soupçonnent qu'elles sont enceintes, deviennent enceintes ou ont l'intention de devenir enceintes pendant le traitement. Un test de grossesse doit être effectué en cas de suspicion de grossesse et la poursuite du traitement doit être discutée avec son médecin.
Les patients doivent informer leur médecin s'ils développent un essoufflement, une toux persistante, des difficultés respiratoires en position couchée ou un gonflement des extrémités.
