Xalatan 2.5ml Latanoprost Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
XALATAN® (latanoprost) Solution ophtalmique
LA DESCRIPTION
Le latanoprost est un analogue de la prostaglandine F2α. Son nom chimique est isopropyl-(Z)-7[(1R,2R,3R,5S)3,5dihydroxy-2-[(3R)-3-hydroxy-5-phénylpentyl]cyclopentyl]-5-hepténoate. Sa formule moléculaire est C26H40O5 et sa structure chimique est :
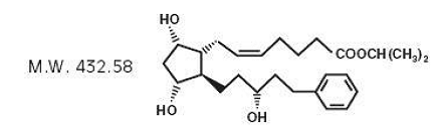
Le latanoprost est une huile incolore à légèrement jaune qui est très soluble dans l'acétonitrile et librement soluble dans l'acétone, l'éthanol, l'acétate d'éthyle, l'isopropanol, le méthanol et l'octanol. Il est pratiquement insoluble dans l'eau.
XALATAN (solution ophtalmique de latanoprost) 0,005 % est fourni sous forme de solution aqueuse stérile, isotonique et tamponnée de latanoprost avec un pH d'environ 6,7 et une osmolalité d'environ 267 mOsmol/kg. Chaque mL de XALATAN contient 50 mcg de latanoprost. Du chlorure de benzalkonium, 0,02 % est ajouté comme conservateur. Les ingrédients inactifs sont : chlorure de sodium, phosphate monosodique monohydraté, phosphate disodique anhydre et eau pour injection. Une goutte contient environ 1,5 mcg de latanoprost.
LES INDICATIONS
XALATAN 2,5 ml est indiqué pour la réduction de la pression intraoculaire élevée chez les patients atteints de glaucome à angle ouvert ou d'hypertension oculaire.
DOSAGE ET ADMINISTRATION
La posologie recommandée est d'une goutte dans l'œil ou les yeux affectés une fois par jour le soir. Si une dose est oubliée, le traitement doit se poursuivre normalement avec la dose suivante.
La posologie de XALATAN ne doit pas dépasser une fois par jour ; l'utilisation combinée de deux ou plusieurs prostaglandines, ou d'analogues de prostaglandines dont XALATAN 2,5 ml n'est pas recommandée. Il a été démontré que l'administration de ces produits médicamenteux à base de prostaglandines plus d'une fois par jour peut diminuer l'effet d'abaissement de la pression intraoculaire (PIO) ou provoquer des élévations paradoxales de la PIO.
La réduction de la PIO commence environ 3 à 4 heures après l'administration et l'effet maximal est atteint après 8 à 12 heures.
XALATAN peut être utilisé en concomitance avec d'autres médicaments ophtalmiques topiques pour abaisser la PIO. Si plus d'un médicament ophtalmique topique est utilisé, les médicaments doivent être administrés à au moins cinq (5) minutes d'intervalle. Les lentilles de contact doivent être retirées avant l'administration de XALATAN 2,5 ml et peuvent être remises 15 minutes après l'administration
COMMENT FOURNIE
Formes posologiques et points forts
Solution ophtalmique stérile contenant 50 mcg/mL de latanoprost.
Stockage et manutention
XALATAN est une solution incolore claire, isotonique, tamponnée et conservée de latanoprost 0,005 % (50 mcg/mL). Il est fourni sous forme de solution de 2,5 ml dans un flacon en polyéthylène basse densité transparent de 5 ml avec un embout compte-gouttes en polyéthylène transparent, un bouchon à vis turquoise en polyéthylène haute densité et un surbouchon inviolable en polyéthylène basse densité transparent.
Remplissage de 2,5 mL, 0,005 % (50 mcg/mL) : Emballage de 1 flacon : CDN 0013-8303-04 Remplissage de 2,5 mL, 0,005 % (50 mcg/mL) : Emballage multiple de 3 flacons : CDN 0013-8303-01
Stockage
Protéger de la lumière. Conserver les flacons non ouverts au réfrigérateur entre 2° et 8°C (36° et 46°F). Pendant l'expédition au patient, la bouteille peut être maintenue à des températures allant jusqu'à 40°C (104°F) pendant une période n'excédant pas 8 jours. Une fois qu'un flacon est ouvert pour être utilisé, il peut être conservé à température ambiante jusqu'à 25°C (77°F) pendant 6 semaines.
Distribué par : Pharmacia & Upjohn Co., Division of Pfizer Inc., NY, NY 10017. Pfizer Manufacturing Belgium NV Puurs, Belgique. Révisé : s/o
EFFETS SECONDAIRES
Les effets indésirables suivants ont été signalés après la commercialisation et sont discutés plus en détail dans d'autres sections de l'étiquette :
- Modifications de la pigmentation de l'iris [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Assombrissement de la peau des paupières [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Modifications des cils (augmentation de la longueur, de l'épaisseur, de la pigmentation et du nombre de cils) [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Inflammation intraoculaire (iritis/uvéite) [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Œdème maculaire, y compris œdème maculaire cystoïde [voir AVERTISSEMENTS ET PRECAUTIONS ]
Expérience des essais cliniques
Étant donné que les essais cliniques sont menés dans des conditions très variables, les taux d'effets indésirables observés dans les études cliniques d'un médicament ne peuvent pas être directement comparés aux taux des essais cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique clinique.
XALATAN 2,5 ml a été étudié dans trois essais cliniques multicentriques, randomisés et contrôlés. Les patients ont reçu 50 mcg/mL de XALATAN une fois par jour ou 5 mg/mL de comparateur actif (timolol) deux fois par jour. La population de patients étudiée avait un âge moyen de 65 ± 10 ans. Sept pour cent des patients se sont retirés avant le point final de 6 mois.
Moins de 1% des patients traités par XALATAN 2,5 ml ont nécessité l'arrêt du traitement en raison d'une intolérance à l'hyperémie conjonctivale.
L'événement/les signes et les symptômes oculaires de la blépharite ont été identifiés comme « fréquemment observés » grâce à l'analyse des données des essais cliniques.
Expérience post-commercialisation
Les réactions suivantes ont été identifiées lors de l'utilisation post-commercialisation de XALATAN dans la pratique clinique. Parce qu'ils sont signalés volontairement par une population de taille inconnue, il n'est pas toujours possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale avec l'exposition aux médicaments. Les réactions, qui ont été choisies pour être incluses en raison soit de leur gravité, soit de la fréquence de leur déclaration, soit d'un éventuel lien de causalité avec XALATAN 2,5 ml, soit d'une combinaison de ces facteurs, comprennent :
Troubles du système nerveux : Vertiges; mal de tête; nécrolyse épidermique toxique
Troubles oculaires : Modifications des cils et des poils vellus de la paupière (augmentation de la longueur, de l'épaisseur, de la pigmentation et du nombre de cils); kératite; œdème cornéen et érosions; inflammation intraoculaire (iritis/uvéite); œdème maculaire, y compris œdème maculaire cystoïde ; trichiasis; modifications périorbitaires et palpébrales entraînant un approfondissement du sillon palpébral; kyste de l'iris ; assombrissement de la peau des paupières; réaction cutanée localisée sur les paupières; conjonctivite; pseudopemphigoïde de la conjonctive oculaire
Troubles respiratoires, thoraciques et médiastinaux : Asthme et exacerbation de l'asthme ; dyspnée
Troubles de la peau et du tissu sous-cutané : Prurit
Infections et infestations : Kératite herpétique
Troubles cardiaques : Angine; palpitations; angine instable
Troubles généraux et conditions au site d'administration : Douleur thoracique
INTERACTIONS MÉDICAMENTEUSES
Des études in vitro ont montré qu'une précipitation se produit lorsque des collyres contenant du thimérosal sont mélangés avec XALATAN. Si de tels médicaments sont utilisés, ils doivent être administrés à au moins cinq (5) minutes d'intervalle.
L'utilisation combinée de deux prostaglandines ou plus, ou d'analogues de prostaglandines, dont XALATAN 2,5 ml, n'est pas recommandée. Il a été démontré que l'administration de ces produits médicamenteux à base de prostaglandines plus d'une fois par jour peut diminuer l'effet d'abaissement de la PIO ou provoquer des élévations paradoxales de la PIO.
AVERTISSEMENTS
Inclus dans le cadre du PRÉCAUTIONS section.
PRÉCAUTIONS
Pigmentation
Il a été rapporté que XALATAN provoque des modifications des tissus pigmentés. Les changements les plus fréquemment rapportés ont été une pigmentation accrue de l'iris, du tissu périorbitaire (paupière) et des cils. On s'attend à ce que la pigmentation augmente tant que le latanoprost est administré.
Le changement de pigmentation est dû à une augmentation de la teneur en mélanine dans les mélanocytes plutôt qu'à une augmentation du nombre de mélanocytes. Après l'arrêt du latanoprost, la pigmentation de l'iris est susceptible d'être permanente, tandis que la pigmentation du tissu périorbitaire et les modifications des cils ont été rapportées comme étant réversibles chez certains patients. Les patients qui reçoivent un traitement doivent être informés de la possibilité d'une pigmentation accrue. Au-delà de 5 ans, les effets de l'augmentation de la pigmentation ne sont pas connus [voir Etudes cliniques ].
Le changement de couleur de l'iris peut ne pas être perceptible pendant plusieurs mois à plusieurs années. En règle générale, la pigmentation brune autour de la pupille s'étend de manière concentrique vers la périphérie de l'iris et l'iris entier ou des parties de l'iris deviennent plus brunâtres. Ni les naevus ni les taches de rousseur de l'iris ne semblent être affectés par le traitement. Bien que le traitement par XALATAN 2,5 ml puisse être poursuivi chez les patients qui développent une augmentation notable de la pigmentation de l'iris, ces patients doivent être examinés régulièrement [voir INFORMATIONS PATIENTS ].
Changements de cils
XALATAN 2,5 ml peut modifier progressivement les cils et les poils de velus de l'œil traité ; ces changements comprennent une augmentation de la longueur, de l'épaisseur, de la pigmentation, du nombre de cils ou de poils et une croissance mal dirigée des cils. Les modifications des cils sont généralement réversibles à l'arrêt du traitement [voir INFORMATIONS PATIENTS ].
Inflammation intraoculaire
XALATAN 2,5 ml doit être utilisé avec prudence chez les patients ayant des antécédents d'inflammation intraoculaire (iritis/uvéite) et ne doit généralement pas être utilisé chez les patients présentant une inflammation intraoculaire active car l'inflammation peut être exacerbée.
Œdème maculaire
Un œdème maculaire, y compris un œdème maculaire cystoïde, a été signalé pendant le traitement par XALATAN. XALATAN 2,5 ml doit être utilisé avec prudence chez les patients aphaques, chez les patients pseudophaques présentant une déchirure de la capsule postérieure du cristallin ou chez les patients présentant des facteurs de risque connus d'œdème maculaire.
Kératite herpétique
La réactivation de la kératite herpétique simplex a été rapportée au cours du traitement par XALATAN. XALATAN 2,5 ml doit être utilisé avec prudence chez les patients ayant des antécédents de kératite herpétique. XALATAN 2,5 ml est à éviter en cas de kératite herpétique active car l'inflammation peut être exacerbée.
Kératite bactérienne
Des kératites bactériennes associées à l'utilisation de contenants multidoses de produits ophtalmiques topiques ont été signalées. Ces récipients avaient été contaminés par inadvertance par des patients qui, dans la plupart des cas, souffraient d'une maladie cornéenne concomitante ou d'une perturbation de la surface épithéliale oculaire [voir INFORMATIONS PATIENTS ].
Utiliser avec des lentilles de contact
Les lentilles de contact doivent être retirées avant l'administration de XALATAN et peuvent être remises 15 minutes après l'administration.
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Le latanoprost n'était cancérigène ni chez la souris ni chez le rat lorsqu'il était administré par gavage oral à des doses allant jusqu'à 170 mcg/kg/jour (environ 2 800 fois la dose humaine maximale recommandée) pendant 20 et 24 mois, respectivement.
Le latanoprost n'a pas été mutagène dans les bactéries, dans le lymphome de souris ou dans les tests du micronoyau de souris. Des aberrations chromosomiques ont été observées in vitro avec des lymphocytes humains. D'autres études in vitro et in vivo sur la synthèse non programmée d'ADN chez le rat se sont révélées négatives.
Le latanoprost n'a pas montré d'effet sur la fertilité masculine ou féminine dans les études animales.
Utilisation dans des populations spécifiques
Grossesse
Effets tératogènes
Catégorie de grossesse C.
Des études de reproduction ont été réalisées chez le rat et le lapin. Dans les lapins, une incidence de 4 de 16 barrages n'avait aucun foetus viable à une dose qui était environ 80 fois la dose humaine maximum et la dose non embryocide la plus élevée dans les lapins était environ 15 fois la dose humaine maximum.
Il n'y a pas d'études adéquates et bien contrôlées chez les femmes enceintes. XALATAN 2,5 ml ne doit être utilisé pendant la grossesse que si le bénéfice potentiel justifie le risque potentiel pour le fœtus.
Mères allaitantes
On ne sait pas si ce médicament ou ses métabolites sont excrétés dans le lait maternel. Étant donné que de nombreux médicaments sont excrétés dans le lait maternel, la prudence s'impose lorsque XALATAN 2,5 ml est administré à une femme qui allaite.
Utilisation pédiatrique
L'innocuité et l'efficacité chez les patients pédiatriques n'ont pas été établies.
Utilisation gériatrique
Aucune différence globale de sécurité ou d'efficacité n'a été observée entre les patients âgés et les patients plus jeunes.
SURDOSAGE
Une perfusion intraveineuse allant jusqu'à 3 mcg/kg chez des volontaires sains a produit des concentrations plasmatiques moyennes 200 fois plus élevées que pendant le traitement clinique et aucun effet indésirable n'a été observé. Des doses intraveineuses de 5,5 à 10 mcg/kg ont causé des douleurs abdominales, des étourdissements, de la fatigue, des bouffées de chaleur, des nausées et des sueurs. En cas de surdosage avec XALATAN, le traitement doit être symptomatique.
CONTRE-INDICATIONS
Hypersensibilité connue au latanoprost, au chlorure de benzalkonium ou à tout autre ingrédient de ce produit.
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
Le latanoprost est un agoniste sélectif des récepteurs FP prostanoïdes qui est censé réduire la pression intraoculaire (PIO) en augmentant l'écoulement de l'humeur aqueuse. Des études chez l'animal et chez l'homme suggèrent que le principal mécanisme d'action est l'augmentation de l'écoulement uvéoscléral. Une PIO élevée représente un facteur de risque majeur de perte de champ glaucomateux. Plus le niveau de PIO est élevé, plus la probabilité de lésions du nerf optique et de perte de champ visuel est grande.
Pharmacodynamie
La réduction de la PIO chez l'homme commence environ 3 à 4 heures après l'administration et l'effet maximal est atteint après 8 à 12 heures. La réduction de la PIO est présente pendant au moins 24 heures.
Pharmacocinétique
Absorption
Le latanoprost est absorbé par la cornée où le promédicament ester isopropylique est hydrolysé en forme acide pour devenir biologiquement actif.
Distribution
Le volume de distribution chez l'homme est de 0,16 ± 0,02 L/kg. L'acide du latanoprost peut être mesuré dans l'humeur aqueuse pendant les 4 premières heures, et dans le plasma uniquement pendant la première heure après l'administration locale. Des études chez l'homme indiquent que le pic de concentration dans l'humeur aqueuse est atteint environ deux heures après l'administration topique.
Métabolisme
Le latanoprost, un promédicament d'ester isopropylique, est hydrolysé par les estérases de la cornée en acide biologiquement actif. L'acide actif du latanoprost atteignant la circulation systémique est principalement métabolisé par le foie en métabolites 1,2-dinor et 1,2,3,4-tetranor via la β-oxydation des acides gras.
Excrétion
L'élimination de l'acide du latanoprost du plasma humain est rapide (t½ = 17 min) après administration intraveineuse et topique. La clairance systémique est d'environ 7 mL/min/kg. Suite à la β-oxydation hépatique, les métabolites sont principalement éliminés par les reins. Environ 88 % et 98 % de la dose administrée sont récupérés dans l'urine après administration topique et intraveineuse, respectivement.
Etudes cliniques
PIO de base élevée
Les patients avec une PIO moyenne initiale de 24 à 25 mmHg qui ont été traités pendant 6 mois dans des essais multicentriques, randomisés et contrôlés ont démontré des réductions de 6 à 8 mmHg de la PIO. Cette réduction de la PIO avec XALATAN 0,005 % administré une fois par jour était équivalente à l'effet du timolol 0,5 % administré deux fois par jour.
Progression de la pigmentation accrue de l'iris
Une étude de sécurité prospective ouverte de 3 ans avec une phase d'extension de 2 ans a été menée pour évaluer la progression de l'augmentation de la pigmentation de l'iris avec l'utilisation continue de XALATAN une fois par jour en tant que traitement adjuvant chez 519 patients atteints de glaucome à angle ouvert. L'analyse était basée sur la population de cas observés des 380 patients qui ont poursuivi la phase d'extension.
Les résultats ont montré que l'apparition d'une augmentation notable de la pigmentation de l'iris s'est produite au cours de la première année de traitement pour la majorité des patients qui ont développé une augmentation notable de la pigmentation de l'iris. Les patients ont continué à montrer des signes d'augmentation de la pigmentation de l'iris tout au long des cinq années de l'étude. L'observation d'une pigmentation accrue de l'iris n'a pas affecté l'incidence, la nature ou la gravité des événements indésirables (autres que la pigmentation accrue de l'iris) enregistrés dans l'étude. La réduction de la PIO était similaire quel que soit le développement d'une pigmentation accrue de l'iris au cours de l'étude.
INFORMATIONS PATIENTS
Potentiel de pigmentation
Informez les patients du potentiel d'augmentation de la pigmentation brune de l'iris, qui peut être permanente. Informer les patients de la possibilité d'un assombrissement de la peau des paupières, qui peut être réversible après l'arrêt de XALATAN [voir AVERTISSEMENTS ET PRECAUTIONS ].
Potentiel de changement de cils
Informer les patients de la possibilité de modifications des cils et des poils de duvet dans l'œil traité pendant le traitement par XALATAN. Ces changements peuvent entraîner une disparité entre les yeux en termes de longueur, d'épaisseur, de pigmentation, de nombre de cils ou de poils de vellus et/ou de direction de la croissance des cils. Les modifications des cils sont généralement réversibles à l'arrêt du traitement.
Manipulation du conteneur
Demandez aux patients d'éviter que l'embout du récipient distributeur n'entre en contact avec l'œil ou les structures environnantes, car cela pourrait entraîner la contamination de l'embout par des bactéries courantes connues pour provoquer des infections oculaires. L'utilisation de solutions contaminées peut entraîner des lésions oculaires graves et une perte de vision subséquente [voir AVERTISSEMENTS ET PRECAUTIONS ].
Quand demander l'avis d'un médecin
Avisez les patients que s'ils développent une affection oculaire intercurrente (par exemple, un traumatisme ou une infection) ou s'ils subissent une chirurgie oculaire, ou s'ils développent des réactions oculaires, en particulier une conjonctivite et des réactions palpébrales, ils doivent immédiatement demander l'avis de leur médecin concernant la poursuite de l'utilisation du médicament à doses multiples. récipient.
Utiliser avec des lentilles de contact
Informer les patients que XALATAN 2,5 ml contient du chlorure de benzalkonium, qui peut être absorbé par les lentilles de contact. Les lentilles de contact doivent être retirées avant l'administration de la solution. Les lentilles peuvent être réinsérées 15 minutes après l'administration de XALATAN.
Utiliser avec d'autres médicaments ophtalmiques
Si plus d'un médicament ophtalmique topique est utilisé, les médicaments doivent être administrés à au moins cinq (5) minutes d'intervalle.
