Goutte pour les yeux: Lumigan 3ml Utilisations, effets secondaires et dosage. Prix en Pharmacie. Medicaments generiques sans ordonnance.
Qu'est-ce que Lumigan et comment est-il utilisé ?
Lumigan 3 ml est un médicament sur ordonnance utilisé pour traiter les symptômes de la pression intraoculaire élevée causée par certains types de glaucome et d'hypotrichose des cils. Lumigan peut être utilisé seul ou avec d'autres médicaments.
Lumigan appartient à une classe de médicaments appelés antiglaucome, agonistes des prostaglandines.
On ne sait pas si Lumigan est sûr et efficace chez les enfants.
Quels sont les effets secondaires possibles de Lumigan ?
Lumigan peut provoquer des effets secondaires graves, notamment :
- gonflement des yeux,
- rougeur de l'oeil,
- inconfort sévère dans les yeux,
- encroûtement ou écoulement de l'œil,
- changements de vision, et
- paupières rouges, enflées ou qui démangent
Consultez immédiatement un médecin si vous présentez l'un des symptômes énumérés ci-dessus.
Les effets secondaires les plus courants de Lumigan incluent :
- rougeur des yeux
Dites au médecin si vous avez un effet secondaire qui vous dérange ou qui ne disparaît pas.
Ce ne sont pas tous les effets secondaires possibles de Lumigan. Pour plus d'informations, consultez votre médecin ou votre pharmacien.
Appelez votre médecin pour obtenir des conseils médicaux sur les effets secondaires. Vous pouvez signaler les effets secondaires à la FDA au 1-800-FDA-1088.
LA DESCRIPTION
LUMIGAN® (solution ophtalmique de bimatoprost) 0,03 % est un analogue synthétique du prostamide à activité hypotensive oculaire. Son nom chimique est (Z)-7-[(1R,2R,3R,5S)-3,5-Dihydroxy-2[(1E,3S)-3-hydroxy-5-phényl-1-pentényl]cyclopentyl]- 5-N-éthylhepténamide, et son poids moléculaire est de 415,58. Sa formule moléculaire est C25H37NO4. Sa structure chimique est :
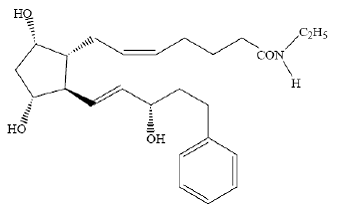
Le bimatoprost est une poudre très soluble dans l'alcool éthylique et l'alcool méthylique et légèrement soluble dans l'eau. LUMIGAN® 0,03 % est une solution ophtalmique limpide, isotonique, incolore et stérile avec une osmolalité d'environ 290 mOsmol/kg.
LUMIGAN® 0,03 % contient Actif: bimatoprost 0,3 mg/mL ; Inactifs : chlorure de benzalkonium 0,05 mg/mL ; chlorure de sodium; phosphate de sodium, dibasique; acide citrique; et de l'eau purifiée. De l'hydroxyde de sodium et/ou de l'acide chlorhydrique peuvent être ajoutés pour ajuster le pH. Le pH pendant sa durée de conservation varie de 6,8 à 7,8.
LES INDICATIONS
LUMIGAN® (solution ophtalmique de bimatoprost) 0,01 % est indiqué pour la réduction de la pression intraoculaire élevée chez les patients atteints de glaucome à angle ouvert ou d'hypertension oculaire.
DOSAGE ET ADMINISTRATION
La posologie recommandée est d'une goutte dans l'œil ou les yeux affectés une fois par jour le soir. LUMIGAN® (solution ophtalmique de bimatoprost) à 0,01 % ne doit pas être administré plus d'une fois par jour puisqu'il a été démontré qu'une administration plus fréquente d'analogues de prostaglandines peut diminuer l'effet de diminution de la pression intraoculaire.
La réduction de la pression intraoculaire commence environ 4 heures après la première administration avec un effet maximal atteint en 8 à 12 heures environ.
LUMIGAN® 0,01 % peut être utilisé en concomitance avec d'autres médicaments ophtalmiques topiques pour abaisser la pression intraoculaire. Si plus d'un médicament ophtalmique topique est utilisé, les médicaments doivent être administrés à au moins cinq (5) minutes d'intervalle.
COMMENT FOURNIE
Formes posologiques et points forts
Solution ophtalmique contenant du bimatoprost 0,1 mg/mL.
Stockage et remise
LUMIGAN® (solution ophtalmique de bimatoprost) 0,01 % est fourni stérile dans des flacons distributeurs ophtalmiques en polyéthylène basse densité blanc opaque et des embouts avec des bouchons en polystyrène turquoise dans les tailles suivantes :
Remplissage de 2,5 ml dans un récipient de 5 ml - CDN 0023-3205-03 Remplissage de 5 ml dans un récipient de 10 ml - CDN 0023-3205-05 Remplissage de 7,5 ml dans un récipient de 10 ml - CDN 0023-3205-08
Stockage: Conserver entre 2 °C et 25 °C (36 °F et 77 °F).
Après ouverture, LUMIGAN® 0,01% peut être utilisé jusqu'à la date de péremption indiquée sur le flacon.
Distribué par : Allergan USA, Inc. Madison, NJ 07940. Révisé : mars 2022
EFFETS SECONDAIRES
Les effets indésirables suivants sont décrits ailleurs dans l'étiquetage :
- Pigmentation, y compris pigmentation blépharique et hyperpigmentation de l'iris [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Changements de cils [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Inflammation intraoculaire [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Œdème maculaire [voir AVERTISSEMENTS ET PRECAUTIONS ]
- Hypersensibilité [voir CONTRE-INDICATIONS ]
Expérience des essais cliniques
Étant donné que les essais cliniques sont menés dans des conditions très variables, les taux d'effets indésirables observés dans les essais cliniques d'un médicament ne peuvent pas être directement comparés aux taux des essais cliniques d'un autre médicament et peuvent ne pas refléter les taux observés dans la pratique.
Dans une étude clinique de 12 mois avec des solutions ophtalmiques de bimatoprost à 0,01 %, l'effet indésirable le plus fréquent était l'hyperémie conjonctivale (31 %). Environ 1,6 % des patients ont arrêté le traitement en raison d'une hyperémie conjonctivale. Autres effets indésirables du médicament (rapportés chez 1 à 4 % des patients) avec LUMIGAN® 0,01 % dans cette étude comprenait un œdème conjonctival, une hémorragie conjonctivale, une irritation oculaire, une douleur oculaire, un prurit oculaire, un érythème de la paupière, un prurit des paupières, une croissance des cils, une hypertrichose, une irritation du site d'instillation, une kératite ponctuée, une hyperpigmentation cutanée, une vision floue et une acuité visuelle réduit.
Expérience post-commercialisation
Les effets indésirables suivants ont été identifiés lors de l'utilisation post-approbation de LUMIGAN® 0,01 %. Étant donné que ces réactions sont signalées volontairement par une population de taille incertaine, il n'est pas toujours possible d'estimer de manière fiable leur fréquence ou d'établir une relation causale avec l'exposition au médicament. Ces réactions, qui ont été choisies pour être incluses en raison de leur gravité, de leur fréquence de notification, de leur possible lien de causalité avec LUMIGAN® , ou une combinaison de ces facteurs comprennent : symptômes de type asthme, étourdissements, sécheresse oculaire, dyspnée, écoulement oculaire, œdème oculaire, sensation de corps étranger, maux de tête, hypersensibilité, y compris signes et symptômes d'allergie oculaire et de dermatite allergique, hypertension, augmentation du larmoiement, modifications périorbitaires et des paupières, y compris approfondissement du sillon palpébral et photophobie.
INTERACTIONS MÉDICAMENTEUSES
Aucune information fournie
AVERTISSEMENTS
Inclus dans le cadre du "PRÉCAUTIONS" Section
PRÉCAUTIONS
Pigmentation
Il a été rapporté que la solution ophtalmique de bimatoprost provoque des modifications des tissus pigmentés. Les changements les plus fréquemment rapportés ont été une pigmentation accrue de l'iris, du tissu périorbitaire (paupière) et des cils. On s'attend à ce que la pigmentation augmente tant que le bimatoprost est administré. Le changement de pigmentation est dû à une augmentation de la teneur en mélanine dans les mélanocytes plutôt qu'à une augmentation du nombre de mélanocytes. Après l'arrêt du bimatoprost, la pigmentation de l'iris est susceptible d'être permanente, tandis que la pigmentation du tissu périorbitaire et les modifications des cils ont été rapportées comme étant réversibles chez certains patients. Les patients qui reçoivent un traitement doivent être informés de la possibilité d'une pigmentation accrue. Les effets à long terme d'une pigmentation accrue ne sont pas connus.
Le changement de couleur de l'iris peut ne pas être perceptible pendant plusieurs mois à plusieurs années. En règle générale, la pigmentation brune autour de la pupille s'étend de manière concentrique vers la périphérie de l'iris et l'iris entier ou des parties de l'iris deviennent plus brunâtres. Ni les naevus ni les taches de rousseur de l'iris ne semblent être affectés par le traitement. Bien que le traitement par LUMIGAN® (solution ophtalmique de bimatoprost) 0,01 % puisse être poursuivi chez les patients qui développent une pigmentation de l'iris sensiblement accrue, ces patients doivent être examinés régulièrement.
Changements de cils
LUMIGAN® 0,01 % peut modifier progressivement les cils et les poils de velus de l'œil traité. Ces changements incluent une augmentation de la longueur, de l'épaisseur et du nombre de cils. Les modifications des cils sont généralement réversibles à l'arrêt du traitement.
Inflammation intraoculaire
Les analogues de la prostaglandine, y compris le bimatoprost, ont été signalés comme provoquant une inflammation intraoculaire. De plus, étant donné que ces produits peuvent exacerber l'inflammation, la prudence s'impose chez les patients présentant une inflammation intraoculaire active (p. ex., uvéite).
Œdème maculaire
Des œdèmes maculaires, y compris des œdèmes maculaires cystoïdes, ont été rapportés au cours du traitement par la solution ophtalmique de bimatoprost. LUMIGAN® 0,01 % doit être utilisé avec prudence chez les patients aphaques, chez les patients pseudophaques présentant une déchirure de la capsule postérieure du cristallin ou chez les patients présentant des facteurs de risque connus d'œdème maculaire.
Kératite bactérienne
Des kératites bactériennes associées à l'utilisation de contenants multidoses de produits ophtalmiques topiques ont été signalées. Ces conteneurs avaient été contaminés par inadvertance par des patients qui, dans la plupart des cas, souffraient d'une maladie cornéenne concomitante ou d'une perturbation de la surface épithéliale oculaire.
Utilisation de lentilles de contact
LUMIGAN® 0,01 % contient du chlorure de benzalkonium, qui peut être absorbé par les lentilles de contact souples et provoquer une décoloration. Les lentilles cornéennes doivent être retirées avant l'instillation de LUMIGAN® 0,01 % et peuvent être remises 15 minutes après son administration.
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Carcinogenèse
Le bimatoprost n'a été cancérogène ni chez la souris ni chez le rat lorsqu'il a été administré par gavage oral pendant 104 semaines à des doses allant jusqu'à 2 mg/kg/jour et 1 mg/kg/jour, respectivement (192 et 291 fois l'exposition systémique humaine estimée au bimatoprost 0,03 % administrés bilatéralement une fois par jour, respectivement, en fonction des taux sanguins d'ASC)
Mutagenèse
Le bimatoprost n'a pas été mutagène ou clastogène dans le test d'Ames, dans le test du lymphome de souris ou dans les tests in vivo du micronoyau de souris.
Altération de la fertilité
Le bimatoprost n'a pas altéré la fertilité chez les rats mâles ou femelles jusqu'à des doses de 0,6 mg/kg/jour (au moins 103 fois l'exposition humaine recommandée au bimatoprost 0,03 % administré bilatéralement une fois par jour en fonction des taux sanguins d'AUC).
Utilisation dans des populations spécifiques
Grossesse
Résumé des risques
Il n'y a pas d'études adéquates et bien contrôlées sur l'administration de LUMIGAN® (solution ophtalmique de bimatoprost) à 0,01 % chez la femme enceinte. Il n'y a pas d'augmentation du risque de malformations congénitales majeures ou de fausses couches d'après l'expérience post-commercialisation du bimatoprost.
Dans des études sur le développement embryofœtal, l'administration de bimatoprost à des souris et des rats gravides au cours de l'organogenèse a entraîné un avortement et un accouchement précoce à des doses orales d'au moins 33 fois (souris) ou 94 fois (rats) l'exposition humaine au bimatoprost à 0,03 % administré une fois par jour de façon bilatérale ( sur la base des taux sanguins d'aire sous la courbe [AUC]). Ces effets indésirables n'ont pas été observés à 2,6 fois (souris) et 47 fois (rats) l'exposition humaine au bimatoprost 0,03 % administré bilatéralement une fois par jour (sur la base des taux sanguins d'ASC).
Dans des études sur le développement pré/postnatal, l'administration de bimatoprost à des rates gravides de l'organogenèse à la fin de la lactation a entraîné une réduction de la durée de la gestation et du poids corporel du fœtus, ainsi qu'une augmentation de la mortalité fœtale et des petits à des doses orales d'au moins 41 fois l'exposition systémique humaine au bimatoprost 0,03 % administré bilatéralement une fois par jour (sur la base des taux sanguins d'ASC). Aucun effet indésirable n'a été observé chez la progéniture du rat à des expositions estimées à 14 fois l'exposition humaine au bimatoprost à 0,03 % administré bilatéralement une fois par jour (sur la base des taux sanguins d'ASC).
Étant donné que les études sur la reproduction chez l'animal ne sont pas toujours prédictives de la réponse humaine, LUMIGAN® 0,01 % ne doit être administré pendant la grossesse que si le bénéfice potentiel justifie le risque potentiel pour le fœtus.
Données
Données animales
Dans une étude sur le développement embryofœtal chez le rat, un avortement a été observé chez des rats gravides ayant reçu du bimatoprost par voie orale pendant l'organogenèse à raison de 0,6 mg/kg/jour (94 fois l'exposition systémique humaine au bimatoprost à 0,03 % administré une fois par jour, sur la base de l'ASC). La dose sans effet indésirable observé (NOAEL) pour l'avortement était de 0,3 mg/kg/jour (estimée à 47 fois l'exposition systémique humaine au bimatoprost 0,03 % administré bilatéralement une fois par jour, sur la base de l'ASC). Aucune anomalie n'a été observée chez les fœtus de rat à des doses allant jusqu'à 0,6 mg/kg/jour.
Dans une étude sur le développement embryofœtal chez la souris, des avortements et des accouchements précoces ont été observés chez des souris gravides ayant reçu du bimatoprost par voie orale pendant l'organogenèse à des doses supérieures ou égales à 0,3 mg/kg/jour (33 fois l'exposition systémique humaine au bimatoprost à 0,03 % administré deux fois par jour, basé sur l'ASC). La NOAEL pour l'avortement et l'accouchement précoce était de 0,1 mg/kg/jour (2,6 fois l'exposition systémique humaine au bimatoprost 0,03 % administré bilatéralement une fois par jour, sur la base de l'ASC). Aucune anomalie n'a été observée chez les fœtus de souris à des doses allant jusqu'à 0,6 mg/kg/jour (72 fois l'exposition systémique humaine au bimatoprost 0,03 % administré bilatéralement une fois par jour, sur la base de l'ASC).
Dans une étude sur le développement pré/postnatal, le traitement de rats gravides avec du bimatoprost par voie orale du jour de gestation 7 au jour de lactation 20 a entraîné une réduction de la durée de la gestation, une augmentation des résorptions tardives, des décès fœtaux et de la mortalité postnatale des petits, ainsi qu'une réduction du poids corporel des petits à des doses supérieures à ou égal à 0,3 mg/kg/jour. Ces effets ont été observés à des expositions d'au moins 41 fois l'exposition systémique humaine au bimatoprost à 0,03 % administré bilatéralement une fois par jour, sur la base de l'ASC. La NOAEL pour le développement postnatal et les performances d'accouplement de la progéniture était de 0,1 mg/kg/jour (estimée à 14 fois l'exposition systémique humaine au bimatoprost 0,03 % administré bilatéralement une fois par jour, sur la base de l'ASC).
Lactation
Résumé des risques
On ne sait pas si un traitement oculaire topique avec LUMIGAN® 0,01 % pourrait entraîner une absorption systémique suffisante pour produire des quantités détectables dans le lait maternel. Dans des études animales, il a été démontré que le bimatoprost est présent dans le lait maternel de rats en lactation à une dose intraveineuse (c'est-à-dire 1 mg/kg) 970 fois la RHOD (sur une base en mg/rn 2 ), cependant, aucune donnée animale n'est disponible. à des doses cliniquement pertinentes.
Les avantages de l'allaitement pour le développement et la santé doivent être pris en compte, ainsi que le besoin clinique de LUMIGAN® 0,01 % pour la mère et tout effet indésirable potentiel de LUMIGAN® 0,01 % sur l'enfant allaité.
Utilisation pédiatrique
L'utilisation chez les patients pédiatriques de moins de 16 ans n'est pas recommandée en raison de problèmes de sécurité potentiels liés à une pigmentation accrue suite à une utilisation chronique à long terme.
Utilisation gériatrique
Aucune différence clinique globale d'innocuité ou d'efficacité n'a été observée entre les patients âgés et les autres patients adultes.
SURDOSAGE
Aucune information n'est disponible sur le surdosage chez l'homme. En cas de surdosage avec LUMIGAN® (solution ophtalmique de bimatoprost) 0,01 %, le traitement doit être symptomatique.
Dans des études orales (par gavage) chez la souris et le rat, des doses allant jusqu'à 100 mg/kg/jour n'ont produit aucune toxicité. Cette dose exprimée en mg/m2 est au moins 210 fois supérieure à la dose accidentelle d'un flacon de LUMIGAN® 0,01% pour un enfant de 10 kg.
CONTRE-INDICATIONS
LUMIGAN® 0,01 % est contre-indiqué chez les patients présentant une hypersensibilité au bimatoprost ou à l'un des ingrédients [voir EFFETS INDÉSIRABLES ].
PHARMACOLOGIE CLINIQUE
Mécanisme d'action
Le bimatoprost, un analogue de la prostaglandine, est un analogue structurel synthétique de la prostaglandine ayant une activité hypotensive oculaire. Il imite sélectivement les effets de substances naturelles, les prostamides. On pense que le bimatoprost abaisse la pression intraoculaire (PIO) chez l'homme en augmentant l'écoulement de l'humeur aqueuse à la fois par le réseau trabéculaire et par les voies uvéosclérales. Une PIO élevée présente un facteur de risque majeur de perte de champ glaucomateux. Plus le niveau de PIO est élevé, plus la probabilité de lésions du nerf optique et de perte de champ visuel est grande.
Pharmacocinétique
Absorption
Après l'administration d'une goutte de solution ophtalmique de bimatoprost à 0,03 % une fois par jour dans les deux yeux de 15 sujets sains pendant deux semaines, les concentrations sanguines ont atteint un pic dans les 10 minutes suivant l'administration et étaient inférieures à la limite inférieure de détection (0,025 ng/mL) chez la plupart des sujets dans 1,5 heures après le dosage. Les valeurs moyennes de la Cmax et de l'ASC0-24h étaient similaires aux jours 7 et 14 à environ 0,08 ng/mL et 0,09 ng•h/mL, respectivement, indiquant que l'état d'équilibre a été atteint au cours de la première semaine d'administration oculaire. Il n'y avait pas d'accumulation systémique significative de médicament au fil du temps.
Distribution
Le bimatoprost est modérément distribué dans les tissus corporels avec un volume de distribution à l'état d'équilibre de 0,67 L/kg. Dans le sang humain, le bimatoprost réside principalement dans le plasma. Environ 12 % du bimatoprost reste non lié dans le plasma humain.
Élimination
Métabolisme
Le bimatoprost est la principale espèce circulant dans le sang une fois qu'il atteint la circulation systémique après administration oculaire. Le bimatoprost subit ensuite une oxydation, une N-déséthylation et une glucuronidation pour former une grande variété de métabolites.
Excrétion
Suite à une dose intraveineuse de bimatoprost radiomarqué (3,12 mcg/kg) chez six sujets sains, la concentration sanguine maximale du médicament inchangé était de 12,2 ng/mL et a diminué rapidement avec une demi-vie d'élimination d'environ 45 minutes. La clairance sanguine totale du bimatoprost était de 1,5 L/h/kg. Jusqu'à 67 % de la dose administrée a été excrétée dans l'urine tandis que 25 % de la dose a été récupérée dans les fèces.
Etudes cliniques
Dans une étude clinique de 12 mois sur des patients atteints de glaucome à angle ouvert ou d'hypertension oculaire avec une PIO initiale moyenne de 23,5 mmHg, l'effet d'abaissement de la PIO de LUMIGAN® 0,01 % une fois par jour (le soir) atteignait 7,5 mmHg.
INFORMATIONS PATIENTS
Potentiel de pigmentation
Informez les patients du potentiel d'augmentation de la pigmentation brune de l'iris, qui peut être permanente. Informer également les patients de la possibilité d'un assombrissement de la peau des paupières, qui peut être réversible après l'arrêt de LUMIGAN® (solution ophtalmique de bimatoprost) 0,01 %.
Potentiel de changement de cils
Informer les patients de la possibilité de modifications des cils et des poils velus dans l'œil traité pendant le traitement avec LUMIGAN® 0,01 %. Ces changements peuvent entraîner une disparité entre les yeux en termes de longueur, d'épaisseur, de pigmentation, de nombre de cils ou de poils de vellus et/ou de direction de la croissance des cils. Les modifications des cils sont généralement réversibles à l'arrêt du traitement.
Manipulation du conteneur
Demandez aux patients d'éviter de laisser l'embout du récipient distributeur entrer en contact avec l'œil, les structures environnantes, les doigts ou toute autre surface afin d'éviter la contamination de la solution par des bactéries courantes connues pour provoquer des infections oculaires. L'utilisation de solutions contaminées peut entraîner des lésions oculaires graves et une perte de vision subséquente.
Quand demander l'avis d'un médecin
Aviser les patients que s'ils développent une affection oculaire intercurrente (par exemple, un traumatisme ou une infection), subissent une chirurgie oculaire ou développent des réactions oculaires, en particulier une conjonctivite et des réactions palpébrales, ils doivent immédiatement consulter leur médecin concernant l'utilisation continue de LUMIGAN® 0,01 %. .
Utilisation de lentilles de contact
Aviser les patients que LUMIGAN® 0,01 % contient du chlorure de benzalkonium, qui peut être absorbé par les lentilles cornéennes souples. Les lentilles cornéennes doivent être retirées avant l'instillation de LUMIGAN® 0,01 % et peuvent être remises 15 minutes après son administration.
Utiliser avec d'autres médicaments ophtalmiques
Avisez les patients que si plus d'un médicament ophtalmique topique est utilisé, les médicaments doivent être administrés au moins cinq (5) minutes entre les applications.
